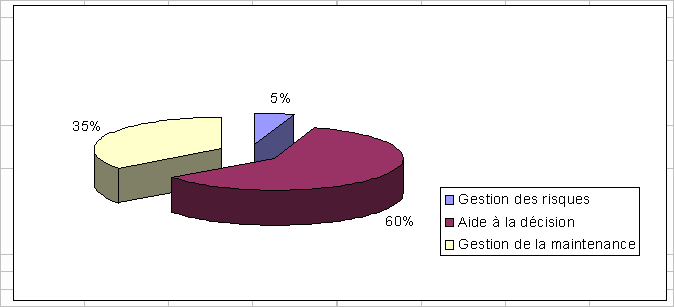
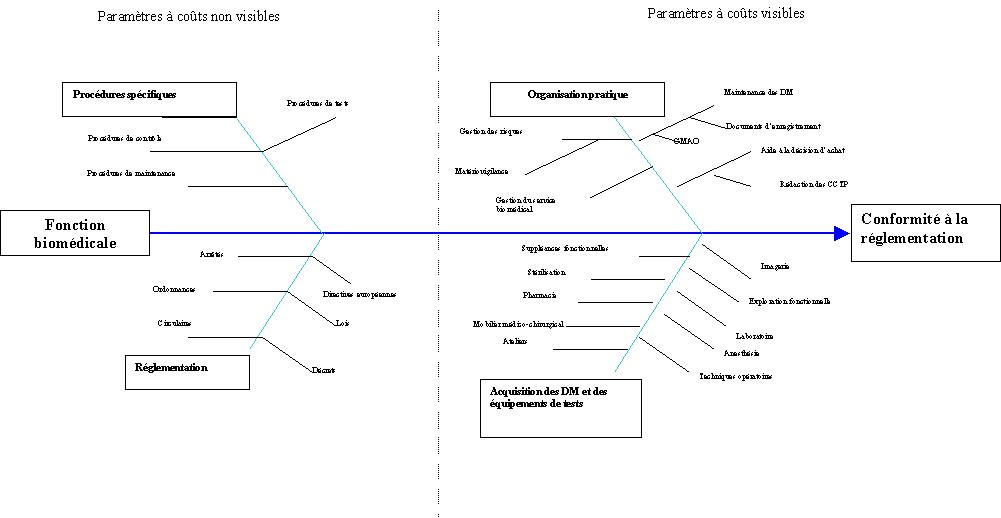
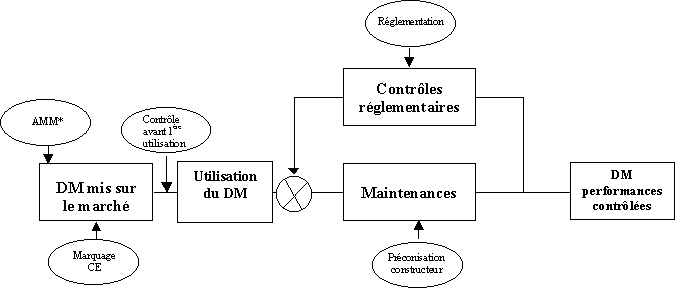
|
Type
|
Référence
|
Date
|
Sujet
|
| Lettre-circulaire |
DH/EM1/14 |
|
Appareils de SPO2 |
| Lettre-circulaire |
DH/EM1/962926 |
|
Microscopes opératoires
et autres dispositifs illuminant la rétine |
| Lettre- circulaire |
DH/EM1/9630059 |
|
Ventilateurs et mélangeurs
de gaz employés pour l’anesthésie, la réanimation
et la néonatalogie. |
| Lettre-circulaire |
DH/EM1/964459 |
|
Tables d’opérations |
| Lettre-circulaire |
DH/EM1/971770 |
|
Phakoémulsificateurs |
| Lettre-Circulaire |
DH/5D 86-312 |
05/09/86
|
Utilisation / entretien
appareils d'anesthésie |
| Lettre-Circulaire |
DH/EM1 88-269 |
25/10/88
|
Risques / incubateurs
ancienne génération |
| Lettre-Circulaire |
DGS/DH/4B 89-280 |
07/02/89
|
Mise en oeuvre Schémas
rég. réanimation |
| Lettre-Circulaire |
DH/EM1 |
26/10/89
|
Sécurité
d'utilisation des défibrillateurs (surtout Lilly) |
| Lettre-Circulaire |
DH/EM1 |
23/01/90
|
Sécurité
d'utilisation des mélangeurs de gaz |
| Lettre-Circulaire |
DH/EM1 |
08/02/90
|
Sécurité
d'utilisation des pompes acc. perf. PLB36, HEMOCARE |
| Lettre-Circulaire |
DH/EM1 |
23/03/90
|
risques d'erreurs flexibles
/ ventilateurs / prises murales |
| Lettre-Circulaire |
DH/EM1 90- |
27/04/90
|
Sécurité
d'utilisation des incubateurs |
| Lettre-Circulaire |
DH/EM1 90- |
03/07/90
|
Risques / mélangeurs
gaz Dräger |
| Lettre-Circulaire |
DH/EM1 91- |
18/01/91
|
Sécurité
d'utilisation de pousse-seringues |
| Lettre-Circulaire |
DH/EM1 91-254 |
25/06/91
|
Sécurité
seringues / pousse-seringues |
| Lettre-Circulaire |
DH/EM1 91- |
28/10/91
|
Sécurité
/ mélangeurs gaz / anesthésie |
| Lettre-Circulaire |
DH/EM1 92- |
09/11/92
|
Sécurité
/ matelas chauffants GMR34 de GAMIDA |
| Lettre-Circulaire |
DH/EM1 93-0107 |
07/01/93
|
Sécurité
/ matelas chauffants GMR34 de GAMIDA |
| Lettre-Circulaire |
DH/EM1 93-482 |
13/07/93
|
Sécurité
/ Réchauffeurs air pulsé / Bair Hugger GAMIDA et autres |
| Lettre-Circulaire |
DH/EM1 93-483 |
16/07/93
|
Sécurité
/ seringues BD 50 ml / Pousse-seringues |
| Lettre-Circulaire |
DH/EM1 93-493 |
20/07/93
|
Sécurité
d'utilisation des bistouris électriques |
| Lettre-Circulaire |
DH/EM1 93-559 |
13/08/93
|
Sécurité
/ seringues BD 50 ml / Pousse-seringues (complément 93-483) |
| Lettre-Circulaire |
DH/EM1 94-090 |
26/01/94
|
Risques / ventilateurs
CESAR (CFPO) |
| Lettre-Circulaire |
DH/EM1 94-328 |
22/03/94
|
Risques / réchauffeurs
de patient Chromex CM-AN 220 |
| Lettre-Circulaire |
DH/EM1 94- |
29/03/94
|
Utilisation des moniteurs
SpO2 |
| Lettre-Circulaire |
DH/EM1 94-776 |
28/07/94
|
Interdiction utilisation
réchauffeurs de patient sans alarme premier défaut |
| Lettre-Circulaire |
DH/EM1 94- |
05/08/94
|
Risques / ventilateurs
CESAR (CFPO) |
| Lettre-Circulaire |
DH/EM1 94- |
17/08/94
|
Risques / mélangeurs
de gaz médicaux |
| Lettre-Circulaire |
DH/EM1 94- |
20/12/94
|
Risques / appareils de
perfusion / roues codeuses |
| Lettre-Circulaire |
DH/EM1 95-0502 |
07/02/95
|
Risques / ventilateurs
Elsa (Datex-Engstroem) |
| Lettre-Circulaire |
DH/EM1 95-503 |
08/02/95
|
Risques / incubateurs
ancienne génération |
| Lettre-Circulaire |
DH/EM1 95-554 |
14/02/95
|
Inventaire des accidents
/ affaissement / tête de gamma caméra |
| Lettre-Circulaire |
DH/EM1 95-614 |
20/02/95
|
Interdiction utilisation
/ chambres à cathéters implantables M.I.T. |
| Lettre-Circulaire |
DH/EM1 95-0804 |
27/02/95
|
Risques / ventilateurs
CESAR (CFPO) |
| Lettre-Circulaire |
DH/EM1 95-2481 |
17/05/95
|
Suspension MM prothèses
mammaires |
| Lettre-Circulaire |
DH/EM1 95-3024 |
11/07/95
|
Risques / pousse-seringues
/ ambulatoire |
| Lettre-Circulaire |
DH/EM1 95-3059 |
13/07/95
|
Interdiction utilisation
/ chambres à cathéters implantables M.I.T. |
| Lettre-Circulaire |
DH/EM1 95-3136 |
02/08/95
|
Risques / incubateurs
/ rideau d'air chaud |
| Lettre-Circulaire |
DH/EM1 95-3137 |
02/08/95
|
Risques / ventilateurs
/ domicile / PLV100 / LifeCare |
| Lettre-Circulaire |
DH/EM1 95-3992 |
24/10/95
|
Suspension utilisation
/ dispositif d'assistance circulatoire |
| Lettre-Circulaire |
DH/EM1 95-4452 |
28/11/95
|
Risques / bistouris élect.
type B |
| Lettre-Circulaire |
DH/EM1 95-4451 |
28/11/95
|
Risques / coeliochirurgie
/ coagulation sous jet d'argon |
| Lettre-Circulaire |
DH/EM1 96-0484 |
05/02/96
|
Risques / ventilateurs
domicile / EOLE 2A (SAIME) |
| Lettre-Circulaire |
DH/EM1 96-1227 |
13/03/96
|
Risques / seroconditionneurs
non munis contrôle pression intracavitaire |
| Lettre-Circulaire |
DH/EM1 96-1467 |
19/03/96
|
Risques / Pompes d'Analgésie
Contrôlée par le patient (P.C.A.) |
| Lettre-Circulaire |
DH/EM1 96-1523 |
20/03/96
|
Risques / valves dérivation
liquide céphalo-rachidien SU8 (Sophysa) |
| Lettre-Circulaire |
DGS/DH 96-236 |
02/04/96
|
Modalités de désinfection
des endoscopes / lieux de soins |
| Lettre-Circulaire |
DH/EM1 96-1641 |
05/04/96
|
Risques / CESAR II (Taema
/ CFPO) |
| Lettre-Circulaire |
DH/EM1 96-2955 |
12/06/96
|
Risques / association
bistouri élec. & réchauffement patient |
| Lettre-Circulaire |
DH/EM1 96-3236 |
20/06/96
|
MM & utilisation évaporateurs
anesthésiques halogénés (détrompeurs) |
| Lettre-Circulaire |
DH/EM1 96-3907 |
19/07/96
|
Interdiction d'utiliser
Défibrillateur BD400 (Philips) |
| Lettre-Circulaire |
DH/EM1 96- |
05/08/96
|
Retrait du marché
VISCUM HMW Lot 0005 (LCA) |
| Lettre-Circulaire |
DH/EM1 96-4460 |
09/08/96
|
Utilisation des systèmes
de réchauffement patient |
| Lettre-Circulaire |
DH/EM1 96-4461 |
09/08/96
|
Risques / ventilateurs
/ domicile / PLV100 / LifeCare |
| Lettre-Circulaire |
DH/EM1 96-4496 |
14/08/96
|
Risques / ventilateurs
domicile / EOLE 3 (SAIME) |
| Lettre-Circulaire |
DH/EM1 96-4502 |
14/08/96
|
Risques / ventilateurs
anesthésie Elsa & Eas 9010 (Datex) |
| Lettre-Circulaire |
DH/EM1 96-4705 |
30/08/96
|
MM & utilisation valves
/ circuit ventilation spontanée ou manuelle |
| Lettre-Circulaire |
DH/EM1 96-5852 |
18/10/96
|
Utilisation valves anti-retour
/ lignes de perfusion |
| Lettre-Circulaire |
DH/EM1 96-6233 |
31/10/96
|
Risques / ventilateurs
domicile / EOLE 3 (SAIME) |
| Lettre-Circulaire |
DH/EM1 96-7602 |
12/12/96
|
Risques / DM ophtalmologie
/ produits / formol |
| Lettre-Circulaire |
DH/EM1 96-8010 |
31/12/96
|
Interdiction MM ventilateurs
ELSA & EAS 9010 (Datex) |
| Lettre-Circulaire |
DH/EM1 97-2536 |
07/01/97
|
Risques / insufflateurs
CO2 / NUMO |
| Lettre-Circulaire |
DH/EM1 97-2600 |
20/01/97
|
Utilisation valves pour
circuit ventilation (spontané & assisté man.) |
| Lettre-Circulaire |
DH/EM1 97-2112 |
17/03/97
|
Risques / canules trachéotomie
Trachéoflex - RÜSCH |
| Lettre-Circulaire |
DH/EM1 97-3158 |
22/04/97
|
Risques / dispositifs
de nutrition entérale / assemblages 6% (luer-lock) |
| Lettre-Circulaire |
DH/EM1 97-3747 |
15/05/97
|
Risques utilisation ventilateurs
CESAR - TAEMA |
| Lettre-Circulaire |
DH/EM1 97-4448 |
02/06/97
|
Risques / canules de trachéotomie
en PVC |
| Lettre-Circulaire |
DH/EM1 97-5939 |
21/07/97
|
Risques / ventilateurs
V710 SIEMENS |
| Lettre-Circulaire |
DH/EM1 97-5948 |
22/07/97
|
Risques ventilateurs EOLE
3 SAIME |
| Lettre-Circulaire |
DH/EM1 97-6967 |
18/08/97
|
Risques / insufflateurs
CO2 / NUMO |
| Lettre-Circulaire |
DH/EM1 97-5134 |
02/07/97
|
Risques / pompes perf.
FD 681 & FD 682 de MMS |
| Lettre-Circulaire |
DH/EM1 97-6965 |
14/08/97
|
Risques / moniteurs 7005
Marquette |
| Lettre-Circulaire |
DH/EM1 97-6922 |
18/08/97
|
Aiguilles sclérose
/ endoscopie digestive |
| Lettre-Circulaire |
DH/EM1 97-7685 |
09/09/97
|
Risques / Airox HOME 1 |
| Lettre-Circulaire |
DGS/DH/AFS 97-662 |
30/09/97
|
Ajournement définitif
du don de sang / receveurs de PSL |
| Lettre-Circulaire |
DH/EM1 97-8579 |
10/10/97
|
Utilisation / Laser /
revascularisation transmyocardique (TMR) |
| Lettre-Circulaire |
DH/EM1 97-011102 |
16/12/97
|
Mise sur le Marché
& utilisation câbles bipolaires / bistouris électriques. |
| Lettre-Circulaire |
DH/EM1 97-011487 |
31/12/97
|
Risques / canules trachéotomie
Tracheoflex (Rüsch) |
| Lettre-Circulaire |
DH/EM1 97-011487 |
31/12/97
|
Risques / canules trachéotomie
Tracheoflex (Rüsch) |
| Lettre-Circulaire |
DH/EM1 98-1133 |
27/01/98
|
Risques / Tables opération
à plateau transférable |
| Lettre-Circulaire |
DH/EM1 98-1433 |
03/02/98
|
Risques / ventilateurs
Eole 3 SAIME |
| Lettre-Circulaire |
DH/EM1 98-3158 |
16/03/98
|
Incidents / Lasers / revascularisation
transmyocardique |
| Lettre-Circulaire |
DH/EM1 98-3302 |
20/03/98
|
Incidents / tables opérations
(matelas & escarres) |
| Lettre-Circulaire |
DH/EM1 98-4542 |
22/04/98
|
Risques / Incubateurs
fermés à rideau d'air chaud |
| Lettre-Circulaire |
DH/EM1 98-12141 |
29/10/98
|
Risques / Ventilateur
à domicile |
| Lettre-Circulaire |
DH/EM1 98-12145 |
29/10/98
|
Risques / Phacoemulsificateurs
(utilisation) |
| Lettre-Circulaire |
DH/EM1 98-12285 |
03/11/98
|
Interdiction utilisation
incubateurs ancienne génération |
| Lettre-Circulaire |
DH/EM1 98-12591 |
13/11/98
|
Risques d'erreurs / connexions
/ perfusion / oxygénothérapie |
| Lettre-Circulaire |
DH/EM1 98-7255 |
15/07/98
|
Risques / bistouris électriques
/plaques neutres |
| Lettre-Circulaire |
DH/EM1 98-8066 |
07/08/98
|
Risques / Evaporateurs
TEC 6 Ohméda |
| Lettre-Circulaire |
DH/EM1 98-9548 |
01/09/98
|
Risques / certains manodétendeurs
AGA |
| Lettre-Circulaire |
DH/EM1 98-10503 |
27/10/98
|
Interdiction utilisation
pompe à perfusion Collin Transomega 4 |
| Lettre-Circulaire |
DH/EM1 98-14109 |
29/12/98
|
Risques / oscillateurs
HF (respirateurs HF) OHF1 / Dufour |