Figure I-1: Effet de champs
B0 de 0.5 T et de 2.3 T sur les niveaux d’énergie des
spins
et répartition
de ces spins sur un cône de précession.
|
|
| Si vous arrivez directement sur cette page sachez que ce travail est un rapport d'étudiant(e)s et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé lors de la période d'enseignement théorique à l'UTC et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part. L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
|
|
Projet DESS "TBH", UTC, 00-01, pp 66 , URL : https://www.utc.fr/~farges/DESS_TBH/00-01/Projets/spectro/srm.htm Etat de l'art de la spectrométrie in vivo du proton par RMN |
||
|
|
|
|
|
La spectrométrie localisée de résonance magnétique est désormais une méthode complémentaire de l'IRM proposée par les constructeurs comme option de routine. Le présent rapport a pour but de rappeler le principe du phénomène de résonance magnétique nucléaire et de décrire les composants du système. Il présente les techniques les plus utilisées pour obtenir des spectres RMN de bonne qualité, à la fois en spectrométrie localisée et en imagerie spectrométrique. Ce document décrit les principaux métabolites observables et énonce enfin les différentes applications existantes ainsi que les perspectives d'avenir de cette méthode. Mots-clés : Spectrométrie localisée, imagerie spectrométrique, résonance magnétique nucléaire, IRM, SRM, in vivo, proton, séquence, acquisition, traitement des données, applications cliniques. |
|
Proton magnetic resonance spectroscopy is now proposed by manufacturers as a routine exploration complementary to MRI. The purpose of this report is to point out the principle of the phenomenon of nuclear magnetic resonance, and to describe the components of the system. It presents the most used techniques to obtain good quality NMR spectra, both in localised spectroscopy and in spectroscopic imaging. This document describes the major observable metabolites and states finally the various existing applications as well as the future prospects of this method. Keywords : Localized spectroscopy, spectroscopic imaging, nuclear magnetic resonance, MRI, MRS, in vivo, proton, sequence, acquisition, data processing, clinical applications |
Nous voulons remercier chaleureusement
toutes les personnes qui nous ont renseignées, conseillées
et ont répondu à nos questions, ce qui nous a permis d'accéder
facilement et rapidement à de multiples sources d'informations.
Pour leur amabilité et leur grande disponibilité, nous tenons
particulièrement à exprimer notre reconnaissance à
:
- Monsieur François LANGEVIN, Enseignant-Chercheur, Université Technologique de Compiègne.
- Monsieur le Professeur Patrick COZZONE, Directeur du Centre de Résonance Magnétique Biologique et Médicale (CRMBM), Faculté de Médecine de Marseille.
- Monsieur le Docteur Jean VION-DURY, Service de Neurophysiologie Clinique, Hôpital de la Conception, Marseille.- Monsieur Jean-Michel FRANCONI, Professeur de Physique, Université de Bordeaux.
- Madame Ulrike DYDAK, Doctorante au Département de Résonance Magnétique, Institute for Biomedical Engineering, Zurich (Suisse).
- Mademoiselle Aude HERMANT, Messieurs Bruno BERTHET et Joseph BENMAIR, Ingénieurs IRM, Philips Systèmes Médicaux, Suresnes.
- Monsieur le Docteur Alain BRESSON, Chef du service de Radiologie, Centre Hospitalier François Maillot, Briey.
- Monsieur Lionel NICOL, Ingénieur IRM, Siemens Division Médicale, Saint-Denis.
- Monsieur Martin LABELLE, Doctorant au Département de Radiologie, Hôpital Saint-Luc, Montréal (Québec).
1.Principe physique de la résonance magnétique nucléaire2.Interactions indépendantes du temps
2.1.Déplacement chimique3.Interactions dépendantes du temps
2.2.Couplage de spin3.1.Temps de relaxation longitudinal ou spin-réseau (T1)
3.2.Mesure du T1
3.3.Temps de relaxation transversal ou spin-spin (T2)
3.4.Mesure du T2
1.Le système RMN
1.La spectrométrie localisée5.Méthodes d’amélioration du signal RMN
5.1.Suppression du signal de l’eau libre
5.2.Suppression du signal des lipides
1.Techniques de localisation sur un seul volume1.1.Séquence PRESS2.Techniques de localisation multi-volumes
1.2.Séquence STEAM2.1.Technique CSI
2.2.Technique SENSE-SI
1.Cerveau1.1.Maladie d’Alzheimer2.Prostate
1.2.Epilepsie
1.3.Tumeurs cérébrales
1.4.Sclérose en plaque
L’imagerie par résonance
magnétique (IRM) et la spectrométrie par résonance
magnétique (SRM) sont une seule et même technique (utilisant
un matériel identique) qui ne diffère que de la façon
dont les données sont représentées. La spectroscopie
(la dénomination officielle française est spectrométrie)
est fondée sur la mesure des signaux de résonance magnétique
générés par certains noyaux (habituellement 1H
ou 31P) en réponse à des impulsions radiofréquence.
Elle permet ainsi d’identifier les types de molécules contenues
dans un volume parfaitement défini d’un tissu biologique et leurs
concentrations respectives.
Depuis dix ans, la spectrométrie est proposée par les constructeurs sur les imageurs par résonance magnétique. Désormais, elle a évoluée et est ouverte à un public médical plus large. Il n’est plus nécessaire d’être au sein d’une équipe spécialisée ou bien entouré de physiciens pour réaliser une spectrométrie de qualité (tout du moins monovoxel), dans un contexte d’application clinique.
La caractérisation des processus d’une pathologie nécessite la corrélation entre ce qui est visuellement observé à l’aide d’une image anatomique et les changements biochimiques qui surviennent dans les régions explorées. La médecine nucléaire, dont fait partie la tomographie par émission de positrons (TEP), a été utilisée pour examiner ces changements métaboliques. Cependant, cette technique ne permet pas d’études étendues du fait de l’exposition aux radiations du patient. La spectrométrie RMN in vivo du proton peut-être utilisée pour surveiller fréquemment ces changements métaboliques et biochimiques. Elle se révèle être un outil de diagnostic complémentaire à l’IRM en permettant la confrontation directe des données anatomiques (fournies par l’IRM) et des données métaboliques (par l’identification, la localisation et la quantification de certains composés).
Après avoir défini
les enjeux et les problèmes potentiels, nous aborderons la spectrométrie
RMN in vivo du proton sous un angle d’abord technique (principe
du phénomène, données mesurées, techniques
utilisées pour réaliser ces mesures). Puis nous mettrons
en évidence les applications cliniques actuelles et potentielles
de la spectrométrie par résonance magnétique.
La spectrométrie
RMN in vivo du proton (SRM) apporte une information radicalement différente
de celle que fournit l’IRM. Nous traiterons plus particulièrement
du domaine cérébral, domaine de loin le plus fréquemment
exploré.
Une lésion observable en IRM est le plus souvent due à l’apparition de molécules d’eau plus mobiles et plus libres que dans le tissu sain (œdème, cavitation…). L’image de la lésion est formée ainsi à partir de tissus qui souffrent considérablement ou bien qui sont déjà morts. Des cas se situent à mi-chemin entre la santé neuronale ou gliale d’une part, et la mort cellulaire d’autre part (lorsque la santé neuronale ou gliale n’est pas satisfaisante : encéphalopathie).
Il existe donc en plus d’une exploration IRM qui s’avérera éventuellement normale, une place pour une autre exploration réalisant la détection d’anomalies métaboliques qui n’ont pas encore entraîné de lésion histologique ou d’œdème, mais « seulement » une souffrance cellulaire.
Le profil métabolique
de la SRM n’est, qu’à de rares exceptions, spécifique d’une
pathologie. Cependant, si elle produit des informations différentes
de l’IRM, potentiellement précoces, dès lors le domaine de
prédilection de la spectrométrie sera la qualification et
la quantification de la souffrance cérébrale, diffuse ou
localisée. La possibilité qu’elle offre de détecter
un marqueur glial (myo-inositol) et un marqueur neuronal (N-acétylaspartate),
un marqueur d’envahissement macrophagique ou d’anoxie (lactate), fait que
la combinatoire de ces informations conduit à dire de quel type
de souffrance cérébrale il s’agit, et quelle est son intensité.
Si l’on fait une analogie, on peut dire que les particules de spin non nul se comportent comme des petits aimants. En spectrométrie RMN in vivo, on s’intéresse surtout à un certain nombre de noyaux atomiques parmi lesquels on peut citer le 1H (hydrogène, encore appelé proton), le 13C (carbone 13), le 31P (phosphore 31) et le 19F (fluor 19). On dit que ces particules possèdent un moment magnétique.
Dans cet exposé, nous nous intéresserons uniquement à la spectrométrie du proton, technique la plus répandue dans ce domaine, du fait de l’abondance très élevée de l’hydrogène (99.98%) et de son fort moment magnétique, ce qui facilite l’observation des signaux de résonance.
Quand des noyaux possédant un spin sont soumis à un champ magnétique B0 très puissant (par rapport au champ magnétique terrestre), ils peuvent prendre deux orientations différentes : soit ils s’alignent dans la même direction que celui-ci, soit ils s’alignent dans la direction contraire. Ceux qui sont alignés dans la même direction que le champ B0 (position parallèle) ont une énergie un peu plus basse que ceux qui sont alignés dans la direction contraire (position anti-parallèle, cf. Figure I-1). Ces spins précessent sur deux cônes opposés, l’un correspondant à l’orientation parallèle (le plus peuplé) et l’autre à l’orientation anti-parallèle. A cet instant, le système de spins est à l’équilibre.
Pour observer un signal,
il faut rompre cet équilibre en soumettant les spins à une
radiation électromagnétique de caractéristiques adéquates,
dans le domaine des radiofréquences (RF). Il est possible d’exciter
ces noyaux et de les faire passer d’un niveau d’énergie (ou d’un
état de spin) inférieur à un niveau supérieur.
La différence énergétique qui sépare ces deux
niveaux dépend de l’intensité du champ magnétique
appliqué : plus fort est ce champ, plus grande est la différence
entre les niveaux.

Figure I-1: Effet de champs
B0 de 0.5 T et de 2.3 T sur les niveaux d’énergie des
spins
et répartition
de ces spins sur un cône de précession.
L’échantillon (zone d’intérêt du patient à imager) est alors soumis à un second champ magnétique B1 (produit par une source de radiations électromagnétiques) dont la direction de propagation est orientée perpendiculairement au champ produit par l’aimant et n’ayant aucune incidence sur le champ B0. L’énergie est fournie par une radiofréquence appelée fréquence de Larmor qui assure la transition. Cette fréquence de Larmor est définie par la relation suivante :
![]()
où g est le rapport gyromagnétique propre à chaque type de noyau, et B0 est le champ magnétique permanent appliqué selon l’axe crânio-caudal du patient.
Le système entre alors en résonance, et sa réponse à la perturbation, apportée par la radio-fréquence, est le spectre de RMN. Si tous les protons d’un composé résonnaient exactement à la même fréquence, la RMN ne serait d’aucune utilité pratique. Or, la fréquence de Larmor d’un proton est affectée par les électrons environnants caractérisant les phénomènes de déplacements chimiques et de couplage de spins.
![]()
où Bi est le champ magnétique global du proton,
et si est le terme de blindage électronique (négligeable devant B0).
Par conséquent, les protons ne résonnent plus exactement à la même fréquence w0 mais à une fréquence wi définie par :
![]()
La fréquence de résonance d’un spin dépend donc autant du champ magnétique qu’il subit que de son environnement moléculaire. Les différences de fréquence di ne sont généralement pas exprimées en Hz sinon elles seraient variables en fonction du champ B0 appliqué, mais en parties par million (ppm) où di est défini par la relation :
![]()
où wréf représente la valeur d’une fréquence de résonance arbitrairement choisie (par exemple, w0 ou le N-acétylaspartate dans le cas d’une imagerie cérébrale).
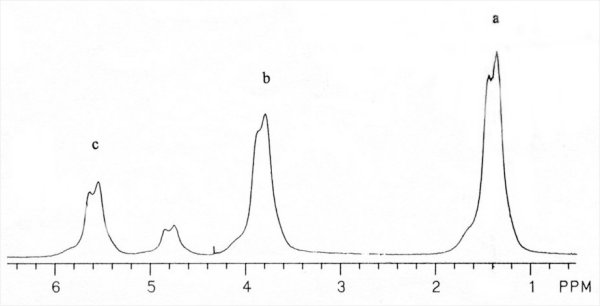
Ces déplacements chimiques permettent donc d’étudier puis d’identifier le spectre (groupes fonctionnels par groupes fonctionnels, cf. Figure I-2) de métabolites utiles au praticien pour produire un diagnostic de certaines pathologies précises que nous définirons plus loin.

Figure I-2 : Spectre d'une solution d'éthanol diluée dans de l'eau à 95%. Les pics de résonance a, b et c sont respectivement ceux des groupements méthyl, méthylène et hydroxyl (le pic non annoté est celui de l'eau).
Cependant, l’identification de molécules particulières (par exemple l’ATP) par les déplacements chimiques, les pics du 31P sont indifférenciables. En effet, les noyaux de 31P sont trop loin de l’adénosine et de la guanosine pour interagir avec eux. On n’observe donc aucun déplacement chimique. La différenciation de certaines molécules se fait également grâce à un autre type d’interaction moléculaire : le couplage de spin.
·il est indépendant du champ B0 appliqué alors que le déplacement chimique est
directement proportionnel à celui-ci lorsqu’il est mesuré en Hz
·de plus, il existe toujours un autre spin impliqué dans le couplage alors que le
déplacement chimique est propre à un groupement fonctionnel d’une molécule.
Le couplage de spin peut, par exemple, être mis en évidence par l’étude du spectre de la solution d’éthanol citée plus haut réalisé avec une meilleure résolution spectrale (cf. Figure I-3). Comme sur la figure précédente, nous observons la présence de trois pics de résonance principaux eux-mêmes subdivisés en plusieurs pics.
Les pics des groupements méthyl et hydroxyl se divisent en trois pics séparés d’un variation de fréquence caractérisée par les constantes de couplage J1 et J2. La présence de ces trois pics est due au couplage des protons des groupements méthyl et hydroxyl avec ceux du groupement méthylène. Les deux spins du groupement méthylène peuvent adopter trois types d’arrangements s’ils sont soumis à un champ magnétique B0 (voir Figure I-4). Par conséquent, un proton situé dans un groupement fonctionnel adjacent (dans ce cas, le méthyl et l’hydroxyl) « ressentira » l’un des trois champs magnétiques locaux possibles dus au couplage du méthyl et de l’hydroxyl avec le méthylène. La probabilité des différents arrangements des spins est 1 : 2 : 1 (d’où une aire du pic central doublée par rapport aux deux autres).
Dans un échantillon d’éthanol, ces trois champs magnétiques locaux génèrent des fréquences de résonance différentes, d’où la présence de trois pics centrés sur la fréquence de résonance des protons du groupement méthyl.
On observe huit pics de résonance pour le groupement méthylène. En effet, il y a couplage des protons de ce groupement avec tout d’abord ceux du méthyl (ce qui induit la présence de quatre pics de résonance correspondant aux quatre possibilités de réarrangement des spins du méthyl, de probabilités respectives 1 : 3 : 3 : 1 d’où des rapports d’aires identiques) et avec ceux de l’hydroxyl (ce qui provoque le dédoublement des quatre pics cités précédemment correspondant aux deux possibilités de réarrangements de l’hydroxyl). Les écarts de fréquence entre les quatre pics du méthyl seront caractérisés par la constante de couplage J1 tandis que les écarts entre chaque pic (deux à deux) seront caractérisés par la constante de couplage J2. Les valeurs des constantes de couplage varient selon qu’il existe une liaison directe entre les spins ou non : si la liaison est directe, la valeur de la constante de couplage sera plus élevée.
Le couplage peut également
se produire avec des spins différents (exemple : 1H-13C,
1H-31P).
D’une façon générale, pour deux spins couplés,
la constante de couplage est significativement plus faible que le déplacement
chimique. Il existe des procédés visant à supprimer
le couplage des spins (de même nature ou de natures différentes)
comme la saturation.
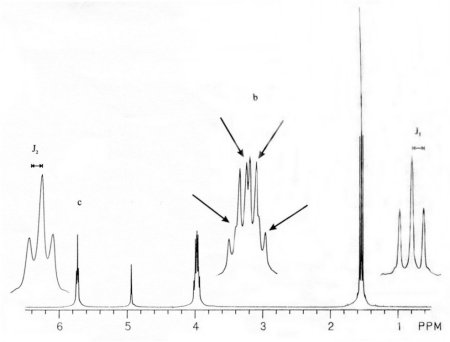
Figure I-3 : Spectre de
haute résolution d'un solution d'éthanol diluée à
95% dans de l'eau.
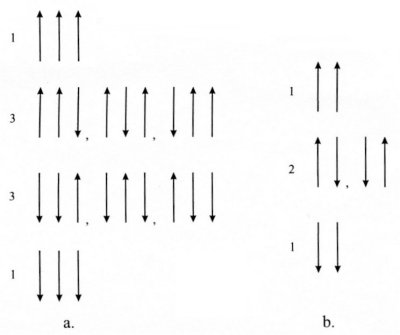
Figure I-4 : a) Probabilité des arrangements de spin de trois
protons,
b) Probabilité d'arrangements de deux protons.
![]()
Le T1 est donc associé
à la vitesse de récupération de l’aimantation longitudinale
et est caractéristique d’un tissu ou d’un métabolite donné.
En effet, le mécanisme de relaxation spin-réseau dépend
de la présence d’interactions moléculaires qui varient avec
une fréquence propre -L rivalisant avec la fréquence
-0. Plus -0 est proche de -L, plus les
transferts d’énergie seront rapides et nombreux. Dans le cas où
le réseau est constitué de protéines par exemple,
le T1 a tendance à être court. Inversement, si -L
est très différente de -0 (cas des métabolites
étudiés en spectrométrie RMN in vivo du proton),
la valeur de T1 est nettement augmentée.
Figure I-5 : Courbe de « repousse » de l’aimantation Mz suite à une impulsion RF 90°.
A la deuxième impulsion, la perte de signal est déjà moins importante et après plusieurs répétitions de ces impulsions, la variation de M devient négligeable. On obtient donc un signal stable dépendant de :
-la concentration en protons dans le volume d’intérêt,
-la valeur de T1,
-la valeur de TR (temps de répétition, voir plus bas),
-l’énergie de l’impulsion RF .
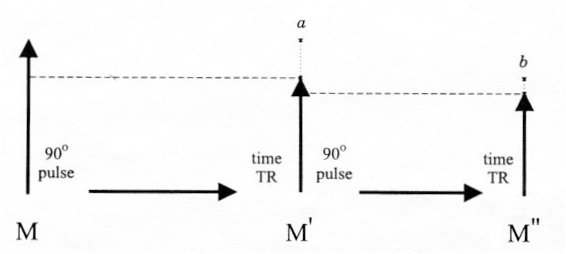
Figure I-6 : Effet de deux impulsions RF 90° sur l’aimantation longitudinale Mz.
Ces impulsions muettes produisent un phénomène de saturation à un degré significatif et donc une perte importante de signal (les populations de spins des cônes de précession ayant tendance à s’équilibrer). En effet, si le temps de répétition de l’impulsion RF 90° est court, les métabolites étudiés en spectrométrie RMN ayant des T1 longs, l’onde RF est assimilée à une onde continue. Il est donc nécessaire de corriger ces effets saturants pour déterminer les concentrations de protons du volume d’intérêt (VOI, Volume of Interest) et donc des métabolites.
La saturation possède également un autre intérêt relatif au découplage. Pour découpler les spins de l’atome observé de ceux de l’atome couplé, on stimule l’atome que l’on veut découpler à sa fréquence propre par des impulsions RF très rapprochées, et on atténue très fortement le signal qu’il aurait été susceptible de fournir sans le découplage (c’est-à-dire les perturbations). A l’aide de cette méthode, on obtient un accroissement important du signal des spins de l’atome observé.
·La saturation partielle :
Cette séquence consiste à recueillir le signal FID (Free Induction Decay, décroissance d’induction libre) juste après une impulsion RF 90° (cf. Figure I-7). Cette séquence annule le vecteur d’aimantation Mz par cette impulsion RF 90°. Elle permet d’obtenir des temps d’échos très courts et un bon contraste des tissus en T1. En revanche, elle donne peu d’informations sur T2 qui est noyé dans T2* (T2 dus aux inhomogénéités, voir I.3.4, Mesure du T2).
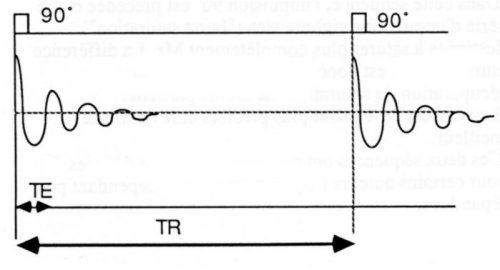
L’utilisation de cette séquence seule a été complètement abandonnée.
·La Saturation-Récupération :
La saturation-récuperation est une variante de la saturation partielle. Dans cette séquence, l’impulsion RF 90° est précédée d’une série d’impulsions destinées à saturer complètement Mz. La saturation ici est donc moins partielle. Les valeurs de T1 seront donc plus précises et le contraste meilleur.
·L’inversion-Récupération :
Cette séquence débute par l’application d’un impulsion RF 180° qui inverse la direction du vecteur d’aimantation Mz. Lorsque cette impulsion s’arrête, le vecteur Mz revient à sa position initiale suivant sa courbe de relaxation T1. Pour recueillir un signal, il est nécessaire d’appliquer une impulsion RF 90° au temps t + e.t plus tard, ce qui projette l’aimantation M0 « ayant repoussée » dans le plan (x,0,y).
Le temps entre l’impulsion RF 180° et l’impulsion RF 90° s’appelle le temps d’inversion (TI). Si TI est tel que l’impulsion RF 90° est appliquée au moment où la courbe T1 (d’un tissu particulier) croise le plan (x,0,y), il n’y a pas de vecteur Mz à basculer et donc pas de signal. On peut se servir de cette propriété pour faire disparaître le signal d’un tissu (par exemple la graisse) et obtenir un meilleur contraste avec les tissus voisins (voir Figure I-8).
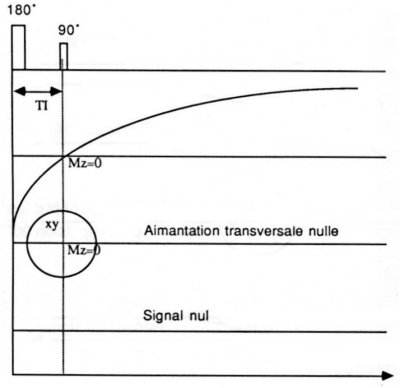
La technique WEFT (Water
Elimination Fourier Transform) est une séquence d’inversion-récupération.
Cette disparition de cohérence produit le signal Free Induction Decay (FID). La perte de magnétisation dans le plan transversal s’effectue selon une constante de temps T2 (voir Figure I-9), ou T2* (T2 du aux inhomogénéités du champ B0 : mode de fabrication de l’aimant, inhomogénéités de l’échantillon, gradients de localisation) et suit la relation suivante :
![]()
Au niveau microscopique, le phénomène consiste en un relarguage d’énergie entre des spins proches les uns des autres et tournant à une fréquence -0. Les interactions inter et intramoléculaires comme les vibrations et les rotations participent également à la perte de cohérence des spins et ainsi à la réduction de l’amplitude de l’aimantation transversale.
Le T2 a tendance par conséquent à être court dans un tissu ou le mouvement des spins est restreint (exemple : protéines de l’os), et long dans un tissu ou le mouvement des spins est moins limité (comme le liquide céphalo-rachidien).
Figure I-9: Courbe de décroissance de l’aimantation transversale.
On peut ensuite soustraire du signal obtenu la constante due aux inhomogénéités. Le résultat est, après soustraction, la décroissance réelle du signal du au déphasage des spins (voir Figure I-10). En joignant les sommets des courbes FID successives, on mesure la vraie valeur de T2.
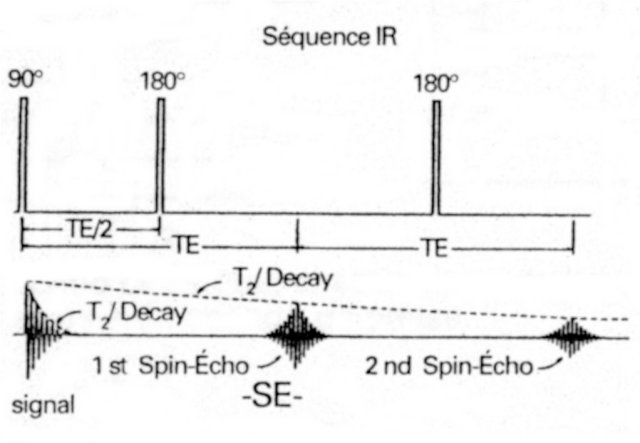
Figure I-10 : Séquence Echo de Spin et principe de mesure du T2 « vrai ».
La séquence écho de spin se décompose en plusieurs étapes :
-une impulsion RF 90° qui fait basculer M0 dans le plan transversal,
-un délai court t permettant aux spins de se déphaser,
-une impulsion RF 180° qui fait basculer les spins de 180,
-un délai court t permettant aux spins de se rephaser et de produire un nouvel écho.
Pour mieux comprendre le rephasage des spins, on peut les assimiler à des coureurs. Si trois coureurs partent en même temps pour une course, ils se distanceront rapidement, on peut dire qu’ils « se déphasent ». Au bout d’un certain temps, on leur demande de repartir en sens inverse. Si leur vitesse reste constante, ils arriveront ensemble sur la ligne d’arrivée : ils seront « rephasés ».
Il existe plusieurs variantes de la séquence écho de spin (plusieurs impulsions RF 180° après l’impulsion 90°, exploitation d’un écho sur deux…) ; la technique PRESS que nous verrons plus loin en est une.
La SRM in vivo
réalisée chez l’homme utilise la même technologie que
les imageurs par RMN, et souvent les mêmes machines, sur lesquelles
on a seulement réalisé l’ajout d’un module de spectrométrie,
qui comprend des modifications au niveau du matériel électronique
et des programmes informatiques (séquences SVS et CSI, techniques
de suppression de l’eau…).
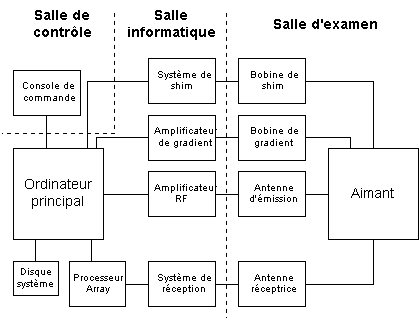
Du fait de l’utilisation de champs élevés, l’aimant est de type cryogénique supraconducteur, les autres types (résistifs ou permanents) sont limités à 0.3 T. Il est constitué de plusieurs bobines supraconductrices en alliage Niobium-Titane permettant de générer le champ magnétique (4 à 6 bobines cryogéniques offrent une homogénéité maximale à 1.5 T), ainsi que d’un système de refroidissement à hélium liquide pour maintenir une température proche du zéro absolu (4.4 °K), essentielle pour assurer la supraconductivité. Contrairement aux premières IRM qui nécessitaient un ravitaillement régulier en azote ou en hélium (dont les coûts sont élevés), les systèmes actuels n’ont pratiquement plus ou peu de pertes en fluides de refroidissement.
On utilise aussi des gradients pour modifier le champ magnétique statique B0 afin de le rendre le plus homogène possible au niveau d’un volume donné : c’est l’opération de "shimming". Cette douzaine de bobines de shim (actives ou passives) compense les petites distorsions du champ (de l’ordre du µT) liées aux défauts de fabrication et à l’environnement.
La chaîne radiofréquence est composée d’un synthétiseur de signal radiofréquence dont la valeur dépend du champ B0 (Tableau II-1). Le signal RF est modulé (quelques kHz) par le séquenceur pour générer les gradients et est amplifié avant d’être envoyé sur l’antenne choisie. A la réception du signal RMN, celui-ci est d’abord pré-amplifié puis démodulé (64 MHz ± quelques kHz), ensuite digitalisé par un convertisseur analogique-numérique (CAN) et enfin mémorisé par l’ordinateur.
En spectrométrie,
plusieurs noyaux (1H, 31P, 19F, 13C
...) peuvent être étudiés. Il faut donc disposer d’une
chaîne radiofréquence et d’un amplificateur réglables
afin de générer les fréquences de Larmor correspondantes.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e phénomène de résonance est créé par une impulsion radiofréquence, de courte durée et de forte intensité, qui permet de faire résonner tous les noyaux du spectre. Une telle impulsion excite toutes les fréquences d’une bande spectrale infinie. En pratique, une impulsion de durée t couvrira une bande de fréquence : DF = ±1/T. La durée de l’impulsion t dépend de son intensité exprimée par B1, de la fréquence de résonance du noyau étudié représenté par g, et des caractéristiques électroniques de l’antenne produisant l’impulsion. L’angle de basculement est alors donné par la relation :
Ceci nous interdit une observation ultérieure du phénomène de résonance qui nécessite un déséquilibre des populations. Par la suite, les noyaux restituent leur excès d’énergie au milieu par couplage avec d’autres noyaux, pour retrouver leur distribution initiale. Ces processus qui conduisent à ce retour à l’équilibre thermique, appelés processus de relaxation (T1 et T2) peuvent durer plusieurs secondes voir dizaines de secondes. Par conséquent, il sera nécessaire d’attendre un temps plus ou moins long avant d’exciter à nouveau le système de spins étudié.
Si toutefois, on désire répéter l’expérience plus rapidement c’est-à-dire sans attendre un délai égal à 5 T1 entre chaque impulsion il sera nécessaire de calculer la valeur optimale de la durée de l’impulsion, celle-ci étant donnée par la relation : Cos teta = e (-TR/T1).
Il sera important de conserver TR > T1, afin d’obtenir une valeur optimale pour l’angle d’impulsion. Cette valeur, appelée angle de Ernst, est égale à 70° pour TR = T1.
La phase est la deuxième
caractéristique de l’impulsion après son intensité.
En général, le champ B1 (l’impulsion RF) est placé
selon l’axe x basculant l’aimantation selon l’axe y. En fait,
cette impulsion peut être placé selon x, y,
-x
ou -y. Cela peut être particulièrement important pour
la création de séquences sophistiquées ou dans les
applications in vivo : ce sont les techniques de cyclage de phase.
La mesure du signal RMN nécessite des conditions d’expérimentation très rigoureuses :
-l’axe de l’antenne c’est à dire celui du champ B1 doit être perpendiculaire à B0.
-l’antenne doit être accordée à la fréquence de résonance du noyau étudié et adapté en impédance aux circuits électroniques de détection.
Il existe plusieurs type
de bobines, mais on utilise surtout des résonateurs en spectrométrie
(antennes de type "cage d’oiseau"). Le champ B1 produit par
un résonateur est plus homogène que celui d’une antenne de
surface mais cette dernière est proche de la région étudiée
donc plus sensible. Pour certaines applications médicales, les antennes
de surfaces restent indispensables. De plus, elles sont maintenant utilisées
en réseau pour augmenter la sensibilité et l’homogénéité
d’une antenne en particulier, et ce au détriment des autres. En
imagerie, l’antenne corps sert d’antenne d’émission et toutes les
autres (tête y compris) fonctionnent uniquement en réception.
En spectrométrie, on utilise la même antenne pour l’émission
et la réception, afin de contrôler la répartition spectrale
de l’émission et d’augmenter la sensibilité.
Les signaux restants sont
définis non plus par leur fréquence absolue mais par leur
offset, c’est à dire la différence entre leur fréquence
absolue et la fréquence porteuse. Cependant avec ce système
de détection, il faut placer la fréquence porteuse à
un bout du spectre pour distinguer tous les signaux. Pour remédier
à cela, on utilise deux détecteurs placés à
90° l’un de l’autre : c’est la méthode de détection en
quadrature. Ainsi les antennes de détection reçoivent deux
signaux RMN déphasés l’un par rapport à l’autre de
90°. Cette détection en quadrature présente de nombreux
avantages, elle permet d’identifier les signaux d’offset positif et négatif
par rapport à la fréquence porteuse. Celle-ci étant
centrale, la bande de fréquence d’excitation est diminuée
de moitié, ce qui divise l’intensité de l’impulsion et le
taux d’échantillonnage par deux et le bruit d’un facteur ![]() .
.
A partir de ce point, dans le but d’obtenir le spectre de l’échantillon, nous allons utiliser des traitements nécessitant l’utilisation d’un ordinateur. Parmi ces traitements, le plus important est l’algorithme de la Transformée de Fourier Rapide (FFT: Fast Fourier Transform). Mais avant cela il faut convertir ce signal continu (forme analogique) en un signal discret (forme numérique) au moyen d’un convertisseur analogique-numérique (CAN). Des caractéristiques techniques de ce CAN vont dépendre la qualité de la digitalisation. Celle ci est caractérisée par trois paramètres : la précision (c’est à dire le nombre de points d’échantillonnage sur l’échelle temporelle), la numérisation (le nombre de points nécessaires pour coder l’intensité du signal) et la vitesse à laquelle ces signaux sont échantillonnés.
D’après les critères d’échantillonnage (critère de Nyquist et théorème de Shannon), un signal sinusoïdal doit être discrétisé ou décrit par au minimum deux points par période pour être correctement représenté. Nous comprenons maintenant pourquoi il est nécessaire de convertir le signal RMN radiofréquence. Sinon, pour digitaliser un signal RMN de 200 MHz, nous devrions utiliser un CAN travaillant à une fréquence supérieure à 400 MHz (opération extrêmement difficile et coûteuse). Par contre pour obtenir un spectre de 2 kHz, la fréquence d’échantillonnage minimale (Fe) n’est que de 4 kHz. La résolution digitale, c’est à dire la précision avec laquelle le signal est analysé, est déterminée en fonction du temps d’échantillonnage (Te = 1/Fe) et du nombre total de points (N). Dans l’exemple d’un signal de 2 kHz, chaque point est obtenu toutes les 250 µs. Le temps d’acquisition d’un signal (décrit sur 8192 points) est Tacq = N´Te = 2 s, et la résolution digitale vaut 2.103/8192 = 0.24 Hz/point. Si l’on utilise une détection en quadrature, le nombre de points N pourra être divisé par deux, ce qui permet de diminuer d’autant le temps d’acquisition.
Enfin il reste une caractéristique
de la digitalisation : c’est la dynamique, c’est à dire la
capacité du système à coder le plus grand nombre d’amplitudes
différentes. Chaque point de mesure de l’amplitude d’un signal est
codé par un nombre de bits donnés. Ainsi pour un mot de 8
bits il peut prendre 28 = 256 valeurs et donc coder autant de
signaux d’amplitude différents. La dynamique du système augmente
avec la taille du mot informatique. On pourra même associer deux
mots pour doubler la dynamique, c’est ce que l’on appelle la double
précision. Si le spectre est composé de signaux de très
large intensité (comme le pic de l’eau ou le pic du solvant), il
est impératif de posséder un système de digitalisation
avec une plus grande dynamique (32 bits en double précision). Si
ce n’est pas suffisant et c’est le cas général, il faudra
alors utiliser des techniques de suppression des pics de l’eau (cf. III.5.1).
Afin de reconstruire très
rapidement les images et les spectres, on utilise un module "array-processor"
composé de plusieurs microprocesseurs de type RISC (plus puissants
que la gamme Intel Pentium de type CISC) et d’une grosse mémoire
RAM qui permettent d’effectuer très rapidement des calculs spécifiques,
comme les transformées de Fourier. Les images reconstruites ou les
données brutes peuvent être tout comme l’IRM sauvegardées
sur support numérique (disque dur, CD) ou envoyées vers un
reprographe.
Deux méthodes
principales sont utilisées : la SRM localisée, dite monovoxel,
où le volume d’intérêt spectrométrique est petit
et unique, et l’imagerie spectrométrique ou imagerie métabolique
par spectrométrie, méthode dans laquelle on enregistre simultanément
le signal venant de nombreux volumes élémentaires.
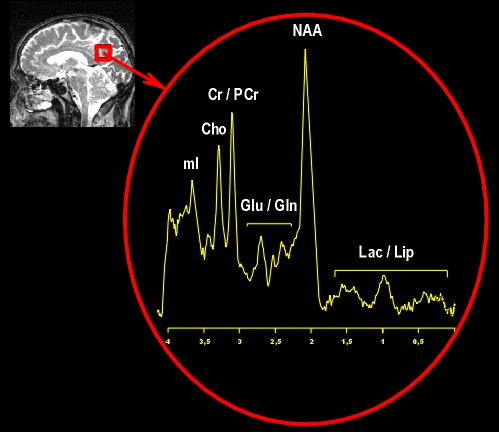
Figure III-2 : Exemple de spectre 1H du cerveau montrant les différents métabolites.
L’application clinique de l’ISRM en dehors du cadre de la recherche semble se développer lentement, notamment en raison de sa fiabilité inférieure à celle de la SRM monovoxel (le taux de rejet des examens est encore trop important) et de plus grandes difficultés techniques, dont particulièrement :
-la très grande sensibilité aux mouvements des patients,
-la meilleure homogénéité possible du champ magnétique,
-le traitement automatique fiable des données (256 spectres obtenus pour une matrice 16x16).
Des progrès peuvent être raisonnablement espérés dans ce domaine permettant dans quelques années l’obtention d’examens fiables et à haut taux de succès.
De multiples représentations différentes des données sont possibles. Elles peuvent être affichées selon une carte de distribution métabolique montrant l’intensité d’un métabolite particulier, spectre par spectre, par ratios de métabolites ou encore selon une combinaison de ces possibilités, en surimpression sur les images obtenues par IRM pour corréler les variations métaboliques et anatomiques. Cela permet d’identifier rapidement les régions de signal suspect.
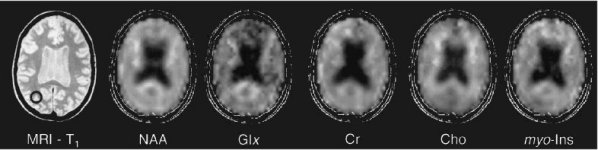
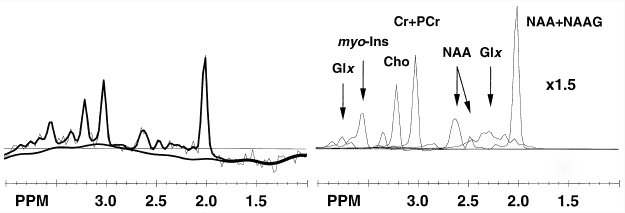
Figure III-3
: IRM (T1) ventriculaire et carte de plusieurs métabolites (ISRM
PRESS 1.5 T, spin écho, TE=25 ms),
Spectre du voxel entouré
avant et après adaptation de la ligne de base.
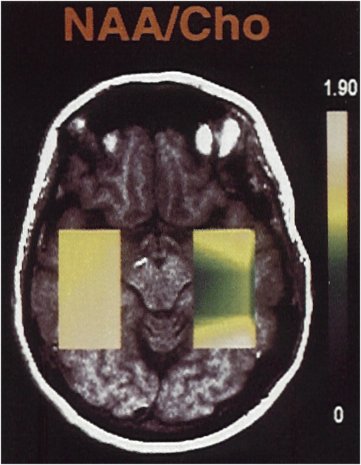
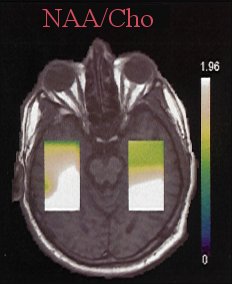
Figure III-4 : Association d’une IRM (T1) et de la carte métabolique correspondant au rapport NAA/Cho (CSI).
Le VOI (en SRM localisée) est en général un cube d’une dizaine de millilitres ou moins. Ce voxel d’où provient le signal enregistré est sélectionné en général par des combinaisons de gradients de champ magnétique et d’impulsions RF similaires à ceux utilisés en IRM. Le signal qui pourrait provenir de l’extérieur de ce cube est annulé, ce qui assure en fait une sélectivité anatomique tridimensionnelle de l’origine des métabolites. Ce volume peut être choisi dans n’importe quelle partie du corps, bien que les zones proches des structures osseuses ou d’hématomes soient plus difficiles à étudier. La localisation précise du VOI s’effectue à partir de l’IRM conventionnelle réalisée précédemment.
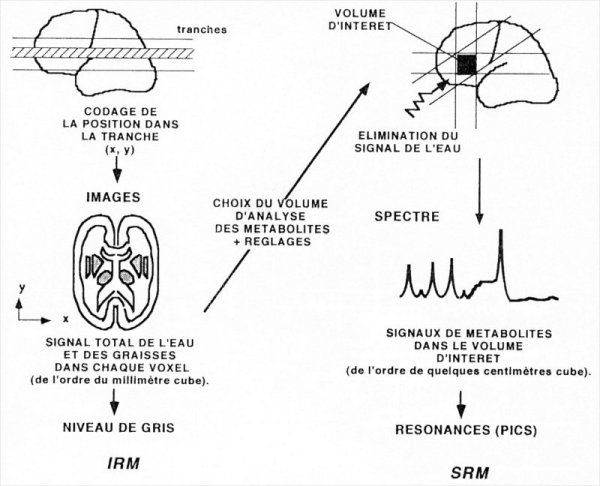
Figure III-5 : Procédure de spectrométrie intégrée à la suite de l’examen IRM.
Un examen par SRM du 1H comprend donc :
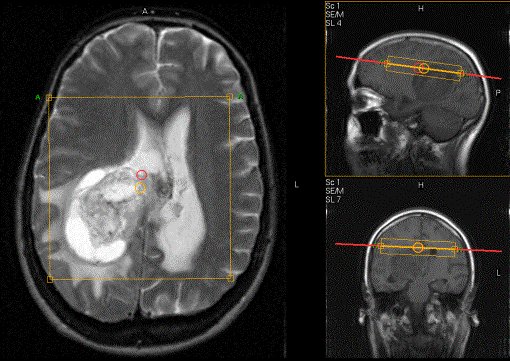
Figure III-6
: Localisation du VOI spectrométrique à partir d’une IRM.
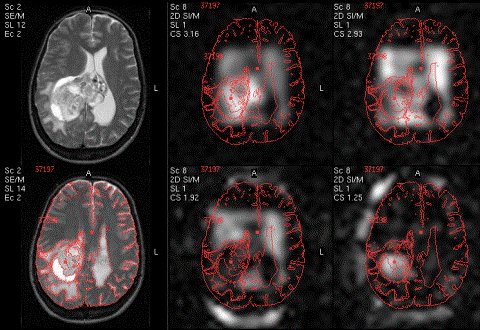
Figure III-7 : Carte de distribution métabolique. En haut : IRM, Cho, Cr. En bas : IRM, NAA, Lac.
Quelques points importants concernant l’acquisition d’un spectre par SRM dans des conditions cliniques doivent être soulignés [VION-DURY, 2000] :
-Le bon fonctionnement de l’imageur doit être vérifié, au moyen du fantôme spécifique à la SRM fourni par le constructeur (il contient quelques molécules comme l’acétate ou le lactate). Les spectres obtenus doivent être reproductibles et le signal des métabolites ne doit pas varier de manière significative d’un endroit à l’autre du fantôme. Il est souhaitable d’effectuer ces tests mensuellement dans les mêmes conditions, de manière à vérifier la stabilité de l’appareillage.
-Les protocoles doivent être maîtrisés et optimisés, c’est à dire les plus courts possible, pour éviter que le sujet ne s’impatiente et ne bouge.
-Il faut toujours adapter, autant que faire se peut, le VOI spectrométrique au volume et à la forme de la lésion à étudier. Il ne faut donc pas avoir une approche trop rigide ou systématique.
-L’excellente homogénéité de B0 dans le VOI est un élément déterminant de la qualité du spectre. On doit conserver à l’esprit que la présence de sang (dans les tumeurs par exemple) dégradera le spectre jusqu’à le rendre non interprétable. Il en est de même d’un voxel positionné à cheval sur une zone osseuse, ou bien trop proche d’une cavité aérienne. Si le patient a eu un EEG juste avant l’examen, il est également nécessaire de vérifier qu’il ne présente plus de pâte EEG (elle possède des propriétés magnétiques nocives pour l’homogénéité de B0).
-Il peut être recommandé de réaliser la spectrométrie avec une synchronisation cardiaque qui, même si elle peut être gênante en raison d’un TR variable, peut permettre de gagner entre 25 et 40% de signal dans certaines séquences STEAM [FELDBLINGER, 1998].
-Le nombre de spectres sommés doit être suffisant pour obtenir un RSB satisfaisant (128 sommations pour un volume de 8 ml sur les appareils actuels). Un faible RSB génère une incertitude importante sur les aires des pics (il doit être au moins égal à 3).
-Les
résonances de choline et créatine-phosphocréatine
doivent être clairement séparées (cf. Figure
III-8).
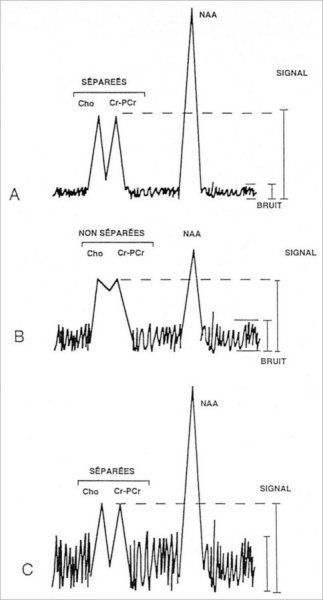 A
: Spectre théorique de qualité acceptable : les résonances
de la choline et de la créatine-phosphocréatine sont parfaitement
séparées. Le signal est très grand par rapport au
bruit (RSB élevé).
A
: Spectre théorique de qualité acceptable : les résonances
de la choline et de la créatine-phosphocréatine sont parfaitement
séparées. Le signal est très grand par rapport au
bruit (RSB élevé).
B : Mauvais réglage de l’homogénéité du champ magnétique local (ou présence de mouvements du patient pendant l’acquisition) : élargissement des résonances, coalescence des pics et baisse significative du RSB.
C : Insuffisance de signal (nombre d’accumulations insuffisant, structure trop petite…) ou excès de bruit (bruit électronique surajouté, parasites extérieurs…). Les pics sont séparés, mais le RSB est très mauvais.
Plusieurs opérations (avant application de la transformée de Fourier) sont de nature à améliorer le résultat final du traitement spectral : la procédure du "zero filling" tout d’abord, qui complète le signal en ajoutant à sa suite des points de valeur nulle. Ceci permet d’augmenter le nombre de points décrivant le signal et d’améliorer artificiellement la résolution. Ensuite, un filtrage Gaussien ou Lorentzien est appliqué pour réduire le bruit et augmenter le signal. Enfin, les constructeurs proposent souvent un programme de correction automatique des déphasages dus aux courants de Foucault générés par les gradients de champ magnétique ("eddy-currents"). Cette correction, qui est effectuée avant tout autre traitement du signal, est indispensable avant toute analyse spectrale.
Les résultats, pour
être pertinents, doivent être présentés en utilisant
les aires des pics de résonance et non leurs intensités [VION-DURY,
2000, 1999]. Certaines règles de quantification de l’aire métabolique
doivent être respectées, comme par exemple les pieds des résonances,
qui doivent se trouver sur la même ligne de base horizontale (passant
à mi-intensité du bruit) : c’est la correction de phase.
L’affichage correct des données (spectres, ratios, cartes métaboliques)
est ensuite effectué.
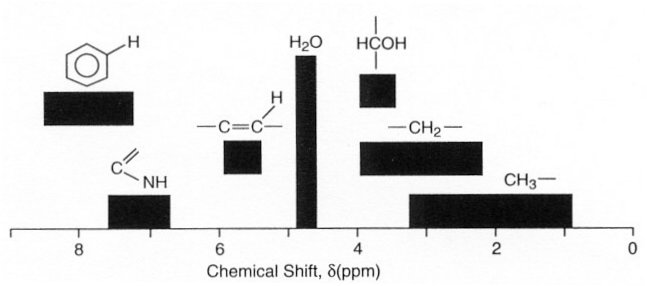
Figure III-9 : Groupes fonctionnels détectables par spectrométrie RMN.
La SRM fournit un moyen simple pour évaluer les caractéristiques biochimiques des cellules par l’analyse directe et non-invasive des métabolites. Une des plus grandes barrières à son utilisation clinique a été la fausse idée que seul un physicien puisse produire des spectres fiables. La spectrométrie peut être exécutée avec les mêmes équipement et personnel utilisés pour les examens courants d’IRM.
Les études qualitatives consistent en la production d’un spectre (un graphique) des métabolites à l’intérieur du voxel choisi du tissu, alors que les études quantitatives mesurent les niveaux (ou les rapports) réels des métabolites à l’intérieur du voxel choisi. La présentation des résultats peut se faire en rapports de métabolites ou en quantification absolue par rapport à une référence interne ou externe (la première solution est plus simple, accessible et rapide).
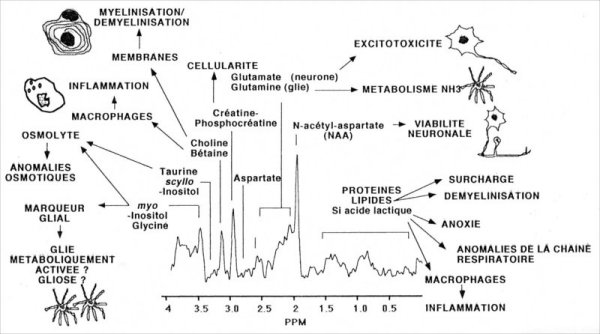
Au niveau cérébral, les métabolites les plus communs (les déplacements chimiques sont notés dans le Tableau III-1) situés dans les tissus sont les suivants [SALVAN, 1997] :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La présence des métabolites suivants est habituellement anormale au niveau du cerveau :
Par conséquent, il
convient de supprimer ou d’atténuer correctement ces signaux (pics
de résonance) afin de quantifier les métabolites.
Le ratio en concentration
de l’eau libre et des métabolites est très important
: 110 M par rapport à 10-3 M. Si l’on ne supprime pas
ce signal, le convertisseur analogique-numérique qui lit le signal
se réfère à la plus grande intensité de signal
reçue, ce qui a pour conséquence de faire totalement disparaître
les signaux des métabolites à observer. Deux méthodes
sont principalement utilisées : la séquence CHESS, qui est
la plus répandue, et la séquence PRESS.
Le deuxième
signal important du spectre protonique est donné par les groupes
méthylènes (CH2) des acides gras. Pour supprimer
ces pics, on utilise également les techniques CHESS et WEFT. Si
la première de ces techniques est déjà utilisée
pour supprimer le pic de l’eau libre, on utilisera la seconde et vice versa.
En ce qui concerne la séquence WEFT, le temps d’inversion, c’est-à-dire
le moment où l’on applique l’impulsion RF 90°, est calculé
de façon à correspondre à une aimantation longitudinale
des lipides nulle.
Il existe une multitude
de séquences plus ou moins récentes et efficaces, nous ne
développerons que les techniques les plus utilisées. Les
séquences simple-volume (SVS) permettent une évaluation d’un
voxel d’un tissu. Les techniques d’acquisition de signal multi-voxels (CSI)
permettent d’acquérir une large carte métabolique. Pour ces
deux méthodes, on joue sur la valeur du temps d’écho dans
le but d’observer plus ou moins de métabolites. Une technique à
temps d’écho court (18 à 34 ms) détecte plus de métabolites,
en particulier les métabolites ayant un T2 court (cf. Figure
IV-1), toutefois le réglage de l’appareil est alors plus
difficile. Les séquences à temps d’écho long (135
à 270 ms) sont plus souvent utilisées et détectent
les métabolites les plus mobiles.
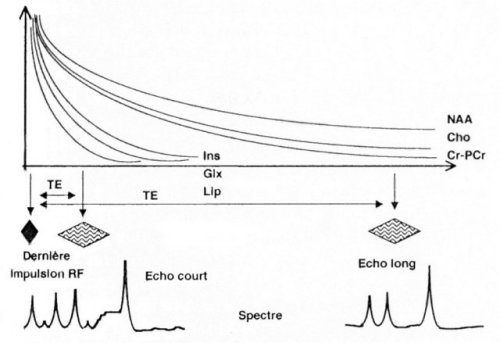
Figure IV-1 : Composition du spectre en fonction du temps d’écho TE (valeurs arbitraires).
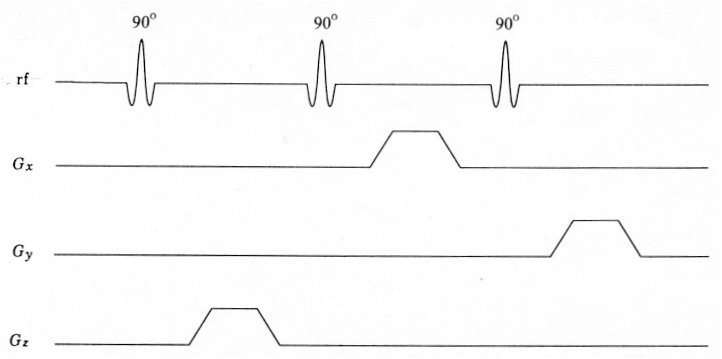
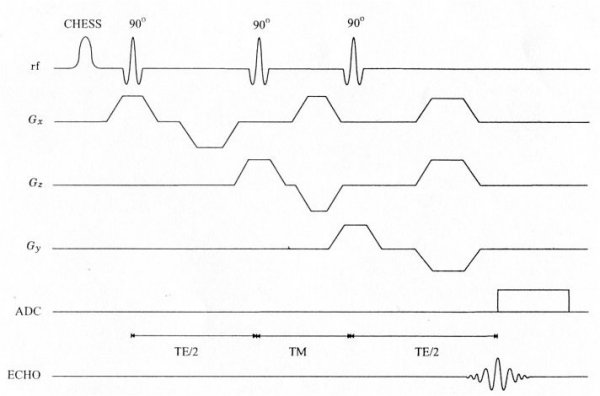
Le principe des techniques PRESS et STEAM est d’exciter le volume d’intérêt par trois impulsions sélectives et de recueillir le signal de ce volume. Toutefois, nous verrons plus loin que les caractéristiques de ces deux techniques sont différentes.
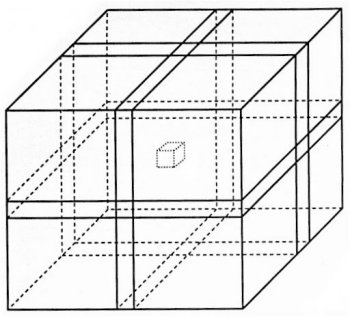
Figure IV-2 : Le volume d’intérêt (voxel) est défini par l’intersection de trois plans orthogonaux.
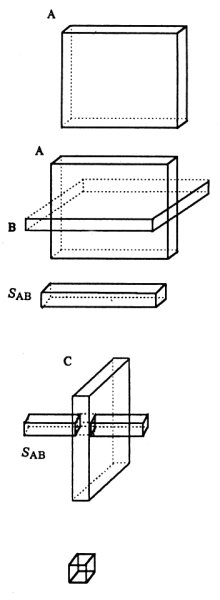 Coupe
A : Elle est sélectionnée avec une impulsion RF 90° et
un gradient selon x.
Coupe
A : Elle est sélectionnée avec une impulsion RF 90° et
un gradient selon x.
Coupe B : elle est sélectionnée avec une seconde impulsion RF 180° (90° pour STEAM) et un gradient selon z.
Volume SAB défini par l’intersection des coupes A et B. Les spins de ce volume subissent les 2 impulsions RF.
Coupe C : elle est sélectionnée par une troisième impulsion RF de 180° (90° pour STEAM) et un gradient selon y.
Volume défini par l’intersection des trois coupes orthogonales. Seuls les spins de ce volume subissent les 3 impulsions RF et contribuent au signal final.
Figure IV-3 : Principe des séquences simple voxel (excitation étape par étape d’un petit volume à l’aide de 3 impulsions RF sélectives PRESS).
La coupe A est sélectionnée grâce à l’application d’un gradient Gx et excitée par une impulsion RF 90°. Les spins de cette coupe produisent un signal FID qui n’est pas pris en compte. La coupe B est sélectionnée par l’application d’un gradient Gz et une impulsion RF 180° à TE1/2 après l’impulsion RF 90°. L’application de cette impulsion RF 180° a pour effet de rephaser les spins du pavé SAB (intersection des plans A et B). L’écho généré par ce pavé après excitation par l’impulsion RF 180° n’est pas non plus échantillonné.
La coupe C est sélectionnée par l’application d’un gradient Gy et une impulsion RF 180°. Seuls les spins appartenant au volume correspondant à l’intersection du plan de coupe C et du pavé SAB sont excités par les trois impulsions RF. C’est l’aimantation de ce volume qui produit l’écho final qui lui est échantillonné et exploité, il se forme à TE2/2 après la seconde impulsion RF. Le déroulement de cette séquence est visible sur le chronogramme de la Figure IV-4. En observant cette séquence, on peut noter que la séquence PRESS est une variante de l’écho de spin vu précédemment.
Points forts / points faibles :
La technique PRESS permet
d’obtenir un signal d’écho maximal (contrairement à STEAM)
: le gain de signal est multiplié par deux, et cette méthode
reste peu sensible au mouvement et au couplage homonucléaire. Cette
séquence est utilisée pour des temps d’échos longs
(supérieurs à 135 ms). En revanche, pour les temps d’échos
courts, cette séquence n’est pas adaptée du fait d’une trop
grande perte de signal.
Ceci a pour effet de générer un écho stimulé à partir du VOI. L’écho généré au temps TM résulte de la deuxième et troisième impulsion RF 90°, l’écho généré à TE/2 de la première et deuxième impulsion, l’écho généré à TE/2 + TM provient de la première et de la troisième impulsion et enfin, l’écho stimulé, généré à TE/2.
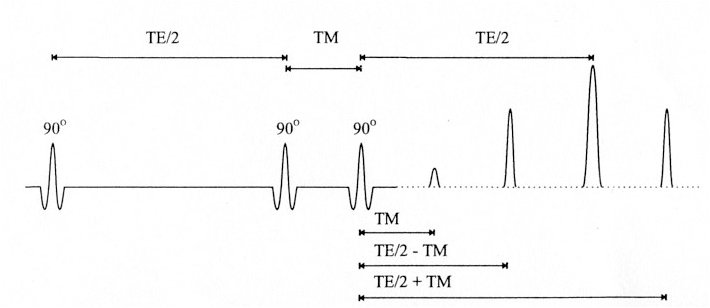
En pratique, pour trois impulsions 90° successives (voir Figure IV-5), on obtient en réalité quatre échos mais seul l’écho de plus forte amplitude est acquis. Les autres sont éliminés par l’application de « gradients de retard » (cf.Figure IV-6).

En raison de l’obtention d’un écho stimulé, l’amplitude du signal est réduite de moitié. Par contre, l’utilisation d’impulsions à 90° pour la sélection de coupe rend cette technique très robuste vis à vis des imperfections expérimentales, et permet l’acquisition de petits VOI pour des temps d’écho très courts.
Points fort / points faibles :
La séquence STEAM se révèle plus efficace pour des métabolites ayant un T2 court car des temps d’écho courts (temps de recueil du signal) peuvent être employés. D’autre part, la suppression du pic de l’eau libre est également plus efficace car les impulsions CHESS peuvent être placées au sein de la séquence et non pas seulement au début (pendant TM), sans dégrader le temps d’écho. L’intensité du signal recueilli pour des temps d’écho courts est donc plus importante.
En revanche, l’intensité du signal est divisée par deux, les métabolites dont le signal est faible sont de fait inobservables. De plus, cette méthode est relativement sensible aux mouvements et au couplage homonucléaire par rapport à PRESS.
Les techniques simple-voxel (SVS) sont en conclusion couramment utilisées dans bon nombre d’applications cliniques. Elles produisent un spectre d’un volume localisé dans un tissu (voir Figure IV-7) en une mesure. La durée de cette mesure varie entre 2 et 6 minutes selon le volume, la séquence et les paramètres choisis. Dans le cas où N volumes ont à être examinés, il est nécessaire de répéter la mesure N fois.
Figure IV-7
: A) IRM (pondérée T1) montrant la région rétro-orbitale,
B) Spectre SRM
(STEAM, TE=135 ms, TR=1600 ms) 1H du VOI indiqué en A.
Malgré le fait que la technologie actuelle permette un temps de mesure acceptable, les techniques simple voxel sont moins efficaces que les techniques multivoxels qui permettent d’acquérir 32´32 spectres en une séquence. Toutefois, la spectrométrie simple voxel gagne aujourd’hui en popularité de par sa simplicité de mise en œuvre et de l’accès immédiat à l’interprétation du spectre d’un petit volume de tissu. Grâce à ces caractéristiques, certains centres la réalise en routine pour certaines pathologies cérébrales notamment.
Remarque : Une autre séquence
simple voxel peut-être utilisée : la technique ISIS (Image
Selected In vivo Spectroscopy). Cette technique consiste en une
préparation de l’aimantation M0 à l’aide de trois
impulsions RF 180° (en présence de gradients) puis une lecture
par une simple impulsion RF 90°. Nous ne développerons pas cette
méthode car elle est surtout utilisée en spectrométrie
RMN du phosphore 31 (détection de signaux FID à décroissance
rapide).
Les techniques CSI 1D, 2D et 3D génèrent donc des spectres localisés respectivement dans des coupes, des colonnes et des voxels. En ce qui concerne les applications cliniques, CSI 1D et 2D sont associées avec d’autres méthodes, comme des impulsions de sélection de coupe, qui localisent le volume d’intérêt dans la ou les dimensions qui ne sont pas codées en phase.
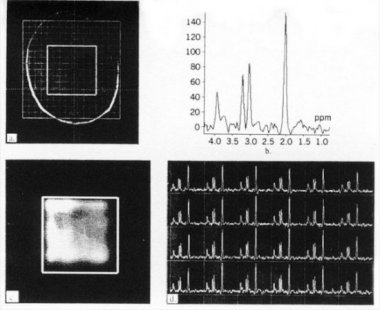
Figure IV-8
: a) Grille CSI 2D dans le plan transversal. b) Spectre RMN du voxel
central de l’image.
c) Carte de distribution
du NAA pour un sujet sain. d) Carte spectrale regroupant 24 spectres RMN.
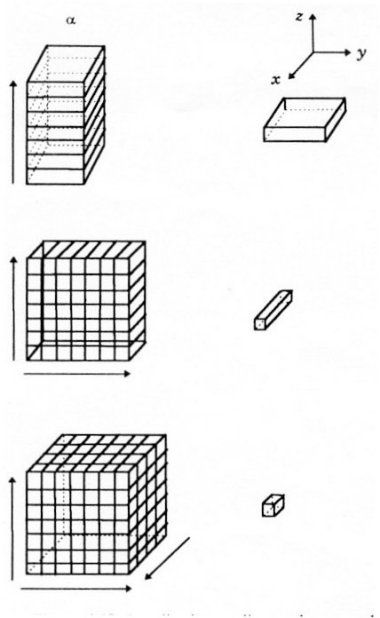
Par exemple, dans la technique CSI 1D, une colonne de tissu est définie par des impulsions RF sélectives selon deux dimensions et « coupée » par un gradient de codage de phase selon la troisième dimension. En revanche, pour la technique CSI 2D, une coupe de tissu est définie avec une impulsion RF sélective selon une dimension et « coupée en cubes » avec deux gradients de codage de phase selon les deux autres dimensions (voir Figure IV-9).
 CSI
1D
CSI
1D
Codage de phase selon une dimension (z).
Les spectres proviennent des coupes perpendiculaires à la direction z.
CSI 2D
Codage de phase selon 2 dimensions (y et z).
Les spectres proviennent de petites colonnes parallèles à la direction x.
CSI 3D
Codage de phase selon les 3 dimensions.
Les spectres proviennent des voxels.
Figure IV-9 : Localisation des coupes, colonnes et voxels pour les techniques CSI 1D, 2D et 3D.
La séquence « volume-selective » CSI 2D, permet d’exciter sélectivement les spins contenus dans un volume défini et d’exclure les spins environnants.
Le principe de cette technique est le même que pour les techniques spectrométriques simple-voxel à la différence que la taille du volume défini est plus grande. La séquence volume-selective CSI 2D est créée en ajoutant à une séquence PRESS ou STEAM (simple voxel) deux gradients de codage de phase (voir Figure IV-10). Dans ce cas, le codage de phase est réalisé selon les axes x et y (les trois impulsions étant RF sélectives). Le gradient z possède un amplitude plus élevée de manière à sélectionner une coupe fine (1.5 à 2 cm). Les gradients x et y ont une amplitude plus faible ; les largeur et longueur de la coupe ainsi induites seront plus importantes (8 cm × 9 cm). Des temps d’écho de 40 à 270 ms sont obtenus avec PRESS et de 18 à 34 ms avec STEAM.
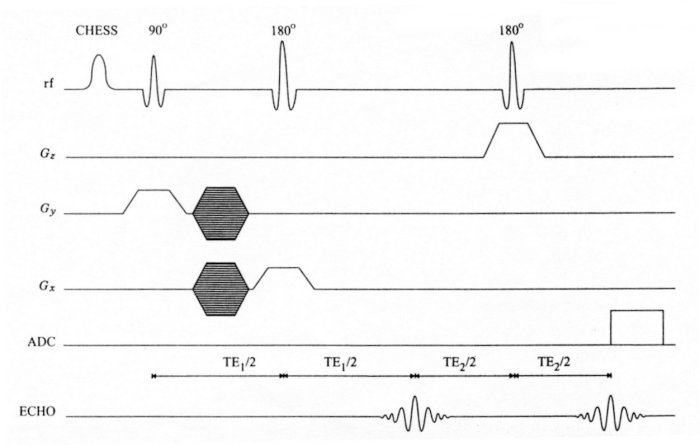
Figure IV-10 : Chronogramme de la technique « volume selective » CSI 2D (séquence basée sur PRESS).
Points forts / points faibles :
Les séquences à long TE (utilisant PRESS) permettent d’acquérir des spectres avec une ligne de base stable et donc une meilleure quantification des pics résolus. En revanche, elles ne permettent pas l’observation de métabolites ayant un T2 court. Les séquences à court TE (utilisant STEAM) permettent l’observation de métabolites ayant un T2 court. En revanche, elles ne permettent pas d’acquérir des spectres avec une ligne de base stable et rendent la quantification des pics résolus difficile.
D’un point de vue général, un inconvénient majeur de la technique volume-selective CSI 2D réside dans le fait d’être contraint à répéter la mesure lorsque plusieurs coupes de tissu sont nécessaires pour un diagnostic. Ceci prolonge le temps d’examen d’un facteur égal au nombre total de coupes acquises.
·Multiple Slice CSI
Certaines pathologies s’étendent sur un volume plus grand que celui délimité par la technique CSI 2D et exigent l’utilisation d’une technique CSI multicoupe. Elle est basée sur une séquence standard écho de spin (une impulsion RF 90° suivie d’une ou plusieurs impulsions RF 180°) modifiée pour intégrer des impulsions CHESS (pour la suppression du signal de l’eau libre) et une saturation du volume environnant (pour la suppression du signal des lipides).
Une autre variante de cette technique emploie une séquence écho de gradient à la place d’un écho de spin permettant ainsi la détection des métabolites ayant un T2 court. La méthode de saturation du volume environnant visant toujours à la suppression du signal des lipides sous-cutanés.
·Fast CSI
La technique CSI rapide est la plus récente innovation des techniques d’imagerie spectrométrique. Elle permet de réduire le temps d’acquisition de deux tiers : 10 à 14 minutes pour acquérir une ISRM avec un large VOI (32x32) au lieu d’une demi-heure. Cette technique est issue de concepts relatifs au codage spatial pendant l’échantillonnage de l’écho de résonance magnétique [POHMANN, 1997 ; DUYN, 1993]. La différence majeure avec une séquence CSI 2D conventionnelle est le codage de phase, réalisé uniquement selon l’axe x. Le codage selon l’axe y est arrêté pendant l’échantillonnage et assuré par l’application de gradients bipolaires. Un gradient Gz est appliqué à chaque impulsion sélective pour sélectionner la coupe désirée (voir Figure IV-11).
De plus, le signal de l’eau libre est supprimé à l’aide d’impulsions CHESS situées au début et pendant la séquence (juste avant la deuxième impulsion sélective RF 180°). Ceci augmente l’efficacité de la suppression du signal de l’eau libre (meilleure saturation). Le signal des lipides, quant à lui, est supprimé en saturant le volume environnant de la même manière que pour la technique multislice CSI 2D. Cette séquence permet d’obtenir une coupe CSI 2D avec une résolution de 0.4 à 2 cm3 en un temps variant de 1 à 6 minutes.
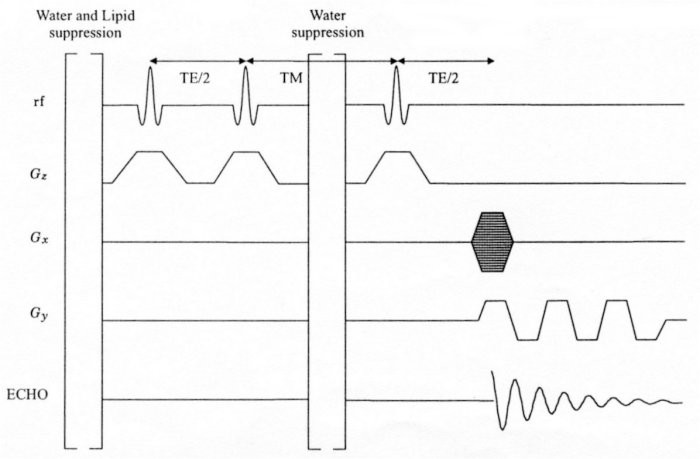
Figure IV-11 : Chronogramme d’une séquence CSI rapide (basée sur STEAM), avec suppression des signaux de l’eau libre et des lipides.
Points forts / points faibles :
Les techniques CSI rapides ont prouvé leur efficacité et sont utilisées en spectrométrie clinique de routine dans certains centres. Un des intérêts majeurs de cette technique est de permettre à l’utilisateur de pouvoir ajuster la position du volume d’intérêt en déplaçant une grille CSI (de la même manière que le Field Of View (FOV) en IRM). Leur durée est en plus acceptable au regard des données diagnostiques qu’elles peuvent apporter au clinicien (voir § V).
Cependant, il subsiste un
certain nombre de problèmes techniques. La suppression du signal
de l’eau libre n’est pas toujours réalisée correctement,
ce qui perturbe le spectre mesuré. De plus, du fait des techniques
de reconstruction de l’image utilisées (Pointspread Function), le
spectre de chaque voxel contient une partie de l’information contenue dans
les voxels voisins. Ces phénomènes doivent donc être
pris en compte au niveau de l’interprétation clinique.
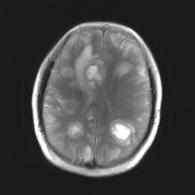
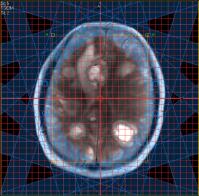
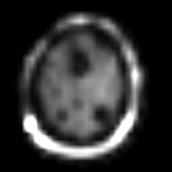
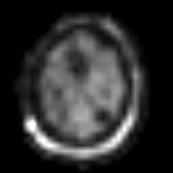
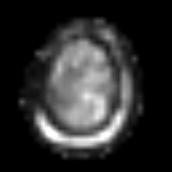
Figure IV-12
: Métastases d’un mélanome. En haut : IRM et préparation
de la grille CSI,
En bas : carte de distribution
NAA, Cr et Cho (SENSE-SI).
Le codage de la sensibilité forme un complément de valeur au codage du gradient. Il permet une réduction considérable du temps d’analyse en respectant l’imagerie standard de Fourier. La faisabilité de l’imagerie SENSE a été démontrée in vitro et in vivo. En termes d’utilité pratique, la caractéristique la plus pertinente de la technique est sa flexibilité. Indépendamment de l’antenne et de la géométrie de coupe, des images sans artefact spécifique sont obtenues.
Il a été montré que le RSB dans les images SENSE est gouverné par une limitation fondamentale caractérisée par la racine carrée du temps d’acquisition. Donc la méthode est appropriée seulement quand la nécessité d’un temps de scan rapide l’emporte sur le RSB.
Le potentiel de cette méthode
pour réduire radicalement le temps d’analyse par un facteur de 10
voire est envisagé (les premières expérimentations
ont commencé). Un RSB de base peut être amélioré
jusqu’à un certain point en augmentant le nombre d’antennes réceptrices.
Les premiers rapports
sur les applications cliniques de la SRM sur le cerveau humain sont apparues
en 1986, d’abord avec la spectrométrie localisée (SVS) puis
quelques années plus tard avec l’ISRM.
Une des études les plus étendues [SHONK, 1995] en ce qui concerne l’échantillon de patients, a porté sur 114 personnes atteintes de démence:
-65 d’entre elles atteintes probablement par la maladie,
-10 patients ayant une démence du lobe frontal (maladie de Pick),
-et 39 autres patients étant atteints d’autres types de démences (Pseudo-
démences, maladies de Parkinson…).
Le volume d’intérêt était situé dans la région occipitale médiane. Les concentrations de certains métabolites ont été mesurées. Cependant, aucune de ces mesures n’a donné d’informations pour différencier les démences causées par la maladie d’Alzheimer et les démences du lobe frontal [CHRISTIANSEN, 1995]. En effet, pour les patients atteints de ces deux pathologies, on observe aussi bien une diminution de la concentration en NAA qu’une augmentation de la concentration en myo-inositol par rapport à des sujets âgés sains. En ce qui concerne les autres démences, la différenciation n’est pas meilleure.
Dans d’autres études [MACKAY, 1996 ; CONSTANS, 1995 ; MEYERHOF, 1995], le nombre de patients variait entre 8 et 14 dont les résultats étaient également comparés avec des sujets de contrôle sains. Ces études ont mis en évidence une diminution du rapport NAA/Créatine (de 10 à 20%) dans les substances blanche et grise au sein des 9 VOI choisis. De plus, les patients atteints de la maladie d’Alzheimer avaient un rapport Choline/Créatine plus faible en particulier dans la substance grise. Aucune observation n’a été décrite quant au myo-inositol car ce métabolite n’était pas visible, ayant un T2 court comparé au temps d’écho. Toutefois, comme pour la première étude, les niveaux de chacun des rapports de concentration des métabolites se sont révélés incapables d’identifier significativement la maladie parmi d’autres types de démences.
Une des caractéristiques cliniques de beaucoup de syndromes démentiels est une perte de neurones. Le N-acétylaspartate est un métabolite, nous l’avons vu plus haut, présent uniquement dans le cerveau mature (substance grise).
Par conséquent, une perte de neurones doit logiquement engendrer une concentration en NAA diminuée s’il existe une relation linéaire entre le nombre de neurones présents dans le tissu cérébral observé et cette concentration [CHENG, 1997].
La diminution en concentration de NAA a été observée effectivement dans la majorité des papiers parus depuis 1993 [JACKSON, 1996] (voir Tableau V-1), mais cette observation ne peut malheureusement être considérée comme un caractère diagnostic discriminant. En effet, cette diminution de concentration est caractéristique de la majorité des syndromes démentiels.
L’augmentation du signal du myo-inositol a été confirmé. En effet, des corrélations ont été mises en évidence, entre la baisse du score cognitif et l’augmentation de la concentration de ce métabolite (voir Figure V-1).
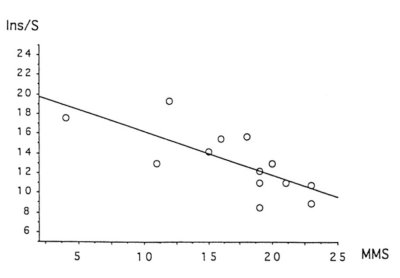
Figure V-1 : Corrélation entre la baisse du score cognitif et l’augmentation du signal de l’inositol.
La sensibilité diagnostique de la SRM dans la maladie d’Alzheimer est de l’ordre de 83%. La fiabilité des méthodes employées est également en faveur d’un transfert potentiel clinique rapide (93%). L’ensemble de ces résultats s’avère prometteur quant à un futur transfert clinique de la SRM dans les démences. Toutefois, il manque, dans ce domaine, une standardisation plus avancée des procédures et une stratégie d’exploration par SRM tenant plus compte de l’évolution topographique au cours du temps.
|
|
(ms) |
(ms) |
|
|
|
|
|
|
|
|
Augmentation du rapport Cho/Cr |
|
|
|
|
|
|
Augmentation du rapport mI/Cr |
|
|
|
|
|
|
Augmentation en mI |
|
|
|
|
|
|
Augmentation en mI |
|
|
|
|
|
|
|
|
|
|
|
|
culaire |
|
|
|
|
|
|
culaire |
|
|
|
|
|
|
culaire |
|
|
|
|
|
|
culaire |
|
|
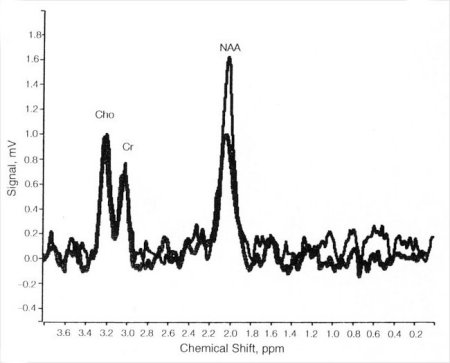
Figure V-2 : Spectre d’une épilepsie (NAA æ) par rapport à un témoin.
Le rapport NAA/Cr est, quant à lui, abaissé. L’activation intense de la glycolyse anaérobie dans le foyer après un état de mal explique la présence de lactate sur le spectre [NG, 1994]. Différents auteurs ont noté de fréquentes altérations métaboliques bilatérales (entre 40 et 50%), le côté où se situe le foyer étant celui qui présente le plus grand nombre d’anomalies métaboliques [ENDE, 1997]. Apparemment, le rapport NAA/(Cr+Cho) serait le plus sensible pour détecter le foyer épileptique en l’absence des résultats de l’électroencéphalogramme.
Les anomalies métaboliques mises en évidence par la SRM sont souvent observées sur des lobes temporaux à l’IRM. Le taux de succès de la SRM, évalué entre 70 et 100% selon les auteurs et les protocoles, est en général supérieur à celui de l’IRM seule et à celui des méthodes utilisant les traceurs radioactifs [LEBAS, 1998 ; KUZNIECKY, 1997].
En ce qui concerne les épilepsies
généralisées primaires, chez l’adulte et chez l’enfant,
peu de travaux ont été conduits pour caractériser
le foyer épileptique sur le plan métabolique.
Comme le pronostic est directement apparenté avec le classement histologique de la tumeur, le prélèvement tissulaire direct est souvent utilisé. Malheureusement, une résection ou de multiples biopsies sont nécessaires pour établir sérieusement le degré de malignité. Une simple biopsie ne peut pas refléter entièrement le grade d’un lésion et les techniques moins invasives ne fournissent que des informations limitées.
La SRM permet d’accroître la spécificité des tissus et de distinguer aisément le tissu cérébral normal par rapport aux astrocytomes.
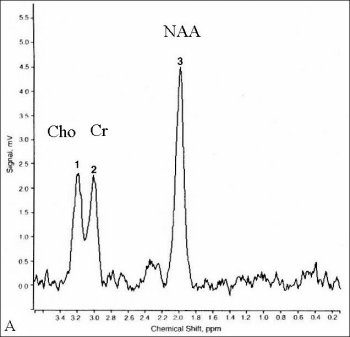
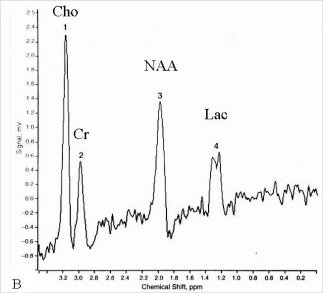
Figure V-3 : SRM 1H simple-voxel (PRESS, TE = 272 ms). A : Spectre cérébral normal. B : astrocytome de niveau IV : augmentation de Cho, baisse de NAA, présence d’un double pic de lactate.
Une concentration de choline élevée reflète un turn-over cellulaire et un métabolisme membranaire actifs. Le niveau de Cho cependant ne peut pas être directement corrélé avec l’activité cellulaire, car il est élevé à la fois dans les astrocytomes qui croissent rapidement, mais aussi dans certaines tumeurs à croissance faible, comme les méningiomes. Une augmentation de Cho apparaît aussi dans le cerveau en développement, dans de multiples scléroses, et dans l’encéphalite allergique. Le niveau de NAA est faible, ce qui reflète probablement une diminution de la population de neurones normaux et de leur métabolisme, étant infiltrés par des cellules tumorales. Le lactate reflète généralement une nécrose et par conséquent un plus haut degré de malignité.
Après un traitement par radiothérapie, la nécrose due à la radiation survient généralement dans les deux premières années suivant le traitement. Mais c’est aussi la période de temps pendant laquelle la plupart des récidives apparaissent. L’apparence sous scanner X et IRM de la nécrose radiative peut être identique à celle de la tumeur, car toutes deux montrent une amélioration du contraste. Comme le pronostic de ces lésions diffère, la méthode non-invasive de diagnostic par SRM permet d’observer les dégâts tissulaires de la radiation, avant même qu’ils ne soient visibles par IRM. La nécrose radiative démontre nettement un abaissement des niveaux de NAA, Cho et Cr, qui vont de pair avec la mort tissulaire. De plus, la radiothérapie induit un large pic caractéristique (localisé entre 0 et 2 ppm), qui est probablement une combinaison de lipides mobiles et d’acides aminés produits par la destruction du tissu, et de lactate par ischémie et nécrose. La technique spectrométrique peut, dans les faits, déterminer la réponse d’un néoplasme dans un délai de deux semaines après un traitement initial par radiothérapie ou chimiothérapie. Alors qu’avec les examens courants d’IRM la détermination de la réponse d’une tumeur à un traitement peut prendre 3 à 6 mois, la SRM peut déterminer si la tumeur résiduelle est inactive (en rémission) ou bien en activité.
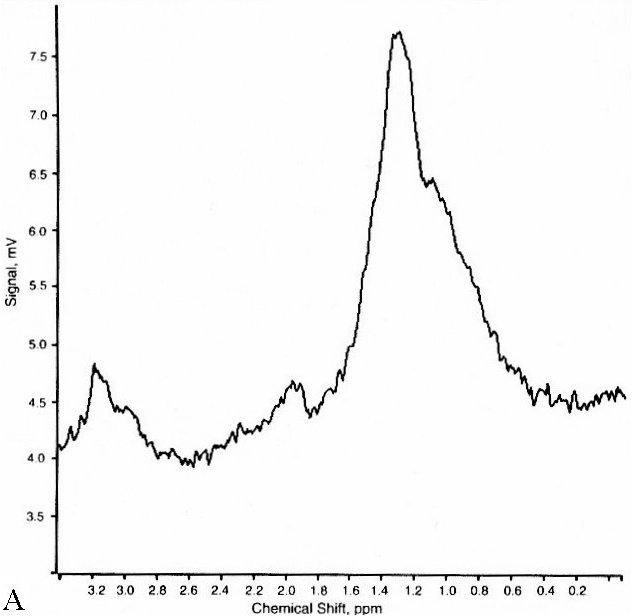
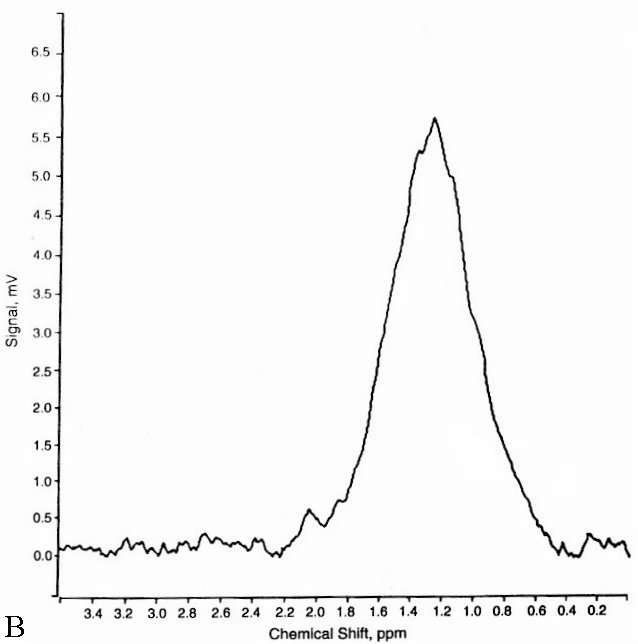
Figure V-4 : SRM simple-voxel (PRESS, TE = 272 ms). A : Spectre d’un astrocytome après irradiation (pic de Cho à 3.2 ppm => tumeur résiduelle). B : Nécrose radiative (plus de tumeur).
Chez l’enfant, puisqu’elle est plus sensible que l’IRM en démontrant un retard de développement du cerveau, la SRM est utile pour suivre la maturation normale du cerveau, et elle peut être employée de concert avec l’examen d’IRM pour suivre le processus de myélinisation. La SRM peut également caractériser une masse cérébrale singulière discernée sur l’IRM comme un néoplasme (tumeur), et elle a donc été employée intensivement en évaluation dans ces conditions [BYRD, 1998].
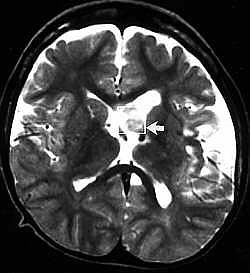
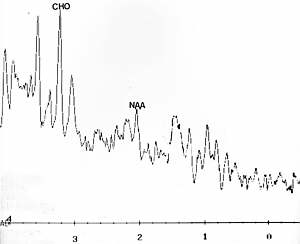
Figure V-5
: A) IRM (T2) : enfant avec sclérose (masse en excès au niveau
du ventricule latéral gauche),
B) SRM (STEAM)
: même enfant avec baisse de NAA et augmentation de Cho, ce qui indique
la masse dans le néoplasme.
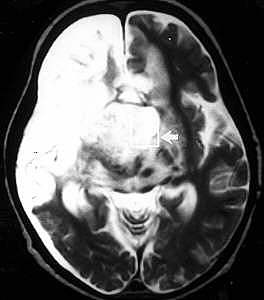
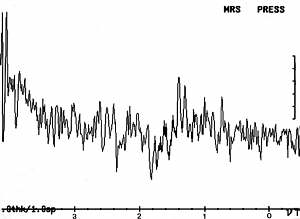
Figure V-6
: A) IRM (pondéré T2) : enfant avec néoplasme traité
par chirurgie, radio- et chimiothérapie.
B) SRM (PRESS)
: spectre du même enfant sans métabolite, indiquant une nécrose
sans néoplasme résiduel.
Les enfants qui présentent un dysfonctionnement évident du cerveau tels que des troubles de la parole et du langage, des détériorations intellectuelle ou motrice, un retard mental, des troubles psychiatriques, ou des troubles d’attention passent généralement des examens standards d’IRM. Mais la SRM peut également être employée pour aider à diagnostiquer un fonctionnement anormal du cerveau et à suivre des troubles cérébraux métabolique et neurodégénérescent. Elle peut aussi aider à diagnostiquer et suivre l’ampleur des dommages cérébraux dans l’asphyxie périnatale (encéphalopathie hypoxique-ischémique) [ROSS, 1994 ; IZIKA, 1993].
La SRM permet également la détection de lymphomes cérébraux primaires, tumeurs présentes chez les personnes âgées, les individus immunodéficients ou atteints du virus du SIDA. Les lymphomes sont caractérisés par l’élévation de Cho et des lipides, et la réduction significative de Cr et NAA.
En conclusion, l’identification
et l’analyse de six métabolites (NAA, Cho, Cr, Ala, Lac et les lipides)
permet d’atteindre 91% de précision dans la classification des astrocytomes,
méningiomes et tissus épileptogènes non tumoraux.
Les astrocytomes peuvent être classifiés en faible et haut
niveau avec une précision supérieure à 95%, contre
57% en n’utilisant que les données IRM. L’apport clinique de la
SRM (supérieur à l’IRM) est la séparation entre une
radionécrose et une récidive tumorale, ainsi que la différenciation
entre un abcès cérébral et une tumeur gliale.
De nombreuses études ont paru portant sur la sclérose en plaques mais il paraît difficile de tirer une séméiologie métabolique précise de cette pathologie en raison de la taille des échantillons de patients explorés (inférieurs à 15 la plupart du temps). Toutefois, la SRM permet la détection de la signature métabolique des lésions élémentaires de cette pathologie : inflammation (choline, lactate), démyélinisation (choline, lipides), et souffrance axonale (NAA).
Il est possible de différencier grâce à la SRM du proton des lésions à caractère chronique. La présence de lipides sur le spectre provenant d’une lésion de SEP est en faveur du caractère récent de la lésion. La souffrance axonale retrouvée au cours de la sclérose en plaques est objectivée par la baisse de concentration du NAA qui apparaît comme un témoin de la gravité de la maladie à un moment donné, et souligne la relation entre l’importance du dysfonctionnement voire de la perte axonale et la gravité du déficit clinique dans la SEP [KUZNIECKY, 1997].
La baisse de la concentration en NAA est plus importante dans les lésions au cours des formes bénignes, corrélée au score Expanded Disability Status Scale et au volume lésionnel [NARAYAMA, 1998 ; DAVIE, 1997]. La concentration en NAA évolue au même rythme que les formes progressives et se normalise en dehors des épisodes aigus dans les formes rémitentes et dans l’amélioration clinique. Cependant, la baisse du signal du NAA ne semble pas posséder une signification univoque puisque dans les lésions à caractère aigu, elle correspondrait à une souffrance axonale due à l’œdème et à l’inflammation alors que, dans les lésions chroniques, elle serait plus en relation avec une perte axonale [ARNOLD, 1994].
Même si aucun profil métabolique n’est spécifique de la pathologie (quant à la quantification des anomalies métaboliques des lésions et à l’évaluation du caractère aigu ou chronique), la SRM constitue par rapport à l’IRM conventionnelle un outil plus sensible dans l’évaluation de la progression de la maladie.
Le Tableau V-2 regroupe les
différentes variations des métabolites (la signification
des abréviations est donnée dans le Tableau III-1, page 29)
en fonction de plusieurs états pathologiques cérébraux
[SALIBI, 1998 ; VION-DURY, 1998].
|
|
|
| Stroke |
|
|
Tumeurs gliales
|
|
|
Méningiome
|
|
|
Nécrose
|
|
|
VIH et maladies apparentées
|
|
|
Sclérose en plaque
|
|
|
Maladie d’Alzheimer
|
|
|
Epilepsie
|
|
|
Encéphalopathie hépatique
|
|
|
Hypoxie
|
|
|
Anoxie
|
|
|
Abcès cérébral
|
|
Après une technique
thérapeutique (hormonale, cryochirurgie, radiothérapie),
la prostate diminue significativement en taille et dans la plupart des
cas la distinction des zones anatomiques normale et pathologique (sur les
images IRM pondérées T2) est perdue. Une solution est de
combiner l’information anatomique fournie par l’image RM et métabolique
(discrimination tissulaire). La spectrométrie RM étend l’évaluation
diagnostique au delà de l’information anatomique fournie par l’imagerie
RM à travers la détection des métabolites cellulaires.
Les récents développements et l’utilisation d’antennes endorectales
de surface ont fourni la sensibilité nécessaire pour acquérir
des données spectrométriques [KURHANEWICZ, 2000].
Les premières études ont utilisé la spectrométrie du 31P, mais sa relativement faible sensibilité a limité son utilisation : seuls un spectre grossier et une résolution spatiale moyenne ont été atteints. La plus grande sensibilité de la SRM du 1H avec suppression du signal de l’eau et des lipides permet l’acquisition de spectres de suffisamment petits volumes (~ 1 ml) en un ordre de temps raisonnable cliniquement (~ 15 minutes).
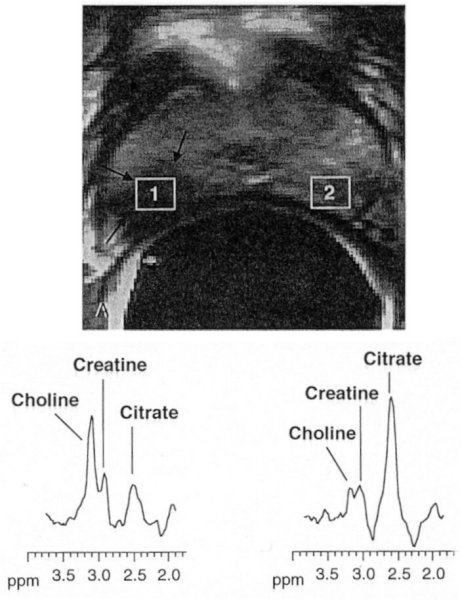
Figure V-7 : Cancer de la prostate d’un homme de 58 ans. IRM (Fast SE, pondéré T2) par antenne endorectale. La tumeur est située en (1). A gauche, le spectre par SRM de la zone anormale (citrate æ, choline ä). A droite, spectre d’une zone périphérique normale (citrate dominant, pas d’élévation de choline).
On observe dans les régions cancéreuses deux différences significatives dans les niveaux métaboliques : une augmentation significative des niveaux de choline de la prostate par rapport à la zone périphérique normale, et une diminution significative des niveaux de citrate. Ces changements métaboliques avec le cancer sont retrouvés dans les deux techniques spectrométriques, mais ces variations sont plus dramatiques en imagerie spectrométrique.
Initialement, la SRM (1H) a utilisé les techniques de localisation STEAM et PRESS pour acquérir des spectres de zones de la prostate qui apparaissent normale ou anormale sur des images RM pondérées en T2. Ces techniques simple-voxel permettent de diagnostiquer un cancer de la prostate (dans les régions cancéreuses le taux de citrate est réduit et celui de choline est augmenté). Bien que la SRM simple-voxel soit capable de fournir des informations métaboliques depuis une simple zone de la prostate, elle ne peut pas fournir d’information sur l’ampleur et l’hétérogénéité du cancer de la prostate et par conséquent elle nécessite d’autres informations à propos de la localisation de la tumeur.
Un examen clinique demande pour être développé :
-une localisation spectrale précise des régions souvent petites de la morphologie anormale,
-une corrélation précise avec les images haute-résolution RM,
-une méthode pour estimer l’étendue spatiale du métabolisme anormal,
-une couverture de la glande entière.
La technique CSI (codage de phase en 3D) est ainsi utilisée. On sélectionne par PRESS ou STEAM le volume concerné. Par la suite, un codage tridimensionnel de la phase est appliqué, ce qui produit des séries de spectres contigus de toute la prostate. En plus de produire des spectres de plus d’une région (voir Figure V-8), la CSI 3D a l’avantage que les conditions expérimentales stipulent uniquement la taille du voxel individuel. La position spatiale du spectre peut être sélectionnée rétrospectivement via un déplacement de voxel. L’acquisition multivoxel ne nécessite pas de connaître la localisation exacte du cancer, elle peut fournir des informations sur l’ampleur spatiale et l’hétérogénéité du cancer. Avec l’évolution de l’ISRM, on peut acquérir des spectres 1H en haute résolution (0.24 cm3) de la prostate entière en un temps raisonnable du point de vue clinique (8.5 à 17 minutes). L’examen d’ISRM peut être ajouté après une IRM, et les données métaboliques peuvent alors être superposées aux images anatomiques correspondantes (cf. Figure V-9).
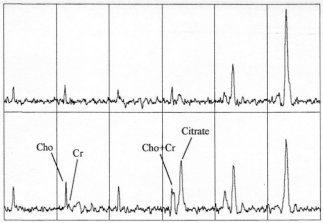
Figure V-8 : Spectres 0.24 cm3 d’une région de la prostate. (Cho ä + Citr æ = K).
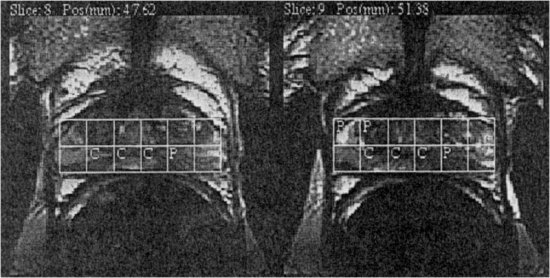
Figure V-9
: Association de données anatomiques et métaboliques. cc/c
= (creatine+choline)/citrate.
C = ratio cc/c > 3 s
des valeurs normales, P = cc/c > 2 s).
La comparaison des signaux
du muscle squelettique et de la graisse a révélé qu’il
existait deux compartiments dans le tissu musculaire. Certains auteurs
ont suggéré la comparaison relative des pics de l’eau et
de la graisse pour évaluer une pathologie musculaire [SALIBI, 1998].
Plus récemment, l’imagerie spectrométrique a quantifié
la créatine totale dans un muscle du mollet chez l’homme et permettra,
à l’avenir, une meilleure compréhension de son métabolisme
et une évaluation de la réponse d’une thérapie utilisant
ce composé [VION-DURY, 1999].
En ce qui concerne les pathologies
chroniques, l’analyse du métabolisme chez les patients avec sténose
unilatérale de la carotide, montre une augmentation de choline dans
les zones non infarcies, du côté de la sténose, et
la présence de lactate chez un tiers des patients.
Des voies de recherche sont abordées par l’étude en spectrométrie de la prématurité et de l’asphyxie à la naissance, dans d’autres maladies psychologiques, dans la réactivité vasculaire cérébrale (importance du lactate en tant que métabolite cérébral vasodilatateur [MIHARA, 2000]) et dans le domaine de l’angiographie.
Une nouvelle technique
diagnostique, lorsqu’elle apparaît, requiert une validation dans
de nombreux sites ainsi que la démonstration de son utilité
par rapport à des problèmes diagnostiques que d’autres méthodes
ne résolvent pas, pour un coût financier acceptable.
La complexité de la validation pour la SRM tient cependant en plusieurs points :
-La diversité des machines, des séquences, des constructeurs et des procédures en fonction des constructeurs, des sites et de l’expérience des opérateurs.
-L’absence de culture antérieure aux années 1990 en ce qui concerne à la fois la neurochimie et les modifications des taux et des caractéristiques physico-chimiques de chacun des composés détectés dans les diverses maladies neurologiques (complexité des maladies, connaissances partielles de leur physiopathologie…).
-Aucune méthode de référence dans la quasi-totalité des cas (la biopsie n’analyse pas les anomalies métaboliques).
Pour pallier à quelques-uns de ces problèmes, le réseau français de spectrométrie cérébrale clinique a défini plusieurs règles à respecter pour qu’une étude puisse être considérée comme crédible en minimisant les erreurs techniques [VION-DURY, 1998].
-Le rapport signal sur bruit d’un spectre doit être au moins égal à 3.
-Les résonances de choline et créatine-phosphocréatine doivent être clairement séparées.
-Les
résultats doivent être présentés en utilisant
les aires des pics et non leurs intensités.
La spectrométrie
par résonance magnétique in vivo du proton permet,
de par la nature des informations qu’elle procure, de quantifier une souffrance
cellulaire par l’analyse de certains métabolites, dont les principaux
sont le N-acétylaspartate, la choline, la créatine, le lactate
et le myo-inositol. Par conséquent, la SRM est un outil privilégié
d’évaluation thérapeutique.
Moins coûteux et beaucoup plus accessible que la tomographie par émission de positons (bien que pour des métabolites de très faibles concentrations, la TEP reste la technologie la plus performante), cette technique recouvre en partie le même domaine tout en restant complémentaire.
La validation des différentes techniques de spectrométrie nécessite une harmonisation plus complète des paramètres choisis par les spectroscopistes afin d’obtenir des données crédibles, ce qui pourra ainsi conduire à une interprétation fiable. Si des spectres sont réalisés au cours d’examens d’IRM classiques sur des sites cliniques conventionnels, on pourra étendre les intérêts de cette méthode et l’utiliser au mieux. Le développement de la SRM exigera également de mener une réflexion approfondie sur la physiopathologie métabolique des maladies.
Pour l’heure, une grande partie des applications se sont orientées vers l’exploration de la fonction cérébrale dans son versant métabolique. Cependant, la spectrométrie RMN in vivo du proton se révèle très prometteuse puisqu’elle peut être appliquée à d’autres domaines d’exploration clinique, tels que certaines pathologies viscérales, musculaires, ou encore cardiaques.
Sites Web consultés