Le phénomène de résonance magnétique
nucléaire a été observé pour la
première fois en 1946 par Block et Purcell. Sa première
application fut la spectrométrie in vitro, largement
utilisée par les physiciens et les chimistes pour
l'identification de la structure des macromolécules. La
première application de la résonance magnétique
à l'homme a été l'imagerie par résonance
magnétique au début des années 80.
L'installation
du premier appareil d'imagerie par résonance magnétique
nucléaire a donné suite à des évolutions
technologiques permettant, avec le développement de
l'informatique, l'émergence de techniques
dérivées comme l'imagerie de perfusion, l'imagerie de
diffusion, l'angio-RM ou encore la spectrométrie par
résonance magnétique in vivo.
Cette
dernière technique permet de fournir des informations
supplémentaires relatives aux métabolismes cellulaires
des tissus dont l'information morphologique aura été
donnée préalablement par une séquence
d'imagerie. Elle est appliquée notamment au cerveau, au
muscle, à la prostate ou encore aux organes tels que le foie
ou suite à une greffe de rein.
Suivant
l'examen, la spectrométrie par résonance
magnétique utilise, entre autres, le proton et le phosphore.
Ce document traite
exclusivement de la spectrométrie par résonance
magnétique invivo du proton et de ses applications au
niveau neurologique. Une première partie de ce rapport se
consacre aux principes généraux et physiques qui
caractérisent cette technique. Dans un deuxième temps,
nous présentons différentes applications cliniques en
tentant de mettre en évidence les informations que peut
apporter la spectrométrie de résonance
magnétique et leurs conséquences sur les
méthodes de diagnostic.
Chapitre 1
Rappel de magnétisme
nucléaire
1.1 Propriétés
magnétiques de l'atome
Le noyau de l'atome est constitué d'un certain nombre de
protons et neutrons animés d'un mouvement complexe
intégrant une rotation individuelle autour d'un axe passant
par leurs propres centres.
Une
charge qui tourne (proton), induit autour d'elle un champ
magnétique appelé moment magnétique,
aligné sur son axe de rotation et représenté par
un vecteur d'aimantation
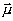
.
Parmi les noyaux
d'intérêt biologique possédant des
propriétés magnétiques le noyau
d'hydrogène, formé d'un seul proton, joue un rôle
important en imagerie. Celui ci représente 2/3 des atomes de
l'organisme et possède un moment magnétique
intrinsèque élevé et donne lieu à un
phénomène de résonance important.
Figure 1 : Moment magnétique du proton
Vecteur d'aimantation macroscopique
En l'absence d'un champ magnétique externe, les protons d'un
échantillon tissulaire sont orientés de façon
aléatoire : la résultante est nulle et il n'y a pas de
vecteur d'aimantation élémentaire macroscopique
(
=0).
Soumis à un
champ magnétique extérieur, les protons s'orientent
selon la direction de ce dernier avec apparition d'un vecteur
d'aimantation macroscopique
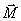 0
0En effet, la
répartition des protons dans le sens parallèle et
antiparallèle est à peu près équivalente
: il y a un peu plus de protons parallèles
à
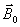
qu'antiparallèles
(2 par million). Ces protons résiduels,
constituent
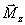
et produisent un signal RMN.
Les
protons précessent autour de B0 avec une
fréquence angulaire w0 donnée par
l'équation de Larmor : w 0 = gamma B0
avec gamma : rapport gyromagnétique.
1.2 Phénomène de
résonance
La résonance magnétique nucléaire consiste
à étudier les modifications d'aimantation des noyaux
d'une substance sous l'action conjointe de deux champs
magnétiques : un champ magnétique statique (
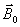
)
et un champ magnétique tournant (
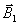
)
(onde électromagnétique ou de radiofréquence).
Etat d'équilibre : champ
magnétique
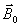
A
l'équilibre, le vecteur d'aimantation
macroscopique
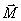 0
0
résultant est aligné sur
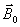
selon
oz, sans composante transversale dans le plan xoy. En effet les
protons s'alignent selon
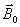
et
précessent autour de
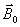
.
Ceci fait apparaître une composante
longitudinale
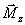
(aimantation
longitudinale). Il n'est pas possible de mesurer directement le
vecteur d'aimantation macroscopique à l'équilibre
(selon oz), car il est infiniment petit par rapport
à
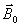
.
Pour pouvoir le mesurer, il faut le basculer dans le plan xoy par un
deuxième champ magnétique ou onde de
radiofréquence (RF).
Perturbation
de l'état d'équilibre: champ magnétique tournant
(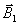 )
)
L'impulsion RF est
appliquée dans le plan xoy selon ox. La fréquence
angulaire w
r du champ magnétique tournant doit
être égale (synchronisée) à la
fréquence de Larmor w
0spécifique des protons
dans le champ donné
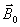
:
on dit alors que les deux systèmes sont en résonance
(w
r = w
0).
L'apport
d'énergie par l'impulsion RF entraîne respectivement,
par égalisation des protons sur les deux niveaux
d'énergie (par transition parallèle -
antiparallèle) et mise en phase des spins, une disparition de
la composante longitudinale
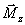
et
une apparition de la composante transversale
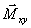
de
l'aimantation : c'est le phénomène d'excitation.
Dès
la fin de l'excitation, le vecteur
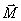
retourne
à l'état d'équilibre et les
phénomènes inverses vont avoir lieu :
Repousse
progressive de
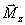
par
transition antiparallèle ? parallèle : c'est la
relaxation T
1,Décroissance
de
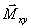
par
déphasage de spins : c'est la relaxation T
2.
C'est
par la relaxation des protons que le phénomène de RMN
devient observable.
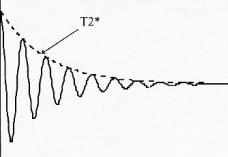
1.3 Mesure du signal RMN: signal
d'induction libre ou FID
Lorsque l'impulsion RF s'arrête, les spins reviennent à
leur état d'équilibre, en restituant l'énergie
acquise durant l'excitation sous forme d'un signal ayant une
fréquence spécifique. Son amplitude est maximale au
départ et diminue rapidement en fonction du temps. Ce signal
est appelé signal d'induction libre ou Free induction Decay :
FID [6].
[6]
Figure 2 : Signal d'induction libre
Chapitre 2
Bases de la spectrométrie par
résonance magnétique
2.1 Objectif de la spectrométrie
par résonance magnétique
Le but de la spectrométrie par résonance
magnétique in vivo est de fournir des informations
d'ordre chimique sur la composition des tissus. En effet, les tissus
se constituent de métabolites spécifiques dont la
concentration varie en fonction de leur état clinique.
Cette
étude est réalisée afin de détecter un
état pathologique et d'orienter, dans la mesure du possible,
sur le type de pathologie.
Utilisant
le même principe que l'IRM, la spectrométrie par
résonance magnétique (SRM) est une méthode non
invasive qui fournit une information en temps réel de la
situation du métabolisme cellulaire.
2.2 Différence entre
l'imagerie et la spectrométrie par résonance
magnétique
L'image par résonance magnétique, en IRM, est
réalisée essentiellement à partir de la
fréquence de résonance des protons de l'eau
présents en plus grande quantité que tout autres
éléments dans le corps humain.
Par différentes
techniques, la SRM permet de visualiser les informations via les
fréquence de résonance des protons des autres
métabolites en supprimant le signal provenant des protons de
l'eau.
Ainsi est obtenue, non
plus une localisation spatiale des tissus comme c'est le cas en
IRM,mais une image de l'environnement chimique de ces même
tissus.
L'espace,
en imagerie, est codé par variation de fréquence. La
composition chimique des métabolites étudiés
n'a, dans ce cas, pas de valeur. Les signaux del'eau, de la graisse
et des autres molécules contenant de l'hydrogène se
combinent pour donner un seul signal de chaque unité de
volume, appelée voxel, et la contribution de chaque
élément n'est plus identifiable. La
spectrométrie permet une mise en évidencede cette
contribution d'une manière qualitative et quantitative.
Une
deuxième différence concerne le rapport signal sur
bruit (S/B) acquis lors des deux techniques qui est beaucoup plus
faible avec la SRM. La raison principale est la division du signal
provenant de chaque voxel, en ses composants chimiquement distincts.
Pour obtenir un bon rapport S/B, il faut considérer de plus
larges voxels pour la SRM(1 à 8 cm
3) que pour l'IRM
(1 à 5 mm
3) [4].
2.3 Nucléides détectables
en SRM
Les nucléides détectables en spectrométrie qui
ont un intérêt physiologique sont les suivants :
l'hydrogène (1H), le phosphore(31P), le
fluor (19F), le carbone (13C), le potassium
(39K), le sodium (23Na), l'azote
(14N et 15N) et l'oxygène
(17O).
Avec
un nombre impair de protons ou de neutrons, ces nucléides
possèdent un moment magnétique qui permet leur
excitation et l'obtention d'un spectre de fréquences
[4].
Parmi
ces nucléides, l'hydrogène, étant le plus
abondant dans le corps humain, est le plus utilisé en
spectrométrie.
Dans
notre étude, nous ne développerons que la
spectrométrie de l'hydrogène (
1H SRM).
2.4 Restitution des données et
reconstitution des spectres
2.4.1
Le signal spectroscopique par résonance magnétique
Le signal d'induction libre (FID) est un signal dans le domaine
temporel. Il est le résultat de la superposition de plusieurs
signaux qui ont des fréquences différentes.
La
transformation de Fourier (TF) convertit ce signal du domaine
temporel au domaine fréquentiel constituant ainsi le spectre
observable lors d'un examen en spectrométrie.
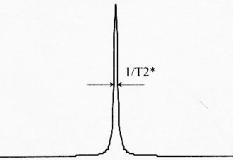
Si le signal par résonance magnétique contient une
seule fréquence w
0, le mouvement du moment
magnétique macroscopique
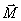
est
représenté par une sinusoïde amortie par une
exponentielle de temps en T
2*
. Le spectre
correspondant est une lorentzienne en w
0 avec une largeur
à mi hauteur inversement proportionnelle à
T
2*.
|
|
Transformée de
Fourier
|
|
[9]
Figure 3 : Cas d'un signal contenant une seule
fréquence
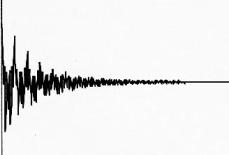
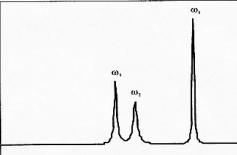
Si le signal contient plusieurs composantes, chacune ayant une
fréquence de résonance et un T2
différents de l'autre, le spectre obtenu après
transformation de Fourier possède plusieurs pics.
La
position, l'amplitude et la largeur de chaque pic dépend de la
fréquence de résonance et du T2 de chaque
composant [9].
|
Transformée de Fourier
|
|
[9]
Figure 4 : Cas d'un signal contenant plusieurs
fréquences
2.4.2
Caractéristiques du spectre
Les données en spectrométrie sont
représentées sous forme de spectres. L'aire sous chaque
pic caractérise le nombre relatif de chaque nucléide
détecté pour une entité chimique dans un volume
d'intérêt.
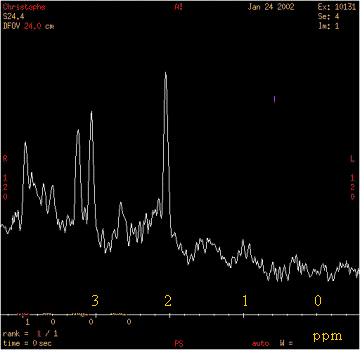
Figure 5 : Exemple de spectre par SRM d'un cerveau
sain
D'après des TP réalisés au CIMA et au CHU de
TOURS
L'échelle utilisée en SRM est dite de
déplacement chimique et notée delta. Etant en
relation directe avec le champ magnétique B0,
l'expression du déplacement chimique a été
standardisée pour permettre sa lecture directe sur l'axe,
quelque soit le champ appliqué : une nouvelle unité a
été créée, la partie par million de la
fréquence exprimée en Hertz (ppm). Ainsi les valeurs
obtenues seront indépendantes du champ magnétique
utilisé.
L'échelle
est donnée par la formule suivante :
delta
= ((v ref ˆ vobs) / v
ref)*10^6 v ref
: position en Hertz observée pour le composé de
référence
v obs : position observée pour le signal
d'intérêt
Les déplacements chimiques sont exprimés par rapport
à la fréquence de résonance d'une substance de
référence. Ayant un effet d'écran
important et donc un champ magnétique moins ressenti, le
tetraméthylsilane (TMS) est la substance de
référence en SRM du proton (d=0 ppm).
Sur
l'axe des abscisses, représentant la fréquence, il se
trouve à droite de la plupart des métabolites
observables [4].
Si
l'homogénéité du champ magnétique devient
faible, la largeur des pics augmente jusqu'à former un seul
pic. Cela se produit également si un gradient est
appliqué lors de l'acquisition du signal. Dans le but d'avoir
un champ magnétique homogène et des informations
optimales par déplacement chimique, aucun gradient n'est
appliqué durant l'acquisition du signal (Cf.figures 20 et
21)[9].
Chapitre 3
Metabolites observables en
1H SRM
3.1 Les origines des métabolites
observables
Les métabolites mesurés dans un examen de cerveau en 1H
SRM sont des éléments importants de son
métabolisme cellulaire. Ainsi toutes modifications de la
présence de ces métabolites dans le cycle permet de
détecter certaines pathologies.
Durant la production d'énergie, le cycle suivant se produit
:
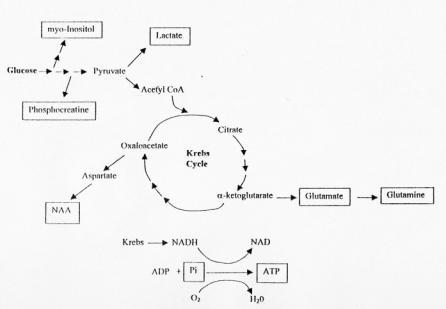 [4]
[4]
Figure 6 : Cycle de production d'énergie
Les principales raies détectées en 1H SRM du cerveau
sont celles du N-Acétyl-Aspartate (NAA), de la choline (Cho),
(phosphorylcholine et glycérophosphorylcholine inclus), de la
créatine (Cr), du myo-inositol (mI), du glutamate et du
glutamine (Glx), et dans les cas pathologiques, du lactate (Lac) et
des lipides (Cf : figure 15).
3.2 Les principaux métabolites
observables en 1H SRM
Le N-Acétyl-Aspartate (NAA)
C'est le composé qui donne la raie de plus grande amplitude
sur le spectre d'un cerveau sain(Cf.figure 6). Ceci correspond
à une concentration tissulaire importante (7 à 10
mmoles/kg). Présent dans les neurones, le
N-Acétyl-Aspartate est qualifié de marqueur
d'intégrité neuronale. Il est un reflet de la
densité et du fonctionnement neuronal.A l'apparition de
certaines pathologies, sa concentration diminue.
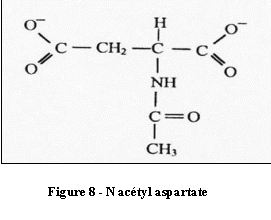
[4]
Le pic observé en spectrométrie est relatif
essentiellement à la glycérophosphocholine (GPC) et
à la glycérophosphoéthanolamine (GPE) qui
forment la bicouche membranaire phospholipidique des cellules. La
choline libre, en faible concentration, renseigne sur la
densité cellulaire. Le pic de la choline accentué en
cas de tumeur traduit soit une démyélinisation ou un
turn-over membranaire important dû à une
prolifération membranaire.
Il est un marqueur de souffrance membranaire.
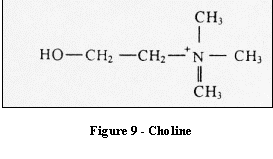
[4]
Le myo-Inositol est responsable des échanges à travers
les membranes. Son pic est observé uniquement à de
courts temps d'écho puisqu'il a un court T
2.Une
augmentation de la concentration de ce métabolite est
rencontrée lors des processus qui impliquent une activation
gliale; sa diminution est parfois reliée à des
phénomènes d'hyper osmolarité.
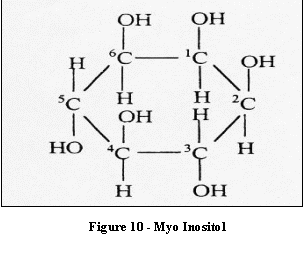
[4]
Le lactate n'est pas normalement détecté dans les
spectres relatifs à des sujets normaux (sa concentration est
de 1 mmol/Kg). Il apparaît lorsque le cycle normal de
l'oxygénation oxydative ne fonctionne plus correctement et
l'énergie cellulaire est fournie par la glycolyse
anaérobie. Il est un indicateur de la souffrance cellulaire ou
des réactions macrophagiques. Les tumeurs malignes
cérébrales comme les nécroses sont traduites par
une augmentation de la concentration de lactate, facteur important
dans le diagnostic d'une tumeur maligne à plus haut
degré.
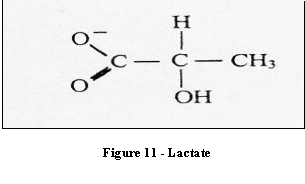
[4]
Les protons responsables du pic appartiennent à la
phosphocréatine et à la créatine qui participent
à la réaction de créatine kinase. Elle assure
une concentration constante de créatine. Son pic n'est en
l'occurrence pas affecté lors d'une pathologie et sert
très souvent de référence. Elle est prise en
compte pour le calcul de certains ratios de métabolites (cf.
§3.4).La concentration de la créatine est estimée
à 6 mmol/Kg dans la substance blanche et à 8 mmol/Kg
dans la substance grise. Elle est témoin du métabolisme
énergétique cellulaire.
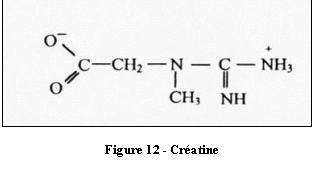
[4]
Le glutamate, est une forme de stockage du neurotransmetteur
excitateur, le glutamine. Dans le cerveau humain sa concentration
varie de 6 à 10 mmol/Kg. Il est un indicateur de la souffrance
cellulaire.
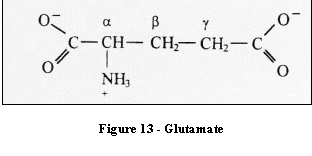
[4]
Le GABA est un neurotransmetteur inhibiteur impliqué dans la
communication des neurones courts.
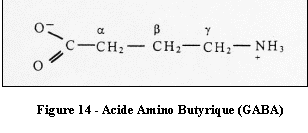
[4]
Présents en très faible quantité dans un cerveau
sain pour être observables, ils sont visibles dans les spectres
du proton du cerveau surtout autour et dans les tumeurs. Les lipides
sont associés aux macromolécules qui résultent
de l'arrêt de la myélinisation dans la substance
blanche. Le pic des lipides peut contaminer celui du lactate
puisqu'ils ont tous deux des fréquences de résonance
proches l'une de l'autre.
3.3
Localisation fréquentielle des métabolites
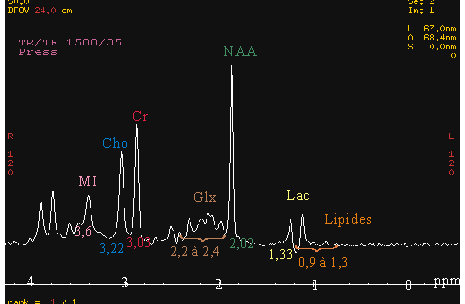
Figure 15 : Spectre caractéristique du
fantôme "General Electric Medical Systems"
D'après des TP réalisés au CIMA et au CHU de
TOURS
Fréquences de résonance des métabolites
principaux :
|
Métabolite
|
Fréquence de résonance en ppm
|
|
Choline (Cho)
|
3,22
|
|
Créatine ( Cr)
|
3,03
|
|
Glutamate (Glx)
|
2,2 à 2,4
|
|
Lactate (Lac)
|
1,33
|
|
Myo Inositol (mI)
|
3,6
|
|
N Acétyl Aspartate (NAA)
|
2,02
|
|
Lipides
|
0,9 à 1,3
|
La forme
des pics du spectre ainsi que leurs positions relatives sont
expliquées dans le chapitre suivant "Paramètres
spectraux et phénomènes physiques en
1H
SRM".
3.4 Quantification des
métabolites à partir des spectres
Les concentrations des métabolites peuvent être
déduites des spectres d'une façon précise.
Cependant, la reproductibilité des résultats
quantifiés demeure problématique. Les mesures absolues
exigent un contrôle de tous les facteurs contribuant à
l'obtention des spectres.
En pratique des
ratios de concentrations sont utilisés plutôt que des
valeurs de concentrations absolues.
Le
pic de créatine étant relativement stable dans la
plupart des pathologies, l'aire de la raie de ce métabolite
est utilisée comme référence pour les calculs
des ratios. Ainsi, on peut exprimer par exemple la présence
des métabolites de NAA ou de la choline par les rapports des
aires de chaque raie : Cho/Cr, NAA/Cr,·
Toutefois,
plusieurs paramètres affectent ce rapport et doivent rester
constants lors des prises de mesures (TE, administration de
gadolinium, quantité de matière blanche et de
matière grise dans le voxel·) [4].
Chapitre
4
Paramètres spectraux et
phénomènes physiques en 1H SRM
Trois paramètres principaux permettent de définir le
spectre d'un métabolite particulier :
- Le déplacement chimique qui définit la position de la
raie sur une échelle de fréquence par rapport à
une fréquence de résonance de référence,
- La multiplicité de la raie, reliée à la
constante de couplage spin ˆ spin (J),
- Le temps de relaxation (T2) qui est relié
à la largeur de la raie à mi hauteur.
A
noter, que l'aire d'une raie est directement proportionnelle à
la concentration du métabolite dans le volume
d'intérêt.
4.1 Déplacement chimique
L'analyse précise du signal RMN des noyaux d'hydrogène
permet de constater que la fréquence de résonance des
noyaux n'est pas tout à fait la même suivant la liaison
chimique où est engagé le noyau. Ce
phénomène s'explique par le fait que chaque groupement
chimique ou molécule étudié voit le champ
magnétique appliqué B0 différent, du
fait de l'influence de son environnement chimique.
En fait, la
fréquence de résonance des protons dépend de
leur environnement chimique : les électrons de liaison
entourant les protons produisent un effet d'écran au champ
magnétique, défini par le paramètre sigma. Le
champ Bi ressenti par ces particules est donné par Bi =
B0(1- sigmai ). Il est donc différent du
champ appliqué B0 et la fréquence de
résonance caractéristique sera : wi = gamma
Bi
C'est
ainsi qu'un même type de noyaux peut, à
l'intérieur d'un volume d'intérêt, subir des
champs différents dépendant de leur environnement
chimique. Le déplacement chimique est donc responsable de la
position des pics dans le spectre.
L'exemple du spectre du méthanol, identifié par ses
deux pics, illustre bien ce phénomène.
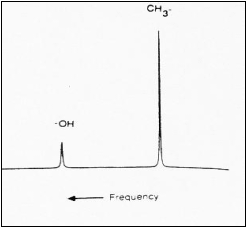
Figure 16 : Exemple de déplacement chimique
[14]
Le groupement hydroxyl résonne à une fréquence
plus élevée que celle du groupement méthyl. Les
électrons de liaison carbone-hydrogène dans le
groupement méthyl ont pour effet de rendre le champ ressenti
par les protons légèrement inférieur au champ
extérieur appliqué B0.
Dans
le groupement hydroxyl, l'atome d'oxygène, du fait de son
électronégativité élevée, attire
les électrons de liaison et expose ainsi le proton H au champ
B0 qui est alors mieux ressenti.
La
fréquence de résonance des protons dépend donc
aussi bien de leur environnement chimique que du champ
extérieur appliqué.
Les
aires des pics étant dépendantes de la concentration
des protons dans le métabolite mesuré, le rapport des
aires dans cet exemple, égal à 3/1, est donc
justifié par la présence de trois protons dans le
groupement méthyl (CH3) et d'un seul proton dans le
groupement hydroxyl (OH).
Bien
que le déplacement chimique soit à la base
d'artéfacts en imagerie, il permet en spectrométrie
d'identifier des groupements fonctionnels au sein des
molécules et de déterminer leurs structures.
Le déplacement chimique est également illustré
par l'exemple suivant : Le pic du NAA à 2,02 ppm et celui de
la créatine à 3,03 ppm sont issus du signal du
groupement CH3. Cependant, ces deux pics n'occupent pas le
même emplacement sur le spectre (cf. figure15).
L'effet
d'écran des électrons est plus important sur le
groupement CH3 de la molécule de NAA qu'il ne l'est
sur celui de la créatine et donc, le premier ressent un champ
magnétique plus petit et résonne donc à une
fréquence plus faible que celle de la créatine (il est
localisé à droite du pic de la créatine).
La
SRM se distingue de l'IRM par l'exploitation du
phénomène de déplacement chimique : elle
exploite les déplacements chimiques présentés
par des groupement de même nature selon le type
d'environnements chimiques dans lesquels ils sont
insérés [14,1].
4.2 Le couplage de spin
L'interaction entre noyaux atomiques de groupements chimiques voisins
se traduit par une décomposition de chaque raie en raie
complexe (doublets, triplets,·). L'amplitude de cette interaction
appelée couplage de spin, est définie par la constante
de couplage spin-spin (J) exprimée en Hertz. Elle
dépend à la fois de la nature de la liaison et du
nombre de liaisons mises en jeu.
L'exemple de
l'acétaldéhyde, CH3CHO, illustre bien ce
phénomène :
Il
y a deux types de protons dans la molécule CH3CHO :
ceux du groupement méthyl (CH3) et ceux du
groupement CHO. Partant de l'hypothèse qu'un spin peut avoir
deux états possibles "up" et "down", les trois spins des
protons du groupement CH3 peuvent avoir les quatre
configurations représentées sur la figure 17 :
- 3 spins up,
- 2 spins up et 1 spin down,
- 2 spins down et 1 spin up,
- 3 spins down.
La formation du
quadruplet est la conséquence de l'interaction de ces quatre
configurations avec le pic CHO.
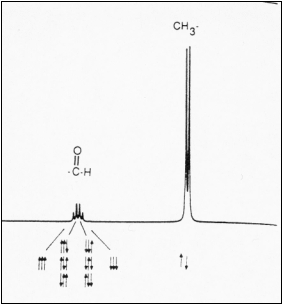
Figure 17 : Exemple de couplage de spin
[14]
La probabilité que la deuxième ou la troisième
orientation se produise étant trois fois plus grande que pour
la première ou la quatrième, les intensités des
pics sont donc dans un rapport 1:3:3:1.
Concernant
l'interaction du CHO sur le CH3, deux orientations sont
possibles pour le proton du groupement aldéhyde, "up"
et "down", avec une égale probabilité. La
formation du doublet est la conséquence de l'interaction de
ces deux configurations avec le pic CH3, avec des
intensités de pics dans un rapport 1:1 [14,1].
Cas particulier de couplage de spin : l'inversion du pic du
lactate
Le couplage de spin de la molécule de lactate (CH3-CHOH-COO)
est un cas particulier. Son spectre présente un doublet pour
les protons du groupement CH3 à 1,3 ppm et un
quadruplet plus petit pour le proton du groupement CH à 4,3
ppm (dus aux configurations possibles vues précédemment
relatives à chaque groupement).
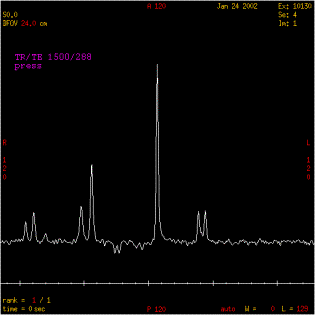
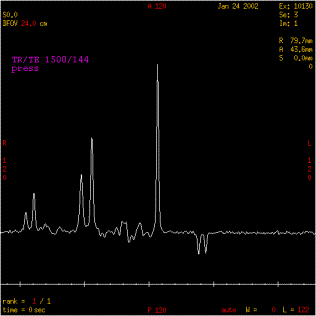
Figure 18 : Inversion du pic du lactate
D'après des TP réalisée
au CIMA et au CHU de TOURS
Les protons de ces deux groupements ont un faible couplage
représenté par la constante de couplage spin-spin J =
7Hz (soit 1/J=135 ms et 2/J=270 ms).Ce couplage a pour effet
d'inverser le pic de lactate à TE=135 ms.
En
effet, à TE = 270 ms, le pic est à sa position
initiale. Au fur et à mesure que le TE s'approche de 135 ms,
le doublet devient de plus en plus petit, traverse la ligne de base
et s'inverse complètement pour TE = 135 ms [4] .
4.3 Relaxation
La relaxation est le retour des spins à leur état
initial en restituant l'énergie d'exitation. Responsable du
contraste en IRM, elle contribue à la quantification des
concentrations des métabolites sur les spectres et donne des
informations sur l'environnement moléculaire des spins. Les
différences entre les temps de relaxation sont
utilisées pour supprimer des signaux (ex : cas des lipides
dont la relaxation est totale pour un TE > 135 ms) et ainsi
simplifier le spectre et le rendre plus exploitable.
4.3.1
La relaxation T1
Lors de la relaxation T1, les spins de fréquence de
résonance w0,communiquent leur énergie
d'excitation aux molécules avoisinantes de fréquences
intrinsèques wL.
Si
la valeur de wLs'approche de w0, le transfert
d'énergie est plus rapide et réduit d'autant plus le
temps T1 : c'est le cas des macromolécules comme
les protéines. Les petites molécules ont un
T1 nettement plus long.
4.3.2
La relaxation T2
Après une impulsion RF de 90°, les spins ont tendance
à perdre la cohérence de rotation dans le plan xy. Ce
phénomène de déphasage entraîne la
diminution de la composante transversale de la magnétisation,
c'est la relaxation T2.
Ce paramètre
est aussi relié à la largeur de raie à
mi-hauteur par l'expression
: v 1/2 =
1/(pi T2)
L'inhomogénéité du champ magnétique
principal se répercute sur la largeur de raie en introduisant
une dispersion de fréquence (ainsi dans la formule
précédente T2 sera remplacé par
T2*.
Les
effets de la relaxation consiste en une perte du signal en
T
1 pour de courts T
R et en T
2 pour
de longs T
E.
Chapitre 5
Techniques de localisation en
1H SRM
5.1 Spécificité du pic de
l'eau et des lipides
La gamme de mesure des métabolites observables est de l'ordre
de la millimolaire. La concentration des protons dans l'eau est de
110 M ( 104 à 105 plus grande).
Cette
différence de concentration entre les protons de l'eau qui
résonnent à 4,7 ppm et les autres métabolites
affecte le signal du spectre du proton.
Lors
de la conversion du signal, l'échelle de grandeur du spectre
est établie en fonction du pic le plus élevé.
Dans ce cas, le pic de l'eau masque les autres.
Afin
de pouvoir observer les métabolites d'intérêt, le
pic de l'eau doit être supprimé (Cf. : §5.2).
Le même
principe s'applique aux protons associés aux lipides (0,9-1,4
ppm) qui ont des signaux 104 fois plus intenses que ceux
de la créatine ou de la choline.
Dans
les études dont le volume d'intérêt (VOI) est
inclus entièrement dans le cerveau, la suppression des pics
des lipides n'est pas nécessaire :
Avec
un TE > 136 ms, la relaxation des lipides est complète et
par voie de conséquence, ne figurent pas lors de l'acquisition
du signal.
Dans
d'autres cas, la suppression des signaux est nécessaire. Si le
VOI comporte ou est proche du tissus crânien superficiel ou
retro-orbital, la suppression de la résonance de l'eau et de
la graisse est indispensable. Leur présence masque les signaux
des autres métabolites [7].
5.2 Séquences de suppression ou
atténuation du pic de l'eau et des lipides
La méthode la plus utilisée pour supprimer le signal de
l'eau est CHESS (CHEmical Shift Selective).
Elle
consiste à utiliser une impulsion dont la bande passante est
restreinte. Centrée sur la fréquence de
résonance de l'eau, cette séquence est appliquée
avant la réalisation de la séquence de sélection
de volume. L'application des impulsions CHESS engendre un quasi
état d'équilibre qui permet aux spins excités
à haut niveau d'énergie de retourner rapidement
à leur niveau de basse énergie. Dans ces conditions,
?E, créée par B0, devient nulle et aucun
signal de l'eau n'est détecté.
Une deuxième
technique, moins utilisée que la précédente,
existe pour éliminer le signal de l'eau : WEFT (Water
Elimination Fourier Transform Technique).
Elle
utilise une impulsion sélective de fréquence de
180°. Centrée sur la fréquence de résonance
du pic à éliminer, cette impulsion est supprimée
avant l'application de la séquence de sélection de
volume. En effet, après un temps t de l'application de
l'impulsion d'inversion, le signal du nucléide passe par un
point nul qui dépend de son temps de relaxation T1.
Le choix du temps
t détermine le pic à supprimer (eau ou lipides)
[14].
5.3 Techniques de localisation
"monovoxel"
Les techniques de localisation "monovoxel" permettent
d'acquérir un spectre issu d'un volume de tissus défini
par l'intersection de 3 plans orthogonaux. Deux approches sont
utilisées pour déterminer ce volume.
La première
consiste à exciter uniquement le volume d'intérêt
avec des impulsions radiofréquences. Cette approche est
utilisée dans les techniques dites STEAM (STimulated Echo
Acquisition Mode) et PRESS (Point RESolved Spectroscopy). Elles
intègrent toutes les deux, trois impulsions
radiofréquences.
La deuxième
approche consiste à exciter un volume puis à
éliminer les signaux non souhaitables. C'est le cas de la
technique ISIS (Image Selective
In vivo Spectrscopy), surtout
utilisée en spectrométrie du phosphore. Elle ne sera
pas traitée dans ce chapitre.
5.3.1
Principe des séquences de localisation "monovoxel"

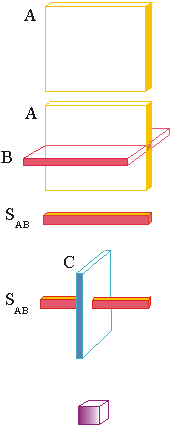 Figure
19 : Principe de localisation d'un voxel en
spectrométrie
Figure
19 : Principe de localisation d'un voxel en
spectrométrie
"monovoxel" par les séquences STEAM ou PRESS
5.3.2
Séquences de localisation "monovoxel"
Stimulated Echo Acquisition Mode (STEAM)
Figure 20 :La séquence STEAM
Point RESolved Spectroscopy (PRESS)
[9]
Figure 21 : La séquence PRESS
Chacune
de ces deux techniques comprend trois impulsions
radiofréquences de sélection de coupe : 3 impulsions de
90° pour STEAM et une impulsion de 90° et 2 de 180°
pour PRESS. Des gradients de sélection de coupe sont
appliqués avec ces impulsions selon les trois directions
orthogonales x,y et z.
En début de
chaque séquence, les impulsions CHESS sont appliquées
pour supprimer le signal de l'eau.
5.4 Comparaison entre STEAM et
PRESS
Ces deux séquences sont composées de trois impulsions
radiofréquence sélectives, chacune dans une direction
de l'espace. Le voxel étudié est placé à
l'intersection de ces trois plans. Cependant, STEAM souffre moins des
défauts de localisation spatiale (pas d'impulsions de
180° délicats à produire, induisant des profils de
coupes dans certains cas plus approximatifs que ceux des impulsions
de 90°) et donc de pollution par le volume extérieur au
VOI.
La
différence majeure entre ces deux techniques est dans la
nature de l'écho.
Dans
PRESS, l'écho est formé en prenant en compte la
magnétisation complète alors que dans STEAM seule une
partie du signal crée l'écho stimulé. Par
conséquent, PRESS a un rapport signal sur bruit plus grand que
celui de STEAM.
Etant
en relation directe avec les impulsions RF de chaque séquence,
les VOI déterminent les performances cliniques de chaque
technique. Les volumes d'intérêt de STEAM sont plus
larges que ceux de PRESS. De plus, elle permet à de courts TE
de mieux réduire la perte en T
2 pendant la
relaxation et permet ainsi l'observation des métabolites
à de courts T
2 [9].
5.5 Avantages et inconvénients
de la spectrométrie "monovoxel"
Aujourd'hui utilisée dans un grand nombre d'applications
cliniques au niveau du cerveau, la spectrométrie "monovoxel"
produit un seul spectre issu d'un volume avec une séquence de
mesure.
Cette
mesure, qui peut durer de 2 à 6 minutes, dépend de la
séquence choisie et des paramètres correspondants. Une
même mesure doit être répétée autant
de fois qu'il y a de volumes à examiner. Bien que les
technologies actuelles permettent cette répétition dans
un temps raisonnable, les techniques "monovoxel" ne sont pas aussi
efficientes que les techniques dites "multivoxel". Ces
dernières permettent l'acquisition de plusieurs spectres, dans
différentes localisations, en une seule séquence
d'acquisition.
Toutefois, la
spectrométrie "monovoxel" est de plus en plus utilisée
grâce à la simplicité de son
implémentation et à l'interprétation
immédiate d'un seul spectre, et surtout grâce à
son court temps d'acquisition.
Avec
des résultats cliniques acceptables, elle est employée
dans certains centres d'imagerie comme examen de routine ou vient
compléter un examen d'imagerie dans le cas de pathologies au
niveau du cerveau [9].
5.6 Technique de localisation
"multivoxel"
5.6.1 Chemical Shift
Imaging (CSI)
Appelée également imagerie spectroscopique (IS),
elle permet de recueillir des données spectroscopiques
à partir de voxels multiples et adjacents couvrant un large
VOI en une seule mesure.
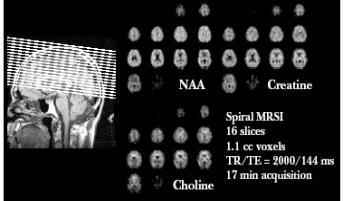
Figure 22 : Exemple d'images de métabolites
[Images "General Electric Medical Systems]
Les données
du VOI peuvent être étudiées de
différentes manières : comme étant
reliées à des voxels individuels, des cartes de
spectres ou des images de métabolites.
La
séquence CSI est surtout utilisée lors des pathologies
du cerveau. Elle est combinée à une excitation de
sélection de coupe ou de volume pour produire par exemple des
voxels de 1 cm3 (Cf : §5.6.2).
Cette technique "multivoxel" révèle
particulièrement son intérêt car elle offre la
possibilité de comparer les spectres provenant de
différents tissus.
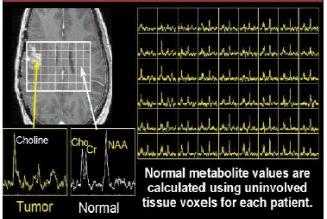
Figure 23 : Comparaison de spectres provenant de
différents tissus
[Images "General Electric Medical Systems]
Par exemple, le spectre d'une lésion peut être
comparé à celui d'un tissu sain du cerveau au
même titre que la distribution hétérogène
des métabolites dans la lésion.
La
séquence CSI présente l'avantage de pouvoir combiner
les voxels adjacents avec leurs spectres respectifs pour reproduire,
le plus précisément possible, la forme de la
lésion étudiée.
5.6.2
Volume Selective 2D CSI : Exemple de séquence de CSI de
sélection de volume
Le but de cette technique est d'exciter sélectivement les
spins dans un volume en excluant tous les spins des tissus non
désirés. Les principes de l'excitation de
sélection de volume en CSI sont les mêmes que ceux
décrits pour la spectrométrie "monovoxel" à
l'exception du volume défini, ici, par l'intersection de deux
plans.
Une séquence
de CSI de sélection de volume est obtenue en ajoutant à
une séquence PRESS ou STEAM une table de codage de phase pour
CSI 1D, deux tables de codage de phase pour CSI 2D et trois tables de
codage de phase pour CSI 3D.
La figure 22
illustre une séquence CSI 2D basée sur une
séquence PRESS. Le codage de phase se fait selon les
directions x et y[9].
[9]
Figure 24 : La séquence CSI 2D
Les impulsions CHESS sont utilisées au début de
la séquence CSI 2D pour supprimer le signal de
l'eau
Le temps d'écho
pour une séquence CSI 2D est de 40 à 270 ms avec PRESS
et de 20 à 30 ms avec STEAM.
Chapitre
6
Applications cliniques
Les applications cliniques de la SRM in vivo actuelles et en
développement concernent l'exploration du métabolisme
énergétique musculaire, où lors d'un effort,
l'étude de la vitesse de récupération de la
phosphocréatine et de l'écart de déplacement
chimique entre la phosphocréatine et la phosphate inorganique
renseignent sur le pH du milieu. Un second domaine en
développement est celui de la prostate avec d'une part, la
quantification de la choline qui est un reflet indirect de la
prolifération cellulaire, et d'autre part l'estimation du
citrate qui est celui du fonctionnement glandulaire normal. Le
troisième domaine d'application permet de tester la
vitalité d'un greffon, comme par exemple, un rein.
Toutefois, la spectrométrie du proton sur le cerveau est de
loin l'application la plus utilisée. Elle peut
désormais devenir une technique d'investigation courante en
recherche clinique neurologique et dans certains cas une
méthode diagnostique ou pronostique dont la sensibilité
est supérieure à celle de l'IRM.
Elle
révèle son intérêt dans les processus
cérébraux tumoraux, métaboliques, vasculaires,
inflammatoires infectieux et dégénératifs.
Dans ce qui suit,
nous donnerons quelques exemples concrets sur des processus
soulignant, ainsi, le rôle de la 1H SRM.
Toutefois,
avant de traiter de cas pathologiques, il est nécessaire de
connaître les étapes d'un examen de
spectrométrie. Cette présentation se fera au travers de
l'examen d'un cerveau sain et permettra de visualiser des profils de
spectres qui pourront être pris comme référence.
De même, un
essai sur fantôme (Cf. annexe 3 : TP sur fantôme"GEMS")
permet de mettre en évidence touts les métabolites
observables ainsi que de visualiser notamment l'inversion du pic de
lactate (traité dans le chapitre des phénomènes
physiques relatifs à la SRM in vivo).
Ces
différentes observations ont été
réalisées par le biais de travaux pratiques au CIMA
(Centre d'Imagerie Médicale Avancée) de
Compiègne et au CHU de TOURS.
6.1
Les différentes étapes d'un examen de
spectrométrie : application au cerveau sain
Le positionnement du patient
Le patient est positionné de la même façon que
lors d'un examen standard du cerveau en IRM.
La
tête doit être immobilisée de façon
à minimiser tous mouvements involontaires qui pourraient
entraîner des erreurs de localisation ou de pertes de signal.
Le "shim" global
Utilisé avant tout examen en spectrométrie, cette
procédure permetd'homogénéiser le champ
magnétique sur tout le volume détecté et
d'obtenir ainsi une meilleure qualité du signal de
résonance et de l'image. En routine clinique, cette
procédure est automatisée sur les appareils d'IRM.
La sélection de la séquence de mesure et de ses
paramètres
La
grande résolution spatiale de la spectrométrie
"multivoxel" par rapport à la spectrométrie "monovoxel"
et la possibilité d'identifier la variation des
métabolites à partir d'une seule mesure fait d'elle la
méthode privilégiée pour la détection des
pathologies. Cependant la spectrométrie "monovoxel" est plus
couramment utilisée grâce à sa simplicité
et à son intérêt clinique et surtout son temps
d'acquisition relativement court.
Comme
en imagerie, le choix des paramètres de mesure a un impact
direct sur les résultats de l'examen. Ces paramètres
sont le temps d'écho TE, le temps de répétition
TR, le nombre d'acquisition, la position et les dimensions du voxel.
Ces paramètres affectent le S/B, la résolution
spectrale, le traitement de données, la quantification et le
résultat final.
Acquisition des images par IRM pour la localisation du volume
d'intérêt
Avant
tout examen de spectrométrie, une séquence de
repérage par IRM est indispensable afin de réaliser une
localisation optimale du volume d'intérêt.
Positionnement du VOI
La position du
VOI est fonction de la pathologie à examiner. En
spectrométrie "monovoxel", lors d'un cas pathologique sa
dimension est ajustée pour minimiser l'inclusion des tissus
sains.
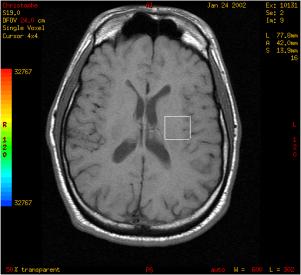
Figure 25 : Positionnement du volume d'intérêt
suite à une séquence d'IRM.
D'après des TP réalisés
au CIMA et au CHU de TOURS
Le "Shim" localLe
but du "shim" local est d'optimiser
l'homogénéité du champ magnétique sur le
VOI sélectionné. Un bon "shim" produit des pics plus
étroits, une meilleure résolution du spectre, et un
meilleur rapport S/B.
L'acquisition
Elle
dure de 2 à 6 minutes en spectrométrie "monovoxel"
(utilisée en TP) et peut atteindre 12 minutes en fonction des
paramètres.
Restitution des données et reconstruction des spectres
Les deux
séquences réalisées à un TE court de 30
ms puis, à un TE long de 288 ms permettent de visualiser tous
les pics de métabolites observables dans un cerveau sain :
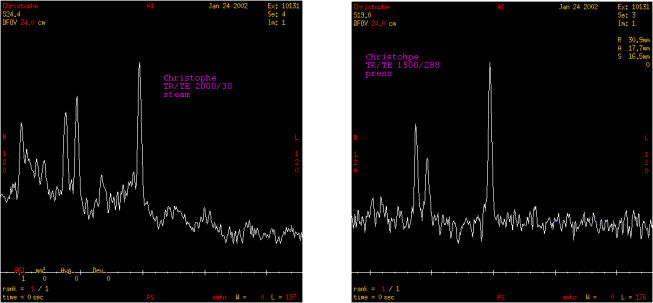
Figure 26 : Spectre d'un cerveau sain
D'après des TP réalisés au
CIMA et au CHU de TOURS
Exploitation des résultatsTrois
métabolites sont observés à long TE de
façon constante et mesurable dans un tissu
cérébral sain [12] :
-Le NAA à 2,02 ppm : c'est le composé qui donne
habituellement la raie de plus grande amplitude dans le spectre d'un
cerveau sain,
-La choline à 3,22 ppm (phosphocholine incluse),
- La créatine à 3,03 ppm (phosphocréatine
incluse) de présence quasi constante.
Uniquement à court TE, en plus de ceux
précédemment cités, les métabolites
suivants sont observables puisqu'ils ont un T2 faible :
- Le myo-inositol à 3,06 ppm
- Le glutamate-glutamine de 2,1 à 2,5 ppm
Dans
les deux cas, d'autres métabolites sont absents des spectres
puisqu'ils apparaissent uniquement en cas de pathologies :
-Le lactate à 1,33 ppm
- Les lipides entre 0,9 et 1,3 ppm
Remarque
: Le TE est choisi, en fonction des métabolites à
observer. De longs TE permettent d'éliminer les pics des
métabolites ayant un temps de relaxation T
2 faible
rendant ainsi le spectre plus clair et son exploitation moins
complexe.
6.2
Applications aux processus pathologiques
6.2.1 Processus tumoral
Définition : Un processus tumoral est une
prolifération cellulaire anormale, non inflammatoire, de
tissus ayant perdu la capacité de réguler.
Une
tumeur bénigne est d'aspect régulier, localisée,
refoulant les structures voisines, souvent limitée par une
capsule.
Une tumeur maligne est d'aspect irrégulier,
envahissant les structures voisines puis disséminant à
distance. Cependant, l'aspect macroscopique ne suffit pas pour
établir un diagnostic. Il faut réaliser une biopsie
destinée à l'examen anatomopathologique pour
différencier une tumeur bénigne d'une tumeur maligne.
[19]
La spectrométrie et le processus tumoral dans la
littérature [16]
Si l'IRM peut
détecter la présence des tumeurs
cérébrales, elle ne peut pas identifier leurs types. La
SRM, en quantifiant les métabolites dans la tumeur, peut aider
à améliorer la classification des tumeurs selon leurs
types.
Ainsi la
présence des lipides sur le spectre constitue un des
critères assez fiable en faveur du caractère
évolutif ou agressif de la tumeur gliale(Neggendank et
Sauter, 1996; Poptani et al., 1995).
De
la même manière, la présence de lactate souligne
le caractère glycolitique anaérobique de certaines
parties de la tumeur (Sijens et al., 1996).
En
général, lors d'un examen d'une tumeur par SRM, six
pics principaux apparaissent sur le spectre (certains ne le sont pas
selon le type des tumeurs) :
- Le pic de la choline à 3,22 ppm dont l'accroissement peut
indiquer l'augmentation du turn over (dégradation et
synthèse) des membranes
cellulaires et donc être un reflet indirect de
prolifération,
- Le pic de la créatine à 3,03 ppm, reflet du
métabolisme énergétique,
- Le pic de NAA à 2,02 ppm, marqueur de
l'intégrité neuronale,
- Le pic de l'alanine à 1,4 ppm, signe de la perturbation du
métabolisme intermédiaire,
- Le pic du lactate à 1,3 ppm, signe d'une glycolyse
anaérobie ou d'une glycolyse due à des processus
enzymatiques anormaux,
- Le pic des lipides qui devient visible suite à la
dégradation des membranes cellulaires.
En
outre, des métastases cérébrales peuvent
être détectées par SRM à des stades
précoces alors qu'elles ne le sont qu'imparfaitement par IRM
avec injection de gadolinium [16].
Cas clinique : Processus expansif du
tronc cérébral et de la région sous thalamique :
suspicion d'un processus tumoral
Réalisation de la séquence
d'imagerie afin de placer le volume d'intérêt. Ce
dernier est disposé sur le site pathologique.
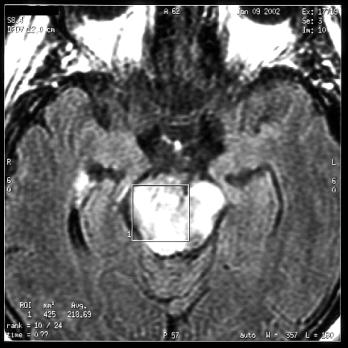 Cas clinique du CHU de CAEN
Cas clinique du CHU de CAEN
Figure 27 : Positionnement du volume d'intérêt suite
à une séquence d'IRM.
Acquisition et restitution des données
Deux séquences sont réalisées. Une
première à TE court puis une seconde à TE long
:
- PRESS, TR/TE : 1500/35 ms
- PRESS, TR/TE : 1500/144 ms
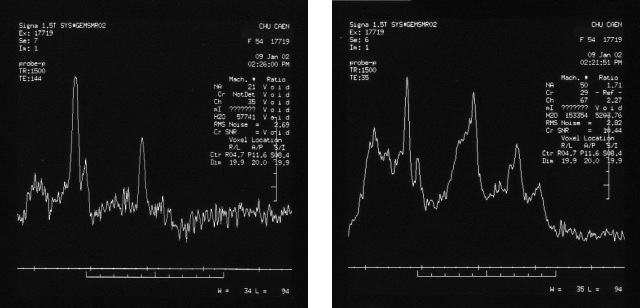
Figure 28 : Cas de suspicion de processus tumoral
(Cas clinique du CHU de CAEN)
Exploitation des résultats
La
première séquence de spectrométrie à TE
court (35 ms) permet de mettre en évidence :
- la présence de N-Acétyl-Aspartate à 2,02 ppm,
- la présence du pic de Glx (glutamate ou glutamine) sur la
gauche du pic de NAA,
- la présence importante de choline à 3,2 ppm,
- la présence de lactate à 1,3 ppm,
- la présence de myo-inosotol à 3,6 ppm (observable
uniquement à TE court),
- la présence de la créatine en proportion faible en
comparaison au pic de la choline.
La
deuxième séquence de spectrométrie à TE
long met en évidence :
- la présence du pic de NAA à 2,02 ppm,
- la présence de la choline toujours en quantité
importante,
- la présence de la créatine toujours faible,
- la présence de lactate est confirmé avec l'inversion
de son pic.
Interprétation médicale
Un des facteurs essentiels dans l'interprétation de ces
spectres concerne la présence importante de la choline, avec
de plus, un rapport Cho/Cr > 2. Cette analyse évoque une
suspicion de processus tumoral plutôt qu'un processus
inflammatoire granulo mateux.
La
créatine, à 3,03 ppm, est effectivement prise comme
référence dans le calcul de rapports
métaboliques puisque sa présence dans la certaines
pathologies et tissus apparement sains est relativement
constante(cf.§3.4).
Conclusion
La
spectrométrie permet dans ce cas, en plus de fournir
l'information métabolique, de guider, le neuro chirurgien dans
le choix du lieu de la biopsie. La SRM offre alors la
possibilité de réaliser un compromis entre risque et
intérêt.
Il
est incontestable que la voie est ouverte pour le remplacement
à terme des certaines biopsies par des procédures de
SRM nettement moins invasives (cf. autres pathologies :
l'abcès cérébral où il existe la
présence très spécifique de certains acides
aminés comme le succinate et l'acétate)
(Revue
Neurologique, Paris ;155:11, 912).
6.2.2 Processus
métabolique
Les maladies
métaboliques représentent un vaste domaine de la SRM
cérébrale du proton regroupant notamment les maladies
d'origine génétique.
Maladies mitochondriales : Encéphalopathie
mitochondriale
Définition : L'encéphalopathie mitochondriale
ou MELAS est une variété de maladies de
l'encéphale touchant les mitochondries.
L'encéphalopathie se caractérise par une atteinte
globale de l'encéphale comprenant le cerveau, le cervelet et
le tronc cérébral.[21]
Un des
symptômes de la pathologie se traduit par un manque de force
musculaire.
Actuellement, la
plupart des études de spectrométrie
cérébrale sur les mitochondropathies sont
réalisées en SRM du proton. Par contre, l'exploration
musculaire par SRM est le plus souvent effectuée en phosphore
31 dans ces pathologies mitochondriales.
La
présence de lactate, témoin de l'activation de la
glycolyse anaérobie, est trouvée de manière
inconstante dans ce type de pathologies.(Detre et al., 1991;
Cross et al. 1993). Elle est décrite selon trois
modalités[16] :
- une
accumulation de lactate chez des patients présentant un
syndrome de Kearns Sayres,
- un faible
signal en provenance du lactate chez quelques patients
présentant le syndrome de MERRF,
- une
accumulation transitoire de lactate en rapport avec l'accident
vasculaire cérébral chez des patients atteints de MELAS
En plus de la
présence de lactate, les mitochondropathies peuvent
s'accompagner d'une souffrance neuronale objectivée par une
diminution du NAA
(Matthews et al. 1993).
Cas clinique : Présentation d'un
cas de syndrome d'encéphalopathie mitochondriale du type MELAS
que l'on a suivi
Le
cas pathologique suivant permet de comparer deux examens
réalisés à cinq mois d'intervalle. Un traitement
médicamenteux a été administré suite au
premier examen. Le résultat est contrôlé au cours
du second examen de spectrométrie.
Premier examen : Détection de la pathologie
Une
séquence d'imagerie est réalisée avant l'examen
de SRM pour la localisation du VOI.
Dans
ce cas, le VOI est entièrement placé sur la zone
pathologique. Elle est repérée en IRM par un
hypersignal dû à des ždèmes intracellulaires dans
cette région
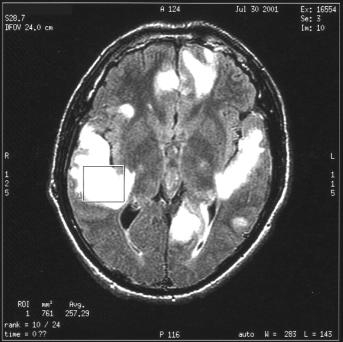 Cas clinique du CHU de Caen
Cas clinique du CHU de Caen
Figure 29 : Positionnement du volume d'intérêt suite
à une séquence d'IRM.
Acquisition et restitution des données
Les
séquences utilisées lors de cet examen sont des
séquences PRESS :
- TR/TE : 1500/35 ms
- TR/TE : 1500/144 ms
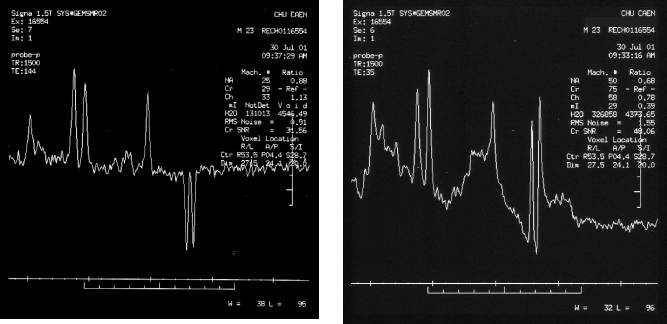
Figure 30 : Cas d'encéphalopathie
mitochondriale
Exploitation des résultats
Par
comparaison au spectre d'un cerveau sain, le premier spectre ( TE =
35 ms) montre que :
- Le pic du NAA à 2,02 ppm est diminué,
- Le pic du Glx (glutamate-glutamine) de 2,2 à 2,4 ppm est
augmenté,
-Le pic du myo-inositol à 3,6 ppm est diminué,
- Le pic du lactate est présent de manière importante,
- Des signaux des lipides et des phospholipides sont présents
dans la région de 0,9 ppm.
Le
deuxième spectre réalisé avec un temps
d'écho plus long (TE = 144 ms) met en évidence :
- la présence du lactate : le pic de ce métabolite est
bien identifié puisqu'il s'inverse à TE=144 ms,
- l'absence du pic des lipides à TE long.
Interprétation médicale
La diminution du pic du NAA peut être expliquée par un
dysfonctionnement des neurones.
L'augmentation
du pic du Glx et la diminution du pic du myo-inositol sont en
relation avec le dysfonctionnement des mitochondries.
L'augmentation
du pic du lactate est un signe de la souffrance cellulaire et de
l'utilisation de la voie de la glycolyse anaérobie pour
compenser le déficit oxydatif mitochondrial.
Deuxième examen : Suivi de l'évolution de la
pathologie
Cet
examen par SRM est fait après cinq mois de traitement suite au
précédent examen. La localisation du VOI
repéré par "1" sur l'image est la même que celle
du premier examen. Ceci a pour but d'identifier la variation des
concentrations des métabolites dans cette région et
donc l'évolution de la pathologie.
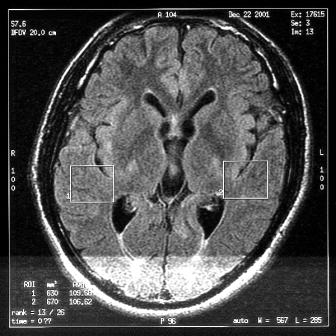 Cas clinique du CHU de CAEN
Cas clinique du CHU de CAEN
Figure 31 : Positionnement du volume d'intérêt suite
à une séquence d'IRM.
Acquisition et restitution des données
Les séquences réalisées sont identiques au
premier examen : PRESSˆTR/TE : 1500/35-1500/144 ms, dans le but
d'être dans les mêmes conditions d'acquisition des
données.
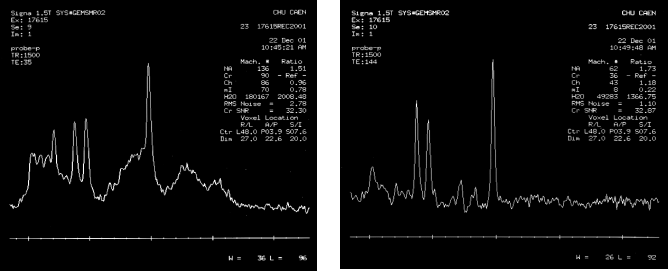
Figure 32 : Suivi d'encéphalopathie
mitochondriale
Exploitation des résultats
Ces
deux spectres réalisés après un simple
traitement par médicaments, montrent :
- une nette augmentation du pic du NAA par rapport à celui de
l'examen précédent,
- une diminution considérable du pic du lactate
contaminé par la présence du pic des lipides entre 0,9
ppm et 1,3 ppm.
La deuxième acquisition à long TE ne détectant
pas le pic des lipides, confirme la quasi absence du lactate.
Interprétation médicale
La
diminution du pic du lactate est la conséquence de la
diminution du déficit oxydatif mitochondrial et de
l'utilisation de la glycolyse anaérobie. La présence de
lactate en quantité importante est un signe de la
gravité de la maladie : son atténuation, dans ce cas,
révèle l'efficacité du traitement et
l'amélioration spontanée du déficit
mitochondrial.
Un
retour du pic du NAA à une amplitude et une aire quasi
normale, est un signe d'un retour à la normale du
fonctionnement neuronal. Ce dysfonctionnement neuronal d'origine
mitochondriale est donc, dans ce cas, réversible.
Conclusion
Dans
cet exemple, la spectrométrie révèle d'une part,
qu'elle est capable de quantifier le lactate tissulaire et
d'évaluer ainsi la gravité de la maladie et d'autre
part, d'identifier la pathologie sans avoir recours à la
biopsie. Cet avantage est primordial puisqu'une technique non
invasive qu'est la spectrométrie peut remplacer, dans cette
pathologie mitochondriale, la biopsie cérébrale,
invasive pour une pathologie extrêmement variable dans le
temps.
De
plus, en prouvant la réversibilité de ce type de
dysfonctionnement neuronal, la SRM souligne ici son utilité
pour le suivi thérapeutique de cette pathologie.
6.2.3 Processus pathologique
affectant la myéline : La Leucodystrophie
Définition : Le terme de leucodystrophie se rapporte
à un groupe de maladies d'origine génétiques
affectant la myéline du système nerveux central.
Dans
les leucodystrophies, cette myéline a des problèmes
pour se former, se maintenir ou parfois même, au contraire elle
se trouve en trop grande quantité. La conséquence est
une mauvaise conduction de l'influx nerveux avec toutes les
conséquences que cela peut avoir pour l'organisme.[17]
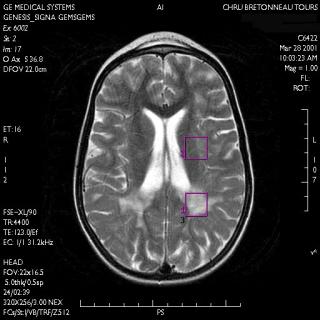
Cas
clinique : Leucodystrophie d'origine indéterminée
Cette
application va permettre de comparer la présence des
métabolites au sein d'un même cerveau pathologique en
différentes régions.
La
séquence d'imagerie fait apparaître un hyper signal
repéré par la zone 1.
Le
volume d'intérêt 2 est placé dans une zone
visiblement saine. Le repère 3 caractérise le
même volume d'intérêt que le 1 mais le TE est
long.
 Cas clinique du CHU de TOURS
Cas clinique du CHU de TOURS
Figure 33 : Positionnement du volume d'intérêt suite
à une séquence d'IRM.
Acquisition et restitution des données
La séquence utilisée lors de cet examen est la
séquence STEAM avec deux temps d'écho différents
30 et 144 ms, sur deux localisations différentes dans le but
de comparer les deux spectres d'une substance blanche saine
etlésée.
Spectres à TE court dans les tissus lésés :1 et
sains : 2
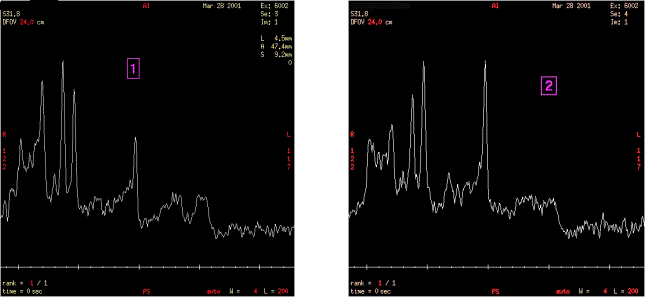
Figure 34 : Cas de leucodystrophie d'origine
indéterminée
Exploitation des résultats
Une
première séquence de spectrométrie à TE
court (30 ms) permet de mettre en évidence par rapport au
cerveau sain :
- la présence de N-Acétyl-Aspartate à 2,02 ppm
très faible par rapport à la créatine,
- la présence importante de cholineà 3,2 ppm,
- la présence de lipides de 0,9 à 1,3 ppm,
- la présence de myo-inosotol à 3,6 ppm relativement
importante,
La
deuxième séquence, dont le VOI est situé dans le
tissu sain, met en évidence par rapport au spectre de la zone
"1" :
- le pic du N-Acétyl-Aspartate nettement plus haut,
- le pic de la cholineplus faible,
- le pic du myo-inositol plus faible,
- la présence de lipides de 0,9 à 1,3 ppm est
confirmée.
D'après la littérature [16] :
La
diminution du NAA traduit une souffrance neuronale. Dans un spectre
de cerveau sain, la choline existe à des concentrations trop
faibles pour que sa contribution au spectre soit significative. Dans
ce cas, sa concentration est élevée et traduit un
renouvellement membranaire augmenté (densité cellulaire
accrue). Les phospholipides sont présents dans le cerveau sain
mais se trouvent en quantité peu importante.
Remarque
: Dans la mesure où les lipides résonnent pratiquement
dans le même domaine de fréquence que le lactate, soit
1,3 ppm, le pics des lipides contamine celui du lactate. Pour pouvoir
observer le lactate, une séquence à TE long, permettant
d'éliminer les T2 courts comme les lipides, doit
être réalisée.
Réalisation d'une troisième séquence dont le but
est de déterminer la présence de lactate
Cette
séquence STEAM à TE long (144 ms) permet
d'éliminer le pic des lipides.
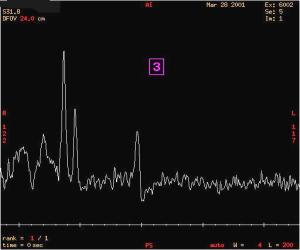
Figure 35 : troisième séquence à TE
long
Le spectre correspondant, dont le VOI est disposé au
même emplacement que lors du relevé "1"donc en zone
lésée, ne fait pas apparaître de pic à 1,3
ppm correspondant à la fréquence de résonance du
lactate.
Par
contre, il confirme les résultats obtenus concernant le pic de
N-Acéryl-Aspartate faible et celui de choline
élevé.
Interprétation médicale
Le
profil métabolique montre clairement une forte
démyélinisation marquée par une augmentation de
la cholineet une nette diminution du N-Acétyl-Aspartate.
La présence
de larges massifs de lipides peut être en rapport avec un
processus de mort cellulaire ou de libération de
phospholipides provenant de la myéline. Elle est
combinée à l'absence de lactate sur le spectre,
(confirmée sur l'acquisition à TE 144ms), ce qui
suggère un état chronique, beaucoup plus qu'aigu.
Une augmentation du
myo-inositol est également notée. Ce composé,
encore peu connu, tient un rôle dans la régulation
osmotique. Son élévation serait alors en rapport avec
une réaction cellulaire, et/ou l'apparition d'un ždème.
Sa diminution peut être notée également dans
certains troubles osmotiques comme ceux de l'encéphalopathie
hépatique.
Conclusion
Dans
ce cas clinique, une fois de plus, la SRM dévoile ses
capacités. Lors des deux premières séquences, le
premier VOI a été disposé sur la zone
lésée et le second, dans une zone visiblement saine,
d'après une séquence d'imagerie. Pourtant la
séquence de spectrométrie permet de détecter,
entre 0,9 et 1,3 ppm, un pic large correspondant au pic des lipides.
Alors
que l'IRM n'avait pas décelé de tissus
lésés, la deuxième séquence de
spectrométrie est capable de le faire.
6.2.4 Autres pathologies
Processus infectieux : Abcès
cérébraux
Les abcès cérébraux, sont des cas exemplaires
dans lesquels la spectrométrie du proton a clairement
démontré son intérêt. La visualisation
d'un abcès sur image IRM est très semblable à
celle d'une tumeur nécrosée [16].
Les spectres
enregistrés au sein d'abcès cérébraux
possèdent souvent un profil de spectre spécifique
à ce type de pathologie. Il intègre non seulement une
présence de lactate mais également de succinate
à 2,4 ppm, d'acétate à 1,9 ppm et parfois
d'analine à 1,48 ppm.
Ces
deux premiers métabolites sont absents de tout autre profil
métabolique pathologique (Rémy et al., 1995;
Martinez-Perez et al., 1997) et leur présence
élimine à priori le diagnostic d'une tumeur
proliférante.
Dans
ce cas, l'apport de la SRM est primordial. Sans spectrométrie,
avec un doute entre tumeur et abcès, la biopsie, avec les
risques que cela engendre, est inévitable.
En
sachant qu'un abcès se résorbe parfois par un simple
traitement médicamenteux par antibiotiques, la SRM permet dans
ce cas d'éviter une biopsie.
Elle
se révèle être un outil essentiel dans
l'activité du neurochirurgien.
Processus inflammatoire :
Sclérose en plaque
Définition : La sclérose en plaque (SEP) se
caractérise par une démyélinisation en plaque de
la substance blanche du système nerveux central. Elle peut se
localiser à de multiples foyers : l'encéphale, le nerf
optique, le tronc cérébral, la moelle et le
cervelet.[18]
Au
regard de la diversité des formes évolutives de la
maladie, de très faibles échantillons de patients ont
été explorés. Cependant les potentialités
de la SRM dans l'étude de cette pathologie sont bien
définies.
La
1H SRM permet la détection des métabolites
des lésions élémentaires dans la sclérose
en plaque :
- Une inflammation : augmentation de la choline et du lactate,
- Une démyélinisation : augmentation de la cholineet
des lipides,
- La souffrance axonale : diminution de N-Acétyl-Aspartate.
De plus, elle
permet de différencier les lésions à
caractère aigu de celles à caractère chronique.
La présence de lipides sur le spectre provenantd'une
lésion de SEP est en faveur du caractère récent
de la lésion alors que l'augmentation de la résonance
des composés contenant de la cholinesemble en rapport avec une
lésion plus ancienne (Larsson et al., 1991).
La
souffrance axonale retrouvée au cours de la SEP est
caractérisée par la baisse du NAA qui apparaît
comme un témoin de la gravité de la maladie.
A
noter que le signal du NAA se normalise, en dehors des formes
aiguës lors de l'amélioration clinique qui se traduit par
une remyélinisation limitée. Cette dernière
observation souligne la réversibilité de la souffrance
axonale [15,16].
Les
épilepsies
L'épilepsie résulte de troubles dans l'activité
électrique normale du cerveau. Elle se traduit par des
"crises" dont la nature dépend de la région du cerveau
affectée.[20]
La localisation du foyer épileptique représente un
problème diagnostique important. Elle est
incomplètement assurée par les méthodes non
invasives classiques (IRM par exemple) et nécessite souvent
des méthodes invasives. La SRM du proton est employée
dans l'exploration de la pathologie en raison de ses meilleures
capacités de localisation et de sa plus grande
sensibilité.
La zone de
lésion épileptique peut être définie comme
la zone d'anomalies métaboliques maximales. Le rapport NAA/(Cr
+ Cho) semble le plus sensible pour détecter le foyer
épileptique. Les anomalies métaboliques mises en
évidence par la SRM sont dans certains cas, observées
sur des hémisphères normaux à l'IRM.
Dans
les épilepsies temporales, une diminution de NAA est
associée ou non à une augmentation de cholinedans les
lobes temporaux. Alors que dans ces maladies le rapport NAA/Cr est
abaissé dans les deux lobes, il est normal dans le lobe
temporal des patients présentant une épilepsie
généralisée primaire[16].
L'activation
intense de la glycolyse anaérobie dans le foyer après
un état de mal explique la présence de lactate sur le
spectre (Ng et al., 1994 ; Jackson et Connely,1996).
D'après
des séquences spéciales d'édition, la
possibilité de détecter le GABA constitue un avantage
de la SRM dans les épilepsies. Ainsi après un
état de mal épileptique, en plus de la diminution du
NAA, une augmentation de glutamate pourraient correspondre à
l'accumulation du GABA ( Fazekas et al.,1995).
CONCLUSION
Cette étude de la spectrométrie par résonance
magnétique nucléaire du proton, appliquée au
cerveau humain, à partir de différents cas cliniques, a
permis de mettre en évidence l'intérêt et la
puissance de cette technique. Certains cas pathologiques
traités soulignent l'apport bénéfique que peut
engendrer la réalisation d'une courte séquence de
spectrométrie suite à un examen d'imagerie.
La SRM in
vivo permet d'une part,de fournir des informations en temps
réel et au même titre que l'IRM de façon non
invasive et se révèle d'autre part, dans certains cas,
plus efficace que cette dernière grâce à une
sensibilité accrue.
Les
cas pathologiques traités dans ce rapport confirment
l'intérêt qu'elle peut apporter dans la décision
du neurochirurgien préalablement à son intervention
chirurgicale comme par exemple une biopsie.
Un
autre élément essentiel est la capacité de la
SRM dans le suivi thérapeutique de pathologie.
Ces
différents points font que la spectrométrie par
résonance magnétique nucléaire in vivo du
proton, notamment cérébrale, est une technique
d'investigation de plus en plus demandée par les praticiens
dans les établissements possédant non seulement les
équipements mais également le personnel et les
compétences adaptées à l'interprétation
des résultats.
Pour
ces différentes raisons, la présence de la
spectrométrie par résonance magnétique devrait
s'accentuer au sein des établissements de santé et
à terme devenir un outil de diagnostic complémentaire
permettant une corrélation avec un examen morphologique de
type IRM. Ainsi les radiologues et biophysiciens, utilisateurs de
cette technique, pourront voir se concrétiser leur demande
visant en la reconnaissance de la SRM in vivo.
Sur
un plan plus personnel, nous avons extrêmement profité
de la réalisation de cette étude. Sans être
médecins, même si nous n'avons pu mesurer
complètement la portée et le potentiel que peut avoir
la technique de la SRM, nous avons pu, au travers des
différents cas cliniques étudiés,
apprécier ses capacités.
Par
des exemples simples, nous espérons que ce document
contribuera à son développement en convaincant le
lecteur de son intérêt.
BIBLIOGRAPHIE
OUVRAGES
[1]
ALAUX A. , l'image par résonance magnétique, Sauramps
Médical,116-137,142-151
[2]
CASTILLO M., M.D., KWOCK L., „Clinical applications of MR
spectroscopy‰ Chapter3 : Proton Magnetic Resonance Spectroscopy
of Brain Tumors : 49-78
[3]
DE GRAAF R. A.,In vivo NMR spectroscopyˆPrinciples and
Techniques, Wiley
[4] ELSTER A. D.,BURDETTE J. H., Questions & answers in.
Magnetic resonance imaging (second edition), chapter10 : MR
spectroscopy, MOSBY, 215-234
[5] HORST F., Basic one and tow Dimensional NMR
Spectroscopy, Third revised Edition, WILEY-LISS
[6] KASTLER B., Comprendre l'IRM, Masson
[7]
KWOCK L., Clinical applications of MR spectroscopy, Clinical proton
Magnetic resonance Spectroscopy : Basic Principles, Mukherji S. K.,
WILEY-LISS, 1998, 1-31
[8]
PALEY M., Proton spectroscopy of the human brain, Chapter 15,
[9]
SALIBI N., BROWN M. A., Clinical MR Spectroscopy-First principles,
WILEY-LISS, 1998, 3-49, 63-101.
ARTICLES
[10]
COZZONE P. J., VION-DURY J., BENDAHAN D., CONFORT-GOUNY S., Voies
d'avenir de la spectroscopie de résonance magnétique en
clinique humaine, La revue du praticien, Paris, 1996, 46,
853-858.
[11]
DIDELOT JM., SIWIEC L.,Etat de l'art de la spectrométrie in
vivo du proton par RMN, DESS TBH 2000/2001,UTC.
[12] GRAND S.,
ESTEVE F., RUBIN C., LEBAS J. F., REMY C., la spectrométrie 1H
: une approche métabolique des tumeurs
cérébraleet de leur suivi après une irradiation
externe, Rev. Med interne 1997 ; 18 : 865-875,
[13] LE
BAS J.-F., ESTEVE F., GRAND S., RUBIN C., REMY C., BENABID A. L.,
DECORPS M., Spectroscopie RMN et pathologie cérébrale,
applications cliniques ˆ J. Neuro., MASSON, Paris, 1998, 25,
55-69,
[14]
LENKINSKI R. E., Categorical course in physics : the Basics physics
of MR Imaging, RSNA 1997, 163-174.
[15] VIALA K.,
STIEVENART J. L., CABANIS E.-A., LYON- O., TOURBAH A.,
spectrométrie par résonance magnétique et
sclérose en plaque, revue neurologique 2000, MASSON, Paris,
156 : 1078-1086.
[16] VION-DURY
J., SALVAN A.-M., COZZONE P. J., Spectrométrie de
résonance magnétique du proton et métabolisme
cérébral », Revue neurologique, MASSON, Paris,
1999 ; 155 : 11, 903-926.
Site internet
[17]
www.medisite.fr/pathologie/genetique/leucodystrophie/-39
[18]
www.medinfo.com/principales/fichieurs/pm-neu-sceplaques-shtml
[19]
wwwusers.imaget.fr/~pol/00smna9c.htm
[20]
http://www.epilepsie-france.fr
[21]
www.vulgaris-medical.com/texte/encemito
[22]
www.canal-u.education.fr
[23]
www.chu-rouen.fr
Annexes
Annexe
1
Caractéristiques
techniques du fantôme "GEMS"
|
Concentration
|
Symbole
|
Nomenclature
|
g/l
|
T2 (ms)
|
|
50 mM
|
KH2PO4
|
Phosphate de potassium monobasique
|
136.1
|
-
|
|
56 mM
|
NAOH
|
Hydroxide de sodium
|
2.25
|
-
|
|
12.5 mM
|
NAA
|
N Acétyl Aspartate
|
2.19
|
400
|
|
10.0 mM
|
Cr
|
Créatine
|
1.5
|
265
|
|
3.0 mM
|
Ch
|
Choline
|
0.5
|
175
|
|
7.5 mM
|
mI
|
Myo inositol
|
1.35
|
75
|
|
12.5 mM
|
Glu
|
L-acide glutamique
|
2.34
|
-
|
|
5 mM
|
Lac
|
DL-acide lactique
|
0.5
|
-
|
|
0.10%
|
Azide
|
Azide de sodium
|
1
|
-
|
|
0.10%
|
GdDPTA
|
Magnavest
|
1 ml
|
-
|
Annexe
2
Temps de relaxation T1 et T2 des
métabolites dans les différentes régions du
cerveau
Zone
occipitale
Thalamus
Cervelet
|
Métabolites
|
d ( ppm)
|
T1
|
T2
|
T1
|
T2
|
T1
|
T2
|
|
Choline
|
3.22
|
1150
|
330
|
1200
|
320
|
1500
|
410
|
|
Créatine
|
3.03
|
1550
|
240
|
1750
|
200
|
1500
|
190
|
|
NAA
|
2.02
|
1450
|
450
|
1400
|
340
|
1700
|
300
|
|
Myo inositol
|
3.5
|
900
|
110
|
1100
|
150
|
1850
|
130
|
|
lactate
|
1.3
|
1550
|
1200
|
|
|
|
|
Annexe
3
Essai
sur fantôme"GEMS"
Afin de mettre
en évidence les différentes notions abordées
dans cette étude et avant de passer à l'étude de
cas cliniques, un essai de spectrométrie du proton est
réalisé sur fantôme "GEMS" (cf. annexe 1 :
caractéristiques techniques du fantôme).
Les buts de ce TP
sont les suivants :
- repérer tous les métabolites observables en
1H SRM,
- comparer les spectres à courts et longs TE,
- noter l'inversion du pic de lactate pour un TE de 135 ms.
Pour
cela, différentes séquences sont
réalisées :
- PRESS ; TR/TE : 1500/144 ms
- PRESS ; TR/TE : 1500/35 ms
- PRESS ; TR/TE : 1500/288 ms
- STEAM; TR/TE : 200/30 ms
Remarques
: La température du fantôme est de 25°C
Bilan des résultats
1-Recherche des métabolites observables sur le
spectre par 1H SRM
Dans
ce but, les deux séquences suivantes sont
réalisées :
PRESS : TE = 35
ms
PRESS : TE = 288 ms
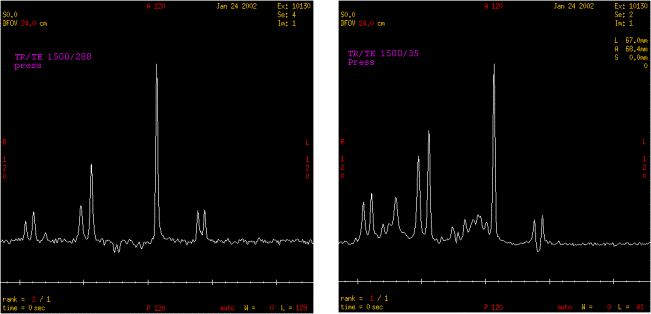
A de courts TE comme à de longs TE, les métabolites
suivants sont observés :
- NAA à 2,02 ppm,
- Choline à 3,22 ppm,
- Créatine à 3,03 ppm,
- Lactate à 1,33 ppm
D'autres
métabolites ne sont observables qu'à de courts TE
puisqu'ils ont de courts T2 :
- Myo Inositol à 3,6ppm,
- Glutamate entre 2,2 et 2,4 ppm,
2-Caractérisation de l'inversion du pic de
lactate
La
présence de lactate dans un cerveau n'est observable que dans
le cas de pathologie. Cet essai sur fantôme est une
façon certaine de pouvoir le mettre en évidence au
moins une fois.
Pour
un court TE différent de 135 ms on observe la présence
d'un doublet à 1,33 ppm.
A
TE = 135ms, on note l'inversion de ce doublet.
A
noter que cette inversion s'effectue à144ms pour l'IRM
utilisé.
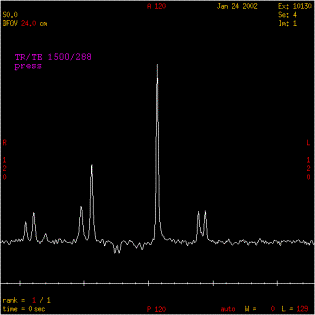
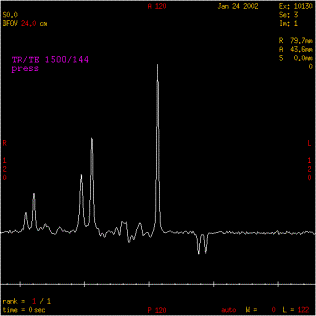
L'inversion du pic de lactate est effectivement visualisable pour
un TE de 144 ms dans notre cas.
3-Autres essais
Une séquence STEAM a également été
réalisée mais n'a pas particulièrement
apporté de résultats. En effet, à de courts TE,
on observe pratiquement un spectre identique pour les deux
séquences.

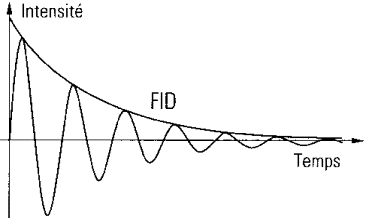





 [4]
[4] [4]
[4] [4]
[4] [4]
[4] [4]
[4] [4]
[4] [4]
[4] [4]
[4]





 Figure
19 : Principe de localisation d'un voxel en
spectrométrie
Figure
19 : Principe de localisation d'un voxel en
spectrométrie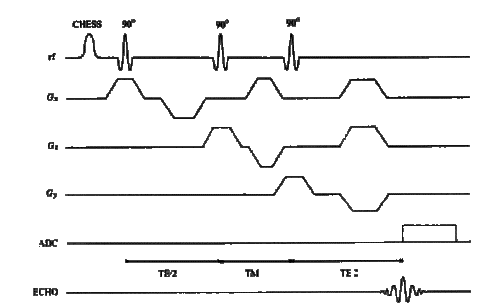
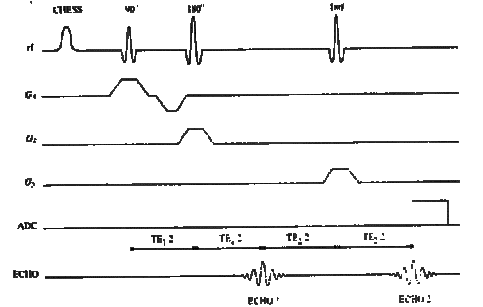





 Cas clinique du CHU de CAEN
Cas clinique du CHU de CAEN
 Cas clinique du CHU de Caen
Cas clinique du CHU de Caen
 Cas clinique du CHU de CAEN
Cas clinique du CHU de CAEN
 Cas clinique du CHU de TOURS
Cas clinique du CHU de TOURS



