Retour sommaire
Pour résumer :
Les démarches qualité sont
une tendance de fond pour encore de nombreuses années au sein des
structures sanitaires. Le secteur biomédical trouve une réponse
cohérente et efficace à l’arrêté du 5 Décembre
2001 avec l’accréditation ISO 17025. Celle-ci peut en effet
servir de référence pour démontrer sa capacité
à mettre en œuvre le contrôle qualité face à
une sérieuse concurrence de la sous-traitance.
III.
Méthode de mise en place d'une
activité de contrôle qualité de sécurité
électrique.
A.
Définition du contrôle
qualité
La "frontière" n'est pas toujours bien définie entre maintenance
préventive et contrôle-qualité mais elle existe pourtant
bien :
- au cours d'une maintenance préventive par exemple, le technicien
dispose d'un "kit" de maintenance, c'est-à-dire qu'il va devoir changer
certaines pièces constitutives du ventilateur (ex : les valves, le
filtre de l'humidificateur, les tuyaux des circuits inspiratoires et expiratoires
etc.) ;
- par contre, pour un contrôle-qualité, le technicien aura
un protocole de différents tests à effectuer sur le ventilateur
(ex : contrôle des fréquences, réglage de la FiO2, réglage
des débits, contrôle du trigger etc.).
Bien que la maintenance préventive diffère du contrôle-qualité,
ces deux activités n'en sont pas moins complémentaires puisque
l'une peut déclencher la réalisation de l'autre et réciproquementB
- Pourquoi faire du contrôle-qualité ?
Avant même de parler de motivations liées à la réglementation,
la motivation première de la réalisation du contrôle-qualité
est d'assurer la sécurité du patient, de l'utilisateur et
des tiers.
En réalité, du point de vue réglementaire, cette motivation
existe également puisque c'est la transcription de l'une des exigences
essentielles formulées dans l'article 100A, adopté le 7 mai
1985 par le Conseil des Ministres européen ; cet article avait pour
objectif la suppression des entraves réglementaires nationales aux
échanges en vue de l'établissement du marché unique.
Cet article, intitulé "Nouvelle approche en matière d'harmonisation
technique et de normalisation" limite dans des "principes de base" l'intervention
de l'autorité publique réglementaire, au niveau des produits
industriels, à des exigences essentielles, avec des objectifs de
sécurité et de santé.
Dans cette nouvelle approche, on trouve :
- un principe : la libre circulation au
sein des états membres ;
- des moyens : la conformité à des exigences essentielles,
décrites dans des directives, et non plus la conformité à
des normes partielles et souvent incomplètes ;
- des références : des normes européennes harmonisées
et la conformité aux exigences essentielles ;
- les modalités de vérification de cette conformité
;
- une preuve : la marquage CE, attestant la conformité aux exigences
essentielles et autorisant sa mise en vente sur la marché européen.
La réalisation du contrôle-qualité
s'inscrit donc parfaitement dans la réponse à ces exigences
essentielles de sécurité et de santé.
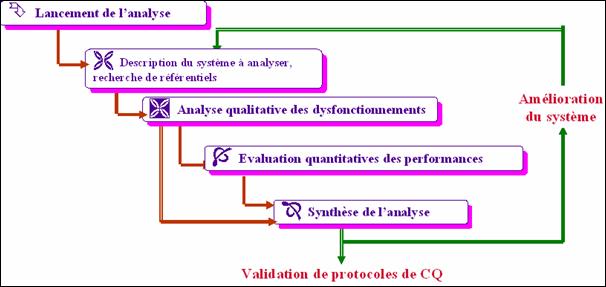
Par ailleurs, en langage "qualité"
et comme le montre le schéma ci-dessous, le contrôle-qualité
fait partie intégrante de la maîtrise de la qualité,
c'est-à-dire de toutes "les techniques, activités à
caractère opérationnel utilisées pour satisfaire aux
exigences pour la qualité" (Cf. ISO 8402).
Retour sommaire
B.
LE TEST DE SÉCURITÉ
ÉLECTRIQUE
La norme NF EN 60 601-1 détermine
les règles générales de la sécurité électrique
des équipements médicaux. Elle définit les courants
de fuite et courants auxiliaires patient à mesurer. Les valeurs limites
de ces courants sont fixées selon la classification des appareils.
Bon nombre d'entre eux font l'objet de normes spécifiques qui modifient
ou complètent la norme générale.
L'étude combinée de ces normes permet de développer
des procédures de contrôle de sécurité électrique.
Celles-ci regroupent l'identification de l'équipement, la liste du
matériel nécessaire, le schéma du montage et les résultats.
La sécurité dans l'utilisation du courant électrique
occupe une place prépondérante dans les normes. Dans le domaine
médical, pour assurer la sécurité et éviter
tout risque pour le patient et les opérateurs, les différentes
associations normatives ont publié des prescriptions précises.
La norme IEC 601.1 est le document général complété
ou modifié par un certain nombre de prescriptions spéciales
regroupées dans les Règles Particulières de Sécurité
des Appareils Electromédicaux
LA NORME IEC 601.1
Elle regroupe tous les types d'appareils
médicaux sans distinction, qu'ils soient électriques ou non.
Elle est présentée en dix sections
- Généralités : Elle détermine le domaine d'application
et l'objet de la norme. Elle pose la terminologie et les définitions,
ainsi que les caractéristiques générales des appareils
- Condition environnement : Elle détermine les catégories, les
moyens, et les conditions de sécurité
- Protection contre les chocs électriques : Elle définit la classification et la protection
contre les chocs électriques, les courants de fuite se rapportant
aux appareils électromédicaux
- Protection contre les chocs mécaniques : Cette partie traite de la résistance mécanique,
des aspects physiques et sonores
- Protection contre les risques dus aux rayonnements
non désirables ou excessifs : Rayonnements X, alpha, bêta, gamma, micro-ondes,
visibles, infrarouges, ultraviolets, énergie acoustique, et la
compatibilité électromagnétique.
- Protection contre les risques d'ignition de mélanges
anesthésiques inflammables : Définition de catégories d'appareils
: AP, APG. Essai des appareils.
- Protection contre les températures excessives
et autres risques : Classification en fonction des risques. Matériaux
utilisés.
- Caractéristiques : Précision sur les caractéristiques
de fonctionnement et protection contre les caractéristiques de
sortie présentant des risques.
- Fonctionnement : Conditions de défauts. Essai d'environnement.
- Règles de construction : Concernant les constructeurs
C.
Présentation du projet
Retour sommaire
Le laboratoire DESS TBH effectue des contrôles de sécurité
électrique sur les dispositifs médicaux. Pour réaliser
ces contrôles, le laboratoire dispose d’équipements de
contrôle adéquats.
1.
Objectif
Mettre en place un banc de contrôle
de sécurité compatible avec la norme ISO 17025.
Ce banc devra répondre à
des exigences techniques mais également des exigences en matière
d’ergonomie, de confort et de mobilité.
2.
Structure Documentaire
Notre étude nous a mené
à mettre en place un système d’assurance de la qualité.
La structure documentaire ci-dessous précise le fonctionnement de ce
système :

Le manuel qualité
en est le « porte parole » ; il décrit
l’ensemble de la gestion et de l’organisation du système
qualité. Il fait appel à différentes procédures.
Une première
version de ce manuel, sous forme d’ébauche, est disponible
en annexe 1.
Notre système
qualité fait appel à deux types de procédures :
·
Les procédures dites « générales »
Une procédure décrit la manière
spécifiée d’effectuer une activité ou un processus.
Chaque procédure générale répondra
aux exigences d’ordre organisationnelles citées dans les paragraphes
de la norme ISO 17025, semblable aux exigences de la norme ISO 9001 :1994.
Un exemple de procédure générale
a été développé, il s’agit de la procédure
de maîtrise de la documentation qui explique la façon d’élaborer,
de vérifier, de valider et de diffuser tous les documents de notre
démarche qualité.
Cette procédure figure en annexe 2 de ce rapport.
Néanmoins, il est nécessaire de mettre
en place toutes les autres procédures explicitant notre organisation
et qui sont exigées par la norme ISO
17025.
Retour sommaire
Le tableau ci-dessous en donne les principaux
titres :
|
Paragraphe de la norme ISO 17025
|
Titre de la procédure
|
|
4.4 |
Revue des demandes, appels d’offres et contrats
|
|
4.5 |
Sous-traitance des essais et des étalonnages
|
|
4.6 |
Achats de services et de fournitures
|
|
4.7 |
Services à la clientèle
|
|
4.9 |
Maîtrise des travaux d’essai non conformes
|
|
4.12 |
Maîtrise des enregistrements
|
Chacune des exigences organisationnelles de la norme
ISO 17025 citées ci-dessus doit faire l’objet de la mise en
place de procédures au sein du laboratoire qui prouvent notre conformité à ces dernières.
Une même procédure peut répondre
à une ou plusieurs exigences de cette norme.
Retour sommaire
·
Une procédure d’essai
Cette procédure est unique, quel que soit
le test effectué.
Elle décrit l’ensemble de l’organisation
du test effectué depuis la réception du matériel à
contrôler jusqu’à sa restitution au client. La conformité
à la norme ISO 17025 est respectée par la prise en compte
des exigences techniques de cette dernière. La validation de cette
procédure est indispensable pour prouver notre robustesse dans nos
méthodes d’essais.
Cette procédure d’essai, première
version, en est à son stade d’élaboration ; elle
doit être, à elle seule, capable de répondre aux exigences
techniques de la norme ISO 17025. Cette première version est disponible
en annexe 3.
La procédure
d’essai fait appel au mode opératoire spécifique
au contrôle à effectuer.
Le mode opératoire
décrit l’enchaînement des tâches à réaliser
pour effectuer l’essai auquel il se rattache. Il représente
le protocole de contrôle qualité concerné.
Nous avons choisi
une telle structure documentaire afin qu’elle permette une certaine
évolutivité des activités du laboratoire. En
effet, si le laboratoire souhaite effectuer à terme des étalonnages,
il lui suffira de les formaliser dans une procédure d’étalonnage
étant au même niveau que celle d’essai. De plus, s’il
veut accroître son activité en réalisant de nouveaux
essais (exemple : contrôle qualité défibrillateur,
bistouris, …), il lui suffira de décrire les nouveaux modes
opératoires (protocoles) s’y rattachant.
Le laboratoire doit
avoir trois types de modes opératoires :
-
mode opératoire d’essai,
-
mode opératoire de manutention et de préparation
des objets,
-
mode opératoire d’utilisation des objets.
Le mode opératoire
d’essai nous concernant dans ce projet, contrôle de sécurité
électrique sur les DM, est disponible en annexe 4.
Retour sommaire
Le technicien chargé
d’effectuer un contrôle donné (sécurité
électrique) suivra le protocole en question en enregistrant ses
mesures sous forme informatique (voir étude de faisabilité
réalisée ci-après) ou sous forme papier (voir exemple
ci-dessous). Ces actions nous permettront de garantir une certaine traçabilité,
une des exigences essentielles de la norme ISO 17025. Ces enregistrements
permettront au laboratoire de remettre au client un rapport d’essai
validé et dont les résultats seront sous assurance qualité.
| RAPPORT D’ESSAI |
Page
N° : 1 / x |
|
Dossier de suivi N° : |
|
Non
du laboratoire : |
|
Adresse
du laboratoire : |
|
Non
du client : |
|
Adresse
du client : |
|
Appareil
médical : |
Classe : I II
TBTS |
Type : B
BF CF |
|
Marque
de l’appareil : |
|
N°
de série de l’appareil : |
|
Date
de réception : |
|
Non
du technicien :
|
Signature : |
|
Conditions
ambiantes :
Température
entre 10° et 40° :
Humidité
entre 30% et 70% :
Pression
atmosphérique entre 700 hPa et 1060 hPa : |
|
TEST ELECTRIQUE |
|
Date
de l’essai : |
RESULTAT |
|
Tension
secteur |
|
|
PH-Terre : |
|
|
N-Terre : |
|
|
PH-Neutre : |
|
|
Résistance d’isolement |
|
|
PH/Neutre
-Enveloppe : |
|
|
Résistance
de terre : |
|
|
Courant de fuite à la terre |
|
|
Polarité
normale : |
|
|
Polarité
normale sans le neutre : |
|
|
Polarité
inverse : |
|
|
Polarité
inverse sans le neutre : |
|
|
Courant de fuite sur l’enveloppe |
|
|
Polarité
normale : |
|
|
Polarité
normale sans le neutre : |
|
|
Polarité
normale sans la terre : |
|
|
Polarité
inverse sans le neutre : |
|
|
Polarité
inverse sans la terre : |
|
|
CONFORME
NON CONFORME |
| "AVERTISSEMENT" ce
document ne peut être reproduit sans autorisation écrite
du laboratoire. |
|
|
|
|
|
|
Retour sommaire
Les impacts des coûts directs ou indirects
de l'indisponibilité des équipements, la perception des gains
potentiels liés à une plus grande disponibilité et
à une meilleure image de qualité sont autant de facteurs qui
ont accentué la perception des résultats attendus d'une gestion
effective de la maintenance.
Les conditions de mise en oeuvre d'une telle gestion impliquent la connaissance
de très nombreux paramètres identifiant :
- la nature et la performance de l'équipement
;
- les conditions de maintenance ;
- l'activité de production ;
- la disponibilité opérationnelle ;
- les coûts.
La seule
connaissance de ces informations n'est pas suffisante, il faut veiller à
leur accessibilité. Cette dernière condition rend indispensable
la " puissance de traitement
" de l'informatique
Nous avons donc
étudié la possibilité d'enregistrement des données
collectées par les ECME sur une GMAO.
. 
Figure 4 : Représentation des liaisons entre ECME et la G.M.A.O.
Retour sommaire
Il s'agit donc de recenser les ''passerelles'' informatiques éventuelles
existant entre les ECME ( ou leurs logiciels associés), et les logiciels
de GMAO couramment utilisés dans les services biomédicaux.
Cette étude nous a paru intéressante à mener, un système
de ''rapatriement'' des données permettant une intégration
aux méthodes de travail existantes, un gain de temps et donc de productivité.
Le problème
peut se schématiser de la manière suivante :

Retour sommaire
Après avoir
contacté différents fournisseurs, les renseignements que ces
derniers nos ont transmis sont présentés dans le tableau ci-dessous :
|
GMAO / Fabricant ECME |
METRON |
GAMIDA |
|
SYSTEMIS
|
|
Possibilité
de rapatrier les données sous forme de fichier texte. L’archivage
ne pourra pas être réalisé dans la GMAO. |
|
SOPHIE |
Interface informatique
en cours d’étude. |
|
|
OPTIM |
Bientôt avec ANSUR : possibilité
d’enregistrer les rapports de mesure en mode « fichier
lié ».
Chaque rapport sera automatiquement archivé
et « attaché » au fichier de suivi
du DM testé dans la GMAO.
Avec PROSOFT :
possibilité de rapatrier les rapports de mesure en format
« texte ». L’archivage dans la GMAO
est possible, mais sera réalisé manuellement par le
technicien. |
Possibilité
de rapatrier les données sous forme de fichier texte. L’archivage
ne pourra pas être réalisé dans la GMAO. |
Retour sommaire
Si le rapatriement des données sur la GMAO
est réalisable, le technicien pourra envoyer à distance
les données du contrôle qualité réalisé
sur le serveur intranet de l’établissement. Il faudra pour
cela qu’il dispose des autorisations nécessaires (login, mot
de passe), lui permettant de réaliser cette opération. Il
devra pour cela disposer d’un logiciel de type PC Anywhere, qui permet
d’ouvrir une fenêtre de commande du serveur à distance,
en se connectant à ce dernier.
Retour sommaire
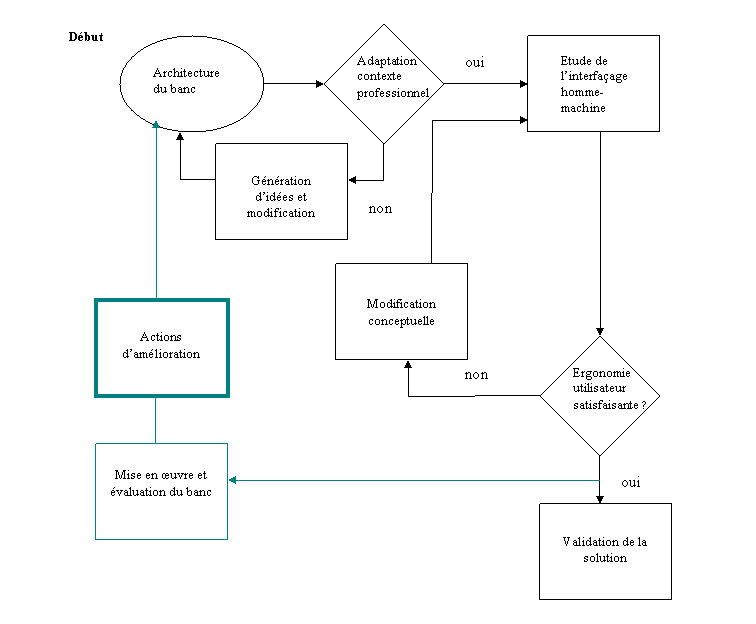
Le logigramme ci-dessous présente notre méthodologie
de travail. Elle nous a servie à élaborer une première
ébauche de l’architecture du banc. Une étude de satisfaction
client ultérieure nous permettra d’apporter des modifications
afin d’améliorer continuellement cette première proposition.
Retour sommaire
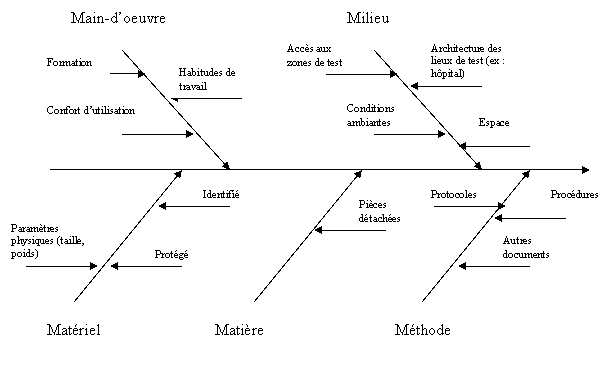
Le
diagramme de causes à effet (ISCHIKAWA)
Il a été
inventé par le professeur K. ISHIKAWA en 1950. Il est nécessaire
d'avoir préalablement identifié le problème et réalisé
un brainstorming pour rechercher toutes les causes possibles concernant
la dérive de l'indicateur de qualité.
Il permet
de visualiser de façon simple l'ensemble des causes potentielles
concernant le constat d'un effet quel qu'il soit. Il a pour but d'analyser
une situation où l'effet à corriger peut être produit
par plusieurs causes et rechercher les causes principales et secondaires
produisant l'effet.
La visualisation
des données sur un seul diagramme permet l'étude des relations
qui existent entre un effet et ses causes présumées regroupées
en familles.
Cependant,
cet outil ne permet pas d'identifier avec certitude toutes les causes réelles.
Les règles
de construction d'un diagramme causes-effet sont les suivantes :
·
Définir clairement le problème, en
terme d'effet, que l'on traite et l'inscrire sans ambiguïté
dans une case à droite du diagramme.
·
Identifier les grands domaines ou catégories
dans lesquels les causes du problème trouvent leur origine. En règle
générale on se limite à cinq catégories, les
" cinq M " (Main d'oeuvre, Méthode, Milieu, Machines, Matériaux)
mais le service biomédical ne doit pas adopter systématiquement
cette classification ; il peut en choisir une différente, mieux adaptée
au problème qu'il a à traiter. Une fois les catégories
définies, celles-ci sont portées sur le graphique en arête
de poisson.
·
Rechercher le maximum de causes possibles.
Retour sommaire
Le banc devra s’adapter aux différentes
exigences de la tâche à réaliser, aux diverses habitudes
et connaissances des différents utilisateurs.
Cette flexibilité permettra d’atteindre
les objectifs suivants :
·
Adaptation à la diversité des utilisateurs
·
L’outil doit s’adapter à l’homme
et non l’inverse
L’utilisation du banc devra être explicite :
les éléments fournis doivent permettre à l’utilisateur
de maîtriser le lancement et le déroulement des opérations.
(conditions de réponse à la norme ISO 17025).
Retour sommaire
Le diagramme d’Ishikawa fait apparaître
deux catégories de facteurs prépondérants :
a. Ceux liés au contexte professionnel
- Architecture,
- Espace,
- Accès aux zones de test.
b. Ceux liés à l’interaction
utilisateur/matériel
- Formation,
- Habitudes de travail,
- Confort d’utilisation.
Retour sommaire
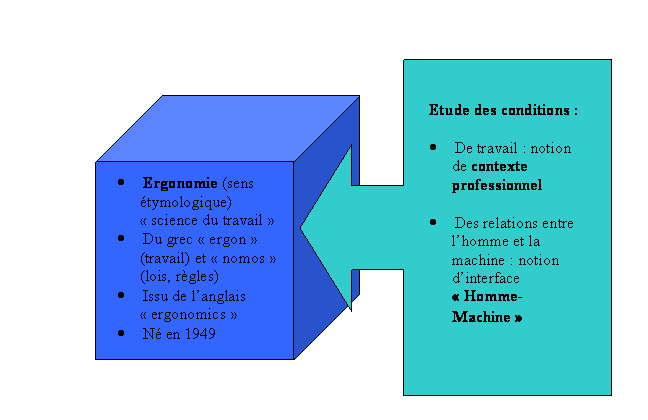
Ergonomie
Le Centre National de Recherche Scientifique (CNRS),
ainsi que l’Institut National de Recherche et de Sécurité
(INRS) ont mis au point des guides d’ergonomie pour l’aménagement
de postes de travail (avec ordinateurs). (en exemple, une partie d’un de ces guides
est fournie en annexe 5).
Nous nous sommes inspirés de ces recommandations,
fidèles à la législation, afin d’établir
les principes architecturaux généraux de notre banc d’essai.
Ces paramètres pourront constituer des indicateurs intéressants
quant à l’ergonomie du poste de travail mobile.
En tenant compte des dimensionnements et des poids
des divers ECME présents sur le marché, nous avons suivi ces
guides. Ce travail a abouti à la réalisation des plans
d’un prototype de banc mobile.
Liste
non exhaustive des ECME couramment utilisés dans les services biomédicaux.
Cette liste est classée par type de test.
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Sécurité Electrique
|
METRON |
QA 90 |
30,5 x 34,2 x 13,2 cm
|
5.8 kg |
|
|
Gamida tech |
601 Pro Series |
12,5 x 41 x 28 cm |
7,7 kg |
|
|
Gamida tech |
505 Pro Series |
|
|
|
|
Gamida tech |
180 |
|
|
|
|
Integral Process |
Unimet 1000 ST |
|
|
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Défibrillateurs
|
METRON |
QA 40 M |
28 x 24,8 x 9,8 cm
|
1.85 kg |
|
|
Metron |
QA 45 |
28. x 24.8 x
9.8 cm |
2.06 kg |
|
|
Gamida tech |
QED-6M et QED 6H |
27 x 24 x 10 cm |
2,2 kg |
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Bistouris
|
METRON |
QA ES |
39,5 x 34,2
x 13,2 cm
|
9.8 kg |
|
|
Gamida tech |
454 A |
|
|
|
|
Gamida tech |
RF 303 |
|
|
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Respirateurs
|
METRON |
QA-VTM |
27 x 35 x 9,5 cm
|
3.5 kg
|
|
|
Gamida tech |
Ventis+Log |
Système |
portable |
|
|
Gamida tech |
Vt Plus |
25 x 25 x 13 cm |
4,5 kg |
|
|
Seres |
Vigil Air |
|
|
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Pousse-Seringues et Pompes
|
METRON |
Lagu
|
|
|
|
|
Gamida tech |
IDA 4 |
30 x 18 x 23 cm |
4,9 kg |
|
|
Gamida tech |
IDA 2 PLUS |
|
|
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Tensiomètres
|
METRON |
QA-1290
|
23 x 33,5 x 11,5 cm
|
3,5 kg |
|
|
Gamida tech |
BP PUMP |
25 x 25 x 13 cm |
3,4 kg |
|
|
Integral Process |
Smart Arm |
|
|
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Simulateurs Patients
|
METRON |
PS-410/420/430/320
|
3,4 x 9,4 x 15,6 cm
|
0,4 kg |
|
|
Gamida tech |
LH 1,2 & 3 |
13 x 20 x 4 cm |
400-500 g |
|
|
Integral Process |
SP 200 & 500 |
|
|
Retour sommaire
Divers tests.
|
ECME |
Marque |
Type |
Dimensions |
Poids |
|
Analyseur d'halogénés |
RIKEN KEIKI |
IF 18 |
|
|
|
Sonde Température |
KANE MAG |
KM 330 |
|
|
|
Incubateur |
GAMIDA |
KOALA |
|
|
|
SpO2 |
NELLCOR |
SRC2 |
|
|
|
Radiomètre UV |
VILBER LOUMAT |
UVR 460 |
|
|
|
Lux Mètre |
ROLINE |
R01332 |
|
|
|
Lux Mètre |
LUTRON |
LX102 |
|
|
|
Mesureur Pression Universel |
GAMIDA |
DPM 2+ |
|
|
Matériel
présent sur le banc.
Ø
Exemplaire original de la norme
Ø
Manuel qualité, avec la structure documentaire
associée : procédures, protocoles, modes opératoires
Ø
Les ECME sont présents avec leur notice d’utilisation
Ø
Un nombre suffisant de câbles (secteur, informatique
pour une éventuelle connexion au réseau de l’établissement)
Ø
Des détrompeurs secteurs
Ø
Un ordinateur portable équipé de :
o
Logiciel de gestion de l’ECME
o
Logiciel de connexion à un serveur distant
(type « PC anywhere ») pour le rapatriement éventuel
des données sur GMAO
Ø
Eventuellement une imprimante
Ø
Les fiches de rapports et d’enregistrement
d’essai
Ø
Appareils de mesure des conditions ambiantes (thermomètres,
hygromètres, manomètre, …)
Notre démarche nous a amené à
considérer deux méthodes de conception différentes.
Retour sommaire
Bancs
mobiles constitués de bras amovibles
Schéma général de l’organisation d’un banc
à bras



Types de bras amovibles
permettant l’adaptation de matériels au pied central
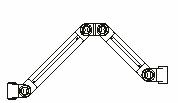
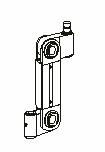
Retour sommaire
Avantages :
Un banc constitué de cette manière
serait totalement modulable. On peut ajouter sur le pied central un nombre
important de bras. L’architecture est évolutive.
Inconvénients :
Ce système offre peu de protections pour le
matériel transporté. Le poids des différents ECME est
à prendre en compte et risque de poser problème. La stabilité
du système ne nous a donc pas paru satisfaisante.
La documentation risque d’être égarée.
La solution retenue fut donc la suivante :
Bancs
mobiles type « chariot »
La documentation est classée dans un tiroir
prévu à cet effet.
Les ECME sont placés dans un habitacle semi-fermé,
garantissant leur protection.
Le système est robuste, et facilement déplaçable,
il s’inspire des chariots fréquemment rencontrés dans
le milieu hospitalier (réanimation, certains services biomédicaux,
…)
L’informatique s’y intègre facilement.
Les impératifs de mobilité et de modularité seront facilement
respectés.
Retour sommaire
La norme ISO 17025 représente un support permettant
une plus grande crédibilité, une reconnaissance nationale et
internationale de compétence, ainsi que la possibilité d’effectuer
des contrôles pour d’autres sites en tant que tierce partie.
Pourquoi un service biomédical, ayant développé
des compétences dans un domaine technologique particulier, ne pourrait-il
pas réaliser ces essais en son sein, mais également dans le
cadre d’accords passés avec d’autres établissements ?
Le développement d’une coopération
entre les services biomédicaux hospitaliers, notamment au travers de
ce type de démarche, ne peut être bénéfique que
pour l’ensemble de la profession.
La conception de bancs mobiles s’intègre
parfaitement dans cette démarche. La réalisation de ce type
de structure permettrait en effet d’effectuer les contrôles qualité
de manière externalisée. Pour que ce concept soit viable, il
faudra s’assurer d’une totale modularité de ces bancs.
Les propositions architecturales que nous avons formulées devront être
mises à l’épreuve (réalisation de prototypes) afin
de s’inscrire dans une démarche d’évaluation et
d’amélioration continue.
Quoi qu’il en soit, la possibilité
d’être accrédité, sur un nombre plus important de
contrôles qualité, repose sur la réalisation de référentiels
nationaux. Si le contrôle de sécurité électrique
est une méthode normalisée (norme EN 60-601), de nombreux domaines
ne possèdent pas de référentiels en terme de contrôle
qualité (ex : échographie, radiologie conventionnelle,…).
La mise en place de méthodes
d’essai normalisées par type de dispositif médical pourrait
être le résultat d’une collaboration entre exploitants
et fournisseurs, supervisée par le G-MED, organisme notifié.
La formation de groupes de travail à l’écoute des évolutions
technologiques de l’appareillage est indispensable dans un avenir proche
pour mettre en place des méthodes d’essai performantes.
Cette démarche, en permettant de prouver la
maîtrise et la crédibilité des contrôles qualité
des dispositifs médicaux, contribuera à la qualité des
soins et à la sécurité du patient.
Retour sommaire
1 - Accréditation:
L'accréditation
est une procédure d'évaluation externe du fonctionnement et
des pratiques des établissements de santé privés et publics,
assurée par des professionnels de santé, indépendante
des établissements et de leur organisme de tutelle.
2- Certification:
La certification est l'attestation formelle délivrée
par un organisme certificateur reconnu compétent et impartial,qu'un
produit, un processus ou un service est conforme à des exigences fixées
par un référentiel ( normes de lasérie ISO 9000).
3 - Assurance qualité: Ensemble des actions préétablies et
systématiques pour donner la confiance appropriée en ce qu'un
produit ou service satisfera aux exigences données relatives à
la qualité.
4- Démarche
qualité:Ensemble des actions que mène l'entreprise
pour se développer par la satisfaction de ses clients.
5- ECME :Equipements de Contrôle, de Mesure et d’Essai
6- Mission:L'objectif ou la raison d'être de l'organisation.
7- Procédure:Manière spécifiée d'accomplir
une activité.
8- Processus:Succession d'étapes ajoutant de la valeur
en produisant les éléments requis à partir d'une variété
d'éléments reçus.
9- Produit:
Résultat d'activités ou de processus.
10- Protocole : Descriptif de techniques à appliquer et/ou
de consignes à observer.
11- Qualité:Ensemble des caractéristiques d'une entité
qui lui confèrent l'aptitude à satisfaire des besoins exprimés
ou implicites.
12- Qualité
des soins:Niveau auquel parviennent les organisations de santé,
en terme d'augmentation de la probabilité des résultats souhaités
pour les individus et les populations, et de compatibilité avec l'état
des connaissances actuelles.
13- Référence:Énoncé d'une attente ou d'une exigence
permettant de satisfaire la délivrance de soins ou de prestations de
qualité.
14-Référentiel:Ensemble de références couvrant un
domaine d'activités d'un établissement de santé.
15- Traçabilité:Aptitude à retrouver l'historique, l'utilisation
ou la localisation d'une entité au moyen d'identifications enregistrées.
Retour sommaire
SITES INTERNET
GIGLEUX R., IRACANE M.,
« Mise en œuvre d'un banc de test de sécurité
électrique selon la norme ISO 17025 »,2001-2002, Projet
DESS "TBH", UTC.
https://www.utc.fr/~farges/dess_tbh/01_02/Projets/acc_secu_elec/accreditation.htm
BOISDE C., CASSARO J.,
DEROUBAIX A., MINARET G., SENECHAL J., « mise en œuvre d'un banc
d'un équipement de laboratoire, selon la norme ISO 17 025 »,
2001-2002, module GE 37, UTC.
DESGIPPES D., GALLOFRE
J., GANDON M., « La sécurité électrique des dispositifs
électromédicaux », 1999-2000, rapport
SPIBH, UTC.
FARGES G., « sécurité
électrique des dispositifs médicaux », cours de juillet
2001.
FARGES G., LABARRE A.,
LORIMIER A., TAUPIAC S., « Contrôle qualité et NF EN 45
001 : du service biomédical au laboratoire biomédical »,
février 2001, vol 22 n°1, p6-8, RBM NEWS.
NF EN 45 001, «
Critères généraux concernant le fonctionnement des laboratoires
d'essais », décembre 1989, éditions AFNOR.
NF EN 60 601-1, «
Appareils électromédicaux : règles générales
de sécurité », novembre 1990, éditions AFNOR.
NF EN ISO/CEI 17 025,
« Prescriptions générales concernant la compétences
des laboratoires d'étalonnages et d'essais », mai 2000, éditions
AFNOR.
NF EN 9001 : 2000,
« Systèmes de management de la qualité, Exigences »,
décembre 2000, éditions AFNOR.
REVOIL G., « Assurance
qualité dans les laboratoires d'analyses et d'essais », éditions
AFNOR,
1995.
REVOIL G., « Qualité dans les laboratoires d'analyses
et d'essais », éditions AFNOR,
2001.
Retour sommaire