| Projet DESS "TBH", UTC, 02-03, pp 52 , URL : https://www.utc.fr/~farges/dess_tbh/02-03/Projets/vbpb/vbpb.html PROCESSUS DE VALIDATION D'UN SERVICE BIOMEDICAL EN BONNES PRATIQUES BIOMEDICALES |
|
 Emmanuel BERENGER |
|
| |
| Si vous arrivez directement sur cette page sachez que ce travail est un rapport d'étudiant(e)s et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé lors de la période d'enseignement théorique à l'UTC et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part. L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
| Université de Technologie de Compiègne |
| Projet DESS "TBH", UTC, 02-03, pp 52 , URL : https://www.utc.fr/~farges/dess_tbh/02-03/Projets/vbpb/vbpb.html PROCESSUS DE VALIDATION D'UN SERVICE BIOMEDICAL EN BONNES PRATIQUES BIOMEDICALES |
|
 Emmanuel BERENGER |
|
| Suite à la publication du Guide des
Bonnes Pratiques Biomédicales en Etablissement de Santé
en novembre 2002, référentiel métier de la communauté
biomédicale, il reste à celle-ci à le mettre
en œuvre et à l’améliorer. |
| After the publication in November 2002 of
“Guide to good biomedical practices in Health Care Establishments”,
the biomedical community is now in the position to implement and improve
on its conditions. |
Nous tenons tout d’abord à remercier Monsieur
FARGES de nous avoir donné l’opportunité de traiter ce sujet,
de nous avoir suivis et orientés tout au long de notre étude,
ainsi que Monsieur CHEVALLIER pour sa contribution.
Un merci particulier à Mme KERTESZ et M.AUFFRET de l’Agence Française
Nationale de Normalisation ( AFNOR) de l’aide qu’ils ont pu nous
apporter.
Nous remercions également M.GHOMARI Ingénieur Biomédical
du CHU de Rouen et M.JABORSKA du CH de CREIL qui ont bien voulu répondre
à nos questions.
Nous tenons à remercier également les différents intervenants
rencontrés lors de nos cours de DESS TBH pour les conseils qu’ils
ont pu nous fournir.
Que toutes ces personnes veuillent trouver ici l’expression de notre reconnaissance
et de notre gratitude.
I Etat de l’art des autres référentiels
2.5. Evaluation par une deuxième partie
2.6.
Evaluation par une tierce partie
3.4. La Déclaration de Conformité
3.5. La Charte Qualité Service Biomédical
3.6. La Certification NF Service Biomédical
L’accréditation des établissements
de santé, la réglementation (décrets de maintenance du
5 décembre 2001 [1], arrêté du 3 octobre 1995 [2],…)
justifient la mise en place d’une démarche qualité au sein
des services biomédicaux.
Comme suite à l’élaboration et à
la publication en novembre 2002 du « Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé »[3], référentiel
métier de la communauté biomédicale, il revient à
celle-ci à le mettre en œuvre et à l’améliorer.
Les services biomédicaux
volontaires à l’application du guide par eux-mêmes ont besoin
d’éclairage sur l’évaluation et la validation.
Le fait de pouvoir se valider
« bonnes pratiques biomédicales » permettrait aux
services biomédicaux d’obtenir la reconnaissance des services rendus
et donc de la profession.
L’objet de ce rapport consiste à apporter
des propositions sur le processus d’évaluation et de validation
d’un service biomédical en « bonnes pratiques biomédicales ».
I. ETAT
DE L’ART DES AUTRES REFERENTIELS:
Les guides de bonnes pratiques sont déjà nombreux dans le monde de la Santé. Citons par exemple les « Bonnes Pratiques de Laboratoire » [4], les « Bonnes Pratiques de Pharmacie Hospitalière » [5], la « Bonne Exécution des Analyses de Biologie Médicale (GBEA)» [6], le « Guide des Bonnes Pratiques d’Hygiène » [7].
Avant d’aborder notre étude sur la validation
d’un service biomédical en « bonnes pratiques biomédicales »,
nous avons analysé ces guides afin d’apprécier si la communauté
biomédicale pouvait s’inspirer de leurs expériences.
a) Guide des Bonnes Pratiques de Pharmacie Hospitalière:
· Il existe un Arrêté Ministériel
: Arrêté du 22 juin 2001 relatif aux Bonnes Pratiques de Pharmacie
Hospitalière.
· Il a été crée un
manuel d’auto-évaluation pour permettre l’utilisation de
ce guide.
· L’évaluation se base sur
la méthode de « l’Audit Clinique » [8] de
l’ANAES qui consiste à une
auto-évaluation.
b) Guide des Bonnes Pratiques de Laboratoire:
· Il existe un Arrêté Ministériel
: Arrêté du 14 mars 2000 relatif aux bonnes pratiques de laboratoire.
· Ce référentiel d’organisation et
de conformité est d’application soit volontaire (Laboratoire d’étude),
soit obligatoire (Industries pharmaceutiques).
· Le Conseil Canadien des Normes à élaborer
un document relatif à la reconnaissance du respect des principes de Bonnes
Pratiques de Laboratoire. (correspond à une auto-déclaration de
conformité) [9].
c) Guide des Bonnes Pratiques d’Hygiène:
· Principes élaborés par
un fascicule de documentation publié par l’AFNOR en mars 1995.Ce
fascicule porte sur la méthodologie d’élaboration d’un
guide de bonnes pratiques d’hygiène.
· La décision de mise en œuvre
d’un guide vient des professionnels eux-mêmes mais ils peuvent avoir
recours à des personnes extérieurs qui se chargeront de la rédaction
en liaison constante avec la profession concernée.
· A la suite de la publication de la directive
93/43 CEE, la procédure de validation nationale a été précisée
par un avis publié par le Journal Officiel du 24 novembre 1993.
Ce bref aperçu nous montre que chacun de ces
guides possèdent ses propres caractéristiques.
En règle générale, tous ces référentiels
sont étroitement liés à des arrêtés ou des
directives ministériels.
En ce qui concerne l’évaluation, certains
comme les « Bonnes Pratiques de Pharmacie Hospitalière »,
s’appuient sur la méthode de « l’Audit Clinique »
de l’ANAES qui consiste à une auto-évaluation.
Quant à la validation, il
n’existe pas vraiment de « modèle ».
Pour certains, des solutions ont été proposé,
comme par exemple le Conseil Canadien des Normes qui a élaboré
un document relatif à une auto-déclaration de conformité
pour les Bonnes Pratiques de Laboratoire.
Définition : Examen méthodique et indépendant en vue
de déterminer si les activités et résultats à la
qualité satisfont aux dispositions préétablies et si ces
dispositions sont mises en œuvre de façon effectives et sont aptes
à atteindre les objectifs.
Avant d’étudier les possibilités
d’évaluation au sein d’un service biomédical, précisons
les conditions qui s’avèrent nécessaire à une bonne
démarche.
Elles conduisent à préciser le rôle
déterminant de deux acteurs essentiels que
sont les responsables et le personnel biomédical.
En effet, l’implication claire des responsables
constitue un facteur déterminant pour la réussite d’une
politique d’évaluation des pratiques et d’amélioration
de la qualité au sein du service biomédical.
Cet engagement des responsables doit reposer sur un
objectif clair et précis. Il doit être explicite et se concrétiser
dans le cadre d’une déclaration formelle d’intention.
En effet, sans un tel engagement, la conduite d’une
démarche volontaire pendant un temps donné, est toujours possible,
mais les chances de pérennité et d’extension sont hypothétiques.
L’implication des responsables a également
objet d’assurer la coordination entre les actions engagées et l’organisation
générale ainsi que d’apprécier et de réunir
les moyens nécessaires qui pourront apparaître en fonction du développement
des actions.
L’engagement du service biomédical est
essentiel. L’évaluation est une démarche qui peut être
difficile à mettre en œuvre, tant au plan technique qu’au
plan de la culture professionnelle, dans la mesure où elle va obliger
une argumentation des pratiques qui feront l’objet de l’étude.
L’ensemble de ces actions, engagées par
le personnel du service biomédical, devront être respectées
dans ses dimensions individuelles et collectives.
L’évaluation est importante dans un environnement
privilégiant l’obtention de résultats parce qu’elle
offre un retour d’informations sur l’efficience, l’efficacité
et les performances des pratiques professionnelles. Elle peut donc présenter
une importance essentielle pour l’amélioration de ces pratiques
et l’innovation dans le domaine concerné.
L’objet générale d’une évaluation
est « d’apprécier les faits » et de « les
comparer aux attentes ». Ceci suppose de mesurer, de recueillir de
l’information sur la situation pour savoir ce qui s’est passé et de s’interroger
sur ce que l’on souhaitait ou ce que l’on attendait (objectifs,
normes, référentiels…).
L’évaluation consisterait à comparer
ce qui s’est réalisé par rapport à ce qui est attendu.
Ceci suppose donc que l’on dispose de référentiels de pratiques
(recommandations de bonnes pratiques, références…) qui soient
validés au plan scientifique et adaptés à la pratique.
Cette comparaison entre la pratique et le référentiel
vise à améliorer celle-ci (et éventuellement le référentiel)
pour apprécier si les écarts étaient justifiés ou
non : il s’agit d’une « rétroaction »
(Figure 5 : Cycle de l’auto-évaluation).
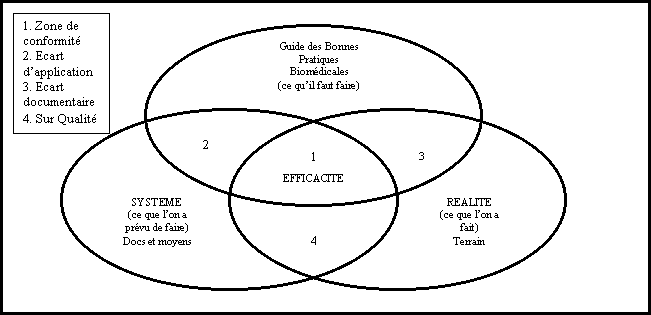
Fig.1 Evaluation : outil de mesure de l’efficacité
du système de management
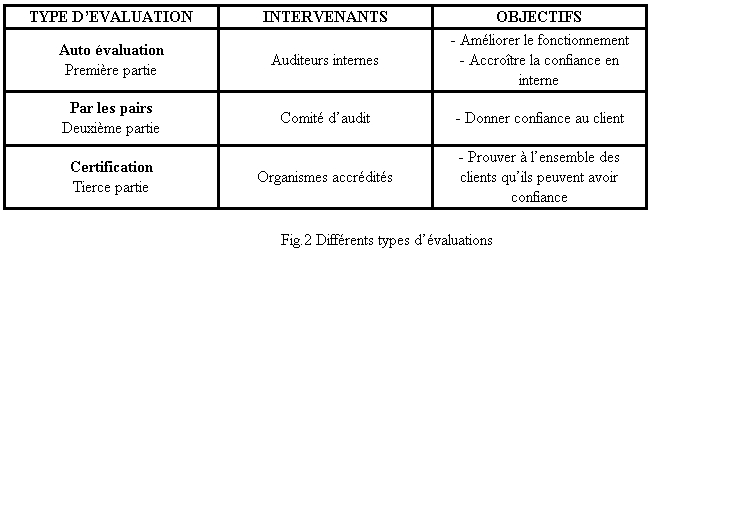
Il existe différents types d’évaluations
suivant les objectifs que l’on souhaite atteindre.
(Fig.2 Différents types d’évaluations)
Effectivement, si l’on souhaite uniquement améliorer
nos pratiques en interne une auto- évaluation est suffisante,
encore appelée évaluation par une première partie. En d’autres
termes le service biomédical lui-même réalise l’évaluation.
Il existe également l’évaluation
par une deuxième partie, ou évaluation par les pairs. Le
service biomédical inviterait , par exemple, un client potentiel à
vérifier que les services qu’il propose sont conformes au Guide des Bonnes Pratiques
Biomédicales en Etablissement de Santé.
Dans le cas du service biomédical on peut imaginer
un Comité d’audit qui serait composé de différents
membres de la profession (AFIB, AAMB, ATD…).
Enfin l’évaluation par une tierce
partie, qui correspond à une certification. Dans ce cas, l’évaluation
est réalisée par un organisme indépendant extérieur
aux structures du service biomédical. Si le système de management
ou les pratiques du service biomédical sont conformes aux références
du guide, l’organisme délivrerait un certificat de conformité.
Dans le cas de notre étude qui concerne la validation
d’un service biomédical en bonnes pratiques biomédicales,
ces trois types d’évaluations pourraient être nécessaires
suivant le procédé de validation retenu.
Définition : Examen systématique effectué par l’
organisme lui-même en vue de déterminer dans quelle mesure il est
capable de satisfaire à un certain nombre d’exigences.
L’auto-évaluation a pour objet d’évaluer
l’efficacité et l’efficience par rapport à des critères
définis, et d’établir des plans d’actions.
Elle doit permettre au responsable du service biomédical
de vérifier la mise en œuvre des dispositions, leurs adéquations
aux références du Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé pour maintenir et améliorer le système
Qualité au service du patient.
L’auto-évaluation est :
· un examen complet,
· systématique,
· régulier,
des activités et résultats du service biomédical par comparaison
aux références du Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé.
L’auto-évaluation a pour objet :
· l’identification
claire des points forts,
· l’identification
des domaines à améliorer,
en vue d’améliorations planifiées et suivies.
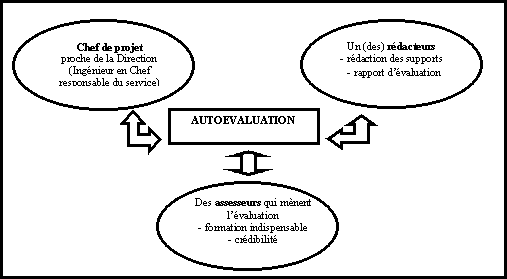
Pour être bien menée l’auto-évaluation
nécessite différents acteurs.
Le choix de ces acteurs doit assurer objectivité et impartialité
du processus d’évaluation.
L’auto-évaluation nécessite ainsi :
· un pilote ou Chef
de projet qui doit être proche de la Direction.
Dans le cas du service biomédical celui-ci pourrait être
l’Ingénieur biomédical (accompagné d’un Responsable
qualité s’il existe dans l’établissement concerné).
·
un (des) rédacteur(s) :
- rédigent les supports (« traduction »
du Guide des Bonnes Pratiques Biomédicale en Etablissement de Santé :
grilles d’évaluation)
- rédigent le rapport d’évaluation (données
quantifiées et vérifiables).
· un (ou des) assesseur(s), qui mènent l’évaluation :
- une formation complète est indispensable,
- doivent être crédibles.
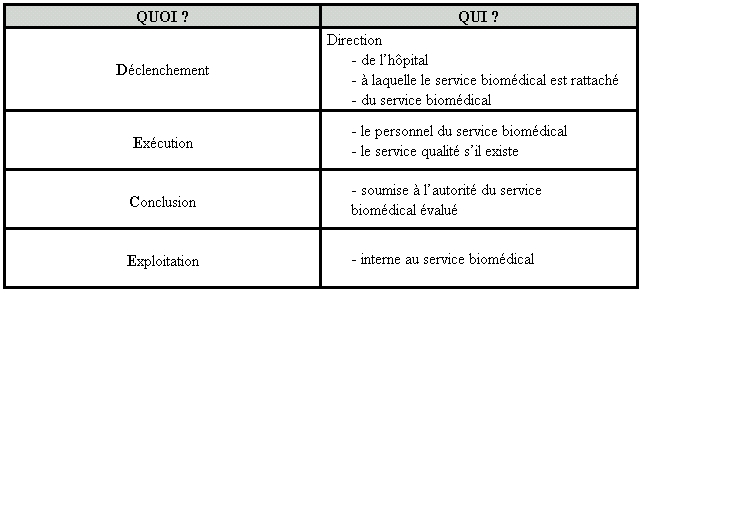
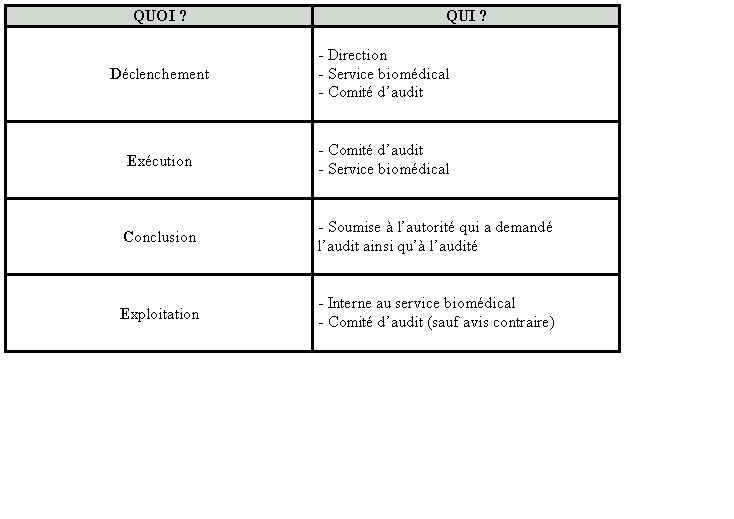
Les principaux champs de responsabilité sont
présentés dans le tableau ci-dessous.
On y retrouve les principaux acteurs responsables du champ d’application
correspondant.
2.4.4. Méthodologie
de l’auto évaluation :
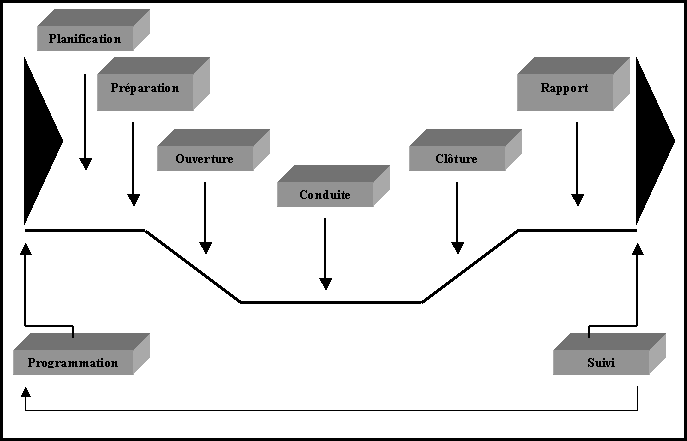
a) Processus général :
Avant
d’entrer dans le détail de chaque étape de l’auto
évaluation, présentons le processus général sous
la forme d’un organigramme.
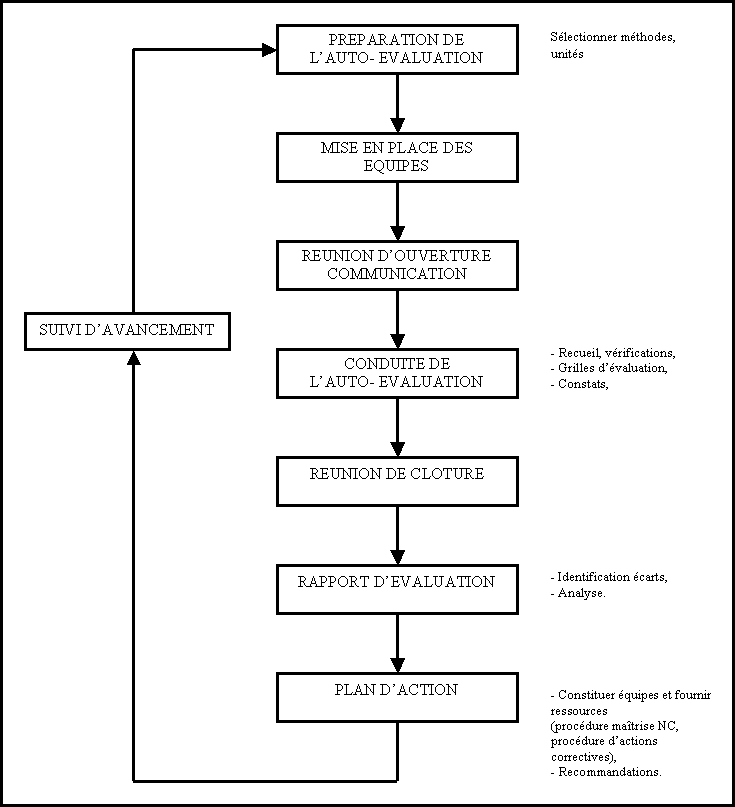
b) Les étapes de l’auto évaluation :
· Engagement du service :
Pour la bonne réussite de l’évaluation, il est indispensable que le personnel du service soit motivé et impliqué, mais il faut également que l’équipe de Direction soit engagée.
· Préparation :
Cette préparation est l’œuvre du Chef
de projet désigné (ainsi que du Responsable qualité s’il
existe).
Elle implique de :
1. Réexaminer les références
du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé,
2 Définir le cadre d’action
de l’évaluation et ses finalités : procédures,
services, processus…Il s’agit en fait des différents éléments
liés aux bonnes pratiques opérationnelles et fonctionnelles du
Guide des Bonnes Pratiques Biomédicales en Etablissement de santé,
3. Analyser les documents élaborés
au sein du service (procédures, logigrammes, enregistrements…)
qui seront examinés lors de l’évaluation,
4. Elaborer le questionnaire qui va permettre le recueil et la
vérification des données : grilles d’évaluation
construites à partir du Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé.(voir annexe exemple de grille d’évaluation),
- les procédures de maîtrise des non conformités,
(voir annexe),
- les procédures d’actions correctives,
(voir annexe)
- les formulaires de traitement de non conformité,
- les formulaires d’action corrective…(voir
annexe).
5. Etablir le plan d’audit :
- lister l’ensemble des activités à
auditer par rapport aux BPO et BPF du Guide des Bonnes Pratiques Biomédicales
en Etablissement de santé,
- lister les personnes à auditer,
- établir une chronologie ( date et heure de
l’inspection de chaque activité),
- faire valider la préparation par la personne
et/ou fonction habilitée (si nécessaire).
· Mise en place de l’ équipe :
L’équipe chargée de l’évaluation
est établie par le Chef du projet.
Pour décider de la taille et de la composition
de l’équipe, il est recommandé de tenir compte des éléments
suivants :
· Réunion
d’ouverture :
L’ensemble du personnel concerné doit être
informé. C’est à dire non seulement le personnel du service
biomédical mais peut être également celui des services techniques
ou d’ailleurs (ex : maintenance table d’opérations peut
être effectué par le service technique).
La Direction doit également être impliquée.
= Communication
sur le projet
Pour cela une réunion d’ouverture est nécessaire afin que tous soient informés.
Sous la responsabilité du Chef de projet, la
réunion d’ouverture doit comprendre :
· Conduite
de l’auto-évaluation :
Elle correspond à un recueil de données
et à la vérification d’informations.
Recueil et vérification :
Les informations peuvent être obtenues et vérifiées
de différentes façons et auprès de différentes sources
telles que :
- entretiens,
- observation des activités, de l’environnement
et des interfaces entre les fonctions,
- documentations, plans, procédures documentées, instructions,
spécifications, dessins, commandes,…
- enregistrements, tels que enregistrements de contrôle, procès
verbal,
- rapports provenant d’autres sources, par exemple rapports externes et
évaluations de fournisseurs…
- résumés et analyses des données, mesures et indicateurs
de performance.
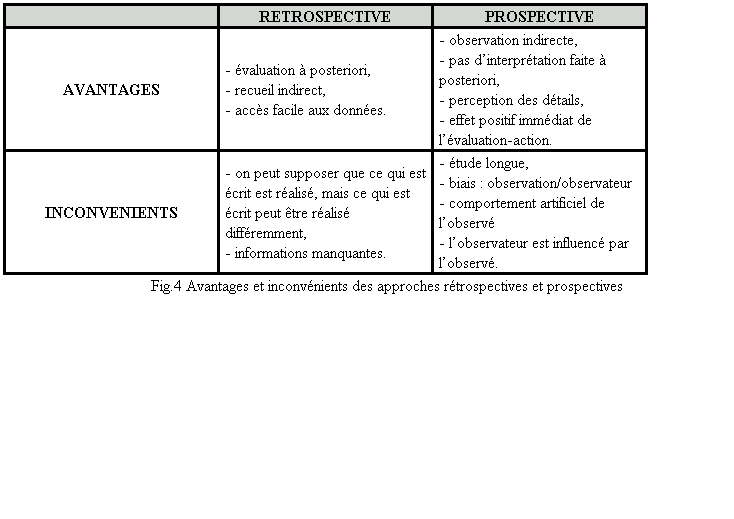
La méthodologie
générale de l’auto-évaluation est descriptive, avec
un recueil de données et de vérifications rétrospectifs
ou prospectifs.
- L’approche
rétrospective est définie comme « une technique
où l’on applique les critères de mesure à des situations
passées ». Elle évite les biais liés à
l’observation directe mais souffre de données colligées
de façon incomplète.
- A côté de cette modalité classique, l’auto-évaluation peut se réaliser de façon prospective. Elle prend alors la forme d’une évaluation-action.
L’approche
prospective est définie comme « une technique permettant de
suivre un échantillon de sujets afin d’étudier les phénomènes
qui les affectent au cours du temps, sous les yeux de l’évaluateur,
et d’appliquer les critères d’évaluation au fur et
à mesure du déroulement des événements ».
Dans ce cas, l’évaluation prend la forme d’entretiens ou
d’observations directes qui sont plus délicats à entreprendre.
Cette modalité est parfois nécessaire, mais l’observation
induit bien évidemment un changement conscient ou inconscient des pratiques.
2. Grille
d’évaluation :
Pour effectuer le recueil des
données il est nécessaire d’avoir un outil qui peut
être une grille d’évaluation. Cette grille peut être
construite sur la base du référentiel qui est en l’occurrence
le Guide des Bonnes Pratiques Biomédicales en Etablissement de
Santé.
Dans l’absolu, il serait même possible de créer un manuel d’auto-évaluation qui respecterait totalement le texte du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé selon une articulation différente (voir annexe exemple).
Ex : BPO-04-2 :
Plan du service biomédical
Le
plan du service biomédical est établi et consultable facilement
dans le service.
On y retrouve les différentes zones dédiées à
son activité.
Dans la grille d’évaluation deviendrait :
Le
plan du service biomédical est-il établi et est-il consultable
facilement dans le service ?
Y retrouve-t-on les différentes zones dédiées à
son activité ?
(exigence BPO-04-02 Plan du service biomédical)
L’appréciation de chaque réponse entraîne l’attribution d’un score qui pourrait être compris entre 1 et 4. Une des cases 1, 2, 3 ou 4 devant être obligatoirement cochée, sauf si la question n’est pas applicable, selon la pondération suivante :
- un
score égal à 1 signifie que l’objet de la question
est totalement réalisé.
- un score égal à 2 signifie que l’objet de la question
est partiellement réalisé.
- un score égal à 3 signifie qu’une réflexion
sur l’objet de la question est en cours.
- un score égal à 4 signifie que l’objet de la question
n’est pas réalisé.
- lorsqu’une question ne s’applique pas la case NA (non applicable)
serait cochée.
3.
Constats d’évaluation :
- L’évaluation
des preuves recueillies par rapport aux critères du Guide des Bonnes
Pratiques Biomédicales en Etablissement de Santé doit aboutir
à un constat.
Ce constat pouvant en d’autres termes être une conformité
ou une non-conformité.
- Les membres de l’équipe
d’évaluation revoient leurs constats à intervalles
adéquats au cours de l’évaluation, et notamment avant
la réunion de clôture avec la personne concernée.
- Les non-conformités
par rapport aux références du Guide des Bonnes Pratiques
Biomédicales en Etablissement de Santé sont identifiées
et enregistrées de manière claire et concise, comprise par
la personne concernée et corroborées par des preuves d’évaluation.
(nécessité d’une documentation d’appui :
voir annexe formulaire de non-conformité)
- Il y a lieu de revoir les non-conformités avec la personne concernée par l’activité évaluée pour obtenir un constat de faits. Par sa reconnaissance des faits, elle indique que les faits contenus dans le rapport de non-conformité sont exacts et déclare qu’elle a compris la non-conformité.
Toute divergence d’opinion
concernant les faits doit être résolue. Les points non résolus
doivent être enregistrés.
· Réunion de clôture :
Suite à l’évaluation il est nécessaire
d’effectuer une réunion de clôture.
Au préalable, les membres de l’équipe d’évaluation
se réunissent pour la préparer et :
La réunion de clôture :
elle est dirigée par le Chef de projet, en présence des
personnes présentent au cours de la réunion d’ouverture,
elle a pour objectifs de :
Pour accroître les chances de réussite, l’équipe d’évaluation doit :
-
Présenter des observations de l’évaluation,
- Effectuer une synthèse et une conclusion claire et objective,
- Obtenir l’accord du personnel évalué,
- Utiliser un mode impersonnel,
- Accorder le bénéfice du doute,
- Ne pas mettre la Direction en porte à faux devant ses collaborateurs,
- Ne pas faire de suggestions à priori,
- Ne pas juger la compétence des individus,
- Eviter l’effet de surprise.
·
Rapport d’évaluation :
Le Chef de projet
est chargé de la préparation, de la précision et
de l’exhaustivité du rapport d’évaluation.
En règle
générale le rapport d’évaluation doit
contenir des conclusions sur :
- la
conformité du système de management aux critères
d’évaluation définis par le Guide des Bonnes Pratiques
Biomédicales en Etablissement de Santé,
- la
mise en oeuvre efficace du système de management dans le champ
de l’évaluation.
Mais il doit
fournir également un compte rendu fidèle de l’auto-évaluation
et contenir des conclusions telles que :
1. Sur la base des données recueillies, dresser un bilan qui pourrait comprendre :
- le pourcentage d’observations complètes, incomplètes, absentes ou inexploitables,
- l’analyse globale des résultats, critère par critère, afin d’effectuer la comparaison avec les standards définis par le Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé.
2.
Identifier les écarts :
Les résultats peuvent être présentés sous forme de tableaux synthétiques ou sous la forme de diagramme radar…
3. Les analyser, déterminer leurs causes :
Cette analyse se fait bien sûr au sein de l’équipe de l’évaluation.
La mise en évidence d’écarts entre l’observation et les références du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé conduit à en rechercher les causes qui peuvent correspondre aux types suivants :
-
causes professionnelles : les procédures, pratiques
établies peuvent être incompatibles ou inadaptées.
La formation pour leur application peut aussi être insuffisante,
ou leur application déficiente pour des raisons diverses,
- causes
organisationnelles : un défaut de coordination entre les
différents professionnels, souvent lié à des moyens
de communication insuffisants (écrits et/ou oraux),
- causes institutionnelles :
liées à des moyens inadéquates ou mal employés…
4. Les informations propres à l’évaluation :
- les constats d’évaluations : conformités et non-conformités,
- l’identification des membres de l’équipe d’évaluation,
- un résumé du processus de l’évaluation, y compris tous les obstacles rencontrés,
- une liste
de diffusion pour le rapport d’évaluation car celui-ci
doit bien sûr être diffusé,…
·
Plan d’action :
Le rapport d’évaluation donne lieu aux plans
d’action.
C’est à dire à l’élaboration
d’actions correctives et préventives.
Il peut faire partie intégrante du rapport d’évaluation.
1. Les recommandations peuvent être hiérarchisées
en fonction de la facilité et de la rapidité de leur application,
2. Ces mesures correctives nécessitent éventuellement
d’être testées pour vérifier qu’elles
sont applicables et aptes à améliorer la qualité
des pratiques,
3. Les plans
d’action doivent proposer des priorités, des mesures concrètes
d’amélioration et un calendrier de réalisation.
Ils précisent les résultats attendus et les
moyens à mettre en œuvre.
Ils font donc partie intégrante du rapport d’évaluation
dont l’objectif est de permettre une amélioration de la qualité.
4. Le rapport, outre son rôle interne, permet ainsi d’expliquer la démarche aux professionnels concernés.
Une publication
peut aussi être souhaitable dans ce domaine de l’évaluation
où les références sont encore peu nombreuses.
Elle représente un élément de valorisation intéressant
du travail réalisé, mais ne sera envisagé que si
le potentiel d’amélioration a été démontré.
· Suivi
de l’avancement :
Le Chef de projet est chargé de déterminer et de déclencher toutes les actions correctives nécessaires pour traiter une non-conformité.
Il convient de mener des actions correctives et les actions de suivi ultérieures qui peuvent inclure des évaluations supplémentaires, dans des délais convenus.
Il convient
de vérifier les actions correctives conformément à
la procédure documentée appropriée. Un rapport de
suivi peut être préparé et diffusé d’une
façon similaire à celle du rapport d’évaluation
original.
En résumé :
1. Un dispositif de suivi est établi et
mise en œuvre à échéance fixée, impliquant
l’engagement du personnel concerné dans la durée,
2. Si
les résultats de l’évaluation ont révélé
des écarts significatifs, une nouvelle évaluation sera nécessaire
après la première étude. Le délai est adapté
en fonction, notamment, de la gravité de la situation et des écarts
constatés,
3. L’utilisation des mêmes outils
permet la comparaison avec les premiers résultats,
4. Le suivi est considéré comme une étape indispensable à la fermeture de la « boucle évaluative » et introduit le caractère dynamique de la démarche d’amélioration de la qualité, devant inspirer l’ensemble du cheminement méthodologique.
Figure 5 Le 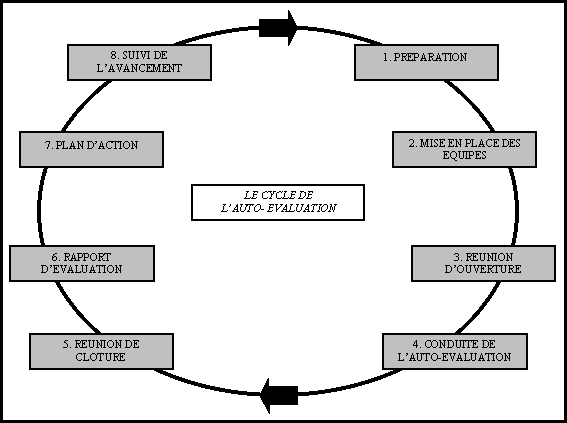 cycle de l’auto-évaluation
cycle de l’auto-évaluation
2.5. Evaluation par une
deuxième partie :
Définition : L’évaluation par une deuxième partie est réalisée par un client de l’organisme fournisseur. Le fournisseur invitera, par exemple un client potentiel à vérifier que les services qu’il propose sont conformes à un référentiel défini.
-
Elle correspondrait à une évaluation par
des pairs.
-
Elle devrait faire appel cependant à des assesseurs
expérimentés, sélectionnés parmi des cadres extérieurs
au service.
- Elle devrait permettre de donner confiance aux différents
clients.
- Comme on a pu le citer précédemment pour
ce qui concerne l’évaluation des services biomédicaux,
il serait intéressant de créer un Comité d’audit
qui serait charger d’effectuer ce type d’évaluation.
Une fois que l’auto-évaluation serait
menée dans le service biomédical, on pourrait constater de véritables
changements favorables.
Ce serait alors le moment de faire évaluer les résultats par
des pairs, et de s’organiser pour assurer la pérennité
de cette dynamique d’amélioration pendant et au-delà du
déroulement de cette évaluation afin d’obtenir la « validation
du service biomédical en bonnes pratiques biomédicales ».
C’est à dire :
Un Chef de projet proche de la
Direction qui aurait mené au préalable une auto-évaluation.
L’Ingénieur biomédical occuperait bien ce rôle.
Le personnel du service biomédical
audité (techniciens, adjoints techniques, ingénieurs, secrétaires,
magasiniers,…), motivé et préparé au préalable
par une auto-évaluation,
Des assesseurs expérimentés,
extérieurs au service.
Pour ce faire il serait donc intéressant
de créer un Comité d’audit qui serait le même
pour tous les services biomédicaux qui seraient motivés pour ce
lancer dans la « validation de leur service biomédical
en bonnes pratiques biomédicales ».
Bien évidemment ce Comité d’audit serait recomposé
périodiquement pour des raisons que l’on étudiera ultérieurement.
Et
il devrait être composé de titulaires et de suppléants pour
des raisons de disponibilités.
-
un (des) membre(s) de l’AFIB (Association Française des Ingénieurs
Biomédicaux), dont certains ont contribué à la réalisation
du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé,
et dont l’association représente nationalement la profession,
-
un (des) membre(s) de l’AAMB (Association des Agents de
Maintenance Biomédicale) ou ATD (Association des Techniciens
de Dialyse), pour avoir un regard du « technicien »,
sachant que celui-ci est une des « matières premières »
primordiale du service,
- un (des) membre(s) de l’UTC (Université
de Technologie de Compiègne) dont M.Gilbert Farges Enseignant-Chercheur
dans cette université est à l’origine du Guide des Bonnes
Pratiques Biomédicales en Etablissement de Santé, pour avoir
un « médiateur » au sein de ce Comité,
extérieur au monde professionnel, mais apportant
des connaissances non négligeables en matière de management
de la qualité,
- un (des) membre(s) de l’AFSSAPS (Agence Française
de Sécurité Sanitaire des Produits de Santé) pour avoir
un regard réglementaire,
- et un (des) représentant(s) des services de
soins de l’établissement concerné pour avoir un regard
du monde médical.
=> Au sein de ce Comité d’audit, il faudrait
nommer un Président du Comité d’audit qui
serait le principal interlocuteur au Chef de projet de l’établissement
audité.
Ce Président pourrait être un membre de
l’UTC sachant que celui-ci apparaît comme étant le plus
« neutre » et peut être le plus disponible.
=> Compétences du Comité :
Il
serait recommandé que les membres du Comité d’audit
aient reçu une formation pour développer les connaissances
et les capacités nécessaires à la réalisation
d’audits. Cette formation pourrait être effectuée par
l’UTC.
Ils devront être formés dans les domaines
suivants :
- la connaissance du Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé sur lequel les audits des services biomédicaux
seraient effectués,
- les techniques d’examen, de questionnement,
d’enregistrement des informations, d’évaluation et de
compte rendu,
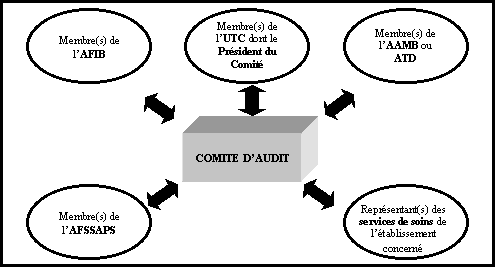
Figure 6 : Composition du Comité
d'audit
2.5.4. Méthodologie de l’évaluation par une deuxième partie :
a)
Introduction :
La méthodologie de l’évaluation
par une deuxième partie présente des similitudes avec l’auto-
évaluation vu précédemment.
La principale différence étant que les
auditeurs seraient des personnes extérieures au service biomédical
(Comité d’audit), et qu’un travail commun devrait être
entrepris.
Comme cité précédemment, nous allons retrouver des similitudes avec l’auto-évaluation. Avant d’entrer dans le détail de chaque étape, présentons le processus sous la forme d’un schéma.
c) Les étapes de l’évaluation par une deuxième partie :
· Programmation :
Cette étape serait plus d’ordre administrative, mais elle serait cependant décisive. C’est elle qui confirmerait si le service biomédical est prêt à être évalué.
Un séminaire de lancement aurait lieu entre le Comité d’audit et le service biomédical qui désirerait se faire auditer.
Pour ce faire
différents points devraient être traités :
1. Le service biomédical qui souhaiterait se faire auditer devrait envoyer un accord d’engagement à l’évaluation au secrétariat du Comité d’audit qu’il resterait à définir.
2. Après réception le Comité d’audit enverrait un courrier d’accueil au service biomédical dans lequel on pourrait trouver :
- un guide qui présente succinctement le Comité d’audit, les différents membres,…
- la description de la méthode utilisée, les documents nécessaires à la constitution du dossier,…
3. Le service biomédical enverrait les documents demandés au Comité d’audit comme :
- organigramme du service, taille de l’établissement,…
- manuel d’assurance qualité,
- rapport d’auto-évaluation,
- liste des plans d’action,
- procédures d’action corrective,…
4.
Revue de contrat technique par le Comité d’audit :
Après réception des documents et étude,
- confirmation de l’évaluation :
le service biomédical serait prêt à être évalué,
- confirmation de la/les dates de l’audit sur site,
- éventuellement demande de renseignements, documents supplémentaires,…
· Planification :
Elle correspondrait à la constitution de l’équipe d’audit.
En effet, le Comité d’audit qui serait composé d’Ingénieurs biomédicaux, d’adjoints techniques, techniciens,…en situation d’activité (et pourquoi pas retraités !!!); il serait nécessaire que le Président du Comité puisse réunir le nombre de personnes suffisant.
Pour décider de la taille et de la composition
du Comité, le Président pourrait tenir compte des éléments
suivants :
- les objectifs,
le champ, le ou les localisation(s) et la durée estimée de l’audit
en fonction de la taille du service biomédical audité,
- la nécessité de préserver l’indépendance
du Comité par rapport aux activités à auditer et d’éviter
les conflits d’intérêts,
- et comme pour l’auto-évaluation la capacité des membres
du Comité à travailler ensemble pour optimiser leurs compétences
et interagir efficacement avec l’audité de manière à
obtenir la combinaison collective des connaissances, d’aptitudes et de
qualité personnelles, nécessaire pour effectuer l’audit
de manière efficiente.
· Préparation :
Le Président du Comité élaborerait
avec le Chef de projet du service biomédical un plan pour les activités
d’audit qui peut contenir :
1. Définition de la finalité d’audit
2.
Délimitation du champ de l’audit
Le périmètre d’action, l’identification des sites, des activités qui sont essentielles pour atteindre les objectifs de l’audit,
3. Bien prendre connaissance du service biomédical audité
-
documentations et matériels,
- constitution du personnel, effectif, qualification,…
4. Instruction des dossiers,
5. Elaboration du plan d’audit
-
lister l’ensemble des activités à auditer,
- lister les personnes à auditer,
- établir une chronologie,…
6. Notification de l’audit
- pas d’audit surprise, il
doit être programmé (écrit préférable),
- suffisamment tôt à l’avance,
- la date, la durée de l’audit devraient être précisées
ainsi que les noms des membres du Comité d’audit.
· Réunion
d’ouverture :
L’ensemble
du personnel du service biomédical et les membres du Comité d’audit
devraient être présents.
Sous la responsabilité du Président d’audit
et du Chef de projet, la réunion d’ouverture pourrait comprendre :
1. la
présentation mutuelle des participants, y compris un résumé
de leur rôles et un encouragement à une participation active,
2. la revue des objectifs et le champ de l’audit
En cours de validation du
service biomédical ?
Reconnaissance des pratiques ?…
3. l’accord sur le calendrier de l’audit, avec le personnel du service biomédical, par exemple date de la réunion de clôture, toutes les réunions intermédiaires entre le Comité et le Chef de projet,
4.
une courte présentation des méthodes et procédures à
utiliser pour mener l’audit,
5.
la confirmation de circuits de communication officiels entre le Comité
d’audit et le service biomédical,
6.
la confirmation de la disponibilité de toutes les ressources et installations
nécessaires aux membres du Comité d’audit,
7. la
confirmation des questions relatives à la confidentialité,
8.
la confirmation que pendant l’audit, le service biomédical sera
tenu de l’avancement et que, si les objectifs de l’audit se révèlent
irréalisables, le Président du Comité en analyserait
les raisons avec le Chef de projet,
9.
la confirmation de la disponibilité, des rôles et de l’identité
de toute la documentation,…
En résumé
plan d’une réunion d’ouverture :
· Accueil
par la Direction du Comité d’audit,
· Présentation du Comité
d’audit et des interlocuteurs du service biomédical audité,
· Explication de la démarche
d’audit,
- Finalité,
- Champs,
- Programme (modification éventuelle compte tenu
des contraintes),
- Déontologie du Comité d’audit :
pas de culpabilisation, pas d’inquisition,
- Objectifs de l’audit : amélioration,
action de progrès, reconnaissance, validation,…
- Confidentialité du Comité d’audit,
· Appel à la coopération,
à la transparence.
· Conduite
de l’évaluation :
Là
encore nous allons retrouver la méthode utilisée pour l’auto-évaluation,
mais ici l’évaluateur est le Comité d’audit.
On identifiera ici que des règles générales
liées à l’évaluation.
Elle se déroulerait selon le plan établi en respectant
les délais impartis.
Son principal objectif étant d’établir les
points forts et les points à améliorer dans l’optique
d’aboutir à un consensus.
Elle se baserait
sur :
1. Recueil
et vérification de données :
Les informations seraient obtenues
de la même manière que pour l’auto- évaluation (entretiens,
observations, documentations,…).
2. Outils
pour l’enregistrement du recueil des données :
Là encore le Comité
d’audit devrait utiliser des outils pour recueillir les données
qu’il aurait élaboré au préalable avec les différents
membres (grilles d’évaluation, manuel d’évaluation
bâtis sur le Guide des Bonnes Pratiques Biomédicales en Etablissement
de Santé…).
Et ici il s’agirait d’exiger des preuves :
- Pourrais-je
voir le document ?
- Pouvez-vous me donner le document d’enregistrement ?
- Puis-je examiner…
- Présentez-moi la liste Réf ?…
Et lorsque un problème
serait constaté il faudrait l’exposé clairement à
l’audité (il peut ne pas être d’accord).
3. Maîtrise
du temps :
Il s’agirait
aussi de maîtriser son temps et les délais fixés.
Il s’agirait alors de :
- laisser les questions de détail,
- poser les questions, sans en exiger les preuves (faire confiance…pour
les sujets mineurs que l’on sait par ailleurs conformes),
- poser les questions sans exiger de réponse : ce serait
un sujet de réflexion et d’amélioration à apporter
au Président du Comité,
- s’il restait des sujets importants à examiner, demander au
Président du Comité l’autorisation d’augmenter
la durée de l’audit …
4. Constats d’audit :
Il s’agirait donc pour les
membres du Comité d’établir des constats, c’est
à dire une évaluation des preuves recueillies par rapport aux
critères de l’audit (Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé). Ce qui correspondrait donc à une
conformité ou une non-conformité.
- les membres
du Comité devraient revoir leurs constats à intervalles adéquats
au cours de l’audit, et notamment avant la réunion de clôture
le personnel du service biomédical audité,
- les non-conformités
par rapport aux références du Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé seraient identifiées et enregistrées
de manière claire et concise, comprise par le personnel audité
et corroborées par des preuves d’audit,
- il y aurait lieu de revoir les non-conformités avec le personnel concerné pour obtenir un constat des faits.
Par sa reconnaissance
des faits, il indiquerait que les faits contenus dans le rapport de non-conformité
seraient exacts et déclarerait qu’il a compris la non-conformité,
- en signalant
la constatation (même non encore classées en non-conformité
ou remarque) au moment où ils les feraient et en réunion de
synthèse quotidienne, les membres du Comité permettraient de
faciliter la réunion de clôture et au service biomédical
de disposer d’un délai de réflexion pour proposer de possibles
actions correctives,
- les membres du Comité
rapporteraient des constatations, ils devraient faire état de faits
mais en aucun cas ne devraient émettre, ni au cours de l’audit,
ni dans leur rapport, de recommandation(s) incluant des moyens ni proposer
de solution(s), ils devraient rester neutre,
- toute divergence d’opinion concernant les faits devrait être résolue. Les points non résolus seraient alors enregistrés.
5. Il
serait judicieux également de déterminer un vocabulaire pour
moduler la gravité des constats :
- non-conformité : déviation par rapport à une référence spécifiée du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé. (fiche de non-conformité),
- remarque :
risque potentiel de déficience du système (fiche
de remarque),
- observation : point
verbal à améliorer mais ne présentant pas de risque (pourrait
être verbal).
· Réunion
de clôture :
Elle réunirait
les différents responsables de l’audit Chef de projet, Président
du Comité pour faire le point à la fin de l’examen sur le
terrain.
Elle permettrait :
- d’établir un premier bilan à chaud avec le service biomédical
et de lui faire part des principales constatations,
- de lever d’éventuelles ambiguïtés sur les écarts
constatés.
Mais au préalable le Comité d’audit devrait se réunir pour la préparer.
Il se réunirait
pour :
- revoir les constats et toutes
autres informations appropriées recueillies pendant l’évaluation,
- préparer une liste complète des constats d’évaluation,
- s’accorder sur les conclusions de l’évaluation,
- définir les rôles et les tâches pour la réunion
de clôture,
- discuter des actions de suivi de l’évaluation ultérieurs
si nécessaire.
La réunion de clôture : là encore elle serait dirigée par le Président du Comité d’audit, en présence du Chef de projet et de ses collaborateurs, elle aurait donc pour objectifs de :
- présenter les constats
et conclusions d’audit (comprises et acceptées par le service biomédical) :
- d’abord
les points forts,
- les points sensibles,
- et enfin les non-conformités et/ou remarques,
- résoudre
toutes les divergences d’opinion,
- à l’issu de cette réunion un procès verbal
de clôture d’audit pourrait être
signé par le Responsable du service biomédical et le Comité
d’audit, en assurant encore que le service biomédical a bien compris
le contenu de toutes les fiches annoncées.
- à ce stade d’avancement le Comité pourrait par expérience
apporter conseil quant aux plans d’action à mener pour effectuer
les actions correctives.
· Rapport
d’audit :
Le Président
du Comité d’audit serait chargé de la préparation,
de la précision et de l’exhaustivité du rapport d’audit.
Ce rapport
fournirait un compte rendu fidèle de l’audit et contiendrait des
conclusions telles que :
- l’identification
du service biomédical audité et du Comité d’audit
- les critères de l’audit (Guide des Bonnes Pratiques
Biomédicales en Etablissement de Santé), y compris les documents
la liste des documents de références sur lesquels s’est
appuyé l’audit,
- la (les) date(s) de l’audit et le(s) lieu(x) où il a été
réalisé,
- la période couverte par l’audit,
- les constats d’audits (non-conformités, remarques,…)
- l’identification du Chef de projet,
- l’identification des membres du Comité,
- un résumé du processus d’audit, y compris tous les obstacles
rencontrés,
- une liste de diffusion pour le rapport d’audit,
- la preuve que les objectifs et le champ d’audit ont été
respectés conformément au plan d’audit,
- une déclaration relative à la nature confidentielle du contenu
si nécessaire,…
Ce rapport complet et précis serait adressé
au Responsable du service biomédical dans les délais fixés.
On pourrait également fixé un délai de réponse pour
communiquer d’éventuelles observations.
· Suivi
de l’audit :
Le service biomédical serait chargé de déterminer et de
déclencher suite au rapport d’audit toutes les actions correctives
nécessaires pour traiter une non-conformité et donc l’établissement
d’un plan d’action.
Il conviendrait de mener les actions correctives et les actions de suivi ultérieurs
qui pourrait inclure des audits supplémentaires, dans les délais
convenus.
Il conviendrait également que le service biomédical informe le
Comité d’audit de l’état d’avancement des activités
d’action corrective.
Il conviendrait de vérifier les actions correctives conformément
à la procédure documentée qui sera mise en place.
Un rapport de suivi pourrait être préparé et diffusé
d’une façon similaire à celle du rapport d’audit.
2.6. Evaluation par une tierce partie :
Définition : L’évaluation par une tierce partie est réalisée par un organisme accrédité indépendant et extérieur aux structures du fournisseur et du client.
Elle
correspond à une certification.
L’organisme
vérifie si le système de management est conforme aux exigences
spécifiées.
Si le système est conforme à ces exigences l’organisme délivre
un certificat de validité.
C’est l’évaluation que certains services biomédicaux
ont dû entreprendre pour obtenir la certification ISO 9000.(Angers, Bourg-en-Bresse,
Rouen…)
Dans notre cas pour ce qui concerne le Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé, il faudrait que celui-ci soit reconnu comme
référentiel national pour pouvoir entreprendre une telle évaluation
basée sur ses références. Sujet que l’on étudiera
dans la troisième partie du projet.
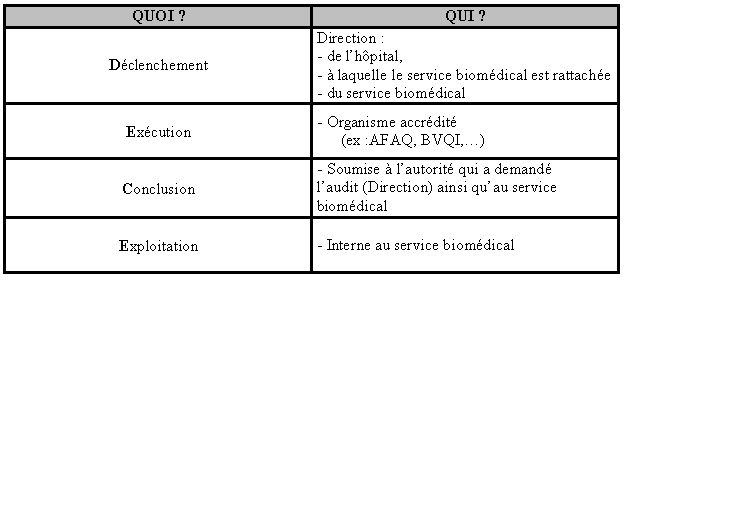
On retrouve comme pour les évaluations précédentes les mêmes acteurs pour ce qui concerne le service biomédical. C’est à dire :
Et les membres
de l’organisme accrédité :
·
Un responsable d’audit,
· Un ou plusieurs auditeurs.
2.6.4. Méthodologie de l’évaluation par une tierce partie :
a) Introduction :
L’évaluation par une tierce partie correspond
donc à une certification.
La méthodologie que nous allons décrire,
représente l’évaluation qu’un service biomédical
devrait entreprendre s’il souhaitait obtenir une certification « NF
Service Biomédical » [11] (voir Processus de validation).
b) Processus général :
Nous allons présenter
le processus sous la forme de logigrammes :
(Inspirés du Guide de l’Audit des Systèmes de Management
de l’AFAQ)
Notre étude portera sur le cas d’un audit initial.
- Logigramme A : Processus de certification,
- Logigramme B : Processus des audits,
- Logigramme C : Réalisation de l’audit
sur site,
- Logigramme D : Processus de prise de décision
de certification.
Légende utilisée :
- Ser Bio : service biomédical évalué
- CC : Comité de certification
- RA : Responsable d’audit -ChA : Chargé d’Affaires de l’organisme
- A : Auditeurs accrédité
- Org :
Organisme accrédité

1. Logigramme A : Processus de certification
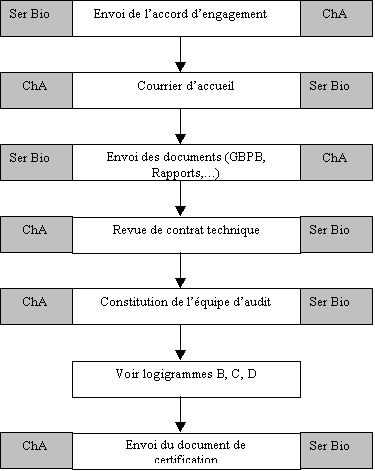
Notes explicatives :
· Revue de contrat technique : Après
réception des documents du service biomédical,
- confirmation du champ et du périmètre
de la certification,
- validation du libellé du futur certificat,
- confirmation de la ou les date(s) de l’audit,
- éventuellement demande de renseignements complémentaires.
· Constitution de l’équipe :
Critères étudiés,
- compétences métier,
- caractéristiques organisationnelles (structures simples, complexes,…)
- date(s) de l’audit,
- proximité géographique.
Elle serait composée
là aussi d’un Responsable d’audit et de un ou plusieurs
auditeurs.
· Envoi du document de certification :
Les documents suivants seraient joints,
- le rapport d’audit final, (sauf en l’absence
d’écart, le rapport est déjà en la possession
du service biomédical)
- le programme prévisionnel des audits de suivi et de renouvellement…
2. Logigramme
B : Processus de l’audit
simplifié
Dans un but de rendre l’organigramme simple et
compréhensible, nous avons quelquefois regroupé les destinataires
de documents.
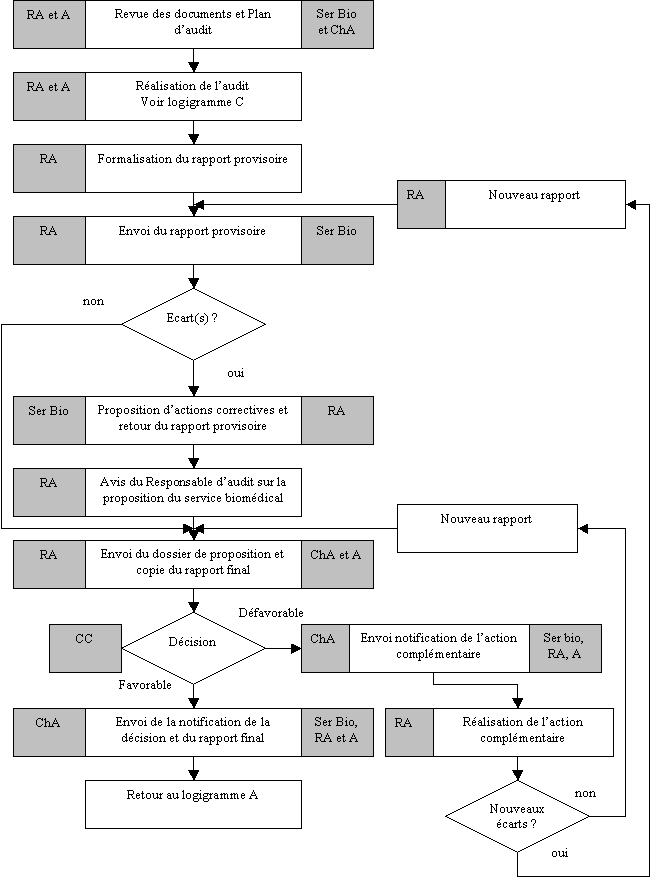
Notes explicatives :
· Revue des documents : A la réception
des documents transmis par le Chargé d’affaires,
- l’équipe d’audit (Responsable d’audit
et auditeurs) étudierait les documents afin de procéder à
leur revue,
- le Responsable d’audit établirait le plan prévisionnel
détaillé de l’audit qui permettrait au service biomédical
de prévoir la disponibilité, à leur poste, des personnes
auxquelles les auditeurs auraient à s’adresser lors de leur
passage sur les lieux de travail,
- ce plan serait adressé au service biomédical à temps
voulu,
- cette revue serait généralement réalisée sur
site avant le début de l’audit,
- au moment de la réunion d’ouverture, le plan d’audit
serait confirmé ou éventuellement modifié ou complété
à la demande du service biomédical et avec l’accord
du Responsable d’audit.
· Réalisation de l’audit :
Les fiches de non-conformités ou remarque :
Elles seraient établies
par l’équipe d’audit et acceptées par le service
biomédical en réunion de clôture, elles seraient alors
formalisées par écrit. Le Responsable d’audit devrait
laisser au service biomédical une copie des fiches pour lui permettre
de préparer sans attendre la réception du rapport provisoire.
· Envoi du rapport provisoire : Après
avoir complété les autres éléments du rapport
d’audit provisoire, le Responsable d’audit l’adresserait
directement au service biomédical.
· Proposition d’actions correctives :
Le service biomédical
disposerait d’un délai défini pour :
- définir les corrections et/ou actions correctives
qu’il aurait mis ou mettrait en œuvre et les dates cibles de
réalisation,
- renvoyer l’original du rapport d’audit provisoire au Responsable
d’audit avec, éventuellement, tout document apportant la preuve
de la mise en œuvre des actions correctives.
Le Responsable d’audit gèrerait
les relances et informerait le Chargé d’affaires si le service
biomédical ne respectait
pas les délais convenus.
· Avis du Responsable d’audit :
A réception de la réponse du service biomédical, dans
le cadre de l’envoi du rapport provisoire (fiches de non-conformité,
remarque) :
- le Responsable d’audit
porterait son commentaire sur la pertinence de cette réponse et la
date cible indiquée par le service biomédical,
- dans son commentaire, le responsable d’audit ne devrait pas se prononcer
sur la nature du prochain audit puisque la décision appartiendrait
au Comité de certification.
- sans preuves suffisantes fournies, le Responsable d’audit ne pourrait
se prononcer et cocherait la (les) case(s) concernée(s) « en
attente de vérifications »,
- et dans le cas contraire, il pourrait éventuellement lever la non-conformité
et/ou la remarque si les preuves suffisantes de l’exécution
de l’action corrective lui auraient été fournies.
· Nouveau rapport : Cette deuxième
vérification ne serait utilisée que lors d’un audit
ultérieur, que lorsque la première vérification n’aurait
pas pu conduire à la levée complète de la non-conformité
et/ou remarque.
· Envoi du dossier de proposition :
Après réception de la réponse du service biomédical,
le Responsable d’audit enverrait au Chargé d’affaires
le dossier de proposition qui comprendrait le rapport final d’audit
et sa fiche de proposition au Comité de certification.
D’autre part, en l’absence d’écart,
le responsable d’audit enverrait le rapport final d’audit simultanément
au service biomédical, au Chargé d’affaires et aux auditeurs
s’il y a lieu.
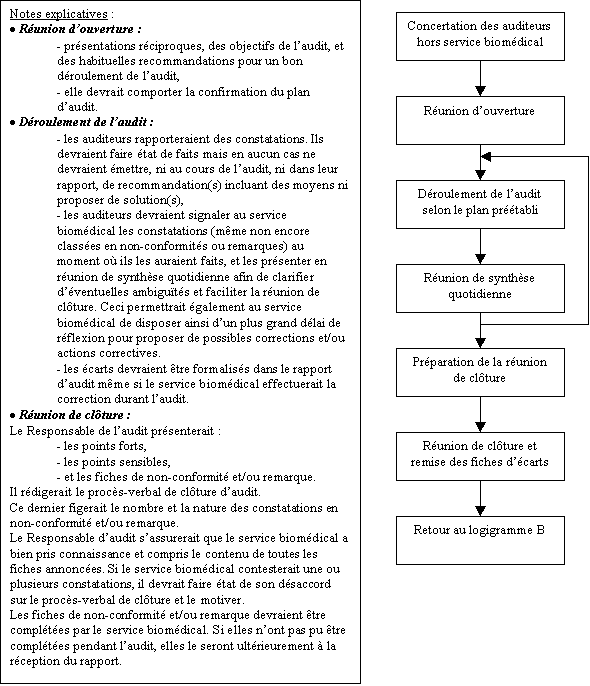
3. Logigramme C : Réalisation de l’audit sur site
4. Logigramme D : Processus de prise de décision de certification
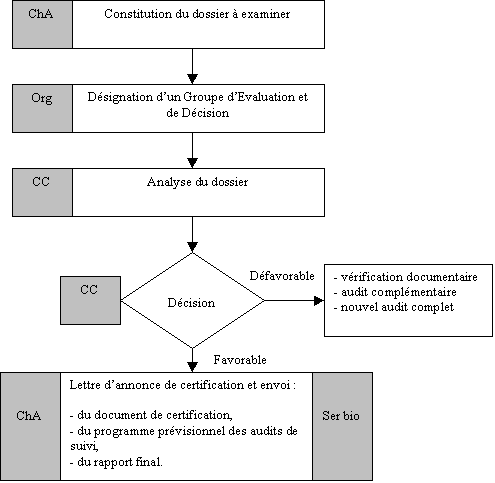

Notes explicatives :
· Dossier : il contiendrait :
- la présentation du service biomédical,
- la portée de la certification demandée par le service biomédical,
- le rapport d’audit,
- la fiche de proposition au Comité de certification remplie par le
Responsable d’audit en accord avec les auditeurs.
· Groupe d’Evaluation et de Décision :
Il devrait comprendre
obligatoirement des membres du Comité d’audit concerné
de telle sorte qu’il n’y aurait pas d’intérêt
dominant de l’un des collèges (fournisseurs et clients,…).
· Analyse du dossier :
Elle porterait de
façon non anonyme, sur :
- la pertinence et la cohérence du programme
d’audit par rapport au service biomédical et la demande de certification,
- la validation, la suppression ou le reclassement des non-conformités
et remarques telles que libellé dans le rapport d’audit,
- la réponse de l’organisme ainsi que les commentaires du Responsable
d’audit sur cette réponse, pour chaque non-conformité
ou remarque,
- la proposition du Responsable d’audit quant à la décision
à prendre.
· Prise de décision :
La certification ne pourrait
être délivrée tant qu’il resterait une non-conformité
non levée et/ou tant qu’il subsisterait une remarque non levée.
Un ensemble de remarques non levées en cours pourrait
être considéré comme constituant globalement une non-conformité.
Décisions
possibles après un audit de certification initial :
- certification immédiate,
- certification immédiate avec réalisation d’un audit
supplémentaire de suivi rapproché,
- certification immédiate avec un suivi documentaire sur certains points
particuliers à une période déterminée par le Groupe
d’Evaluation et de Décision. Ce suivi serait effectué
par l’organisme accrédité concerné,
- certification différée après constat d’exécution
d’actions correctives par :
- une vérification documentaire,
- un audit complémentaire,
- un nouvel audit complet.
L’évaluation apparaît donc bien aujourd’hui,
comme un point d’entrée pertinent pour développer la gestion
de la qualité et permettre la vérification de la bonne mise en
œuvre du Guide des Bonnes Pratiques Biomédicales en Etablissement
de Santé au sein d’un service biomédical.
D’autre part, elle s’inscrit dans les démarches
actuelles d’amélioration continue de la qualité, qu’elle
peut de surcroît initier.
Elle devra donc toutefois être progressivement
renforcée dans le cadre d’une approche plus structurée et
systématique (validation, certification ?) pour permettre d’entretenir
une dynamique de gestion continue des bonnes pratiques.
Afin que l’investissement fait dans un tel processus conduise à un résultat satisfaisant, il est nécessaire également de s’assurer que les objectifs visés peuvent être atteints et garantir la bonne mise en œuvre du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé.
III. PROCESSUS DE VALIDATION :
Définition : La validation est une confirmation par examen et apport de preuves tangibles que la mise en œuvre ou l’utilisation de tout processus, procédure, matériel ou produit, activité ou système permet réellement d’atteindre les résultats escomptés.
L’objectif de cette partie du projet est d’étudier
et de proposer un processus pour la validation d’un service biomédical
en bonnes pratiques biomédicales.
En effet, une fois qu’un service biomédical
à mis toutes les dispositions et actions nécessaires en œuvre
pour satisfaire aux références du guide (cf. rapport MM TAPPIE
& DHORNE Etudiants DESS TBH 2002-2003 : Processus de mise en œuvre
du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé);
celui-ci pourrait se faire évaluer par l’un des processus que l’on
a pu décrire précédemment pour faire vérifier qu’il
répond bien aux références du guide.
Cependant, suite à la mise en œuvre et à
l’évaluation des questions se posent :
- comment pourrait-il prouver sa conformité ?
- comment et qui pourrait lui délivrer un certificat de conformité ?
Avant de faire une étude sur un processus de
validation, on pourrait se poser la question pourquoi valider ?
En fait, M.Farges, Enseignant-Chercheur à l’Université
Technologique de Compiègne, dans l’introduction du Guide des Bonnes
Pratiques Biomédicales en Etablissement de Santé nous donne presque
la réponse.
Tout d’abord, l’origine du guide vient en
quelque sorte de la profession qui souhaitait démontrer ses capacités
professionnelles et obtenir une reconnaissance juste et impartiale des services
rendus.
Ce qui explique que le fait de « se valider
bonnes pratiques biomédicales » permettrait une reconnaissance
d’autant plus forte. Et d’autre part de valoriser la profession.
De plus, le fait de pouvoir « se valider
bonnes pratiques biomédicales » permettrait aux services biomédicaux
désireux de s’initier dans une démarche qualité de
faire le choix Guide des Bonnes Pratiques Biomédicales en Etablissement
de Santé.
Ainsi pour encourager le choix Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé, il serait nécessaire qu’il apporte une reconnaissance par un processus de validation.
Suite à plusieurs réflexions nous allons
proposer trois solutions permettant à un service biomédical de
« se valider bonnes pratiques biomédicales ».
Les trois solutions proposées ne sont que des
propositions et ne se veulent en aucun cas comme étant les seules.
De toutes les solutions envisagées, nous en avons
retenues trois avec des degrés de contraintes et d’applications
différentes.
C’est à dire :
- une Déclaration de Conformité
basée sur la norme ISO 17050
(en projet) [10], qui correspond à une auto-déclaration,
- une Charte Qualité délivrée
par les pairs,
- une Certification NF Service Biomédical
[11] qui serait délivrée par l’AFNOR.
3.4. La Déclaration de Conformité :
Définition : La Déclaration de Conformité correspond
à une attestation, émise par une première partie, indiquant
qu’un produit, un processus ou un système de management est conforme.
· Projet de norme ISO 17050 : Déclaration
de conformité [10]
La Déclaration de
Conformité correspond à un projet de norme ISO 17050, élaborée
par le Comité pour l’évaluation de la conformité
(CASCO) de l’Organisation Internationale de Normalisation.
L’objectif de cette déclaration est de
donner l’assurance que l’objet de la déclaration est conforme
aux exigences spécifiées auxquelles elle fait référence.
Elle indique clairement qui est responsable de cette conformité
et de cette déclaration.
En d’autres termes : un service biomédical
pourrait confirmer lui même par écrit que les services qu’il
fournit répond aux références du Guide des Bonnes Pratiques
Biomédicales en Etablissement de Santé.
Cette confirmation écrite est désignée
sous le nom :
Déclaration
de Conformité d’un fournisseur.
Elle correspond donc à une auto-déclaration.
En établissant une auto-déclaration de
conformité, un organisme fournisseur s’épargne ainsi
le coût d’une évaluation par tierce partie.
Un fournisseur peut décider d’adopter cette formule s’il
est convaincu que sa prestation est suffisamment bonne pour qu’il puisse
se dispenser d’obtenir une confirmation de conformité indépendante.
L’auto-déclaration
ne dégage cependant pas le fournisseur de son obligation de satisfaire
aux exigences pertinentes. Notamment en ce qui concerne les questions de responsabilités
du fait des services. C’est pourquoi pour les déclarations de ce
type, une surveillance efficace après déclaration est en générale
indispensable.
· Projet de norme ISO 17049 : Documentation d’appui relative à
la Déclaration de Conformité [10]
Pour aider les autorités compétentes dans
leurs activités de surveillance, et pour augmenter la confiance accordée
à la déclaration, il est possible de joindre une documentation
d’appui contenant les informations sur lesquelles le fournisseur se
fonde pour émettre sa demande.
La Déclaration de Conformité émise
par un fournisseur peut ainsi faire références aux résultats
des évaluations réalisées par une ou plusieurs première,
seconde et tierce partie.
La Déclaration de Conformité peut ainsi
être mieux acceptée avec un dossier contenant des informations
sur lesquelles le fournisseur fonde sa déclaration.
3.4.2. Application au service biomédical :
a)
Démarche générale :
Décrivons tout d’abord sous la forme d’un organigramme la démarche que devrait suivre un service biomédical pour qu’il puisse établir une Déclaration de Conformité suite à la mise en œuvre du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé.
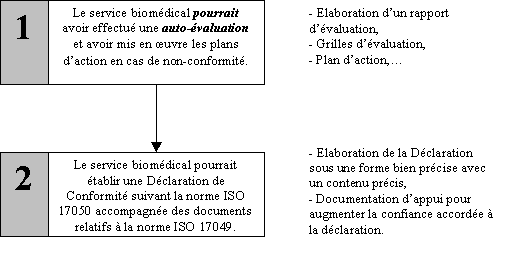
b)
Exigences générales :
Le service biomédical qui émettrait une
Déclaration de Conformité serait responsable de
cette déclaration ainsi que de son contenu (références
du Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé).
La déclaration devrait être fondée
sur une évaluation réalisée par une première
partie (auto-évaluation) et éventuellement une seconde
partie (pairs : Comité d’audit).
Dans le cas où il aurait reçu le concours
des pairs pour l’évaluation il pourrait donc l’indiquer
sur la déclaration.
c) Contenu de la déclaration :
Le service biomédical qui émettrait une déclaration
devrait s’assurer qu’elle contient suffisamment d’informations
pour permettre :
- de l’identifier,
- d’identifier le Guide des Bonnes Pratiques Biomédicales en
Etablissement de Santé qui correspondrait aux références
du guide,
- d’identifier le signataire de la déclaration.
Elle devrait au moins contenir
les informations suivantes :
- le nom et l’adresse du
service biomédical,
- l’objet de la déclaration : « Service
biomédical conforme aux Guide des Bonnes Pratiques Biomédicales
en Etablissement de Santé»,
- la déclaration de conformité,
- les exigences de référence : « Guide
des Bonnes Pratiques Biomédicales en Etablissement de Santé »
- la date et le lieu d’émission de
la déclaration,
- la signature ou signe équivalent de validation,
les nom et fonction de la(des) personne(s)
autorisée(s) agissant au nom du fournisseur.
Il serait possible de donner des informations supplémentaires
permettant de liées la déclaration à des résultats
d’évaluation :
- la référence
d’un rapport d’évaluation par les pairs,
- la référence d’un rapport d’auto évaluation,
soit à la référence de la documentation d’appui relative à la norme ISO 17049.
d) Contenu de la documentation d’appui : ISO 17049
Pour monter la conformité
avec les références spécifiées la documentation
d’appui pourrait inclure les informations suivantes :
- les méthodes d’évaluation,
- les résultats de l’évaluation : rapports d’évaluation,
rapports plan d’action…
- l’identification des évaluateurs externes éventuels :
Comité d’audit (pairs),
- manuel d’assurance qualité,
- toute autre information appropriée…
Rappelons tout d’abord que les normes ISO 17049
et ISO 17050 sont des projets.
L’intérêt d’une telle démarche
serait qu’elle permettrait de se dispenser d’une évaluation
par une tierce partie (certification).Et d’autre part, elle n’affecterait
que des coûts réduits.
Cependant, on peut se demander quel crédit accorder
à une simple auto-déclaration.
3.5. La Charte Qualité Service Biomédical :
Pour ce faire connaître et reconnaître par
des clients potentiels et existants (fournisseurs et services de soins), il
s’agirait d’avoir un « référentiel »
propre et commun à la communauté biomédicale : Le
Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé.
Ce référentiel représenterait les
« références » à remplir
par le service biomédical pour obtenir à coups sûr
la satisfaction client et du coup « l’attestation Charte
Qualité Biomédicale ».
Le service biomédical serait évalué
et noté par les pairs suivant un diagnostic décrit dans
la partie : Processus d’évaluation par une deuxième
partie.
Ce dernier, après rapport, lui
permettrait de connaître ses points forts et ses points faibles, et ainsi
les axes d’amélioration potentiel. Des suggestions d’actions
seraient proposées.
Suite à l’évaluation
et aux actions correctives le Comité d’audit après délibération
délivrerait suivant le cas : « l’attestation
Charte Qualité Biomédicale ».
Le but majeur de cette Charte
serait d’aider tout service biomédical volontaire
à s’inscrire dans une démarche constante d’amélioration
de son image, de promotion de son métier en prouvant à la communauté médical
que cette dernière à raison de faire confiance au service biomédical.
Diagramme décrivant les différentes étapes d’attribution de l’attestation de la Charte
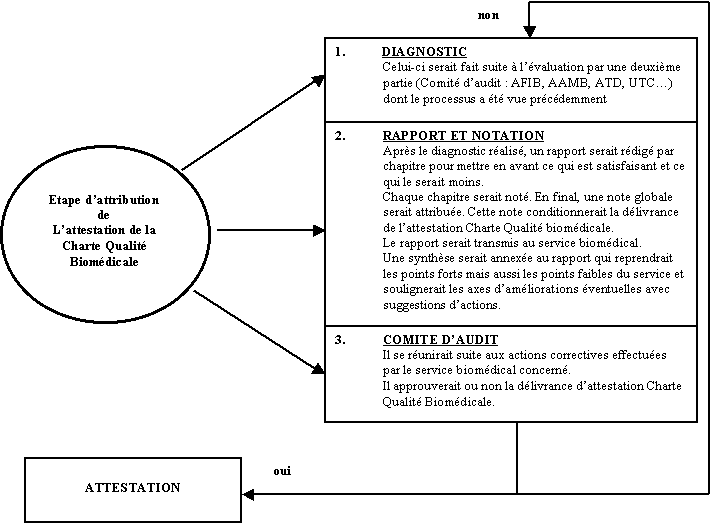
Là encore, faisons un bref récapitulatif
de l’intérêt d’une Charte Qualité Biomédicale.
Tout d’abord, elle correspondrait à une reconnaissance par les
pairs et on pourrait donc y accorder un crédit.
Elle éviterait là aussi une évaluation par une tierce partie
et donc engendrerait des coûts moins importants.
Mais cependant, elle présenterait aussi des inconvénients qui
seraient d’une part la formation des membres du Comité d’audit
(coût) et leur disponibilité (temps passé à faire
les audits, temps à acquérir pour faire ces audits,…).
3.6. La Certification NF Service Biomédical :
La certification NF Service est une marque
de qualité délivrée par AFNOR Certification, organisme
certificateur indépendant.
Cette marque n’est attribuée qu’après
des contrôles rigoureux du service et de l’organisation du prestataire.
La marque NF Service utilise la norme
comme document de référence et apporte la preuve que les exigences
de qualité décrites dans cette norme sont remplies.
La certification NF Service se matérialise par
l’apposition du logo NF sur les documents administratifs
et commerciaux du prestataire.
La certification NF Service est un engagement dans la durée
puisque le service certifié est régulièrement contrôlé
par AFNOR Certification.
La marque NF Service a pour objectifs :
- de définir et approuver aux clients la qualité
de votre service,
- de valoriser le professionnalisme et le savoir faire,
- d’apporter un avantage concurrentiel.
3.6.3. Application au service biomédical :
a) Démarche pour obtenir le label « NF Service Biomédical » :
Pour obtenir une validation, il serait possible qu’un
service biomédical obtienne un label NF Service Biomédical.

La
certification NF service s’appuie sur une norme.
Ce qui sous entend que notre référentiel
qui est le Guide des Bonnes Pratiques Biomédicales en Etablissement de
Santé, devrait devenir une norme pour qu’un service biomédical
envisage une marque NF Service.
Suite à la normalisation éventuelle du
Guide des Bonnes Pratiques Biomédicales en Etablissement de Santé,
il faudrait développer la marque « NF service Biomédical » au sein d’AFNOR Certification.
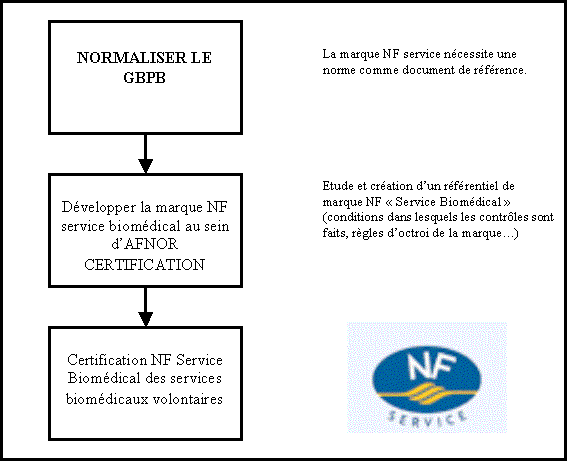
b) Normalisation du guide :
1. Définitions :
Qu’est-ce qu’une norme ?
La norme est un document établi par consensus,
qui fournit, pour des usages communs et répétés, des règles,
des lignes directrices ou des caractéristiques, pour des activités
ou leurs résultats, garantissant un niveau d’ordre optimal dans
un contexte donné (extrait du guide ISO/CEI 2).
Qu’est-ce que le consensus ?
Le consensus est défini comme un accord général
caractérisé par l’absence d’opposition ferme à
l’encontre de l’essentiel du sujet émanant d’une partie
importante des intérêts en jeu et par un processus de recherche
de prise en considération des vues de toutes les parties concernées
et de rapprochement des positions divergentes éventuelles.
Note : « Le consensus n’applique pas nécessairement l’unanimité ».(extrait du guide ISO/CEI 2)
2.
Procédure de normalisation du guide :
Décrivons ci-dessous
sous forme d’un organigramme la procédure à suivre pour
la normalisation éventuelle du Guide des
Bonnes Pratiques Biomédicales en Etablissement de Santé (au sein
de l’AFNOR).
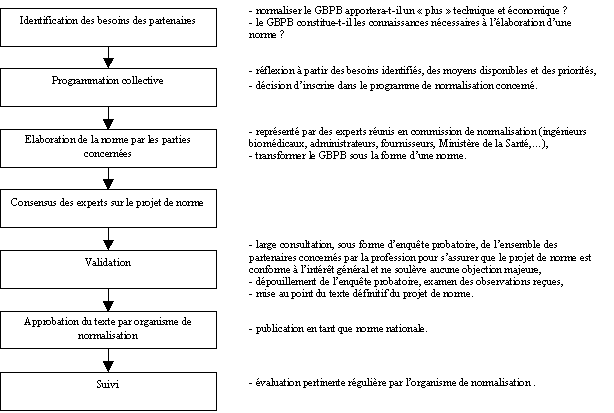
Comment la norme pourrait-elle être utilisée ?
Elle serait déjà d’application volontaire.
Elle serait utilisée comme la référence incontestable et
représenterait le savoir-faire de la communauté biomédicale.
c) Démarche pour développer la marque NF Service Biomédical :
L’élaboration d’une marque NF service
est faite au sein d’AFNOR Certification.
L’élaboration d’une marque NF Service
se base ainsi sur deux étapes :
Elaboration du référentiel
de Certification
- Etape 1 : les normes de spécifications
et/ou d’essais
- analyse des attentes clients,
- définition des engagements et des performances à atteindre (caractéristiques
certifiées).
Cette étape consiste à préciser
les différents documents (normes) sur lesquels la marque NF Service se
baserait (Guide des Bonnes Pratiques Biomédicales en Etablissement de
Santé « normalisé »,…).
- Etape 2 : le règlement de
certification
- conception des règles d’octroi de la
marque (modalités, nature et fréquences des contrôles)
- validation par un comité de marque,
- approbation et publication au Journal Officiel.
d) Obtention de la marque NF Service Biomédical :
Suite au développement de la marque « NF
Service Biomédical » au sein d’AFNOR Certification,
tout service biomédical volontaire pourrait ainsi obtenir la marque suivant
la procédure suivante.
L’intérêt d’une telle démarche
serait qu’elle apporterait une réelle reconnaissance nationale
à la profession ainsi que la crédibilité de la marque NF.
Par contre, elle engendrerait des coûts liés
à la normalisation du guide , au développement de la marque NF
Service et à la certification des services biomédicaux.
Il reste à savoir également si la profession
serait prête à s’engager dans une telle démarche,
ce qu’elle en espèrerait et le bénéfice qu’elle
pourrait en retirer.
3.7. Synthèse et analyse des coûts :
Les trois solutions proposées présentent
des avantages et des inconvénients.
Résumons les dans le tableau ci-dessous.
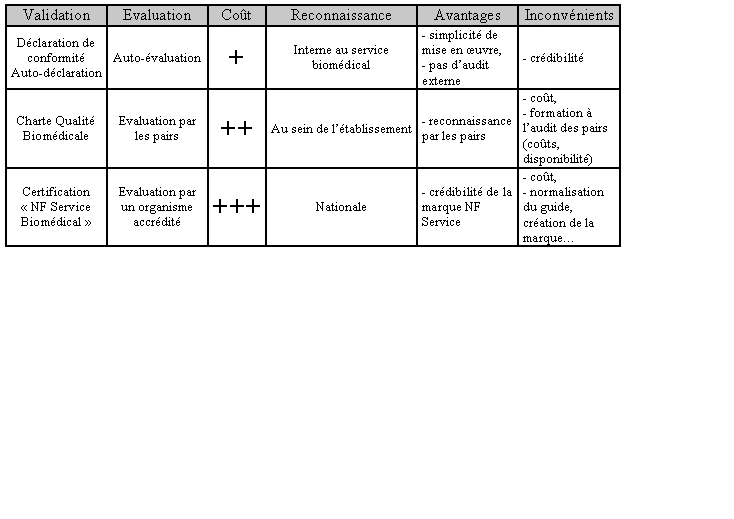
Le Guide des Bonnes Pratiques Biomédicales en
Etablissement de Santé fournit aux acteurs biomédicaux les outils
méthodologiques, reconnus par la communauté biomédicale. C’est en cela qu’il contribue à
l’amélioration et à la maîtrise de la qualité
des soins.
Face aux changements culturels et structurels importants auxquels sont soumis
les acteurs biomédicaux et leurs partenaires, aux différentes
contraintes réglementaires qui pèsent sur eux et aux exigences
croissantes des patients, la validation apporterait des solutions.
Cependant, quelque soit la solution de validation retenue,
le service biomédical devrait avant cette étape de validation
effectuer une évaluation de ces pratiques pour vérifier qu’il
répond bien aux références du guide.
La solution de validation retenue devrait être d’une part commune
à toute la communauté biomédicale et d’autre part
choisie par celle-ci. Le choix par la
communauté biomédicale de la procédure de validation sera
fonction des investissements financiers et humains qui peuvent être consentis.
Là encore le but de cette validation serait d’aider
tout service biomédical volontaire à s’inscrire dans une
démarche constante d’amélioration de son image, de promotion
de son métier en prouvant à la communauté médicale
et au patient que ces derniers ont raison de faire confiance au service biomédical.
Bibliographie
citée :
[1] Décret
n° 2001-1154 du 5 décembre 2001 relatif à l’obligation
de maintenance et au contrôle de qualité des dispositifs médicaux
prévus à l’article L.5212-1 du code de la santé
publique (3ème partie : Décrets), JORF n°
284 du 7 décembre 2001, NOR : MESP0123968D.
[2] Arrêté
du 3 octobre 1995 relatif aux modalités d’utilisation et de contrôle
des matériels et dispositifs médicaux assurant les fonctions
et actes cités aux articles D.712-43 et D.712-47 du code de la santé
publique, JORF octobre 1995.
[3] Guide des Bonnes
Pratiques Biomédicales en Etablissement de Santé ; auteurs
G.Farges, G.Wahart, J.M.Denax, H.Metayer, ITBM/RBM News Nov.2002 Vol.23 Suppl.2.
[4] Arrêté
du 14 mars 2000 relatif aux bonnes pratiques de laboratoire, JORF bulletin 2000-12 du 23 mars 2000, NOR : MESP0020869A.
[5] Guide des Bonnes
Pratiques de Pharmacie Hospitalière, Ministère de l’Emploi
et de la Solidarité – Direction des hôpitaux, enquête
publique – Arrêté du 22juin 2001 relatif aux bonnes pratiques
de pharmacie hospitalière, JORF Bulletin 2001-27 du 3 juillet 2001,
NOR : SANH0122497A. http://www.sante.gouv.fr/htm/minister/gbp/pratok.htm
[6] Arrêté
du 26 avril 2002 modifiant l’arrêté du 26 novembre 1999
relatif à la bonnes exécution des analyses de biologie médicale
(GBEA), JORF n ° 104 du 4 mai 2002 p.8375, NOR : SANP0221588A.
[7] Guide des Bonnes
Pratiques d’Hygiène, Directive 93/43/CEE parue au JORF du 24
novembre 1993, NOR : ECOC9300177V.
[8] Agence Nationale
d’Accréditation et d’Evaluation en Santé (ANAES).
L’audit clinique. Bases méthodologiques de l’évaluation
des pratiques professionnelles. Avril 1999.
[9] Demande de
reconnaissance relative au Respect des principes de Bonnes Pratiques de Laboratoire
CAN-P-1584, monographie sur l’environnement n° 48, 1992,
http://www.oecd.org/ehs/ehsmono
http://www.scc.ca/accreditation/palcan/psa/glp_f.html
http://www.scc.ca/publicat/canp/1584_f.pdf.
[10] Projet de
norme ISO 17050, Exigences générales pour la déclaration
de Conformité du fournisseur, ISO/CEI CD 17050 du 16 avril 2002.Projet de norme ISO 17049, Exigences générales
relatives à la documentation venant à l’appui de la déclaration
de conformité du fournisseur, ISO/CEI CD 17049 du 15 avril 2002.
Edition ISO/CASCO, Comité pour l’évaluation de la conformité.
http://www.iso.ch/iso/fr/comms-markets/
[11] Certification
NF Service, AFNOR certification
http://www.marque-nf.com
Rapports et thèses
d’étudiants :
· Apport d’une démarche qualité
de type ISO 9002 au service biomédical dans le cadre de l’accréditation
S.NENNIG, - rapport de stage DESS TBH, UTC 1999.
· Que choisir comme indicateur de qualité pour
le service biomédical ? Olivier DUCAMP, Nicolas MOCQUET, Sophie
NENNIG, projet d’étude DESS TBH 1999.
· Audit de la maintenance biomédicale :
méthodologie et application H.DION ; rapport de stage DESS TBH,
UTC, 2000.
· Guide méthodologique pour l’avancement
de la qualité, S.PIERREFITTE, J.MESCAM ; projet DESS TBH UTC
1998.
· Pourquoi et comment se faire certifier ISO 9002.
Application à un service biomédical, Marc POMMIER rapport
thèse professionnelle Mastère Equipements biomédicaux 1998.
· Guide et outils d’évaluation pour l’assurance
qualité des prestations et de l’organisation des services techniques
biomédicaux, S.CABLAN, Mastère Equipements biomédicaux
UTC, 1994.
· Auto-évaluation et procédures au service
biomédical, Gilles BOUVIER, rapport stage SPIBH UTC 2000.
Support de cours
· Méthodologie de la maintenance, F. THIBAULT,
formation DESS TBH, UTC, Module OMQM, U.T.C., 1998.
· Guide des Bonnes Pratique en Etablissement de Santé,
G. FARGES, cours DESS TBH. 2002-2003
· ISO 9000 : 2000, G. FARGES; cours DESS
TBH 2002-2003.
Site Internet :
http://www.sante.gouv.fr/htm/minister/gbp/pratok.htm
http://www.oecd.org/ehs/ehsmono
http://www.scc.ca/accreditation/palcan/psa/glp_f.html
http://www.scc.ca/publicat/canp/1584_f.pdf.
http://www.iso.ch/iso/fr/comms-markets/
http://www.marque-nf.com
https://www.utc.fr/~farges
http://www.aamb.asso.fr
http://www.sifth.com
http://www.agmed.santé.gouv.fr/
http://www.anaes.fr
http://www.dialyse.asso.fr
http://www.hosmat.com/asurqualite/anaes1.html
http://www.qualiteonline.com
AAMB : Association des agents de maintenance biomédicale
(France).
http://www.aamb.asso.fr
Accréditation : procédure externe à un établissement
volontaire, qui lui permet de conférer de façon publiquement accessible
une reconnaissance de qualité au regard de références préalablement
établies.
AFAQ : Association Française Assurance Qualité
AFIB : association française des ingénieurs
biomédicaux
http://www.sifth.com
AFNOR : association française de normalisation
http://www.afnor.fr
AFSSAPS : agence française de sécurité
sanitaire des produits de santé
http://www.agmed.santé.gouv.fr/
ANAES : Agence nationale d’accréditation
et d’évaluation en santé
http://www.anaes.fr
ATD : Association des techniciens de dialyse
http://www.dialyse.asso.fr
Bonnes pratiques
fonctionnelles : Actions de management
à mettre en œuvre afin d’avoir une organisation robuste et
efficiente.
Bonnes pratiques
opérationnelles : Actions
à mettre en œuvre afin de réaliser des activités pertinentes
et optimales au sein du service biomédical.
BVQI : Bureau Véritas Quality International
Décret : décision, ordre émanant du pouvoir
exécutif.
Démarche
qualité : ensemble des
dispositifs mis en place par une structure en vue de répondre aux objectifs
et aux conditions de l’accréditation ou à des exigences
de qualité librement adoptés. Ce programme rend nécessaire
une évaluation régulière et permanente des activités
concernées, et la fourniture des preuves correspondantes.
DESS : Diplôme d’études supérieures
spécialisées (devenus des masters suivant l’harmonisation
européenne de l’enseignement supérieur).
Exigence : besoin ou attente qui peut être formulé,
habituellement implicite, ou imposé (ISO 9000 : 2000).
Fournisseur : organisme ou personne qui procure un produit
(ISO 9000 : 2000).
GBEA : guide de bonne exécution des analyses
(voir arrêté du 26 novembre 1999 relatif à la bonne exécution
des analyses de biologie médicale modifié par l’arrêté
du 26 avril 2002).
Processus : Système d’activités utilisant
des ressources pour transformer des éléments d’entrée
en éléments de sortie (ISO 9000 : 2000)
Procédure : manière spécifiée d’effectuer
une activité ou un processus (ISO 9000 : 2000)
Qualité : aptitude d’un ensemble de caractéristiques
intrinsèques d’un produit, d’un système ou d’un
processus à satisfaire les exigences des clients et autres parties intéressées
(ISO 9000 : 2000).