|
|
| Si vous arrivez directement sur cette page, sachez que ce travail est un rapport d'étudiants et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé pendant la période de formation et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part . L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
|
|
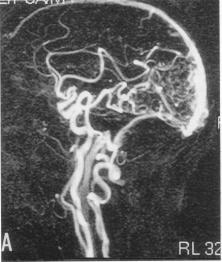
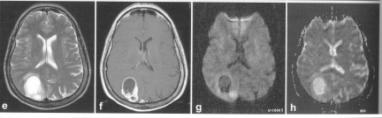
Détection de la vascularisation tumorale en Imagerie RMN, J.C Esmelin, A. Graillot, Projet DESS "TBH", UTC, 03-04 URL : https://www.utc.fr/~farges/dess_tbh/ Détection de la vascularisation tumorale en Imagerie RMN
|
|
 Jean-Christophe ESMELIN |
 Alexandre GRAILLOT |
REMERCIEMENTS
CIMA (Centre d'Imagerie Avancé de Compiégne) :
M.
François Langevin
Etudiants
en thèse : MM. Cristian Alarcon et Adnan Abdalmajeed
Centre
Hospitalier de Compiègne :
Dr
COULLET, Chef du service de radiologie
|
L'angiogénèse tumorale est le développement de nouveaux vaisseaux capillaires aux abords d'une tumeur en réponse à un stimuli chimique externe. Elle joue un rôle essentiel dans le développement tumoral et dans la réponse aux traitements anti-cancéreux. L'Imagerie par Résonance Magnétique (IRM) est une technique d'imagerie non-irradiante utilisant les propriétés magnétiques intrinséques du corps humain. Cette technique en perpétuelle évolution offre de nouvelles applications et de nombreuses perspectives notamment en oncologie. Le projet a pour objectif de donner une vision complète sur l'angiogénèse tumorale et sa visualisation en IRM. Ceci passe par l'état actuel des connaissances concernant l'angiogénèse tumorale et les pistes de traitement en développement, mais aussi la description des séquences en IRM utilisées pour visualiser la vascularisation tumorale. En effet le paramétrage de la machine joue un rôle essentiel dans le suivi des cancers et dans la visualsation de la néo-angiogénèse. L'optimisation des séquences permettra d'améliorer la qualité des diagnostics et le choix de traitements appropriés.
|
|
Angiogenesis is the growth
and development of new capillary blood vessels from a pre-existing
vascularization in response to externally chemical stimuli. It has an
impact on the development of tumour and treatment response. Magnetic Resonance Imaging
(MRI) is an imaging technique used pirmarly in medical seetings to
produce high quality images of the inside of the human body. It based
on the magntic properties of H protons. The aim of this project is
firstly to give a clear and complete point of view about the knowledge
concerning tumoral angiogenesis and different treatments witch are
developed; secondly, to describe different sequences used in cancer by
MRI: that's to say the configuration of the machine wich can allow to
see the development of the tumour, to visualize the neo-vascularization
and consequently to do a right diagnostic, to give o prognostic and to
prescribe an adapted treatment. |
Mots-Clefs : Angiogénèse, Cancer, Traitements, I.R.M, Séquences, Détection. |
INTRODUCTION
PARTIE I : QU'EST CE QUE L'ANGIOGÉNÈSE ?
a)
Connaissances
actuelles sur la vascularisation tumorale
· Dépendance des tumeurs vis-à-vis de l’angiogénèse
· Médiateurs moléculaires de l’angiogénèse
· Mécanismes impliqués dans la vascularisation tumorale
b)
Vascularisation
tumorale et traitements
· Oxygénation et hypoxie de la tumeur
· Vers les médicaments anti-angiogénèse
· Approche thérapeutique utilisant le débit tumoral
· Oxygénation et radiosensibilité
· Oxygénation et chimiosensibilité
· Traitements oxygène-dépendants
c)
Les
équipes de recherche en France
d)
Bilan
du chapitre : ce qu’il faut retenir
· Vascularisation et traitements
PARTIE II : IMAGERIE PAR RÉSONANCE
MAGNÉTIQUE (IRM)
a)
Place
de l’IRM en Oncologie
· Tableau récapitulatif par organe visé
· Bilan
b)
Séquences
et options en IRM
· Séquences Inversion Récupération (I-R)
·
Séquences injectées (Gadolinium)
·
Imagerie de flux (exemple de
l’angiographie
par RM)
·
Imagerie de perfusion et de diffusion
c)
Modalités
d’exploration en IRM
d)
Spécificités,
modalités et exploration de l’angiogénèse en IRM
· Sein
· Le système nerveux central, exemple du gliome cérébral
· Modalités de détection de l’angiogénèse en IRM
· Bilan
e)
Les
autres techniques d’imagerie
·
PET-Scan
CONCLUSION
La formation de nouveaux vaisseaux sanguins est essentielle pour assurer le transport de l’oxygène, des éléments nutritifs et des déchets lorsque de nouveaux besoins se manifestent dans l’organisme. Ainsi dans l’embryon, le cœur et les vaisseaux constituent le premier système fonctionnel. Chez l’adulte, la formation de nouveaux vaisseaux sanguins se produit dans une situation physiologique normale, par exemple au cours du développement des muscles après des exercices répétés, dans les tissus adipeux, au cours de la cicatrisation ou pendant le développement cyclique du corps jaune et de la muqueuse utérine. Mais elle est aussi stimulée dans de nombreuses situations pathologiques et notamment dans les tumeurs.
L’implantation de fragments de tumeurs dans la cornée du lapin a permis de mettre en évidence la capacité des cellules cancéreuses à stimuler la formation de nouveaux vaisseaux sanguins. Cela suggère que la croissance d’une tumeur dépend de la formation de nouveaux vaisseaux sanguins. Ces néo-vaisseaux permettent à une tumeur de se « brancher » sur la circulation générale et d’obtenir ainsi les éléments nutritifs indispensables à sa croissance. Ils vont également fournir aux cellules cancéreuses une voie pour aller établir des métastases. Au cours de ces dernières années, cette hypothèse a été vérifiée dans une série de modèles expérimentaux.
Le pronostic d’un cancer est fonction du stade (I, II, III) atteint par celui-ci, c’est à dire dépendant de la taille de la tumeur et l’envahissement des organes voisins (T), de l’atteinte ganglionnaire médiastinale (N), et de la présence de métastases (M). La présence de métastases indique un mauvais pronostic pour la guérison d’un cancer, hors l’angiogénèse est un facteur permettant ce phénomène. Il est donc indispensable de détecter la présence de néo-vaisseaux au niveau des tumeurs primitives afin d’en faciliter le diagnostic.
Annexe 1 : Classification TNM et stades O, I , II , III
L’imagerie par Résonance Magnétique (IRM) est une des techniques les plus innovantes dans le monde de l’imagerie médicale. De par sa précision, elle a permis de grands progrès notamment en ce qui concerne les états patho-physiologiques de l’Homme.
Son intérêt réside dans sa capacité à réaliser des coupes dans tous les plans de l’espace, et permettre une ébauche de caractérisation tissulaire (eau, graisse, sang, os…) grâce à la confrontation des différents types d’acquisition possibles. L’un des avantages non négligeable est que cette technique n’utilise pas de rayonnements ionisants, mais les propriétés magnétiques intrinsèques du corps humain.
L’objectif principal
de ce projet
est de comprendre les mécanismes qui régissent l’angiogénèse tumorale
et de
faire part des découvertes médicales récentes faites dans ce domaine.
Il
s’agira par la suite de déterminer les séquences appropriées pour la
détection
de la vascularisation des tumeurs et améliorer le diagnostic et le
suivi du
cancer pour différents organes. Pour cela, il est essentiel de
manipuler la
machine et d’assister à des examens menés par des professionnels,
d’aller à la
rencontre des équipes de recherche. Enfin, il sera intéressant de
présenter les
différentes techniques d’imageries (IRM, Scanner, Echo Doppler,
médecine
nucléaire) pouvant être utilisées dans la détection de l’angiogénèse et
de les
comparer.
PARTIE I : QU'EST CE QUE
L'ANGIOGÉNÈSE ?
a)
Connaissances
actuelles sur la vascularisation tumorale
Ce qui permet à une cellule tumorale de proliférer et de former une tumeur ayant un certain volume, c’est sa capacité à susciter une réaction de la part de l’hôte, lui permettant d’obtenir les nutriments dont elle a besoin.
Les cellules tumorales cultivées in vitro peuvent former des colonies de taille importante (plusieurs milliers de cellules). Cependant, au bout d’un certain nombre de multiplications, le centre de la colonie (souvent constitué par les cellules souches) ne reçoit plus de nutriments, devient hypoxique et finit par mourir. On observe une nécrose centrale, et la disparition de toute la colonie (les cellules filles ayant perdu le pouvoir de mitoses indéfinies).
In vivo, l’apparition d’une réaction de l’hôte, sous l’influence de facteurs spécifiques fabriqués par les cellules tumorales permet à celles-ci de disposer des néo-vaisseaux indispensables à la constitution de tumeurs plus ou moins volumineuses.
Il ne s'agit pas seulement de
néo-vaisseaux, mais
de toute une réaction conjonctive associée, appelée en
anatomopathologie la
stroma-réaction.
·
Dépendance des
tumeurs vis à vis de
l’angiogénèse
Les expériences de transplantations
tumorales
dans des organes avasculaires, comme par exemple la cornée du lapin,
prouvent
le rôle actif des tumeurs dans la création des néo-vaisseaux
nécessaires à leur
oxygénation et à leur alimentation.
Importance de l'angiogénèse pour
le
développement local
Lorsque les cellules tumorales sont inoculées dans un organe avasculaire, elles prolifèrent jusqu’à une taille d’environ 1 mm3, puis stagnent et deviennent ‘dormantes’. Lorsqu’on les inocule de nouveau dans des organes vasculaires, elles prolifèrent donnant naissance à une tumeur massive et à des métastases.
Les tumeurs expérimentales implantées en suspension dans la chambre antérieure de l’œil de lapin ou dans le vitré sont vivantes mais de petite taille. Lorsqu’elles sont implantées près des vaisseaux de l’iris, elles induisent une néo-vascularisation et prolifèrent de façon très rapide.
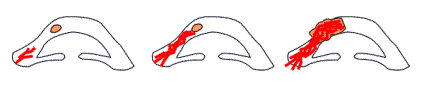
Etude expérimentale de
l’angiogénèse sur la cornée du lapin.
La tumeur implantée loin des vaisseaux de l’iris n’entraîne aucune
vascularisation et ne se développe pas. La tumeur implantée près de
l’iris
induit une néo-vascularisation et envahit les structures normales.
Source : Faculté de Médecine, Centre François
Baclesse, Caen
L’étude histologique des tumeurs avasculaires du vitré montre une prolifération des cellules externes, mais la mort par apoptose des cellules situées à l’intérieur du clone multicellulaire.
L’angiogénèse est nécessaire à la croissance tumorale mais non suffisante : de nombreuses tumeurs bénignes sont hypervascularisées (exemple : adénomes cortico-surrénaliens). Ces cellules ne possèdent pas les caractères de malignité leur permettant d’évoluer à distance de leur origine.
Enfin, certaines tumeurs évoluent
pratiquement
sans angiogénèse : gliomatose méningée, leucémies.
Angiogénèse et métastases
Une cellule tumorale, pour migrer à distance de son origine, à travers les vaisseaux, doit pouvoir les pénétrer.
Dans les tumeurs expérimentales, on ne voit pas survenir de métastases avant la néo-vascularisation. On établit une corrélation entre le pouvoir métastatique des cellules tumorales et l’importance de la vascularisation de la tumeur primitive. Les cellules tumorales pénètrent à travers les capillaires de la néo-vascularisation qui seraient moins étanches que les capillaires normaux. Les cellules tumorales peuvent les traverser facilement. Les protéines plasmatiques diffusent vers l'espace extra-cellulaire provoquant un œdème local important.
Au niveau de la croissance capillaire existent tous les enzymes normaux nécessaires à la migration des cellules endothéliales, et notamment ceux nécessaires à la dissolution de la membrane basale des vaisseaux, comme les collagénases de type IV ou V ou encore l’activateur du plasminogène. Mises à profit par les cellules tumorales, elles permettent à celles-ci de migrer.
Les clones métastatiques migrent à partir de la tumeur initiale. Au niveau du site métastatique, certaines sont capables de stimuler les cellules endothéliales de l’hôte, et ainsi de se développer. L’administration expérimentale à l’animal de substances inhibant cette angiogénèse va empêcher l’éclosion de métastases macroscopiquement visibles. Cependant, les cellules métastatiques sont présentes, mais dormantes. Elles ne s’exprimeront que lorsque le traitement à visée anti-angiogénique aura été arrêté.
In vivo, chez l’homme, certains clones
métastatiques ne possèdent probablement pas de pouvoir angiogénique et
restent
dormantes pendant de nombreuses années (expliquant ainsi les métastases
de
survenue très tardives).
|
|
|
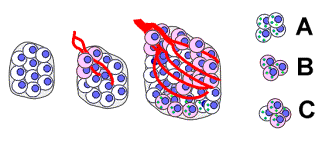
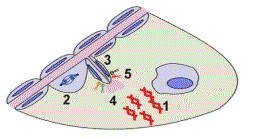
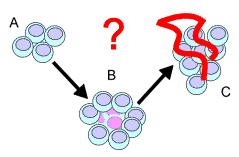
Illustration de la différence entre le
pouvoir angiogène et le pouvoir métastastique des cellules cancéreuses. Le clone A a un pouvoir métastasiant, mais
pas de pouvoir angiogène. La métastase produite sera probablement
‘dormante’. Le clone B comporte des cellules à pouvoir angiogène et
formera des métastases actives. Le clone C est mixte : certaines
cellules sans pouvoir angiogénique passent dans la circulation. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
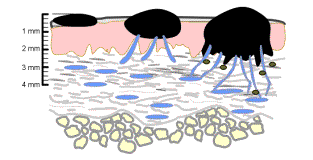
Les mélanomes de moins de 0,76 mm
d’épaisseur ne
métastasent pratiquement jamais. Ils restent dans l’épiderme, en dehors
de la
membrane basale, à distance du derme bien vascularisé. Les mélanomes
plus épais
sont associés à une néo-vascularisation au niveau du derme, avec
souvent des
images de cellules tumorales entourant les néo-vaisseaux capillaires.
Ils ont
alors acquis un pouvoir métastatique important.
|
|
|
Schéma
de l’évolution d’un mélanome malin. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
Une observation analogue peut être
faite au
niveau des cancers in situ du col utérin qui évoluent vers des cancers
micro
invasifs, non métastasiants jusqu’environ 3 mm d’épaisseur.
Ainsi, les cellules cancéreuses ont un pouvoir de micro-invasion locale indépendant de leur pouvoir angiogène.
Angiogénèse et métastases lymphatiques
On ne trouve pas de néo-vaisseaux lymphatiques dans les tumeurs cancéreuses primitives. Les tumeurs ne semblent pas capables d’induire une angiogénèse lymphatique. La lymphe est exsudée à partir des nouveaux vaisseaux artériolaires de la tumeur, moins étanches que les capillaires normaux, à un endroit où la pression intra-capillaire provoquée par la prolifération tumorale est forte. Les cellules cancéreuses suivent le trajet de la lymphe, et atteignent ainsi les ganglions lymphatiques qui drainent normalement l’organe.
L’encre de chine injectée dans une
tumeur
vascularisée de cornée du lapin est drainée rapidement vers les
ganglions
ipsi-latéraux. L’encre injectée dans une tumeur non vascularisée reste
localisée indéfiniment.
La plupart des tumeurs humaines sont détectées alors qu’existe déjà une néo-vascularisation. On peut cependant définir des tumeurs in situ et des lésions pré-néoplasiques hyperplasiques qui permettent d'affirmer que pouvoir de prolifération et pouvoir angiogénique constituent deux phénotypes cellulaires différents.
Phase avasculaire
Au niveau de la tumeur primitive
Pendant la phase avasculaire, la croissance tumorale est faible, le temps de doublement est très long. Il existe un état d’équilibre entre une production accrue et une perte cellulaire accrue, essentiellement par apoptose.
La détection des cancers avasculaires
est
difficile, sauf sur une surface d’observation facile comme la peau, la
rétine,
la cavité buccale, le col de l’utérus, la vessie. Ces lésions sont
planes ou
exubérantes, fines, à croissance apparemment lente, et ne donnent
pratiquement
jamais de métastases.
Au niveau des métastases
Les cellules métastatiques sont originaires de cellules ayant migré grâce à leur pouvoir angiogénique ou en accompagnant ces cellules.
Grâce aux techniques de biologie
moléculaire, en
période périopératoire, on met souvent en évidence de nombreuses
cellules
malignes circulant dans le sang. Cependant, cette observation n’est pas
toujours corrélée avec le développement de métastases décelables dans
les mois
ou années qui suivent l’intervention.
|
|
|
|
Explication du
phénomène de ‘dormance’ et des métastases. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
|
De même, des métastases surviennent de
très
nombreuses années après que la tumeur primitive a été apparemment
guérie. Le
temps de doublement cellulaire ne suffit pas à expliquer cette latence
dans
l’évolution.
L’absence de corrélation absolue entre cellules circulantes et métastases et le phénomène de ‘dormance’ pourraient être dus à l’absence de pouvoir angiogénique de ces cellules métastatiques. Certes, elles se multiplient localement, au siège de leur métastase, mais les cellules filles, ne provoquant pas de néo-vascularisation, meurent par apoptose. Lorsqu’elles acquièrent le pouvoir angiogénique, elles se développent en métastase agressive.
Expérimentalement, on inhibe le
développement de
métastases par des médicaments anti-angiogéniques : les
micro-métastases
inhibées ont un taux de synthèse de DNA élevé, malgré un temps de
doublement
très long.
Phase vasculaire
Les tumeurs (primitives ou métastatiques), qui ont provoqué une néo-vascularisation, peuvent croître, envahir localement et métastaser. La néo-vascularisation permet les échanges de nutriments, d’oxygène, mais aussi l’évacuation des déchets cellulaires.
On décrira plus loin les facteurs
angiogéniques
impliqués dans la stimulation de l’angiogénèse. A l’inverse, on observe
un
effet important de cette vascularisation sur les cellules cancéreuses.
Effets paracrine de la néo-vascularisation
On appelle ainsi l’effet de stimulation
de
croissance des cellules tumorales, provoquées par les cellules
endothéliales,
par leur relargage local de facteurs de croissance qui, à leur tour,
stimulent
les cellules cancéreuses
|
|
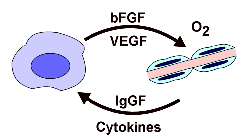
|
Interactions entre les cellules cancéreuses
et les cellules endothéliales. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
Les cellules endothéliales, qui se
multiplient,
fabriquent des facteurs tels que le facteur de croissance basique
fibroblastique (bFGF), le facteur de croissance dérivé des plaquettes
(PDGF),
le facteur de croissance proche de l’insuline de type 1 (IGF-1), des
cytokines
comme les interleukines IL-1, IL-6, IL-8, et le facteur de stimulation
des
granulocytes et des macrophages ou GM-CSF. Tous ces facteurs
favorisent, à des
degrés divers, selon le type cellulaire, la croissance des cellules
tumorales
in vitro. Ils ont probablement un rôle in vivo.
Les cellules tumorales croissent préférentiellement le long des travées endothéliales. Il en résulte un processus paracrine de stimulation réciproque des cellules endothéliales et cancéreuses.
Enfin, l’hypoxie relative, qui existe
près du
centre de la tumeur en raison de la compression par la masse
cellulaire,
stimule également les récepteurs endothéliaux pour le facteur de
perméabilité
vasculaire, appelé VEGF/VPF. Cette stimulation augmente la fuite des
cellules
tumorales vers le système lymphatique (hyperpression), mais également
vers la
circulation sanguine.
Apparition des symptômes
La néo-vascularisation anarchique des tumeurs cancéreuses est responsable de certains symptômes hémorragiques observés en clinique : hématurie, crachats hémoptoïques, métrorragies, ascite hémorragique.
D’autres symptômes, comme la douleur osseuse des métastases, sont souvent dus à l’hypervascularisation et l’hyperpression locale.
L’œdème local de compression est provoqué par l’augmentation de pression oncotique, l’absence de drainage lymphatique efficace, puis l’apparition d’une stase lymphatique due à la présence de cellules malignes.
En angiographie, la néo-vascularisation artériolaire de la tumeur et la concentration du colorant iodé par la tumeur constituent des signes radiologiques distinctifs en faveur de la malignité. Cependant, on peut aussi constater au centre de la tumeur des zones peu vascularisées, correspondant à l’hyperpression centrale et à la nécrose.
Certains syndromes dits paranéoplasiques semblent en relation directe avec l’angiogénèse localisée : sécrétion inappropriée d’hormones, états d’hyper-coagulabilité, sécrétions de facteurs cachectisants.
·
Médiateurs moléculaires de l’angiogénèse
Médiateurs positifs
De nombreuses substances organiques
sont capables
d’interagir pour favoriser la néo-vascularisation. In vitro, on peut
démontrer
un effet de stimulation de la prolifération des cellules endothéliales.
Deux
facteurs sont particulièrement bien connus, le VEGF et le b-FGF.
Le VEGF
Le facteur de croissance de l’endothélium vasculaire ou VEGF, encore appelé VPF(pour facteur de perméabilité vasculaire) est sécrété par la tumeur. Il a une activité mitogène spécifique pour les cellules endothéliales in vitro et un fort pouvoir angiogénique in vivo. L’expression de ce facteur et des récepteurs pour ce facteur est corrélée avec le développement embryologique, le développement cyclique de l’endomètre, du placenta, des hémangiomes ou des tumeurs. Les cellules endothéliales sont les seules à posséder un récepteur spécifique pour ce facteur.
Le VEGF existe sous 4 formes
moléculaires
(polypeptides de 121, 165, 189 et 206 acides aminés).
|
|
|
Principales
fonctions du VEGF/VPF.
Source : Faculté de Médecine, Centre François
Baclesse, Caen |
Il existe au moins deux types de
récepteurs
spécifiques pour le VEGF : le récepteur KDR (kinase domain
containing
receptor) et FLT1 (fms-like tyrosine kinase). Ce sont des
récepteurs
à activité tyrosine kinase. Une fois activés, les récepteurs subissent
une
auto-phosphorylation et stimulent les voies de transmission du signal.
L’interaction entre VEGF et ses récepteurs nécessite la présence des
protéoglycanes (notamment l’héparine).
On retrouve des taux élevés de VEGF
dans le sérum
de certaines patientes atteintes d’un cancer du sein ou les urines de
malades
atteints de cancer de la vessie.
Le b-FGF
Le facteur de croissance fibroblastique basique (b-FGF) est exprimé (sous forme du mRNA) et excrété par une grande quantité de tumeurs in vitro. Il se lie facilement avec les protéoglycanes de la membrane cellulaire, notamment le sulfate d’héparine.
On retrouve ce bFGF dans le sérum et les urines des malades cancéreux. La grande quantité produite est favorisée par la présence d’héparinase et de collagénase tumorales, qui libéreraient le b-FGF lié aux protéoglycanes péri-cellulaires. Le rôle des macrophages péri-tumoraux dans la sécrétion de b-FGF n’est pas bien élucidé.
Le bFGF exerce un puissant effet
mitogène et
chimiotactique pour les cellules endothéliales et pour les cellules
fibroblastiques et musculaires lisses des vaisseaux. Tous ces éléments
constituent la stroma-réaction péri-tumorale observée au microscope,
qui
réalise le tissu de soutien de la tumeur.
|
|
|
Effet
du bFGF pour la constitution de la ‘stroma réaction’. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
In vitro, il existe une synergie entre le bFGF et le VEGF. L’hypoxie stimule la production de VEGF et augmente la proportion de récepteurs sur les cellules endothéliales. Un autre stimulus de la production de VEGF est la présence de facteur transformant TGF b.
Rôle de l'héparine
L’héparine et le sulfate d’héparine constituent des éléments régulateurs majeurs de l’angiogénèse.
Ainsi, vis à vis des facteurs de croissance fibrolastiques, l’héparine potientialise l’effet mitogénique du FGF acide. Elle stabilise et protège les facteurs FGF de l’inactivation, et fonctionne comme des récepteurs de faible affinité qui séquestre le facteur bFGF et facilite son interaction avec les récepteurs cellulaires de haute affinité.
Du fait de leur séquestration, en grande abondance, dans l’espace péri-cellulaire, par l’héparine et les autres protéoglycanes, les facteurs FGF sont le plus souvent inactifs. Ils sont relargués et activés, grâce à des héparinases, après un traumatisme local minime, une irradiation, une inflammation, un choc thermique ou une nécrose tumorale, et entraînent la prolifération des cellules endothéliales et fibroblastiques nécessaires pour la réparation, la cicatrisation ou la poursuite de la prolifération tumorale.
Les cellules inflammatoires et les
cellules
tumorales possèdent des héparinases qui entraînent la migration
cellulaire,
l’invasion et la réaction vasculaire. D’autres héparinases peuvent
agir :
thrombine, plasmine.
|
|
|
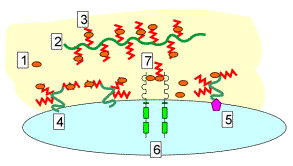
Schéma
du rôle de l’héparine sulfate dans la régulation de la disponibilité du
facteur de croissance bFGF [1]. Les
protéoglycanes de la matrice extra-cellulaire [2] comportent de
nombreux radicaux héparine sulfate [3] qui séquestrent les FGF et les
VGEF. Il existe en outre des récepteurs membranaires de faible affinité
pour les FGF, constitués de protéoglycanes transmembranaires [4] comme
les syndécanes ou associés à la membrane [5] comme les glypicanes,
contenant de nombreuses chaînes de sulfate d’héparine. Les récepteurs à
haute affinité [6] sont dimérisés sous l’effet de la stimulation par
les facteurs de croissance [7]. Ceux-ci sont souvent présentés associés
à des chaînes de sulfate d’héparine. L’action des héparinases ou des
plasmines permet de libérer les facteurs de croissance. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
Après la stimulation par des facteurs angiogéniques libérés de la matrice extra-cellulaire (notamment des protéoglycanes), les cellules endothéliales vont fabriquer les enzymes protéolytiques nécessaires à la destruction de la membrane cellulaire endothéliale (métalloprotéinases, collagénases) , puis à la prolifération dans le tissu conjonctif.
Un certain nombre de molécules
d’adhésion sont
synthétisées au cours de la construction des néo-vaisseaux.
|
|
|
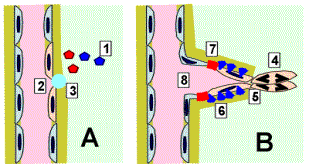
Schéma
des interactions au niveau des capillaires. Source : Faculté de Médecine, Centre François
Baclesse, Caen |
Les sélectines E et P sont indispensables à la formation du tube capillaire : elles semblent stimuler le chimiotactisme des cellules endothéliales in vitro (mais n’ont pas d’effet sur la prolifération des cellules vasculaires).
Les molécules d’adhésion de la famille des immunoglobulines (ICAM-1, ICAM-2, VCAM-1) jouent un rôle dans l’adhésion intercellulaire. ICAM-2 est exprimée par les cellules endothéliales au repos ; ICAM-1 et VCAM-1 sont associées aux intégrines, permettant la mobilité des cellules endothéliales le long de trajets définis.
Les intégrines, et notamment l’intégrine avß3, jouent un rôle majeur de cohésion à l’interface cellule – espace extra-cellulaire. L’intégrine avß3 n’est pas exprimée au niveau des capillaires au repos, mais devient très exprimée au niveau des capillaires se divisant. Les anticorps anti avß3 ou le peptide RGD bloquent l'angiogénèse peri-tumorale ou l'angiogénèse induite dans la cornée du lapin.
Outre la multiplication des cellules endothéliales, d’autres phénomènes indépendants interviennent pour créer la néo-vascularisation. Ainsi, la migration des cellules endothéliales paraît indépendante du pouvoir de multiplication des cellules endothéliales.
La forme des cellules endothéliales influence aussi leur prolifération : l’élongation des cellules, en réponse à un stimulus chimiotactique, provoque l’apparition de mitoses. Quand la taille des cellules est réduite (par leur multiplication et leur juxtaposition), le b-FGF devient un facteur de différentiation cellulaire, et perd son pouvoir mitogène.
Les
interactions
cellulaires au niveau de l’endothélium sont très nombreuses. Les
péricytes, en
grand nombre dans la rétinopathie diabétique ou certaines tumeurs,
régulent
négativement la prolifération endothéliale.
Inhibiteurs
de l'angiogénèse
Dans des conditions physiologiques, de très nombreux facteurs négatifs ne permettent l’expression des facteurs angiogéniques que dans des situations particulières (embryogenèse, inflammation, cicatrisation, menstruation).
L’endothélium ne prolifère pas en dehors de ces circonstances particulières, et la vie d’une cellule endothéliale normale dépasse les 1000 jours. Cependant, sous l’effet de ces forts stimuli (VEGF, b-FGF), les cellules endothéliales peuvent proliférer aussi vite que les cellules de la moelle osseuse.
Les fibroblastes cutanés sécrètent de grandes quantités d’interféron b (b -IFN). Le b -IFN, mais également l’interféron a (a -IFN) diminuent la synthèse du mRNA et des protéines FGF des cellules tumorales. Ces deux interférons inhibent la migration endothéliale in vitro, l’angiogénèse in vivo. Expérimentalement, les transplants chez la souris nude de tumeurs coliques ou rénales peuvent ainsi être impossibles sous la peau (présence de fibroblastes sécrétant de l’interféron b), mais possibles sous la capsule rénale (fibroblastes ne sécrétant pas l’interféron b).
D'autres molécules ont un rôle inhibiteur de l’angiogénèse, tout au moins expérimentalement. La corrélation avec la clinique n’existe pas toujours. Dans le sérum, les facteurs angiogéniques décrits plus hauts sont catabolisés très rapidement, et l’activité d’angiogénèse n’existe que très localement autour des cellules tumorales, quand les substances angiogènes sont en excès par rapport aux nombreux facteurs anti angiogènes.
La plupart des inhibiteurs de
l’angiogénèse sont
associés à l’héparine : le facteur plaquettaire 4 ou PF4, la
thrombospondine,
les facteurs stéroïdiens. Des dérivés synthétiques de l'héparine
(cyclodextrine
tetradecasulfate) sont en expérimentation clinique pour leur action de
dissolution de la membrane basale des capillaires en croissance, sans
activité
sur celle des capillaires au repos ou des gros vaisseaux.
Rôle possible de la protéine
p53
Un rôle important semble dévolu au gène p53 et à une protéine sécrétée avec ce gène, la thrombospondine, citée plus haut comme inhibitrice de l’angiogénèse. Les fibroblastes de malades atteints de cancers dans le cadre du syndrome de Li-Fraumeni ne contiennent qu’un seul allèle du gène p53 : ces cellules ne sont ni tumorigènes, ni angiogéniques in vivo chez la souris nude. Après de nombreux passages, quelques cellules vont perdre l’allèle restant p53. Elles deviennent angiogéniques et tumorigènes, et ne fabriquent plus de thrombospondine.
Le gène p53 pourrait agir aussi sur la
synthèse
de l’interféron a (a -IFN) : dans
certaines
lignées cellulaires issues de glioblastomes, existe une délétion du
gène p53.
Si on les fait réexprimer le gène, on observe une disparition du
pouvoir
angiogénique, avec réapparition de la synthèse de a-IFN.
La
délétion du gène pour le a -IFN s’observe dans des
cancers de
vessie, de mélanomes et de leucémies.
·
Mécanismes impliqués dans
l’angiogénèse
tumorale
Deux hypothèses peuvent être formulées
pour
expliquer la présence d’une angiogénèse intra-tumorale.
Réponse physiologique à des
besoins
métaboliques
Deux conditions physiologiques ou pathologiques peuvent expliquer un besoin accru de vascularisation :
·
Augmentation des besoins métaboliques
(effort physique, placenta, développement fœtal, cicatrisation, etc.)
·
Diminution du flux sanguin
(rétinopathie diabétique, maladie ischémique coronarienne, etc.)
Dans ces conditions physiologiques (ou pathologiques), on observe une sécrétion de VEGF, en réaction à l’hypoxie des cellules normales.
Dans les tumeurs très volumineuses, on observe une synthèse de VEGF (sous forme de mRNA) dans les cellules bordant la nécrose centrale (zone d’hypoxie), et une synthèse accrue de mRNA du récepteur KDR des cellules endothéliales voisines.
Ainsi, une proportion plus ou moins
importante de
l’angiogénèse tumorale serait en rapport avec l’anoxie des cellules
cancéreuses.
|
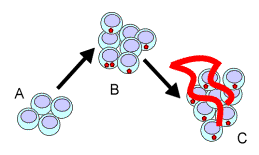
|
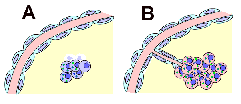
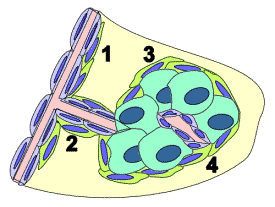
En
[A], la tumeur initiale primitive (ou la métastase dormante) non
vascularisée voit des cellules se multiplier à un rythme à peu près
équivalent à celui de l’apoptose. En
[B], la multiplication cellulaire s’est accrue ou une résistance à
l’apoptose s’est installée : les cellules au centre de la tumeur sont
hypoxiques et fabriquent du VEGF et du FGF. En
[C], la tumeur ou la métastase est irriguée et peut se multiplier. Source : Faculté de Médecine, Centre François Baclesse, Caen |
Réponse à une modification
génétique
Cette hypothèse suppose qu’une mutation supplémentaire des cellules cancéreuses entraîne une stimulation de l’angiogénèse et permet la croissance tumorale. Les cellules tumorales acquièrent ainsi un avantage pour leur développement, en modifiant l’équilibre subtil entre facteurs favorisant l’angiogénèse et facteurs inhibiteurs.
Certaines expériences montrent une corrélation entre la synthèse ou l’excrétion du VEGF et du bFGF et le pouvoir angiogénique et métastasiant des cellules tumorales. Ainsi, l’activation anormale de l’oncogène H-Ras augmente l’expression du mRNA pour le VEGF. A l’inverse, dans d’autres études, c’est la disparition de la synthèse des inhibiteurs de l’angiogénèse (par exemple la thrombospondine, dont le gène est proche de certains gènes suppresseurs et notamment le p53), qui expliquerait la vascularisation accrue des tumeurs.
|
|
Schéma de la deuxième hypothèse : les
cellules tumorales [A] (tumeur primitive ou métastase ‘dormante’)
perdent des gènes suppresseurs de tumeur, perdent des inhibiteurs de
l’angiogénèse ou
bien elles acquièrent de nouvelles propriétés de sécrétion de facteurs
angiogéniques [B] (représentés par le pentagone). La
tumeur devient ainsi bien oxygénée et peut pousser de façon importante
[C]. Source : Faculté de Médecine, Centre François Baclesse, Caen |
Si on transfecte expérimentalement une
tumeur
mélanique humaine par le gène du VEGF (cDNA), on observe, lors de la
transplantation dans la souris nude, une vascularisation accrue, mais
également
une augmentation du pouvoir métastatique. A l’inverse, la transfection
par un
cDNA antisense, induit une absence de toute synthèse de VEGF et
l’absence de
développement de la tumeur dans la souris nude.
retour sommaire
Un mélange de ces deux mécanismes
Il semble probable que ces deux mécanismes sont retrouvés in vivo.
Le phénomène de « dormance » constitue encore une énigme. Pourquoi certaines cellules métastatiques (c’est-à-dire ayant acquis certains gènes de l’angiogénèse pour quitter leur lieu initial de croissance) ne se développent-elles pas sur leur site métastatique, n’induisant plus d’angiogénèse, pendant des mois ou des années ?
La dormance ne signifie pas l’absence de prolifération. Le taux de prolifération des cellules de métastases dormantes est identique à celui des cellules des métastases actives, mais on observe un taux plus important d’apoptose. Cette apoptose est probablement induite par l’hypoxie. Lorsque d’autres gènes suppresseurs sont délétés (perte totale du p53, par exemple), on observe une diminution de la sensibilité des cellules à l’hypoxie.
Ainsi, trois mécanismes se conjuguent pour expliquer les relations entre croissance tumorale et angiogénèse :
· Utilisation des stimuli angiogéniques normaux en rapport avec les mécanismes physiologiques (hypoxie surtout),
· Production exagérée de facteurs angiogéniques,
· Perte des régulateurs de l’angiogénèse par altération génétique
b)
Vascularisation
tumorale et traitements
Une des difficultés rencontrées dans le traitement des cancer est de définir des traitements qui soient spécifiquement dirigés contre les cellules tumorales et qui soient le moins toxique pour les cellules saines.
L’oxygénation des
cellules
tumorales et par conséquent la néo-vascularisation est déterminante
dans
l’efficacité des traitement anticancéreux, il s’agira donc ici de
décrire les
différentes pistes thérapeutique, et l’incidence de l’oxygénation de la
tumeur
sur leur efficacité.
·
Hypoxie et oxygénation de la tumeur
La chimiothérapie et
la
radiothérapie diffèrent par les mécanismes de résistance ou
d’adaptation
qu’elles induisent au niveau des cellules tumorales. Pour les molécules
de
chimiothérapie, une exposition répétée au médicament peut entraîner une
résistance acquise. A contrario, les radiations utilisées en
radiothérapie vont
pénétrer physiquement les cellules. Elles vont certes se heurter à des
radiosensibilités variables, mais n’entraîneront jamais de résistance
acquise.
Cependant, que ce soit par médication ou par radiation, la réponse des cellules va dépendre de leur environnement et en particulier de la présence d’oxygène dans les tissus tumoraux au moment de l’exposition. Cette disponibilité en oxygène va à son tour dépendre de la vascularisation de la tumeur (hémoglobine, flux sanguin), de la pression interstitielle et du métabolisme cellulaire.
Facteurs influençant l’oxygénation tumorale
La croissance tumorale est soumise à deux conditions : il doit y avoir un apport nutritif et en oxygène d’une part, et les déchets métaboliques doivent pouvoir être éliminés d’autre part. Il y a dans de nombreuses tumeurs des changements typiques de vascularisation : faible néo-vascularisation, augmentation des distances inter-capilaires, distorsions des vaisseaux… Dans les modèles expérimentaux (rongeur), les tumeurs prolifèrent plus rapidement que les vaisseaux, la micro-circulation est ainsi rapidement perturbée. Des diminutions de débit sanguin, une circulation intermittente, une perméabilité anormale des vaisseaux sont observées. Concernant l’Homme, les données sont plus limitées, mais elles montrent tout de même que le débit varie considérablement d’une tumeur à une autre, y compris dans les tumeurs de même type histologique. Le débit peut être supérieur ou inférieur à celui du tissu d’origine, de manière générale, la taille de la tumeur n’a pas d’influence sur le taux de perfusion. Des shunts vasculaires ainsi que des détournements du volume sanguin peut également affecter le débit intratumoral.
Il est important de prendre en compte la pression interstitielle. En effet il existe trois compartiments dans une tumeur : 50% du volume occupé par le compartiment cellulaire, 10% par le compartiment vasculaire et 40% par le compartiment interstitiel. Dans le compartiment interstitiel, la pression est en général élevée pour trois raisons :
- une perte de vaisseaux lymphatique fonctionnels qui à pour conséquence une accumulation de liquide dans l’espace interstitiel,
- une perméabilité vasculaire élevée,
- une collapse (fermeture) des vaisseaux.
Le passage des vaisseaux dans le milieu interstitiel se fait par diffusion (proportionnelle à la surface d’échange et à la différence de concentration entre le plasma et le milieu interstitiel) et par convection (proportionnelle à la différence de pression entre les vaisseaux et le milieu interstitiel). Ainsi, alors que les courants de convection dans ces espaces sont estimés à moins de 1% du débit plasmatique dans les tissus sains, ils peuvent représenter jusqu’à 14% dans les tumeurs humaines. Cette augmentation de la pression interstitielle contribuera au fur et à mesure de la croissance de la tumeur à la diminution de sa perfusion.
Cela entraînera donc
une
diminution de l’oxygénation tumorale, et par conséquent le
développement de
nécroses. Le métabolisme de la tumeur et la concentration en oxygène
étant
interdépendant, plus ce métabolisme sera intense plus l’oxygène
disponible sera
faible si le débit sanguin est insuffisant.
Hypoxie tissulaire
L’hypoxie tumorale a tout d’abord été interprétée comme étant une conséquence de la distance entre les cellules et les vaisseaux nourriciers. En 1950, a été suggéré la présence de cellules hypoxiques dans les tumeurs. On a alors pensé que la présence d’une nécrose cellulaire à 100-120 mm des vaisseaux pouvait s’expliquer par la diffusion limitée de l’oxygène et par le métabolisme cellulaire (consommation d’oxygène). En l’absence d’oxygène, les cellules s’arrêtent dans leur cycle, la synthèse d’ADN et de protéines utiles diminue, des protéines de stress sont synthétisées et le taux de substances sulphydriles diminue. Ces altérations de la physiologie cellulaire diminuent la capacité des cellules à réparer les dommages radio et chimio-induits. Cette image de l’hypoxie dite chronique ou permanente appelée récemment « hypoxie liée à la limitation de diffusion de l’oxygène » à longtemps été la seule à prévaloir.
Dans les années 1980, ce schéma classique a été reconsidéré car l’existence de zones hypoxiques à proximité immédiate des vaisseaux a été visualisée grâce à différentes méthodes (laser doppler, injections de colorants…). Cette hypoxie appelée intermittente ou transitoire, est liée à une occlusion temporaire des vaisseaux, les cellules étant alors alternativement oxygénée puis soumise à une hypoxie. La durée de ces collapsus vasculaires reste mal connue et pourrait être de l’ordre de quelques minutes à quelques dizaines de minutes. L’hypoxie transitoire pourrait accélérer la progression tumorale et renforcer son pouvoir métastasique. De plus dans les cellules soumises à une hypoxie transitoire, la décroissance des substances sulphydriles est peu importante car la durée de l’hypoxie est limitée. Par conséquent les cellules restent peu radio-sensibles.
La variation intermittente du débit sanguin dans les tumeurs pourrait être liée à la constriction partielle des muscles lisses dans les artérioles et à un collapsus des capillaires centraux alimentés par le vaisseau nourricier. La pression qui conduit à une fermeture des vaisseaux n’est pas liée à une pression excessive dans les tissus normaux, mais plutôt à une pression interstitielle élevée, et présenterait une rythmicité. Ce nouveau concept a eu des conséquences importantes pour le développement de nouvelles thérapies anticancéreuses. Pour réduire l’influence de l’hypoxie sur la radiosensibilité tumoral, les traitements devraient agir aussi sur les cellules en hypoxie permanente ou transitoire.
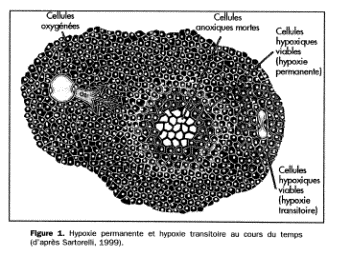
Pour quantifier l’oxygénation
tissulaire des tumeurs on peut utiliser les méthodes indiquées dans le
tableau
de la page suivante, l’oxymétrie étant la plus utilisée :
|
Non invasives |
Résolution |
Paramètre |
|
RMN PET SPECT |
< 500 mm > 1 mm > 5 mm |
Métabolisme Imagerie Imagerie |
|
Invasives |
|
|
|
Oxymétrie Résonance paramag. des électrons Laser Doppler Etude au microscope après biopsie - nitromidazoles marqués - test des comètes Cryophotospectrométrie Quenching |
10 – 200 mm 10 – 100 mm Cellule Cellule Erythrocytes Cellule |
Flux des érythrocytes Cellules hypoxiques Cassures ADN HbO2 Concentration en ATP |
Les considérations théoriques sur
l’angiogénèse commencent
à avoir une certaine importance en clinique, même si elles ne
débouchent pas,
pour l’instant, sur des progrès thérapeutiques.
Valeur pronostique de la quantification de
l'angiogénèse
Sur une coupe histologique, l’utilisation
d’anticorps anti CD31 ou anti facteur VIII permet un immuno-marquage
spécifique
des capillaires de la tumeur.
Le nombre de micro-vaisseaux dans les tumeurs du sein est corrélé avec le risque de métastases. En analyse multivariée, la densité en micro-vaisseaux chez les malades sans ganglions envahis constitue un meilleur facteur pronostic que le grade tumoral, la taille tumorale et les récepteurs en œstrogène. Sur les coupes histologiques, reflétant l’hétérogénéité biologique habituelle des cancers, les tumeurs ont des secteurs plus ou moins denses quant à leur néo-vascularisation : c’est la quantification du secteur le plus vascularisé qui exprime au mieux le pronostic.
Une telle valeur pronostique se retrouve également pour les cancers du poumon, de la prostate, et ORL, ainsi que pour le risque de récidives locales dans les tumeurs cérébrales.
Quantification des peptides dans
les urines
ou le sang
Le dosage radio-immunologique du facteur bFGF dans le sang montre une augmentation du taux chez les malades cancéreux (300 à 400 pg/ml comparé à un taux normal de 30 pg/ml).
Dans les urines, on retrouve chez près de 37% des malades cancéreux des concentrations de bFGF dépassant la limite supérieure des sujets normaux (90% du percentile : 600 pg/g de créatinine).
Les taux les plus élevés sont retrouvés chez les nourrissons porteurs d'hémangiomes (prolifération rapide des vaisseaux capillaires) avec des taux urinaires dépassant fréquemment 20 000 pg/g de créatinine. Ces niveaux reviennent à la normale quand l’hémangiome régresse spontanément à l’âge de 2 à 4 ans. Si on doit traiter l’hémangiome (risque vital dû à sa situation, risque pour la vue), on observe une chute rapide dès le début de la régression. Il n’existe aucune modification du taux de bFGF urinaire dans les autres malformations vasculaires.
Le rôle pronostic du dosage du VEGF est encore à
déterminer.
|
TIMP
1 et 2 Troponine 1 Throbospondine1 Glioma
derived angiogenesis inhibitory factot |
|
IFNa / b Platelet
factor 4 PEDF
(pigment epithelium-derived factor) |
|
Fragment 16 kDa de la
prolactine Fragment de la
fibronectine Angiostatine EndostatineAntithrombine ANUP (Anti neoplastic urinary protein |
Tableau
non exhaustif des inhibiteurs naturels de l’angiogénèse
· Vers des médicaments anti-angiogénèse
Rôle de
l'interféron
dans les hemangiome dangereux
La découverte du rôle anti-angiogène de l’interféron a-2 a conduit à son utilisation thérapeutique dans les hémangiomes à risque du nourrisson. La majorité des hémangiomes ne nécessitent aucun traitement, régressant spontanément avec l’âge. Quelques localisations présentent des risques vitaux ou fonctionnels importants (coagulopathie secondaire, localisations intracrâniennes, hépatiques, pulmonaires, gastro-intestinales). Les corticoïdes sont très actifs, mais leurs effets secondaires sont importants, notamment sur la croissance de l'enfant.L’interféron a-2 est très efficace chez le nourrisson porteur d’hémangiome, bien mieux supporté chez l’enfant que chez l’adulte (peu de réactions fébriles notamment).
Autres
essais
thérapeutiques
De nombreuses tumeurs ont été traitées par l’interféron ; cependant, l’activité de cette thérapeutique n'apparaît constante que dans certaines hémopathies par des mécanismes d’action sans rapport avec l’angiogénèse.
L’action potentielle des médicaments à
visée anti
angiogénèse pourrait s’exercer surtout pour la prévention des
métastases ou la
réduction du risque de récidive locale, après un traitement local ou
général
approprié. Parmi les molécules semblant prometteuses, on peut citer le
tétra-hydro-cortisol (qui n’a aucune activité corticoïde), le
tétradécasulfate
de b -cyclodextrine, la minocycline, qui, expérimentalement, réduisent
le
nombre de métastases (tumeur de Lewis de la souris) et augmentent la
survie des
animaux, après un traitement initial par un médicament antimitotique.
Ils
semblent très bien tolérés. Ces futurs médicaments devant être
administrés
pendant de longues périodes, cette bonne tolérance permettra de donner
au
patient une bonne qualité de vie. A l’heure actuelle, les essais
cliniques ne
sont pas encore commencés, mais il s’agit là d’une voie de recherche
prometteuse.
· Approche thérapeutique utilisant le débit tumoral
Schématiquement, deux types d’approches combinées sont possibles pour traiter une tumeur :
- augmenter le débit tumoral afin d’augmenter l’apport des médicaments anti-cancéreux et/ou augmenter l’oxygénation des cellules tumorales afin de les rendre plus radiosensibles.
- Réduire le débit tumoral afin d’induire des mécanismes aboutissant à l’ischémie de la tumeur et/ou à une hypoxie favorisant l’action de thérapeutiques cytotoxiques et de thérapies géniques spécifiques.
Augmentation du
débit
tumoral :
La plupart des essais destinés à augmenter le débit tumoral ont utilisé des vasoconstricteurs. Les mécanismes d’autorégulation présents dans les tissus sains sont absents au niveau de la tumeur. Pour cette raison, l’augmentation de la pression artérielle induite par le vasoconstricteur (administré de façon systémique) entraîne une augmentation importante du débit sanguin intratumoral. Cette solution est utilisée pour accroître l’apport de substances anti-cancéreuses à la tumeur et augmenter ainsi l’effet thérapeutique. L’angiotensine II est le vasoconstricteur le plus utilisé et l’augmentation de débit tumoral qu’elle induit a été mise en évidence sur différents types de tumeurs.
Réduction du
débit
tumoral :
La croissance des
tumeurs solides
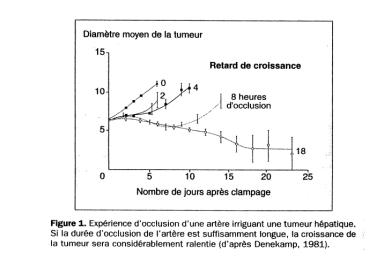
nécessite un apport sanguin important. Comme l’a montré Denekamp, une
occlusion
de quelques heures de l’artère irriguant une tumeur a un effet majeur
sur cette
croissance. Les mécanismes en sont multiples et seulement partiellement
connus
à ce jour : réduction de l’apport en oxygène, altération du pH
local,
accumulation de métabolites toxiques, activation locale de mécanismes
immuno-inflammatoires.
On peut utiliser pour cela soit une approche
directe, soit
une approche indirecte :
L’approche directe est pharmacologique, elle aboutit à une réduction sélective de la perfusion tumorale et repose sur les réponses spécifiques des vaisseaux irriguant les tumeurs lors des stimuli par certains antagonistes.
L’approche indirecte consiste à induire une effet de vol entre vaisseaux irriguant le tissu sain et vaisseaux irriguant la tumeur. Cet effet de vol est possible car les vaisseaux irriguant la tumeur sont dans un état de vasodilatation constant et quasi maximal. Un vasodilatateur n’a donc aucun effet sur ces derniers alors qu’il pourra dilater les autres vaisseaux (irriguant les tissus sains). L’administration d’un vasodilatateur aboutit donc à une nouvelle répartition des débits associés à une baisse de la perfusion tumorale.
En résumé, on peut dire qu’il est possible de combiner une approche vasculaire utilisant les spécificité des circulations tumorales et les approches anticancéreuses classiques. Ainsi une augmentation du débit tumoral induit par une élévation de la pression systémique peut permettre d’augmenter l’apport de substances thérapeutiques au niveau de la tumeur. Par ailleurs, elle favorise l’oxygénation de la tumeur et augmente par la même sa radiosensibilité.
A l’opposé, réduire le débit sanguin tumoral peut limiter la croissance de la tumeur, mais surtout, cette approche qui augmente l’hypoxie tumorale pourrait être combinée à l’utilisation de cytotoxines actives uniquement en milieu hypoxique. Pour la même raison, on peut envisager d’utiliser cette approche en combinaison avec des stratégies de thérapie génique.
· Oxygénation et radiosensibilité
Le rôle de l’oxygène dans la radiosensibilité a été évoqué pour la première fois par Petri en 1923. La première courbe établissant une corrélation entre pression partielle en oxygène et la radiosensibilité des cellules a été publiée en 1959. L’action biologique des radiations ionisantes de faible transfert linéique d’énergie (rayons X et g) dépend pour une large part de la pression partielle en oxygène présent dans l’environnement cellulaire au moment de l’irradiation car l’oxygène réagit avec les radicaux libres
Ainsi le rapport des doses délivrées en
l’absence et en
présence d’oxygène est de l’ordre de 3, à savoir qu’une cellule
oxygénée est
trois fois plus radiosensible qu’une cellule qui ne l’est pas.
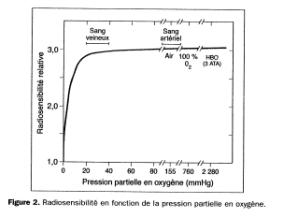
Pour des pressions partielles en oxygène observées le plus souvent dans les tissus sains (40 à 120 mmHg), la radiosensibilité est maximale, comparable à celle observée dans l’air. En revanche pour des pressions comprises entre 0 et 10 mmHg, pression fréquemment rencontrée dans les tumeurs, la radiosensibilité diminue très rapidement. Ces données ne sont valables que si la cellule reste en hypoxie pendant quelques heures. Dans le cas d’une hypoxie prolongée (plus de 24 heures), le taux de substances sulphydriles, et en particulier le glutathion, baisse ce qui entraîne une augmentation de la radiosensibilité, les sulphydriles n’assurant plus leur rôle radioprotecteur. Toutefois, la radiosensibilité reste bien inférieure à celle observée dans l’air.
Le processus de ré-oxygénation a été décrit en 1968 par Thomlinson. Dans les heures ou les jours qui suivent l’administration d’une dose de radiation ionisante, la proportion de cellules hypoxique devrait logiquement augmenter, puisque les cellules oxygénées, donc les plus radiosensibles vont être tuées en premier. Il s’avère au contraire que dans certaines tumeurs il y a une augmentation de l’oxygénation tumorale. Plusieurs hypothèses peuvent expliquer ce phénomène : mobilité des cellules, diminution du métabolisme des cellules irradiées et par conséquent meilleure diffusion de l’oxygène à partir des vaisseaux et possible diminution de l’hypoxie transitoire liée à un effet de l’irradiation sur les parois vasculaires.
·
Oxygénation et
chimiosensibilité
La présence d’oxygène est également un facteur important pour certains agents utilisés en chimiothérapie. En présence d’oxygène, les radicaux libres peuvent être responsables de cassures de l’ADN lorsque celui-ci est exposé à certains agents tels que bléomycine ou le melphalan. La progression tumorale est la conséquence de changements génétiques dans les cellules tumorales. Le micro-environnement peut influencer la vitesse d’apparition de variants résistants à certains médicaments, en particulier en présence d’hypoxie et lorsque celle-ci est transitoire. Les cellules hypoxiques présentes dans les tumeurs peuvent être chimiorésistantes pour plusieurs raison :
- les cellules situées à distance des vaisseaux peuvent ne pas être en contact avec le médicament, soit à cause de la distance de diffusion, soit à cause d’un métabolisme trop rapide
- les cellules situées à distance des vaisseaux sont souvent quiescentes. Des anti-métabolites comme cités précédemment ne peuvent agit que sur des cellules proliférantes.
La capacité pour les agents thérapeutiques d’atteindre toutes les régions de la tumeur en quantité suffisante reste donc le problème clé. Pour améliorer la délivrance des traitements dans une tumeur on peut :
- augmenter le débit sanguin ou la perméabilité vasculaire, la plus souvent cette augmentation est de courte durée et confinée à certaines zones bien vascularisées;
- diminuer la pression interstitielle en augmentant la conductivité hydrolique interstitielle;
- diminuer la densité vasculaire sans détruire la micro-vascularisation;
- augmenter le taux de transport des molécules en utilisant par exemple des produits de faible poids moléculaire, ce qui risquerait de provoquer une augmentation de la toxicité au niveau des tissus sains.
· Traitements oxygène-dépendants
Il existe deux types de cellules hypoxiques, celles qui sont en hypoxie permanente et celle qui sont en hypoxie transitoire. Les cellules en hypoxie chronique sont de manière générale radio-résistantes tant que les effets biologiques des radiations n’auront pas induit de changement dans le débit sanguin, ou une fonte tumorale. Les cellules en hypoxie transitoires vont avoir une radiosensibilité variable au cours du temps.
En théorie, plusieurs modalités peuvent être envisagées pour éliminer l’influence des cellules hypoxiques dans le traitement des cancers :
- augmenter l’oxygénation tumorale et supprimer les territoires hypoxiques,
-
diminuer
l’oxygénation tumorale afin de rendre toutes les cellules tumorales
hypoxiques
à l’aide de vasoconstricteurs et faire agir une cytotoxine spécifique
des
cellules hypoxiques.
c)
Les
équipes de recherche en France
Le tableau suivant liste de manière non exhaustive, les différentes équipes de recherche travaillant sur l’angiogénèse. Il précise la localité, le responsable du projet et le sujet de celui-ci :
|
|
|
|
|
|
|
Université Paris 13 Responsable : Jean-Luc Moretti |
UFR Santé,
Médecine et Biologie Humaine |
|
Nature:
Ciblage et imagerie fonctionnels de la progression tumorale Thèmes de recherche: Maîtrise et connaissance des modèles
expérimentaux d'angiogénèse tumorale. Objectif
: Mise en
oeuvre et évaluation de modèles expérimentaux pertinents permettant la
validation des cibles moléculaires et l'évaluation des médicaments et
des agents d'imagerie de la progression tumorale. Membres de
l'équipe: M. Kraemer
(PU), D. Briane (MCU-HDR), A.M. Cieutat-David (MCU), C. Derbin (PU), M.
Di Benedetto (ATER). |
|
|
Hôpital Saint Antoine L. Degos
Responsable: J. Capeau |
Service de Cancérologie Service
de Cancérologie
|
|
Objectif : Recherche fondamentale et
clinique sur les tumeurs solides et en onco-hématologie : invasion
locale des tumeurs (protéases, remodelage matriciel, processus
inflammatoires et angiogénèse).
Recherche fondamentale et clinique
sur les tumeurs solides et en onco-hématologie: invasion locale des
tumeurs (prostéases, remodelage matriciel, processs immunité tumorale,
pharmacologie des anti-tumoraux). |
|
|
Grenoble
Responsable: Hôpital Saint Louis Responsable : L. Degos |
Biologie cellulaire,
virologie moléculaire et thérapeutiques innovantes des tumeurs.
|
|
Objectif : Différenciation
cellulaire, modulation pharmacologique; invasion et angiogénèse;
immunité tumorale; pharmacologie des anti-tumoraux.
|
|
|
Faculté de Médecine
Necker Responsables: O. Clement ; E. Kanh ; Ca. Cuenod A. Todd-Pokropek
|
Laboratoire de recherche en imagerie U 494 Laboratoire de recherche en imagerie
U 494
|
|
Thématiques impliquant l'imagerie dans
l'équipe ou le laboratoire :
Thématiques
implicant l'iagerie dans l'equipe ou le laboratoire: -Imagerie
fonctionnelle de la microcirculation : applications aux tumeurs, au
foie, à l'angiogénèse, au placenta. - Produits de contraste en IRM - Vectorisation
tumorale: agents de contraste spécifiques et vectorisation
magnétique - Imagerie optique |
|
|
Amiens Responsables: Pr. Marc-Etienne Meyer et Pr. Reinhard Grebe |
L'Unité de
Génie Biophysique et Médical est implantée sur trois sites Amiénois.
L'unité est associée au CNRS (UMR 6600) depuis Janvier 2000. |
|
Objectif : Proposer des techniques d’exploration plus
sensibles et des méthodes de détection plus spécifiques de certaines
pathologies encéphaliques tumorales et infectieuses tel que
l'angiogénèse. |
d)
Bilan
du chapitre : ce qu’il faut retenir
-
La formation des
vaisseaux sanguins est un
processus
qui met en œuvre plusieurs types cellulaires : les cellules
endothéliales
qui tapissent la paroi de vaisseaux, les péricytes qui stabilisent les
parois
et des cellules circulantes.
- La morphogenèse de l’arbre vasculaire commence par un bourgeonnement des capillaires dans toutes les directions, suivi d’un élagage.
- Les facteurs angiogéniques ne sont pas spécifiques des cellules endothéliales. Parmi les facteurs identifiés à ce jour, le VEGF est considéré comme essentiel à la formation des vaisseaux sanguins dans l’embryon.
- Ce sont des facteurs angiogéniques sécrétés par les cellules cancéreuses en hypoxie, qui fournissent aux cellules endothéliales le signal qui les sort de la quiescence. Ils déclenchent les premières étapes de la formation des vaisseaux sanguins.
- La stimulation des cellules endothéliales par les facteurs angiogéniques diminue l’adhérence des cellules endothéliales entre elles et leur permet de migrer à travers la nouvelle matrice extracellulaire qui se forme à la suite de l’extravasation des protéines du plasma.
- Les facteurs spécifiques de la formation de certains lits vasculaires commencent à être identifiés. Le SDF-1 et son récepteur CXCR-4 pour les vaisseaux qui irriguent l’estomac et l’intestin par exemple.
- Le réseau vasculaire irriguant la tumeur provient le plus souvent de la périphérie de celle-ci. La paroi des artérioles qui le constituent est souvent fine avec une média atrophiée. Le réseau intratumoral a un aspect chaotique, hétérogène, avec des vaisseaux sinueux, sans arborescence hiérarchique et présente de nombreux shunts artério-veineux. Il a été récemment démontré que les caractéristiques anatomiques des réseaux tumoraux sont influencés par le type de tumeur.
- L’angiogénèse se développe à partir des vaisseaux de l’hôte dans la zone péritumorale. Le réseau tumoral en formation est caractérisé par une grande plasticité. Pour la plupart des tumeurs, ce processus aboutira à un gradient de densité de vaisseaux caractérisé par une zone périphérique dense en vaisseaux et une zone centrale pouvant être quasi avasculaire.
- Si le niveau de perfusion sanguine des tumeur peut varier considérablement, il existe en général, pour chaque tumeur, trois zones de perfusion allant d’une zone périphérique bien irriguée à une zone centrale ne recevant presque pas de sang. Dans la tumeur, l’écoulement est lent.
- Le niveau d’oxygénation dans les tumeurs est globalement plus bas que dans les tissus sains. L’oxygénation tumorale est surtout caractérisé par l’existence de zones hypoxiques, en particulier dans la partie centrale de la tumeur. La consommation d’oxygène par la tumeur est variable, y compris pour un même type de tumeur. On peut toutefois considérer que la consommation moyenne se situe entre celle des organes à faible consommation et ceux à forte consommation d’oxygène.
- La demande métabolique importante liée aux nombreuses cellules en phase de croissance induit une forte libération d’ions H+ dans l’espace interstitiel tumoral. Le drainage relativement faible de cet espace induit un abaissement marqué du pH extracellulaire dans les tumeurs.
- Plusieurs éléments caractéristiques de la circulation tumorale agissent simultanément pour rendre difficile l’apport des molécules thérapeutiques au centre des tumeurs solides, à savoir, la précarité de la perfusion au centre des tumeurs, les faibles surfaces de diffusions liées au petit nombre de vaisseaux, le grand nombre de cellules tumorales correspondant à chacun des rares micro-vaisseaux, la pression interstitielle élevée limitant le transport convectif des molécules, le piégeage des molécules dans l’espace interstitiel.
- La formation de nouveaux vaisseaux sanguins n’est pas toujours indispensable au début du développement tumoral, car les cellules cancéreuses peuvent recruter des vaisseaux préexistants pour proliférer.
- Les vaisseaux sanguins peuvent favoriser la croissance tumorale en permettant aux cellules cancéreuses de proliférer.
- Les relations entre l’irrigation des tumeurs et leur croissance dépendent des mutations qui affectent les cellules cancéreuses.
- La pression interstitielle est beaucoup plus élevée dans les tumeurs que dans les tissus sains.
- Au fur et à mesure de la croissance tumorale, la néovascularisation ne suffit pas pour assurer une oxygénation tissulaire optimale.
- Au sein des tumeurs solides, des cellules clonogènes peuvent être dans un environnement hypoxique, cette hypoxie peut être transitoire ou permanente.
- Différentes méthodes, invasives ou non permettent de quantifier l’hypoxie tissulaire. Chez l’homme, la plus utilisée est l’oxymétrie.
- Les tumeurs chez l’Homme sont moins bien oxygénées que les tissus sains environnants, elles renferment des zones hypoxiques où la pression partielle en oxygène est inférieure à 10 mmHg, des fluctuations de la perfusion micro-régionale ont également été observées.
-
De façon globale, le métabolisme tumoral
n’est pas
différent de celui des tissus sains, néanmoins à l’échelle
micro-régionale, le
métabolisme est perturbé dans les zones tissulaires hypoxiques.
·
Vascularisation et traitements
- Des inhibiteur de l’angiogénèse ont été purifiés dans des tissus avasculaires. Ces inhibiteurs sont souvent des fragments protéolytiques de protéine qui ne jouent pas de rôle connu dans l’angiogénèse.
- En règle générale, on ne connaît pas le mécanisme d’action des inhibiteurs de l’angiogénèse. Il semble que le rôle de ces facteurs au cours de l’angiogénèse physiologique soit limitée.
- La plupart des stratégies mises en œuvre pour bloquer l’angiogénèse visent à stopper la prolifération ou la migration des cellules endothéliales. L’intégrine avb3 est l’une des cibles privilégiées de ces approches.
- Les stratégies ciblées sur l’endothélium ont permis d’obtenir le ralentissement de la croissance, et parfois la régression de tumeurs implantées sous la peau de souris. Les résultats dépendent du stade auquel les inhibiteurs sont implantés. Généralement, ces stratégies ne provoquent qu’un assoupissement des tumeurs.
- Pour éviter le réveil des tumeurs en fin de thérapie anti-angiogénèse, il existe deux types d’approche:
la répétition de plusieurs cycles avec des inhibiteurs de l’angiogénèse. Cette approche est possible dans la mesure où les cellules endothéliales ne développent pas de résistance. Elle nécessite de grande quantité d’inhibiteurs et de vecteurs viraux.
L’association entre une thérapie ciblée sur l’endothélium et une autre ciblée sur les cellules cancéreuses. Les protocoles restent à définir.
- Il est possible de combiner une approche vasculaire utilisant les spécificités des circulations tumorales et les approches anticancéreuses classiques. Ainsi une augmentation du débit tumoral induit par une élévation de la pression systémique peut permettre d’augmenter l’apport de substances thérapeutiques au niveau de la tumeur. Par ailleurs, elle peut augmenter l’oxygénation des cellules tumorales, augmentant ainsi leur radiosensibilité.
- A l’opposée, réduire le volume sanguin tumoral peut limiter la croissance tumorale, mais surtout cette approche qui augmente l’hypoxie pourrait être combinée à l’utilisation de cytotoxines actives uniquement en milieu hypoxique. Pour la même raison, on peut envisager de combiner cette approche avec des stratégies de thérapie génique utilisant l’hypoxie pour favoriser l’expression d’un gène, ou utilisant des protéines à tropisme anaérobique comme vecteur.
- Une augmentation de l’oxygénation tumorale (ré-oxygénation) est prouvée dans les tumeurs expérimentales. Cette oxygénation peut varier en cours de traitement dans les tumeurs humaines.
- Les cellules hypoxiques (pO2 < 10 mmHg) sont moins radiosensibles que les cellules bien oxygénées. Elles peuvent également être moins sensible à certains agents chimiques utilisés en chimiothérapie.
-
L’hypoxie tissulaire peut entraîner la
sélection de
variants résistants aux traitements.
Cours de Cancérologie, Médecine
Pr.
Jean-François Héron
Faculté de Médecine, Centre François Baclesse, Caen
Angiogénèse, perspectives
Angiogenesis and Cancer Control: From
Concept to Therapeutic Trial
Internet, Steven Brem, MD
Vascularisation Tumorale et Traitements
anticancéreux
Eric Lartigau, M.
Guichard
“John Libbey
Eurotext”
Institut de Biologie de Lille
/ Réseau Français d’Angiogénèse
L’angiogénèse tumorale : une question
de
ravitaillement
Denis
Gingras et Richard
Béliveau
Synthèses
M/S (médecine/sciences), no 9, mars-avril
1998
a)
Place
de l’IRM en Oncologie
·
Tableau
récapitulatif par organe visé
|
Site
Tumorales |
Examens
cliniques (par ordre d’intention) |
Buts
des
examens |
|
SEIN |
1.
Mammographie
|
Dépistage
tumeurs Dépistage
tumeurs superficielles et suivi thérapeutique Suivi et
Différenciation entre récidive et fibrose àmultifocalité. |
|
CERVEAU |
1. TDM
|
Dépistage
tumeur
|
|
FOIE |
1.
Echographie
|
Extension
Métastatiques |
|
PROSTATE |
1.
Echographie endorectale
|
Dépistage
et
bilan d’extension extra prostatique
‘’ ‘’ |
L'IRM est utilisé essentiellement dans le bilan d’extension locale des cancers du sein et du cerveau. Il peut détecter des cancers du seins non vus en mammographie mais le nombre attendu de cancers en IRM n'est pas suffisant pour justifier son utilisation en dépistage.
L'IRM est une méthode de 2ème intention et permet donc de compléter l'exploration anatomique conventionnelle des cancers en apportant des informations spécifiques de l'angiogénèse tumorale, le plus souvent dans le même temps diagnostique.
b)
Séquences
et options en IRM
Ce chapitre a pour objectif de comprendre le principe des différentes séquences réalisables en IRM. Leur compréhension, particulièrement l’imagerie rapide, les séquences injectées, l’imagerie de diffusion et de perfusion, est primordiale car elle permettra de comprendre le choix des séquences en cancérologie et dans la détection de la vascularisation tumorale.
Cette séquence est constituée de deux impulsions RF. Au temps t=0, une impulsion RF de 90° fait basculer la magnétisation longitudinale dans le plan transverse, et fait apparaître la magnétisation transverse. Au temps t=TE/2, l’impulsion de 180° remet en phase les protons en cours de déphasages. Un signal est alors enregistré suite à ce re-phasage au temps TE. Le choix du temps de répétition TR détermine la pondération du contraste de l’image en T1.
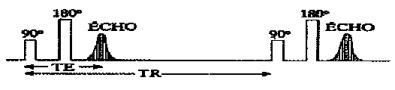
En effet, si le temps de
répétition qui sépare deux excitations de 90° est long par rapport au
temps de
relaxation T1 des tissus, les aimantations longitudinales
auront eu le
temps de totalement remonter entre chaque impulsion de 90° et ces
impulsions
re-basculeront effectivement dans le plan transversal avec une valeur
proche de
la valeur Mo de l'aimantation au repos.
Par contre, si le temps de
répétition TR qui sépare les deux excitations de 90° est court par
rapport au T1 des
tissus ou de l'ordre de ces T1, les aimantations correspondantes n'auront eu
le temps de
remonter qu'à une valeur intermédiaire (MR sur le schéma) et lors du 90°
suivant, l'aimantation lue n'est pas égale à la valeur Mo mais une
valeur MR . Cette
valeur dépend du TR et du temps de relaxation T1 du tissu concerné.
Pour plusieurs tissus avec des
T1 différents on s'aperçoit que pour des TR longs il y a peu d'effet de
T1 et qu'au
contraire, pour des TR relativement courts ou de l'ordre de ces temps
de
relaxation T1, les effets de T1 sur l'intensité des signaux
mesurés sont notables. Le liquide céphalo-rachidien par exemple, qui a
le T1 le plus
long et qui remonte le moins vite, donne le plus faible signal, la
substance
blanche qui a un T1 plus court et qui remonte donc plus vite, aura,
pour cette
même valeur de TR, un signal plus élevé que celui du liquide
céphalorachidien
(LCR).
Le choix du temps d'écho TE
détermine la pondération en T2
du contraste de l’image en exprimant
les
variations de la composante transversale dont la décroissance se fait
en T2 sur la
séquence de spin écho. Si on se réfère cette fois aux courbes de
relaxation
transversale pour différents tissus, on constate que lorsqu'on choisit
un temps
d'écho TE très court, la décroissance en T2 intervient peu et l'amplitude
de l'écho lue correspond à peu près à celle de l'aimantation
longitudinale
basculée dans le plan transversal par l’impulsion de 90°. Par contre,
si les
temps d'écho sont plus longs, de l'ordre des temps de relaxation T2, voire
plus longs que ceux-ci, cette décroissance en T2 est sensible. Le liquide
céphalo-rachidien qui a le plus long T2, garde un signal plus élevé que
la substance blanche qui a un T2
plus court et une composante
transversale qui
décroît donc plus vite.
En conclusion, on remarque les faits suivants :
- Le choix d'un temps de
répétition long (par rapport au temps de relaxation T1)
entraîne peu d'effets du temps de relaxation T1 sur la mesure des
intensités de signaux.
- Le choix d'un temps d'écho
court (par rapport au temps de relaxation T2) entraîne peu d'effet du temps
de relaxation T2 sur les intensités mesurées.
A l'inverse,
- Un temps de répétition court
(par rapport au temps de relaxation longitudinal) entraîne des effets importants de ces temps de
relaxation T1 sur les intensités des signaux.
- Des temps d'écho longs (par
rapport au temps de relaxation transversal) entraînent des effets
importants
des temps de relaxation T2 sur les intensités de signaux.
On en déduit qu'une séquence
avec Un TE court et un TR court donnera une image pondérée en T1 puisque
ce seront les effets de T1 qui vont dominer. Un TE et un TR longs donnera
des images
pondérées en T2. Un TE court et un TR long, on obtiendra un
contraste
pondéré en densité de protons puisque la mesure faite de l'écho est
assez
voisine de l'aimantation Mo de départ, sans que celle-ci soit entachée
ni par
les effets de T1, ni par les effets de
T2.
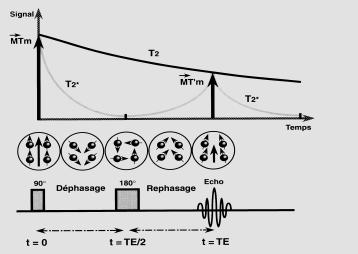
Chronologie des évènements au cours du
phénomène
Spin-Echo :
-
t=0,
application de
l’impulsion de 90° qui bascule MLo
dans le
plan transversal.
Les spins sont en phase et l’aimantation
transversale
est
maximale.
-
Les spins se
déphasent
rapidement : disparition de l’aimantation transversale
-
T= TE/2,
application de
l’impulsion de 180°
-
Les spins se
rephasent
-
T=TE, les spins sont
rephasés : le signal
réapparaît sous la forme d’un écho et peut être mesuré.
Cependant, les
spins ne
sont pas parfaitement rephasés. Ce
déphasage est la conséquence de la
relaxation
spin-spin irréversible. On mesure alors un T2 vrai.
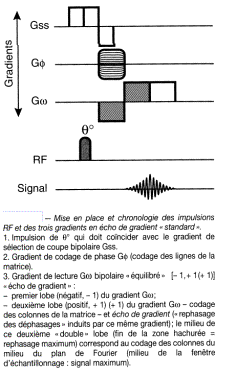
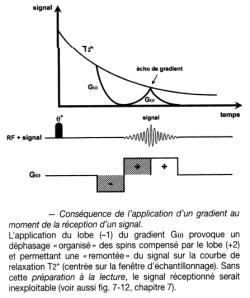
· Echo de Gradients
On peut obtenir un écho de signal RMN à distance de l'excitation de 90°, en appliquant un gradient de lecture dans un sens pendant un temps donné t, puis en l'inversant ensuite.
On observe alors au bout du temps 2 t, un écho, qu'on appelle « écho de gradient », et dont l'amplitude suit la décroissance en T2*. L'obtention de cet écho de gradient permet de faire l'économie d'une impulsion de 180°, mais ne permet pas alors de s'affranchir des effets de l'inhomogénéité du champ Bo sur la mesure du signal RMN. Pour ce qui concerne les images pondérées en T1 cela est sans conséquence. Par contre, pour les images pondérées en T2, on aura non plus un contraste en T2 mais un contraste en T2*.
L'intérêt de ces séquences en
écho de gradient est de pouvoir utiliser pour l'excitation, des
impulsions dont
l'angle est largement inférieur à 90°. Une impulsion qui bascule
l'aimantation
d'un angle de 30° suffit pour créer une composante transversale
significative.
De plus, on note que cette impulsion à 30° n'annule pas l'aimantation
longitudinale, ce qui nous autorise à travailler avec des temps de
répétition
beaucoup plus courts. Le gradient de sélection de coupes est appliqué
en même
temps que l'impulsion sélective, le gradient de codage de phase est
appliqué
autant de fois qu'il y a de lignes ou de colonnes dans la matrice de
l’espace
de K, et le gradient de lecture est appliqué d'abord dans un sens puis
en sens
inverse, permettant la production de l'écho de gradient et le codage en
fréquence nécessaire dans la direction correspondante.
|
|
|
·
Séquences Inversion Récupération (I-R)
Le contraste en T1 d’une séquence de Spin Echo n’est pas excellent car il est limité par la réduction maximale du TE. Pour engendrer un contraste optimal en T1, il faut utiliser une séquence particulière appelée Inversion Récupération (I-R). Elle comporte une impulsion de 180° (inversion) qui a pour but d’inverser l’aimantation Mz0 puis MLr lors de la répétition. Il n’y a donc pas initialement d’aimantation transversale. Ensuite on laisse repousser l’aimantation longitudinale de - Mz0 à + Mz0. Enfin, pour pouvoir mesurer l’aimantation, on bascule au temps TI (temps d’inversion) le vecteur Mz par une impulsion de 90°. Le signal est mesuré soit après l’impulsion RF de 90°, soit lors d’un écho après une impulsion supplémentaire de 180°(séquence IRSE = Inversion Récupération Spin Echo).
L’augmentation du contraste en T1 est liée au fait que lors de la repousse en T1, l’aimantation longitudinale décrit un double parcours (de –Mz0 à +Mz0) et majore ainsi la compétition en T1 en accentuant les différences de contraste. Cette séquence très bien pondérée en T1 permet de parfaitement différencier la substance blanche et la substance grise. Sa qualité explique pourquoi on utilise des séquences IR dans les atlas d’anatomie.
On peut recueillir le signal de deux manières différentes en séquence d’IR :
- Soit on ne tient compte que du module du signal, c’est à dire des valeurs positives. Dans ce cas on utilisé des TI relativement longs pour faire en sorte que la majorité des tissus observés soient revenus dans le positif. Dans le cas contraire, les courbes de deux tissus peuvent se croiser et donner des signaux identiques pour deux tissus distincts. Cela crée une annulation de contraste en ce point.
- Soit on prend en compte le module du signal et la phase. En effet un tissus à aimantation positive et un tissus à aimantation négative présentent une différence de phase de 180°. Ceci permet de leur attribuer un signe positif ou négatif. La différence entre les tissus est alors affichée sur une échelle de gris plus étendue, ce qui permet de mettre en évidence les différences de T1 avec des TI plus courts.
Enfin la séquence d’inversion récupération
permet de par
ses propriétés particulières de réaliser des suppressions de graisse ou
de
liquide par exemple : En effet lors d’une séquence IR, tous les
tissus
passent par 0 lors de la repousse (pour TI=0,69 T1). On peut mettre à
profit
cette annulation de contraste pour supprimer des structures comme la
graisse.
Pour cela il suffit de choisir un temps d’inversion tel que TI=0,69 T1
graisse.
On appelle cette séquence STIR. On peut également supprimer les
liquides (LCR),
il s’agit de la séquence FLAIR.
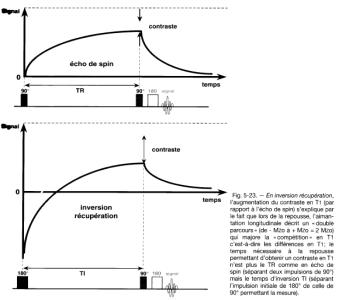
·
Séquences Injectées (Gadolinium)
Les éléments à propriétés paramagnétiques, c'est-à-dire possédant dans leurs couches électroniques des électrons célibataires comme le gadolinium sont utilisés en médecine dans un but diagnostique pour renforcer le contraste en imagerie par résonance magnétique, IRM.
Le gadolinium est un élément classé parmi les terres rares, présent seulement à l'état de traces dans la nature. Il existe sous forme de plusieurs isotopes stables. Du fait de l'existence de sept électrons célibataires, le gadolinium a un effet paramagnétique ou ferromagnétique très élevé, en comparaison avec le fer.
En raison de son effet paramagnétique, le gadolinium présent dans l'eau accélère les vitesses T1 et T2 de relaxation des protons après leur stimulation par une onde électromagnétique. Ce phénomène permet d'améliorer le contraste des images obtenues.
La première indication du gadolinium était la mise en évidence par IRM de la rupture de la barrière hématoencéphalique. Il existe maintenant d'autres utilisations : le diagnostic des tumeurs cérébrales, des tumeurs de la moelle épinière, des os, des parties molles, du foie…
Quelques effets
indésirables, réactions allergiques,
nausées, vomissements et exceptionnellement chocs anaphylactiques et
crises
convulsives, ont été signalés lors de l'utilisation des dérivés du
gadolinium.
De nombreux efforts ont été
réalisés pour développer ce que l’on appelle l’imagerie rapide. Des
séquences
beaucoup plus rapide que les séquences classiques sont utilisées durant
les
examens cliniques.
Le gain en vitesse est obtenu principalement
grâce aux
progrès des bobines de gradient, de l'électronique, des méthodes de
lecture du
plan de Fourier, ainsi que de l'informatique permettant le traitement
de
volumes de données toujours plus importantes. L'application des
hyper-gradients
(gradients d'intensité élevée de 20 - 30mT/m à temps de commutation
courts (0,2
- 0,4 mSec.) est le point de départ des nouvelles séquences et de
l'imagerie
ultra-rapide.
En effet, l'intensité maximale des gradients et leur temps de montée déterminent non seulement la résolution spatiale en terme d'épaisseur de coupes et de dimension de champ de vue d'une part, mais également la résolution temporelle et la résolution en contraste par l'intermédiaire du temps d'écho et du temps de répétition d'autre part.
Plusieurs approches permettent
de raccourcir le temps d'acquisition. Elles reposent sur un balayage
rapide et
plus ou moins complet du plan de Fourier (espace de K). La méthode
actuellement
la plus rapide est celle de l'Echo Planar Imaging (EPI) avec balayage
en dents
de scie de la totalité du plan de Fourier en un seul signal. Le temps
d’acquisition de l’EPI est de l’ordre de 100mSec par image.
Le contraste de l’image va correspondre au type
de
séquence EPI utilisée :
-
EG-EPI :
contraste en T2* (égal à celui d’une séquence
EG avec suppression de graisse, paramètres TE, TR et angle θ identiques)
-
ES-EPI :
contraste T2 (égal à celui d’une séquence
d’ES avec suppression de graisse, paramètres TE, TR et angle θ
identiques), IR-EPI : contraste en T1.
Ces séquences sont
particulièrement utilisées en imagerie de diffusion (voir suite).
La séquence Turbo Spin écho (TSE
ou FSE) est une séquence de type « multishot » dont le temps
d’acquisition est
de l’ordre de quelques minutes par image avec une pondération T2. La
séquence
écho de gradient EPI est aussi pondérée en T2. Le balayage rapide du
plan de
Fourier autorise également l’acquisition tridimensionnelle de coupes
très fines
(0,5 mm) en très haute résolution (1024 X 1024). Les principales
applications
en sont l’ exploration des paires crâniennes, de l’oreille interne, ou
encore
de l’épilepsie (hippocampe). Elles permettent également d'observer et
de
quantifier les variations de prise de contraste autorisant des mesures
de
perfusion tissulaire et de perméabilité capillaire. L’imagerie de
perfusion
(voir plus loin) permet d’évaluer de manière quantitative ou
semi-quantitative
la quantité relative de sang qui irrigue les tissus. Au niveau de
l’encéphale,
elle est fondée sur la quantification de l’effet de susceptibilité
magnétique
T2* induit lors du premier passage d’un bolus de Gadolinium.
Le flux, et en particulier le flux macroscopique est un paramètre important du contraste en IRM. Les protons circulants sont à l’origine d’artéfacts qui s’avèrent néanmoins utiles d’un point de vue diagnostic. Ces phénomènes de flux permettent de distinguer les vaisseaux sanguins, et ce sans utilisation de produits de contraste. Leur visualisation dépend du type de séquence utilisée (SE, EG), des paramètres de la séquence (TR, TE, épaisseur de coupe, angle de bascule), de la vitesse du flux sanguin et de l’orientation du vaisseau par rapport au plan de coupe. Ces phénomènes sont à l’origine de l’angiographie par résonance magnétique.
Le sang, riche en eau, possède une densité protonique élevée (0,8 environ) et un T1 relativement long (800 à 1200 ms à 1,5 T). Le T2 est quant à lui dépendant du degré d’oxygénation du sang car la désoxyhémoglobine a des propriétés paramagnétique qui réduisent le temps de relaxation transversal. Globalement on peut dire que le sang est de signal hypointense en T1 et hyperintense en T2.
Le flux sanguin se caractérise par :
- sa vitesse
- son accélération
-
sa
direction
Le flux est dit laminaire lorsque les vitesses sont relativement faibles (profil de vitesse parabolique, vitesse maximale au centre et quasi nulle près des parois) et turbulent lorsque les vitesses sont plus élevées. Ainsi le flux veineux est laminaire à vitesse relativement constante, le flux artériel est intermédiaire (laminaire en diastole et turbulent en systole).
Lorsqu’un vaisseau traverse un plan de coupe, l’intensité du signal va dépendre du temps de transit ou temps de vol (TOF= Time Of Flight) des protons définis par le temps Tt que met l’embole (partie du sang circulant dans le plan de coupe) à traverser l’épaisseur de coupe.
En spin Echo, on
observe deux
phénomènes, l’un appelé « entrée de coupe » caractérisé par
une
augmentation de l’intensité du signal, l’autre appelé « sortie de
coupe » caractérisé par une diminution du signal, voir son
annulation. En
Echo des Gradients, le signal s’accentue avec la vitesse du flux.
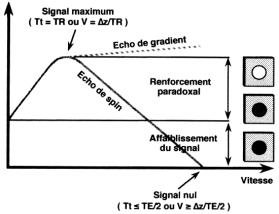
|
|
Spin Echo : Pour des vitesses lentes, l’intensité du
signal augmente jusqu’à un maximum (phénomène d’entrée de coupe ou
Renforcement Paradoxal) – vaisseaux en blanc –pour des vitesses plus
rapides, il diminue progressivement jusqu’à 0 (phénomène de sortie de
coupe, absence de signal) lorsque le flux atteint une vitesse seuil –
vaisseaux en noir – Echo des Gradients : Progression lente du signal (courbe en pointillés) |
Le phénomène de sortie de coupe permet de comprendre pourquoi un grand nombre
de vaisseaux sanguins sont visibles spontanément en IRM (vide de
signal) :
En Spin Echo, les impulsions RF étant sélectives dans
le plan de coupe, seuls les protons ayant subi les
impulsions successives de 90° et 180° peuvent engendrer un signal. Au
delà d’un
seuil de vélocité, les protons stimulés par l’impulsion de 90° ne sont
plus
dans le plan de coupe lors de la seconde impulsion de 180° (avant le
temps
TE/2, c’est à dire pour Tt≤TE/2). Il n’y a donc pas de signal, d’où
l’apparition des vaisseaux par génération de contraste naturel
(paroi/lumière).
Ce phénomène est caractéristique d’un flux rapide.
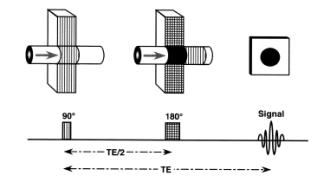
|
Absence
de signal : phénomène de sortie de coupe (flux rapide) Les protons quittent le plan de coupe entre l’impulsion de 90° et celle de 180°. Pas de signal : vaisseaux noirs. Le phénomène est maximal lorsque Tt ≤ TE/2 |
Le phénomène d’entrée de coupe est caractérisé par un renforcement paradoxal du signal. Celui-ci apparaît lorsque la vitesse du flux est telle qu’un renouvellement partiel ou total des protons a lieu à travers le plan de couple à chaque cycle d’impulsion RF (c’est à dire pendant l’intervalle TR). Les protons stimulés par la première impulsion sont des protons « frais » et non saturés comme les protons stationnaires, leur vecteur d’aimantation longitudinal est donc maximal de même que le signal qu’ils engendrent. Ce phénomène est maximal lorsque Tt=TR (voir schéma précédent). Dans le cas des séquences multicoupes, ce signal paradoxal prédomine sur les premières coupes (ou les dernières selon le sens du flux sanguin) car sur les plans de coupe intermédiaires, les protons sont préalablement stimulés par les impulsions des coupes en amont et sont donc partiellement saturés. Il est particulièrement fréquent sur les séquences d’EG, car même pour des flux très rapides, les TR courts s ‘adaptent aux Tt courts. De plus lorsque les TR sont courts, la séquence est généralement acquise en monocoupe et par conséquent chaque coupe successive se comporte comme une coupe d’entrée. Cette technique dite par « temps de vol » (TOF) est à la base de l’angiographie par résonance magnétique.
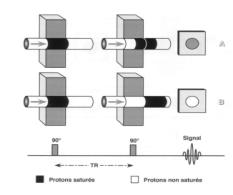
|
Phénomène d’entrée de coupe / renforcement paradoxal du signal (flux lent) : Les protons du plan de coupe préalablement
stimulés sont partiellement (A) ou totalement (B) remplacés par des
protons non encore stimulés durant le TR : apparition d’un RP, le
vaisseau devient blanc. Ce phénomène est maximal quand Tt=TR
|
|
|
|
|
|
|
|
|
Malformation
artério-veineuse
parièto-occipitale. (Angiographie par
Résonance Magnétique) |
|
·
Imagerie de diffusion et de perfusion
L’imagerie de
diffusion a pour but de mettre
en évidence les mouvements
microscopiques de l’eau dans les tissus (mouvement brownien). Ces
mouvements
peuvent être libres (diffusion élevée) ou
limités par des obstacles (diffusion réduite).
En IRM, en présence d’un gradient de champ magnétique, les mouvements des protons d’hydrogène entraînent des déphasages responsables d’une diminution de signal. Ces déphasages sont d’autant plus importants que le mouvements des protons est rapide.
Pour mettre en évidence ces mouvements macroscopiques, il faut que les séquences soient « pondérées en diffusion ». Pour cela, on ajoute des gradients de diffusion aux séquences de type EPI-SE (Echo Planar Imaging - Spin Echo, voir chapitre sur l’imagerie rapide) de part et d’autre de l’impulsion RF de 180°. Ces gradients n’ont aucun effet sur les protons fixe car le déphasage provoqué par le premier gradient est compensé par le second. Par contre pour les protons mobiles, le second gradient ne compense pas l’effet du premier, ainsi plus le mouvement des protons est rapide, plus le signal est atténué.
Pour résumer, les
images
pondérées en diffusion montrent un hypersignal dans les régions de
diffusion
moléculaire réduite et un hyposignal dans les zones de diffusion élevée.
L’effet de diffusion dépend de la valeur des gradients de diffusion mis en œuvre. Le facteur de gradient b se définit selon la relation suivante :
b= (γ G τ)²
(T- τ /3)
|
γ : rapport gyromagnétique G : amplitude du gradient |
τ : durée d’application du gradient T : temps séparant l’application des deux gradients |
b s’exprime en s/mm² et peut varier de 0 à 3000 et plus sur les imageurs actuels. Plus b est élevé, plus la pondération en diffusion est élevée.
Les gradients de diffusion sont appliqués selon les trois axes x, y et z et intégré dans une séquence EPI-SE. Cette technique est parfaitement adaptée car elle dispose d’une excellente résolution temporelle et peut couvrir l’ensemble du cerveau en quelques secondes. En pratique on réalise trois séquences EPI successives avec gradient de diffusion respectivement dans l’axe de sélection de coupe, du codage de phase et du codage en fréquence. Ces trois images peuvent être reconstruite par moyennage des pixels sous la forme d’une quatrième image (image trace) ne laissant apparaître l’hypersignal que s’il est présent sur les trois images.
L’examen visant à mesurer la diffusion comporte habituellement, dans un premier temps, une série de coupe EPI pondérée en T2 avec un facteur b=0, puis dans un second temps, une autre série avec un 500<b<3000 (4 images, x, y, z et trace) sachant que plus b est élevé plus le rapport S/B diminue.
Un paramètre intéressant à mesurer en imagerie de diffusion est le CDA (Coefficient de Diffusion Apparent). Il permet d’évaluer précisément les anomalies de diffusion. Le calcul du CDA se réalise à partir d’au moins deux acquisitions, l’une avec un b=0 donnant un signal So, l’autre avec un b déterminé (élevé si possible) donnant un signal S. La valeur du CDA (en mm²/s) est alors donnée par la formule suivante :
Log (S / So) = -b . CDA
Dans une image CDA, la diffusion lente est visualisée par un hyposignal et la diffusion rapide en hypersignal (contrairement aux images de diffusion).
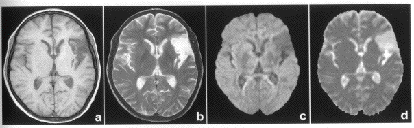
Coupes axiales cérébrales chez un patient présentant
une ischémie ancienne dans le territoire
de
l’artère cérébrale moyenne gauche.
La zone lésés apparaît hypointense sur
l’image
pondérée en T1 (a) et hyperintense sur l’image pondérée en T2 (b). La
lésion
est hypointense en imagerie de diffusion (b=1000) (c) et hyperintense
en image
CDA (d) ce qui correspond à des propriétés de diffusion équivalente à
celle du
LCR.
La
quantification CDA peut être intéressante en complément de l’imagerie
de
diffusion. En effet les séquences de diffusions sont pondérées en T2 de
par
leurs TR et TE très longs (il faut du temps pour pouvoir placer les
gradients
de diffusion). Du coup, les structures au T2 long apparaissent
hyperintenses
comme les structures à diffusion lente, d’où un risque de mauvaise
interprétation. Ce phénomène de persistance de signaux intense
(artéfacts) du
aux structures à T2 long est appelé « T2 shine-through ».
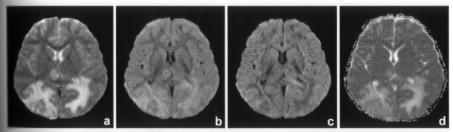
Coupes axiales cérébrales réalisées en
séquence EPI
pondérée en diffusion chez un patient présentant une infection
cérébrale
fongique.
L’œdème
apparaît hyperintense sur l’image pondérée en T2 (a : image sans
gradient
diffuseur, b=0), mais également sur l’image faiblement pondérée en
diffusion
(facteur b= 500), illustrant l’effet T2 shine-through (tissu à T2
long). Cet
artéfact est corrigé par l’augmentation du facteur b
de diffusion (augmentation de la pondération en diffusion),
l’œdème étant alors bien hypointense (c : facteur b=1000). La
cartographie
CDA (d) confirme l’augmentation de la vitesse de diffusion
(hypersignal).
On peut résumer les signaux obtenus en imagerie
de
diffusion en fonction du type de séquence utilisé et la diffusion
réelle de la
structure observée :
|
Séquence
de diffusion |
Diminution
de la diffusion |
Augmentation
de la diffusion |
|
EPI , b<< |
Hypersignal + T2 shine-through |
Hyposignal + T2 shine-through |
|
EPI, b>> |
Hypersignal |
Hyposignal |
|
Imagerie CDA |
Hyposignal |
Hypersignal |
L’imagerie
de
perfusion permet d’estimer les
variations
de volume sanguin dans les tissus sains ou pathologiques. La
micro-circulation
est analysée en utilisant des traceurs exogènes ou endogènes. Ces
derniers vont
modifier le signal provenant des tissus explorés.
Les produits de contrastes généralement utilisés sont à base de gadolinium, qui sont connus pour raccourcir les temps de relaxation T1 et T2. Mais lorsque le gadolinium est confiné dans la micro-vascularisation capillaire, il entraîne une baisse de signal par phénomène de susceptibilité magnétique. En effet la présence de substance paramagnétique dans le vaisseau provoque un gradient par rapport aux tissus environnants en raison de cette susceptibilité plus élevée. Ce phénomène, surtout visible en Echo des Gradients, entraîne une diminution de signal au niveau du vaisseaux et des quelques millimètres alentours. La baisse du signal observé est proportionnelle à la concentration capillaire du produit de contraste.
Le suivi des modifications de signal liées au passage du produit de contraste dans un temps très court impose l’utilisation de séquences ultra rapides en Echo des Gradients (EPI-EG) afin de couvrir l’ensemble de la région d’intérêt en quelques secondes et d’améliorer la sensibilité des images au phénomène de susceptibilité magnétique.
L’ensemble
des
coupes acquises est ensuite traité par un logiciel de post-traitement.
Celui-ci
permet de calculer la variation d’intensité de signal en fonction du
temps sur
la zone d’intérêt.
A partir de
la
courbe obtenue, on peut alors calculer différents paramètres
représentatifs de
la perfusion de la zone d’intérêt :
- le temps d’arrivée de bolus (BAT),
- le temps d’arrivée au pic (TTP),
- le temps de transit moyen (TTM)
- L’amplitude du pic
- Le volume sanguin cérébral régional (rCBV)
-
Le débit sanguin cérébral régional (rCBF)
à CBF = CBV / MTT (en ml/100g/min)
Le schéma
suivant présente la forme caractéristique de la courbe et ses
variations en
fonction de la perfusion de la zone d’intérêt.
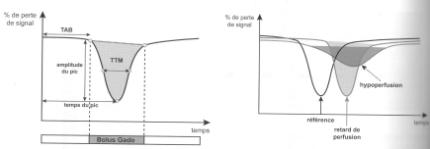
Les
paramètres
obtenus peuvent également être représentés sur une image ne niveaux de
gris ou
en code couleurs. On peut alors visualiser une cartographie CBF, CBV ou
MTT :
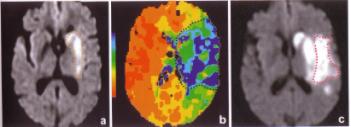
|
Caractérisation de la zone de pénombre
ischémique : -
Imagerie
de diffusion visualisant un accident ischémique (a) -
Cartographie
de la mesure de perfusion cérébrale, hypoperfusion dans la zone en
pointillés (b) -
Imagerie
de diffusion montrant l’extension de l’accident ischémique (c) |
L’imagerie de perfusion trouve de nombreuses applications au niveau de l’encéphale, en oncologie notamment: elle permet d’étudier la vascularisation tumorale, de différencier les prises de contrastes dues à une rupture de la BHE (barrière hémato-encéphalique), de celles liées à la vascularisation ou encore de distinguer une zone de radio-nécrose d’une récidive tumorale, cette liste n’étant pas exhaustive.
La présence de graisse peut compliquer la vision de certaines lésions pathologiques de signal élevé au sein (effet accentué pour les séquences injectées) de structures graisseuses. La graisse est également responsable d’artéfacts de mouvement ou de déplacement chimique.
Les techniques de suppression de graisse peuvent par conséquent s’avérer intéressante pour améliorer la précision diagnostique dans certaines pathologies et pour améliorer la qualité d’image.
La séquence STIR utilise le principe d’inversion récupération (voir « séquence I-R »). Lors de cette séquence, tous les tissus repassent par 0 lors de la repousse. Cette annulation du contraste peut être mise à profit pour supprimer de l’image une structure gênante. Il suffit de choisir un temps d’inversion tel que TI=0,69 T1 de la structure que l’on veut supprimer. Ce TI est relativement court, d’où l’appellation STIR (Short Time Inversion Recovery). Néanmoins cette séquence présente quelques particularités qui inversent le contraste de certaines substances. Cela arrive lorsque la machine ne tient pas compte de la portion négative de Mz. De plus cette séquence peut entraîner la suppression de tissus ayant des T1 proches de la graisse telles que les lésions hémorragiques.
Concernant les applications de la séquence STIR, une grand intérêt réside dans l’effet cumulatif des T1 et T2 longs des tissus associés à la suppression des tissus à T1 courts. Les lésions tumorales apparaissent alors hyperintenses et sont mieux délimitées.
On peut également utilisé une technique de saturation sélective. Il s’agit d’utiliser la différence de fréquence de résonance entre les protons de l’eau et de la graisse. Il est ainsi possible de supprimer la graisse en ajoutant une impulsion sélective centrée sur le pic de résonance de la graisse (impulsion dont la fréquence est décalée de 208 Hz par rapport à l’impulsion habituelle). Ainsi lors de l’impulsion suivante de 90°, le signal de la graisse n’aura pas eu le temps de repousser, obtenant ainsi la suppression du signal. Cette technique est appelée FatSat ou ChemSat.
Les séquences de Dixon utilisent le déphasage entre la graisse et l’eau (2,4 ms à 1,5T). On peut mettre à profit ce phénomène en réalisant une séquence Spin Echo modifiée. Cette séquence produit deux images, l’une classique (S1) et l’autre pour la quelle les protons de l’eau et de la graisse sont déphasés (S2). En additionnant S1 et S2 on obtient une image visualisant les protons d’eau (suppression de la graisse), en soustrayant S1 et S2 on supprime l’eau. Cette séquence reste néanmoins imparfaite car elle est très sensible aux inhomogénéités du champ magnétique.
On peut supprimer des liquides par des séquences d’IR en allongeant les temps d’inversion. C’est la séquence FLAIR (Fluide Attenuated Inversion Recovery). Elles sont utiles pour détecter des plaques périventriculaires mais restent peu pratiques (généralement couplées à une séquence d’ESR)
L’ensemble des
séquences
utilisées en IRM est récapitulé en annexe 4
(séquences en IRM)
c)
Modalités
d’exploration en IRM
L’installation et le centrage du patient répondent à des protocoles préétablis. Selon la région explorée, le décubitus dorsal (le plus courant) ou ventral (en cas de claustrophobie du patient) est choisi. Les choix d’antennes répondent également à des protocoles tenant compte de la morphologie du patient et de la région ou organe à visualiser. On essaie toujours d’obtenir un facteur de remplissage le plus proche de 1: c’est à dire que le volume à explorer doit correspondre au volume couvert par l’antenne afin d’optimiser le rapport signal/bruit. Une antenne de surface permettra d’obtenir un signal important et d’augmenter ainsi la résolution spatiale mais ne couvrira qu’une région superficielle; à l’opposé une antenne de volume offrira un signal plus homogène et permettra d’explorer en profondeur.
Le centrage est réalisé grâce à un faisceau lumineux ou laser selon 2 ou 3 plans de l’espace. Le centre d’intérêt de la région à explorer doit se trouver au milieu de l’antenne et cette dernière doit être placée au centre de l’aimant. On peut parfois décaler le patient pour que la zone d’intérêt se situe au centre du tunnel (l’épaule par exemple).
Un examen IRM impose quelques précautions liées à l’utilisation d’énergies hautes fréquences. On surveille notamment le coefficient d’absorption maximal (SAR, Specific Absorption Rate) correspondant à l’énergie HF absorbée par unité de temps et par Kg de masse corporelle. En effet certaine séquence d’imagerie rapide peuvent transmettre une énergie non négligeable à l’organisme du fait de l’augmentation du nombre d’impulsion RF pendant les séquences. L’atteinte de la limite du SAR peut entraîner des brûlures localisées au niveau d’implants métalliques ou maquillage contenant des pigments ferromagnétiques. Ce risque peut être compensé par la diminution des angles de bascule des impulsions RF (120-150 au lieu de 180°). D’autre part les séquences EPI peuvent entraîner des stimulations nerveuses périphériques liées à la création de courant électrique par induction (commutation rapide des gradients c’est à dire des variations rapides de champs).
Enfin le dernier risque lié à l’utilisation de l’IRM est le « quensh ». Cet accident est lié au passage de l’aimant d’un état de supraconduction à un état de résistivité entraînant une libération d’hélium (gaz utilisé pour refroidir l’aimant supraconducteur) dans la salle. Ce risque extrêmement limité peut entraîner asphyxie et brûlure à froid du patient.
Il est
important
de préciser que la survenue de tels incidents / accidents est rarissime
et est
contrôlée par des systèmes de surveillance fiables (contrôle du SAR,
système
d’évacuation des gaz dans la salle…).
L’étape de
paramétrage est
primordiale et permet de :
- programmer et lancer les séquences d’acquisition
-
d’optimiser
la qualité d’image
Les paramètres mis en
jeux lords
d’une exploration en IRM sont :
- le contraste
- le rapport signal/bruit
- la résolution spatiale
- la présence d’artéfacts
-
le
temps d’acquisition
L’acquisition d’images de qualité constitue un compromis constant entre rapport S/B, résolution spatiale et temps d’acquisition, ces facteurs étant dépendants les uns des autres.
Les différents paramètres à régler lors d’une programmation de séquence sont les suivants :
- le plan de coupe : sagittal, frontal, transverse ou oblique, mise en place d’une séquence de repérage.
- Le type de séquence : spin écho, écho de gradients, Fast-SE, I-R, EPI, STIR…(voir chapitre précédent)
- Les paramètres modifiant le contraste : TE, TR, angle de bascule. (tableau 1)
- Les paramètres ne modifiant pas le contraste : épaisseur de coupe, FOV (field of view) carré ou rectangulaire et matrice symétrique ou asymétrique. A noter que l’augmentation de l’épaisseur de coupe entraîne une augmentation du rapport S/B et une diminution de la résolution spatiale.(tableau 2)
|
|
|
Rapport S/B |
contraste |
T Acq |
Divers |
|
Temps de
répétition |
|
|
En T1 |
|
nombre de coupes |
|
|
|
En T1 |
|
nombre de coupes |
|
|
Temps d’écho |
|
|
En T2 |
|
nombre de coupes |
|
|
|
En T2 |
|
nombre de coupes |
|
|
Angle de
bascule |
|
|
En T1 |
|
|
|
|
puis |
En T2 ρ |
|
|
Tableau : influence de TR, TE et angle
de bascule sur le contraste, le
rapport
S/B et le temps d’acquisition (source
« comprendre l’IRM – B. Kastler, 2003)
Le traitement des images prend de plus en plus d’importance pour l’Angiographie par Résonance Magnétique, les acquisitions 3D et l’imagerie fonctionnelle. Un exemple sera présenté dans les chapitres suivant et est visible en annexe 3.
d)
Spécificités,
modalités et exploration de l’angiogénèse en IRM
Cette partie a pour
objectif de
présenter les applications de l’IRM en cancérologie pour deux types de
tumeurs
(le sein et le gliome cérébral), de dépeindre la manière dont sont
détectées
les tumeurs mais également de présenter les protocoles types utilisés
lors des
examens en IRM. Il s’agit enfin d’expliquer comment explorer
l’angiogénèse avec
les connaissances actuelles.
Le diagnostic du cancer du sein reste basé sur
le triplet
mammographie-échographie-ponction, L’IRM ne peut remplacer ces méthodes
en
raison de sa spécificité insuffisante mais elle a une place
intéressante dans
le bilan d’extension et surtout dans la surveillance du cancer du sein
traité.
D’un point de vue technique l’examen sera pratiqué dans presque la totalité des cas avec injection (0,1 à 0,2 mmol/kg en bolus suivi d’un flush de sérum physiologique), le but étant de détecter l’angiogénèse qui accompagne les cancers.
Les séquences sont
conditionnées
par plusieurs impératifs :
-
Une pondération T1 pour détecter les rehaussements après
gadolinium
- Une durée
suffisamment courte pour détecter le rehaussement des
tumeurs
avant le reste de la glande et réaliser une étude dynamique (répétition
des
séquences pendant 5 à 6 minutes). La plupart des cancers se rehaussent
durant
la première minute et l’on choisira une durée de 60 à 90 secondes qui
constitue
un bon compromis.
-
La nécessité d’explorer l’ensemble du sein avec une résolution
spatiale
suffisante : coupes < 3mm et matrice 256. L’étude d’un seul
sein permet
de réduire le champ et d’obtenir une meilleure résolution spatiale.
Les séquences d’écho
de gradient
3D pondérées selon T1 répondent le mieux à ces impératifs.
Une étude dynamique (répétition de la séquence 4
à 5 fois
après injection) permettra d’effectuer une étude de la cinétique de la
prise de
contraste et d’améliorer la spécificité de la méthode.
Le plan de coupe
dépend du choix
que l’on fait d’explorer un ou deux seins : ce choix dépend de
l’indication et il n’y a pas de protocole standard.
La qualité d’image
sera meilleure
si l’on explore un seul sein. Celui-ci sera alors exploré en coupes
sagittales.
En cas d’étude bilatérale, on choisira le plan axial. On
peut coupler les 2 types d’explorations avec une étude
unilatérale sur le sein choisi en coupes sagittales complétée par des
coupes
axiales sur les 2 seins en sachant que l’étude axiale sera faite à un
stade
tardif, ce qui affaiblira la spécificité.
Détection
des prises de contraste
L’analyse qualitative repose sur la mise en évidence d’un rehaussement focalisé après injection.
La graisse mammaire en hypersignal T1 va gêner la détection des rehaussements après gadolinium. Deux méthodes sont possibles pour s’affranchir du signal de la graisse :
-
La suppression de graisse qui a l’inconvénient d’allonger les séquences
(quelques secondes), de rehausser par effet relatif le signal de la
glande
saine mais
surtout de ne pas toujours être totalement efficace en
raison
d’inhomogénéités de champ.
-
La méthode de soustraction comme en radiologie vasculaire mais la
qualité
d’image est sujette aux mouvements du sein lors de l’exploration. On
peut
réaliser une
analyse initiale des images soustraites pour repérer les
zones
d’hypersignal suspectes qu’on étudie ensuite de façon complémentaire
sur les
coupes natives.
On étudie ensuite la morphologie du rehaussement :
-
en faveur de la malignité, un rehaussement hétérogène ou
périphérique (D¹
abcès), un rehaussement serpigineux (ne pas confondre avec des
vaisseaux
normaux) ou à distribution galactophorique.
-
En faveur de la bénignité, les contours nets et la présence de
septas
internes (rare mais très en faveur d’un adénofibrome).
D’un point de vue
quantitatif, la
spécificité de l’IRM étant relativement faible (60% environ), on peut
tenter de
l’améliorer en réalisant une étude cinétique des rehaussements par
établissement d’une courbe de rehaussement :
-
en faveur de la bénignité, un rehaussement progressif et
inférieur à
100% du signal initial.
- en faveur de la malignité, un rehaussement précoce et intense avec plateau ou mieux baisse du signal vers la 5ème minute (phénomène de lavage).
Sensibilité
et spécificité
La sensibilité de
l’IRM est
proche de 100% pour les lésions infiltrantes (exception rare : les
cancers
colloïdes ou très fibreux) et la négativité de l’examen sera donc
rassurante.
Par contre, elle
chute à 50 %
environ pour les cancers intracanalaires. Malgré la confrontation des
méthodes
qualitatives et qualitatives, la spécificité de l’IRM reste décevante
(60%
environ) et ses indications devront être bien pesées, la découverte de
prises
de contraste sans traduction échographique ou mammographique posant des
problèmes
de prise en charge (en attendant les ponctions sous IRM qui ne sont pas
encore
rentrées en routine) d’autant qu’il faut prendre en compte l’angoisse
des
patientes.
Tableaux récapitulatif des indications et contres-indications:
(source :
CerVal)
|
Mauvaises
indications |
Bonnes
indications |
IRM à visée
diagnostique
L’IRM ne doit pas être proposée comme examen
diagnostique : - les
opacités relèvent de la biopsie sous échographie ou mammographie. - Il
est illusoire d’espérer caractériser les foyers de microcalcifications,
ne doit pas non plus être exploité en vue d’une caractérisation car ils
présentent un nombre élevé de faux positifs et faux négatifs. -
Les
anomalies architecturales sont également une mauvaise indication et
doivent bénéficier d’emblée d’une biopsie chirurgicale. |
Bilan d’extension
La suspicion de multifocalité constitue
une bonne indication car elle est susceptible de modifier la conduite
thérapeutique |
Evaluation de
chimiothérapie néoadjuvante
La chimiothérapie néoadjuvante a le double
intérêt de proposer un traitement conservateur dans certaines tumeurs
volumineuses en cas de bonne réponse et d’évaluer l’efficacité de la
chimiothérapie qui constitue un facteur pronostique important. |
|
Détection des cancers
infracliniques
Elle est illusoire du fait de la sensibilité
médiocre de l’IRM dans les cancers in situ. |
Surveillance de seins
traités
Il s’agit sûrement de la meilleure indication,
la mammographie et parfois l’échographie pouvant être mises en échec.
On recommande d’attendre au moins 12 mois et la spécificité sera
pratiquement de 100% après 18 mois. La surveillance des prothèses mammaires peut
être proposée - pour
chercher des ruptures (séquences T2 avec annulation de graisse) - également
dans la détection des lésions malignes car la sensibilité de l’IRM est
supérieure à celle de la mammographie et les indications de la biopsie
sont plus délicates en cas de prothèse. |
|
Exploration des seins denses Elle est
également une mauvaise indication (nombreux faux positifs). |
L’IRM peut être proposée en cas de discordance
entre
imagerie et données biopsiques, devant une opacité difficile à biopsier.
L’IRM est donc une méthode de 2ème intention d’exploration du sein et ses indications devront être bien pesées pour éviter des difficultés de prise en charge liées à une spécificité faible de la méthode. Celle-ci sera améliorée lorsqu’il sera possible de réaliser en routine des ponctions sous IRM et l’on pourra alors envisager d’élargir les indications.
·
Le système nerveux central (SNC),
exemple du gliome
cérébral
Les gliomes cérébraux représentent plus de 9/10 des tumeurs malignes primitives cérébrales. Environ 7000 nouveaux cas de gliomes cérébraux, par million d’habitants, apparaissent chaque année et, dans le même temps, 4500 décès par million d’habitants sont dus à cette affection.
L’IRM est particulièrement adaptée à l’exploration du SNC et au diagnostic et suivi du cancer. Il peut donc être, contrairement au sein, un examen de première intention. Les caractéristiques du signal d’un gliome cérébral sont les suivantes:
Spontanées :
Par référence au signal moyen du cerveau, la tumeur est habituellement hypointense en T1, hyperintense en T2, indissociable de l’hypersignal de l’œdème associé, plus ou moins marqué. Parfois la plage tumorale peut comporter des zones hémorragiques (hypersignal en T1 et en T2), ou des calcifications dont seules les plus volumineuses seront reconnues par leur absence de signal.
Après
injection :
Les zones non rehaussées après injection au sein d’une tumeur prenant le contraste correspondent à des zones nécrotiques ou à des zones kystiques. Il est essentiel de savoir que la zone de rehaussement, ne représente pas la limite de la tumeur, car des cellules tumorales peuvent être mises en évidence par biopsie stéréotaxique, au delà de cette zone. Bien plus, on ne peut même pas considérer la limite de l’hypersignal en T2 comme une limite de "sécurité" car on peut trouver des cellules malignes en dehors de cette zone, qui représente donc un tissu œdémateux parsemé de cellules tumorales. Le terme d’œdème périlésionnel est donc inapproprié, et il vaut mieux parler d’œdème lésionnel.
La vascularisation et la nécrose tumorale caractérisent le grade tumoral. Si la premier ne permet pas isolément de distinguer un grade II d’un grade III (car le rehaussement de contraste n’implique pas obligatoirement le critère histologique de prolifération endothéliale), la mise en évidence du deuxième implique ipso facto un glioblastome, donc un grade IV. Il est néanmoins parfois impossible de différencier nécrose et composante kystique.
Un protocole type pour les tumeurs
intracrâniennes de
l’adulte est présenté en annexe 5.
Exploration de la néo-angiogénèse
Comme nous l’avons vu précédemment, la formation de néo-vaisseaux résulte de la production par la tumeur d’éléments biochimiques, enzymes et médiateurs qui viennent au contact de l’endothélium vasculaire en franchissant la membrane basale des vaisseaux de voisinage, induisant ainsi une prolifération endothéliale en direction de la tumeur. Cette prolifération endothéliale s’organise en néo-vaisseaux, mais, à la différence des vaisseaux normaux, elle est insuffisamment régulée et, outre la prolifération " directionnelle " qui augmente la longueur du vaisseau, il persiste une prolifération en épaisseur, intraluminale, caractéristique histologique fondamentale de la gradation des tumeurs gliales. Ces néovaisseaux ne s’organisent pas selon le schéma harmonieux (artériole-capillaire-veinule) de l’angioarchitecture normale et manquent également des capacités de régulation de flux des vaisseaux normaux. Il en résulte une irrégularité de flux avec des zones de stase où se produit une agrégation plaquettaire, facilitée par les altérations de l’endothélium, conduisant à des thromboses et des foyers de nécrose tumorale, autre élément de gradation de malignité, et à des hémorragies intratumorales. Enfin ces néovaisseaux sont anormalement perméables et laissent diffuser le liquide plasmatique, augmentant la teneur en eau du tissu tumoral et des tissus avoisinants (œdème). Leur barrière hémato-encéphalique défectueuse contribue au rehaussement de contraste en imagerie, extravasation du produit de contraste dans les tissus tumoraux mais n’est pas seule en cause car l’augmentation de perméabilité s’exerce aussi, par l’action de médiateurs, sur les vaisseaux (normaux) péritumoraux, contribuant à l’œdème péritumoral et au rehaussement de contraste.
Il existe deux mécanismes de prise de contraste : la rupture de barrière hématoencéphalique, aspécifique, traduite par le rehaussement de contraste classique (après injection de gadolinium en T1) d’une part et la néovascularisation, détectable uniquement par imagerie de perfusion (partie II b) d’autre part. L’IRM est parfaitement adapté car le rehaussement de contraste dépeint plus exactement la rupture de barrière hémato-encéphalique et la néovascularisation tumorale.
La prise de contraste observée lors d’une séquence injectée au gadolinium est présentée en annexe 2.
·
Modalités de détection de l’angiogénèse
en IRM
L'imagerie, jusqu'alors anatomique, évolue actuellement afin d'exploiter les connaissances acquises sur la biologie tumorale, et améliorer ses capacités de détection, de caractérisation et de suivi thérapeutique des cancers.
Pour ce type d'examen, il
est indispensable d'injecter un produit de contraste (Gadolinium) qui
modifie
le temps de relaxation des protons de la lésion et augmente le signal
lésionnel. L'imagerie par résonance magnétique permet ainsi d'évaluer
l'angiogénèse
par la quantification de la diffusion dans le tissu tumoral de produit
de
contraste macromoléculaires, due à la perméabilité accrue des
néovaisseaux.
L'acquisition répétée d'images après injection intraveineuse de produit de contraste permet de suivre le rehaussement tissulaire et d'en déduire des paramètres reflétant la micro circulation tumorale. L'angiogénèse tumorale a pour conséquence une augmentation de la densité vasculaire qui, en imagerie, se traduit par une augmentation du flux sanguin et du volume sanguin tumoral. Les vaisseaux tumoraux ont comme autre particularité leur perméabilité élevée due à la formation incomplète des jonctions intercellulaires et de la membrane basale. Cette caractéristique peut être mesurée en imagerie par la constante de transfert endothélial et le volume de distribution extravasculaire et extracellulaire. Ces paramètres de perfusion et de perméabilité ont été utilisés avec succès pour détecter les tumeurs, différencier les lésions bénignes des lésions malignes, et pour le suivi de thérapies anti-angiogéniques en IRM dans les cancers cérébraux et du sein.
La détection de la néo-vascularisation par l’IRM
est donc
permise par l’imagerie de diffusion qui quantifie la diffusion du
produit de
contraste dans le tissu tumoral (utilisation de séquences EPI) et
l’imagerie de
perfusion qui cartographie les structures en mettant en évidence les
hypo et
hyper perfusions (voir chapitre II b).
L'IRM permet
ainsi de
déterminer :
- Volume sanguin
- Débit sanguin
- Perméabilité vasculaire
- Index de taille des
vaisseaux
- Oxygénation tissulaire
-
volume sanguin
-
débit sanguin
-
perméabilité
vasculaire
-
index de taille des
vaisseaux
-
oxygénation
tissulaire
Néanmoins de nombreux travaux sont en cours, et la détection de l’angiogénèse n’est encore systématiquement dans les protocoles d’examens IRM en oncologie.
|
|
|
Masse tumorale pariéto-occipitale droite e : Fast SE T2, f : SE injectée Gadolinium T1, g : imagerie de diffusion (nécrose hypointense au centre), h : CDA (nécrose hyperintense au centre). |
Le traitement d’image post acquisition permet de visualiser la vascularisation de manière plus précise. Les images présentées en annexe 3 est ont été créées par opération de différence :
Il s’agit d’acquérir une même coupe au cours du temps contenant une séquence de référence classique et plusieurs séquences injectées au gadolinium. Les images obtenues lors des séquences injectées sont soustraites à la séquence de référence afin de faire ressortir la diffusion du produit de contraste dans la tumeur.
Considérons deux images, l’image de référence et l’image à soustraire. Par soustraction entre deux images on comprend l’opération de différence entre la valeur (niveau de gris) de chaque voxel de l’image de référence et la valeur correspondante de l’image à soustraire (voxel ayant les mêmes coordonnées).
La soustraction de niveaux de gris (par exemple de 0 à 256) implique une nouvelle plage de niveau de gris pouvant prendre des valeurs négatives (- 256 à 256). Cela nécessite un ré-étalonnage de la plage de niveaux de gris dont la valeur 0 correspond alors à la valeur centrale. C’est pourquoi les images obtenues par différence sont de couleurs gris clair (toutes les zones inchangées entre l’image R et l’image S prennent la valeur 0 et apparaissent donc en gris clair).
Entre la
séquence de référence et la séquence à soustraire, seule la diffusion
du
produit de contraste fait varier l’image, ainsi seules les zones
perfusées
présentent une différence de teinte lors de la soustraction des images
R et S.
Cela permet ainsi de faire ressortir les zones vascularisées de manière
plus
précise et d’observer l’angiogénèse tumorale
La visualisation de
l’angiogénèse
tumorale implique l’utilisation de produit de contraste dérivés du
gadolinium
(ou autres gaz hyperpolarisés) afin d’observer une prise de contraste
au niveau
des zones vascularisées.
L’utilisation
d’imagerie rapide
(type E.P.I.) est appropriée afin de suivre en temps réel la perfusion
du
gadolinium dans la tumeur. L’utilisation de séquence Echo Planar peut
être mise
à profit en imagerie de diffusion (qui permet de déterminer des
coefficients de
diffusion apparente –CDA) et de perfusion (la mieux appropriée
puisqu’elle
cartographie les zones d’hypo et d’hyper-perfusion).
Enfin le traitement d’image peut apporter en précision notamment par des opérations de différence (soustraction entre image de référence et image injectée).
e)
Les
autres techniques d’imagerie
Principe
C'est une méthode non irradiante et tout à fait inoffensive (peut donc être utilisé chez les femmes en enceinte ou en cours d'halètement), fondée sur la capacité qu'ont les ultrasons d'être réfléchis par les différents tissus de l'organisme, qu'ils soient denses ou mous. les ultrasons sont émis par un générateur électrique et pénètrent dans le corps par l'intermédiaire d'une sonde. Leurs échos sont, grâce à un procédé électronique, traduits en images sur un écran.
Le développement de sondes de haute fréquence (13 MHz) a augmenté la sensibilité de détection des flux intratumoraux par l'échographie Doppler.
L'efficacité des traitements anti-angiogéniques a pu être évaluée sur l'évolution de la richesse vasculaire intratumorale visualisée au Doppler. L'étude de l'angiogénèse tumorale en echo-doppler est utilisé en particulier dans des tumeurs superficielles comme les mélanomes. Il a été montré que la présence d'une néovascularisation intratumorale détectée au Doppler couleur était un facteur de risque métastatique.
Applications
Un des intérêts majeurs de l'échographie Doppler est de pouvoir évaluer, par une méthode simple, l'efficacité des nouvelles thérapeutiques visant à bloquer l'angiogénèse tumorale. En optimisant les paramètres d'acquisition des images Doppler, il est possible de visualiser des flux lents dans des microvaisseaux et d'évaluer très précocement l'efficacité d'un traitement, avant toute modification du volume tumoral, sur la diminution de la richesse vasculaire. L'injection de produits de contraste échographiques renforce l'efficacité de la technique. La technologie d'acquisition des signaux Doppler évolue et des logiciels d'analyse de la perfusion permettent d'optimiser la détection de la microvascularisation.
La poursuite des innovations technologiques sur les échographes et le développement en recherche de produits de contraste ciblés spécifiques des tumeurs ouvrent des perspectives diagnostiques et thérapeutiques très intéressantes en cancérologie.
Principe
La tomographie par émission de positons (TEP ou PET = "Positron emission tomography") ne donne pas d’image anatomique comme le font les autres moyens diagnostiques (rayons X, échographie, CT scan, IRM) mais renseigne sur la biochimie des organes. Elle fournit des informations sur le fonctionnement des tissus normaux et pathologiques. Suivant l’isotope radioactif liée à du glucose (comme le fluorodeoxyglucose) utilisé, elle donne au médecin des informations spécifiques sur le métabolisme des tissus.
Applications
Le Pet-Scan est
particulièrement
intéressante en cancérologie car il permet d’étudier le fonctionnement biochimique d’un organe,
tel que le
cerveau, le seins ou les poumons, en donnant des informations
spécifiques sur
le métabolisme de ses tissus : flux et volume sanguin, consommation
cellulaire
du glucose… Les cellules cancéreuses consomment plus de glucose que les
cellules bénignes, ce qui permet de repérer par cette technique
d’éventuels «
points chauds » témoins de récidives cancéreuses. Il permet également
d'évaluer la réponse au traitement.évaluer la
réponse au
traitement.
Le Pet-scan a démontré sa capacité à
quantifier la
microcirculation tumorale avec le [15O]H2O et le [15O]CO,
ainsi qu'au 18-fluorodésoxyglucose qui permet de détecter le tissu
tumoral dont
l'hyper métabolisme provoque l'accumulation du traceur. Cette
accumulation est
significativement corrélée au volume sanguin relatif évalué par IRM.
En France, l’usage de
la Pet-Scan
à visée médicale est encore peu répandu, ceci s’expliquant par le coût
d'acquisition très élevé d'un tel appareil, ainsi que
par le faible nombre de cyclotrons implantés en France.
Or la proximité d’un cyclotron est absolument indispensable car les
produits
utilisés pour la Pet-scan n’ont une durée de vie que de quelques heures.
Principe
Des
faisceaux de rayons X sont émis autour du patient. C'est leur
absorption par
les différents tissus qui va permettre, grâce à un l'ordinateur, de
reconstituer très précisément l'organe examiné sous forme de tranches
très
rapprochées les unes des autres.
Applications
Le
scanner a démontré sa capacité à déterminer certains éléments de
l'angiogénèse
comme les paramètres de perfusion et de perméabilité qui permettent de
détecter
les tumeurs et de différencier les lésions bénignes des lésions
malignes.
Le scanner à cependant un champ d'action plus restreint que l’IRM, il est utilisé principalement pour des applications bien spécifique comme les cancers cérébraux, le contrôle de la réponse à la chimiothérapie, les métastases hépatiques et le module pulmonaire solidaire.
Le scanner est en effet limité,
car si il permet de visualiser une modification de volume ou une
anomalie de structure (tumeur, embolie, anévrisme…), il ne permet pas
d’en
préciser la nature (inflammation, cancer, etc.).
Le scanner reste très utilisé en chirurgie pour renseigner plus précisément sur les zones où l’intervention est envisagée ou bien encore pour guider les drainages et les biopsies.
Il s'agit quand même d'une voie intéressante à envisager surtout lorsque l'IRM, la scintimammographie ou le Pet-scan ne sont pas disponibles ou sont contrindiqués.
Principe
L’application de l’imagerie à l’infrarouge est essentiellement dédiée aux maladies du sein et repose sur le principe maintenant bien reconnu que le flot sanguin autour d’un nouveau cancer est augmenté par rapport au tissu normal. L’intérêt de cette technique repose sur la variation d’activité vasculaire liée à l’angiogénèse. Par conséquent, il s’agit de convertir, en utilisant une caméra infrarouge digitale ultrasensible, le schéma de cette activité métabolique et vasculaire accrue en une image visible sur un écran à haute résolution. L’imagerie à l’infrarouge moderne est une méthode supplémentaire utilisée en première ligne, pour obtenir des renseignements complémentaires à l’examen clinique et à la mammographie.
Avantages
Contrairement à la
mammographie
et à certaines autres méthodes que nous utilisons, l’imagerie à
l’infrarouge ne
nécessite ni radiation, ni contact, ni compression, ni accès
intraveineux. Si
la mammographie dépend surtout de variations structurales, l’imagerie à
l’infrarouge est basée sur le dépistage de l’angiogénèse et des
changements
métaboliques associés à l’initiation et à la croissance tumorale. Elle
permet
parfois de soupçonner une lésion trop petite pour apparaître clairement
sur une
mammographie ou à l’examen clinique. Chaque femme possédant un schéma
infrarouge individuel, toute modification de ce schéma pourra suggérer
la
nécessité d’une surveillance étroite ou d’un examen plus poussé. Ainsi,
on peut
suivre la patiente d’année en année et intervenir dès que la maladie
s’avère
évidente. La possibilité que l’imagerie à l’infrarouge offre de
renouveler les
examens sans inconvénient ou risque, en fait un atout précieux.
|
|
|
Limites
Cependant, l’appareil ne peut pas tout
faire: la
technologie la plus récente et son interprétation sont de première
importance.
Comme pour la mammographie, beaucoup d’expérience et de travail
attentif sont
nécessaires pour distinguer efficacement le bénin du malin. Ainsi, les
cancers
ne provoquent pas tous une angiogénèse perceptible. Comme à la
mammographie,
ils peuvent offrir un aspect faussement normal ou montrer des
affections
bénignes (vasculari-sation marquée mais symétrique, calibre des
vaisseaux
normal, et gradient inférieur à 1 degré C). Ils peuvent donc échapper
au
dépistage. Une lésion de moindre malignité à évolution lente peut
révéler un
degré d’activité vasculaire moins élevé qu’une lésion envahissante à
évolution
rapide.
Les cancers de petites tailles sont parfois ceux avec lesquels on
obtient le
meilleur résultat. Pour être plus efficace, l’imagerie à l’infrarouge,
reflet
de la physiologie tissulaire du sein, doit être confrontée aux autres
méthodes
de diagnostic. Des variations de l’image infrarouge, lorsque produites
et
interprétées par des médecins experts, qui ont aussi accès aux images
infrarouges antérieures et à d’autres techniques de diagnostic, peuvent
fournir
de l’information additionnelle, particulièrement lorsque l’examen
clinique et
mammographique sont non-spécifiques, ou lorsqu’il y a eu chirurgie ou
radiothérapie antérieurement.
L’information acquise par l’examen clinique, la mammographie et
l’imagerie à
l’infrarouge permet au médecin de décider si d’autres examens, tels que
l’échographie, ou un suivi plus serré, est indiqué. Son utilisation
peut
contribuer à la surveillance des patientes déjà traitées, qu’il
s’agisse du
contrôle de la guérison ou du diagnostic précoce de récidives, et à
l’évaluation de l’effet de certains traitements anti-angiogéniques.
Comprendre
l’IRM
B.
Kastler
Masson
(Manuel d’Auto Apprentissage)
IRM
(Imagerie par Résonance Magnétique)
D.
Doyon, E.A Cabanis
Masson
(Abrégés)
EUROCANCER
2003
Compte-rendu
des conférences “John Libbey Eurotext”
http://eurocancer.jle.com/
Imagerie
du sein, place de l’IRM
Martine
BOISSERIE-LACROIX
Journées
Pyrénéennes de Gynécologie - Tarbes - 6 & 7 octobre 2000
IRM
des tumeurs malignes primitives des os
Diard
F., Chateil J.F., K.Amamou, M.Moinard
www.stim.org/str/1reunaft/osteoart2.html
ONCOLOR
(réseau de santé en cancérologie de la région lorraine)
Référentiels
standards neuro-radiologiques (protocoles IRM)
Site
du CerVal (Conseil d’enseignement radiologique du Val de Grâce) :
“Les
tumeurs du SNC“ et “IRM du sein“
http://perso.wanadoo.fr/site.cerval
La prolifération d’une tumeur est dépendante de sa capacité à activer un phénomène de néo-vascularisation pour obtenir l’oxygène et les nutriments dont elle a besoin : c’est l’angiogénèse.
La prise en compte de la néo-vascularisation dans le dépistage du cancer est de plus en plus importante. En effet l’angiogénèse a un impact sur le développement tumoral, l’apparition de métastases et permet donc de hiérarchiser les tumeurs. De plus elle est à l’origine de nouveaux traitements anti-angiogéniques prometteurs.
La visualisation et la quantification de l’angiogénèse en IRM nécessite l’injection de produits de contrastes dérivés du gadolinium. Cela permet d’observer la perfusion du produit dans les différentes structure et par conséquent de différencier tissus sains et cancéreux. L’utilisation des nouvelles possibilités de l’IRM en terme de temps d’acquisition est grandement mis à profit : les séquences d’imagerie rapide (type E.P.I - Echo Planar Imaging) permettent de suivre en temps réel et de cartographier la perfusion du gadolinium et de mettre ainsi en évidence les zones d’hyper et d’hypo perfusion.
L’imagerie de diffusion et de perfusion est ainsi capable de calculer différents paramètres représentatifs de la vascularisation (débit sanguin, volume sanguin, oxygénation tissulaire…)
L’évaluation de l’angiogénèse tumorale permet également d’adapter le traitement du patient; en effet plus une tumeur est vascularisée, plus son pouvoir métastasique est élevé et plus sa chimiosensibilité et sa radiosensibilité sont grandes. Par conséquent on peut mettre a profit cette vascularisation pour oxygéner une tumeur avant une séance de radiothérapie par exemple.
La détection de l’angiogénèse en imagerie est particulièrement adaptée aux performances et à l’innocuité de l’IRM. Elle présente un double intérêt dans le diagnostic et le pronostic, mais aussi dans la prescription adaptée de traitements. De nombreuses recherches sont en cours afin d’optimiser et de protocoliser cette détection et offres de vastes perspectives dans le dépistage et le suivi du cancer.
Annexe 1 : Classification TNM et FIGO
Classification
FIGO :
|
Stade |
interprétation |
Exemple :
cancer de l’utérus |
|
0 |
In-situ |
Intra-épithélial |
|
I |
Microinvasif / Invasif |
|
|
IA |
Microinvasif
(envahissement débutant du stroma) |
|
|
IB |
Invasif
(lesions macroscopiques) |
|
|
II |
Envahissement |
|
|
IIA |
Envahissement
des 2/3 supérieurs du vagin |
|
|
IIB |
Atteinte des paramètres n’atteignant pas la
paroi pelvienne |
|
|
III |
Envahissement important |
|
|
IIIA |
Envahissement
du 1/3 inférieur du vagin |
|
|
IIIB |
Envahissement
du paramètres jusqu’à la paroi pelvienne |
|
|
IV |
Envahissement et Métastases |
|
|
IVA |
Envahissement
de la vessie ou du rectum |
|
|
IVB |
Métastases à
distance |
Classification TNM :
|
classification |
Interprétation |
Exemple :
cancer pelvis |
Tis |
Cancer In situ |
Cancer
in situ |
|
T1 |
Extension |
Infiltration de la muqueuse |
|
T2 |
Extension au muscle superficiel |
|
|
T3A |
extension au muscle profond |
|
|
T3B |
Envahissement de la graisse |
|
|
T4A |
Envahissement des organes adjacents |
|
|
T4B |
Envahissement de la paroi pelvienne |
|
|
N0 |
Absence de métastases ganglionnaires |
Absence de métastase ganglionnaire |
|
N1 |
Métastase ganglionnaire |
Métastase ganglionnaire homolatérale iliaque |
|
N2 |
Métastase ganglionnaire controlatérale |
|
|
N3 |
Métastase ganglionnaire régionale fixée |
|
|
N4 |
Métastase ganglionnaire iliaque
commune/inguinale/aortique |
|
|
M0 |
Absence de métastase |
Pas de métastase |
|
M1 |
Métastase |
Métastase |
Source : « IRM » D. Doyon
(Masson)
Annexe
2 :
Prise de
contraste d’une tumeur du SNC (séquence T1 injectée)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 3 : traitement d’image, tumeur du SNC
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 4 : Séquences en IRM
|
ECHO DE SPIN |
||
|
SE |
Spin Echo (Siemens, GE, Philips) |
Echo de spin. |
|
LASE |
Low Angle
Spin Echo (Siemens) |
Spin echo
avec un TR court et un angle de bascule différent de 90°. |
|
TSE |
Turbo Spin
Echo (Siemens, Philips) |
Spin echo
rapide avec un train d'échos supérieur à 1. |
|
ECHO DE GRADIENT |
||
|
GRE |
Gradient
Recalled Echo (Siemens, GE) |
Echo
de gradient. |
|
FLASH |
Fast
Low Angle Shot (Siemens) |
Echo de
gradient avec spoiling de l'aimantation transverse par gradient ou RF
optimisées pour une pondération T1. |
|
MEDIC |
Multi
Echo Data Image Combination (Siemens) |
Echo de
gradient avec somme de 5 ou 6 echos acquis successivement pour une |
|
FISP |
Fast
Imaging with Steady state Precession (Siemens) |
Echo de
gradient sans spoiling de la magnétisation transverse, images pondérées
T2*/T1. |
|
PSIF |
Mirrored
or reverse FISP (Siemens) |
Echo de
gradient avec lecture de l'écho stimulé, images pondé-rées T2 vraie
(TE>=TR). |
|
Turbo FLASH |
Turbo
Fast Low Angle Shot (Siemens) |
Préparation
de l'aimantation par différents motifs RF (180° pour le contraste T1,
90-180-90° pour le contraste T2). |
|
IMAGERIE ULTRA-RAPIDE |
||
|
TGSE |
Turbo
Gradient Spin Echo (Siemens) |
Mélange de
turbo-spin echo et d'écho de gradient. |
|
HASTE |
Half
Fourier Single shot Turbo spin Echo (Siemens) |
Techniques
turbo-spin echo single shot avec ou sans half fourier. |
|
EPI |
Echo
Planar Imaging single shot |
Echo planar. |
|
MOTIFS PREPARATOIRES |
||
|
IRM |
Inversion-Recovery
in Magnitude (Siemens) |
Techniques
d'inversion-récupération (IR). |
|
TIR |
Turbo
Inversion-Recovery (Siemens) |
Techniques
d'inversion-récupération (IR). |
|
Dark Fluid |
(Siemens) |
Saturation du
signal des liquides par IR, images pondérées T2. |
|
SPIR |
Selective Pulse and Inversion
Recovery (Philips) |
IR sélective sur la graisse. |
|
TERMES EMPLOYES |
||
|
Multi-slab |
(Siemens) |
Acquisition
en 3D de sous-volumes pour éviter la saturation des vaisseaux. |
|
Pulse TONE |
Tilted
Optimized Non saturation Excitation Pulse (Siemens) |
Optimisation
du profil de l'impulsion RF pour éviter la saturation des vaisseaux. |
|
SAT |
Saturation
(Siemens, GE) |
Saturation du
signal dans une région choisie. |
|
GMR |
Gradient
Motion Rephasing (Siemens) |
Gradient de
rephasage des spins en mouvement. |
Annexe
5 :
Protocole
IRM pour les tumeurs intracrâniennes de l’adulte (source Oncolor)
Protocole:
-
séquences :
T2, T1,T1 gadolinium
-
2 plans
orthogonaux
-
Plan axial de
référence : CA-CP
- Coupes de 5 mm
Mesure de la lésion : 3 mesures orthogonales de la prise de contraste, en T2 si pas de prise de contraste
1 - Repérage sagittal rapide
2 - Axial FSE T2 avec écho long ou SE T2 2 échos
3 - Frontal SE T1
4 - Frontal SE T1 + gadolinium
5 - Sagittal SE T1 + gadolinium
Si tumeur ne
prenant pas le contraste, sagittal T2 à la place du sagittal T1 +
gadolinium.
Si tumeur de petite taille, ajouter un plan T1 + gadolinium en coupes de 3 mm
Si
tumeur de la ligne médiane, faire dans un deuxième temps, avant la
chirurgie, une IRM de l’axe spinal jusqu’au cul de sac dural : sagittal
T1 puis
sagittal T1 + gadolinium avec saturation de graisse + axial T1 si
lésion
douteuse.
Le bilan d'évaluation post-opératoire se réalise de la manière suivante :
Précoce
: dans les 72 heures pour une tumeur prenant le contraste, dans
la première semaine pour une tumeur ne prenant pas le contraste :
séquence
en frontal SE T1 avant et après injection
L'IRM dans la
surveillance clinique ou l'évaluation thérapeutique :même
protocole qu’au
diagnostic.