|
Avertissement
|
| Si vous arrivez directement sur cette page
sachez que ce travail est un rapport d'étudiant(e)s et doit être
pris comme tel. Il peut donc comporter des imperfections ou des imprécisions
que le lecteur doit admettre et donc supporter. Il a été
réalisé pendant la période de formation et constitue
avant tout un travail de compilation bibliographique, d'initiation et d'analyses
sur des thématiques associées aux technologies biomédicales.
Nous
ne faisons aucun usage commercial et la duplication est libre. Si vous
avez des raisons de contester ce droit d'usage, merci
de nous en faire part. L'objectif de la
présentation sur le Web est de permettre l'accès à
l'information et d'augmenter ainsi les échanges professionnels.
En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique.
Bonne
lecture... |
La criticité des dispositifs médicaux
et l'allocation optimale des ressources biomédicales, Franck Lemistre,
Yannick Rochais, Projet DESS "TBH", UTC, 1998, pp 70 (le nombre
de pages papier),
URL : https://www.utc.fr/~farges/DESS_TBH/98-99/Projets/NOM/acorb.htm
|
Analyse de la Criticité
pour l'Optimisation
des Ressources Biomédicales
|
|
(photo Auteur 1)
|
(photo Auteur 2)
|
|
Franck Lemistre
|
Yannick Rochais
|
|
Résumé : Analyse de la
Criticité
pour l'Optimisation des Ressources Biomédicales
Voici jeter la base d'un outil qui répondra aux nombreuses préoccupations
des Ingénieurs Biomédicaux qui souhaitent prendre en compte
les risques liés à l'utilisation des dispositifs médicaux.
L'Ingénieur Biomédical doit mettre en oeuvre tous les moyens
nécessaires pour maîtriser l'analyse des risques. L'ouvrage
décrit une méthodologie et un éventail d'outils pour
la réduction de la criticité des dispositifs médicaux
par l'optimisation des ressources biomédicales.
-
Quels sont les outils industriels ?
-
Quel est le contexte hospitalier et du service biomédical ?
-
Comment mettre en place une ACORB à l'hôpital ?
-
Comment agir et diminuer la criticité des dispositifs médicaux
?
-
Comment allouer de façon optimale les ressources biomédicales
?
Summary : Risk Analysis to Optimise
Biomedical Resources
ACORB is the basis for a tool to help biomedical
engineers assess the risks of biomedical devices. Biomedical engineers
have a duty to use every available means of containing exposure to the
risks of their equipment. This work describes a methodology and a set of
tools to reduce the risk of biomedical devices and optimise biomedical
resources.
-
What are the industrial devices ?
-
What is the context of the biomedical department
and of the hospital ?
-
How is ACORB set up in a hospital ?
-
How decrease and act biomedical devices risk ?
-
How is the allocation of biomedical resources best
allocated ?
|
| |
|
REMERCIEMENTS
Nous tenons à remercier toutes les personnes qui de près
ou de loin nous ont permis de mener à bien ce projet, et plus particulièrement
à Monsieur Gilbert Farges pour ses observations et sa disponibilité
qui ont joué un rôle important dans son déroulement.
Avertissement
Nous tenons à prévenir
les futurs lecteurs que ce document est une analyse expérimentale
qui demande un développement complémentaire, théorique
et pratique.
1 Introduction
Chapitre 1
2
Les risques et le monde médical
3
La qualité et la gestion des risques
4 Description
des outils
Chapitre 2
5
Le contexte de l'activité biomédicale
6 Le
contexte hospitalier
7
Le rôle et ressources du service biomédical
8
Analyse fonctionnelle d’un dispositif médical
9
La mise en oeuvre de l'ACORB
10
Comment utiliser l'ACORB ?
Conclusion
Glossaire
Bibliographie
Table des matières
La gestion du risque est une notion qui de nos jours
prend une place de plus en plus prépondérante. Des secteurs
industriels comme l’aéronautique, le nucléaire, l’armement
et le domaine spatial ont déjà mis en place des démarches
de gestion des risques en se basant sur des outils comme les arbres de
défaillance, l’analyse de risque, l’analyse préliminaire
des risques, la criticité des équipements.
Aussi curieux que cela puisse paraître, les
sociétés modernes qui acceptent la fatalité, n’acceptent
plus le risque et en particulier le danger qui provient d’autrui (une personne,
un système…). Le monde médical n’échappe pas à
cette lame de fond. La médecine est certes aujourd'hui de plus en
plus efficace mais elle est aussi " dangereuse ". Les personnes acceptent
sans problème et sans question ses bénéfices, mais
ils ne veulent plus entendre parler des risques qu’elle fait courir. Les
différents exemples que l’on rapporte des États-Unis confirment
qu’il est difficile à un médecin d’exercer son métier
sans qu’il ait au-dessus de la tête une épée de Damoclès.
Il n’est pas à l’abri d’une procédure judiciaire si le patient
n’est pas " satisfait de la prestation ". En France, l’affaire du sang
contaminé et le drame des hémophiles ont été
des facteurs déclenchant sur les problèmes de santé
public et sur la notion de risque. Cependant, il est très surprenant
de voir que l’on n’accepte plus le risque même s’il est lié
à une incertitude.
L'hôpital a pour mission le soin mais elle
se doit d'assurer la sécurité du public qu'il reçoit,
en n'oubliant pas le personnel et toutes les autres personnes qui peuvent
être confrontées à des risques potentiels liés
à l'activité humaine ou à la technique. Avec l'accréditation
et la mise en place des différentes démarches qualité,
la gestion des risques est un domaine qui prend une place de plus en plus
importante dans les organisations. Le risque lié aux équipements
doit d'être pris en compte dans les diverses activités du
service biomédical. Les prestations de maintenance et de formation
ont un impact direct sur le risque. Alors que les budgets des hôpitaux
souffrent d'une baisse régulière de crédits et que
la réglementation est de plus en plus contraignante, il est intéressant
de voir comment la criticité (produit de la gravité et la
fréquence d'un incident) peut permettre au service biomédical
de mieux utiliser les ressources humaines, financières ou matériels
qu'il dispose.
Le document se compose de deux parties, l'une concerne
les aspects théoriques de la notion de criticité, les différents
outils utilisables ainsi que le contexte lié à la gestion
des risques. La seconde traitera de la création d'un outil d'optimisation
des ressources d'un service biomédical basées sur la criticité
des dispositifs médicaux.
Retour Sommaire
CHAPITRE
1
|
II)
Les risques et le monde médical
|
2.1
Introduction
" La liste est longue des drames qui ont affecté dans le passé
la santé de l’homme même si dans la période récente
la gestion de la crise de la vache folle a donné l’exemple d’une
gestion maîtrisée. Dans un monde où l’on se nourrit
plus sûrement que par le passé, où l’on se soigne mieux,
ces crises sont elles l’inévitable rançon du progrès
ou auraient elles pu être évitées grâce à
une réglementation et des structures de contrôle et de veille
suffisantes ? …
La réforme que la présente proposition de loi tend
à mettre en oeuvre présente un caractère d’urgence.
Trop de drames ou de crises sanitaires ont affecté notre pays dans
les années récentes pour qu’il puisse se permettre d’attendre
plus longtemps pour se doter d’une action de l’état en matière
sanitaire adaptée à l’évolution des techniques et
à celle des mentalités. L’histoire montre que la législation
sanitaire n’a progressé réellement qu’à la faveur
de crises ; il faut donc saisir l’occasion créée par tous
les drames récents et agir dans une démarche de prévention
des risques.
Pour autant, cette réforme n’est pas précipitée.
La densité des travaux entrepris par la commission des Affaires
sociales, l’amélioration continue de la législation sanitaire
depuis le début des années quatre-vingt dix, le foisonnement
de la réflexion intervenue depuis lors font que l’on ne pourra reprocher
aux auteurs de la proposition de loi de vouloir légiférer
" à chaud ".
Ensuite, la réforme a une ambition d’exhaustivité.
Une politique de sécurité sanitaire comprend en effet trois
volets : l’évaluation des actes et des pratiques, le contrôle
des produits et la veille sanitaire. Le premier volet a déjà
fait l’objet d’une réforme, avec la mise en place de l’Agence nationale
d’accréditation et d’évaluation en santé (ANAES) prévue
par l’ordonnance du 24 avril 1996 : les auteurs de la présente proposition
de loi considèrent très favorablement la création
de cette nouvelle institution et estiment que l’ANAES constituera un outil
performant pour conduire une politique efficace d’évaluation des
actes médicaux. La proposition de loi traite donc des deux autres
volets de la politique de sécurité sanitaire, à savoir
le contrôle des produits et la veille sanitaire. "…..
La gestion même du risque au sein de l’Hôpital
est un aspect qu’il est encore difficile à évoquer. L’Hôpital
est une structure bi-encéphale avec d’un coté des " administratifs
" sous la responsabilité du directeur de l’établissement
et de l’autre le corps médical morcelé en services dont les
caractéristiques sont très différentes les unes des
autres. Il n’existe pas de réelle unité de toutes les composantes
d’un établissement. Et pourtant, malgré une gestion plus
ou moins autonome de ces deux entités le soin d’un patient requière
la participation de tous : médicaux, infirmiers, paramédicaux,
logisticiens ou administratifs. " Cette non-organisation a un coût
tant médical qu’économique ".
Retour Sommaire
2.2
Le risque à l’hôpital
Avant de s'intéresser plus précisément
au service biomédical, il semble intéressant de situer ce
projet dans le contexte d’un établissement de santé.
" Quant à la prise en compte du risque, c'est une véritable
éthique de la responsabilité individuelle et collective.
Etre responsable, c’est se mettre en état de réduire, au
maximum en l’état de la science et de ses moyens, les risques qui
s’attachent aux activités dont ont à la charge ". Ces quelques
phrases montrent l’état d’esprit à acquérir pour traiter
des risques liés à l’activité hospitalière.
Il se pose alors la question de savoir quelles sont
les risques que l'on trouve à l'hôpital. Trois catégories
de risques peuvent être énoncées :
-
Les risques premiers et peut-être les plus importants sont liés
à l’activité du soin.
-
Accidents médicaux, médicamenteux,
-
Risques infectieux, anesthésiques, transfusionnels,
-
Incidents liés aux dispositifs médicaux, à la recherche
médicale
-
Les risques liés à la vie hospitalière
-
Les risques de gestion
La Figure 1 "La vigilance à l'hôpital"
présente les différents domaines pour lesquels l'hôpital
(le monde de la santé) à déjà mis en place
des processus et des organisations (locale et /ou nationale) afin de maîtriser
les risques liés à son activité. D'une manière
très générale, elles sont regroupées sous le
terme de vigilance :
Figure 1 "La vigilance à
l'hôpital"
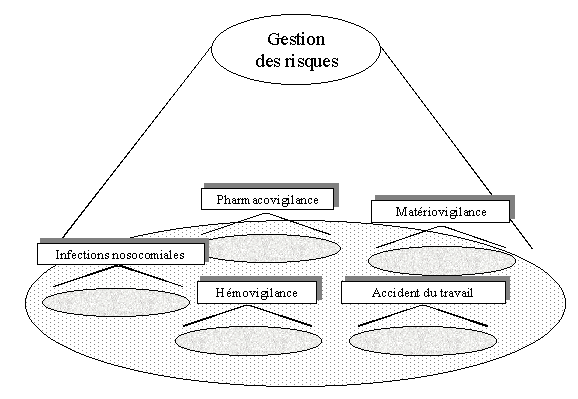 En énonçant les grandes catégories
de vigilance, le risque n'est pas pour autant maîtrisé, il
faut tenir compte de grandeurs supplémentaires comme :
En énonçant les grandes catégories
de vigilance, le risque n'est pas pour autant maîtrisé, il
faut tenir compte de grandeurs supplémentaires comme :
-
Ses causes : techniques, organisationnelles, budgétaires, calendaires,
des faits, des contraintes.
-
La partie affectée : c'est l'activité et / ou la performance
qui encourent les dommages engendrés par le risque.
-
Son impact : c'est la conséquence ou l'effet produit par la réalisation
d'un risque. Il est évalué en terme de délai, de dégradation,
de performance.
-
Sa portée : remise en cause d'objectif.
-
Sa probabilité : le degré d'éventualité de
manifestation du risque (faible, moyenne, élevée) quantitative
(entre 0 et 1).
-
Les actions de maîtrise : dispositions destinées à
éviter l'apparition de risque ou à limiter son impact s'il
se produit.
Depuis le début des années 90, de
plus en plus de sinistres sont déclarés et de plus en plus
d'indemnité sont versées aux victimes des risques hospitaliers.
Ce constat fait par le SHAM montre que toutes les activités hospitalières
ne sont pas sur le même pied d'égalité face au risque.
Quatre spécialités sont plus exposées à savoir:
-
La neurochirurgie,
-
La réanimation,
-
La chirurgie orthopédique,
-
Et bien sûr, l'obstétrique.
Les facteurs qui poussent vers cette situation
ont des origines variées comme :
-
La désacralisation de l'institution hospitalière et des médecins.
-
Le drame de la contamination des hémophiles
-
La médiatisation croissante des activités médicales
et surtout de ces incidents.
-
Une technicité croissante entraînant un sentiment de déshumanisation
des hôpitaux avec la dépersonnalisation de la relation, pousse
les personnes "victimes" à faire éclater la vérité.
Et la liste de ces faits n'est pas exhaustive.
La qualité et la sécurité dans
les établissements de soins.
Avec la réforme hospitalière de 1991
et celle des ordonnances d'avril 1996, on assiste à la prise de
conscience de l'importance de l'évaluation et de la mise en place
de programme d'assurance qualité. L'accréditation, acte volontaire
mais obligatoire dès 2001, est l'objectif final que devront atteindre
les différents établissements. Cependant, une démarche
qualité ne vise pas seulement l'idéal ou l'excellence mais
elle doit permettre de réduire les différents dysfonctionnements
susceptibles de créer des dommages aux patients.
Retour Sommaire
2.3
Les événements indésirables
L’événement indésirable révèle
un dysfonctionnement dans l’organisation d’un hôpital et dont les
conséquences sont ou auraient pu être dommageables (gestion
des risques).
Il existe quatre types d'évènement
indésirable :
-
Les accidents qui résultent directement d'un dysfonctionnement de
l'hôpital et qui sont la cause d'un dommage au patient, au personnel,
aux tiers, à leurs biens, aux biens de l'établissement (exemple
: septicémie d'origine nosocomiale à l'origine du décès
d'un patient).
-
Les incidents qui résultent directement d'un dysfonctionnement de
l'hôpital mais qui sont la cause d'un dommage (exemple : infection
urinaire nosocomiale jugulée par une antibiothérapie).
-
Les "near misses" où le dysfonctionnement s'est produit mais a été
corrigé avant tout dommage. (erreurs de distribution des médicaments
corrigés avant d'arriver au patient).
-
Les situations à risque qui résultent d'un dysfonctionnement
de l'hôpital et qui auraient pu être la cause d'un incident
ou d'un accident (exemple : le non isolement d'un malade contagieux).
Un événement indésirable se caractérise
aussi par :
-
Sa fréquence (nombre d'apparition d'évènements indésirables)
-
Sa gravité (l'importance du préjudice subi).
-
Un acte coupable
Au sens épidémiologique, le risque
est la probabilité de survenue d'un problème défini,
au sein d'une population déterminée, située dans un
environnement dangereux pendant une période donnée. C'est
aussi le danger, inconvénient plus ou moins probable auquel on est
exposé.
2.4
Les évolutions réglementaires
Pour faire suite au marquage CE, à l'arrêté
sur la sécurité en anesthésie réanimation (3
octobre 1995) et de bien d'autres textes réglementaires, le législateur
français, depuis le 1er juillet 1998, a mis en place une nouvelle
réglementation pour le renforcement de la veille sanitaire et du
contrôle de sécurité sanitaire des produits destinés
à l’homme avec la création d'une institut de veille sanitaire,
d'une Agence Française de Sécurité Sanitaire des Produits
de Santé, d'une Agence Française de Sécurité
Sanitaire des Aliments, et peut-être, dans quelques mois, une agence
de sécurité de l'environnement. Avec ce nouvel arsenal juridique,
le milieu de la santé, les services biomédicaux, voient apparaître
de nouvelles exigences et contraintes.
2.4.1
La sécurité sanitaire
Les articles L. 665-4 et L. 665-5 du livre V du Code
de la santé publique sont largement modifiés. Dans l'article
L. 665-4, le législateur réaffirme le rôle du marquage
CE des dispositifs médicaux. Il est demandé que pour les
dispositifs dont " la conception ou la fabrication pouvant être
à l'origine de risques sanitaires … peuvent... être mis en
service, mis à disposition.. ou utilisés que s'ils font l'objet
d'une déclaration… au moins 3 mois avant leur mise sur le marché
auprès de l'agence française de sécurité sanitaire
des produits de santé ". Certes ce paragraphe n'intéresse
pas directement le service biomédical d'un établissement,
mais il montre la volonté des pouvoirs publics de réduire
les risques liés aux dispositifs médicaux.
Cependant l'article L. 665-5 du Code de la santé
est sensiblement modifié : " Pour le dispositif dont la liste
est fixée par le ministre chargé de la santé après
avis de l'agence française de sécurité sanitaire produits
de santé, l'exploitant est tenu de s’assurer du maintien de ces
performances et de la maintenance du dispositif médical. Cette obligation
donne lieu, le cas échéant, à un contrôle qualité
dont les modalités sont définies par décret et dont
le coût est pris en charge par les exploitants des dispositifs ".
Le législateur permet au ministre après
avis de l’Agence Française de Sécurité Sanitaire des
Produits de Santé d'imposer des contrôles sur certains dispositifs
médicaux. Cette disposition modifie radicalement le futur contenu
des politiques de maintenance pour les services biomédicaux. Ces
deux articles montrent l’évolution réglementaire à
laquelle sera soumis le service biomédical et les industriels du
monde de la santé, c’est à dire à de plus en plus
de rigueur.
Retour Sommaire
2.4.2
Analyse de risques et le marquage CE
Le marquage CE est l’aspect réglementaire
qui a la première incidence sur les dispositifs médicaux.
Certes le concept n'est pas nouveau, mais il est intéressant de
l’aborder sous les angles de l'analyse des risques et de la vigilance.
La libre circulation des dispositifs médicaux
est assurée par le marquage CE depuis le 14 juin 1998, avec une
garantie d’un haut niveau de sécurité et de santé,
puisqu’ils doivent respecter des exigences essentielles (article 3 de la
directive 93/42/CEE du 14 juin 1993).
Plusieurs aspects de ces exigences sont importantes
à rappeler.
Les dispositifs médicaux doivent être
conçus et fabriqués de telles manière que leur utilisation
ne compromette pas l’état clinique et la sécurité
des patients … des utilisateurs … lorsqu’ils sont utilisés dans
les conditions et aux fins prévues …Les risques éventuels
liés à leur utilisation constituent des risques acceptables
au regard du bienfait apporté au patient et compatibles avec un
niveau élevé de protection. Les solutions choisies par le
fabricant .. doivent se tenir aux principes d’intégration de la
sécurité en tenant compte de l’état de la technique
généralement reconnu.
-
Pour retenir les solutions les mieux appropriées le fabricant
doit expliquer les principes suivants dans l’ordre indiqué :
-
Eliminer ou réduire autant que possible les risques …
-
Prendre les mesures de protections appropriées … alarmes… pour
les risques qui ne peuvent être éliminés
-
Informer les utilisateurs des risques résiduels
-
Tout effet secondaire et indésirable doit constituer un risque
acceptable au regard des performances du dispositif.
Ces quelques lignes extraites de la directive montrent
que la notion de risque prend une place importante dans la démarche
que doit mettre en place un fabricant de dispositif médical avant
d’apposer la marque "CE" sur celui-ci. Il se doit de respecter les exigences
essentielles qui prennent en compte les risques :
-
Chimiques, physiques, biologiques
-
D’infections et de contaminations microbiennes
-
Liés aux combinaisons et à l’environnement
-
Liés aux rayonnements
-
Electriques
-
Mécaniques
-
Thermiques
-
Liés à l’administration de substances
-
Ergonomiques
-
Liés aux erreurs humaines.
-
…
Deux moyens doivent permettre au fabricant d’assurer
ce haut niveau de sécurité et de santé : l’analyse
de risques (annexe I) et l’évidence clinique (annexe X).
Il est intéressant de visualiser les différentes
relations Figure 2 "L'environnement réglementaire du marquage
CE" qui entrent en jeux dans la procédure qui mènent
un fabricant à apposer le marquage CE sur le dispositif médical
qu'il va mettre sur le marché. La matériovigilance joue alors
le rôle de "contre réaction" après la mise sur la marché
en permettant à l'utilisateur de remonter des dysfonctionnements
et d'influencer la fabrication du dispositif médical.
Figure 2 "L'environnement réglementaire
du marquage CE"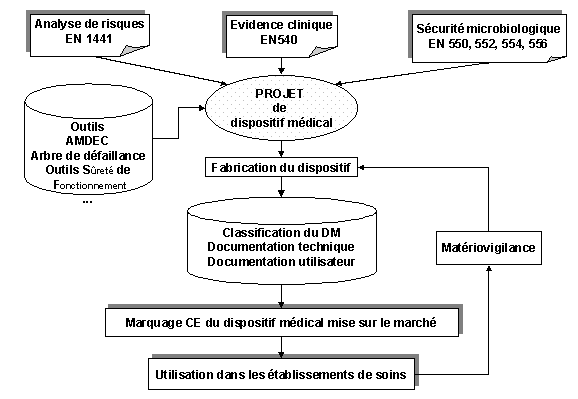
Pour ce faire, le fabricant dispose d’une norme dont
le but est d’identifier les " dangers " potentiels et d’estimer les risques
correspondants (sans faire de quantification), c’est à dire de réaliser
une analyse de risque. Elle ne fixe à aucun moment des niveaux d’acceptabilité.
On peut dire que cette norme d’analyse des risques est une des composantes
qui mène à la notion de maîtrise des risques.
Retour Sommaire
2.4.3
La norme EN 1441
La norme européenne EN 1441 se présente
comme une méthode d’analyse du risque sous la forme d’un organigramme
dont les différentes étapes sont commentées dans diverses
annexes. La Figure 3 "Procédure de réduction des risques"
montre la manière pour un entité de réduire les risques
liés à son activité.
Figure 3 "Procédure de
réduction des risques"
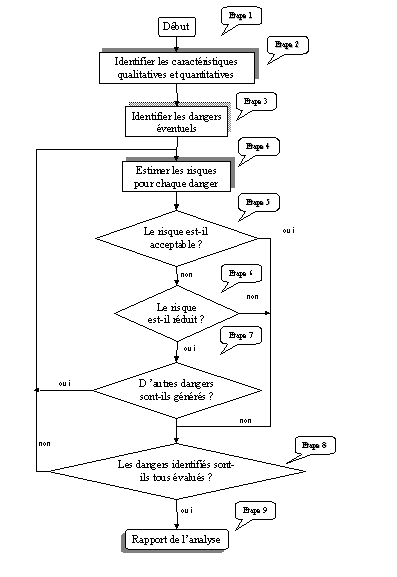 Etape 1
L'analyse de risque peut être effectuée dans le cadre
d'un système qualité. La procédure doit être
suivie, sa conduite et ses résultats doivent faire l'objet d'une
documentation.
Etape 2
Elle permet de se poser toute une série de questions sur le
dispositif afin de dégager pour les étapes suivantes les
dangers à analyser, c’est l'identification des caractéristiques
qualitatives et quantitatives.
Quelques exemples de questions :
Etape 1
L'analyse de risque peut être effectuée dans le cadre
d'un système qualité. La procédure doit être
suivie, sa conduite et ses résultats doivent faire l'objet d'une
documentation.
Etape 2
Elle permet de se poser toute une série de questions sur le
dispositif afin de dégager pour les étapes suivantes les
dangers à analyser, c’est l'identification des caractéristiques
qualitatives et quantitatives.
Quelques exemples de questions :
-
Qu'elle est l’utilisation prévue et comment le dispositif doit-il
être utilisé ?
-
Le dispositif est-il prévu pour entrer en contact avec le patient
ou avec toutes autres personnes ?
-
Quelles sont les matériaux et/ou composants contenus dans le dispositif,
ou utilisés par celui-ci ?
-
De l'énergie est-elle apportée au patient et/ou lui est-elle
retirée ?
-
Des substances sont-elles administrées aux patients et/ou lui sont-elles
retirées ?
-
Des matières biologiques sont-elles traitées par le dispositif
en vue d'une réutilisation ultérieure ?
-
Le dispositif est-il prévalu pour modifier l'environnement du patient
?
-
Des mesurages sont-ils effectués ?
-
Le dispositif effectue-t-il une interprétation ? ….
Etapes 3 et 4
Ces deux étapes permettent d’identifier les dangers et d’estimer
les risques de chacun d’eux dans des conditions normales de fonctionnement
ou dans des conditions de défaut. C’est à ce niveau que l’on
commence à évoquer les deux composantes du risque que sont
les conséquences (gravité) et la probabilité ou de
la fréquence d’apparition.
Etape 5
Pour chaque risque, il faut s’assurer qu’il soit acceptable. Pour
ce faire, on peut utiliser des normes ou d’autres méthodes d’analyses,
deux choix sont alors possibles :
-
le risque est acceptable, on passe à l’étape 8
-
le risque n’est pas acceptable, on essaie de le réduire
Etape 6
La réduction des risques peut se faire grâce : à
des moyens de sécurité (directs ou indirects) sous la forme
de protection, à des moyens de sécurité descriptifs
(la documentation) ou par la redéfinition de l’utilisation.
Etape 7
Elle permet de vérifier que l’étape 6 n’a pas engendré
de nouveaux dangers qu’il faut alors traiter par un retour à l’étape
4.
Etape 8
C'est la dernière étape de la phase d'analyse du risque,
elle permet de vérifier que tous les risques détectés
ont été traité.
Etape 9
Résultat de l'analyse, le rapport formalise et identifie les
risques permettant ainsi une meilleure maîtrise.
Retour Sommaire
2.4.4
Le projet de norme sur la gestion des risques
L'ISO (International Organization for Standardization)
et l'IEC (International Electrotechnical Commission) ainsi que les différents
membres nationaux de ces organismes travaillent à l'élaboration
d'une nouvelle norme sur le risque management (gestion des risques) pour
les dispositifs médicaux (comité ISO/TC 210).
Elle es basée sur :
-
l'ISO 9001 : Modèle pour l'assurance de la qualité en conception,
développement, production, installation et prestations associées.
-
l'ISO 9003 : Modèle pour l'assurance qualité en contrôle
et essais finaux.
-
l'ISO 10993-1,2,3 : Evaluation biologique des dispositifs médicaux.
et des normes IEC comme :
-
IEC 60300-9-3 : Risk analysis of technological systems
-
IEC 60601 : Medical electrical equipment general requirements for safety
-
IEC 60812 : Technique d'analyse pour la fiabilité des système
: AMDE
-
IEC 61025, : Analyse par arbre de défauts
Elle devrait permettre d'harmoniser les attitudes
face à la complexité de la gestion du risque (identification,
maîtrise, réduction). Elle prend en compte 3 concepts pour
l'appréciation du risque :
-
La fréquence
-
Les conséquences du dommage
-
La perception du dommage
Définissant et expliquant le processus du
management du risque, elle propose dans des annexes différents outils
sous la forme de questionnaires permettant d'appréhender la gestion
des risques.
2.5
La matériovigilance
La matériovigilance a pour principe, la
surveillance et l'enregistrement des incidents ou risques d'incident liés
à l'utilisation de dispositifs médicaux en vue d'une meilleure
sécurité pour les patients, les utilisateurs et les tiers.
Ce texte paru dès janvier 1996 fait suite
à la directive européenne et à l'article 10 sur la
clause de sauvegarde après la mise sur le marché. Sans faire
état des sanctions pénales encourues pour le non respect
de ce décret (96/32 du 15/01/96), il joue un rôle de rétroaction
sur le marché. Le principe de cette boucle peut être simplifié
comme le montre Figure 4 "Principe de la matériovigilance".
Sans redéfinir tous les concepts de la matériovigilance,
il est intéressant d'en faire une lecture avec une vision orientée
vers le risque et sa gestion.
Figure 4 "Principe de la matériovigilance"
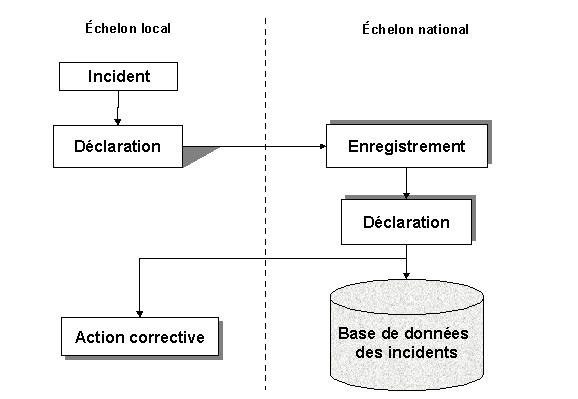
La phase de détection (incident et déclaration)
est un point qui permet deux interprétations possibles :
-
Attendre l'incident et le déclarer
-
Détecter et déclarer un risque potentiel
Ce deuxième aspect est très intéressant
car il demande la mise en œuvre d'une méthode d'analyse précise
afin de détecter le risque avant qu'il n' apparaisse. C'est en réalité
une analyse de risque liée à l'utilisation des dispositifs
médicaux. A ce jour ce type de démarche n'est que très
rarement mis en œuvre même si le décret fait état de
l'obligation de déclarer les incidents mais aussi les risques d'incidents.
Retour Sommaire
|
III)
La qualité et la gestion des risques
|
Avec la matériovigilance, les services biomédicaux
commencent à appréhender les notions de gestion des risques.
Cependant, cette prise de conscience se fait sous la forme d’une obligation
réglementaire. Lorsque l’on met en place une démarche d’assurance
qualité selon le référentiel de type ISO 9000, on
s’aperçoit très rapidement qu’il manque un outil pour permettre
d’optimiser les ressources utiles à l’activité du service
biomédical.
3.1
La qualité
La formalisation de l’activité, les différents
audits, les objectifs qualité et la mesure de l’efficacité
du système qualité amènent les ingénieurs biomédicaux
à concevoir la politique de maintenance et le management des équipes
avec ces nouveaux éclairages. Dans un contexte réglementaire
et financier de plus en plus contraignant, il faut rationaliser l’activité
du biomédical pour continuer à satisfaire le plus possible
les services de soins sans pour autant compromettre la sécurité
et la performance des dispositifs médicaux. Si l’on reprend le cycle
de vie d’un dispositif médical dans un établissement, le
Service Biomédical a une incidence non négligeable sur celui-ci.
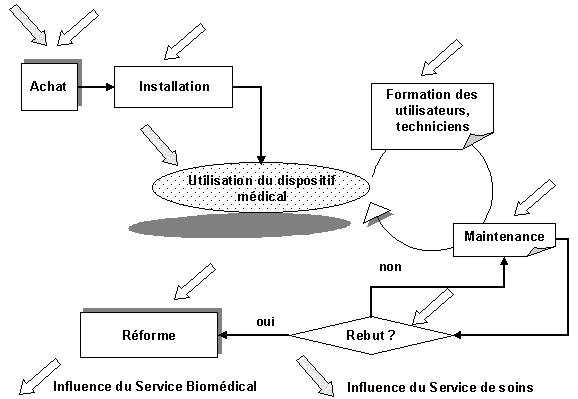
Les différents impacts du service biomédical (Figure 5 "les
différentes influences de l'achat à la réforme"
)ont lieu depuis l'achat jusqu'à la réforme du dispositif
médical. En parallèle, l'influence du service clinique ou
médico-technique sur ce cycle se résume à des interventions
ponctuelles au moment de l'achat (achat et préparation de l'installation)
alors que la période d'utilisation, intégrant aussi l'entretien
régulier de l'équipement, est complètement réservée.
Figure 5 "les différentes
influences de l'achat à la réforme"
La qualité au sens de l'ISO (caractéristiques
d'une entité qui lui confère l'aptitude à satisfaire
des besoins exprimés ou implicites) devient un outil incontournable
dans un service biomédical mais aussi dans un établissement
de soin lorsque l’on veut mettre en place l’accréditation prévue
par l’ordonnance d’avril 1996.
Depuis quelques années, le monde hospitalier
voit apparaître de plus en plus de textes réglementaires où
il est question de qualité et de sécurité. Le GBEA,
l’arrêté du 3 octobre 95 sur l’anesthésie - réanimation
sont là pour affirmer cette évolution sans pour autant faire
référence précisément à la qualité.
Pourtant, ils en reprennent les exigences sans en employer le vocabulaire.
Avec le texte sur la stérilisation, on voit enfin évoqué
les concepts de la qualité ainsi que des références
précises aux normes de type ISO.
Alors que les fabricants de dispositifs médicaux
se voient par la directive 93/42/CEE dans l’obligation de mettre en place
des systèmes qualité pour maîtriser, assurer, la conception
et la fabrication. L’univers hospitalier se doit de se poser quelques questions
sur l’utilisation de ces dispositifs médicaux dans les établissements.
Le rôle d’un service biomédical est de faire le lien entre
deux mondes, l’industriel et le médical, dont les intérêts
ne sont pas toujours les mêmes. Cette interface est donc essentiel,
c’est l’un des rôles du service biomédical. D’un côté
des obligations pour le marquage CE et de l’autre une volonté grandissante
dans l’amélioration de la qualité des soins avec comme point
commun la sécurité et un niveau de performance constant,
il est donc impossible de faire abstraction de ces aspects et le service
biomédical ne peut rester passif et se doit d’être un acteur
de ces changements.
Les démarches qualité permettent de
rationaliser les organisations en facilitant le passage d’une tradition
orale à celle de l’écrit. La traçabilité au
sens large prend une place essentielle dans le système qualité
en assurant le passé, en maîtrisant le présent et en
permettant l’amélioration du futur.
Retour Sommaire
3.2
La gestion des risques
La matériovigilance permet à un niveau
local mais surtout national de surveiller le marché sur ces aspects
sécuritaires (article 10 de la directive 93/42/CEE).
Cependant l’analyse est faite la plupart du temps
après que l’incident ait eu lieu. Il n’y a pas pour le moment de
véritable cellule d’analyse de risque liée à l’activité
médicale mise en place dans les établissements de soins.
Depuis longtemps, aux Etats-Unis la JCAHO a inclus dans ses référentiels
un panel de nouveaux critères consacré à la gestion
des risques et elle encourage l’approche intégrée de la qualité
et de la gestion des risques. Alors que 10 états ont entre 1976
et 1988 rendu obligatoire la gestion du risque au sein de l’hôpital.
Les compagnies d’assurance américaines (représentant 1/3
des hôpitaux) encouragent cette gestion et mettent à la disposition
des établissements des outils méthodologiques pour sa mise
en place et son développement. La Général Accounting
Office analysait en juillet 1989 les points communs des programmes de gestions
des risques. Il y était présenté 3 aspects :
-
Intégration des informations et des programmes dans le domaine de
la qualité et des risques.
-
La mise en place de système d’information permettant l’identification
précoce des événements indésirables.
-
La gestion centralisée du programme sous la responsabilité
d’un "risk manager". Certes il faut mettre en place une structure mais
la gestion des risques est l'affaire de tous. Le rôle du manager
de risque peut être assimilé à celui du correspondant
de matériovigilance. Il se doit d'assurer la gestion, l'information,
l'organisation et l'animation de la procédure de gestion des risques.
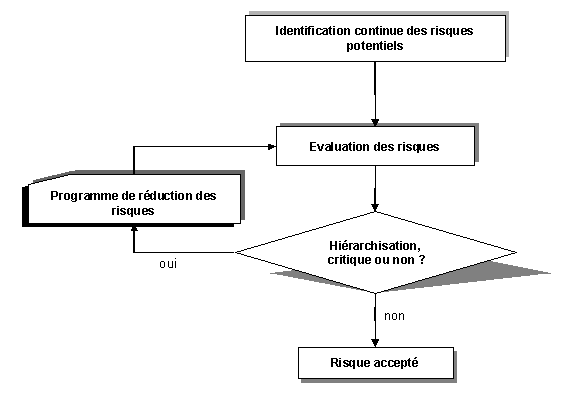
La gestion des risques peut être définie
comme un processus continu (Figure 6 "la gestion des risques"),
coordonné et intégré à l'ensemble d'une organisation,
qui permet l'identification, l'analyse et la maîtrise des dysfonctionnements
qui ont causé ou auraient pu causer des dommages à un patient,
utilisateur ou tiers, au bien de ceux-ci ou de l'établissement.
Figure 6 "la gestion des risques"
 L’autre aspect essentiel qu'il est impossible de
mettre de coté, est la sûreté de fonctionnement.
Lorsque l’on parle de dispositifs médicaux, cette notion est très
vite évoquée. La sûreté de fonctionnement est
" la confiance justifiée dans un service ". Deux notions (Figure
7 "Le dispositif médical") sont à prendre en compte,
l’une concernant le dispositif, l’autre concernant ses caractéristiques
et le service attendu.
L’autre aspect essentiel qu'il est impossible de
mettre de coté, est la sûreté de fonctionnement.
Lorsque l’on parle de dispositifs médicaux, cette notion est très
vite évoquée. La sûreté de fonctionnement est
" la confiance justifiée dans un service ". Deux notions (Figure
7 "Le dispositif médical") sont à prendre en compte,
l’une concernant le dispositif, l’autre concernant ses caractéristiques
et le service attendu.
Figure 7 "Le dispositif médical"
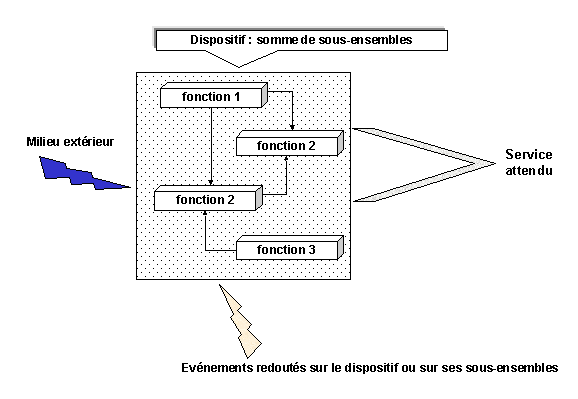
La confiance justifiée fait appelle à
des termes comme :
-
La disponibilité "concept d’aptitude à l’emploi"
Aptitude d'un matériel (liée à
sa fiabilité et à sa maintenabilité) à accomplir
une mission requise dans des conditions données, d'utilisation,
d'environnement et de maintenance, et ce, dans des conditions de temps
déterminées (instant donné ou intervalle de temps
donné).
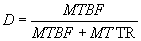
-
La fiabilité concept d’aptitude à la non défaillance
Aptitude d'un bien à accomplir une fonction
requise dans des conditions données pendant un temps donné.
Caractéristique d'un bien exprimé par la probabilité
qu'il accomplisse une fonction requise dans des conditions données
pendant un temps donné.
L'approche de la fiabilité nécessite la connaissance
du temps de bon fonctionnement, ce temps s'apprécie par :
-
MTBF (Mean Time Between Failures ou moyenne des temps entre deux défaillances)
-
MTTF (Mean Time To Failure ou moyenne des temps de bon fonctionnement)
-
La sécurité concept d’aptitude à la non-agression
des individus et de l’environnement
La sécurité est garantie par le maintien
dans le temps des performances et des caractéristiques de cet outil.
-
La maintenabilité concept d’aptitude à la réparation.
Dans des conditions données d'utilisation,
c’est l’aptitude d'un dispositif à être maintenu ou rétabli
dans un état dans lequel il peut accomplir sa fonction requise.
Lorsque la maintenance est accomplie dans des conditions données
avec des procédures et des moyens prescrits.
Elle s'apprécie par la rapidité de
correction de défaut : MTTR (Mean Time to Repair)
Retour Sommaire
|
IV)
Description des outils
|
4.1
Introduction
La prise de conscience du risque afin d’éviter
des dysfonctionnements engendre l'élaboration d'un outil permettant
d'évaluer
la criticité d'un dispositif médical tout en optimisant les
ressources. Ceci permet de garantir une maintenance allant vers une qualité
totale. Les méthodes utilisées en maintenance dans le secteur
industriel guident dans la mise en place de cet outil. Tout d'abord pour
modéliser la vie d’un équipement, il est nécessaire
de cerner sa fiabilité, d'analyser ses défaillances, de mesurer
ses effets et s>
4.2
La probabilité
Effectivement, un dysfonctionnement est dit probable
lorsqu'on a tendance à le juger vrai, sans certitude absolue, on
parle de probabilité d'apparition d'un événement.
La probabilité d'un événement E est obtenue :
-
Soit par le dénombrement et ainsi on a :
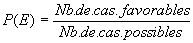
-
Soit de façon expérimentale :
P(E) = f (E)
 (n étant le nombre
d'expériences)
(n étant le nombre
d'expériences)
f (E) est la fréquence observée de l'événement
"E". Plus le nombre d'observation est grande, plus cette fréquence
se rapproche de la probabilité vraie d'avoir E
0 <P(E)<1.
La probabilité 0 correspond à l'impossibilité,
la probabilité 1, à la certitude de la non apparition d’un
événement. Cette donnée demande toutes les informations
sur le dispositif à analyser. Pour mettre en place une politique
de maintenance efficace, il est important de comprendre les phénomènes
de fiabilité et de défaillance.
Retour Sommaire
4.3
Fiabilité
La fiabilité a pour définition normative
la "probabilité d'accomplir une fonction requise, dans des conditions
d'utilisation et pour une période de temps déterminée".
La fiabilité se décompose en 3 parties, la fiabilité
intrinsèque, extrinsèque et totale.
-
La fiabilité intrinsèque est liée à la conception
et la fabrication de l'équipement donc aux composants.
-
La fiabilité extrinsèque est liée aux défaillances
générées par l'utilisation du matériel, le
nettoyage mais surtout le manque de nettoyage, ou bien encore la qualité
de la maintenance.
-
La fiabilité totale est égale à
Fiabilité totale = fiabilité intrinsèque +
fiabilité extrinsèque
Par définition la fiabilité R(t) d'un
matériel à l'instant " t " s'appelle "la probabilité
de survie". La fiabilité d'un matériel réparable est
la probabilité, vue à l'instant zéro, pour qu'il soit
valide à l'instant t, sans avoir subi aucune défaillance
entre 0 et t.
L'étude de la fiabilité des systèmes
s'inscrit aujourd'hui dans une démarche d'amélioration de
la qualité des produits et services. Les exigences grandissantes
des clients font qu'il est nécessaire de s'appuyer sur des méthodes
de Sûreté de Fonctionnement (SdF) qui sont un gage de rigueur.
Les défaillances pendant le cycle de vie d'un
système peuvent être représentées selon une
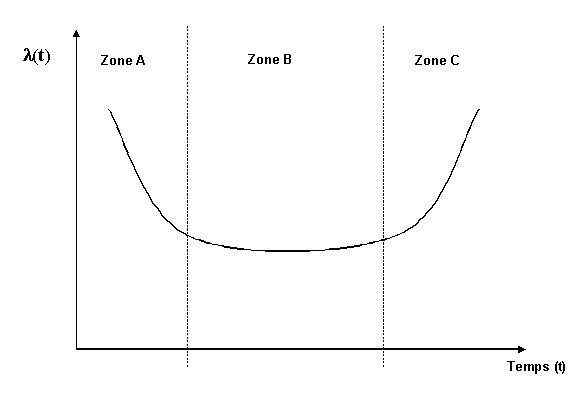
courbe en baignoire comme le montre la figure suivante.
Figure 8 "Courbe en baignoire"
 R(t) =e -l(t)
R(t) =e -l(t)
Observons le comportement d'un système
en service, la Figure 8 "Courbe en baignoire" montre trois zones
caractéristiques :
-
Zone A : les défaillances de jeunesse. Caractérisées
par un taux de défaillance décroissant en fonction du temps.
(rodage, jeunesse, déverminage)
-
Zone B : les défaillances de maturité. A taux de défaillance
sensiblement constant. (maturité, vie utile)
-
Zone C: les défaillances de vieillesse. Avec taux de défaillance
croissant (période d'usure, obsolescence).
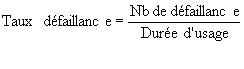
Ce taux est souvent exprimé en pannes / heures.
Une analyse de défaillance permet la recherche
de solutions de maintenance. Elle se base sur plusieurs actions :
-
Opérations correctives d'améliorations
-
Opérations préventives systématiques
-
Opérations préventives conditionnelles
-
Surveillance des points critiques
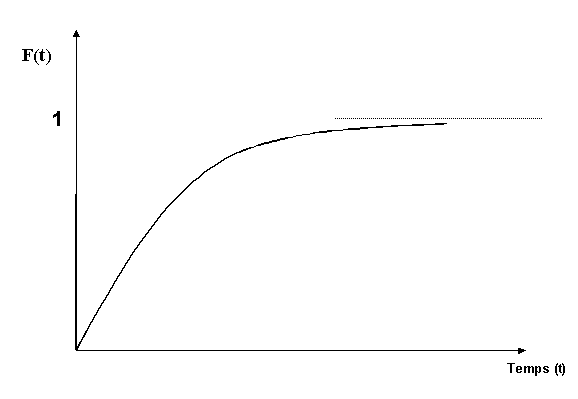
La fiabilité est par définition la
probabilité de bon fonctionnement à l'instant t. On parle
également de défiabilité, qui représente le
complément de la fiabilité. La défiabilité
représente : la probabilité de défaillance et se caractérise
par la formule :
F(t)=1-R(t)
Figure 9 "la défiabilité"
On distingue 4 stades de caractérisation de
la fiabilité :
1) Phase de définition :
-
Allocation d'objectifs de fiabilité
-
Choix des composants
2) Phase de développement :
-
Analyse prévisionnelle de fiabilité
-
Réalisation de prototypes
-
Analyse des défaillances et actions correctives
3) Phase de fabrication :
-
Essai de qualification
-
Contrôle qualité
4) Phase opérationnelle :
-
Recueil et traitement des données de fiabilité
-
Analyse des défaillances et actions correctives
Ces quatre phases engendrent différentes
méthodes d'analyse.
Retour Sommaire
4.4
Analyse qualitative de la fiabilité
4.4.1
Analyse par arbre de défaillances
Un arbre de défaillances est la représentation
de différentes combinaisons d'événements aboutissant
à la réalisation d'un événement unique préalablement
défini (utilisation d'opérateurs ET/OU...) selon que la défaillance
du matériel se produit lorsque les événements se réalisent
ensemble ou séparément.
-
Porte ET : La défaillance de l'ensemble implique la défaillance
de tous les composants.
-
Porte OU : La défaillance d'un composant entraîne la
défaillance de l'ensemble (composant en série).
Cette méthode déductive d'analyse
peut être réalisée à différents stades
selon que l'on s'intéresse au système complet ou à
chacun des sous-systèmes indépendants, elle permet de savoir
comment un système peut-être disponible.
"Les défaillances sont à la maintenance ce que les
maladies sont à la médecine : leur raison d'exister !"
4.2.2
Principales méthodes d'analyse qualitative
Généralement appelé FMEA
(Failure
Modes and Effect Analysis) ou encore
AMDE
(Analyse des Modes de Défaillance et leurs
Effets);
méthode d'analyse préventive qui recense et met en évidence
les risques potentiels.
L'AMDE développée à l'origine dans
l'industrie aéronautique, dans les années 60, elle est rapidement
devenue indispensable dans des domaines tels que l'astronautique ou le
nucléaire. L'AMDE fait aujourd'hui partie intégrante des
méthodes de conception dans l'industrie automobile, chimique...
(La FMEA est le terme Anglais de L'AMDE).
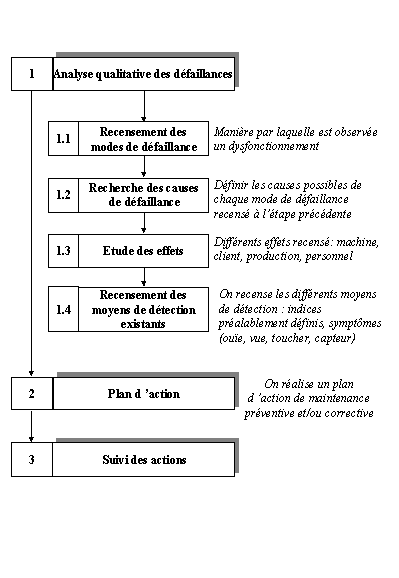
Le schéma ci-dessous démontre les différentes
étapes à mettre en oeuvre pour l'élaboration d'une
méthode d'analyse qualitative de la fiabilité, tel que l'AMDE.
Figure 10 "Méthodologie
de l'AMDE"
Retour Sommaire
4.4.3
Analyse des défaillances
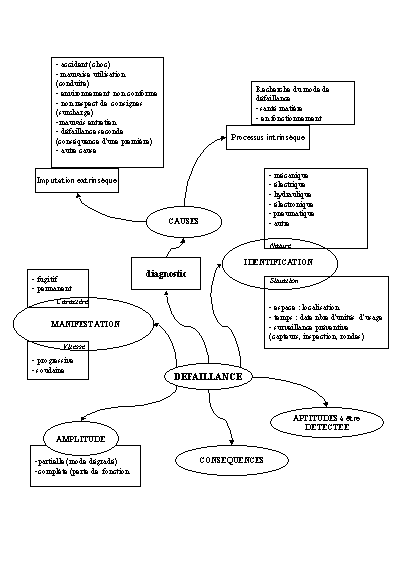
Il est dans l'esprit de la maintenance corrective
de ne pas seulement "dépanner" ou réparer un système
défaillant, mais de chercher à éviter la réapparition
du défaut. Le schéma ci-dessous permet d'appréhender
une défaillance, à l'issue de celle-ci une expertise doit
permettre de rassembler les six éléments de connaissance
d'une défaillance (Figure 11 "Analyse des défaillances")
:
-
Identification
-
Nature
-
Diagnostic
-
Amplitude et vitesse de manifestation
-
Conséquences
-
Aptitude à être détectée
La connaissance de ces 6 éléments
d'expertise est une condition nécessaire à la préconisation
des remèdes correctifs à apporter. La réalisation
de cette méthodologie demande l'établissement d'une fiche
d'analyse de défaillance.
Figure 11 "Analyse des défaillances"
 Retour Sommaire
Retour Sommaire 4.5
Analyse quantitative de la fiabilité
Dans l'analyse quantitative, nous cherchons à
définir le niveau de gravité et la fréquence d'apparition
des défaillances.
4.5
Analyse quantitative de la fiabilité
Dans l'analyse quantitative, nous cherchons à
définir le niveau de gravité et la fréquence d'apparition
des défaillances.
4.5.1
Analyse de la criticité.(AMDEC)
On est conduit à ajouter une colonne au tableau
d'analyse des modes de défaillances. On passe d'une FMEA à
une FMECA (Failure Mode Effects and Criticality
Analysis),
ou d'une AMDE à une AMDEC (Analyse des Modes
de Défaillances de leurs Effets et de leurs Criticité).
L'AMDEC ajoute à l'AMDE la quantification des risques et permet
donc de les hiérarchiser, afin d'agir plus efficacement. Elle permet
la mise en évidence des points critiques et la définition
d'actions correctives.
L'AMDEC est une méthode pouvant être
mise en œuvre tout au long du cycle de vie d'un système, mais qui
est recommandable en tant que technique d'analyse préventive pour
détecter les défaillances potentielles, évaluer les
risques et susciter des actions de prévention.
L'AMDE et l'AMDEC sont efficaces parce qu'elles incitent
à se poser les bonnes questions au bon moment, et favorisent la
communication entre les différents acteurs de l'entreprise. Ce sont
ces techniques qui facilitent l'examen critique de la conception.
Le but de l'AMDEC est de faire le lien entre les
effets et les causes comme le montre la figure suivante :
Figure 12 "AMDEC: lien causes
et effets"
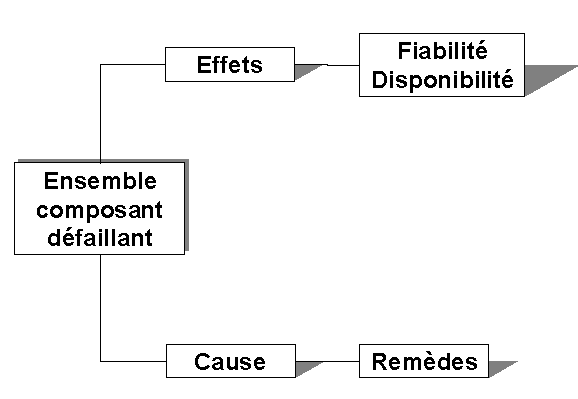
L'industrie actuelle utilise deux types d'AMDEC :
Figure 13 "Les deux types d'AMDEC
dans l'industrie"
Retour Sommaire
4.5.1.1 La
méthodologie
La méthodologie de l'AMDEC présente
4 étapes distinctes :
-
Analyse qualitative des défaillances
-
Analyse quantitative des défaillances
-
Plan d'action
-
Suivi des actions
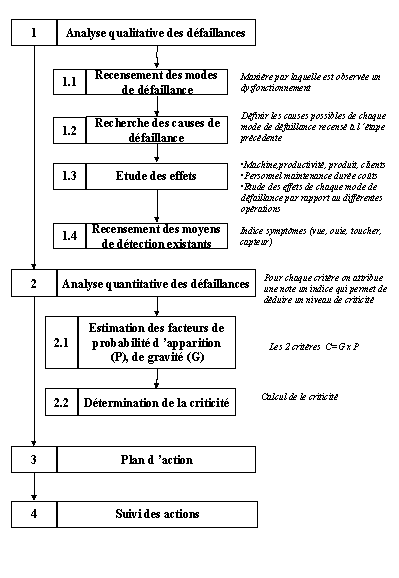
L'étape 1 et 2 sont les plus conséquentes,
elles permettent après une analyse précise des défaillances,
des causes et des effets (étapes 1), de calculer la criticité
une fois la probabilité et la gravité (étape 2) définies.
La figure 13 montre l'organisation et le cheminement d'une telle démarche.
Elle demande la participation de toutes les personnes qui de près
ou de loin jouent un rôle dans l'utilisation, l'entretien du système
analysé.
Figure 14 "Méthodologie
de l'AMDEC"
4.5.1.2
La définition de la gravité et de la probabilité
La méthode consiste à définir
des critères de quantification puis à attribuer une note
à chacun de ces critères (G,P).
Pratiquement chacun de ces trois critères
sera évalué pour chaque mode, à l'aide de grilles
dont on trouve de multiples exemples dans la littérature, la cotation
à 10 niveaux (ou 10 moments) est utilisée mais un système
à 4 niveaux est suffisant (souvent utilisé) et à l'avantage,
outre sa plus grande simplicité de bien s'adapter à la psychologie
de la notation.
niveau 1. catastrophique
niveau 2. critique
niveau 3. marginal
niveau 4. négligeable
Plus l'indice de criticité est élevé
plus le risque lié aux défaillances potentielles est élevé
(criticité,
critique majeure, mineure...).
Ensuite, on élabore des plans d'actions, les
actions sont d'ordre préventives ou correctives selon les cas. Elles
visent à supprimer les causes des défaillances, les priorités
sont directement définies par l'indice de criticité. (étape
3 du schéma ci-dessus).
Toutes les valeurs trouvées de la criticité
supérieures au seuil défini, font l'objet d'une étude
spécifique dont le résultat doit ramener la criticité
au seuil préétabli ou entraîner une autre solution,
redondance...
4.5.1.3 Le
calcul de la criticité
Le calcul de la criticité est basé sur le produit de
la gravité et de la probabilité.
C = Gravité x probabilité d'apparition
-
G : Gravité : niveau du risque occasionné (Aucun
risque, risque de défaut, défaut important).
-
P : Probabilité d'apparition. Probabilité que
la cause se produise et qu'elle entraîne le mode de défaillance
(moins d'1 par an, 1 par an...). L'identification de ce paramètre
demande un certain recul, la présence d'un historique des informations...
Certains industriels utilisent le critère
de non détection afin de calculer la criticité, or, ce critère,
cette valeur reste facultative et présente un problème de
quantification.
-
N : non détection : probabilité qu'une cause
ou qu'un mode de défaillance ne soit pas détecté (décelable
en fonctionnement (à 100 %), décelable en fonctionnement
(à 50 %), non décelable (visible seulement à l'arrêt),
jamais décelable).
4.5.1.4 Tableau
utilisé en AMDEC :
| N° |
Identification du dispositif |
Fonction |
Mode de défaillance |
Effet |
|
|
|
| |
|
|
|
|
Probabilité |
Gravité |
Criticité |
L'AMDEC est également un outil précieux pour
conduire la qualité.
La défaillance est la base de recherche de méthodes,
de procédés, d'analyses, il serait illusoire de vouloir opérer
une maintenance ou une réparation sur un matériel sans avoir
au préalable élucidé la nature de la défaillance
afin de réduire au maximum la probabilité d'occurrence.
Aujourd'hui rare sont les services techniques biomédicaux
qui appliquent la méthode AMDEC, or de façon intuitive, cette
analyse est effectuée par le mainteneur, sans qu'il ait forcément
connaissance au préalable de la méthode.
Retour Sommaire
4.5.2
Analyse par arbres d'événements
Comme l'AMDEC, cette analyse est une méthode
inductive qui consiste à rechercher directement les conséquences,
les effets qu'ont sur un système des évènements élémentaires.
Elle a l'avantage de percevoir tous les états du système.
4.6
D'autres outils utilisés par les industriels
Il existe également d'autres outils mis en
place et utilisés par les industriels, ceci afin de réduire
les dysfonctionnements, afin de mesurer les risques éventuels.
4.6.1
APR (Analyse Préliminaire des Risques)
Identification de l'ensemble des risques. Apparue
dans les années 60, elle est aujourd'hui utilisée dans de
nombreux secteurs tels que l'aéronautique, la chimie, le nucléaire...
Son but étant d'identifier les risques inhérents au système
étudié et ceci dès les premières phases de
la conception. Elle peut de décomposer en plusieurs étapes
:
-
identification des éléments et situations dangereuses ainsi
que les accidents conséquents.
-
évaluation de la gravité des conséquences.
-
propositions de mesures de réduction de risques.
Soit 3 grandes étapes :
-
un constat (inventaire des risques)
-
un diagnostic (analyse)
-
une prescription (établissement de solution)
| 1
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10
|
| Appareil
ou éléments |
Eléments
dangereux |
Situation
dangereuse |
Accident
potentiel |
Gravité |
Probabilité |
Criticité |
Détection |
Mesures
existantes |
Mesures suggérées
|
| |
|
|
|
|
|
|
|
|
|
1 : Identification de l'ensemble étudié ou des
fonctions
2 : Identification des éléments ou de l'ensemble
auxquels on peut associer un danger intrinsèque
3 : Identification des situations dangereuses résultant
de l'interaction d'un élément dangereux et de l'ensemble
du système
4 : Identification des possibilités d'accident liées
aux intéractions entre éléments dangereux et situations
dangereuses
5 : Appréciation de la gravité des effets ou conséquences
suivant la classification développée précédemment
6 : Appréciation de l'occurrence de l'accident potentiel
suivant la classification développée antérieurement
7 : Détermination de la criticité, c'est à
dire gravité x probabilité
8 : Détection de certains incidents par le système
9 : Mesures préventives ou de protection prises par le
service pour éliminer ou maîtriser les risques identifiés
10 : Mesures préventives ou de protection suggérées
pour éliminer ou maîtriser les risques identifiés
Retour Sommaire
4.6.2
La méthode Méride
La méthode Méride permet l'évaluation
des risques industriels, des dysfonctionnements des équipements.
Cette analyse est menée en tenant compte du
contexte de l'entreprise mais aussi de la connaissance des risques liés
au dysfonctionnement
La méthode Méride se définit
en 2 étapes :
-
1ère étape : estimation de la gravité des risques
de défaillance des équipements.
-
2ème étape : étude globale d'évaluation des
risques.
Elle permet de choisir les 6 à 10 équipements
à rotation de risque les plus élevés. Il faut conduire
alors une réflexion rigoureuse et analytique afin de trouver des
solutions pour faire diminuer la valeur du risque de ces équipements
:
-
politique de maintenance (préventive, conditionnelle)
-
pièces de rechange à tenir en stock
-
procédures d'exploitation et de sécurité
-
formation du personnel
-
études financières de remise à niveau, d'amélioration
ou de renouvellement.
Tableau 1"Méride"
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
42
|
13
|
14
|
-
1 - Fonction
-
2 - Installation
-
3 - Equipement
-
4 - Indisponibilité
-
5 - Note globale
-
6 - Qualité
-
7 - Délais
-
8 - Quantité
-
9 - Sécurité
-
10 - Etat
-
11 - Maintenance
-
12 - Documentation
-
13 - Exploitation
-
14 - Remarques
4.6.3
Les outils qualité
-
le Brainstorming (remue-méninges) a pour but de produire
un grand nombre d'idées sur un thème donné. Il favorise
la créativité des participants et permet de faire surgir
des idées nouvelles.
-
Diagramme de Pareto ou analyse ABC (exploitation des relevés
de défaillance) permet d'orienter la politique de maintenance à
mettre en oeuvre. Le but est de faire apparaître les priorités,
de faire le tour d'un problème ou d'une situation (résolution
de problème en groupe de travail).
-
Diagramme d'Ishikawa (diagramme causes/effets) dont
le but est de formuler collectivement les causes d'un problème,
de déterminer avec précision les situations à problèmes,
puis de lister toutes les causes pour ensuite les classer en famille afin
de les positionner sur le diagramme. Arêtes de poisson ou méthodes
des 5 M (Méthodes, Milieu, Matière, Maintenance, Moyens).
-
Le QQOQCP (Qui ?, Quoi ?, Où ?, Quand ?, Comment ?,
Pourquoi ?). C'est une technique de recherche des informations, pour faire
le tour d'un problème ou d'une situation.
Retour Sommaire
CHAPITRE 2
|
V)
Le contexte de l'activité biomédicale
|
Avec le passage à l'an 2000, on constate une
prise en compte de la notion de risque dans les hôpitaux français
au regard de dysfonctionnements susceptibles de perturber le fonctionnement
de bon nombre de dispositifs médicaux qui peuvent être vitaux
pour
certains patients. Un guide méthodologique pour la préparation
du passage à l'an 2000 en milieu hospitalier est le résultat
de cette analyse de risque pour un évènement que l'on a identifié
depuis très longtemps…Cependant, tous les jours, le risque est présent
dans les différentes activités hospitalières, le service
biomédical, les techniciens et ingénieurs ne peuvent pas
l'ignorer.
Avant son arrivée dans un service clinique
ou médico-technique, le dispositif médical passe par des
étapes qui vont influencer son intégration dans le service,
son utilisation, sa sûreté de fonctionnement et ses performances.
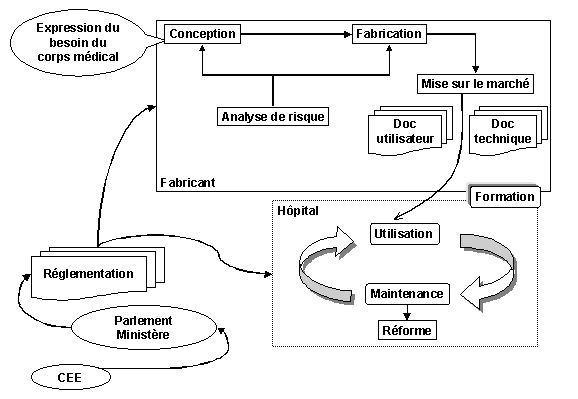
La figure suivante montre d’une manière très générale
l’ensemble de ces étapes. On y retrouve la phase de réalisation
du dispositif médical avec dès la conception, la mise en
place d’analyses de risque. La seconde partie montre au niveau de l’hôpital
le cycle de vie du dispositif médical. La réglementation
qui s’impose à la fois au fabricant mais aussi à l’hôpital,
est un aspect essentiel que l'on doit intégrer dans l'activité.
La documentation technique et utilisateur ainsi que la formation, quant
à elles, ont un impact direct sur le dispositif médical,
(entretien et utilisation).
Figure 15 "Le contexte de l'activité
biomédicale"
Retour Sommaire
Lorsque l'on commence à parler d'analyse de
risque, il faut parfaitement connaître son environnement et principalement
le ou les dispositifs que l'on veut étudier. L'analyse des besoins
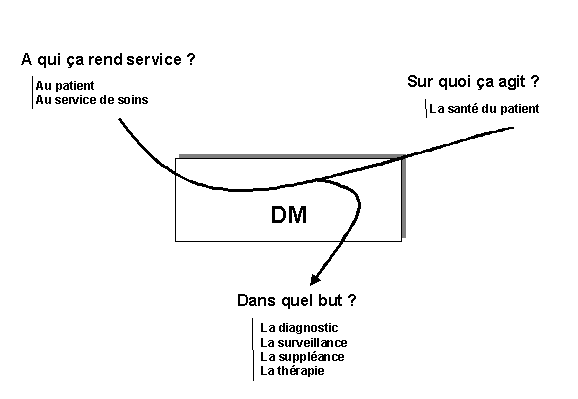
de celui-ci permet de ce faire une première idée. Il suffit
de trois questions simples.
-
A qui ça rend service ?
-
Sur quoi ça agit ?
-
Dans quel but ?
On peut symboliser ceci par une "bête à
cornes" qui servira de base à cette analyse. Les patients sont les
premiers bénéficiaires du dispositif médical car celui-ci
agit sur leurs états (sur quoi ça agit ?), de plus chaque
dispositif médical a une fonction, un but précis (dans quel
but ?). Cependant, il ne faut pas mettre de coté, les utilisateurs
(médecins et personnels soignants) à qui il rend un service
non négligeable en améliorant les techniques et en simplifiant
leur pratique.
Figure 16 "la bête à
cornes"
Retour Sommaire
|
VI)Le
contexte hospitalier
|
L'hôpital est un lieu de soin où travaille
plusieurs corps de métier différents. De plus l'hôpital
d'aujourd'hui devient de plus en plus technique, associé à
l'informatique et est de mieux en mieux équipé entraînant
des contraintes de fonctionnement. Tout ceci ne sont que des facteurs multiplicateurs
de risque d'incidents.
6.1
Un retour d’expérience
Depuis une vingtaine d'année L'ECRI (Emergency
Caire Research Institute) enregistre sur une base de données tous
les incidents imputables aux dispositifs médicaux utilisés
sur le marché américain. Elle a classé l'ensemble
de toutes ces informations en 4 catégories :
-
Dysfonctionnements liés au matériel
-
Fondements scientifiques erronés
-
Défauts de conception
-
Défauts de production
-
Dysfonctionnements liés aux logiciels
-
Incidents lié aux hasards
-
Facteurs environnementaux
-
Alimentation électrique
-
Arrivée des gaz médicaux
-
Interférences électromagnétiques et fréquences
radio (CEM)
-
Température, humidité ….
-
Erreur dans les procédures de management du système
-
Avant l'acquisition d'un dispositif médical
-
Dans l'identification des incidents des alertes et de la communication
en cas d'incident
-
Recueil et conservation des données relatives au suivi et l'entretien
des dispositifs
-
Formation des utilisateurs
-
Erreurs d'utilisation
Ces erreurs sont imputables à la fois au
service biomédical et aux soignants (médecins et infirmiers).
Il est intéressant de définir les causes de ses erreurs :
-
Formations inadéquates
-
Pas d'expérience
-
Pas d'encadrement
-
Les manuels d'utilisations non disponible ou inadéquats
-
Erreurs techniques
-
Erreurs de maintenance
Elles se voient aggravées par des contraintes
de temps, les pressions financières, psychologiques ….
Il est possible de définir un autre type de
classement pour ces erreurs liées à l'utilisation :
-
Erreurs de montage
-
Confiance indue dans un élément automatique
-
Mauvais raccordement
-
Mauvais entretien, contrôle ou réparation
-
Mauvaise utilisation clinique
L'ECRI précise que les erreurs liées
à l'utilisation représentent 50 % des risques dont 40 à
60 % pour les seuls utilisateurs directs du dispositif.
Retour Sommaire
6.2
Les interfaces d'un dispositif médical
La Figure 17 "Le contexte hospitalier" montre
un dispositif médical dans son milieu avec toutes ces interfaces.
On y retrouve tous les acteurs du monde hospitalier, les soignants, les
techniciens mais aussi le patient et les tiers qui ne doivent pas être
oublier. L’environnement du dispositif médical est incomplet si
on ne tient pas compte de l'ensemble des conditions naturelles (climat
architecture) et culturelles qui peuvent agir sur lui ainsi que les organismes
vivants et que diverses activités humaines.
Figure 17 "Le contexte hospitalier"
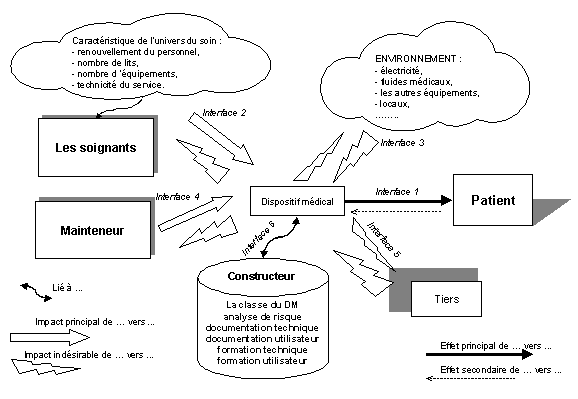
De plus, il ne faut pas mettre de côté
les aspects indispensables qui vont conditionner le cycle de vie (la Figure
18 "le cycle de vie du dispositif médical") du dispositif
médical comme la documentation utilisateur et technique, les périodes
de formation, technique et utilisateur, la classe du dispositif médical
et l'analyse de risque réalisée par le fabricant.
Dans ce cas de figure, l'observation du système
amène une nouvelle approche où il faut prendre en compte
toutes les composantes pour analyser les causes et les effets sur le dispositif
médical tout en gardant comme objectif principal, la qualité
des soins, la sécurité des patients, de l'utilisateur et
du tiers.
6.2.1
L'interface dispositif médical - patient (interface 1)
Le dispositif médical se doit de remplir sa mission
de diagnostic, de surveillance, de suppléance, de thérapie
mais il doit le faire avec une sécurité maximum pour le patient.
Il ne faut pas perdre de vue que le patient doit avoir le moins d'influences
négatives possible (entraînant un dysfonctionnement du dispositif
médical) sur le fonctionnement de celui-ci.
Retour Sommaire
6.2.2
L'interface soignant - dispositif médical (interface 2)
Cette deuxième relation est importante car
elle influence la qualité des soins que doit recevoir le patient
à travers le dispositif médical. Une bonne connaissance de
son utilisation et de son entretien quotidien sont des éléments
majeurs qui assurent au final un effet bénéfique de celui-ci
sur le patient.
La relation service soignant dispositif médical
est modifié par différents aspects. Il faut prendre en compte
les caractéristiques du service de soins dans lequel a lieu la relation.
Effectivement la technicité n'est pas la même d'un service
à l'autre. Un service de médecine n'a pas la même technicité
ou le même taux de technicité q'un service d'urgence, de cardiologie
ou de réanimation. Les dispositifs médicaux sont plus complexes,
plus nombreux mais ainsi plus proche du patient (invasivité). Il
faut également tenir compte de la taille du service en question,
de son nombre de lits, de son nombre d'équipements disponibles ainsi
que de la rotation des personnels.
6.2.3
L'interface environnements - dispositif médical (interface 3)
Cette relation permet d'intégrer l'ensemble
des caractéristiques de l'établissement, de l'état
des locaux et de leurs équipements (climatisation, chauffage, éclairage…),
de la fourniture des différents fluides (oxygène, protoxyde
d'azote, air médical, vide …) et les sources d'alimentation (gaz,
électricité, eau …) utiles au fonctionnement du dispositif
médical. L'environnement direct du dispositif médical doit
être lui aussi pris en compte, c'est en outre, les possibilités
d'interface entre le dispositif médical et d'autres équipements
mais aussi des problèmes de compatibilité électromagnétique
(CEM)
résultants des parasites dus à d'autres dispositifs médicaux
ou équipement dans l'environnement proche ou lointain, aux éclairages
(néons…) ou réseaux informatiques …
6.2.4
L'interface mainteneur - dispositif médical (interface 4)
Cette interface reprend la phase d'entretien du cycle
de vie du dispositif médical. Cette relation, influence la qualité
de la prestation, du service et de sa maintenance. Elle peut-être
déclenchée de deux façons différentes. De manière
involontaire suite à une panne, de manière volontaire (maintenance
préventive, contrôle qualité), les caractéristiques
du service de maintenance qu'il soit interne ou externe à l'hôpital
peuvent modifier la relation Mainteneur - Dispositif médical. Elles
touchent les aspects matériels (outillage, Equipement de Contrôle
de Mesure et d'Essai, locaux, logistique …..), l'organisation même
du service mais ainsi les moyens humains et financiers.
Retour Sommaire
6.2.5
L'interface tiers - dispositif médical (interface 5)
L'influence par des tierces personnes peut engendrer
des dysfonctionnements ou dégrader directement l'état du
dispositif médical ou son environnement proche (indirectement).
Une non connaissance du milieu et un non respect du matériel utilisé
aura un impact sur l'état de santé du patient ou sur le dispositif
médical. Ce risque est très loin des préoccupations
actuelles d'un service biomédical mais, il faut l'intégrer
dans la réflexion.
6.2.6
L'interface constructeur - dispositif médical (interface 6)
Cette relation fait ressortir deux aspects majeurs.
Le premier aspect est celui de la mise en service du dispositif médical
avec ses différents accessoires, sa documentation technique et utilisateur,
son analyse de risque et de sa conformité réglementaire (marquage
CE) préalablement effectuée. Dès l'achat du dispositif
neuf, l'ingénieur biomédical se doit d'intégrer les
aspects de formation technique et utilisateur qui seront mise en œuvre
lors de l'installation. Si toutes ces modalités ne sont pas remplies,
la qualité des soins sera affectée. Le deuxième aspect
est quant à lui dans le sens inverse puisque c'est le dispositif
médical qui va influencer le constructeur, ceci n'est autre que
la matériovigilance.
6.3
Les différents états du dispositif médical dans un
service de soins
Le cycle de vie du dispositif médical dans le
service utilisateur est le point qui va permettre de baser la suite de
l'étude. La Figure 18 "le cycle de vie du dispositif médical"
représente ce cycle, on y retrouve trois phases : l'utilisation,
l'entretien au niveau de l'utilisateur et ou du service biomédical
et enfin le stockage dans le service de clinique ou médico-technique.
Figure 18 "le cycle de
vie du dispositif médical"
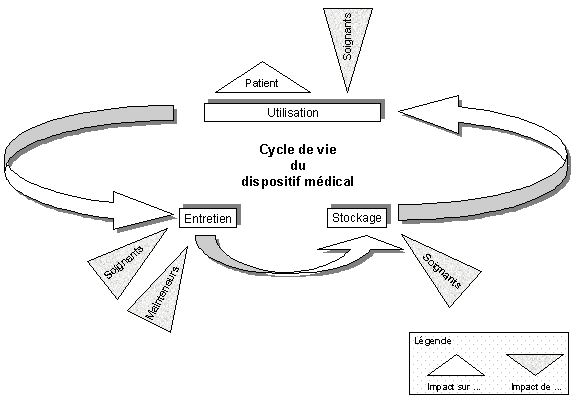
Retour Sommaire
6.4
Le cycle des performances
Un dispositif médical est un système
dont les performances se modifient au fil du temps. Ceci ne veut pas dire
qu'il n'est pas fiable mais il faut garder à l'esprit que malgré
les progrès technologiques, les composants électroniques
et / ou mécaniques se dégradent dans le temps. Dans un environnement
où la vie du patient repose souvent sur le bon fonctionnement d'une
machine, le risque d'une panne, d'une baisse des performances ne sont pas
acceptables.
L'analyse des différents niveaux de performance
d'un dispositif médical montre trois états :
-
Le fonctionnement correcte
-
La panne
-
La dégradation des performances
La Figure 19 "Evaluation des performances du
Dispositif médical seul" représente les 3 états
de performances que peut rencontrer un dispositif médical au court
de son cycle de vie, la fréquence et l'ordre d'apparition de ces
états restant aléatoire.
Figure 19 "Evaluation des performances
du Dispositif médical seul"
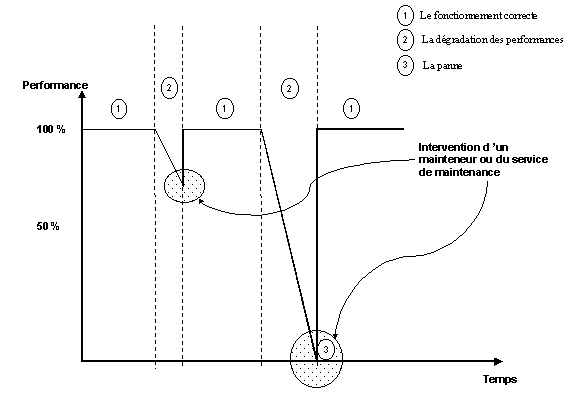
La Figure 17 "Le contexte hospitalier"
montre que le dispositif n'est pas seul. Il est intégré dans
un système plus large qui comprend des utilisateurs, les mainteneurs,
un environnement …
Tous ces éléments vont avoir un impact
sur les performances du dispositif. Les acteurs cités auparavant
peuvent les dégrader. Au cours de son utilisation, le dispositif
peut être à 100 % de ses performances mais il ne répondra
pas aux attentes, comme par exemple une erreur, une fausse manipulation
par manque de connaissance, de formation, par inattention …
Il est possible de définir trois états
de dysfonctionnement dans la vie du trio HOMME -MACHINE-environnement que
l'on retrouvera dans des combinaisons très différentes durant
la vie du dispositif médical à savoir :
-
La panne
-
Défaut d'exploitation
-
Fonctionnement dégradé
Retour Sommaire La Figure 20 "Evolution des performances d'un
dispositif médical dans son environnement" permet de visualiser
les différentes performances d'un dispositif médical lorsqu'il
est dans son environnement à savoir le service de soins. Ce graphique
n'est qu'un exemple pour la démonstration dans le cadre de cette
étude.
La Figure 20 "Evolution des performances d'un
dispositif médical dans son environnement" permet de visualiser
les différentes performances d'un dispositif médical lorsqu'il
est dans son environnement à savoir le service de soins. Ce graphique
n'est qu'un exemple pour la démonstration dans le cadre de cette
étude.
Figure 20 "Evolution des performances
d'un dispositif médical dans son environnement"
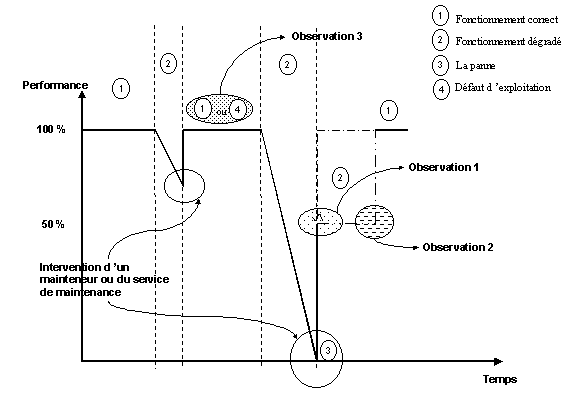
Observation 1
Suite à l'intervention technique sur le
dispositif médical, il ne retrouve pas 100% de ces performances
car il n'y a pas eu de contrôle des performances avant la remise
en service de l'équipement.
Observation 2
La réalisation du contrôle de performances
et d'une action corrective permettent d'assurer 100% des performances pour
le dispositif médical donc un retour à un fonctionnement
correct.
Observation 3
Dans ce cas de figure, deux possibilités
peuvent apparaître, soit le dispositif médical est en fonctionnement
normal, soit il subit un défaut d'exploitation sans pour autant
diminuer le taux de performance.
|
VII)Le
rôle et les ressources du service biomédical
|
Entre le monde des industriels de la santé
et celui des soignants, le service biomédical dans un établissement
(privé ou public) de soins a un rôle d'interface. Intégré
dans le soutien logistique et bien que ne produisant pas de soins, il concourt
cependant à la qualité des soins au regard de son activité
autour des dispositifs médicaux.
7.1
Le rôle
Les deux domaines d'activité du service biomédical sont
le conseil et le suivi des équipements.
Il permet de préparer l'intégration
de nouvelles techniques de nouveaux dispositifs médicaux dans le
service clinique ou médico-technique en collaboration constante
avec les utilisateurs.
-
Evaluation des besoins
-
Choix et implantation des matériels
-
Choix de la politique de maintenance
-
La politique d'amélioration et de renouvellement
-
Respect de la réglementation
-
Les activités de suivi des équipements
Elles permettent de maintenir le parc à
un niveau de performance et de sécurité optimales. Les activités
sont nombreuses comme :
-
Contrôle du bon fonctionnement des matériels
-
Traçabilité des incidents et du matériel
-
Suivi de la disponibilité du parc
-
Gestion rationalisée des prestations de maintenance sous-traitées
-
Formation du personnel technique et des utilisateurs
-
Choix de la politique de maintenance, de la politique d'amélioration
et de renouvellement
-
Respect de la réglementation
-
Assure le contrôle qualité
Retour Sommaire
7.2
Les ressources
Les ressources des services biomédicaux sont
très variables d'un établissement à l'autre. Certes
l'activité est récente mais ceci n'explique pas ces différences.
La taille de l'hôpital peut-être une raison mais, la volonté
de la direction et la politique de maintenance énoncée et
appliquée dans chaque établissement creuse le fossé
entre les différents services biomédicaux.
La Figure 21 "Les moyens du service biomédical"
montre les différents moyens dont dispose le Service Biomédical
pour la mise en œuvre de son activité de suivi des équipements.
six catégories définissent l'ensemble des moyens utilisables
pour l'optimisation des ressources à savoir :
Figure 21 "Les moyens du service
biomédical"
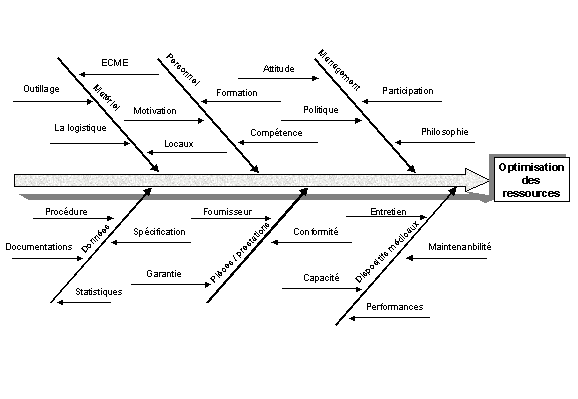
Le personnel est la première ressource qui
vient à l'esprit lorsqu'il faut réaliser une tâche,
une prestation. La formation, la motivation, la compétence et l'implication
des personnels sont autant de facteurs qui doivent être pris en compte
dans l'évaluation des ressources au niveau du personnel. La taille
et l'histoire des services biomédicaux jouent une rôle très
important sur la constitution des équipes techniques.
Après le personnel, vient en seconde ressource,
le matériel. Sans ce moyen, un service de maintenance n'a aucune
raison d'exister. De plus, la réglementation pousse le service à
s'équiper, de par la traçabilité, le contrôle
qualité…
L'ingénieur biomédical lorsqu'il
a la responsabilité d'un service possède, de part sa position,
un ensemble de moyens qu'il peut mettre en œuvre pour l'optimisation des
ressources. Le premier est la politique de maintenance qui définit
les différents objectifs que le service s'est fixé tant en
terme de prestation de maintenance et ou de formation que d'organisation
interne du service.
Le type de management mis en place sur une influence
sur le personnel pour conséquent l'organisation et sur l
-
Les données (informations)
La documentation technique, utilisateur, les différentes
procédures de maintenance, d'organisation, les données statistiques
permettent de constituer une base de travail sur laquelle il est possible
de poser une analyse et une recherche de solution quant à l'amélioration
de la prestation ou à l
Le choix et l'enjeu des prestations doivent être
analysés de façon stratégique. De plus, il ne suffit
pas de choisir le prestataire, il faut également avoir une certaine
maîtrise sur la qualité de travail rendu à savoir :
le service, le coût, le délai de réception des pièces
et la rapidité d'intervention …
Le choix des dispositifs médicaux aura lui
aussi un rôle sur l'optimisation des ressources. Sa maintenabilité,
l'entretien préconisé par le constructeur, ces performances
sont autant de points qui peuvent augmenter l'importance des ressources
à mettre en œuvre pour assurer la sécurité des patients
et utilisateurs.
Des actions correctives sur ces domaines permettent de modifier au final
l'impact de l'activité.
Retour Sommaire
VIII)
Analyse fonctionnelle d’un dispositif médical
|
8.1
Introduction
L'existence d'un service de maintenance biomédical
au sein des hôpitaux a pour objectif le maintien des performances
et de la sécurité des équipements, ainsi que la diminution
des pannes et de ses conséquences. En effet, ces dernières
coûtent chers, elles occasionnent :
-
des coûts d'intervention, de réparation;
-
des coûts de non qualité de soins;
-
des cas de mortalités éventuelles.
De plus actuellement, pratiquement chaque acte
médical effectué dans un établissement de soins ou
même à domicile comporte l'utilisation de plusieurs dispositifs
médicaux.
Il existe aujourd'hui plus de 5000 types de matériels
médicaux sur le marché et des centaines de milliers de marques,
modèles et tailles...
Le nombre, la variété, la complexité,
la sophistication des dispositifs médicaux a considérablement
augmenté ces toutes dernières années et continuent
de croître quasi quotidiennement. Parallèlement, les patients
sont soumis à un nombre croissant d'interventions impliquant l'utilisation
de technologies.
Ces différents paramètres engendrent
et multiplient les risques de dysfonctionnements.
8.1.1
Ce qui peut engendrer des dysfonctionnements.
Les interfaces entre les matières et leur environnement sont
donc plus fréquentes. Elles peuvent être à l'origine
de :
1- Dysfonctionnements liés au matériels :
-
Fondement scientifique erroné
-
Défauts de conception
-
Défauts de production
-
Dysfonctionnement liés aux logiciels
-
Incidents liés au hasard
2- Facteurs environnementaux :
-
Alimentation électrique
-
Les arrivées de gaz médicaux
-
Les interférences électromagnétique et fréquence
radio
-
Autres contingences environnementales (température, humidité...)
3- Erreurs dans les procédures de management du système.
Retour Sommaire 4- Erreurs des utilisateurs : (les risques recensés)
4- Erreurs des utilisateurs : (les risques recensés)
-
Erreur de montage
-
Confiance indue dans un élément automatique
-
Mauvais raccordement
-
Mauvais entretien, contrôle ou réparation
-
Mauvaise utilisation clinique
Ce classement des risques a été mis en place par l'ECRI
(Emergency
Care
Research
Institute),
organisme Nord Américain qui travaille depuis de nombreuses années
dans le secteur des dispositifs biomédicaux.
8.1.2
Comment minimiser les risques ?
Pour minimiser les risques, il faut que :
-
Les équipements soient sûrs et performants
-
Leur gestion garantisse la sécurité du patient, des utilisateurs,
des praticiens et des tiers
-
Les utilisateurs et manipulateurs soient formés correctement
-
Les médecins aient les compétences pour se servir de nouveaux
matériels qui font appel à des procédures sophistiquées.
8.2
Questionnaire d’analyse sur les dispositifs médicaux installés
Afin de pouvoir comprendre le contexte hospitalier,
l'environnement dans lequel est utilisé le dispositif médical,
et, avant d'entreprendre une action tenant compte du rôle et des
ressources du service biomédical, la mise en place d'un questionnaire
permet d'acquérir cette connaissance du milieu. Il est évident
que pour entreprendre des actions correctives de quelque nature que ce
soit (maintenance curative et préventive, formation, contrôle
qualité, mise en place des procédures, organisation…), il
faut connaître le ou les problèmes ou tout du moins ce qui
est à l'origine des défaillances, ceci dans le seul but d'optimiser
les ressources.
Retour Sommaire 8.2.1 Le dispositif
médical
8.2.1 Le dispositif
médical
Quel type de famille d'équipement ?
-
surveillance
-
suppléance
-
diagnostic
-
thérapeutique
Est-ce que le dispositif médical contient un programme ?
Le dispositif médical est-il amené à se déplacer
?
-
dans le bâtiment
-
vers l’extérieur
-
conditions du déplacement
-
moyen de déplacement
Le dispositif médical est-il à usage unique ou réutilisable
?
Ergonomie, convivialité :
-
modes opératoires simplifiés
-
aisance d’utilisation
-
intégration de programmes de sécurité
-
auto contrôle de la machine
-
mise en route, arrêt de la machine
Le dispositif médical possède-t-il des accessoires et
ou des consommables ?
Quelles sont les pannes les plus fréquentes ?
-
Comment sont elles détectées ?
-
Est-ce que l’utilisateur apprécie la dégradation des performances
de sa machine ?
Le dispositif médical délivre t-il une énergie
ou des substances au patient ?
Y a-t-il un entretien particulier du dispositif médical ?
-
les types d’actions
-
fréquence
-
risques de non nettoyage
-
risques qui peuvent apparaître s'il n’y a pas un entretien de base
du dispositif médical
Quels sont les éléments du dispositif médical
qui sont à usage unique ? (lots, stérilisation…)
Est ce que le dispositif médical est susceptible d'être
en contact avec le patient ou avec d'autres personnes ?
Peut-il y avoir des effets à long terme ou retardé ?
Est-ce que le dispositif médical à une durée de
vie limitée ?
Qu'est ce qui détermine l'autonomie du dispositif médical
?
Est-ce que le dispositif médical reçoit des énergies
ou, des substances venant du patient ?
Existe-t-il des moments de non utilisation du dispositif médical
?
-
dans quelles conditions est-il alors mis en attente ?
-
est-ce prévu dans le manuel d’utilisation ?
-
règles de mise en attente ?
-
règles de remise en marche ?
Fréquence d’utilisation du dispositif médical ?
Durée d’utilisation?
8.2.2
Interface utilisateur / appareil
Qui utilise le dispositif médical ?
-
médecin
-
infirmière
-
aide-soignant
Quelle est la formation ou les connaissances requises pour utiliser
le dispositif médical ?
Lors de l’acquisition du dispositif médical avez-vous eu une
formation particulière pour sa bonne utilisation ?
-
si non, pourquoi ?
-
si oui, qui est formé ?
-
combien de personnes sont formées ?
-
quand est-elle effectuée ?
-
qui assure la formation ?
-
ressentez-vous le besoin d’une formation continue ? (fréquence,
sujet de formation)
Existe-t-il une rotation du personnel utilisant le dispositif médical
? (notion de fréquence)
Qui assure la formation des saisonniers ou des remplaçants ?
Existe-t-il des procédures d’utilisation du dispositif médical
?
Existe-t-il des procédures de nettoyage du dispositif médical
?
Existe-t-il un manuel d’utilisation ? (en français ou en anglais)
Connaissance des performances du dispositif médical en terme
d’utilisation ?
-
de toutes les performances
-
de toutes les fonctions
-
de quelques fonctions
Retour Sommaire
8.2.3
Interface environnement / dispositif médical
Adaptabilité des locaux (architecture)
-
Ventilation / climatisation, espace, accessibilité, luminosité,
calme
Quelles sont les alimentations en fluides médicaux, électricité
et eau ?
Existe-t-il des secours ? Electrique, fluide médicaux …?
Interférences entre appareils :
-
Quels types d'interférences ?
-
Quels appareils ?
Risque de l’environnement:
-
Orage, tempête, travaux, eau, neige, grêle...
Y a-t-il des effets non désirés, champ magnétique,
bruit, vibration, courant de fuite …. pour l'environnement ?
Les locaux sont-ils régulièrement entretenus ?
Est-ce que l'évacuation des déchets et le recyclage du
dispositif médical est à prévoir ?
Les allées et venues sont-elles importantes autour du dispositif
médical ?
8.2.4
Interface maintenance / dispositif médical
Type de maintenance:
-
curatif
-
préventif
-
contrôle qualité (vérification des performances)
Type de contrats :
-
Tout risque
-
Partenariat (type du partenariat)
-
Pas de contrat
Lors de l'implantation du dispositif médical est-ce qu'il est
nécessaire d'avoir une installation effectuée par un expert
?
Formation stage ou terrain ?
Existe-t-il une formation continue ?
Existe-t-il une documentation ?
-
En quelle langue ?
-
De quoi est-elle constituée (schéma électrique) ?
Existe-t-il des protocoles ou procédures particuliers ?
-
Existe-t-il des tests de sécurité effectués après
la maintenance ?
-
Existe-t-il des contrôles plus fréquents quand le dispositif
médical vieillit ?
Existe-t-il un suivi de la maintenance ?
-
Fréquence des pannes
-
Importance des pannes
-
Urgence des pannes (comment est-elle estimée ?)
Combien de personnes interviennent sur chaque dispositif médical
? (remplacement lors des vacances, de congés maladie, etc...)
Comment est fait l'approvisionnement et la gestion des pièces
détachées ?
Existe-t-il des équipements de contrôle de mesure et d’essai
(ECME) pour le dispositif médical ?
Existe-t-il un pool de remplacement ? (Même type de dispositif
médical ou dispositif médical ayant la même fonction)
Retour Sommaire
8.3
Définition des défaillances
Il est très difficile de faire l'état
des lieux de tous les cas possibles que peuvent subir l'ensemble d'un système.
L'utilisation d'un arbre d'événement permet de recenser tous
ces états pour ensuite lister les différentes défaillances
du système. Elles seront par la suite, la base de la mise en place
de l'outil d'analyse.
La Figure 22 "Définition des composantes
de l'arbre d'événement" montre les 4 éléments
utilisés pour la mise en place de l'arbre d'événement
ainsi que leur lien, à savoir :
-
L'installation (environnement du dispositif médical)
-
L'exploitant (les équipes médicales et les mainteneurs)
Ce dernier élément de la chaîne
n'entre pas dans l'analyse car elle est uniquement centré sur le
dispositif médical, le service biomédical n'ayant pas d'action
direct sur le patient, il peut seulement agir sur l'installation, le dispositif
médical et les différents exploitants. Cependant la présence
du patient dans la figure rappelle l'importance de l'impact de l'équipement
sur celui-ci.
Figure 22 "Définition
des composantes de l'arbre d'événement"
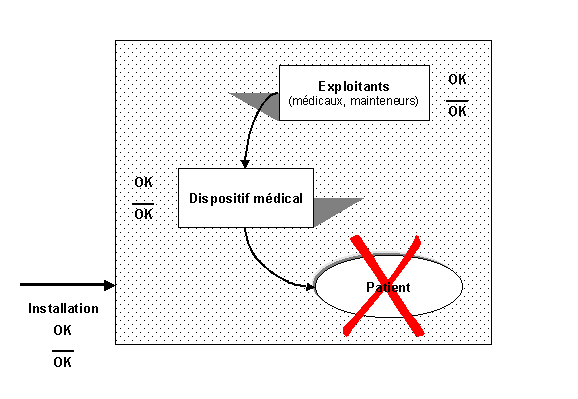
L'arbre d'événement (Figure 23 "arbre
d'événement") permet de définir 8 défaillances
ou probabilité de branche en fonction des trois composants analysés
(installation, dispositif médical et exploitant). Les résultats
de l'arbre montrent 2 sortes de défaillance :
-
Arrêt total
-
Défaut d'exploitation
Retour Sommaire Cependant ces résultats ne prennent pas
en compte le fait que le dispositif médical peut avoir un fonctionnement
dégradé. La perception même du fonctionnement d'un
dispositif se fait à travers celle de l'exploitant. Une mauvaise
connaissance de son outil de travail, un fonctionnement dégradé
(pas 100 % des performances) non détecté sont une source
de risques (de défaillances) qui peuvent avoir une incidence non
négligeable sur l'état et la sécurité du patient.
Pour éviter ce cas de figure, il est primordial de l'intégrer
à la suite de l'analyse. Elle sera basée sur 3 défaillances
génériques (indépendantes de l'équipement étudié)
à savoir :
Cependant ces résultats ne prennent pas
en compte le fait que le dispositif médical peut avoir un fonctionnement
dégradé. La perception même du fonctionnement d'un
dispositif se fait à travers celle de l'exploitant. Une mauvaise
connaissance de son outil de travail, un fonctionnement dégradé
(pas 100 % des performances) non détecté sont une source
de risques (de défaillances) qui peuvent avoir une incidence non
négligeable sur l'état et la sécurité du patient.
Pour éviter ce cas de figure, il est primordial de l'intégrer
à la suite de l'analyse. Elle sera basée sur 3 défaillances
génériques (indépendantes de l'équipement étudié)
à savoir :
-
Arrêt total
-
Défaut d'exploitation
-
Fonctionnement dégradé.
Figure 23 "arbre d'événement"
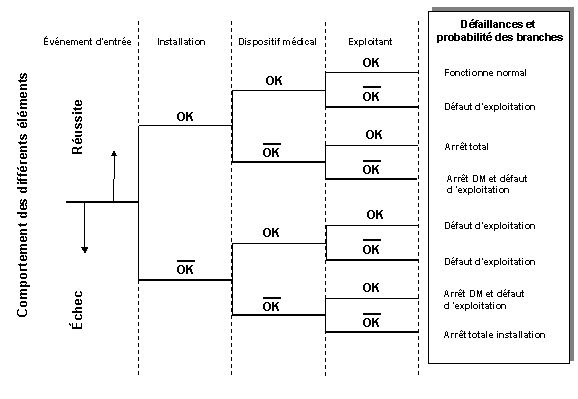
8.4
La définition des causes
8.4.1 Les
causes
Après avoir défini des défaillances
génériques et pour simplifier l'utilisation de l'outil, il
est intéressant de définir des causes là encore génériques
indépendantes du dispositif médical étudié.
L'étude des défaillances et des causes sur un équipement
spécifique (un défibrillateur) en association avec un brainstorming
ont permis l'élaboration d'une liste de causes :
-
Pas de fluide (gaz médicaux, électricité, eau, gaz…)
-
Mauvaise utilisation
-
Pas de procédure (entretien, utilisation)
-
Environnement tierce personne
-
Environnement (électromagnétique, éclairage, réseau
informatique, humidité, climatisation…)
-
Manque de formation, d'information
-
Pas de préventif (maintenance)
-
Mauvaise maîtrise de la sous traitance
-
Déplacement (d'un local à un autre, d'un bâtiment à
un autre…)
-
Insuffisance des secours (groupe électrogène, batteries,
gaz médicaux…)
-
Manque de moyens (humains, financiers et matériels)
-
Pas de documentation utilisateur
-
Pas d'ECME (équipements de contrôle de mesure et d'essai)
-
Pas de contrôle des performances (contrôle qualité)
-
Pas de consommables et / ou accessoires
-
Non respect de la réglementation
Retour Sommaire
8.4.2
Origine des causes
Une fois l'identification des causes effectuée,
il faut pour une future mise en place d'actions, d'optimisation des ressources
connaître ce qui peut les engendrer. Le tableau ci-dessous est le
résultat d'une recherche des origines, du pourquoi des causes génériques
énoncé auparavant. Il est discutable et peut sans aucun problème
être modifié et apprécié selon le contexte et
l'organisation de l'établissement de soins. Il a surtout l'avantage
de mettre en évidence les sources des causes sur lesquelles peut-être
mener des actions correctives et / ou préventives.
|
Environnement
|
Mainteneur
|
Utilisateur
|
Economique
|
| Pas
de fluide |
x
|
|
|
x
|
| Mauvaise
utilisation |
|
|
x
|
|
| Pas
de procédure |
|
x
|
x
|
|
| Environnement
tierce personne |
x
|
|
x
|
|
| Environnement |
x
|
|
|
x
|
| Manque
de formation, d'information |
|
x
|
x
|
|
| Pas
de préventif |
|
x
|
|
|
| Mauvaise
maîtrise de la sous traitance |
|
x
|
|
|
| Déplacement |
x
|
|
x
|
|
| Insuffisance
des secours |
x
|
|
|
x
|
| Manque
de moyens |
|
|
|
x
|
| Pas
de consommables et / ou accessoires |
|
|
|
x
|
| Non
respect de la réglementation |
|
x
|
x
|
|
| Pas
de documentation utilisateur |
|
x
|
x
|
|
| Pas
d'ECME |
|
|
|
x
|
| Pas
de contrôle des performances |
|
x
|
|
|
IX)La
mise en œuvre de l'ACORB
|
Avertissement:
L'Analyse de la Criticité pour l'Optimisation
des Ressources Biomédicales (ACORB) est un outil basé sur
l'AMDEC, il en reprend les principes fondamentaux et y intègre les
spécificités de l'activité biomédicale pour
répondre à l'objectif d'optimisation de la maintenance.
9.1
Introduction
Il est évident que pour entreprendre des actions
correctives de quelques natures que ce soit (maintenance corrective et
préventive, formation, contrôle qualité, mise en place
de procédure, organisation ….), il faut connaître le ou les
problèmes ou tout du moins ce qui peut engendrer des défaillances
ceci dans le seul but d'optimiser les ressources. L'élaboration
de l'ACORB permet de mener à bien ces différentes actions.
Il a pour objectif de quantifier, de détecter les défaillances
afin de reprendre les causes pour comprendre les effets, l'impact direct
ou indirect sur le patient, les exploitants, l'environnement et l'aspect
économique. Le résultat de cette analyse permet de mettre
en évidence les points critiques et de définir des actions
correctives. Cet outil met en avant la question suivante : Sur quelles
points dois-je agir pour diminuer la criticité de tel dispositif
?
9.2
Le calcul de la criticité
L'appréciation de la criticité dans
un établissement de soins engendre différents facteurs. leur
choix est discutable, en contre partie, il reflète une cohérence
et une logique de calcul entraînant un résultat exploitable.
Le calcul se présente de la façon suivante :
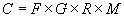
avec
Ce terme est le résultat d'un produit de
4 paramètres. Elle est comprise entre 0 et 1 et peut donc se convertir
en pourcentage.
-
F pour la fréquence ou la probabilité d'apparition d'une
défaillance
Le terme F présente deux nuances distinctes
permettant de l'estimer. La première étant la probabilité
d'apparition et le deuxième étant la fréquence d'apparition.
En effet, la probabilité d'apparition est
une notion qui se mesure par suppositions, par la phrase suivante : "Il
est probable que … "
Par ailleurs, la notion de fréquence d'apparition
ne s'apprécie pas de la même façon puisqu'elle demande
une base d'informations, de l'expérience et du recul. Pour cela,
la GMAO est l’outil indispensable au recueil de l'information. Il est à
la base du partage de celles-ci. Dans les deux cas l'expérience
de la cellule de maintenance biomédicale améliore la qualité
de ces informations.
Ce terme indique la notion de possibilité
de remplacement ou non d'un dispositif médical. Il est vrai que
s'il présente une défaillance mais qu'il y a une possibilité
de remplacement, la criticité intrinsèque de l'appareil en
question ne sera pas modifié, en contre partie la criticité
sur l'état du patient sera elle moins élevé, dans
ce cas R prend le valeur de la fréquence (F). Ceci a pour incidence
la diminution de la criticité. Au contraire, si le remplacement
R n'est pas possible, la valeur est égale à 1 soit, aucune
influence sur le calcul de la criticité.
R est égal à la valeur de F si le remplacement du dispositif
médical est possible
R est égal à 1 si le remplacement du dispositif médical
n'est pas possible.
Elle détermine le niveau de risque occasionné.
Cette notion de gravité dans un établissement de soins peut
être exprimé en fonction du classement des dispositifs médicaux
qui leur sont attribués lors de l'analyse de risque réalisée
lors du marquage CE (soit I, IIa, IIb, III). Pour cela une valeur pour
chacune des différentes classes doit être associée
pour une cohérence et une appréciation des résultats.
Le choix des valeurs associées à la gravité peuvent
se présenter suivant le tableau ci-dessous (la gravité étant
comprise entre 0 et 1). Plusieurs essais de calcul ont permis de déterminer
ces valeurs. Par ailleurs, il est libre de définir une gravité
entre 1 et le minima prédéfini dans le tableau en fonction
de la classe de l'équipement étudié, pour une meilleure
perception de l'état critique de celui-ci suivant son milieu d'utilisation.
Tableau 2
|
|
Gravité minimale pour une classe
|
|
Classe I
|
0.35
|
|
Classe IIa
|
0.55
|
|
Classe IIb
|
0.75
|
|
Classe III
|
0.95
|
M pour la maîtrise de la prestation rendu par le service biomédicale
La maîtrise de la prestation sur un dispositif
médical peut être défini par le fait qu'un des mainteneurs
est formé sur celui-ci, ou qu'un mainteneur formé est en
permanence dans le service utilisateur. La présence ou non d'équipement
de contrôle de mesure et d'essais a également une incidence
sur le facteur M.
Si il y a maîtrise de la prestation rendu,
la valeur de M sera égale à la valeur de la gravité.
Cette valeur ayant une influence directe sur la criticité tout en
conservant la normalisation du calcul.
Dans le cas ou l'on ne maîtrise pas la prestation
(pas de formation, indisponibilité, pas ou peu d'ECME…) la valeur
de M sera de 1 donc aucune influence sur la criticité C.
Retour Sommaire 9.3
Le formulaire d'analyse de l'ACORB
9.3
Le formulaire d'analyse de l'ACORB
9.3.1
Présentation du formulaire
Ce document permet le recueil de toutes les informations
utiles au calcul de la criticité. Il se compose en deux parties
:
La première étant la fiche signalétique du dispositif
médical à savoir,
-
son nom
-
sa marque
-
son type (CEI 601-1) :B, BF, CF
-
sa classe (marquage CE) : I, IIa, IIb, III
Figure 24 "formulaire ACORB"
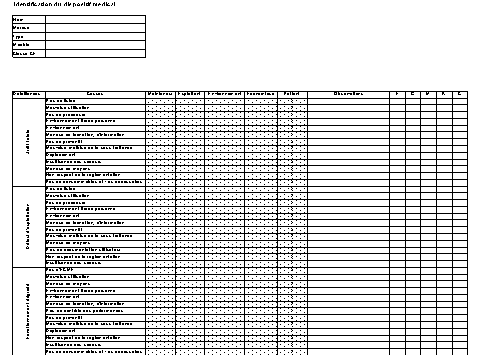
|
X)Comment
utiliser l'ACORB ?
|
10.1
Introduction
L'ACORB est un outil qui demande un travail de groupe
aux différents acteurs, médecins, ingénieurs ou techniciens
biomédicaux et infirmiers. Il se déroule en quatre phases,
dont trois phases d'analyse (formulaire, visualisation), une phase d'optimisation
(actions) et une phase de vérification de l'évolution. Cette
démarche est proche d'une analyse de type PDCA (Plan - Do - Check
- Act), la figure montre l'organisation de ces différentes phases.
Figure 25 "Les quatre étapes
de l'ACORB"
Cet outil peut être utilisé dès
l'arrivée du dispositif médical dans l'établissement,
mais surtout tout au long de son cycle de vie. A l'installation, la mise
en place de l'outil sera plus difficile car l'expérience et la connaissance
du dispositif médical sont réduites. Cependant elle permettra
d'allouer les ressources nécessaires pour minimiser la criticité.
L'utilisation dans les autres cas peut être assimilée à
celui d'un audit "technique" détectant ainsi les différentes
évolutions de la criticité.
Retour Sommaire
10.2
Comment remplir le formulaire ? (phase 1)
La phase 1 de l'ACORB demande la participation
des utilisateurs du dispositif médical ainsi que des ingénieurs
et techniciens biomédicaux. La Figure 26 "Procédure d’utilisation
du formulaire ACORB" montre la procédure qui mène jusqu'au
calcul de la criticité.
Figure 26 "Procédure
d’utilisation du formulaire ACORB"

-
Etape 1 : Choix du dispositif médical
Outre le choix du dispositif médical, elle
intègre la recherche de toutes les informations le concernant comme
la classe CE, le type électrique, la documentation technique et
utilisateur.
-
Etape 2 : Réponse au questionnaire
Elle permet grâce au questionnaire (cf.8.2)
de faire un état des lieux de toutes les interfaces du dispositif
médical. Ce travail demande la participation des utilisateurs et
des mainteneurs. Ils vont définir les causes, les effets et les
améliorations possibles.
En fonction des causes détectées par
l'intermédiaire du questionnaire, la personne en charge du dossier
d'étude choisi les causes qu'elle va exploiter dans le formulaire
ACORB.
-
Etape 3 : Recherche de l'impact
Au regard du questionnaire et des causes détectées,
il faut définir leurs impacts sur l'une ou l'autre des quatre composantes
(patient, exploitant, environnement, économique). Cette étape
doit être là encore réalisée de concert entre
le service biomédical et les soignants.
-
Etape 4 : La fréquence et la gravité
Cette étape est essentielle car elle va
influencer la suite de la procédure. L'évaluation de ces
deux paramètres doit impérativement être réalisée
par un groupe d'expert. L'apport d'un outil informatique comme une GMAO,
assurant l'enregistrement et le traitement des différentes informations
issues des diverses prestations techniques du service biomédical
est une source de données qui facilite le travail.
Lorsque le dispositif médical n'a pas d'historique,
le groupe d'expert doit alors apprécier ces deux paramètres
au regard de leur expérience et du contexte de l'établissement
et ou du service clinique ou médico-technique.
-
La fréquence peut prendre des valeurs comprise entre 0 et 1.
-
La gravité quant à elle ne peut pas passer sous un seuil
minimal fixé au chapitre (9.2) en fonction de la classe CE du dispositif
médical.
-
Etape 5 : Les facteurs maîtrise et remplacement
L'ingénieur biomédical fixe la valeur
de M (maîtrise) et de R (remplacement) en fonction de l'état
des lieux de l'activité biomédicale Ces deux paramètre
demande une bonne connaissance de l'activité. Plusieurs cas de figure
se présentent leur de la définition du niveau de maîtrise
(M). Si le service biomédical n'a pas formalisé ces pratiques
(procédures de contrôle, d'organisation …) et ne peut pas
prouver la réalisation (traçabilité) de son activité,
le paramètre M ne pourra faire l'objet que d'une appréciation
subjective et fonction de la personne qui réalise l'étude.
Dans le cas contraire, la formalisation des pratiques
permet d'apporter des preuves tangibles et de poser un regard objectif
sur l'activité. Cependant, il n'y a pas d'obligation quant à
l'étendu de la maîtrise de l'activité. Lorsque tous
les domaines font l'objet de formalisation, la mise en place d'une démarche
qualité de type ISO devient alors une formalité pour la structure.
-
Etape 6 : Calcul de la criticité
Etape ultime de la procédure, le calcul de la criticité
répond à la formule :
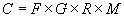
Retour Sommaire
10.3
La visualisation de l'ACORB (phase 2)
Lorsque le tableau est complété
et le calcul de la criticité effectuée. L'exploitation du
formulaire requière l'élaboration d'un graphique. La présentation
sous cette forme permet de se faire une idée plus précise
des points que l'on doit améliorer.
Le principe consiste à regrouper les 4 grandes
familles d'effets (mainteneur, utilisateur, environnement, économique)
sur le même graphique.
L'axe X (compris entre 0 et 1) est fonction de la
fréquence alors que l'axe Y (compris entre 0 et 1) est fonction
de la gravité.
La criticité est représentée
par le diamètre du cercle. Afin de visualiser tous les paramètres
du calcul de la criticité, les valeurs de M et de R sont placées
près de cible ACORB. Donc, plus le diamètre du cercle (sa
surface) est important plus la criticité est forte.
La figure suivante présente la forme du graphique.
La zone en gris représente la zone limite dans laquelle doit se
trouver l'ensemble des centres des différentes cibles ACORB car
la gravité comme la fréquence ne peuvent pas être supérieures
à 1.
L'élaboration de ce graphique est réalisable
à partir d'un tableur de type EXCEL afin de faciliter le travail
de représentation.
Figure 27 "Exemple de visualisation"
Retour Sommaire
10.4
Optimisation des ressources (phase 3)
L'objectif est de faire diminuer la surface des différents
cercles donc la criticité en jouant sur la fréquence, la
maîtrise de la prestation et le remplacement du dispositif médical.
Le choix des cibles qui seront traitées pour réduire la criticité
(par des actions correctives ou préventive) se fait en fonction
de sa position sur le graphique.
10.4.1
La définition des zones critiques
Trois zones (Figure 28 "Les zones à risque) peuvent
être définies.
-
La zone 1 correspond à une aire où la criticité existe
encore mais où la fréquence et la gravité restent
faible. Elle peut être considérée comme une zone "à
risque faible".
-
La zone 2 correspond à une aire ou la criticité augmente
mais reste "acceptable".
-
La zone 3, quant à elle, correspond à une aire ou la criticité
est inacceptable et ou il faut intervenir pour la réduire.
Figure 28 "Les zones à
risque"
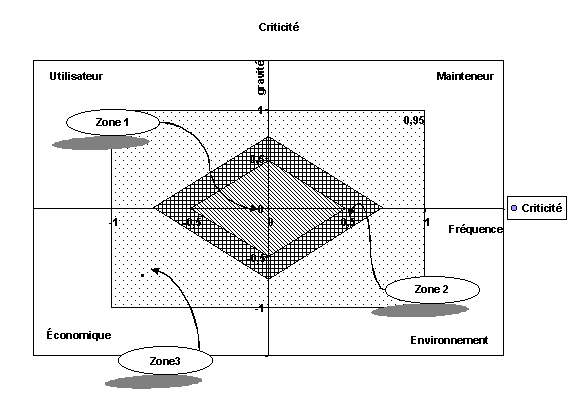
La distinction de ces trois zones est essentielle
car elle va permettre l'optimisation des ressources du service biomédical.
En effet, pourquoi porter les efforts de maintenance préventive,
de formations des utilisateurs sur des dispositifs médicaux dont
la criticité est faible. Certes, il ne faut pas abandonner toutes
prestations sinon il n'y aura plus de réelle maîtrise de l'activité
biomédical.
La définition des zones à risque influence
la suite de l'étude. Les figures 28 et 29 montrent deux types de
zone ayant les mêmes limites pour ce qui est de la fréquence
et de la gravité :
Tableau 3
Limite fréquence et gravité
|
Criticité
|
< 0,5
|
faible
|
< 0,5 et 0,75
|
acceptable
|
0,75
|
inacceptable
|
Retour Sommaire Figure 29 "zones à
risque contraignant"
Figure 29 "zones à
risque contraignant"
Pour un même exemple de cible ACORB, la figure
29 défini la cible comme étant située dans une zone
où la criticité est faible alors que dans la figure 28 la
cible se situe dans la zone où la criticité est acceptable.
Figure 30 "zones à
risque moins exigeant"
 Le choix des limites et de la forme des aires ont un
impact sur les règles qui vont permettre le choix des points à
améliorer. L'aire en forme de losange est plus contraignante que
la forme rectangulaire. Il est donc préférable dans un premier
temps de définir des limites et une aire moins exigeantes puis au
fur et à mesure de l'utilisation de l'outil les faire évoluer
vers des exigences de plus en plus strictes.
Retour Sommaire
Le choix des limites et de la forme des aires ont un
impact sur les règles qui vont permettre le choix des points à
améliorer. L'aire en forme de losange est plus contraignante que
la forme rectangulaire. Il est donc préférable dans un premier
temps de définir des limites et une aire moins exigeantes puis au
fur et à mesure de l'utilisation de l'outil les faire évoluer
vers des exigences de plus en plus strictes.
Retour Sommaire
10.4.2
La stratégie de choix des actions
Avant de définir plus précisément
la manière de choisir les cibles ACORB à analyser pour minimiser
la criticité, il est intéressant de faire un parallèle
entre le risque et la qualité. Le risque est une fonction décroissante
de la qualité. La Figure 31 "risque et qualité" montre
une représentation graphique de cette fonction. Plusieurs remarques
sont à faire sur ce graphique, le risque comme la qualité
sont asymptotique, l'un comme l'autre ne peuvent être égale
à zéro. L'observation 1 montre qu'il y a un seuil d'irresponsabilité
c'est à dire un seuil où la qualité devient inacceptable
ce qui a pour conséquence une valeur de risque très importante.
L'observation 2 peut lui aussi tendre vers zéro mais comme la qualité
il ne pourra jamais donner sous un seuil où le risque est incompressible.
Il correspond à un haut niveau très haut de qualité.
Cette zone est liée au fait que l'utilisation d'un équipement
malgré la gestion des risques et des actions qualité entraînera
toujours des impondérables.
Figure 31 "risque et qualité"
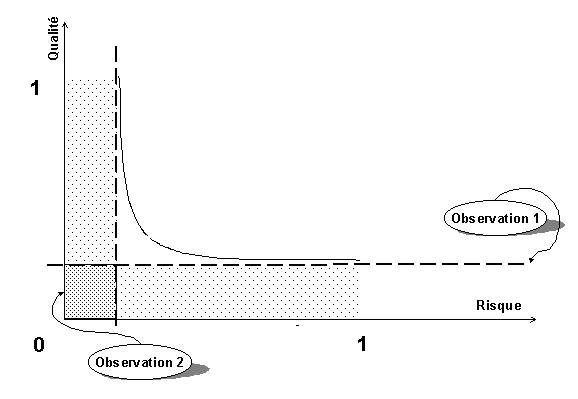
Dans le cadre de l'analyse ACORB, il est possible
de faire un parallèle avec ce qui a été énoncé
ci avant. Les deux grandeurs "fréquence" et "gravité" vont
répondre elles aussi à une fonction asymptotique. Le chapitre
9.2 défini la zone de risque incompressible. Pour rappel cette valeur
est fonction de la classe CE du dispositif médical étudié.
La Figure 32 montre cette limite (observation 1) sous laquelle la gravité
ne peut descendre, il en est de même pour la fréquence (observation
2). La cible ACORB évoluera dans ces limites.
La réduction de la criticité se fait grâce à
des actions sur 2 paramètres (observation 3) à savoir :
-
Le facteur "M"
-
Le facteur "R"
-
La fréquence
La gravité va quant à elle évoluer avec les résultats
des différentes actions sur les autre paramètres.
Figure 32 "les limites incompressibles"
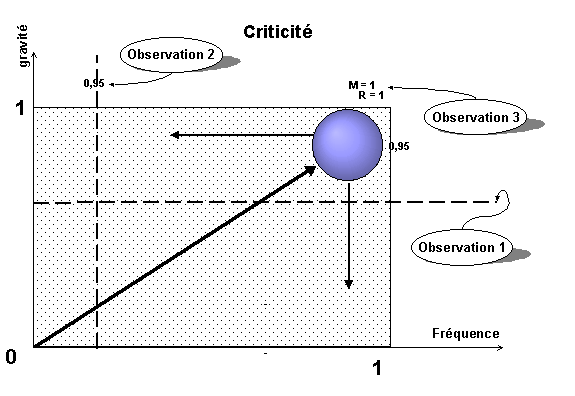
Il est donc important de traiter les cibles ACORB
qui sont les plus éloignées des limites minimales de fréquence
et gravité, sachant qu'au fur et à mesure de l'utilisation
de l'outil, il faudra modifier les différentes zones de risque.
Des modifications pourront être faites sur les limites de la gravité
et de la fréquence en fonction de nouvelles évolutions techniques
du dispositif médical.
Retour Sommaire
10.4.3
Ce sur quoi on peut agir ?
Il est possible de jouer sur plusieurs domaines
pour faire évoluer les différents paramètres de la
criticité comme :
-
L'environnement
-
Les utilisateurs
-
L'activité biomédical
-
L'économique
Les utilisateurs et l'activité biomédical
sont les deux domaines que l'on peut faire évoluer sans trop de
problème et ce malgré le fait que ces deux domaines soient
liés à des activités humaines. Alors que les aspects
économiques et environnementaux sont plus difficiles à effectuer
car ils vont demander la mise en place de moyens qui peuvent être
considérables.
4 voies d'améliorations peuvent être utilisés
à savoir :
-
L'utilisation par la formation des soignants dès la mise en place
d'un nouveau dispositif médical dans le service mais surtout régulièrement
(et à sa demande) pour minimiser l'impact de la rotation du personnel
(surtout dans les CHU) et la perte de connaissance lorsque le dispositif
n'est pas souvent utiliser.
-
L'entretien passe lui aussi par la formation des utilisateurs à
la mise en service et après.
-
L'information des utilisateurs, c'est mettre à leur disposition
la documentation peut-être technique mais surtout utilisateur. La
mise en place des procédures simples pour l'utilisation, l'entretien,
l'attitude à adopter pour faire face à un incident ou pour
détecter une anomalie sur le dispositif..
-
C'est aussi la connaissance des performances du dispositif.
Le suivi des évolutions technologiques et
réglementaires demandent une attention de tous les instants et sont
deux sources de modification de l'activité biomédicale.
Au niveau de l'organisation de l'activité,
les possibilités d'actions sont variées. Il est possible
d'agir sur :
-
La maîtrise de la sous-traitance par une meilleur suivi des contrats,
des prestations, de l'achat des pièces détachées,
des consommables
-
La formation des techniciens biomédicaux
-
Par la mise en place de procédures de maintenance préventives,
curatives et de contrôle qualité
-
La maîtrise de la base documentaire utilisateur et technique
-
L'acquisition de matériels de contrôle, de mesure et d'essai
La certification ou la mise en place d'une démarche
qualité de l'activité biomédical permet d'assurer
une maîtrise bornée par des exigences de type ISO.
-
L'environnement et l'économie
L'aménagement de l'environnement du dispositif
médical demande la mobilisation de moyens financiers importants
surtout lorsque des erreurs de conception se sont glissées dès
l'étude. Il peut être amélioré par l'écoute
de l'expérience et des connaissances des l'utilisateurs. Ces différents
paramètres peuvent être intégré dès la
conception des locaux. L'intégration de nouveau dispositifs médicaux
dans des locaux déjà existant pose d'autres problèmes
comme ceux liés à la climatisation des locaux, à l'alimentation
en fluide. En exploitation, il faut s'assurer de la maîtrise de tous
les paramètres d'alimentation du dispositif comme les secours électriques.
Les aspects économiques viennent en parallèle
à tous ces points. Les budgets, les moyens humains, matériels,
organisationnels sont de plus en plus difficiles à obtenir. Il faut
donc les justifier en démontrant leur impact sur la sécurité
des patients mais aussi sur le coût d'une plainte déposée
par un patients suite à un problème lors de son séjour
dans l'établissement.
Retour Sommaire
10.4.4
La gestion des actions à mener
Lorsque la cible ACORB est sélectionnée,
la suite de l'étude demande la mise en œuvre d'une procédure
de résolution de problème. La Figure 33 Procédure
de traitement des actions à mener montre les différentes
étapes à suivre.
Cette phase se doit être réalisé
en groupe ce qui permettra de trouver la solution la plus adaptée.
Le travail de groupe permet une plus grande créativité. Pour
ce faire, il est intéressant d'utiliser des outils qualité.
Le tableau ci après défini pour les quatre phases (problème,
cause, solution, action) les outils les plus adaptés.
Tableau 4
|
Outils
|
Problème
|
Causes
|
Solution
|
Action
|
| Remue méninges |
l |
l |
l |
|
| Fiche d'acquisition de données |
m |
l |
|
l |
| Vote simple |
l |
m |
m |
|
| Vote pondéré |
l |
m |
|
|
| Graphiques |
|
|
|
l |
| QQOQCP |
|
l |
|
l |
| Diagramme cause effet |
|
l |
|
m |
| Diagramme de Pareto |
m |
l |
|
m |
| Rapport de projet |
|
|
l |
l |
m Utilisable
l recommandé
La procédure de résolution de problème,
ici de recherche de solution en vue de l'amélioration de la criticité
d'un dispositif, ce déroule en 3 phases.
Connaître les causes
Elle conditionne toute la suite de la résolution
du problème. La compréhension du problème demande
un travail de documentation et de recherche de toutes les informations
le caractérisant.
Trois cas de figure sont possibles :
-
Le groupe connaît sans ambiguïté les causes
-
Le groupe pense connaître les causes cependant il faut vérifier
que ce sont les bonnes
-
Le groupe n'a pas d'idées alors il faut se lancer dans une étape
d'investigation (recueil des faits et indices par identification)
L'identification permet la recherche de toutes
les causes possibles (documentation et hiérarchisation). Lors de
cette étape, il est indispensable de faire l'état des lieux
de toutes les causes secondaires afin de verrouiller le problème.
Figure 33 "Procédure
de traitement des actions à mener"
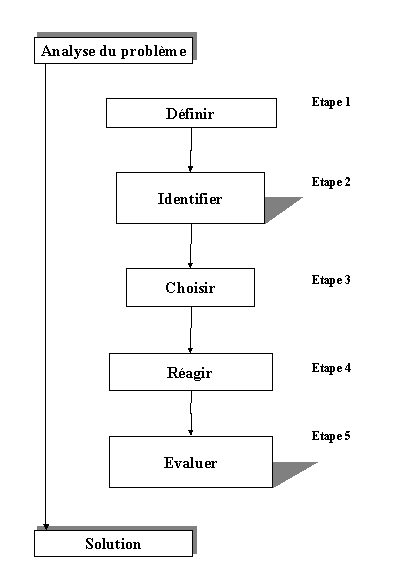
Trouver la solution
Elle passe par 2 sous étapes. La première
consiste à la recherche de toutes les solutions possibles. La créativité,
l'esprit libre évite de trouver un seul et unique solution, pour
ce faire, l'utilisation d'outils qualité comme le remue méninges
pousse les participants à énoncer de multiples idées.
Cependant rien n'empêche le groupe de faire appel à un expert.
La seconde abouti au choix de la solution parmi toutes
les solutions proposées. Lorsque l'action à mettre en œuvre
pour répondre à cette solution demande des moyens financiers,
matériels, humains, l'élaboration d'un dossier la justifiant
(l'enjeu, la planification, les coûts) doit être réalisé
afin que la direction puisse prendre une décision quant à
son application.
La mise en place de la solution doit amener à
définir le plan d'action pour la mise en œuvre de la solution :
-
Quand doit-on le faire ?
-
Qui le fait ?
-
Comment ?
-
…
-
Etape 5
Etape ultime, la mesure de l'efficacité
montre la pertinence de la solution mise en œuvre. Cette étape est
essentielle lorsque l'on met en place une démarche qualité
car elle concourt à son amélioration.
Retour Sommaire
10.5
La vérification (phase 4)
Cette phase s'appréciera de plusieurs manières
et demandera un certain délai pour que le contrôle soit efficace.
Par ailleurs, l’effet de l’action corrective sera ressenti directement
par le service de maintenance (moins d'intervention, moins de casse…).
Toutes ces informations sont disponibles à la consultation sur une
GMAO. Pour confirmer les résultats des actions, il est bon de refaire
l'ACORB.
Ce travail s’inscrit dans un contexte où le
risque prend une place de plus en plus importante. La pression des patients
qui ne veulent plus subir les effets secondaires indésirables de
l’activité médicale, ainsi que l’accroissement des contraintes
réglementaires nationales et européennes concourent à
une prise de conscience du risque au niveau des établissement de
santé. Elle était déjà sous jacente avec la
mise en place des obligations de vigilance (matério, hémato,
pharmaco). Au niveau financier, le risque a un coût que l’on commence
à percevoir au travers des indemnités versées à
la suite d’incident lié à l’activité de soins.
Dans le contexte, le service biomédical se
doit d’agir et d’apporter son concourt à la prise de conscience
du risque à l’hôpital. L’outil ACORB (Analyse de la Criticité
par l’Optimisation des Ressources Biomédicales) est une approche
possible de l’analyse de risque liée à l’activité
du service biomédical. Dans le cadre de démarche de type
ISO, la formalisation de l’activité demande l’utilisation d’un nouvel
outil de suivi. L’association de la criticité et l’optimisation
des ressources (humaines, matériels et financières) permet
à la fois de maîtriser le risque lié aux dispositifs
médicaux et maîtriser la politique de maintenance.
L’outil ACORB est aujourd’hui à l’état
d’embryon. Il se doit d’être expérimenté et confronté
à la réalité du terrain afin de le faire évoluer.
Cependant il permet d’ors et déjà de se familiariser avec
les différents outils d’analyse de risque et de mettre en place
une véritable politique de gestion des risques.
Retour Sommaire
-
ACORB : Analyse de la Criticité pour l'Optimisation
des Ressources Biomédicales.
-
AMDEC : Analyse des Modes de Défaillance,
de leurs Effets et de leur Criticité.
-
AMDE : Analyse des Modes de Défaillances
et de leurs Effets.
-
ANAES : Agence National d’Accréditation
et d’Evaluation en Santé.
-
APR : Analyse Préliminaire du Risque.
-
Criticité : D'après le micro Robert, vient de l'adjectif
critique signifiant : Se trouver dans une situation critique ðdangereux,
grave.
-
Défaillance : Altération ou cessation de l'aptitude
d'un bien à accomplir la fonction requise.
-
ECRI : Emergency Care Research Institute.
-
GBEA : Guide de Bonnes Exécutions des
Analyses
de laboratoire.
-
Gestion des risques : Processus continu, coordonné et intégré
à l'ensemble d'une organisation qui permet l'identification, l'analyse,
et la maîtrise des dysfonctionnements qui ont causé ou auraient
pu causer des dommages à un patient, à un visiteur, à
un membre du personnel, aux biens de ceux-ci ou à ceux de l'établissement.
-
GMAO : Gestion de Maintenance Assisté
par Ordinateur.
-
IEC : International Electrotechnical Commission.
-
ISO : International Organization for Standardization.
-
JCAHO : Joint Commission of Accreditation of
Healthcare
Organization.
-
QQOQCP : Qui ?, Quoi ?, Où ?, Quand
?, Comment ?, Pourquoi ?
-
MTBF : Mean Time Between Failures ou
moyenne des temps entre deux défaillances.
-
MTTF : Mean Time To Failure ou moyenne
des temps de bon fonctionnement.
-
MTTR : Mean Time To Repair.
-
SHAM : Société Hospitalière d'Assurance
Mutuelle.
-
Risque : au sens épidémiologique, le risque est la
probabilité de survenue d'un problème défini, au sein
d'une population déterminée située dans un environnement
dangereux, pendant une période donnée.
Retour Sommaire
Livres
"Les outils de la qualité"
"La maintenance, Mathématique et méthodes"
-
J. BESSIS (préface d'Haroun Tazieff)
"La probabilité et l'évaluation des risques".
-
Le document sur la gestion des risques de la SHAM (Société
Hospitalière
d'Assurance Mutuelles)
74 rue Louis BLANC 69456 LYON Cedex 06
Tél : 04.72.75.50.25 Fax : 04.72.74.22.32
AMDEC/AMDE/AEEL
"L'essentiel de la méthode" Hervé GARIN
-
Pierre ANHOURY et Gérard VIENS
"Gérer la qualité et les risques à l'hôpital"
-
J.RIAUT CETIM (Centre Technique des Industries
Mécaniques)
"Guide de l'AMDEC Machine"
"Pratique de la maintenance industrielle"
Méthodes - Outils - Application
-
Alain Michel CHAUVEL (Dunod)
Qualité méthodes et outils pour résoudre un problème
30 outils pour améliorer la qualité de votre organisation
Articles
-
TH N & deg;591 Décembre 1994
-
Revue Hospitalière de France N & deg;3 mai-juin 1997
-
Journal of Clinical Engineering - Novembre/Décembre 1991
-
Journal of Clinical Engineering - Janvier/Février 1992
-
Revue Hospitalière de France - N & deg;3 -Mai - Juin 1997
-
Qualité et espace Mr Portalis et Mr Morin de Logicom Programme d'armement
M51 1998
Normes et textes réglementaires
-
Directive européenne 93/42/CEE du 14 juin 1993
-
ISO/CD N° 14971 du 21-05-1998 "COMMITTEE DRAFT"
Référence ISO/TC.210/SC N116
EN1441 : "Dispositifs médicaux, analyse des risques" Oct97
Retour Sommaire
1 Introduction
Chapitre 1
2
Les risques et le monde médical
2.1 Introduction
2.2 Le risque à l’hôpital
2.3 Les événements
indésirables
2.4 Les évolutions
réglementaires
2.4.1 La sécurité
sanitaire
2.4.2
Analyse de risques et le marquage CE
2.4.3 La norme EN 1441
2.4.4
Le projet de norme sur la gestion des risques
2.5 La matériovigilance
3
La qualité et la gestion des risques
3.1 La qualité
3.2 La gestion des risques
4 Description
des outils
4.1 Introduction
4.2 La probabilité
4.3 Fiabilité
4.4 Analyse qualitative
de la fiabilité
4.4.1 Analyse
par arbre de défaillances
4.4.2
Principales méthodes d'analyse qualitative
4.4.3
Analyse des défaillances
4.5 Analyse quantitative
de la fiabilité
4.5.1 Analyse
de criticité.(AMDEC)
4.5.1.1 La méthodologie
4.5.1.2
La définition de la gravité et de la probabilité
4.5.1.3 Le calcul
de la criticité
4.5.1.4 Tableau utilisé
en AMDEC
4.5.2 Analyse
par arbres d'événements
4.6 D'autres
outils utilisés par les industriels
4.6.1 APR (Analyse Préliminaire
des Risques)
4.6.2 La méthode Méride
4.6.3 Les outils qualité
Chapitre 2
5
Le contexte de l'activité biomédicale
6 Le
contexte hospitalier
6.1 Un retour d’expérience
6.2 Les interfaces
d'un dispositif médical
6.2.1 L'interface dispositif
médical - patient (interface 1)
6.2.2 L'interface soignant
- dispositif médical (interface 2)
6.2.3 L'interface
environnements - dispositif médical (interface 3)
6.2.4 L'interface mainteneur
- dispositif médical (interface 4)
6.2.5 L'interface tiers
- dispositif médical (interface 5)
6.2.6 L'interface
constructeur - dispositif médical (interface 6)
6.3 Les différents
états
du dispositif médical dans un service de soins
6.4 Le cycle des performances
7 Le
rôle et ressources du service biomédical
7.1 Le rôle
7.2 Les ressources
8
Analyse fonctionnelle d’un dispositif médical
8.1 introduction
8.1.1 Ce
qui peut engendrer des dysfonctionnements.
8.1.2 Comment minimiser
les risques ?
8.2 Questionnaire d’analyse sur les
dispositifs médicaux installés
8.2.1 Le dispositif médical
8.2.2 Interface
utilisateur / appareil
8.2.3 Interface environnement
/ dispositif médical
8.2.4 Interface
maintenance / dispositif médical
8.3 Définition
des défaillances
8.4 La définition des causes
8.4.1 Les causes
8.4.2 Origine des causes
9 La
mise en œuvre de l'ACORB
9.1 Introduction
9.2 Le calcul de la criticité
9.3 Le formulaire d'analyse
de l'ACORB
9.3.1 Présentation
du formulaire
10 Comment
utiliser l'ACORB ?
10.1 Introduction
10.2 Comment remplir le
formulaire ? (phase 1)
10.3 La visualisation de l'ACORB
(phase 2)
10.4 optimisation des ressources
(phase 3)
10.4.1
La définition des zones critiques
10.4.2 La stratégie
de choix des actions
10.4.3 Ce sur quoi
on peut agir ?
10.4.4 La gestion
des actions a mener
10.5 LA VERIFICATION (phase 4)
Conclusion
Glossaire
Bibliographie
Retour Sommaire
Figure 1 "La vigilance à l'hôpital"
Figure 2 "L'environnement réglementaire
du marquage CE"
Figure 3 "Procédure de réduction
des risques"
Figure 4 "Principe de la matériovigilance"
Figure 5 "Les différentes influences
de l'achat à la réforme"
Figure 6 "La gestion des risques"
Figure 7 "Le dispositif médical"
Figure 8 "Courbe en baignoire"
Figure 9 "La défiabilité"
Figure 10 "Méthodologie de
l'AMDE"
Figure 11 "Analyse des défaillances"
Figure 12 "AMDEC: lien causes et effets"
Figure 13 "Les deux types d'AMDEC
dans l'industrie"
Figure 14 "Méthodologie de
l'AMDEC"
Figure 15 "Le contexte de l'activité
biomédicale"
Figure 16 "La bête à
cornes"
Figure 17 "Le contexte hospitalier"
Figure 18 "Le cycle de vie du dispositif
médical"
Figure 19 "Evaluation des performances
du Dispositif médical seul"
Figure 20 "Evolution des performances
d'un dispositif médical dans son environnement"
Figure 21 "Les moyens du service biomédical"
Figure 22 "Définition des composantes
de l'arbre d'événement"
Figure 23 "Arbre d'événement"
Figure 24 "Formulaire ACORB"
Figure 25 "Les quatre étapes
de l'ACORB"
Figure 26 "Procédure d’utilisation
du formulaire ACORB"
Figure 27 "Exemple de visualisation"
Figure 28 "Les zones à risque"
Figure 29 "Zones à risque contraignant"
Figure 30 "Zones à risque moins
exigeant"
Figure 31 "Risque et qualité"
Figure 32 "Les limites incompressibles"
Figure 33 "Procédure de traitement
des actions à mener"
Retour Sommaire





![]() (n étant le nombre
d'expériences)
(n étant le nombre
d'expériences)

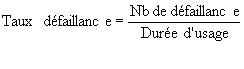














![]()


![]()




