|
Avertissement
|
|
Si vous arrivez directement sur cette
page sachez que ce travail est un rapport
d'étudiant(e)s et doit être pris comme tel. Il
peut donc comporter des imperfections ou des
imprécisions que le lecteur doit admettre et donc
supporter. Il a été réalisé lors
de la période d'enseignement théorique
à l'UTC
et constitue avant-tout un travail de compilation
bibliographique, d'initiation et d'analyse sur des
thématiques associées aux technologies
biomédicales.
Nous ne faisons aucun
usage commercial et la duplication est libre. Si vous avez
des raisons de contester ce droit d'usage, merci
de nous en faire
part.
L'objectif de la présentation sur le Web est de
permettre l'accès à l'information et
d'augmenter ainsi les échanges professionnels. En cas
d'usage du document, n'oubliez pas de le citer comme source
bibliographique. Bonne lecture...
|
|
Réference à rappeler
:
Les Laboratoires : Qualification du
matériel et implication des ingénieurs
biomédicaux, N.Aupetit, K.Vacher Projet DESS,
UTC, 1999, pp ,
URL :
https://www.utc.fr/~farges/dess/1999/Projets/HTBM/HTBM.htm
|
Les laboratoires
:
Qualification du matériel
et
Implication des Ingénieurs
biomédicaux
|

|

|
|
Nathalie AUPETIT
|
Karine VACHER
|
REMERCIEMENTS
Nous souhaitons tout
d'abord adresser nos remerciements à Monsieur G. CHEVALLIER,
responsable du DESS et de notre projet, pour nous avoir suivi tout au
long de notre étude.
Nos remerciements vont
également à tous les membres du groupe de travail de
l'AP-HP : Mesdames CHAPELON, CLESSE, GRANGUILLAUME et Messieurs
FOUILLET, JAFFARD, MOUTY et VIOTTY. et tous les responsables de
service des laboratoires de l'ETS AP-HP : R. Debré,
Lariboisière, Bicètre, Broussais, A. Beclère,
Avicenne, Bichat, Trousseau, Pitié-Salpétrière,
Tenon et P. Brousse qui ont eu la gentillesse de répondre
à notre questionnaire.
Nous tenons
également à remercier toutes les ingénieurs
biomédicaux et les membres de leur service des
différents établissements hospitaliers qui nous ont
permis d'élaborer une grande partie de ce projet : Mesdames
BRUNEVAL, DEMAIRE, THEOLIER, PICOT et Messieurs TOUROUDE, N.GUYEN,
GUIZIER, MARECHAL, MARCHAND, PEMOIGNON, GARCIA, DARIANNE, THEVENET,
DURAND, DEMAINY, GAYON, LEVER, GIGONNET, LERAT, VALLET, SLUPECKI,
HUMBLOT, SICARD, GROSS, DURAND-GASSELIN, HOURS, CASTER, ANCELLIN, Le
LAY, TRIQUET, MARGAS, MARGUET, TALEC, BELLONE, MASSIOT et
CAVANIHAC.
INTRODUCTION
I- LES
LABORATOIRES
I-1 : Présentation
I-1.1 : Situation
et rôle dans l'hôpital
I-1.2 : Le
personnel de laboratoire
I-1.3 : Les
différents types de laboratoire
I-1.4 : Cycle
de vie de l'acte biologique
I-2 : Le
GBEA
I-2.1 : Présentation
générale
I-2.2 : Introduction
I.2.3 : Fonctionnement
I-2.4 :
Exécution des analyses
I-2.5 : Recherche
biomédicale
I-2.6 :
L'assurance qualité
I-2.7 : Archivage
I-2.8 : Implication
II- QUALIFICATION
DU MATERIEL DE LABORATOIRE
II-1 : Mise
en place d'un protocole
II-1.1 :Définition
de la qualification du matériel
II-1.2 : La
démarche
II-1.3 : Les
paramètres critiques
II-2 : Application
à L'ETS AP-HP
II-2.1 : Présentation
de L'ETS
II-2.2 : Le
matériel en transfusion
II-2.3 : Procédure
de vie d'un matériel
II-2.4 :
Audit interne
II-2.5 : La
qualification en transfusion sans assistance
biomédicale
II-3 : Conclusion
III-
L'INGENIEUR
BIOMEDICAL ET LES LABORATOIRES
III-1 : Le
pourquoi et le comment d'une enquête
III-2 : Analyse
de l'enquête nationale auprès des établissements
de soins publics
III-3 : Conclusion
CONCLUSION
GLOSSAIRE
ABREVIATIONS
BIBLIOGRAPHIE
ANNEXES
L'actuelle politique de santé pousse les
établissements hospitaliers à entreprendre une
démarche qualité. Cette politique doit être
applicable à tous les services de soins, sans oublier les
laboratoires d'analyses qui jusqu'alors avaient été
délaissés. Leur place devient d'autant plus importante
qu'une partie de la qualité des soins dépend de la
qualité des résultats biologiques.
La mise en place du Guide des Bonnes Exécutions d'Analyse
(GBEA, arrêté du 2 novembre1994), assimilable à
une norme d'assurance qualité spécifiquement
conçue pour les laboratoires d'analyses médicales,
publics ou privés, entraîne des changements culturels et
des difficultés organisationnelles. Il est d'autant plus
difficile qu'elle nécessite des compétences
particulières seulement détenues par l'ingénieur
biomédical. L'implication de celui-ci est donc envisageable
sachant qu'il devra faire face à un secteur particulier,
mettant en avant une discipline pointue qui est la biologie
L'étude suivante débutera par une
présentation du monde biologique et du GBEA.
La qualité passe, entre autre, par la qualification du
matériel de laboratoire qui ne peut être
effectuée que dans des conditions optimales, par un personnel
compétent. La mise en place de la qualification sera
présentée en seconde partie au sein de l'Etablissement
de Transfusion Sanguine Assistance Publique des Hôpitaux de
Paris.
Suite à cet exemple, l'implication des ingénieurs
biomédicaux a été étudiée à
travers une enquête nationale auprès des
établissements hospitaliers publics. Elle a pour but
d'analyser l'état actuel de la collaboration du service
biomédical et des laboratoires et d'apporter à travers
ce constat, des solutions.
SOMMAIRE
|
I. LES
LABORATOIRES AU SEIN D'UN HOPITAL
|
I.1. Présentation
I.1.1.
Situation et rôle dans l'hôpital
Bien souvent à l'écart des services
d'hospitalisation le laboratoire, assure une aide au diagnostic non
négligeable. Il peut être laboratoire de recherche ou
laboratoire d'analyses biologiques.
L'analyse biologique est divisée en secteurs (biochimie,
hématologieÖ) qui sont répartis dans des
unités distinctes. Cette répartition se fait selon les
responsables de service, le directeur de l'établissement, la
taille et l'activité de l'établissement.
Son rôle dans la détermination d'un traitement
adapté au patient oblige certaines unités
(hématologie, hémostase, biochimie, transfusion
sanguine, microbiologie) a être de garde 24h /24 pour une
action rapide, voire vitale. Cette obligation peut se gérer en
effectuant un regroupement de ces activités dans un
laboratoire de garde qui focalisera son activité sur l'urgence
(Liquide-céphalo-rachidien, hémoculture, groupe
sanguin, numération formule sanguineÖ). La
détermination de l'urgence étant difficile à
évaluer dans certaines situations, ces laboratoires peuvent
être confrontés à une sur-activité
disproportionnée par rapport au dimension du laboratoire et
par rapport au personnel présent.
Par sa situation géographique au sein de l'hôpital,
le personnel de laboratoire peut avoir tendance à assimiler le
patient à un prélèvement et perd donc la notion
d'être vivant. Cette attitude se rencontre le plus souvent lors
d'une forte activité, mais elle est aussi le fruit de la
formation d'un personnel loin des patients et du rôle initial
de l'analyse biologique.
(retour sommaire)
I.1.2. Le
personnel de laboratoire
Le personnel au sein des laboratoires est très
diversifié. Cette diversification dépend de
l'activité du laboratoire, des besoins et des fiches de
postes.
On y rencontre de six à sept catégories
professionnelles :
Ø Les agents
hospitaliers :
Formation : aucune formation n'est
requise, si ce n'est de savoir lire et écrire.
Rôle : entretien des
laboratoires, réception et enregistrement des
prélèvements...
Ø Les aides
soignants :
Formation : niveau
3ème + concours d'accès + certificat
d'aptitude à la fonction d'aide (CAFA = 1
année).
Rôle : entretien des
laboratoires, réception et enregistrement des
prélèvements, secrétariat, aide
laboratoire...
Ø
Les infirmières :
Formation : baccalauréat + concours d'accès +
diplôme d'état d'infirmière (IDE = 3
années).
Rôle : l'infirmière n'apparaît que dans
certaines activités du laboratoire : le
prélèvement sanguin, la ponction de moelle, la
thérapie cellulaire,
le don de
produits sanguins ; et que dans un certain type de laboratoire :
l'hématologie, l'hémostase, la transfusion
sanguine.
Ø Les
techniciens :
Formation : baccalauréat + concours d'accès +
diplôme d'état de laboratoire en analyses
médicales (DELAM = 3 années), ou BTS ou DUT d'analyses
biologiques.
Rôle : assume toute la partie analytique du laboratoire, la
maintenance de premier niveau des matériels, les
contrôles qualité, le prélèvement sanguin
et toute la logistique associée à l'analyse...
Ø Les
surveillants de laboratoire :
Formation : techniciens ou infirmières + concours
d'accès + école des cadres (durée =1
année).
Rôle : encadrement du personnel paramédical,
logistique de tout le laboratoire...
Ø Les
médecins biologistes :
Formation : baccalauréat série scientifique +
spécialisation en biologie (5 années de
généraliste + 3 années de
spécialisation).
Rôle : assume la partie biologique de l'analyse
(interprétation des résultats, signature des
résultats, transmission), les contrôles qualités
et le suivi de la bonne marche du laboratoire au niveau
biologique...
Il peut aussi assumer une fonction d'encadrement en devenant
responsable de service.
Ø Le
secrétariat :
Il joue un rôle important dans la bonne marche du
laboratoire puisqu'il est très souvent le lien entre
toutes les unités et les services de soins.
(retour sommaire)
(retour paragraphe)
I.1.3Les
différents types de laboratoire
Ø Anatomo-pathologie : Etudie les
altérations matérielles des organismes
déterminées par l'état de maladie.
Il faut distinguer l'anatomie pathologique macroscopique,
étude au cours d'une autopsie ou sur une pièce
d'exérèse chirurgicale, et l'anatomie pathologique
microscopique, étude d'un tissu au microscope, après
diverses techniques de coupe et de coloration.
Ø Biochimie : Elle comporte : - l'étude
de la composition des substances formant les cellules, tissus,
organes, humeurs;
- l'étude des réactions qui se produisent dans les
organismes depuis l'apport extérieur (aliments) jusqu'à
l'élimination des déchets, avec tous les
mécanismes intermédiaires, dont l'ensemble constitue le
métabolisme générale dont les
éléments relatifs à chaque groupe de corps
constituent le métabolisme spécial (métabolisme
des glucides, protides, lipides...).
Ø Foeto-pathologie : Etude du
développement et des altérations du foetus. Le foetus
est le produit de la conception non encore arrivé à
terme, mais ayant déjà les formes de l'espèce
distincte et visibles à l'úil nu.
Ø Hématologie : Etude du sang sous tous
ses aspects morphologiques, physiologiques, chimiques et
génétiques. L'hématologie apporte son aide dans
le diagnostic, l'évolution et le traitement des maladies du
sang et des organes hématopoïétiques.
Ø Hémostase : Etude des mécanismes
permettant de stopper l'écoulement du sang. Cette étude
vérifie le maintien de tous les composants (facteurs de la
coagulation, temps de céphaline activéeÖ) qui
assurent l'hémostase spontanée des petites plaies.
Ø Immunologie : Etudie les
phénomènes d'immunité et leurs
conséquences prophylactiques ou thérapeutiques.
L'immunité étant l'état d'un organisme qui
résiste, sans manifestations pathologiques, à une
infection à laquelle un autre organisme, placé dans les
mêmes conditions, réagit par une évolution
morbide. Dans le cas de certaines immunodéficiences, le
laboratoire d'immunologie est amené à fabriquer des
anticorps monoclonaux, des concentrés d'albumine...
Ø Mycologie : Etudie scientifiquement les
champignons et les maladies dermatologiques, gynécologiques
qui en découlent.
Ø Microbiologie : Ensemble des disciplines
biologiques qui s'occupent de tous les organismes microscopiques et
ultramicroscopiques. Les micro-organismes sont des êtres
unicellulaires qui causent des maladies infectieuses.
Ø Parasitologie : Diagnostique et étudie
les parasites de l'homme. Le parasite est un animal ou un
végétal qui se nourrit de façon
nécessaire et permanente (ou prolongée) au
dépend d'un hôte d'une espèce différente,
sur ou dans les tissus duquel il vit fixé, en l'affaiblissant,
sans le tuer.
Ø Pharmacologie : Etudie l'incidence des
médicaments sur l'organisme. Elle vérifie qu'il n'y a
pas d'altération des fonctions organiques et anatomiques suite
à la prise et à la posologie du médicament.
Ø Sérologie : Elle assure le
dépistage des anticorps, microbes ou autres, dans les
sérums ou les liquides organiques. Elle participe au
diagnostic d'un grand nombre de maladies dont l'agent
pathogène est difficile ou impossible à mettre en
évidence : syphilis, kyste hydatique, mononucléose
infectieuse, paludismeÖ.
Ø Toxicologie : Science qui s'occupe des
poisons, leurs effets sur l'organisme et de leur identification.
Ø Transfusion sanguine : Etude des
différents composants et paramètres qui interviennent
en pré et post transfusionnel. La transfusion est une
méthode qui consiste à injecter par voie intraveineuse
des produits sanguins labiles (sang, plasma, plaquettesÖ) d'un
sujet sain à un receveur (malade ou blessé) de groupe
identique ou compatible.
Ø Virologie : Partie de la microbiologie qui
étudie les virus filtrants. Un virus est un agent
pathogène ultramicroscopique, ne pouvant croître que
dans des cellules vivantes. Il peut aussi traverser les filtres qui
arrêtent habituellement les bactéries et sont invisibles
au microscope optique.
Certaines de ces activités peuvent être
regroupées dans une même unité selon les
établissements.
(retour sommaire)
I.1.4.
Cycle de vie de l'acte biologique
Pour que le résultat de l'analyse soit fiable, il faut que
toutes les étapes entre le patient et la transmission (cf.
figure 1) soient obligatoires et soumises
à des procédures.
Une erreur commise à un niveau de cette chaîne peut
entraîner des erreurs graves sur le diagnostic final.
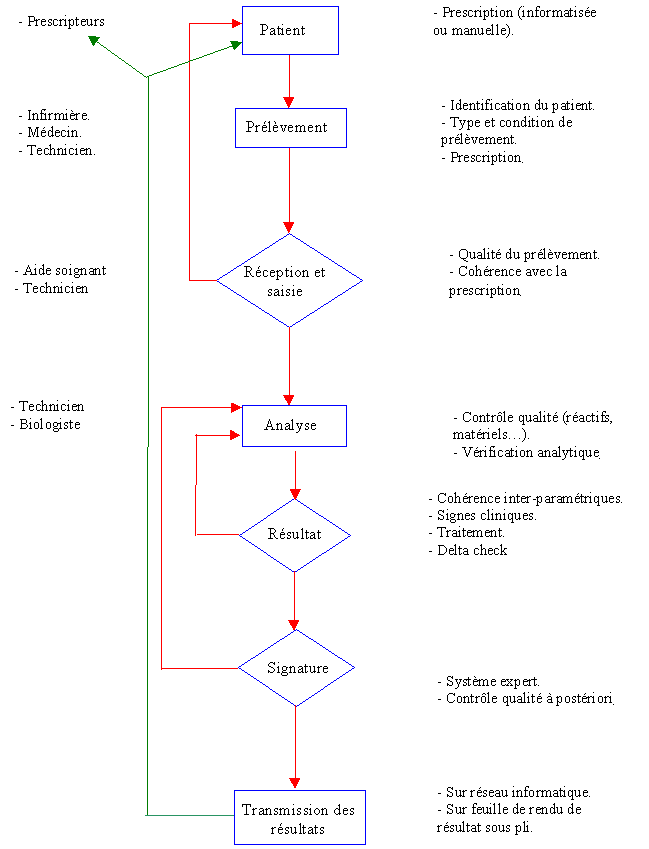
Figure 1 : Cycle de vie de l'acte
biologique
(retour sommaire)
I.2. Le
Guide des Bonnes Exécutions d'Analyses
(GBEA)
I.2.1. Présentation
générale
Début 1994, à la suite de contrôles
effectués dans des laboratoires d'Analyses de Biologie
Médicale, est apparue la nécessité de mettre en
place, en biologie, l'équivalent du guide des Bonnes Pratiques
de Fabrication (BPF) établi en 1978. L'objectif étant
de régir le fonctionnement des laboratoires dans
l'environnement actuel, c'est à dire malgré la
maîtrise des coûts.
Suite au travail du professeur Rousselet (Hôpital
Lariboisière) et de son groupe, sous couvert de la Direction
Générale de la Santé (DGS), le GBEA est apparu
au Journal Officiel du 4 décembre 1994. Il a été
mis en place à partir de l'arrêté du 2 novembre
1994 relatif à la bonne exécution des analyses de
biologie médicale. Il s'agit de règles auxquelles
doivent se conformer les laboratoires d'analyses de biologie
médicale, publics ou privés, en application d'un texte
(décret n°93-354 du 15 mars 1993) relatif aux conditions
d'autorisation des laboratoires d'analyses de biologie
médicale. Cet arrêté a pris effet le
1er janvier 1995.
Afin de mettre à exécution cet arrêté
il a fallu appliquer quelques règles simples.
ü les
procédures décrivant le " comment fait-on ? ".
ü les
procédures doivent être : standardisées,
acceptées et appliquées par tous.
ü tout ce qui
n'est pas écrit : n'est pas.
ü tout ce qui
n'est pas référencé et retrouvable : n'est
pas.
Le guide est composé de six parties définissant
chacune des points précis.
(retour sommaire)
I.2.2.
Introduction
Elle reprend l'objet d'un tel guide. Le GBEA est un guide qui
s'adresse à toutes les personnes travaillant au sein des
laboratoires et devient un instrument au service de la
qualité. La qualité se traduit par la satisfaction du
patient ou de l'utilisateur final. La recherche de la qualité
doit être la préoccupation essentielle et constante de
tout biologiste. La bonne exécution des analyses de biologie
médicale est une des conditions déterminantes de cette
qualité.
La deuxième partie de l'introduction définit les
principaux termes utilisés quand on parle de qualité et
plus particulièrement au sein d'un laboratoire d'analyses.
Elle définit également des termes propres au
fonctionnement d'un laboratoire : échantillons, compte rendu
d'analyses, prélèvementÖ
(retour sommaire)
I.2.3. Fonctionnement
Le guide édicte des règles générales de
fonctionnement concernant l'organisation du service, l'installation,
l'instrumentation, les matériels et réactifs,
l'informatique et l'élimination des déchets.
ü Organisation
Cette partie définit les obligations de la direction et des
responsables de laboratoire des établissements de
santé, celles des biologistes et du personnel.
~ Obligation de la direction en ce qui concerne le personnel,
les procédures opératoires, les installations,
l'instrumentation, les produits consommables et les
réactifs.
~ Obligation du biologiste en ce qui concerne
les comptes rendus d'analyses.
~ Obligation du personnel qui doit se conformer aux
procédures et appliquer le guide.
ü Installation
Ce paragraphe définit des dispositions sur
l'aménagement, l'entretien et la sécurité.
ü Instrumentation
Un laboratoire doit avoir à sa disposition le
matériel adéquat pour réaliser les analyses dans
les meilleures conditions possibles. Selon le type de laboratoire,
une liste de matériels à posséder
obligatoirement est définie.
ü Matériels et réactifs
Cette partie fait appel aux obligations vis à vis de
l'Agence du médicament concernant certains réactifs. Il
est également fait référence aux réactifs
préparés au sein du laboratoire (date de
préparation...), à la stabilité des
réactifs, aux réactifs périmés et ceux
présentant un caractère toxique.
ü Informatique
Il est fait référence au respect de la
confidentialité des résultats.
ü Elimination des déchets
Le guide instaure la mise en place d'une filière
d'élimination des déchets afin de respecter la
santé du personnel et de ne pas polluer l'environnement. Il
est fait la distinction de trois catégories de produits
à risque : déchets potentiellement contaminés,
produits toxiques, produits radioactifs et chimiques.
(retour sommaire)
I.2.4.Exécution des
analyses
Des règles sont définis pour des points bien
particuliers entrant dans le cycle de vie d'un
prélèvement.
ü
Procédures
Ce paragraphe rappelle l'importance des procédures
opératoires écrites au sein d'un laboratoire.
Le personnel doit les appliquer et les respecter.
ü
Prélèvement, identification, conservation et
élimination des échantillons
Le guide spécifie les conditions de réalisation d'un
prélèvement et les personnes habilitées à
le faire. Il est nécessaire d'utiliser du matériel
conçu pour respecter les conditions d'hygiène et de
sécurité.
Un des points essentiel est l'identification correcte de tous les
tubes contenant un échantillon. L'étiquetage doit
être réalisé de manière à ne faire
aucune confusion concernant l'identification du patient. De plus, une
fiche de renseignements doit être faite afin d'assurer la
traçabilité.
Les règles d'hygiène et de sécurité
doivent être respectées afin d'éviter la
contamination du personnel et de l'environnement.
ü
Validation des résultats
La validation doit être double. Elle comporte une validation
analytique (personnel d'exécution sous responsabilité
du biologiste) et une validation biologique (par le biologiste).
ü
Expression des résultats et compte rendu
d'analyse
Les résultats doivent être rendus suivant des
conditions bien précises et sans équivoque. Ils doivent
toujours spécifier le nom du laboratoire ayant effectué
l'analyse.
ü
Transmission des résultats
Elle doit toujours respecter le secret professionnel et la
confidentialité. Il est également fait
référence aux comportements à adopter lorsque le
résultat présage un résultat fatal pour le
patient concerné.
(retour sommaire)
I.2.5.Recherche
biomédicale
Il existe des règles particulières lorsque les analyses
entrent dans le cadre du livre II bis du code de la
santé publique. Il est fait référence aux
conditions d'établissement du protocole expérimental,
à sa réalisation et à l'écriture du
compte rendu.
(retour sommaire)
I.2.6.
L'assurance
qualité
Il est nécessaire que tout laboratoire possède un
système d'assurance qualité s'appliquant à tous
les niveaux de réalisation d'une analyse. Tout le personnel
est concerné par ce système d'assurance qualité.
Il doit être permanent et il doit toujours existé une
trace de sa mise en place. Son respect passe par plusieurs points
:
ü
Responsabilités de la personne chargée de
l'assurance de qualité
Il doit être placé sous la responsabilité d'un
biologiste qui devra avoir la formation, la compétence et
l'expérience nécessaire pour accomplir dans les
meilleures conditions sa tâche.
Le guide décrit les responsabilités de cette
personne vis à vis du personnel exécutant, la gestion
des procédures et la gestion du contrôle
qualité.
ü
Evaluation Externe de la Qualité (EEQ)
Il est fait référence au contrôle de
qualité national, qui correspond à une
évaluation externe. Elle est obligatoire et doit être un
reflet exact de la pratique. L'analyse des résultats doit
entraîner une action correctrice à consigner en cas
d'erreur. La répétition d'erreurs ou des erreurs graves
entraînent un contrôle de bonne exécution des
laboratoires.
Le laboratoire peut aussi participer à des contrôles
organisés par des sociétés scientifiques ou des
groupements de biologistes.
ü
Contrôle de Qualité Interne (CQI)
Il doit être effectué par des personnes
habilitées à le faire et est indispensable pour
déceler des erreurs de mesure afin d'y remédier le plus
rapidement possible.
(retour sommaire)
I.2.7.Archivage
Les archives doivent contenir un minimum de relevés qui sont
(entre autre) :
- les résultats des contrôles effectués en
interne.
- les comptes rendus des analyses effectuées par le
contrôle national de qualité.
- les procédure.
- les documents relatifs aux instruments, à la maintenance,
aux réactifs et aux consommables.
- les documents relatifs à l'enlèvement des
déchets.
La durée de conservation de ces différents documents
est variable.
Les archives doivent être entreposées dans un local
adapté à cet usage, permettant la conservation des
documents sans aucune altération.
(retour sommaire)
I.2.8.Implication
L'introduction de ce guide dans les laboratoires d'analyses
médicales bouscule et va bousculer les habitudes de chaque
biologiste et techniciens afin d'assurer et améliorer la
qualité. Sa mise en place entraîne de nombreux
problèmes : humains, organisationnels, financiersÖ
Malgré toutes les contraintes qu'il entraîne, son but
est d'assurer une qualité totale du résultat final
sachant qu'elle doit donc être appliquée à toutes
les étapes d'une analyse (cf. I.1.4.) :
- pré-analytique
en effectuant le prélèvement dans les meilleurs
conditions possibles d'hygiène et sécurité, en
notant les conditions dans lesquels il a été
réalisé (heure, état du patientÖ) et en
assurant une bonne identification du patient.
- analytique en
utilisant le matériel approprié à l'analyse et
en utilisant des consommables et réactifs fiables (importance
de leur identification).
- post-analytique en
assurant une bonne transmission des résultats.
En réunissant tous ces facteurs, la sécurité
du patient sera respectée.
(retour sommaire)
|
II. QUALIFICATION
DU MATERIEL DE LABORATOIRE
|
II.1. Mise
en place d'un protocole
La qualification du matériel, utilisée dans un
processus de qualité est une exigence exprimée dans de
nombreux référentiels. Dans le cas des laboratoires
d'analyses et de recherche, il en existe de nombreux, tels que les
Bonnes Pratiques de Fabrication (BPF), les Bonnes Pratiques de
Laboratoire (BPL), le Guide de Bonne Exécution des Analyses
(GBEA), les normes ISO 9000, qui rendent obligatoire la
qualification. Il faut considérer que les laboratoires
s'automatisent de plus en plus et que le rendu du résultat du
patient dépend, entre autre, de la fiabilité du
matériel.
La qualification du matériel de laboratoire concerne donc
tous les laboratoires mono-tâches, pluridisciplinaires,
semi-automatisés ou automatisés ainsi que tous les
types de matériel (de la pipette à l'automate
multi-analyses).
Il faut cependant garder en mémoire que seul les appareils
qui ont une incidence sur la qualité du résultat
(produit ou service) doivent être qualifiés. Il
apparaît, aussi que le choix de qualifier ou non un
matériel est sous la responsabilité du responsable de
service.
(retour
sommaire)
II.1.1. Définition
de la qualification du matériel
Ce sont des opérations qui consistent à
démontrer qu'un matériel fonctionne correctement et
donne réellement les résultats attendus.
Elles comprennent la qualification à réception
(état de recette) et la qualification opérationnelle
(état d'essai).
La qualification du matériel au laboratoire se trouve, si
nécessaire, incluse dans un concept plus large de validation
du système analytique interactif matériel -
méthode - réactif.
(retour sommaire)
II.1.2. La
démarche
Elle est une étape importante dans la démarche de
réponse par rapport à un cahier des charges
établi. Il faut donc l'introduire dans la vie de l'appareil
grâce à la préparation et la rédaction
d'un protocole (informations nécessaires au bon
déroulement de la qualification). La rédaction de ce
protocole nécessite obligatoirement d'y introduire des
renseignements sur le matériel (statut et utilisation), le
type de qualification à effectuer, la documentation et les
référentiels, les modes opératoires (protocoles
techniques), les éléments de sortie, les fiches
d'interventions et l'archivage.
1 - Le matériel :
Ä
Identification et statut :
Il est indispensable d'identifier correctement le matériel
concerné par le protocole.
Il convient de noter :
- le nom du fournisseur.
- la marque.
- le type.
- le numéro de série.
- le numéro d'inventaire.
- l'emplacement de l'appareil (numéro de la
pièce laboratoire) qui doit éventuellement renvoyer
à un plan.
Il convient aussi de faire apparaître le statut de
l'appareil (prêt, location, vente, achat...). Ce statut est
susceptible de changer, dans ce cas, le changement doit être
tracé par un amendement au protocole.
Ä
Objectifs d'utilisation :
Le rôle de l'appareil dans le processus d'analyse du
laboratoire et la description des objectifs d'utilisation (vitesse de
lecture, plage de vitesse de centrifugation, gamme des prises d'essai
usuelles pour un automate de prélèvement...) doivent
permettre de mieux connaître les différents
paramètres qui devront être contrôlés ou
vérifiés.
2 - Type de qualification
effectuée
Ä
Qualification à réception :
Il s'agit de vérifier et contrôler un certains nombres
d'éléments :
- adéquation entre le bon de livraison et le
bon de commande
- aspect visuel du modèle,
détérioration...
- état de fonctionnement par mise sous tension
(s' il y a lieu)
- vérification et attestation des tests
effectués par la société de
vérification habilitée
Ä
Qualification opérationnelle :
Les paramètres à mesurer ou à tester sont les
paramètres critiques pour juger des performances de l'appareil
par rapport au cahier des charges. Ils doivent, entre autre, tenir
compte des recommandations du fournisseur, des utilisateurs et des
référentiels.
Ces paramètres se mesurent ou se contrôlent
grâce à des équipements de contrôle de
mesure et d'essai. Tous ces paramètres doivent être
soumis à des critères d'acceptation.
Il est très important d'exploiter correctement toutes ces
données.
La qualification opérationnelle est soumise à une
planification au sein du laboratoire. Elle peut faire suite à
des actions de maintenance (préventive ou curative), à
une validation non conforme (de l'analyse pratiquée ou de
l'appareil), à un changement d'emplacement dans le laboratoire
ou hors du laboratoire (lors d'un prêt) ou tout simplement par
rapport à une fréquence préétablie (en
fonction des recommandations du constructeur ou du bon sens de
l'utilisateur).
Dans des cas bien précis, comme une validation de technique
non conforme, il est possible d'envisager une qualification partielle
qui ne couvrira que certaines fonctions ou gammes d'utilisation du
matériel. L'utilisation des fonctions ou gammes non
qualifiées est alors exclue pour un moment (le temps de
refaire la technique) et soumise par la suite (à la fin de la
technique) à une nouvelle qualification partielle.
Attention ! Tous les paramètres doivent être
requalifiés avant toute réutilisation de
l'appareil.
Les équipements de contrôle de mesure et d'essai :
Ils doivent être parfaitement identifiés et
raccordés à la chaîne métrologique
nationale (lorsque le raccordement est possible) et qu'ils aient
obtenu leur certificat d'étalonnage ou un constat de
vérification.
Il faut que ces équipements soient adaptés aux
mesures spécifiques à faire en terme de
sensibilité, précision et justesse.
Métrologie (NF X 07-010) : La métrologie
regroupe tous les aspects (théoriques et pratiques) se
rapportant aux mesurages, quelque soit l'incertitude de ceux-ci, le
domaine de la science et de la technologie.
Les constats de vérification des moyens de mesure sont
concernés par la norme FD X 07-011 et le raccordement des
résultats de mesure aux étalons, par la norme FD X
07-015.
Les critères d'acceptation : Ils sont fixés
pour chaque paramètre à étudier dès la
conception du cahier de charges (clauses techniques).
Il est parfois impossible de fixer ces paramètres par
rapport aux clauses techniques, soit parce qu'elles n'ont pas
été spécifiées dans le cahier des
charges, soit parce que l'appareil date de plusieurs années
(perte des références techniques), soit parce qu'il y a
eu des changements de sites (l'appareil a bougé sans
être accompagné de ses spécificités
techniques). Il faut donc, dans ce cas, recontacter le fournisseur et
redéfinir les critères d'acceptation ou de rejet.
(retour sommaire)
3 - Documentations et
référentiels
Il s'agit de lister et de donner les références des
documents entrants nécessaires à la rédaction et
à l'application du protocole de qualification. Il s'agit :
- du cahier des charges.
- de la documentation du fournisseur (modes
opératoires, schémas électriques et
mécaniques, certificats divers : conformité CE du
matériel....) ainsi que le nom du responsable du service
après vente et son numéro de
téléphone.
- les procédures générales
du laboratoire pouvant être utilisées pour la
qualification du matériel.
- les normes techniques.
- les normes d'hygiène et de
sécurité.
4 - Modes opératoires
Ils indiquent pour chaque type de matériel le type de
qualification à réception et de qualification
opérationnelle qu'il faut effectuer. Ils indiquent aussi le
type d'équipement de contrôle de mesure et d'essai qu'il
faut utiliser ainsi que les critères d'acceptation de ces
mesures. Le tout sera complété par une fiche
d'intervention pour le recueil des données.
Attention ! Les modes opératoires sont
spécifiques à chaque type de matériel et sont
mis en place selon les normes en vigueur et selon les indications du
fournisseur (documentation technique).
(retour sommaire)
5 - Les éléments de sortie
La nature des éléments des sortie est double :
- Les supports de recueil des données brutes : ils
concernent la destination de ces données brutes (les
destinataires), l'analyse des résultats et le lieu
d'archivage.
- Les produits ou échantillons entrés en contact
avec le matériel qualifié : certain mode
opératoire font intervenir des solutions de test (eau,
colorant...) qui devront être éliminées à
l'issue des essais. Dans le cas de l'utilisation de produits
biologiques (liquide céphalo-rachidien, sang...), il convient
de suivre la procédure d'hygiène spécifique au
laboratoire.
6 - Les fiches d'intervention
Il s'agit de décrire les règles et le formalisme du
recueil des données brutes et de lister les supports de
recueil.
Dans le cas de la qualification du matériel, une fiche
d'intervention listant tous les éléments
nécessaires à une bonne traçabilité,
paraît le document le mieux adapté.
Cette fiche d'intervention peut être associée
à une fiche d'incident ou bien les deux ne peuvent faire
qu'une.
7 - Archivage
L'ensemble des documents relatifs à la qualification du
matériel de laboratoire (protocole, fiche d'intervention...)
sera archivé selon la procédure générale
d'archivage des documents du laboratoire.
8 - Conclusion
L'ensemble de ces étapes est nécessaire pour la
rédaction d'un protocole de qualification adapté.
Cependant, lors de ces étapes il a été omis
les responsabilités du personnel et ses compétences.
Ces deux paramètres, qui seront traités dans un
prochain chapitre(II.2.1.), sont bien sûr obligatoires pour une
bonne gestion de la qualification au sein du laboratoire.
(retour sommaire)
II.1.3. Les
paramètres critiques
La qualification du matériel étant une démarche
permettant de prouver l'aptitude du matériel à remplir
les fonctions attendues, elle conduit par la même à la
maîtrise des paramètres critiques lors de son
utilisation.
Elle devra donc vérifier :
- l'exactitude des
mesures.
- la dérive.
- la
fidélité.
- la
répétabilité des résultats.
- la
reproductibilité des résultats.
- la fiabilité et
la justesse.
Le tout doit être confirmé par une validation.
La validation est la confirmation par examen et par apport de preuves
tangibles que les exigences particulières pour un usage
spécifique prévu sont satisfaites. La validation
s'effectue sur le produit final dans des conditions d'utilisation
définies. Plusieurs validations peuvent être
effectuées s'il y a différents usages
prévus.
A matériel différent,
qualification différente : étalonnage, calibration,
pesée...
(retour sommaire)
II.2. Application
à l'Etablissement de Transfusion Sanguine Assistance Publique
ñ Hôpitaux de Paris
L'établissement de Transfusion Sanguine de l'Assistance
Publique Hôpitaux de Paris (ETS AP-HP) a mis en place depuis le
mois de juin des groupes qui travaillent sur la qualité dans
trois domaines essentiels (prélèvement des donneurs,
distribution des produits sanguins labiles, matériel). Cette
démarche a été entreprise, avec la participation
de biologistes, de surveillants de laboratoire et de Madame F.Paris,
responsable de la qualité au siège de la
transfusion.
Elle a pour but d'évaluer l'état actuel des choses,
de guider les sites en leur apportant des informations
adéquates à l'installation et à
l'homogénéisation de cette démarche.
De part la loi n°98-535 du 1er Juillet 1998
relative au renforcement de la veille sanitaire et du contrôle
de la sécurité sanitaire des produits destinés
à l'homme, l'ETS AP-HP ne connaît pas encore sa
destinée mais par l'intermédiaire de cette
homogénéisation, elle facilite sa
réorganisation. Le remplacement de l'Agence Française
du Sang par un Etablissement Français du Sang (EFS) qui
deviendrait le gestionnaire unique du service public transfusionnel,
oblige une réorganisation importante de l'ETS AP-HP
(personnel, financier...).
(retour sommaire)
II.2.1. Présentation de
l'ETS AP-HP
L'ETS représente 26 sites (cf. Figure 2)
et un siège, répartis sur Paris et sa proche banlieue.
Ces sites sont situés dans les établissements de soins
de l'Assistance Publique Hôpitaux de Paris.
Le siège est constitué de six divisions :
- la direction générale.
- les achats et qualité.
- les finances.
- les ressources humaines.
- la formation.
- l'informatique.
Par son statut d'établissement à part
entière, on retrouve aussi un représentant syndical FO,
CFDT, CRC.
En ce qui concerne les achats, ils s'effectuent au niveau du
siège après que chaque site ait fait parvenir son plan
d'équipement. Celui-ci sera discuté avec les
intéressés et sera réévalué selon
les priorités.
Figure 2 : Les sites de
l'AP-HP
Ä Le personnel
:
La transfusion sanguine regroupe sept catégories de
personnel de laboratoire.
Par la diversité du personnel, donc par la
diversité des formations, on pourrait croire que la mise en
place des contrôles qualité du matériel sera
aisé. Or, il n'en est rien puisqu'aucune de ces personnes
n'a de formation initiale en qualité et en techniques
biomédicales. Pour bien des utilisateurs de
matériel, le contrôle qualité de celui-ci ne
fait pas parti de leurs attributions et n'est sûrement pas
une priorité dans leur planning.
Pour la bonne gestion de la qualification, il faut donc qu'elle
se trouve sous la responsabilité d'un membre de
l'équipe qui aura :
- la motivation,
- les compétences nécessaires,
- une grande disponibilité.
Cette personne sera chargée du suivi du planning, de la
finalisation du protocole, du bon déroulement du recueil
des données, de la coordination des actions, de l'analyse
et de la discussion des résultats puis de
l'élaboration de la conclusion finale.
Il est nécessaire que le responsable de la qualification
soit en contact permanent avec un membre des services
biomédicaux, un membre du service achat, le responsable
qualité et chaque fournisseur.
Tout le personnel effectuant les tests de qualification devra
avoir été formé à l'utilisation du
matériel par le fournisseur ou par toute personne en ayant
les compétences et avoir connaissance des procédures
d'hygiène et sécurité s'y rapportant.
Ä Les
unités d'analyse et de recherche à l'ETS
AP-HP
On trouve de nombreuses unités au sein de l'ETS qui sont
:
ü
Préparation-transformation des produits sanguins
: Poolage, irradiation, filtrationÖ, des produits
sanguins.
ü
Qualification biologique des dons : Numération
formule sanguine, culture bactériologique...
Vérification de la transformation et du
conditionnement des produits sanguins grâce à
des contrôles qualité.
ü
Distribution : Gestion des produits sanguins finis,
distribution aux patients, hémovigilance.
ü
Immuno-Hématologie : Groupage sanguin, recherche
et identification des anticorps iréguliers dans le
sérum, coombs direct, phénotypageÖ
ü Biologie
moléculaire : Elle a pour but d'affiner et de
confirmer la détection virale faite en
sérologie. Elle permet aussi une identification
précise de l'agent pathogène en
présence.
Virus concernés : HIV, HAV, HCV,
HBVÖ
ü
Virologie sérologie : Recherche
d'anticorps spécifiques à une infection virale
dans le sérum des patients
Virus concernés : HIV, HCV, HAV, HTLV,
HBVÖ
ü
HLA-cytologie : Laboratoire d'histocompatibilité
:Anticorps anti HLAÖ
ü
Cryo-congélation : Congélation des
produits biologiques après un certain nombre de
traitements.
ü
Sérothéque : Archivage des sérums
patients.
ü
Thérapie cellulaire : Concerne tous les
traitements imposés aux moelles osseuses, cellules
souches, sang de cordonÖ
ü
Hémostase : Temps de céphaline
activée, temps de QuickÖ
ü
Laboratoire Macrophage.
ü Anticorps
monoclonaux.
ü Banque de
cornées.
ü Banque de
tissus.
Les différentes unités présentent en
transfusion sont classifiées en groupes de " risques
biologiques ". :
- P1 (Pas de risques pour le personnel) :
Immuno-hématologie, distribution des produits
sanguins...
- P2 (Risques sévères et
transmissibles pour le personnel) : Sérologie,
qualification des dons, préparation et
transformation des produits sanguins...
- P3 (Risques graves et mortelles pour le
personnel) : Virologie, biologie
moléculaire...
Ces unités devraient donc avoir des niveaux de
confinement différents. Par manque de moyens financiers,
à cause de structures mal adaptées et aussi parfois
par un manque de connaissance des réglementations en
vigueur, cela n'est pas toujours le cas.
(retour sommaire)
II.2.2
: Le matériel en
transfusion :
Ä L'inventaire :
L'inventaire du matériel de l'ETS date du 25 novembre 1998. Il
regroupe tous les sites sous un inventaire unique et
général.
Il est constitué d'environ 4000 matériels au sein
des laboratoires dont 3000 sont concernés par le
contrôle qualité. La liste des différents
matériels se trouve en annexe 2.
- Présentation de l'inventaire :
Plusieurs renseignements sont donnés
pour chaque appareil qui sont :
- Nom du site où se trouve l'appareil
concerné.
- Numéro d'inventaire.
- Activité du site.
- Nature du bien.
- Code CNEH.
- Désignation CNEH.
- Libellé complémentaire.
- Marque de l'appareil.
- Fournisseur.
- Code fournisseur.
- Type du modèle.
- Numéro de série.
Sa mise en place récente ne permet pas encore
d'apprécier son impact sur la gestion de la qualification.
Cependant, il devrait permettre des contrôles qualité
plus adapté à chaque type/modèle d'appareil et
marques.
Ä Les
fabricants
Ils sont au nombre de 120 environ.
La complexité des achats et des contrôles
qualité à l'ETS peut sûrement s'expliquer par la
diversité des fabricants pour un matériel
identique.
A titre d'exemple :
- Congélateurs à ñ20°C : 15
fabricants.
- Agitateurs : 7 fabricants.
- Soudeuses : 6 fabricants.
- Microscopes : 7 fabricants.
- Balances : 6 fabricants.
Il apparaît clair qu'il est plus difficile de gérer
la maintenance (contrats, pièces de rechange pour la
maintenance de niveau un...), l'entretien spécifique et les
contrôles qualité (paramètres, instruments de
mesure et d'essai...) dans ces conditions.
(retour sommaire)
II.2.3
: Procédure de vie d'un
matériel
La qualification de réception et opérationnelle d'un
matériel s'inscrit dans le cycle de vie d'un matériel,
régit par une procédure.
Ä
Procédure de vie d'un matériel :
L'organigramme de la procédure est
représenté sur la figure
n°3.
Cette procédure de vie sera accompagnée de
procédures parallèles, telles que :
- gestion des achats.
- qualification du matériel.
- validation du matériel.
- maintenance du matériel.
- gestion des anomalies.
- archivage des données.
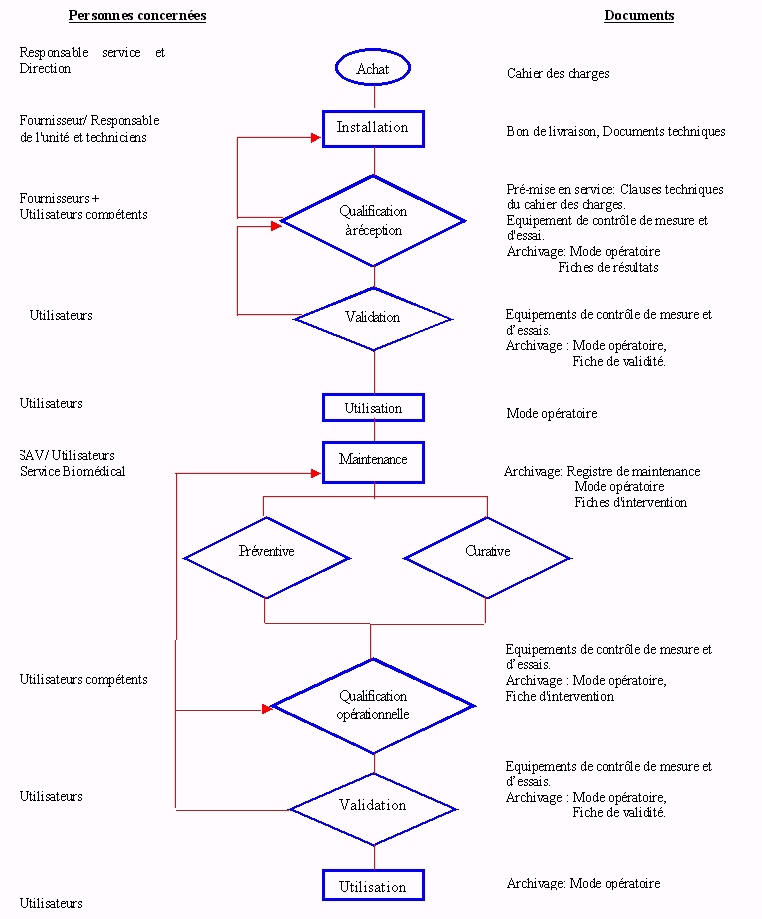
Figure 3 : Procédure de
vie d'un matériel
(retour sommaire)
Ä Mode
opératoire
Proposition de deux types de mode opératoire selon les
conseils du constructeur et le bon sens de l'utilisateur.
Ces modes opératoires concernent les réglages et
contrôles mais ils pourraient aussi concerner la maintenance de
niveau un.
1er mode opératoire : Qualification
à réception d'un incubateur de microplaque IPS
ü Appareils
concernés :
L'ensemble des appareils IPS (monoñtension, bi-tension non
CEM, bi-tension CEM) neufs ou provenant de réparation.
ü Personnes
habilitées au contrôle qualité :
Celles ayant été formées par la
société Sanofi Pasteur.
ü Matériel
nécessaire :
- un indicateur de température de
résolution 0,1° C.
- une sonde thermique étalonnée avec
l'indicateur thermique (taille de la sonde<2mm).
- une microplaque Greiner.
- une pipette multicanaux (distribution de
200µl).
- cônes pour pipette multicanaux.
ü Durée de
l'opération : 2h30mm.
ü Contrôles
Qualité :
- Déballage et installation :
Référencée sur une fiche de
résultat.
- Contrôle de la température dans la
microplaque.
- Contrôle de la température du
plateau.
On peut trouver les détails de chaque opération en
annexe 3 : qualification à
réception d'un incubateur de microplaques IPS
ü Critères
d'acceptation :
- Température dans la cupule : Le contrôle
sera considéré comme conforme si la
température lue sur l'indicateur est comprise entre
la température de consigne +/- 0,5°C.
- Température du plateau : idem ci- dessus.
ü
Désinstallation / remballage :
- Rejet de l'appareil lors du contrôle de
réception.
- Rejet de l'appareil après
réparation..
Les fiches de résultats (cf.
annexe 4) doivent être validées
par le responsable qualification du laboratoire. Elles seront ensuite
archivées selon la procédure établie.
La qualification à réception se fait suivant les
clauses techniques du cahier des charges.
Lors de la réception du matériel il faut aussi
vérifier si toute la documentation technique (en
français), les pièces de rechange
élémentaires... sont présentes.
2ème mode
opératoire : Qualification opérationnelle du
laveur microplaques LP 35 de Sanofi Diagnostics Pasteur
ü Appareil concerné :
Laveur microplaques LP 35 pour des dépistages
sérologiques effectués en technique ELISA.
Ces contrôles et réglages sont les
mêmes quelque soit le type de LP35.
ü
Personnes habilitées à faire ces contrôles
:
Celles ayant été formées par la
société Sanofi Pasteur .
ü
Matériel nécessaire :
- une balance (précision 0,1g ; charge maximale
à peser : 500g).
- une microplaque de 12 barrettes de 8 cupules à
fond plat.
- deux litres d'eau distillée.
- deux litres de solution de lavage SDP prête
à l'emploi (R2 - code SDP :72240 ñ à
diluer au 1/10e ).
- un récipient (dimensions minimales : L=65mm ;
l=20mm ; p=40mm).
- un tournevis plat ou une clé ALLEN de 1,5.
ü Durée des
opérations : 1heure.
ü Précautions
:
Pour tout laveur en contact avec des produits
potentiellement infectieux, procéder à la
décontamination tel qu'elle a été
définie dans une procédure
générale au laboratoire.
üContrôles
:
Les réaliser après l'entretien trimestriel
de l'appareil. Les détails de chaque opération
se trouve en annexe 5 : qualification
opérationnelle du laveur microplaques Sanofi
Diagnostics Pasteur.
- Vérification des paramètres du mode "
maintenance ".
- Vérification des paramètres du mode "
réglage ".
- Vérification de la position de la microplaque
par rapport au manifold.
- Vérification da la position horizontale du
manifold.
- Vérification des paramètres du mode "
Lavage ".
- Vérification et réglage de la position
d'overflow (ou trop plein).
Tous les paramètres
vérifiés seront inscrits sur une fiche d'intervention
qui sera ensuite vérifiée et validée par le
responsable qualification du laboratoire . Cette fiche sera ensuite
archivée selon la procédure établie (cf;
annexe 6).
Si le contrôle qualité est effectué par la
société celle-ci doit remettre un rapport
d'intervention qui sera analysé et archivé dans les
mêmes conditions.
(retour sommaire)
II.2.4
: Audit interne
L'audit selon l'ISO 8402, est un " Examen méthodique et
indépendant en vue de déterminer si les
activités et résultats relatifs à la
qualité satisfont aux dispositions préétablies,
et si ces dispositions sont mises en úuvre de façon
efficace et apte à atteindre les objectifs "(1)
(2).
Selon la norme ISO 10011-11, l'audit permet de :
- Représenter les écarts (positifs ou
négatifs) entre ce qui doit être fait et ce qui
est fait.
- Représenter les écarts (positifs ou
négatifs) entre la réalité et les
objectifs à atteindre.
- Caractériser l'adéquation du
référentiel aux objectifs à
atteindre.
L'audit pose deux questions :
- Procède-t-on comme prévu ?
- S'est-on donné les moyens pour atteindre les
objectifs ?
Le type d'audit qui a été choisi pour évaluer
la qualification du matériel de laboratoire sur les 26 sites
transfusionnels est un audit interne
(cf. annexe 8 ).
Un audit interne se déroulera en trois temps :
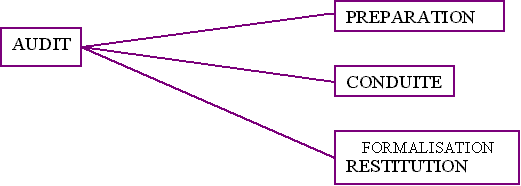
Ä
Préparation :
Cinq surveillants de laboratoire et deux étudiantes en DESS
" Technologies Biomédicales Hospitalières " de
Compiègne. Cette préparation s'est répartie en
six réunions sur une durée de cinq mois.
Ä Conduite
:
Il a été décidé d'associer cet audit
aux audits des autres groupes de travail (prélèvements
et distribution) et d'éditer une méthodologie sur la
qualification.
Les dispositions sur le recueil de données n'ont pas encore
été définies.
Ä
Formalisation et restitution :
L'analyse des écarts sera indiquée à chaque
laboratoire sous forme de rapport, accompagné du livret de
méthodologie pour la construction d'un plan d'action
(correctif ou préventif).
Un suivi sera assuré grâce à la mise en place
d'indicateurs de suivi, de réunion de coordination et
éventuellement d'audit de suivi (selon la demande).
(retour sommaire)
II.2.5
: La qualification en
transfusion sans assistance biomédicale
Le questionnaire qui se trouve
en annexe 9 a été envoyé
à tous les chefs de service des laboratoires de l'ETS AP-HP :
onze réponses. Les sites qui nous ont répondu sont R.
Debré, Lariboisière, Bicètre, Broussais,
Béclère, Avicenne, Bichat, Trousseau, Pitié
Salpétrière, Tenon et Brousse.
Ä
La qualification

Dans l'état
actuel des choses, la qualification du matériel n'est
assurée que partiellement dans des conditions critiques. On
peut, effectivement, voir que seulement 10% des utilisateurs ne
connaissent, que partiellement, les normes en vigueur. Il faut donc
envisager en premier lieu une formation de ces utilisateurs par du
personnel compétent et par les fournisseurs.
(retour sommaire)
Ä
Le GBEA
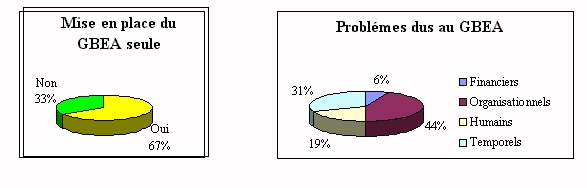
Dans plus de 65% des établissements, la mise en place du
GBEA est assurée par le personnel de laboratoire seul,
d'où des problèmes financiers, organisationnels,
humains et temporels. Cela rejoint le problème
précèdent où il faudrait une personne
compétente au moins à mi-temps, ce qui permettrait de
résoudre un peu les problèmes organisationnels, humains
et temporels. Le problème budgétaire ne serait
résolu que par une aide financière du
ministère.
Par une mauvaise connaissance des implications, il y a d'autant
plus de problème, que l'ingénieur biomédical
n'intervient dans aucun des sites de transfusion de l'AP-HP pour
apporter son aide et ses connaissances et que toutes les
procédures ont un été mises en place seule.
(retour sommaire)
Ä
Les achats
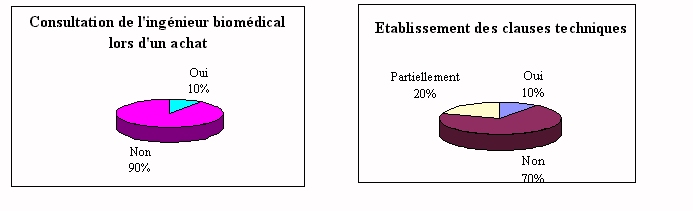
Lëingénieur
biomédical ne participe qu'à 10% des consultations lors
de l'achat d'un nouvel dispositif. Pourtant il apparaît
être une des personnes les mieux placés pour participer
au choix d'un nouvel équipement donc à
l'établissement des clauses techniques.
Le partenariat n'existant pas, l'utilisateur a de nombreux
contacts informels avec le fournisseur.
(retour sommaire)
Ä
L'ingénieur biomédical
Dans les réponses
précédentes on a pu voir que l'ingénieur
biomédical intervenait peu sur les site, pourtant les
laboratoires demandent son intervention. A près de 90% ils
estiment qu'il est indispensable. En effet, les principaux propos
recueillis sont :
u
L'ingénieur
biomédical a reçu la formation spécifique, de ce
fait, il appréhende mieux les difficultés
techniques.
u
Il peut être
indispensable pour les conseils techniques, le cahier des charges, la
validation et la qualification.
u
Je ne pense pas que "
indispensable " soit le mot, mais plutôt " souhaitable ", dans
la mesure où ses connaissances techniques et juridiques
(légales) sont importantes avant tout choix et lors de la
qualification.
u
Il doit connaître
parfaitement les dispositifs installés dans les laboratoires,
il doit aider à la mise en place des
procédures.
u
Il peut participer à
la mise en place de procédures. C'est un interlocuteur
indispensable pour répondre à nos questions sur
l'utilisation, le choix, la validation du matériel et les
réparations simples.
u
Les nombreuses lois, les
nouvelles normes passent souvent inaperçues pour les sites
transfusionnels.
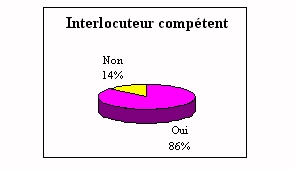
La majorité pense qu'il est un interlocuteur
compétent. En effet nous avons recueillis plusieurs
réflexions qui sont :
u
Sa formation lui permet
d'appréhender avec compétences les différents
aspects du secteur de la biologie.
u
Dans la démarche
d'assurance qualité, il est un maillon
indispensable.
u
Il est formé pour
optimiser le matériel et son suivi.
Les plus sceptiques sur ses compétences en biologie
rapportent :
u
Il est multidisciplinaires
donc, c'est difficile d'être compètent dans tous les
domaines.
u
Je pense qu'il a des
connaissances pratiques sur le matériel, mais je ne connais
pas ses compétences vis à vis des différentes
disciplines en biologie.
Il n'informe jamais des nouveautés sur le marché,
alors que cela rentre dans ses fonctions.
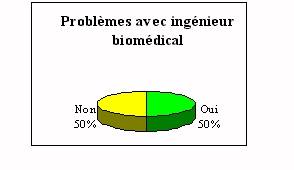
A travers les réflexions précédentes,
l'analyse des contacts entre les laboratoires et le service
biomédical semblaient primordiales. On peut voir qu'il y a des
problèmes pour la moitié des cas. Les principales
raisons à ces problèmes sont :
|
|
u
Les service
biomédical est dans l'hôpital et ne met pas nos
appareils en route donc pas de réparation, pas de
soutien.
u
Nous ne sommes pas
prioritaire par rapport aux autres services.
u
Nous n'avons aucun
contact avec lui.
u
La non appartenance
à l'hôpital siège pose de nombreux
problèmes.
|
Malgré ces problèmes rencontrés, tous
reconnaissent la nécessité d'un ingénieur
biomédical. Les principales raisons évoquées ont
été :
u
L'ingénieur
biomédical serait la personne référante en
matière de qualification et de validation. Toute fois, il
devrait travailler en étroite collaboration avec
l'équipe des techniciens d'analyses biologiques afin de
respecter et de tenir compte de l'expérience des gens de
terrain.
u
Il apporterait des conseils
et assurerait un suivi technique des appareils, participerait
à l'établissement du cahier des charges et aux normes
de sécurité.
u
Il pourrait résoudre
plus rapidement des problèmes ponctuels sans faire appel
systématiquement au SAV.
u
Nécessité d'un
interlocuteur ingénieur biomédical appartenant à
l'ETS.
u
On assiste à
l'arrivée d'appareils de plus en plus sophistiqués et
nombreux qui imposent la présence d'une personne
référante pour assurer le bon fonctionnement lors de
l'installation et d'un dysfonctionnement.
u
Il participerait à
l'établissement du cahier des charges et assurerait la gestion
des inventaires.
(retour sommaire)
II.3. Conclusion
Au dire du personnel de laboratoire,
l'ingénieur biomédical devrait tenir une place
importante dans son fonctionnement et pourtant il n'en est rien. Les
difficultés mises en avant par les laboratoires doivent
s'expliquer par un certain nombre de raisons qu'il semblait
essentielles de connaître afin de pouvoir apporter des
solutions et un avenir à ce partenariat délicat.
(retour sommaire)
|
III.
L'ingénieur biomédical et les
laboratoires
|
III.1.Le
pourquoi et le comment d'une enquête
Après
l'étude des principales méthodes de recueil
d'informations, il fut décidé de recueillir les
informations concernant l'implication des ingénieurs
biomédicaux dans les laboratoires grâce à une
enquête par questionnaire.
Cette enquête consiste à poser une série de
questions à 100 services biomédicaux dans des
hôpitaux de taille variable.
Le choix des hôpitaux, c'est fait par :
- leur fonction
d'établissement public.
- leur taille (nombre
de lits).
- leur situation
géographique (répartition équitable sur toute la
France).
- département
(1à 2, selon la taille de celui-ci).
Ce questionnaire comporte 47 questions (cf.
annexe 10), le plus souvent à
réponses simples (oui, non, partiellement) et d'autres
associées à une explication.
Il est dit "d'administration directe " car envoyé par
courrier.
L'avantage de ce type d'enquête est la possibilité de
quantifier de multiples données et de procéder
dés lors à de nombreuses analyses de corrélation
(3).
Il est primordial pour que la méthode soit fiable que :
- l'échantillon soit choisi avec rigueur.
- la formulation des questions soit claire et sans
équivoque.
- il y ait correspondance entre le monde de
référence des questions et le monde de
référence du répondant.
- l'administration du questionnaire soit fiable et se fasse
en toute confiance.
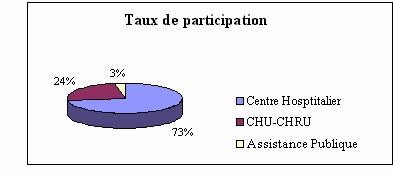
Sur 100 questionnaires envoyés le 18 décembre 1998,
37 ont été retournés avant le 1er
février 1999.
(retour sommaire)
III.2.Analyse
de l'enquête nationale auprès des établissements
de soins publics
Présentation des
réponses obtenues suivant différents thèmes.
Ä
Organisation hospitalière
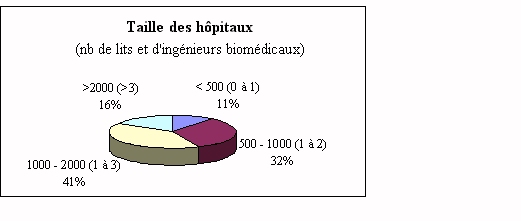
L'importance du service
biomédical varie souvent selon la taille de
l'établissement (cf.
annexe 11). Le nombre d'ingénieur biomédical est
spécifié entre parenthèses dans le graphe
précédent. Il arrive que cet ingénieur soit
spécialisé pour les laboratoires mais ceci
essentiellement dans les centres hospitaliers régionaux et
universitaires (>2000 lits).
Il faut noter que certains centres hospitaliers de 450 lits ne
possèdent pas d'ingénieur biomédical, mais ont,
néanmoins un service biomédical. Le nombre de
techniciens et adjoints techniques biomédicaux varie souvent
suivant la taille de l'établissement donc selon le nombre de
dispositifs médicaux sous leur responsabilité.
Ä Le
GBEA dans les laboratoires
ü Types de laboratoires implantés dans
l'hôpital
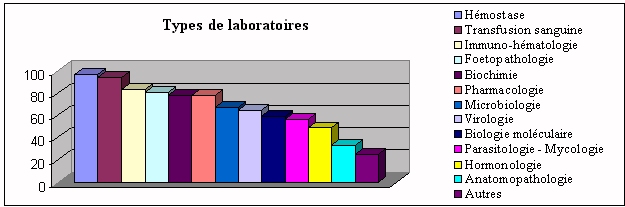
Sont regroupés
sous " autres ", les laboratoires d'immunologie, de neuropathologie,
toxicologie, biologie de la reproduction, radio-immunologie,
cytologie génitale, génétique, biologie
hépathique et microscopie électronique (cf.
I.1.2).
üComité de
pilotage
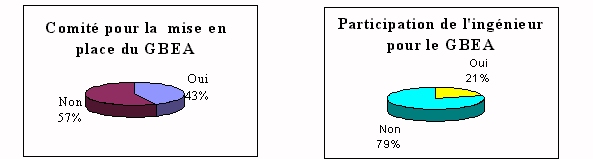
Malgré le
décret d'application du GBEA (Journal Officiel du 4
décembre 1994) applicable au 1er janvier 1995, peu
d'établissement ont instauré un comité de
pilotage de ce guide. Ce qui oblige donc 57% des laboratoires
à fonctionner en autonomie. De plus dans ces cas là,
80% n'ont aucune aide de l'ingénieur biomédical qui
d'ailleurs participe très peu aux comités de pilotage.
Les raisons évoquées sont les suivantes
w
Sur organisation interne du laboratoire,
w
Par oubli de la part des biologistes,
w
Selon un choix de la direction,
w
Démarche autonome des biologistes qui appellent si ils
ont besoin d'un expert,
w
Par manque de temps,
w
Les biologistes ne pensent pas à la
nécessité de la chose.
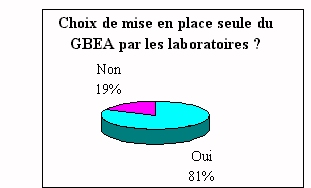
|
Dans le cas des laboratoires qui mettent seul en place le
GBEA, ils sont confrontés à la
complexité des procédures, au planning ainsi
qu'à l'achat de nouveaux équipements.
Dans le cas des comités de pilotage, les
laboratoires mettent en commun leurs connaissances,
compétences et évitent la redondance de
travail (procédure, mode opératoire,
contrôles qualité...). Il est vrai que bien
souvent les laboratoires ont du matériel identique et
un fonctionnement similaire.
|
Dans le cas des comités de pilotage avec participation de
l'ingénieur biomédical, la mise en place est
facilitée par les connaissances de celui-ci sur tout ce qui
concerne :
w Au sujet des
procédures de maintenance de réception et de suivi des
équipements
w Pour l'acheminement des
échantillons,
w En tant que
conseillé sur les priorités au sein du comité du
GBEA. Il fait une analyse de la situation,
w En effectuant des
réunions mensuelles de suivi.
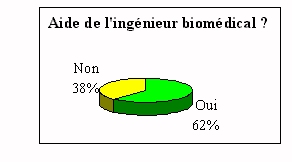
|
La solution est la mise en place d'un comité de
pilotage où tous les laboratoires sont
représentés, associés à un
ingénieur biomédical. Ce qui permettra une
homogénéisation des procédures, un
regroupement des achats pour les équipements de
contrôle de mesure et d'essai et une parfaite
évaluation du coût de mise en place sur tout
l'établissement.
|
ü
Compétences du personnel de laboratoire
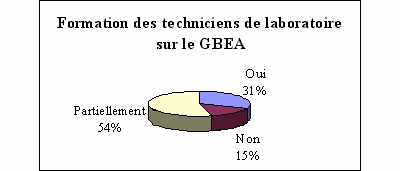
|
Selon les établissements concernés, les
réponses furent très diverses, mais il est
rare (seulement 31% des réponses) que les techniciens
de laboratoire aient suivi une formation adéquate
pour la mise en place d'un tel guide. D'où le
rôle de l'ingénieur biomédical ou de
toute personne compétente.
Une bonne formation,
c'est une bonne application.
|
ü Problèmes
rencontrés par le service biomédical
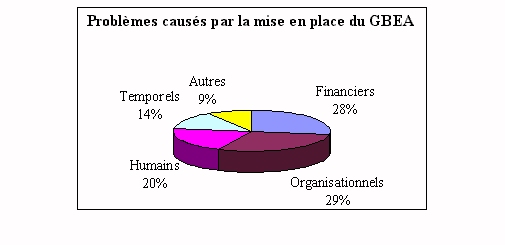
La mise en place d'un tel guide entraîne
en premier lieu des problèmes organisationnels et financiers.
Il est vrai que lorsque le ministère de la Santé a mis
en place ce guide, il n'a prévu aucune aide financière
pour embaucher du personnel supplémentaire ou prévu des
séminaires de formation. Au cours des réponses, il a
été spécifié par certains
ingénieurs que la mise en place entraînait
également des changements de culture au sein du laboratoire,
auxquelles il est parfois très difficile de faire face
(autarcie des laboratoires, conflit de techniciens). De plus, ces
changements demandent l'acquisition de matériel informatique
qui n'a pas toujours été prévu dans le budget
annuel. Il a été très rarement
spécifié qu'il n'y avait aucun problème.
La politique d'économie de la
santé doit peut être s'accompagner, au départ, de
certaines dépenses pour obtenir, par la suite, des
économies liées à une qualité
optimale.
(retour sommaire)
Ä Les
achats
ü L'ingénieur
biomédical et les achats
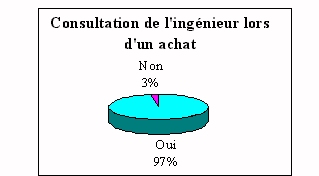
|
L'ingénieur biomédical est donc presque
toujours consulté lors de l'acquisition d'un nouvel
appareil de laboratoire. Ce qui rappelle une de ses
fonctions principales.
Dans la plupart des cas, l'ingénieur
biomédical est consulté pour tous les types de
dispositifs. Certains ont spécifié qu'ils ne
s'occupaient d'équipements que lorsque le prix
était supérieur à 5000 francs, donc
pratiquement pour tous les achats, alors que pour d'autres
seulement pour les achats supérieurs à 20000
francs.
|
Les 3% qui ne sont pas concernés par l'achat, le sont par
un manque de communication et par une exclusion systématique
lors des achats d'un nouveau dispositif.
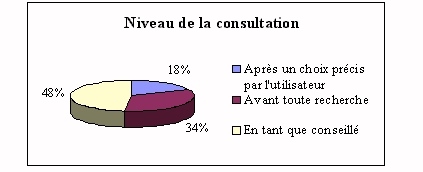
|
Dans la plupart des cas, l'ingénieur est surtout
consulté en tant que conseillé, c'est à
dire après un travail effectué par le
personnel de laboratoire. Mais dans 34% des cas il est
consulté avant toute recherche, ce qui signifie qu'il
va être amené à se renseigner
auprès des fournisseurs pour être au fait des
nouveautés (mais seulement la moitié des
ingénieurs biomédicaux le sont).
|
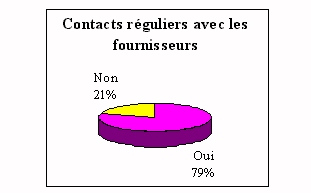
Les moyens d'information sont les salons organisés par
les fournisseurs et les contacts réguliers avec les
commerciaux.

La démarche
paraît difficile puisque les ingénieurs
biomédicaux démontrent un manque d'intérêt
par manque de temps. La contradiction, entre les pourcentages de
participations aux salons et les contacts réguliers avec les
fournisseurs, peut s'expliquer par les contacts
privilégiés en comité plus restreints
(commerciaux, présentation directement chez les
fournisseurs...).
|
Les attentes des futurs utilisateurs doivent être
comblées par un achat adéquate. Il faut donc
que l'ingénieur biomédical ait des
connaissances suffisantes en analyses de laboratoire.
|
|
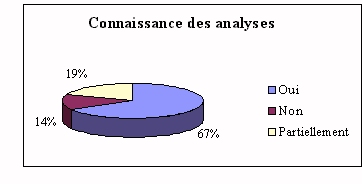
Pour la plupart, leurs connaissances sur les analyses
effectuées sur les automates de laboratoire sont
insuffisantes. Une méconnaissance, partielle ou
totale, ne peut qu'engendrer des problèmes de
compréhension dus au langage technique utilisé
par les biologistes, ce qui peut avoir des
conséquences " graves " sur l'achat.
|
|
Le fait de définir correctement les besoins des
utilisateurs est un acte fondamental, déterminant dans la
réussite du processus d'achat.
L'équipement acheté doit être parfaitement
adapté à l'utilisation réelle du
matériel. S'il est sous-évalué, l'investissement
devra certainement être réitéré
rapidement. S'il est surévalué, il s'agit d'un
gaspillage d'argent. Or seulement dans moins de 60% des cas
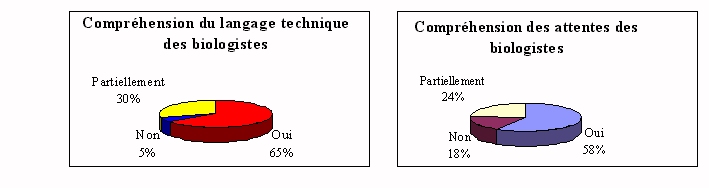
l'ingénieur comprend le langage du biologiste.
Problèmes rencontrés :
w Les techniciens de
laboratoire aident les ingénieurs biomédicaux dans les
explications, car ils comprennent leurs incompréhensions, ce
qui n'est pas fait par les biologistes.
w Il n'est pas sûr que
le choix de l'ingénieur biomédical doit être
très technique, le biologiste est le mieux placé pour
savoir les meilleures qualités d'un automate. Mais
l'ingénieur doit rationaliser les achats avec une bonne vue
d'ensemble pour éviter les doublons.
w Les enjeux ne sont pas
toujours clairs.
Ceux qui rencontrent le moins de
difficultés, sont ceux qui communiquent.
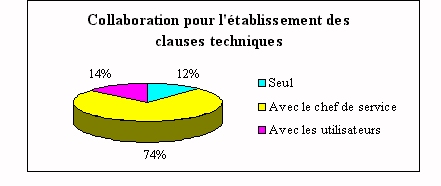
ü
Participation de l'ingénieur
biomédical
|
La consultation de l'ingénieur biomédical
lors d'un achat s'achève par l'établissement
des clauses techniques. Pour cela il travaille dans la
grande majorité des cas avec les utilisateurs. Ceci
est du à son manque de connaissances dans les
analyses et techniques de laboratoires.
|
.
Les 10% qui travaillent seuls, le font car ils sont
spécialisés dans ce domaine
|
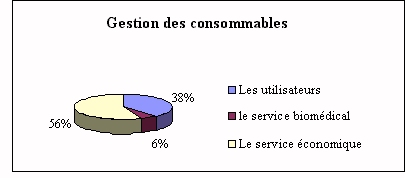
Par contre, la gestion des consommables les concerne peu.
Souvent, les dépenses sont prévues lors de
l'achat du nouvel appareil et la gestion assurée par
les utilisateurs du laboratoire sous la tutelle de la
direction économique.
|
(retour sommaire)
Ä La
fonction maintenance
ü La maintenance préventive
|
Ces faibles pourcentages, à une exception
près, peuvent s'expliquer par le fait de la
complexité des automates de laboratoire ou par le
manque d'intérêt de ce service (manque de
formations et d'informations).
Ces chiffres, sont soit le fait qu'il n'assure qu'une
partie de la maintenance partielle et seulement sur les gros
automates, soit le fait de nombreux contrats de maintenance
passés entre les fournisseurs et le service
biomédical (la complexité de certains
appareils peut pousser le service biomédical à
conclure de nombreux contrats de maintenance avec les
fournisseurs ayant des techniciens spécialisés
selon le type d'appareils).
|
Les raisons sont :
w La rapidité de
l'intervention, surtout pendant les heures
ouvrés,
w Ceci permet un contact plus
direct et il y a un certain manque de compétences au sein du
service biomédical en ce qui concerne les
laboratoires,
w Ceci est du à un
manque de temps,
w Les fournisseurs ont
prévu des contrats tous risques, et les compétences des
biomédicaux sont trop faibles,
w A cause du
peu d'interventions du service biomédical au sein des
laboratoires.
Le choix des contrats de maintenance externe est
décidé à 75% par l'ingénieur
biomédical. Dans 4% des cas seul la direction et le service
économique interviennent. Les 21% restant sont des contrats
directement négociés entre le fournisseur et le
laboratoire.
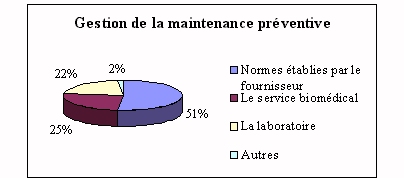
Quand le service biomédical intervient dans la maintenance
préventive (un quart de la gestion) c'est par rapport aux
compétences des utilisateurs ou selon les normes
établies par le fournisseur. D'où l'importance de la
documentation technique du fournisseur qui doit être fournie
lorsqu'il livre un nouveau dispositif au sein d'un laboratoire.
|
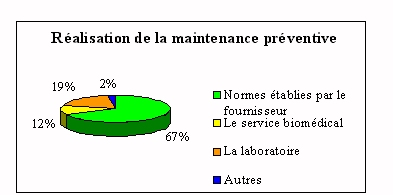
On retrouve ici l'importance du fournisseur qui
réalise plus de 65% de la maintenance
préventive. Le laboratoire intervient sur la
maintenance préventive essentiellement pour des
petits appareils et seulement si des personnes ont les
compétences et sont aptes à le faire.
|
|
Il nous a été signalé que la
maintenance préventive se faisait parfois selon la
situation budgétaire. De telles contraintes
deviennent dangereuses quant à la fiabilité du
rendu de résultats.
Un Résultat = Un
Patient
|
ü
Dysfonctionnement d'un appareil
|
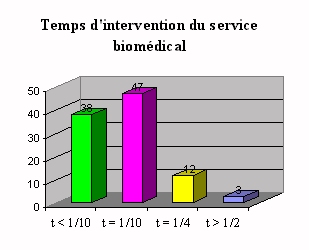
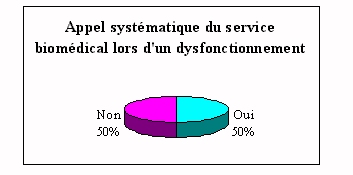
Pour 50% des cas, le laboratoire fait appel au service
après vente du fournisseur (contrat de
maintenance).
|
Dans le cas où le service biomédical intervient , il
doit parfois faire face à de nombreux problèmes de
maintenance. Les principaux problèmes évoquées
par les ingénieurs biomédicaux ont été
:
w La technicité des
utilisateurs,
w Non respect de la
quantité des interventions préventives,
w Problème de la
compétence des intervenants,
w Révolution
culturelle due à la mise en place du GBEA,
w Manque
d'effectif,
w Manque de formations et de
connaissance sur le fonctionnement des
équipements,
w Une disponibilité
des équipements de laboratoire réduite pour la
maintenance préventive,
w Problème de stockage
et de livraison des pièces
détachées,
w Manque
d'équipements, de contrôle, de mesure et
d'essais,
w Trop peu d'intervention sur
les automates de laboratoire, donc cette rareté entraîne
un manque de compétence,
w Trop grande
diversité des équipements,
w Quelques mauvaises
surprises pour les automates sans contrat, mais ceci est heureusement
rare,
w Manque de
disponibilité du personnel,
w Pas plus de problème
qu'avec les autres services.
Toutes ces remarques mettent en évidence la
diversité des problèmes que peuvent rencontrer un
service biomédical au sein des laboratoires. L'idéal
serait la mise à disposition de techniciens ou adjoints
techniques biomédicaux spécialisés dans ce
domaine. Ils assureraient la gestion des pièces
détachées, leur stockage, ainsi que la gestion des
équipements de contrôle de mesure et d'essais (manque et
patrimoine) afin de mener à bien la maintenance
préventive ou curative.
Rare sont ceux qui reconnaissent que le laboratoire ne pose pas
plus de problèmes qu'un autre service (radiologie,
hémodialyseÖ).
(retour sommaire)
Ä La
fonction maintenance
ü La qualification à
réception
|
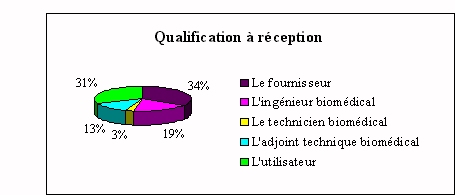
Le fournisseur et l'utilisateur sont
généralement ceux qui effectuent l'état
de recette lors de l'installation d'un nouvel appareil de
laboratoire. Dans cette étape il s'agit de
vérifier que l'appareil qui vient d'être
livré correspond bien à toutes les clauses
spécifiées dans le cahier des
charges.
|
Bien souvent l'utilisateur ne connaît pas
exactement les clauses techniques définies lors de l'achat et
ses compétences restent restreintes en la matière.
Les réponses de certains ingénieurs biomédicaux
sont restées très vagues face au terme " état de
recette " qui leur est inconnu. Les 89% qui n'interviennent pas lors
de l'installation, évoquent les problèmes suivants
:
w Contact après
période probatoire,
w L'ingénieur
biomédical n'intervient que dans la conformité à
la commande,
w Choix entre les
laboratoires et la direction,
w L'ingénieur
biomédical et son service ne sont pas plus compétents
que les utilisateurs,
w Manque de
disponibilité de l'ingénieur biomédical, charge
de travail trop importante et les critères analytiques sont
trop poussées.
Ceux qui interviennent le font au niveau de la conformité
de la commande lors de son envoi et n'ont donc aucune implication
lors de l'arrivée d'un nouvel automate.
Toutefois le rapport techniciens - techniciens est encore mis en
avant dans la répartition des compétences donc des
tâches.
ü La
qualification opérationnelle
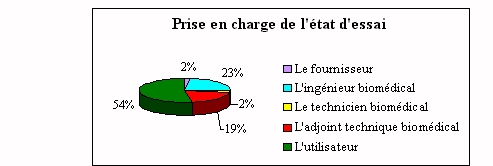
L'ingénieur
biomédical est peu concerné par la qualification
opérationnelle par rapport à l'utilisateur qui
l'effectue dans plus de la moitié des cas. En effet,
même si l'utilisateur n'est pas la plus
spécialisé pour la qualification d'un dispositif c'est
lui qui le connaît le mieux. L'idéal serait que
l'état d'essai se fasse en collaboration (ingénieur
biomédical et utilisateur) pour un échange des
connaissances.
(retour sommaire)
Ä
Intervention dans les laboratoires
A travers les questions précédentes, la plupart des
ingénieurs biomédicaux interviennent pas ou peu, dans
les laboratoires.
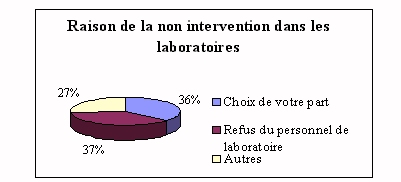
Ceci peut s'expliquer par différentes raisons :
w Manque de
temps.
w Problèmes humains
difficilement accessibles aux biomédicaux. Les biologistes
pensent que leurs techniciens sont plus compétents que les
biomédicaux.
w Les biologistes pensent
posséder toute la partie technique.
w Manque d'informations et de
formation sur les techniques utilisées en biologie et sur
leurs caractéristiques.
w Problèmes de
vocabulaire et de connaissance.
w Problème avec le
directeur du service économique qui change d'avis tous les
jours.
w Manque d'informations sur
la vie des laboratoires.
w Trop grande
diversité des matériels au sein des nombreux
laboratoires.
Les causes de ces problèmes sont donc très diverses.
Il en ressort surtout, des problèmes d'informations et de
connaissances sur les différentes techniques utilisées
dans les laboratoires, ce qui créés des
problèmes de langage entre les deux services. Il ne faut pas
négliger les problèmes humains et relationnels entre
les biologistes et les biomédicaux, qui préservent
chacun leurs acquis en établissant un fossé entre leur
deux secteurs d'activité.
(retour sommaire)
Ä Les
formations
Les réponses
obtenues par le questionnaire, mettent en évidence une faible
implication des ingénieurs biomédicaux dans les
laboratoires. Ils sont pourtant souvent amenés à
apporter leur contribution de part leur fonction initiale.
Pourtant leur manque de connaissance sur les différents
types de réactions, d'analyses et de langage biologique est un
obstacle à leur implication. Le même problème se
pose pour les techniciens ou adjoints techniques biomédicaux
qui sont amenés à assurer la maintenance des appareils
dans les laboratoires.
Il apparaissait donc nécessaire, d'analyser ces
problèmes en remontant à la source, c'est à dire
leur formation initiale et en étudiant l'évolution de
leur parcours grâce aux formations suivies au cours de leur
carrière.

L'analyse de l'histogramme démontre que 60% des
ingénieurs en poste dans des établissements de soins
publics proviennent de l'université de Compiègne.
La majorité est
issue du cycle Ingénieur Biomédical Hospitalier
(IBMH). Ce cursus comprend trois semaines de cours sur les
laboratoires pour une durée de formation pratique et
théorique de six mois.
Les DESS "
Technologies Biomédicales Hospitalières " de
Compiègne représentent 25% de l'effectif total des
réponses. Ils ont reçu environ 40 heures d'enseignement
(pour un total de 450 heures) consacrés aux laboratoires. Ces
heures concernent, les analyses en microbiologie, biologie cellulaire
et moléculaire, biochimique, les réactions chimiques et
enzymatiques ainsi que les principes en hématologie et
hémostase.
Les 40 autres pour-cent se répartissent sur plusieurs
filières telles que :
Le Centre National
des Arts et Métiers (CNAM) ne propose aucun cycle vraiment
destiné à la formation d'ingénieurs
biomédicaux hospitaliers. Il propose une formation pour
ingénieur en génie biologique en suivant le cycle
sciences chimiques biologiques et nucléaires où aucune
heure sur les laboratoires n'est prévue, mais par contre des
cours sur la chimie, la biologie et la biochimie.
L'Institut National
des Sciences Appliquées (INSA) en génie biochimique
possède des enseignements sur la biologie appliquée
(génie biochimique, enzymatique, biochimie, génie
génétiqueÖ) et la biologie moléculaire
appliquée (ADN synthétique et ses applicationsÖ),
immunologie et antibiotiques. Si cette formation est complète
dans le domaine de la biologie, elle reste très superficielle
dans le domaine du biomédical.
L'Institut
Catholique des Arts et Métiers (ICAM) de Lille, "
mastère en ingéniérie biomédicale "
propose des enseignements en biochimie, cytologie, embryologie,
immunologie, bactériologie et virologie et sur la
certification des laboratoires. Le biomédical est là
encore négligé.
L'Ecole Nationale
Supérieure de l'Electronique et de ses Applications
(ENSEA) est une formation continue qui propose, entre autre, un
enseignement contenant de la physique, de l'électronique
numérique et analogique, mais ne propose aucune formation en
laboratoire d'analyses.
Pour les techniciens et adjoints techniques biomédicaux les
formations sont encore plus diverses que pour les ingénieurs
biomédicaux. La plupart ont des CAP, des baccalauréats,
BTS ou DUT de maintenance, d'électronique ou
d'électricité. Quelques uns ont un Diplôme
National de Technicien Supérieur (DNTS) en maintenance
biomédicale. Certains ont suivi les formations
complémentaires SPIBH ou SPILAB proposés par
l'université de Compiègne. La formation SPILAB est la
plus apte à former des techniciens spécialisés
dans les laboratoires.
Le Stage de
Perfectionnement à l'instrumentation de Laboratoire (SPILAB)
a pour objectif de faire comprendre aux futurs adjoints
techniques, les méthodes utilisées actuellement dans
les laboratoires et l'intérêt clinique des
paramètres dosés, ainsi que de maîtriser les
équipements concernés. Il est constitué de 3
semaines de cours théoriques et de 12 semaines de stage
pratique.
Le Stage de
Perfectionnement à l'ingénierie Biomédicale
Hospitalière (SPIBH) dont le but est de former des
techniciens supérieurs en Ingénierie Biomédicale
Hospitalière ne prévoit dans son programme aucune heure
destinée aux techniques de laboratoire.
Le Diplôme
d'Etudes Supérieurs Technologies Universitaires (DESTU)
Génie biomédical de Lorient, consacre
environ 78 heures sur 420 heures aux techniques de laboratoire afin
de former des Techniciens supérieurs biomédicaux
spécialisés dans ce domaine.
En général très peu sont
spécialisés dans les laboratoires, ce qui est un
handicap supplémentaire pour que le service biomédical
se sente proche de ce qui se pratique dans ces mêmes
laboratoires.

De plus les ingénieurs biomédicaux ont plus
cherché à sensibiliser les adjoints techniques à
ce guide que les techniciens biomédicaux.
Il apparaît aussi que les ingénieurs
biomédicaux n'ont pas plus souhaité suivre des
formations complémentaires dans le domaine du laboratoire.

Seule l'assurance qualité semble les intéresser
(futur accréditation de tous les établissements de
santé d'ici 2001).
De plus l'allocation d'un budget spécifique à
l'implication du service biomédical n'est pas prévu
dans 70% des cas

Néanmoins, les domaines suscitant l'intérêt
des biomédicaux, seraient : l'élargissement de leurs
connaissances en biologie, l'organisation de la maintenance et
l'automatisation de la phase pré-analytique.
Au manque d'intérêt, d'autres difficultés
viennent se greffer.
- w
Pas le temps, manque de disponibilité,
- w
Ceci mobilise trop d'énergie par rapport à la
structure,
- w
Pas de demande, pas d'occasion,
- w
Pas nécessaire car formation initiale en chimie et
biologie,
- w
Ceci n'est pas prioritaire pour le service biomédical,
car de nombreux matériels sont mis à disposition, et
il y a des contrats tout risque,
- w
Pas nécessaire pour le laboratoire, qui reste
maître des prestations,
- w
Choix des équipements biomédicaux trop restreinte
et l'ingénieur biomédical se concentre sur des
domaines de ses compétences.
Dans la majeure partie des cas, le manque de temps est
évoqué. Pourtant, d'autres, avouent volontiers que leur
intérêt va plutôt vers l'imagerie et le bloc
opératoire. Une autre raison évoqué a
été la prise de poste d'ingénieur
biomédical depuis quelques temps.

Les principales formations ont généralement
été dispensées par des organismes
spécialisés. Il arrive pourtant que des constructeurs
proposent des formations adaptées à leur type de
matériel lors de l'installation de celui-ci.
Les organismes de formations en contact avec les
ingénieurs biomédicaux, sont :
Le Centre d'Etudes et de Formation
Hospitalières de Cahors qui propose des formations sur :
la stérilisation, l'hygiène, l'assurance
qualité, les médicaments et les dispositifs
médicaux, mais aucune n'est spécifique aux
laboratoires.
L'Alliance pour le Génie Biologique
et Médical ne connaît aucun organisme de formation
proposant des stages d'approfondissement des connaissances sur les
techniques de laboratoire.
Il semble donc que seuls les fournisseurs proposent des stages de
formation spécifiques. Ces stages peuvent être
prévus dès l'établissement du cahier des
charges.
III.3. Conclusion
Après analyse
des réponses du questionnaire, il apparaît que le
service biomédical a encore de grandes difficultés
à s'impliquer dans la vie des laboratoires. Plus de 20% des
services biomédicaux ne sont pas concernés par leur
fonctionnement et 30% ne le sont que très partiellement.
Pour les 50% restant, l'implication n'est que très rarement
totale. Sachant que dans le cas les Centres Hospitaliers qui
disposent de plusieurs ingénieurs biomédicaux, la mise
en place d'un ingénieur biomédical compétent
dans les laboratoires a grandement facilité les
échanges entre ces deux entités.
Cette implication pourrait sûrement être
améliorée par des formations plus adaptées. Il
est vrai que les formations initiales des ingénieurs
comprennent rarement des modules conséquents en biologie et
que les formations par les organismes sont rarement orientées
dans cette direction.
Les fournisseurs restent donc les seuls personnes aptes à
former l'ingénieur dans ce domaine d'activité à
partir du moment où celui-ci en fait la demande.
(retour sommaire)
L'apparition du GBEA a
donc obligé les laboratoires à prendre conscience de
problèmes sous-jacents à tous les points de vue de leur
fonctionnement . L'analyse de ces problèmes montrent que deux
secteurs sont difficiles à appréhender de part leur
complexité et leur niveau technique. La maintenance, qui ne
peut être prise en charge que par les services
biomédicaux ou par les fournisseurs et la qualification du
matériel qui ne peut être envisagée que sous
forme de partenariat. De plus, le personnel de laboratoire ne
possède pas toutes les compétences et les structures
pour gérer ces secteurs et préfère porter toute
son attention sur la biologie pure.
La mise en place du GBEA est donc un travail de longue haleine qui
nécessite une collaboration efficace de tous les acteurs
hospitaliers.
La politique gouvernementale d'économie de santé
oblige de nombreux directeurs hospitaliers à se donner des
priorités qui passent obligatoirement par une étude des
dépenses. Dans cette démarche les laboratoires
représentent un enjeu économique important
(consommables, personnel, organisation...) et si des économies
peuvent être faites à ce niveau ce ne sera que par
l'intermédiaire d'une démarche qualité
optimale.
C'est pourquoi le partenariat avec les ingénieurs
biomédicaux est nécessaire. Mais à ce jour cette
collaboration n'est appliquée que dans 50% des Centres
Hospitaliers Publics. Les problèmes rencontrés sont
divers, mais tous essentiels (contacts délicats,
priorités sont ailleurs, compétences trop restreintes
dans ce domaine, aucun échange d'informations...).
Ils ne sont pas nouveaux mais bien réels depuis
l'apparition du GBEA.
Dans l'état actuel des choses, les ingénieurs
biomédicaux doivent se former plus spécifiquement
à la biologie pour devenir des partenaires efficaces. Il faut
donc que les écoles réorganisent leurs enseignements et
laissent une place plus grande aux laboratoires. Il en est de
même pour les organismes de formations.
La solution réside peut être aussi, dans une
communication plus constructive entre les biologistes et les services
biomédicaux. N'oublions pas que les deux possèdent un
bagage technique et que des échanges de formations peuvent
être envisageables au sein de leur établissement.
C'est pourquoi il apparaît essentiel que l'analyse du
questionnaire soit retransmise à tous les ingénieurs
biomédicaux qui se sentent concernés par ces
problèmes.
Pour que la santé
avance, il faut se donner des moyens qui passent parfois par le
dialogue.
SOMMAIRE
Vocabulaire international des termes fondamentaux et
généraux de métrologie-norme NF X 07 001
Critères généraux concernant le
fonctionnement de laboratoires d'essais-norme EN 45001
ð Dérive :
Variation lente d'une caractéristique métrologique d'un
instrument de mesure.
ð Essai :
Opération technique qui consiste à
déterminer une ou plusieurs caractéristiques ou la
performance d'un produit, matériau, équipement,
organisme, phénomène physique, processus ou service
donné, selon un mode opératoire spécifié.
Le résultat d'un essai figure ordinairement dans un document
parfois appelé rapport d'essai ou certificat d'essai.
ð Etalonnage :
Ensemble des opérations établissant dans des
conditions spécifiées, la relation entre les valeurs
indiquées par un appareil de mesure ou un système, ou
les valeurs représentées par une mesure
matérialisée ou un matériau de
référence, et les valeurs correspondantes d'une
grandeur réalisée à des repères sur des
échelles arbitraires.
Le résultat d'un étalonnage permet d'estimer les
erreurs d'indication de l'appareil de mesure, du système de
mesure ou de la mesure matérialisée, ou d'attribuer des
valeurs à des repères sur des échelles
arbitraires.
ð Exactitude des
mesures : Etroitesse de l'accord entre le résultat d'un
mesurage et la valeur vraie ou la meilleure estimation de la valeur
conventionnellement vraie. L'exactitude fournit une indication sur
les erreurs systématiques car elle est calculée avec la
valeur moyenne des résultats de mesure.
ð
Fidélité d'un instrument de mesure : Aptitude d'un
instrument de mesure à donner des indications très
voisines lors de l'application répétée d'une
même valeur dans les mêmes conditions de mesure.
ð Justesse d'un
instrument de mesure : Aptitude d'un instrument de mesure
à donner des indications exemptes d'erreur
systématique.
ð Maintenance
préventive : Ensemble des actions
déclenchées suite à un constat de
dégradation d'un organe ou d'un équipement qui remplit
toujours sa fonction. Cette activité occasionne ou non une
immobilisation de l'équipement par rapport à la
production. Ces actions de maintenance systématiques ou
conditionnelles sont inscrites de manière volontaire et
maîtrisées.
Maintenance de niveau un : correspond aux réglages
simples ou échanges de consommables prévus par le
constructeur, sans démontage et en toute
sécurité.
ð
Répétabilité des résultats de mesurage :
Etroitesse de l'accord entre les résultats des mesurages
successifs effectués dans la totalité des mêmes
conditions de mesure. Les conditions dites conditions de
répétabilité comprennent : - même mode
opératoire - même observateur - même lieu -
répétition durant une courte période de temps -
même instrument de mesure utilisé dans les mêmes
conditions (même équipement et mêmes
réactifs en biologie).
ð
Reproductibilité des résultats de mesurage :
Etroitesse de l'accord entre les résultats des mesurages
successifs effectués en faisant varier les conditions de
mesure. Pour qu'une expression de la reproductibilité soit
valable, il est nécessaire de spécifier les conditions
que l'on fait varier. Les conditions peuvent comprendre : - principe
de mesure méthode de mesure - observateur - instrument de
mesure - étalon de référence - lieu - conditions
d'utilisation - temps.
ð
Traçabilité : Propriété du
résultat d'un mesurage ou d'un étalon tel qu'il puisse
être relié à des références
déterminées, généralement des
étalons nationaux ou internationaux, par
l'intermédiaire d'une chaîne ininterrompue de
comparaisons (chaîne de raccordement aux étalons) ayant
toutes des incertitudes déterminées.
(retour sommaire)
ð AFS : Agence
Françaice du Sang.
ð CNEH :Centre
National d'Expertise Hospitalière.
ð EFS :
Etablissement de Transfusion Sanguine.
ð ETS AP-HP :
Etablissement de Transfusion Sanguine de l'Assistance Publique
Hôpitaux de Paris.
ð GBEA : Guide de
Bonne Exécution des Analyses.
ð HAV : Virus de
l'Hépatite A.
ð HBV : Virus de
l'Hépatite B.
ð HCV : Virus de
l'Hépatite C.
ð HIV :
Hépatite Immunodéficience Virus.
ð HLA : Human
Leucocyt Antigen.
ð HTLV :Human
T-cell Lymphotropic Virus.
(retour sommaire)
- (1) " Méthodes et outils pour résoudre un
problème " ; Alain- Michel Chauvel. Edition
Dunod.
- (2) " Maintenance et assurance de la qualité " ;
Yves Lavinal ñ Erick Perruche. Les éditions
d'organisation.
(retour paragraphe)
(3) " L'enquête et assurance de la qualité
" ; Claude Javeau. Edition de l'université de
Bruxelles.(retour paragraphe)
ð Normes AFNOR :
- ISO 8402 : Management de la qualité et assurance
de la qualité (vocabulaire).
- NFX 07 001 (1993) : Vocabulaire international des termes
fondamentaux et généraux de
métrologie.
- NF EN 30012-1 (1994) : Exigence d'assurance de la
qualité des équipements de mesure. Confirmation
métrologique de l'équipement de mesure
- EN 29003/ISO 9003 : Systèmes qualité
ñ modèles pour l'assurance qualité en
contrôle et essai final.
ð Cours d'analyses
biologiques ; Mesdames Bourdillon, Labarre, les
Docteurs Darchis, Delavenne, Darnige, et Messieurs Oudet, Sorde,
Laval, Pulvin et Favreau. DESS Technologies Biomédicales
Hospitalières, promotion 98/99.
ð Cours Outils et
Méthodologies en Qualité et Maintenance ;
Messieurs Thibaut et Friedrich. DESS Technologies
Biomédicales Hospitalières, promotion 98/99.
(retour sommaire)
Annexe
2 :
Inventaire des 26 sites
transfusionnels AP-HP
Seul est concerné le matériel des différents
laboratoires internes à la transfusion sanguine de
l'AP-HP.
Ce matériel a été répertorié
selon la désignation CNEH.
|
Désignation
|
Quantité
|
|
Agitateurs
|
247
|
|
Amplificateurs d'ADN
|
11
|
|
Analyseur d'images microscopiques
|
1
|
|
Analyseurs / colorimètres
|
4
|
|
Analyseurs multi-paramétriques
|
8
|
|
Analyseurs pour immunochimie
|
42
|
|
Automates à groupes sanguins
|
8
|
|
Automates de coagulation
|
4
|
|
Automates de préparation - distribution
|
65
|
|
Automates pour numération formule sanguine
|
10
|
|
Bains thermostatés
|
81
|
|
Balances de laboratoire
|
98
|
|
Caméra Ampli Photographique
|
1
|
|
Centrifugeuses
|
268
|
|
Chambres froides 4°
|
200
|
|
Chromatographe en phase liquide
|
1
|
|
Congélateurs à -20°
|
205
|
|
Congélateurs à -80°
|
76
|
|
Cuve à ultrason
|
1
|
|
Cuves générateurs pour
électrophorèse
|
17
|
|
Diluteurs
|
4
|
|
Eclairages opératoires
|
2
|
|
Enceinte anaérobie
|
1
|
|
Etuves
|
68
|
|
Hottes de laboratoire
|
55
|
|
Incubateurs
|
93
|
|
Instrumentation chirurgicale
|
12
|
|
Irradiateurs UVA / UVB
|
5
|
|
Laveurs de cellules
|
49
|
|
Lecteurs de plaques photostimulables
|
3
|
|
Microscopes
|
118
|
|
Négatoscopes
|
2
|
|
Onduleur
|
6
|
|
Osmomètre
|
1
|
|
Petit matériel de laboratoire
|
Environ 1000
|
|
pH mètre
|
17
|
|
Photothérapie par UV
|
5
|
|
Pipettes électroniques
|
79
|
|
Pompe à membrane
|
1
|
|
Pompes à perfusion
|
5
|
|
Pousse seringues
|
3
|
|
Réchauffeurs de poche à sang
|
25
|
|
Soudeuses de sachet
|
96
|
|
Spectrophotomètre d'absorption
|
5
|
|
Spectrophotomètres d'émission atomique
|
3
|
|
Stérilisateur par chaleur sèche
|
3
|
|
Total
|
3009
|
(retour paragraphe)
(retour sommaire)
Annexe
3 :
Qualification à
réception d'un incubateur de microplaques
IPS
A. Instructions de
contrôle qualité.
Ä
Déballage et installation
Compléter sur la fiche de résultats, les cases :
- nom du technicien,
- date du contrôle,
- signature.
ü Vérifier sur le carton
d'emballage les informations suivantes et les noter sur la fiche de
résultats :
- état du carton,
- code SDP de l'appareil,
- n° de série de
l'appareil.
ü Ouvrir le carton et sortir
l'appareil.
ü Disposer l'appareil sur une
table horizontale, à proximité d'une prise
d'alimentation électrique (deux pôles + terre).
ü Vérifier la
concordance entre les renseignements relevés sur le carton et
ceux se trouvant sur l'appareil, et compléter la fiche de
résultats.
ü Vérifier la
correspondance entre la présence des élèments
dans le carton et le contenu de la " packing list "
référence.
ü Vérifier visuellement
l'aspect de l'appareil (tâches, rayures, défauts..)
ü Installer l'appareil, en
suivant les instructions d'installation de l'appareil
référence.
Ä
Contrôle de la température dans la
microplaque
ü
Préparer la microplaque :
ü Mettre 200µl d'eau
distillée dans toutes les cupules de la microplaque à
l'aide de la pipette, coller un film adhésif sur la
microplaque.
ü Faire un trou dans le film au
niveau de la cupule E6.
ü Mettre la sonde thermique
dans la cupule sans toucher les parois ni le fond de cette
dernière.
ü Fixer la sonde thermique
à l'aide de ruban adhésif.
ü Connecter la sonde à
l'indicateur de température.
ü
Contrôle de la température :
ü Placer la microplaque,
équipée de la sonde thermique, à l'emplacement
avant gauche de l'IPS.
ü Connecter l'appareil au
secteur.
ü Commencer l'acquisition des
températures et mettre l'incubateur sous tension en même
temps ; la température de l'afficheur doit s'allumer. Dans le
cas contraire, le contrôle sera considéré comme
défaillant. Se reporter au chapitre " Appareil refusé
lors du contrôle qualité ".
ü Appuyer sur le bouton "
Contrôle/Adjust " pour vérifier la température de
consigne (en général 40°C).
ü Attendre 60 minutes.
ü Relever la température
indiquée sur l'indicateur de température.
ü Noter sur la fiche de
résultats, la valeur affichée par l'appareil.
Ä
Contrôle de la température du plateau
Ce contrôle est facultatif. Il ne sera réalisé
que sur demande spécifique de la part d'un client interne ou
externe à Sanofi Diagnostics Pasteur.
ü Placer la sonde thermique au
milieu de l'emplacement avant gauche de l'IPS.
ü Fermer le couvercle de
l'appareil.
ü Connecter l'appareil au
secteur.
ü Commencer l'acquisition des
températures et mettre l'incubateur sous tension ; la
température de l'afficheur doit s'allumer. Dans le cas
contraire, le contrôle sera considéré comme
défaillant. Se reporter au chapitre " Appareil refusé
lors du contrôle qualité ".
ü Appuyer sur le bouton "
Contrôle pour vérifier la température de
consigne.
ü Attendre 60 minutes.
ü Noter sur la fiche de
résultats, la valeur affichée sur l'appareil.
ü Ce contrôle peut
être fait sur l'ensemble des trois autres plots sur demande
spécifique.
B. Critères
d'acceptation
Ä Température dans la cupule
Le contrôle sera considéré comme conforme si
la température lue sur l'indicateur est comprise entre la
température de consigne + ou ñ0.5°C, pour une
température de consigne comprise entre 37°C et 42°C
:
|
Température de consigne
|
Température de l'afficheur
|
Température dans la cupule
|
|
37°C
|
37°C ± 0.5°C
|
37°C±0.5°C
|
|
40°C
|
40°C ± 0.5°C
|
40°C ± 0.5°C
|
Ä
Température du plateau
Le contrôle sera considéré comme conforme si
la température lue sur l'indicateur est comprise entre la
température de consigne + 3°C ou ñ0.5°C, pour
une température de consigne comprise entre 37°C et
42°C :
|
Température de consigne
|
Température de l'afficheur
|
Température dans la cupule
|
|
37°C
|
37°C ± 0.5°C
|
37°C±0.5°C
|
|
40°C
|
40°C ± 0.5°C
|
43°C ± 0.5°C
|
Si ces critères ne sont pas respectés, se
reporter au chapitre " Appareil refusé lors du contrôle
qualité.
C.
Désinstallation / Remballage
Ä
Désinstallation
ü Mettre l'appareil hors
tension.
ü Débrancher le cordon
secteur.
Ä
Remballage
ü Vérifier visuellement
l'aspect de l'appareil.
ü Emballer l'appareil dans un
sac plastique.
ü Replacer l'appareil dans son
carton d'emballage.
ü Avant de refermer le carton,
vérifier la présence des éléments.
ü Refermer le carton.
D. Appareil
refusé lors du contrôle
qualité
Ä
Rejet d'un appareil lors d'un contrôle de réception
(provenant directement du fournisseur)
Ne pas mettre l'appareil concerné, ni ceux appartenant
au même lot de livraison en stock, à l'exception des
instruments ayant passé avec succès le contrôle
qualité.
Avertir le fournisseur et le support technique, en leur adressant
un rapport concernant les motifs de rejet. En fonction des
réponses du fournisseur ou du support technique :
- Contacter un technicien SAV pour remise en état.
- Retourner l'appareil au fournisseur pour remise en
état.
Ä
Rejet d'un appareil après réparation (provenance
du SAV)
Ne pas mettre l'appareil concerné en stock.
Avertir le support technique et le SAV, en leur adressant un
rapport concernant les motifs de rejet. Le SAV se chargera de
remettre en état l'appareil concerné. En cas de
problème, contacter le support technique.
(retour
paragraphe)
(retour sommaire)
Annexe
4 :
Fiche de
résultats après qualification à
réception

(retour sommaire)
(retour paragraphe)
Annexe
5 :
Qualification
opérationnelle du laveur microplaques de
Sanofi Diagnostics
Pasteur
Nous vous présentons ici les détails de chaque
étape de vérification.
Ä
Vérification des paramètres du mode "
maintenance "
. Eteindre l'appareil.
. Entrer dans le mode " maintenance ", en appuyant
sur les touches Y, N et l'interrupteur ON.
. Appuyer sur la touche N, lorsque le message " M1
MAINTENANCE " apparaît sur l'écran.
. Vérifier les paramètres de la liste
ci-dessous, en appuyant sur la touche Y ; si ces paramètres ne
sont pas corrects, corriger les en les appuyant sur la touche N ou B,
puis en les validant par la touche Y.
Ä
Vérification des paramètres du mode "
réglage "
. Mettre l'appareil sous tension en appuyant sur
l'interrupteur ON.
. Sélectionner le mode " réglage " en
appuyant sur la touche N, puis le valider en appuyant sur Y.
. Sélectionner la fonction souhaitée en
appuyant sur la touche N, puis la valider sur Y.
. Régler le paramètre de la fonction
souhaitée en utilisant les touches N ou B, puis le valider en
appuyant sur Y ; à la fin du réglage, le logiciel
retourne au menu principal, mode REGLAGE ou mode LAVAGE.
Ä
Vérification de la position de la microplaque par
rapport au manifold
. Mettre l'appareil sous tension en appuyant sur
l'interrupteur ON.
. Sélectionner le mode " réglage " en
appuyant 3 fois sur la touche N, puis valider par la touche Y.
. Poser une microplaque à fond plat sur le
support.
. Valider la fonction " Réglage plaque ", en
appuyant sur la touche Y. Le support de plaque se déplacera
jusqu'à ce que la dernière barrette (n°12) soit
sous le manifold, puis montera jusqu'à ce que les aiguilles
d'aspiration s'approchent du fond et de la paroi droite des cupules.
Soulever légèrement le manifold vers le haut, et
laisser le retomber sous sa propre masse ; il doit tomber librement,
tout en étant le plus près de la paroi droite sans la
toucher.
. Si le réglage n'est pas correct, tourner les deux
vis qui se trouvent sur le côté droit du support de
plaque.
. Le réglage terminé, appuyer sur l'une des
trois touches, Y, N, B, ou attendre que le support revienne à
sa position initiale, au bout de 1 mn.
Ä
Vérification da la position horizontale du
manifold.
. Déplacer manuellement le support de microplaque
jusqu'à ce que les aiguilles d'aspiration du manifold viennent
affleurer le côté gauche de la surface supérieure
du bac de rinçage
. Vérifier que l'espace défini par les deux
extrémités du manifold et la surface supérieur
du bac de rinçage est constant. Si ce n'est pas le cas
desserrer les deux vis du support de manifold et orienter
celui-ci.
. Eteindre l'appareil en appuyant sur l'interrupteur
OFF.
Ä
Vérification des paramètres du mode " Lavage
"
. Remplir le flacon RINSE avec litres d'eau
distillée.
. Programmer un test n°x (x=1à19) avec les
paramètres suivants en sélectionnant le mode
paramètre de lavage 2 fois Y :
- Procédure de base : 82
- Mode plaque
- Temps de contact : 02
- Temps de lavage de fond : 05
- Rincer l'appareil, pour mettre la bouteille RINSE sous
pression
- Prendre le récipient
- Tarer ce récipient sur la balance
- Oter le récipient
- Placer le manifold au-dessus du récipient ; les aiguilles
d'aspiration ne doivent pas être en contact avec le liquide
distribué
- Lancer le test n°x pour 3 cycles et 12 barrettes
- Peser le récipient. La masse mesuré doit
être entre 270g et 330g.
Si le volume n'est pas correct tourner la vis Allen qui se trouve
sur la face latéral du fluide connector mâle ou tourner
la vis qui se trouve dans le bloc fluidique.
- Repérer le réglage après chaque
modification.
Ä
Vérification et réglage de la position
d'overflow (ou trop plein)
. Remplir la bouteille Wash de solution de lavage SDP
R2.
. Rincer l'appareil en lançant un RINSE.
. Lancer le test n°x en sélectionnant 1 cycle sur 12
strips.
. Arrêter l'appareil en appuyant sur la touche STOP à
la fin de la distribution de la 12ème strip.
. Vérifier le niveau du ménisque dans les cupules.
Le ménisque de la solution distribuée, doit être
très légèrement supérieur au haut de la
cupule. Si ce n'est pas le cas, modifier la valeur du
paramètre M6 POS. TROP PL. Dans le mode " maintenance "
(retour paragraphe)
(retour sommaire)
Annexe
6 :
Fiche d'intervention
après qualification opérationnelle

(retour sommaire)
(retour paragraphe)
Annexe
8 :
Audit
interne
|
|
Mot clé
|
Secteur
|
Sous -secteur
|
Question
|
Vraie
|
Plutôt vraie
|
Plutôt fausse
|
Fausse
|
|
1
|
Achat
|
LA"
|
LM""
|
Lors de l'achat d'un matériel, participez-vous
à l'établissement du cahier des charges?
|
|
|
|
|
|
2
|
Achat
|
LA
|
LM
|
Vérifiez-vous la conformité de la livraison
d'un nouvel appareil?
|
|
|
|
|
|
3
|
Achat
|
LA
|
LM
|
A l'installation du matériel, un état de
recette est il effectué par rapport au cahier des
charges?
|
|
|
|
|
|
4
|
Achat
|
LA
|
LM
|
Le nouveau matériel est il mis en route par le
fournisseur avec les utilisateurs?
|
|
|
|
|
|
5
|
Qualification
|
LA
|
LM
|
Des procédures de qualification de vos appareils
existent elles?
|
|
|
|
|
|
6
|
Qualification
|
LA
|
LM
|
Si vous procédez vous même à la
qualification des appareils, avez vous le matériel
adapté?
|
|
|
|
|
|
7
|
Qualification
|
LA
|
LM
|
Le matériel servant à la qualification est
il conforme aux normes ISO ou à celles du
constructeur?
|
|
|
|
|
|
8
|
Qualification
|
LA
|
LM
|
Assurez vous la traçabilité des
qualifications?
|
|
|
|
|
|
9
|
Qualification
|
LA
|
LM
|
Cette traçabilité est elle
archivée?
|
|
|
|
|
|
10
|
Validation
|
LA
|
LM
|
Des procédures de validation de vos appareils
existent elles?
|
|
|
|
|
|
11
|
Validation
|
LA
|
LM
|
Avant d'utiliser vos appareils, procédez vous
à un contrôle de fonctionnement?
|
|
|
|
|
|
12
|
Validation
|
LA
|
LM
|
Lorsque vous effectuez les contrôles de vos
appareils la fréquence est elle définie?
|
|
|
|
|
|
13
|
Validation
|
LA
|
LM
|
Assurez vous la traçabilité de vos
contrôles?
|
|
|
|
|
|
14
|
Validation
|
LA
|
LM
|
La traçabilité des contrôles est elle
archivée?
|
|
|
|
|
|
15
|
Validation
|
LA
|
LM
|
Vos appareils de contrôle sont ils
périodiquement vérifiés?
|
|
|
|
|
|
16
|
Validation
|
LA
|
LM
|
En cas de dysfonctionnement, prenez vous
systématiquement des mesures correctives?
|
|
|
|
|
|
17
|
Validation
|
LA
|
LM
|
Disposez vous d'une procédure décrivant la
conduite à tenir en cas de dysfonctionnement?
|
|
|
|
|
|
18
|
Maintenance
|
LA
|
LM
|
Est il prévu une procédure gérant la
maintenance de vos appareils?
|
|
|
|
|
|
19
|
Maintenance
|
LA
|
LM
|
Avez vous un registre de maintenance pour tous vos
appareils?
|
|
|
|
|
|
20
|
Maintenance
|
LA
|
LM
|
Les registres de maintenance sont ils
archivés?
|
|
|
|
|
|
21
|
Maintenance
|
LA
|
LM
|
Après chaque maintenance, préventive ou
curative, effectuez vous une qualification de vos
appareils?
|
|
|
|
|
|
22
|
Maintenance
|
LA
|
LM
|
Possédez vous un stock de pièces pour les
maintenances de niveau un?
|
|
|
|
|
|
23
|
Maintenance
|
LA
|
LM
|
Vos appareils disposent ils d'une fiche de vie?
|
|
|
|
|
|
24
|
Formation
|
LA
|
LM
|
Le personnel est il formé à l'utilisation
du matériel?
|
|
|
|
|
|
25
|
Formation
|
LA
|
LM
|
Le personnel est il formé pour procéder aux
étapes de validation et qualification des
appareils?
|
|
|
|
|
|
26
|
Documentation
|
LA
|
LM
|
Laissez vous à la disposition du personnel la
documentation technique du fabricant pour chaque
appareil?
|
|
|
|
|
|
27
|
Hygiène
sécurité
|
LA
|
LM
|
Les utilisateurs ont ils connaissance des règles
de sécurité et d'utilisation des
matériels?
|
|
|
|
|
|
28
|
Hygiène
sécurité
|
LA
|
LM
|
Vos appareils sont ils conformes aux règles
d'hygiène et de sécurité?
|
|
|
|
|
|
29
|
Hygiène
sécurité
|
LA
|
LM
|
Vos appareils sont ils installés dans un lieu
adapté?
|
|
|
|
|
Remarque :
LA signifie "laboratoire d'analyses"
LM signifie "laboratoire
médical"
(retour
sommaire)
(retour
paragraphe)
Annexe
9 :
La qualification en
transfusion sans assistance biomédicale
- (1) La qualification du matériel peut-elle
être assurée par le personnel de laboratoire ?
Oui o Non
o
- (2) Connaissez-vous toutes les normes concernant cette
qualification ?
Oui
o Non
o
- (3) Mettez-vous seul en place le GBEA ?
- Oui o
Non o
4. Si oui , cela pose t'il des problèmes :
- Financiers o
- Organisationnels o
- Humains o
- Temporels o
5. Si non, l'ingénieur biomédical participe t'il
à sa mise en place ?
Oui o
Non o
6. Lors de l'achat d'un dispositif, consultez-vous
l'ingénieur biomédical ?
Oui o
Non o
7. L'établissement des clauses techniques se fait-il
avec votre participation ?
Oui o
Non o
8. Suite à l'achat d'un dispositif, l'installation de
celui-ci s'effectue avec :
- Le fournisseur o
- L'ingénieur biomédical o
- L'utilisateur o
9. Avez-vous mis en place les procédures de :
- Maintenance o
- Validation o
- Qualification o
- Intervention lors d'un dysfonctionnement o
- Traçabilité o
10. Pensez-vous qu'actuellement, l'ingénieur
biomédical vous est indispensable ?
Oui o Non
o
- Pourquoi ?
11. Pensez-vous qu'il s'agit d'un interlocuteur
compétent dans le secteur de le biologie ?
Oui o Non
o
- Pourquoi ?.
12. Vous informe t'il des nouveaux dispositifs médicaux
disponibles sur le marché ?
Oui o Non
o
13. Lors des contacts avec le service biomédical,
rencontrez-vous des problèmes ?
Oui o Non
o
- Si oui, lesquels et pourquoi ?
14. En conclusion, la mise en place d'un ingénieur
biomédical spécialisé pour le laboratoire, vous
semble t'elle nécessaire ?
Oui o Non
o
- Pourquoi ?.
(retour sommaire)
(retour paragraphe)
Annexe
10 :
Rôle de
l'ingénieur biomédical au sein des
laboratoires
I . Organisation
hospitalière
- 1. Nom et adresse du centre hospitalier :
- 2. Nombre de lits :
- 3. Nom du responsable de la cellule biomédicale
:
- 4. Année d'implantation du service
biomédical :
- 5. Nombre d'ingénieurs biomédicaux
:
- 6. Formation initiale des ingénieurs
biomédicaux :
- 7. Nombre de techniciens biomédicaux :
- 8. Formation initiale des techniciens biomédicaux
:
- 9. Nombre d'adjoints techniques biomédicaux
:
- 10. Formation initiale des adjoints techniques
biomédicaux :
-
- II . Le GBEA dans les
laboratoires
11.Types de laboratoires implantés dans l'hôpital
:
- Anatomopathologie o
- Microbiologie o
- Parasitologie ñ Mycologie o
- Biochimie o
- Hormonologie o
- Foetopathologie o
- Pharmacologie o
- Transfusion sanguine o
- Biologie moléculaire o
- Virologie o
- Immuno-hématologie o
- Hémostase o
12.Existe t'il au sein de votre hôpital un comité
de pilotage pour la mise en place du GBEA ? Oui
o Non o
13. Si oui, y participez-vous ? Oui o
Non o
- Si oui, à quel niveau :
14. Si le personnel de laboratoire met seul en place le GBEA,
est ce un choix de leur part ? Oui o
Non o
15. Si oui, leur apportez-vous votre aide ? Oui
o Non o
16. Si non, ont-ils suivi une formation adéquate
?
Oui o Non
o Partiellement o
17. Avez-vous sensibilisés les techniciens
biomédicaux à ce guide ?
Oui o Non
o Partiellement o
18. Avez-vous sensibilisés les adjoints techniques
biomédicaux à ce guide ?
Oui o Non
o Partiellement o
19. La mise en place du GBEA engendre t'elle des
problèmes :
- Financiers o
- Organisationnels o
- Humains o
- Temporels o
- Autres (à préciser) :
III . Les achats
20. L'ingénieur biomédical est-il toujours
consulté lors des achats d'un dispositif médical au
sein des laboratoires ? Oui o
Non o
- Si oui, pour quels types de dispositifs médicaux :
- Si non, pourquoi ?
21. A quel niveau a lieu la consultation ?
- Après un choix précis par l'utilisateur
o £
- Avant toute recherche o
- En tant que conseiller o
22. Par qui se fait la gestion des consommables associés
à un automate ?
- Les utilisateurs o
- Le service biomédical o
- Le service économique o
- Autres
23. L'ingénieur biomédical participe t'il
à l'établissement des clauses techniques :
- Seul o
- Avec le chef de service o
- Avec les utilisateurs o
IV . La fonction
maintenance
24. Estimer le temps total d'intervention du service
biomédical au sein des laboratoires par rapport à la
maintenance des autres activités, au cours d'une année
?
< 1/10 o
1/10 o ¼ o
1/3 o ½ o
25. La maintenance préventive, sa planification et ses
procédures ont été instaurées suivant
:
- Les normes établies par le fournisseur
o
- Le service biomédical o
- Le laboratoire o
- Autres
25 bis. Elle est réalisée suivant :
- Les normes établies par le fournisseur
o
- Le service biomédical o
- Le laboratoire o
- Autres
26. L'archivage des interventions se fait :
- Dans les laboratoires o
- Dans le service biomédical o
27. Le laboratoire fait-il systématiquement appel au
service biomédical lors d'un dysfonctionnement d'un dispositif
médical ? Oui o
Non o
- Si non, qui contacte t'il ?
- Pourquoi
28. Qui fait le choix des contrats de maintenance externe
:
- Le service biomédical o
- L'ingénieur biomédical o
29. Quels problèmes rencontrez-vous lors de vos
interventions de maintenance :
V . La qualification
30. Lors de l'installation d'un nouveau dispositif d
ëanalyses biologiques, la qualification est faite par :
- Le fournisseur o
- Le service biomédical
. l'ingénieur biomédical o
. le technicien biomédical o
. l'adjoint technique biomédical o
- L'utilisateur o
31. Si vous n'intervenez pas dans l'état de recette,
pouvez-vous expliquer pourquoi :
32. Les états d'essai sont pris en charge par :
- Le fournisseur o
- Le service biomédical
. l'ingénieur biomédical o
. le technicien biomédical o
. l'adjoint technique biomédical o
- L'utilisateur o
VI . Les formations
33. Depuis votre prise de poste, avez-vous suivi des formations
destinées au laboratoire (si oui, précisez le nombre de
fois) :
- La maintenance Oui o
Non o Nombre de fois
- La qualification Oui o
Non o Nombre de fois
- L'assurance qualité Oui o
Non o Nombre de fois
34. Quel type de formation était-ce :
- Constructeur o
- Organisme de formation o
- Inter-hospitalières o
- Universitaires o
35. Si vous n'avez suivi aucune formation, pourquoi ?
36. Connaissez-vous les types d'analyses effectués par
les automates et leur utilisation dans les services ? Oui
o Non o
37. Lors des réunions de choix d'équipements
médicaux, comprenez-vous le langage technique utilisé
par les biologistes ? Oui o
Non o
38. Comprenez-vous systématiquement leurs attentes ?
Oui o Non
o
39.
Si non, n'est ce pas gênant lorsque vous
participez à l'achat d'un nouvel automate ?
Oui o
Non
o -
Pourquoi ?
40. Si vous intervenez peu ou pas au sein des laboratoires
:
- Est ce un choix de votre part o
- Un refus du personnel de laboratoire o
41.Lors de vos démarches vis à vis des
laboratoires, quels sont les problèmes que vous rencontrez
(problèmes techniques, humains, manque de formations et
d'informations) :
42. Assistez-vous systématiquement aux salons " de la
biologie et du laboratoire " ? Oui o
Non o
43. Entretenez-vous des contacts réguliers avec les
constructeurs ? Oui o
Non o
44. Etes-vous au fait des nouveautés ? Oui
o
Non o
45. Allouez-vous une partie de votre budget formation
développement des connaissances biologiques ? Oui
o Non o
- Si oui, pouvez-vous préciser dans quels
domaines
46. Si oui, les techniciens et les adjoints techniques
biomédicaux sont-ils intéressés par ces
formations ?
Oui o
Non o
47. Avez-vous des remarques supplémentaires à
faire ?
(retour sommaire)
(retour paragraphe)
Annexe
11 :
Etablissements ayant
participés à l'enquête
|
Type
|
Ville
|
Nb de lits
|
Nom Ingénieur
biomédical
|
Nb Ingénieur
|
Nb techniciens
|
Nb adjoints techniques
|
|
CHG
|
Auch
|
350
|
Mr N.Guyen
|
0
|
4
|
1
|
|
CH
|
Bayonne
|
1700
|
Mr J.M. Hours
|
1
|
6+1 objecteur
|
1
|
|
CH
|
Briançon
|
|
|
0
|
|
|
|
CHU
|
Caen
|
1948
|
Mr R. Triquet
|
2
|
15
|
11
|
|
CH
|
Charlevilles
|
1200
|
Mr P. Slupecki
|
1
|
|
4
|
|
CHG
|
Chartres
|
1200
|
Mr Humblot
|
2
|
3
|
|
|
CH
|
Compiègne
|
720
|
Mr P. Durand
|
1
|
3
|
3
|
|
CHI
|
Créteil
|
700
|
Mr Darianne
|
1,5
|
3
|
1
|
|
CH
|
Evreux
|
600
|
Mme D. Bruneval
|
1
|
3
|
1
|
|
CHU
|
Gonesse
|
1029
|
Mr F. Lerat
|
1
|
3
|
1
|
|
CH
|
Haute Savoie
|
2200
|
Mr P.O. Marquet
|
3
|
3
|
3
|
|
CH
|
Le Havre
|
|
Mr R. Talec
|
2
|
6
|
6
|
|
CH
|
Le Mans
|
1896
|
Mr J. Le Lay
|
1
|
6
|
4
|
|
CHRU
|
Lille
|
|
Mr J.L. Massiot
|
8
|
7
|
14
|
|
CHG
|
Lons Le Saulnier
|
563
|
Mr E. Marechal
|
0,5
|
|
2
|
|
CH
|
Lyon
|
1200
|
Mme S. Theolier
|
2
|
2
|
6
|
|
CH
|
Mantes la Jolie
|
700
|
Mr N. Thevenet
|
1
|
1
|
|
|
AP
|
Marseille
|
4170
|
Mr J.M. Cavanihac
|
8
|
52
|
52
|
|
CH
|
Meaux
|
959
|
Mr J.C. Gayon
|
1
|
0
|
3
|
|
CHRU
|
Metz-Thionville
|
1500
|
Mr C. Gross
|
2
|
12
|
9
|
|
CH
|
Montluçon
|
931
|
Mr L. Demainay
|
1
|
3
|
3
|
|
CH
|
Mulhouse
|
1700
|
Mr P. Caster
|
2
|
8
|
5
|
|
CH
|
Narbonne
|
650
|
Mr D. Garcia
|
1
|
4
|
2
|
|
CH
|
Nevers
|
480
|
Mr P. Guizier
|
1
|
4
|
0
|
|
CHU
|
Nice
|
2271
|
Mr M. Bellone
|
4
|
23
|
20
|
|
CHU
|
Poitiers
|
1766
|
Mr J. Ancellin
|
2
|
11
|
4
|
|
CHU
|
Rennes
|
2390
|
Mme C. Picot
|
3 (1 labo)
|
10
|
4
|
|
CH
|
St Nazaire
|
1100
|
Mme B. Vallet
|
1
|
5
|
5
|
|
CH
|
St Quentin
|
1000
|
Mr P. Lever
|
1
|
1
|
5
|
|
CHI
|
Toulon
|
|
Mr. Durand-Gasselin
|
1
|
10,5
|
2
|
|
CHRU
|
Toulouse
|
1364
|
Mr Sicard
|
1
|
23
|
7
|
|
CHRU
|
Tours
|
2000
|
Mr Margas
|
3 (1 labo)
|
1 (labo)
|
|
|
CH
|
Troyes
|
|
Melle Demairé
|
1
|
2
|
1
|
|
CASH
|
Nanterre
|
297
|
Mr P. Touroude
|
1
|
2
|
1
|
|
CHG
|
Auch
|
350
|
Mr N.Guyen
|
0
|
4
|
1
|
|
CH
|
Briançon
|
441
|
|
0
|
|
|
|
CH
|
Nevers
|
480
|
Mr P. Guizier
|
1
|
4
|
0
|
|
CHG
|
Lons Le Saulnier
|
563
|
Mr E. Marechal
|
0,5
|
|
2
|
|
CH
|
Bourges
|
570
|
Mr Marchand
|
1
|
4
|
1
|
|
CH
|
Evreux
|
600
|
Mme D. Bruneval
|
1
|
3
|
1
|
|
CH
|
Lannion
|
644
|
Mr Pénoignon
|
1
|
1
|
2
|
|
CH
|
Narbonne
|
650
|
Mr D. Garcia
|
1
|
4
|
2
|
|
CHI
|
Créteil
|
700
|
Mr Darianne
|
1,5
|
3
|
1
|
|
CH
|
Mantes la Jolie
|
700
|
Mr N. Thevenet
|
1
|
1
|
|
|
CH
|
Compiègne
|
720
|
Mr P. Durand
|
1
|
3
|
3
|
|
CH
|
Montluçon
|
931
|
Mr L. Demainay
|
1
|
3
|
3
|
|
CH
|
Meaux
|
959
|
Mr J.C. Gayon
|
1
|
0
|
3
|
|
CH
|
St Quentin
|
1000
|
Mr P. Lever
|
1
|
1
|
5
|
|
CH
|
Dax
|
1000
|
Mr B. Gigonnet
|
2
|
|
1
|
|
CHU
|
Gonesse
|
1029
|
Mr F. Lerat
|
1
|
3
|
5
|
|
CH
|
St Nazaire
|
1100
|
Mme B. Vallet
|
1
|
5
|
1
|
|
CH
|
Troyes
|
1175
|
Melle Demairé
|
1
|
2
|
4
|
|
CH
|
Charlevilles
|
1200
|
Mr P. Slupecki
|
1
|
|
|
|
CHG
|
Chartres
|
1200
|
Mr Humblot
|
2
|
3
|
6
|
|
CH
|
Lyon
|
1200
|
Mme S. Theolier
|
2
|
2
|
7
|
|
CHRU
|
Toulouse
|
1364
|
Mr Sicard
|
1
|
23
|
9
|
|
CHRU
|
Metz-Thionville
|
1500
|
Mr C. Gross
|
2
|
12
|
2
|
|
CHI
|
Toulon
|
1583
|
Mr. Durand-Gasselin
|
1
|
10,5
|
1
|
|
CH
|
Bayonne
|
1700
|
Mr J.M. Hours
|
1
|
6+1 objecteur
|
5
|
|
CH
|
Mulhouse
|
1700
|
Mr P. Caster
|
2
|
8
|
4
|
|
CHU
|
Poitiers
|
1766
|
Mr J. Ancellin
|
2
|
11
|
4
|
|
CH
|
Le Mans
|
1896
|
Mr J. Le Lay
|
1
|
6
|
11
|
|
CHU
|
Caen
|
1948
|
Mr R. Triquet
|
2
|
15
|
|
|
CHRU
|
Tours
|
2000
|
Mr Margas
|
3 (1 labo)
|
1 (labo)
|
3
|
|
CH
|
Haute Savoie
|
2200
|
Mr P.O. Marquet
|
3
|
3
|
6
|
|
CH
|
Le Havre
|
2258
|
Mr R. Talec
|
2
|
6
|
20
|
|
CHU
|
Nice
|
2271
|
Mr M. Bellone
|
4
|
23
|
4
|
|
CHU
|
Rennes
|
2390
|
Mme C. Picot
|
3 (1 labo)
|
10
|
14
|
|
CHRU
|
Lille
|
3445
|
Mr J.L. Massiot
|
8
|
7
|
52
|
|
AP
|
Marseille
|
4170
|
Mr J.M. Cavanihac
|
8
|
52
|
4
|
(retour sommaire)
(retour paragraphe)









































