|
Avertissement
|
| Si vous arrivez directement sur cette page sachez que
ce travail est un rapport d'étudiant(e)s et doit être pris
comme tel. Il peut donc comporter des imperfections ou des imprécisions
que le lecteur doit admettre et donc supporter. Il a été
réalisé pendant la période de formation et constitue
avant-tout un travail de compilation bibliographique,
d'initiation et d'analyse sur des thématiques associées aux
technologies biomédicales. Nous ne
faisons aucun usage commercial et la duplication est libre. Si vous avez
des raisons de contester ce droit d'usage, merci
de nous en faire part. L'objectif de la présentation
sur le Web est de permettre l'accès à l'information et d'augmenter
ainsi les échanges professionnels. En cas d'usage du document, n'oubliez
pas de le citer comme source bibliographique. Bonne lecture... |
Réference à rappeler
:Appel d'Offres Européen en monitoring et matériovigilance
, C. Maliges, Stage DESS, UTC, 1999, pp 49
URL : https://www.utc.fr/~farges/DESS_TBH/98-99/Stages/Maliges/Maliges.htm
|
|
Appel d'offres européen en
monitoring
Matériovigilance
|

Cédric MALIGES
|
|
| Résumé :
Le rôle de l’ingénieur biomédical tend à
se spécialiser, il doit intégrer les subtilités du
code des marchés public.
L’objectif de ce projet est de décrire le déroulement
d’un appel d’offres européen, de la définition des besoins
à la mise en service. La rédaction du cahier des charges
technique n’est qu’un des ses éléments. Le marché
en monitoring que j’ai traité sert de cas pratique.
Des dossiers traitant des incubateurs ou des bras d’anesthésie
m’ont permis de progresser dans la gestion des acquisitions.
Outre l’aspect achat, j’ai du gérer la matériovigilance,
que ce soient des déclarations internes d’incidents , des notes
d’alertes ministérielles ou en provenance de sociétés.
Mots clés :
marché public, appel d’offres européen, moniteur,
matériovigilance
Abstract :
The clinical engineer function tends to become more specialized, he
has to take into account sublets of publics purchase.
The aim of this project is to describe the unfolding of the European
bids of tenders. It’s become from the description of needs to the putting
into service. The drafting of the technical description is just a part
of it. The purchasing of medical monitors I have realized brought the process
into practice.
I could improve my knowledge in the acquisition management with files
like : incubators or ceiling service units.
Key words :
public purchase, bids of tenders, monitoring, medical devices |
Je tiens avant toutes choses à remercier toutes les personnes
qui ont contribuer au bon déroulement de mon stage et en particulier
:
Madame LACROIX-CASANOVA et Monsieur MOREAU, ingénieurs biomédicaux
au Centre Hospitalier Universitaire de Montpellier, pour m'avoir accueilli
et conseillé tout au long du stage,
Je remercie également Messieurs Farges
et Chevallier pour m'avoir
acceptée au sein du DESS
de Technologies Biomédicales Hospitalières et m'avoir
permis d'approfondir ma formation.
Introduction
Partie 1 : Le cadre du stage
1. Le
Centre Hospitalier Universitaire de Montpellier
2. Le Département Biomédical
Partie 2 : Processus
d'achat d'un dispositif médical en centre hospitalier
1.
Synoptique de l'achat d'un équipement sur Appel d'Offre Européen
2. Les
plans d'équipement au C.H.U. de Montpellier
3. Règlementation
4. Marchés publics
5. Critères de
choix du matériel
6. Règlement
de la consultation et cahier des charges
7. Essais, démonstration,
visites de sites
8. Choix du titulaire
Partie 3 : Appel d'Offres
Européen en monitoring
1. Caractéristiques
techniques
2. La règlementation
3. Moniteurs
de surveillance multi-paramétriques
Partie 4 : Apport des
autres sujets traités
1. Achat
d'oxymètres de pouls
2. Achat
de lèves malades avec pesée
3. Achat
d'incubateurs
4. Achat
de 6 bras d'anesthésie
5. Participation
à la rédaction du C.C.T.P. de l'I.R.M.
6. Achat
d'un injecteur de produits de contraste
7.Réunion sur l'accréditation
8. Réunion hébdomadaire
9. Réunion AFIB
10. Réunion
ingénieurs
11. La matériovigilance
Conclusion
Bibliographie
La fonction d'ingénieur biomédical en C.H.U. tend à
se scinder en deux, l'ingénieur achat et l'ingénieur maintenance.
La gestion du parc de dispositifs médicaux assurée par le
second dépend directement de la qualité des achats assurée
par le premier.
Ma mission au C.H.U. de Montpellier
consiste à traiter un appel d'offres européen en monitoring.
Une vaste recherche d'informations sur le processus d'achat que doit intégrer
l'ingénieur biomédical est indispensable. Il m’a paru souhaitable
d’être à la fois générique et exhaustif dans
le recueil des données afin de pouvoir transposer cette étude
à tout marché.
Le cas pratique d'un appel d'offres à bons de commande servira
de démonstration pour les étapes à suivre. Afin de
faciliter la lecture, de nombreux documents sont insérés
en annexe. Une description succincte de divers dossiers traités
au cours de ce stage montre mon évolution dans la conduite de marchés
publics.
La gestion des textes réglementaires ainsi que mon expérience
en tant que correspondant local matériovigilance chargé des
dispositifs médicaux non stérile est évoquée
dans ce rapport.
(Retour Sommaire)
|
Partie 1
: Le cadre du stage
|
1.
Le Centre Hospitalier Universitaire de Montpellier :
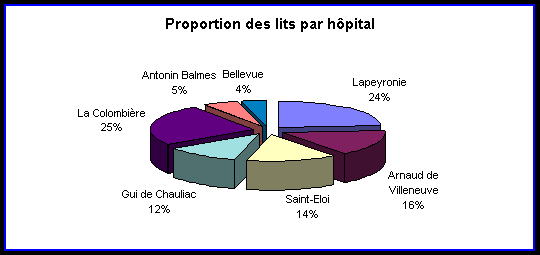
Il est composé par sept hôpitaux répartis en trois
groupes d'établissements :
Lapeyronie - Arnaud de Villeneuve
Saint-Eloi - Gui de Chauliac
La Colombière - Antonin Balmes - Bellevue
| Hôpital |
Spécialités |
Nombre de lits |
| Lapeyronie |
Orthopédie, Médecine Interne,
Urgences, Rhumatologie |
698 |
| Arnaud de Villeneuve |
Pédiatrie, Chirurgie Cardio-Vasculaire,
Pneumologie |
467 |
| Saint-Eloi |
Chirurgie Viscérale et Digestive |
416 |
| Gui de Chauliac |
Neurochirurgie, Ophtalmologie, O.R.L., Dermatologie |
340 |
| La Colombière |
Psychiatrie |
732 |
| Antonin Balmes |
Gérontologie |
160 |
| Bellevue |
Gériatrie |
116 |
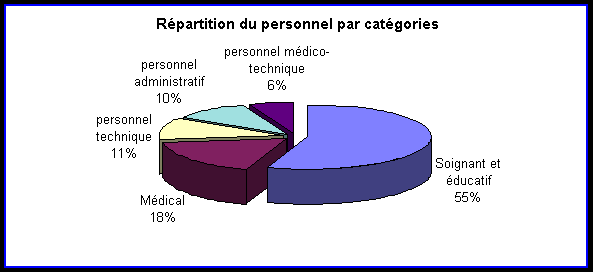
Son fonctionnement est assuré par :
le personnel soignant et éducatif : 55%
le personnel médical : 18%
le personnel technique : 11%
le personnel administratif : 10%
le personnel médico-technique : 6%
Le département biomédical dépend de la Direction
des Equipements et de la Logistique (D.E.L.) placée directement
sous la Direction Générale. Les directions fonctionnelles
(dont la D.E.L.) et les directions d’établissements sont totalement
indépendantes.
Organigramme de la direction (DG, DGA, Directions fonctionnelles, Directions
d'établissements)
Le budget de la Direction des Equipements et de la Logistique (environ300
millions F TTC) est égal au 1/10ième du budget
total du C.H.U..
(Retour Sommaire)
2.
Le Département Biomédical :
Il comprend 40 agents dont :
4 ingénieurs,
32 agents techniques,
4 agents administratifs.
Organigramme : cf. annexe 1
La proximité géographique des hôpitaux a permis
de localiser le département biomédical sur un seul site,
l'hôpital Lapeyronie. Un agent administratif est chargé de
collecter puis de ramener les dispositifs dans les services de soins.
Les évolutions technologiques et la volonté d’atteindre
un très bon niveau de qualité de prestations ont favorisé
la scission du département biomédical en sept ateliers autonomes.
Ils sont sous la responsabilité d’un adjoint technique.
2.1. Les ateliers biomédicaux
:
Leurs missions est d’assurer la maintenabilité et le suivi du
matériel médical depuis sa mise en service jusqu'à
sa réforme.
Spécialités :
Electronique médicale : monitoring, pompes, électrocardiographes,
pousse-seringue, vidéo,
Electro-médical : respirateurs, couveuses, analyseurs de gaz,
Imagerie : radiologie, amplificateurs de luminescence, radio mobiles,
reprographes,
Dialyse : générateurs de dialyse,
Stérilisation : trois stérilisations centrales sont gérées
par cet atelier,
Laboratoire : automates, endoscopie,
Médico-technique : tables de bloc, scialytiques , moteurs.
Installation
Les ateliers procèdent aux essais, à la réception
et à l'installation du matériel neuf en collaboration avec
les fabricants. Ils saisissent les nouveaux matériels dans l’inventaire
et participent aux réformes.
Formation
Ils veillent aux conditions de bonne utilisation du matériel.
Maintenance
Ils assurent :
la maintenance préventive et corrective du matériel dont
ils ont la charge directe,
le contrôle de l'entretien du matériel dont ils ont le
suivi en cas de prestation externe.
Renouvellement
Les ateliers participent à la définition et à la
mise en œuvre d'une politique de choix et de renouvellement du matériel
afin de répondre aux objectifs de qualité.
Dépenses
Grâce à un suivi régulier, ils doivent assurer la
maîtrise des dépenses de fonctionnement.
2.2. Les Ingénieurs Biomédicaux :
Missions :
la gestion du budget d'investissement en matériel médical,
achats sur simple facture ou acquisition suite à un appel d'offres,
les études en ingénierie biomédicale,
la gestion des contrats de maintenance : négociations, suivis,
engagements des dépenses,
l'organisation et le suivi de la mise en place des dispositifs médicaux.
la matériovigilance et le respect de la réglementation
La maîtrise du budget alloué au fonctionnement du département
est une priorité, elle est suivie chaque semaine. Un nouvel ingénieur
a pour fonction de gérer la maintenance. La part de la maintenance
sous-traitée dans ce budget est voisine de 50%.
La répartition du budget de ce département s'effectue
de la façon suivante :
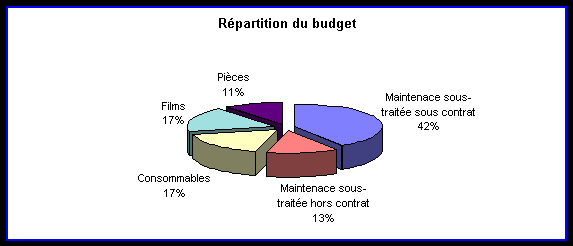
Ce budget est à rapprocher du volume croissant d’acquisitions(58
millions F TTC en 1998), que ce soit en matériel nouveau / renouvellement
ou d’acquisitions spécifiques. Celles-ci ne sont pas imputées
sur le même budget, elles sont fonction de Contrats d’Objectifs et
de Moyens passés entre le C.H.U. et l’Agence Régionale d’Hospitalisation.
Ces acquisitions concernent du matériel prévu dans des le
cadre restructurations, afin de ne pas pénaliser les autres services
de soins.
Budgets d'acquisition de matériels médical :
| Matériels nouveaux / Renouvellement |
40 millions F TTC |
| Acquisitions spécifiques |
18 millions F TTC |
Les 40 millions F TTC sont répartis entre cinq spécialités,
dont plus du tiers pour l’imagerie.
Spécialités :
Imagerie
Médecine
Chirurgie
Anesthésie / Réanimation
Laboratoire
Tous les équipements sont amortis sur une durée maximale
de sept ans. Certains équipements (échographes…) bénéficient
d’une évolution (up date) avant la fin de l’amortissement. De plus
en plus, l’investissement en matériel médical est prioritaire.
La part croissante des dispositifs médicaux depuis dix ans se caractérise
par une augmentation continue de la valeur technique du lit.
| Année |
1994 |
1995 |
1996 |
1997 |
1998 |
| Valeur (FTTC) |
99616 |
103541 |
122538 |
133871 |
138647 |
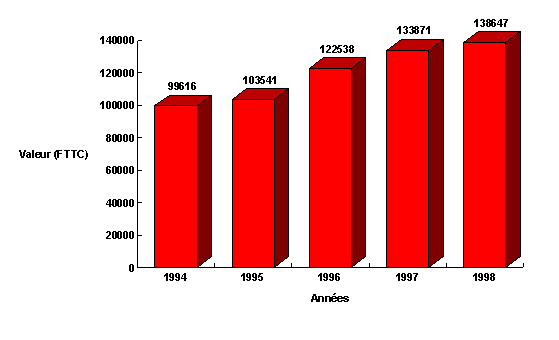
La croissance de la fonction achat dans l’ingénierie hospitalière
est synchronisée avec celle de la valeur technique du lit. L’ingénieur
intervient dés la rédaction des plans d’équipements.
Par la suite, le processus d’achat d’un dispositif médical en
centre hospitalier va être détaillé.
(Retour Sommaire)
|
Partie
2 : Processus d'achat d'un dispositif médical en centre hospitalier
|
Cette partie se veut générique, sa structure est identique
à celle du processus d’achat d’un matériel en hôpital.
Son plan logique est celui du synoptique suivant.
(Exemple d’un plan d’équipement annuel)
1.
Synoptique de l'achat d'un équipement sur Appel d'Offres Européen
:
Juin : Expression du besoin
t = t0
Septembre : Etude financière
Novembre : Etude par la sous-commission des équipements médicaux
(organe de la CME)
Décembre : Avis de la Commission des Equipements Médicaux.
Janvier : Inscription au Plan d'Equipement
1er semestre : Définition de l'équipement
15 j : Elaboration du RPAO, CCAP, CCTP
Lancement de l'Appel d'Offre Européen
Composition de la Commission d'Appel d'Offres ( C.A.O.)
52 j : Réception des offres des fournisseurs
Ouverture des plis par la C.A.O.
60 j : Essais dans des services tests
15-20 j : Analyse des offres
Choix par la C.A.O.
10 j : Mise au point du marché
20 j maximum : Envoi du marché à la tutelle
Retour du marché, enregistré, visé
Notification au fournisseur
3 mois : Livraison, réception, installation, essais validés
par lé département biomédical
t = to + 21 mois
45 j : Paiement au fournisseur
1 an : Fin de garantie, libération de la caution ou retenue de
garantie
Je commence par une définition des besoins, sa validation au
plan d’équipement, en décrivant le cas particulier des équipements
soumis à autorisations. Je poursuis par la réglementation
en vigueur, la description des types de marchés publics et des critères
de choix. La rédaction des cahiers des charges, la gestion des essais,
le rapport de choix et la mise en service du matériel clôtureront
cette partie.
(Retour Sommaire)
2.
Les Plans d'Equipement au C.H.U. de Montpellier :
2.1. Le Budget :
La Direction Générale et la Direction des Affaires Financières
décident du budget consacré aux investissements.
Le budget global, provenant de la tutelle, ne couvre que les dépenses
d’exploitation. Le budget d’investissement provient des amortissements.
Ces mêmes amortissements peuvent passer en budget d’exploitation
mais cela réduit le patrimoine de l’établissement.
Le Directeur des Equipements et de la Logistique (D.E.L.) décide
de la répartition du budget entre les 5 grandes disciplines (Chirurgie,
Médecine, Anesthésie/Réanimation, Imagerie, Laboratoire).
2.2. Le plan annuel d'équipement :
Ø
Juin : Demande
d’expression des besoins aux chefs de service
Chaque demande est rattachée à l’une des 5 disciplines.
Renouvellement ou matériel nouveau doit être précisé.
Sinon, le format de la demande est libre.
Chaque service indique un montant estimatif, vérifié par
le biomédical.
Expression des besoins
Cet acte est déterminant, le dispositif acheté doit être
parfaitement adapté à l'utilisation réelle du matériel.
Cas d'une sous-évaluation, le montant de l’investissement devra
être complété rapidement (problématique si le
dispositif n'est pas fini d'amortir).
Cas d'une surévaluation, la somme restante est remise à
disposition pour financer des renouvellements urgents.
Deux possibilités :
Renouvellement d'un matériel existant.
S'assurer que les fonctionnalités de l'équipement actuel
sont toujours adaptées à la pratique médicale.
Se renseigner sur les évolutions technologiques depuis le dernier
achat.
Nouvelle acquisition.
Nécessité d'un débat avec l'ensemble des utilisateurs
(médecins, soignants).
Evaluer l'activité réelle (déterminer la nature
des actes, de leur quantité si besoin grâce au PMSI).
Evaluer les performances en terme de personnel et d’organisation.
Se documenter en particulier sur le coût d'utilisation (consommables
captifs ou non) auprès de revues médicales ou biomédicales,
de fournisseurs.
S'assurer que la Direction des Travaux peut effectuer des travaux d'aménagement
si nécessaire.
Les besoins exprimés par les services doivent être justifiés
et précis :
type de matériel souhaité,
utilisation prévue,
activité prévisible ,
conséquence de l'équipement sur l'activité,
estimation des quantités et des coûts des consommables,
formations éventuelles à dispenser au personnel.
Les besoins recensés par le département biomédical
à partir du suivi du parc de matériels en fonction :
du coût de la maintenance qui dépasse les normes admises,
du risque de panne grave est établi,
de l’âge et la fréquence d'utilisation qui se rapprochent
des limites admises,
du matériel nécessaire comme complément à
un équipement de base.
Le matériel nouveau est souvent privilégié par
les chefs de service au détriment du matériel de remplacement.
Sélection des dispositifs médicaux
Plusieurs réunions entre les coordinateurs des disciplines et
le département biomédical sont nécessaires.
Ø
Fin Septembre
: Synthèse des besoins dans un document.
Les totaux par service et par discipline sont réalisés.
Ø
Les coordinateurs
de disciplines (médecins) et le président de la commission
des équipements médicaux sont chargés de faire une
sélection parmi les besoins, pour cadrer avec le budget établi
pour leur discipline.
Ø
Entre Octobre
et Janvier, chaque coordinateur de discipline présente son projet
au Directeur de la D.E.L..
- Des extensions budgétaires ne peuvent être envisagées
qu’à titre exceptionnel, dans la mesure où le Directeur distribue
toujours totalement le budget sans garder de réserve d’extension.
- Après accord de celui-ci et du président, le plan par
discipline passe à l’équipe des investissements de la D.E.L.
pour vérification des budgets définitifs.
Ø
Un document
final est défini au plus tard au mois de Février.
- Il est transmis aux coordinateurs de disciplines, aux chefs de service,
aux ingénieurs biomédicaux.
- Sa réalisation peut commencer.
Quand un matériel non prévu doit être acquis en
cours d’année
- Acquisition en anticipation sur le P.E. suivant.
- Acquisition en remplacement d’un matériel ayant été
retenu, s’il n’est pas à acquérir de manière prioritaire.
- Acquisition grâce aux marges issues de la négociation
avec les fournisseurs (de plus en plus restreintes dans la mesure où
l’on passe par des procédures d’Appel d’Offres).
2.3. Le plan tri-annuel d'équipement :
Ø
Au lieu
de raisonner sur une année, le centre hospitalier prévoit
les besoins en équipements sur 3 ans.
Ø
Ils sont
recueillis de la même manière que pour un plan annuel (Début
d’expression en Juin 2000 pour le prochain P.E. du C.H.U. de Montpellier).
Ø
L’enveloppe
prévisionnelle est décidée par le Directeur Général,
le Directeur de la D.E.L. et le Directeur des Affaires Financières.
Ø
Les coordinateurs
de discipline répartissent les enveloppes annuelles pour chacune
des trois années en regard des besoins exprimés. Néanmoins,
seule la première année est validée de façon
définitive.
Ø
Pendant
la réalisation de la première année, les chefs de
service et les coordinateurs de disciplines doivent préparer la
validation de la deuxième année (en Juillet 2001). Les adaptations
sont possibles mais sans augmentation budgétaire.
Intérêts
Ø
Force chaque
service à réfléchir à long terme pour préparer
l’acquisition d’un matériel (formation du personnel, coûts
de fonctionnement, locaux et contraintes techniques). Cela facilite également
la tâche de la Direction des Travaux quand il y a des aménagements
de locaux à réaliser (climatisation, alimentation, ventilation,
etc.).
Ø
Quand les
chefs de services sont habitués, ils estiment précisément
leurs besoins sur trois ans et les plans sont rarement modifiés
sur cette durée. Cela permet alors une simplification des procédures
d’achat (marché à bons de commande, allotissement en tranche
ferme et tranches conditionnelles).
Après avoir détaillé les plans d’équipement,
je vais approfondir le cas particulier d’un équipement soumis à
autorisation. Il doit être planifié sur les plans pluri-annuels,
le dossier complet est à la tutelle (Agence Régionale d’Hospitalisation)
un an avant la fin d’expiration de l’amortissement du dispositif.
2.4. Cas particulier des équipements soumis
à autorisation :
Réalisation du dossier de demande d'autorisation.
Le problème des équipements lourds s'est rapidement fait
sentir, ces techniques ayant un coût d'achat et d'entretien croissant
pour le système de santé. La carte sanitaire apparaît
comme une évolution du concept d'économie de santé.
Le Code de la Santé Publique définit les équipements
lourds à l'article L.712-19 comme " les équipements mobiliers
destinés soit au diagnostic, à la thérapeutique, ou
à la rééducation fonctionnelle... et qui ne peuvent
être utilisés que dans des conditions d'installation et de
fonctionnement particulièrement onéreuses ou pouvant entraîner
un excès d'actes médicaux..."
La liste de ces équipements est donnée à l'article
R.712-2II du code de la santé publique.
L'ordonnance 96-346 du 24 Avril 1996 a permis la création des
Agences
Régionales d'Hospitalisation (A.R.H.) ; elles sont devenues
opérationnelles au cours du premier trimestre 1997. Ce sont des
groupements d'intérêt public associant l'Etat et l'assurance
maladie. Elles sont chargées de mettre en œuvre , au niveau régional
la politique du gouvernement, d'analyser et de coordonner l'activité
des établissements de santé publics et privés, de
conclure avec eux des contrats pluriannuels d'objectifs et de moyens et
de déterminer leurs ressources. Instances de coordination, les agences
font appel aux services de l'Etat (D.R.A.S.S., D.D.A.S.S., médecin
inspecteur régional) ainsi qu'à ceux de l'assurance maladie
(C.R.A.M. et échelon régional du contrôle médical).
Elles s'appuient sur les travaux des conférences régionales
de santé qui définissent annuellement les priorités
régionales sur les avis des comités régionaux de l'organisation
sanitaire (C.R.O.S.S.).
Elles élaborent, en partenariat avec tous les professionnels
de santé, les schémas régionaux de l'organisation
sanitaire (S.R.O.S.S.) qui tracent, tous les cinq ans, le cadre de l'évolution
de l'offre de soins hospitalière en adéquation avec l'ensemble
du système de santé.
Afin de mieux coordonner l’implantation des équipements lourds,
la tutelle se sert d’une carte sanitaire référençant
la population minimale nécessaire à l’implantation des ces
dispositifs.
Carte Sanitaire : indice des besoins afférents aux équipements
lourds.
| Type d'équipement |
Indice |
| Scanographe |
1 appareil pour 110 000 habitants +
1 appareil par tranche d'au moins 1 500 lits actifs autorisés |
| I.R.M. |
1 appareil pour 400 000 habitants + 1 appareil
par tranche d'au moins 1 500 lits actifs autorisés |
| Caméra à ScintillationTomographe
à Emissions |
1 appareil pour 140 000 habitants +
1 appareil par tranche d'au moins 2 500 lits actifs autorisés |
| Lithotriteur |
1 appareil pour 1 500 000 habitants à
2 800 000 habitants |
| Dialyse chroniqueGénérateur d'hémodialyse |
40 à 50 appareils pour 1 million d'habitants |
| Radiothérapie |
6 appareils pour 1 million d'habitants |
La durée de l'autorisation est fonction du dispositif médical,
elle est déterminée par le décret 93-407 du 17 Mars
1993.
Equipement lourd soumis à une autorisation de 5 ans :
Ø
Appareil
de Circulation Extra-Corporelle (C.E.C.)
Equipements lourds soumis à une autorisation de 7 ans :
Ø
IRM
Ø
Scanner
Ø
Angiographe
numérisé
Ø
Caméra
à positons
Ø
Tomographe
à émissions
Ø
Cyclotron
Ø
Accélérateur
de particules
Ø
Sources
scellées de radioéléments
Ø
Compteurs
de radioactivité corps -entier
Ø
Lithotripteur
Ø
Caisson
Hyperbare
Ø
Appareil
d'Hémodialyse
Ø
Séparation
in vivo des éléments figurés du sang
La procédure à appliquer pour une autorisation d’équipement
lourd est la suivante.
Demande de renouvellement de l'autorisation.
D'après la loi du 31 Juillet 1991, l'établissement de
santé doit respecter un délai de dépôt, il doit
de même satisfaire à l'évaluation périodique.
Délai de dépôt.
La demande doit intervenir au moins un an avant la fin de l'échéance
(articles L.712-14 et L.712-15). Il doit également satisfaire aux
objectifs fixés par le
Schéma Régional de l'Organisation de la Santé (S.R.O.S.)
(ordonnance 96-346 du 24 Avril 1996).
Evaluation périodique.
Le demandeur de l'autorisation prend l'engagement de procéder
à des évaluations périodiques. Il devra les soumettre
à la Commission Médicale d'Etablissement (C.M.E.) et au Conseil
d'Administration (C.A.) au minimum tous les 2 ans, concernant les équipements
lourds.
Dépôt de la demande.
La demande de renouvellement est adressée au Ministre de tutelle
avec avis de la Commission Régionale de l'Organisation Sanitaire
et Sociale (C.R.O.S.S.) et de la Commission Nationale de l'Organisation
Sanitaire et Sociale (C.N.O.S.S.). Ces commissions se prononcent en fonction
de la carte sanitaire et du schéma d'organisation sanitaire.
En l'absence de réponse dans les six mois, l'autorisation est
renouvelée par tacite reconduction.
Dans un C.H.U. cette procédure est bien assimilée ; en
1999, 13 demandes de renouvellement de matériels ont été
effectuées à Montpellier.
Equipements soumis à autorisation au C.H.U. de Montpellier :
2 I.R.M.
5 Scanners
5 Gamma-Caméras
5 Angiographes numérisés
2 Salles de coronarographie
1 Caisson Hyperbare
1 Lithotripteur
4 CEC
24 Générateurs d’Hémodialyse
3 Séparateurs de cellules
Soit un total de 52 matériels lourds, c’est le résultat
d’ambitieux plans d’investissements pluri-annuels
Une fois le dispositif budgété, le rôle de l’ingénieur
biomédical est d’étudier la réglementation en vigueur.
Il doit savoir où trouver les textes de loi, les décrets,
les circulaires ainsi que les articles du code la santé publique.
L’utilisation d’Internet permet d’avoir ces informations instantanément,
en provenance de sites officiels ou d’associations.
(Retour Sommaire)
3. Règlementation
:
Dans la première partie de ce chapitre, les méthodes de
recherche de la réglementation à appliquer seront détaillées.
La seconde partie résume les éléments indispensables
à intégrer à tout cahier des charges.
3.1. Recherche de la règlementation à
appliquer :
Les lois, décrets, arrêtés, circulaires ne sont
qu’une des composantes de la réglementation. Le code de la santé
publique synthétise les autres composantes. En plus du marquage
CE, il fait référence au respect des exigences essentielles
de sécurité et de santé validé par le respect
des normes européennes.
Lois, décrets, arrêtés, circulaires
Afin de déterminer les textes s'appliquant aux moniteurs médicaux,
j'ai utilisé le site Web HOSMAT.
Cette association a été créée par un ancien
Ingénieur Biomédical : M. Jean-Marie Bayle.
Ce site répertorie toutes les lois, décrets, lettres circulaires
depuis 1989.
J'ai utilisé un moteur de recherche sur le Web afin de trouver
le code la santé publique.
Code de la santé publique :
Je l’obtiens en tapant " code de
la santé publique " sur un moteur de recherche. L'annexe 2 regroupe
l’intégralité des article cités ultérieurement.
Dans la rubrique réglementation, j'extrais les informations suivantes
:
Maintenance des dispositifs médicaux : Loi n° 98-535 du
1er juillet 1998, article L. 665-5
Description du dispositif médical : Article R. 665-1
Article L. 665-3
Matériovigilance : Article R. 665-48 (Cette partie est traitée
dans le paragraphe XX)
Compatibilité technique : Article L. 665-8
Marquage CE
Le marquage CE ne peut être apposé sur un dispositif médical
que s'il est conforme à des exigences essentielles de sécurité
et de santé fixées par voie réglementaire.
Le respect des normes européennes harmonisées entraîne
présomption de conformité aux exigences essentielles de sécurité
et de santé.
Législation concernant le marquage CE :
dispositifs médicaux implantables actifs (directive 90/385/CEE).
Obligatoire depuis le 1er Janvier 1995,
autres dispositifs médicaux (directive 93/42/CEE). Applicable
depuis le 1er Janvier 1995 et obligatoire depuis le 14 juin 1998,
dispositifs destinés au diagnostic in-vitro (directive 98/79/CEE).
L'établissement de la conformité à ces exigences
s'appuie sur des procédures (modes de preuves) qui dépendent
de la classe et de la catégorie du dispositif médical.
Les exigences demandées au fournisseur par l'organisme notificateur
sont :
Classe I : une documentation technique
Classe II a : une documentation technique et un contrôle de fabrication,
un système d'assurance qualité complet sauf pour la conception
Classe II b : un examen CE de type et un contrôle de fabrication,
un système d'assurance qualité complet sauf pour la conception
Classe III : un examen CE de type et un contrôle de fabrication,
un système d'assurance qualité complet
La présence du marquage CE médical est pour l'ingénieur
biomédical l'assurance que le D.M. respecte les normes en vigueur.
Il doit exiger avant tout essai un certificat d'obtention de ce marquage
tout en s'assurant que la classe du D.M. correspond bien à son utilisation.
Normes
Rôle de l'A.F.N.O.R.
En France, l'organisme qui répertorie les normes françaises
(NF) ou européennes (EN) et internationales (ISO)
est l'Agence Française de la NORmalisation.
En application du décret n° 84-74 du 26 janvier 1984 fixant
le statut de la normalisation, ces normes sont élaborées
et gérées par l'A.F.N.O.R. aidé pour les appareils
électromédicaux par l’Union
Technique de l'Electricité (U.T.E., bureau de normalisation
de l'A.F.N.O.R.).
Ces organismes français de normalisation travaillent en collaboration
avec les organismes européens (C.E.N., C.E.N.E.L.E.C.) et internationaux
(I.S.O., C.E.I.). Ces normes couvrent la plupart des dispositifs médicaux.
L'intérêt des normes réside dans le fait qu'elles
sont lisibles, révisables régulièrement et rapidement,
et qu'elles permettent une clarification des solutions techniques pour
assurer la sécurité et la qualité des dispositifs
médicaux.
Recherche des normes :
Afin de déterminer les normes s'appliquant aux moniteurs médicaux,
j'utilise le site Web de l'A.F.N.O.R.
Cet organisme se rémunère en vendant les normes.
.
Ce site comprend un catalogue de normes en ligne, on peut sélectionner
une norme grâce à un moteur de recherche. Les champs suivants
sont à compléter optionnellement :
Référence de la norme,
Mot : type de matériel,
ICS (classification internationale pour les normes),
Date de parution de norme.
Un ingénieur n’a pas le temps ni les moyens de rechercher toutes
les normes en vigueur pour chaque dispositif à acquérir.
Un service biomédical n’a pas de budget spécifique pour l’achat
de ces textes. Donc sa seule garantie de l’application de celles-ci est
la présence (obligatoire) du marquage CE médical.
3.2. Eléments à intégrer à
tout C.C.T.P. :
Marquage CE médical :
Le matériel devra être conforme aux normes en vigueur au
jour de la livraison et devra répondre à la Directive Européenne
n° 93/42/CEE du Marquage CE (décret n° 95-283 du 13 mars
1995). La classe du dispositif sera précisée.
Les certificats de conformité seront joints au dossier.
An 2000 :
Le C.C.T.P. doit comprendre une fiche d'engagement sur le passage en
l'an 2000 des systèmes informatiques intégrés dans
le D.M. en référence à la circulaire ministérielle
DH/S15/97-639 du 02 octobre 1997.
Le fournisseur doit s'engager à :
Assurer la mise à niveau des équipements qu'il installe
pour la présente consultation, avant le 01/01/2000 . La mise à
niveau des équipements comprend, au delà du fonctionnement
quotidien des équipements, la rétro compatibilité
des informations archivées entre la date de mise en service de l'équipement
et la date de mise à niveau.
Prendre à sa charge toute fourniture (pièces, main d'œuvre
et déplacement) nécessaire à cette mise à niveau.
Prévenir, dans un délai raisonnable, le destinataire, des
contraintes éventuelles liées aux opérations de mise
à niveau.
Après avoir définis les besoins, budgété
l’acquisition, s’être documenté sur la réglementation,
l’ingénieur est confronté aux différents types de
marchés.
(Retour Sommaire)
4. Les marchés
publics :
Le budget d’acquisition d’un équipement impose de passer soit
un marché négocié, soit un appel d’offres. L’ingénieur
intervient dans le choix d’un marché simple ou pluri-annuel. Il
doit maîtriser les nuances entre un marché à tranches
conditionnelles et un marché à bons de commandes.
4.1. Marchés à tranches conditionnelles
:
La durée maximale d'application de ces marchés est de
3 ans. Ils comportent un minimum et un maximum pour chaque année.
Le marché à tranches conditionnelles comporte une tranche
ferme et une ou plusieurs tranches conditionnelles. Le marché définit
la consistance, le prix et les modalités d'exécution des
prestations de
chaque tranche.
L'exécution de chaque tranche conditionnelle est subordonnée
à une décision de la personne responsable du marché,
notifiée au titulaire dans les conditions fixées au marché.
Lorsqu'une tranche conditionnelle est affermie avec retard ou qu'elle
n'est pas affermie, le titulaire peut bénéficier, si le marché
le prévoit et dans les conditions qu'il définit, d'une indemnité
d'attente et d'une indemnité de dédit.
Dépassement du seuil maximal de moins de 5% : la seule
formalité est de tenir la commission d'appel d'offre informée.
Dépassement du seuil maximal compris entre 5 et 100% : il faut
procéder à un avenant.
Dépassement du seuil maximal supérieur à 100% :
un nouveau marché est nécessaire.
Ce marché est moins utilisé que le marché à
bons de commande. Ce dernier permet d’acquérir du matériel,
non pas en quantité fixe renouvelable chaque année, mais
quand c’est nécessaire pendant la durée du marché.
4.2. Marchés à bons de commandes :
Il comporte facultativement un minimum et un maximum pour chaque année.
Selon l'article 76 du code des marchés publics, quand pour des raisons
économiques, techniques ou financières, le rythme ou l'étendue
des besoins à satisfaire ne peuvent être entièrement
arrêtés dans le marché, la personne responsable du
marché peut passer un marché fractionné sous la forme
d'un marché à bons de commande ou d'un marché à
tranches conditionnelles.
Les marchés à bons de commande sont passés pour
une durée qui ne peut excéder trois ans. Néanmoins,
elle peut atteindre cinq ans lorsque le marché est passé
en application du 1° ou du 2° du II de l'article 104.
1. Le marché à bons de commande détermine les spécifications,
la consistance et le prix des prestations ; Il en fixe le minimum et le
maximum en valeur ou en quantité. Le montant maximum ne peut être
supérieur à quatre fois le minimum.
Le marché s'exécute par émission de bons de commande
successifs, selon les besoins. Chaque bon de
commande précise celles des prestations décrites dans
le marché dont l'exécution est demandée. Il en
détermine la quantité.
2. Par dérogation dûment motivée dans le rapport
de présentation, lorsque le volume du besoin et sa survenance ne
peuvent être a priori appréciés par la personne publique
contractante, il peut être conclu un marché sans minimum,
ni maximum.
Dans ce cas, il ne peut être passé de marchés portant
sur des prestations identiques.
La personne responsable du marché ou son représentant
choisit l'attributaire du bon de commande.
La durée maximale est ramenée à deux ans pour les
marchés ne comportant pas de minimum ni de
maximum comme spécifié ci-dessus.
Suite à cette synthèse sur les marchés pluri-annuels,
je m’attarderais sur la description de l’appel d’offres européen,
objet de mon stage.
4.3. Appel d'Offres Européen :
L'Appel d'Offre est défini dans le Livre III, Chapitre II, Section
III du Code des Marchés Publics (c. f. annexe 3)
C'est un marché public pour la fonction hospitalière dont
le montant est supérieur à 700 000 F TTC. Des contraintes
spécifiques s'appliquent en fonction du montant de l'enveloppe.
| Montant de l'enveloppe |
Type de Marché |
Publication obligatoire |
Délai normal (jours)
Délai d'urgence (jours) |
| 700 000 FTTC <...<900 000 FTTC |
Appel d'Offres |
Journal d'Annonce Légale |
36 j
15 j |
| 900 000 FTTC <...<1 300 000 FHT |
Appel d'Offres |
Buletin Officiel d'Annonce des Marchés
Publics |
36 j
15 j |
| 1 300 000 FHT<... |
Appel d'OffresEuropéen |
Journal Officiel de la Communauté Européenne |
52 j15 j |
Les Centres Hospitaliers doivent publier la publicité relative
au marché au Journal Officiel de la Communauté Européenne
quand l'enveloppe dépasse :
1 300 000 FHT pour les marchés de fournitures ,
1 300 000 FHT pour les marchés de services,
32 900 000 FHT pour les marchés de travaux.
Remarque : la publication au J.O.C.E. est gratuite contrairement à
la publication au B.O.A.M.P..
4.4. Cas particulier de l'UGAP :
Selon l'article 1er du décret n°85-801 du 30 juillet 1985,
"l'UGAP a pour mission d'acheter et de céder des produits et des
services destinés aux personnes publiques et aux organismes de statut
privé assurant une mission de service public, d'apporter à
ces personnages et organismes, l'assistance technique dont ils peuvent
avoir besoin en matière d'équipement et d'approvisionnement,
et d'apporter son concours à des opérations d'intérêt
général".
L'Union des Groupements d'Achats Publics est un Etablissement Public
à but Industriel et Commercial (E.P.I.C.). Depuis un an, il a subi
de profondes mutations que je vais détailler.
Avant juillet 1998 :
Cet organisme a comme but l'achat public (hôpitaux, écoles...),
une commission sur chaque achat (voisine de 7%) assure sa subsistance.
Il bénéficie en compagnie du Centre National de la Recherche
Scientifique (C.N.R.S.) et de l’Institut National de la Santé Et
de la Recherche Médicale (l'I.N.S.E.RM.)
de l'article 103 du code des marchés publics. Cela permet de mettre
les sociétés en concurrence une première fois pour
être "référencée UGAP", puis une seconde fois
quand un établissement public passe une commande.
L'intérêt principal de cet article est une multi-attribution
qui permet d'avoir plusieurs fournisseurs pour même type de matériel.
Ceci est contraire à l'esprit du code des marchés publics.
Après juillet 1998 :
Les ministres de tutelle de l'UGAP ont par la lettre de mission du 5
décembre 1997, dénoncé ce manquement à l'esprit
du code des marchés publics. La lettre du 19 février 1998
effectue une mise au point concernant la situation de l'UGAP (cf. annexe
4).
Le retrait de l'article 103 en est le résultat, l'organisme est
mis en demeure de passer des marchés pour tous les achats : "cessation
immédiate de la passation de marchés selon des procédures
susceptibles d’être critiquables au regard du Code des marchés
publics, passation aussi rapide que possible de nouveaux marchés
sur appel d’offres".
Après renseignement pris auprès du Directeur Régional
de l'UGAP du Languedoc Roussillon, ce groupement a choisi comme marché
systématique l'Appel d'Offres Européen à bons de commandes
(enveloppe supérieure à 900 000 FHT pour un organisme d'état
conformément aux dispositions de l'arrêté du 9 février
1994). Les bons de commandes sont renouvelables pendant un à deux
ans pour le matériel médical, l'option de renouveler pendant
3 ans a été abandonnée du fait de son évolution
rapide.
Pour chaque matériel n'est sélectionné qu'un fournisseur.
Ce choix est réalisé par les neufs ingénieurs biomédicaux
qui travaillent pour cet organisme. Le rapport de choix de chaque matériel
peut être demandé par un centre hospitalier, ainsi que les
critères de choix pondérés .
Du fait de ces profondes mutations, son Chiffre d'Affaire en 1999risqua
d’être la moitié de celui de 1997.
Le programme 1999 comprend 160 appels d'offres européens. Le
catalogue médical de l'UGAP sera disponible courant septembre. Les
matériels suivant y seront proposés.
| Dispositif Médical |
Date de parution |
| Automates de laboratoire |
1er semestre 1999 |
| Bistouris |
2ème semestre 1999 |
| Développement radiologique et reprographie |
1er semestre 1999 |
| Echographie |
2ème semestre 1999 |
| Endoscopie |
1er semestre 1999 |
| Equipement de base du laboratoire |
1er semestre 1999 |
| Explorations fonctionnelles cardiorespiratoires
et neurologiques |
1er semestre 1999 |
| Générateurs de dialyse |
1er semestre 1999 |
| Hygiène et transfert du patient |
1er semestre 1999 |
| Lavage, désinfection, stérilisation |
1er semestre 1999 |
| Mobilier médicalisé |
1er semestre 1999 |
| Monitorage, cardiostimulation |
2ème semestre 1999 |
| Perfusion, réchauffement |
1er semestre 1999 |
| Radiologie conventionnelle |
1er semestre 1999 |
| Réanimation néonatale |
1er semestre 1999 |
| Tables d'opération et équipement
de bloc opératoire |
2ème semestre 1999 |
| Tables télécommandées (radiologie) |
2ème semestre 1999 |
| Ventilation |
2ème semestre 1999 |
Tous les équipements médicaux sont concernés exceptés
les équipements lourds soumis à autorisation.L'U.G.A.P. ne
peut les proposer car la part de l'immobilier dépasse les 10% du
montant total de l'investissement total. Or il ne peut commercialiser des
équipements dont la part du mobilier dépasse les 90% de l'investissement
dans ce type de marché.
Son rôle actuel s'assimile à celui d'un fournisseur multi-marques
de matériel médical. L'avantage est que la mise en concurrence
a déjà été réalisée, ce qui permet
de réduire les délais d'acquisition.
La procédure idéale est de contacter les fournisseur susceptibles
de répondre au marché, leurs proposer une mise en essai du
matériel en leur signifiant qu'un de leur concurrent est l'UGAP.
Si ce dernier donne satisfaction quant aux critères de choix,
le centre hospitalier n'a qu'un bon de commande à passer.
Sinon le marché doit être réalisé conformément
au code des marchés publics (publicité...).
Après avoir défini l’appel d’offres en insistant sur le
rôle de l’U.G.A.P., je vais décrire les critères de
choix à rédiger avant le règlement de la consultation
et les cahiers des charges.
(Retour Sommaire)
5.
Critères de choix du matériel :
Ils sont configurable en fonction du matériel objet du marché.
Le classement n'est pas anodin, les critères sont classés
par ordre croissant d'importance.
1 Conformité aux normes en vigueur.
2 Adaptation aux besoins réels des utilisateurs.
3 Convivialité et simplicité d'utilisation.
4 Technologie du matériel.
5 Fiabilité, réputation de l'entreprise.
6 Caractéristique du S.A.V., réputation, fiabilité.
7 Evolutivité du matériel.
8 Prix de l'investissement.
9 Coût de l'exploitation.
10 Coût de la maintenance.
11 Solidité financière de l'entreprise.
(Retour Sommaire)
6.
Règlement de la consultation et cahiers de charges :
6.1. Règlement de la consultation :
Le Règlement de la Consultation de l'Appel d'Offres comprend
l'acte d'engagement ainsi que les éléments suivants (article
255 du code des marchés publics) :
1.L'indication des parties contractantes ;
2.La définition de l'objet du marché.
3.La référence aux articles et alinéas du chapitre
II ci-après en vertu desquels le marché est passé
;
4.L'énumération par ordre de priorité des pièces
incorporées dans le contrat ;
5.Le prix ou les modalités de sa détermination ;
6.Le délai d'exécution du marché ou la date de
son achèvement ;
7.Les conditions de réception et, le cas échéant,
de livraison des prestations ;
8.Les conditions de règlement ;
9.Les conditions de résiliation ;
10.La date de notification du marché ;
11.Le comptable public assignataire chargé du paiement.
L'article 318 du Livre III précise les documents présents
dans les cahiers des charges.Leur but est de définir les conditions
dans lesquelles les marchés sont exécutés. Ils comprennent
des documents généraux et des documents particuliers. Les
documents généraux sont :
1 Les cahiers des clauses administratives générales qui
fixent les dispositions administratives applicables à toute une
catégorie de marchés ;
2. Les cahiers des clauses techniques générales qui fixent
les dispositions techniques applicables à toutes les prestations
d'une même nature.
Les documents particuliers sont :
1. Les cahiers des clauses administratives particulières qui
fixent les dispositions administratives propres à chaque marché
;
2. Les cahiers des clauses techniques particulières qui fixent
les dispositions techniques nécessaires à l'exécution
des prestations prévues au marché.
6.2. Cahier des Charges Techniques Particulières
:
Il doit comprendre (cf. annexe 5) :Fiche descriptive de l'équipement
: Ø Définition de l'offre de
base.Ø Définition des variantes.
Ø
Définition
des options.
Fiche information générale :
Ø
Informations
fournisseurs.
Ø
Noms des
contacts commerciaux.
Ø
Noms des
supports produits.
Fiche engagement garantie :
Ø
Garantie
légales.
Ø
Garantie
supplémentaires offertes.
Fiche livraison installation réception :
Ø
Obtenir
des engagements fermes et écrits des fournisseurs.
Ø
Introduire
la notion de pénalité de retard.
Ø
Différencier
les délais de livraison des délais d'installation.
Ø
Lister précisément
l'ensemble des contraintes d'exploitation.
Ø
Différencier
ce qui est à la charge du fournisseur et ce qui est à la
charge de l'hôpital.
Ø
Faire prendre
en charge au fournisseur tous les oublis liés à l'implantation.
Ø
Faire réaliser
un plan d'implantation réel et non un plan type.
Ø
Décrire
au préalable l'ensemble des processus d'admission du matériel.
Fiche formation du personnel :
Ø
Former du
personnel utilisateur avec manuels d'utilisation rédigés
en français.
Ø
Former du
personnel technique avec manuels d'utilisation rédigés en
français.
Ø
Bien faire
préciser au fournisseur ce qui est compris dans l'offre, ce qui
est payant en su, ce qu'il ne prend pas en charge.
Fiche service après vente (S.A.V.) :
Ø
S.A.V. ponctuel
(prix des déplacements, forfaits horaires, forfaits hébergement).
Ø
S.A.V. permanent
(description, restriction, coût des contrats,...).
Ø
Faire préciser
la liste des pièces détachées considérées
comme consommable. Demander le tarif des principales pièces d'usure.
Fiche coût d'exploitation :
Ø
Coût
et quantitatif prévisionnel de l'ensemble des consommables.
Ø
Consommables
captifs ou non.
Ø
Programme
d'entretien détaillé avec périodicité pendant
la période de garantie.
Fiche passage à l'An 2000 :
Fiche marquage CE et respect de la réglementation en vigueur
:
Questionnaire technique (pour cela une parfaite connaissance de l'offre
industrielle est nécessaire) :
Ø
Bien ciblé,
éviter qu'il soit interminable.
Ø
Se fixer
préalablement des critères fondamentaux sur lesquels on sera
amené à juger l'appareil.
Ø
Adapter
le questionnaire en fonction des ces critères.
Désormais, la publicité est envoyée au J.O.CE.,
les sociétés retirent les documents officiels. Au maximum,
deux mois plus tard (52 jours), elles envoient deux enveloppes. La première
contenant les documents administratifs, la seconde la proposition. L’ouverture
des plis a lieu en commission d’appel d’offres. Le rôle de l’ingénieur
est de rédiger une feuille d’évaluation grâce aux critères
de choix, de rencontrer la société et d’organiser les essais.
(Retour Sommaire)
7.
Essais : Démonstration, visite de sites :
La gestion des essais ne peut être générique. Plus
le matériel est onéreux, plus le nombre de fournisseurs décroît.
Deux possibilités,
Si un faible nombre de sociétés postule, la gestion peut
être déléguée aux utilisateurs.
Le groupe de travail (Médecins, Directeurs, Ingénieurs)
chargé d'étudier les dossiers qui seront remis lors du dépôt
des offres pourra alors être amené à demander à
chaque soumissionnaire de présenter les performances des équipements
proposés à l'entière charge de celui-ci :
au cours d'une séance de travail au centre hospitalier,
sur un site de référence en exploitation choisi par le
groupe de travail,
dans l'(les) usine(s) de fabrication.
Il est impératif de stipuler dans le cahier des charges la date
de clôture des essais.
Par exemple : Les démonstrations et mises en prêt éventuelles
pourront débuter dès la mise à disposition du cahier
des charges, pour se terminer impérativement le Vendredi XX à
17 heures.
Si un grand nombre de sociétés est susceptible de postuler,
la gestion des essais doit être coordonnée directement par
l'Ingénieur Biomédical (cas du monitoring compact).
Afin de cadrer les essais de façon indiscutable et donc d'assurer
une équité entre les fournisseurs. Il faut rédiger
une procédure d'essais à faire parvenir à tous les
services tests.
Ces services seront sélectionnés en fonction de :
Ø
La diversité
des services utilisateurs.
Ø
Leur situation
géographique.
Ø
Le nombre
de dispositifs médicaux concerné par le marché.
Ø
La motivation
des utilisateurs sur une durée égale ou supérieure
à un mois.
La procédure comprendra :
Ø
Le nom,
la fonction et le poste du responsable des essais à joindre impérativement
avant tout contact avec les fournisseurs.
Ø
L'obligation
pour chaque fournisseur, et pour chaque matériel, de remplir une
fiche de mise en prêt à renvoyer avant tout essai au département
biomédical. Il autorisera ou non ces essais (ex : absence de marquage
CE). Tous les champs que comporte cette fiche sont obligatoires, la date
de fin de prêt doit coïncider avec la date de fin d'essai inscrite
sur le planning ci-joint.
Ø
Le planning
des essais avec des durées identiques entre toutes les sociétés.
Sa mise au point est due à la coordination entre le responsable
des essais et la société. (cf. annexe 7)
Ø
Une fiche
d'évaluation à renvoyer immédiatement après
chaque essai. (cette fiche est à rédiger après avoir
défini les critères de choix).
Maintenant, je vais procéder à une synthèse des
informations financières, techniques, médicales. C’est l’objet
du rapport d’analyse des offres, plus communément appelé
rapport de choix. Il sera présenté en commission d’appel
d’offres. S’il est validé la commande sera passée. Après
le délai de livraison spécifié dans l’offre, la société
livre, installe et met en service le matériel. L’atelier biomédical
concerné valide cette mise en service et vérifie que la formation
des utilisateurs a eu lieu.
(Retour Sommaire)
8. Choix du
titulaire :
8.1. Rapport de choix :
Ø
Associer
l'ensemble des utilisateurs (médecins, cadres soignants, ingénieurs,...).
Ø
Traiter
avec équité l'ensemble des fournisseurs.
Plan type du rapport de choix :
I. Composition de chaque lot et enveloppe qui lui est attribué.
II. Publicité.
III. Dates d'envoi et de réception des plis.
IV. Date d'ouverture des plis par la Commission d'Appel d'Offres
V. Analyse des offres par ordre d'arrivé des plis
VI. Conclusion : attribution de chaque lot à une société
Il est régi par les articles 203 et 298 du Code des Marchés
Publics (cf. annexe 8).
Nécessité d'une collégialité du choix (utilisateurs,
ingénieurs, services économiques).
8.2. Choix :
Le rapport d’analyse est présenté en Commission d’Appel
d’Offres. Deux possibilités :
Validé : sera présenté en commission d’appel d’offres.
S’il est validé, les services administratifs rédigent la
mise au point du marché, puis l’envoient à la tutelle. Au
retour, le marché est enregistré, visé puis notifié
au fournisseur.
S’il n’est pas validé : l’ingénieur et/ou les utilisateurs
devront fournir des renseignements complémentaires. Après
la rédaction d’un nouveau rapport de choix, la commission d’appel
d’offres examinera les informations supplémentaires et validera
ou non ce choix.
8.3. Livraison, Installation, Mise en service :
Suite au délai de livraison, la livraison, l’installation et
la mise en service ont lieu. Le service biomédical après
les essais validés, et après s’être assuré de
la formation utilisateur autorise l’envoi du marché à la
tutelle. Après retour du marché, la notification du marché
au fournisseur a lieu, puis 45 jours après la livraison le centre
hospitalier procède au paiement.
La libération de la caution ou de la retenue de garantie a lieu
un an après la mise en service. Le plus souvent, c’est la date de
fin de garantie.
(Retour Sommaire)
|
Partie
3 : APPEL D OFFRES EUROPEEN EN MONITORING
|
1.
Caractéristiques techniques :
Paramètres monitorés permettant la surveillance des processus
physiologiques vitaux du patient
ElectroCardioGramme (E.C.G.)
Saturation Partielle du sang en Oxygène (SpO2)
Pression Non Invasive (P.N.I.)
Température
Pression Invasive
Capnographie
Taux d’oxygène et de dioxyde de carbone transcutané (tcpO2
/ tcpCO2)
L'objectif de ce paragraphe est une description sommaire du principe
de fonctionnement des paramètres monitorés par les scopes.
Principe de fonctionnement de l'électrocardiographie :
Le signal prélevé par les électrodes en Ag / AgCl
est électrique (de l'ordre de 1mv). Un amplificateur de fort gain
est nécessaire. Le principal problème pour monitorer l'ECG
est de filtrer les signaux parasites. En particulier deux filtres sont
indispensables :
filtres du myogramme,
filtre secteur (50 Hz).
Après l'acquisition du signal, il doit être digitalisé,
mémorisé. Parfois le moniteur permet la détection
d'arythmies grâce à un algorithme. Possibilité de détecter
les asystolies, la fibrillation ventriculaire, la tachycardie.
Une analyse du segment S-T peut également être proposée
sur des moniteurs compacts.
Principe de fonctionnement de la fréquence respiratoire :
Impédancemétrie (méthode la plus couramment
employé pour des moniteurs compacts): On va injecter un courant
constant alternatif sur les électrodes ECG puis mesurer les variations
de tension aux borne des électrodes.Thermistance :On va mesurer
les variations de température cycliques (fréquence respiratoire)
devant une narine.
Principe de fonctionnement de l’oxymétrie de pouls :
On sait depuis longtemps que l’oxyhémoglobine est rouge et l’hémoglobine
réduite bleue. Une technique capable de mesurer des variations de
coloration permet donc de la détermination de l’oxygénation
de l’hémoglobine donc la saturation.
Comme les variations de couleur sont dues à des différences
d’absorption de lumière sélective, on peut obtenir des résultats
identiques en utilisant une source lumineuse monochromatique et en observant
le niveau d’absorption. A une longueur d’onde donnée, l’hémoglobine
rouge va présenter une absorption différente de celle de
l’hémoglobine réduite, bleue. Cette technique spectrophotomètrique
fait appel à la loi de Beer.
I=Io.exp(-.C.X)
Où : Io = Intensité de lumière incidente pénétrant
dans la chambre de mesure
I = Intensité de lumière transmise à la sortie
de la chambre
X = Epaisseur de la chambre
C = Concentration de l’élément à étudier
= Coefficient d’extinction moléculaire de l’élément
considéré à la longueur d’onde
Sachant que pour chaque substance à une longueur d’onde donnée,
il existe une quantité spécifique d’absorption lumineuse,
présente dans la loi de Beer et appelée coefficient d’extinction
moléculaire.
La loi de Beer implique les notions suivantes :
source lumineuse monochromatique,
faisceau lumineux homogène et dirigé perpendiculairement
à la chambre de mesure,
échantillon inconnu présent dans une solution qui n’interfère
pas,
la solution est claire et non turbide,
L’oxymètre de pouls a un microprocesseur qui effectue la gestion
entre logiciel / matériel (software / hardware). L’élément
de mesure comprend 2 diodes électroluminescentes (L.E.D.) émettant
l’une dans le rouge (660nm) et l’autre dans l’infrarouge (940 nm) ainsi
qu’une diode photo réceptrice. Les systèmes d’alimentation
des L.E.D. et des amplificateurs de la photodiode sont couplés au
microprocesseur par l’intermédiaire de convertisseur digital / analogique
et analogique / digital. Les signaux terminaux sont surveillés par
le logiciel. Chaque L.E.D. est allumée et éteinte alternativement
de telle façon que la photodiode ne détecte que la lumière
provenant d’une seule source à la fois.
Les signaux au niveau d’un site périphérique (doigt en
général) sont généralement perdus dans les
cas suivants :
hypothermie significative,
hypotension (Pression sanguine moyenne inférieure à 50
mm Hg),
administration de vasoconstricteurs,
compression artérielle directe.
Principe de fonctionnement de la pression non Invasive :
Mesure de la pression systolique, de la pression diastolique et de la
pression artérielle moyenne. Pour le mode adulte / enfant, le brassard
gonfle initialement à 180 mm Hg, pour le mode nouveaux-nés
le brassard gonfle à 125 mm Hg.
Deux méthodes :
Méthode de Korotkow (la moins utilisée):
Le brassard comprend un capteur de détection de pression (quartz
piézo-électrique) et un microphone permettant la détection
des bruits.
Méthode Oscillométrique (la plus utilisée) :
Séquence de détermination :
Une fois que le brassard s’est gonflé à la pression initiale,
le moniteur commence une séquence de dégonflage par palier
où sont déterminés successivement la systolique, la
pression artérielle moyenne (P.A.M.), la diastolique à partir
des impulsions induites au brassard aux différents paliers de pression.
Cette méthode de détermination de la pression met en œuvre
un transducteur mesurant non seulement la pression du brassard, mais également
les infimes oscillations de pression le traversant.
Le moniteur dégonfle le brassard chaque fois qu’il détecte
2 pulsations d’amplitude sensiblement égales. La période
séparant ces deux paliers de dégonflage dépend de
la fréquence de ces couples de pulsations égales (pouls du
patient), mais si le moniteur ne trouve aucune pulsation dans un délai
très court (1 à 2s), il dégonfle à nouveau
le brassard. Le dégonflage et la détection de pulsations
égales se poursuivent jusqu’à ce que la diastolique soit
déterminée.
Cycle de fonctionnement de base :
- période de gonflage
- période de dégonflage
- période d’évaluation
- période d’attente
Principe de fonctionnement de la capnographie :
La théorie réside en l'utilisation de la spectrométrie
lumineuse sélective sur une bande d'absorption des Infra Rouges
par le CO2.
Le moniteur mesure le gaz carbonique grâce à un capteur
muni de transistors. On place ce capteur sur l'adaptateur patient et l'adaptateur
patient est placé sur le circuit respiratoire.
La lumière infrarouge est générée par des
LED placées sur une branche du capteur en "U", elle est réceptionnée
par un photo détecteur placé sur l'autre branche du "U".
L'oxyde de carbone, traversant l'adaptateur à la suite de la
respiration , absorbe une certaine quantité de cette énergie
lumineuse. Le moniteur fait la relation entre la quantité de cette
énergie absorbée et la quantité de CO2 présente
dans la cellule d'échantillonnage (adaptateur patient).
La méthode inspiratoire utilise le même principe physique,
la différence est qu'avec une tubulure on prélève
un échantillon d'air expiré qui sera analysé par un
capteur situé dans le moniteur et non plus sur le circuit patient.
Le capnogramme est la courbe de la concentration du CO2 mesurée
au niveau de l'air expiré. Il a normalement une forme rectangulaire
à laquelle on décrit 5 phases principales (après la
brève phase initiale E1, inapparente, correspondant à l'expiration
de l'espace mort anatomique) :
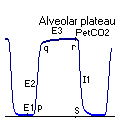
Le capnogramme normal
E2 : pente ascendante, presque verticale (air mixé),
Angle Q : proche de 90°, habituellement bien marqué,
E3 : plateau expiratoire presque horizontal (air alvéolaire),
R : pic télé expiratoire (PetCO2) proche de la PaCO2,
I1 : pente descendante verticale (début de l'inspiration suivante)
Principe de fonctionnement de la tcpO2 et la tcpCO2 :
Comme son nom l'indique, il s'agit de moniteurs transcutanés
de gaz du sang. Le principe de fonctionnement est simple. Comme l'oxygène
et le gaz carbonique peuvent diffuser à travers les tissus et la
peau du corps, il est possible de les détecter grâce à
un capteur appliqué sur la surface de la peau. Afin de créer
une artérisation locale, le capteur est chauffé à
une température constante qui est plus élevée que
la température normale du corps à la surface de la peau,
ce qui provoque une diffusion plus importante des gaz à travers
la peau.
Le capteur est constitué de deux électrodes :
Une électrode de type Clark pour mesurer la pO2 (pression partielle
en oxygène) via un courant électrique.
Une électrode de type Severinghauss pour mesurer la pCO2 via
une mesure du pH.
La valeur transcutanée des gaz du sang peut être interprétée
comme la pression partielle des gaz du sang régnant au niveau du
tissu de la peau ayant subi une artérisation, la corrélation
étant surtout vraie chez les nouveaux nés.
Technique : une évaluation transcutanée des pressions
des gaz carbonique par rapport à une analyse artérielle des
gaz du sang classique.
Cette technique a cependant ses limites, on peut citer entre autres
cas :
Vasoconstriction périphérique profonde.
Maladies provoquant des occlusions artérielles.
Shunt artério-veineux.
Oedème de la peau.
Hypothermie pendant une intervention chirurgicale
Elle nécessite de plus une surveillance rapprochée de
la température du capteur qui doit être suffisamment élevé
sans toutefois brûler le patient. Il est nécessaire de changer
souvent le site de mesure (toutes les 2 heures).
En suivant la structure de la première partie, je vais préciser
quel est l’aspect réglementaire de ce type de moniteurs.
(Retour Sommaire)
2. La règlementation
:
Nous utiliserons le Web afin de rechercher le code la santé publique,
pour cela nous utiliserons un moteur de recherche.
Je suis la méthodologie sur la recherche de la réglementation
explicitée précédemment.
Lois, décrets, arrêtés, circulaires
L’intégralité des textes cités ci-dessous se trouve
en annexe 9.
Une Loi :
loi n°94-43 du 18 janvier 1994 relative à la santé
publique et à la protection sociale
Un Décret :
Décret n° 95-292 du 16 mars 1995 relatif aux dispositifs
médicaux
Quatre Lettres Circulaires :
Lettre Circulaire 14 du 29 mars 1994 relative à l'utilisation
des moniteurs de la saturation de l'hémoglobine en oxygène
par oxymétrie de pouls (SpO2).
Lettre Circulaire 960146 du 16 janvier 1996 relative à la
sécurité des moniteurs BP 308 MARK III de la société
BAXTER
Lettre Circulaire 960490 du 7 février 1996 relative aux moniteurs
de surveillance de la série 7000 à 7010 de la société
MARQUETTE, qui dans certaines conditions ne détectent pas la fréquence
cardiaque ce qui représente un risque vital pour le patient.
Lettre Circulaire 976965 du 14 août 1997 relative aux risques
liés à l'utilisation des moniteurs de surveillance série
7005 de la société MARQUETTE.
Projet de lettre circulaire relative aux moniteurs de surveillance
des paramètres physiologiques.
Marquage CE
Ce dispositif est un appareil électromédical servant au
diagnostic. Il doit être marqué CE médical, Classe
IIb.
Normes :
Le matériel de médecine est référencé
dans le catalogue "classe S", chapitre "Médecine-Chirurgie". Ce
chapitre comprend les normes de NF S 90 et ses sous sections à NF
S 99 et ses sous sections.NF S 90 : Médico-Chirurgical et Pharmaceutique
NF S 91 Art dentaire
NF S 92 Systèmes d'analyses médicales in vitro
NF S 93 Transfusion, Perfusion, Injection, CEC
NF S 94 Implants et Instruments Chirurgicaux
NF S 97 Divers
NF S 99 Généralités
Concernant la recherche d'appareils éléctromédicaux
comprenant implicitement les moniteurs médicaux, le résultat
est le suivant :
66 normes ou projets de normes ont été trouvés
on remarque rapidement que les normes correspondant aux moniteurs ont
comme référence :
NF EN 60601-1
NF EN 60601-2
A présent recherchons les normes concernant la compatibilité
électromagnétique :
Parmi les 100 réponses affichées, on filtre la norme correspondant
aux appareillages Industriels, Scientifiques et Médicaux (ISM) :
NF EN 55011
(Retour Sommaire)
3.
Moniteurs de surveillance multi-paramétrques :
Etude de marché sur les moniteurs compact au C.H.U. de Montpellier
L’objectif de cette étude est d’abord ce cerner quelles sociétés
ne sont pas référencé au C.H.U. de Montpellier comme
distributeur de monitoring. Ceci partie des critères de choix de
l’offre, en effet, j’avais stipulé dans les critères de choix
qu’une intégration dans le parc existant est souhaité.
Actuellement dans cette catégorie de moniteurs, on trouve sept
sociétés. Cela implique sept interlocuteurs différents
quant au service après vente.
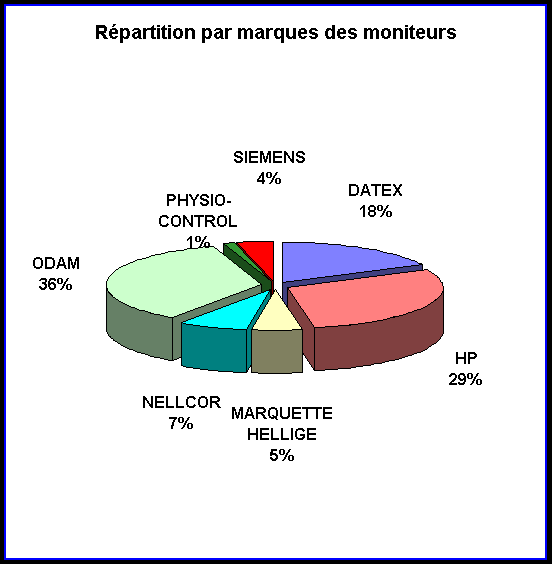
En affinant les données obtenues grâce à la Gestion
de la Maintenance Assistée par Ordinateur (G.M.A.O.), je vais distinguer
les différents modèles de moniteurs par marque.
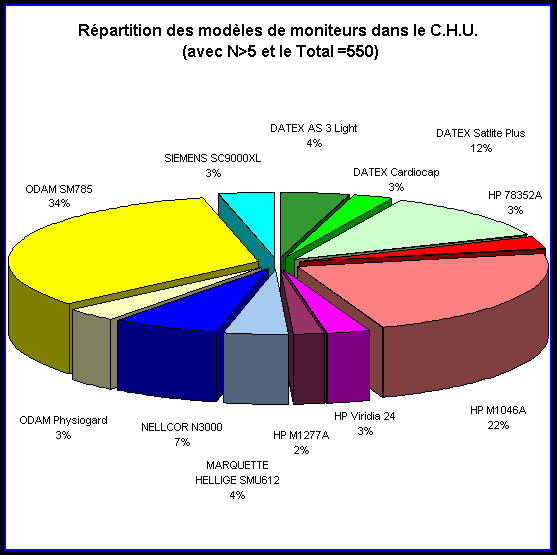
Cela permet de cibler quels moniteurs sont déjà connus
de notre service. Le but est d’avoir une estimation de la fiabilité
des différents modèles.
Critères de choix
J’ai choisi les critères suivant :
Caractéristiques techniques du matériel
Intégration dans le parc existant
Coût d'acquisition
Prix de revient du consommable
Ergonomie du matériel
Organisation du SAV
Références similaires d'installation
Rédaction du C.C.T.P.
Cette partie a déjà été traitée en
détail précédemment. Le cahier des charges apparaît
dans l’annexe 5.
Conditions d'Essais
Dans les Plans d'Equipements 98/99 ainsi que pour les 2 ans à
venir, le C.H.U. de Montpellier prévoit l'acquisition de 45 à
135 moniteurs de type "compact".
Plusieurs dizaines de sociétés sont susceptibles de répondre
à cet Appel d'Offres Européen à bons de commandes.
C'est pourquoi, il est impossible d'effectuer des essais dans tous les
services.
Définition du nombre de services d'essai et leur situation :
Trois points à observer :
Géographiquement, on distingue deux sites comprenant chacun 2
hôpitaux : Arnaud de Villeneuve / Lapeyronie et Gui de Chauliac /
Saint-Eloi.
L'importance du marché, et donc le nombre de sociétés
susceptible de répondre.
La divergence en terme de spécialités entre les services
de soins (12 lots qui vont de la réanimation neurochirurgicale au
SAMU).
J’ai choisi un service d'essais sur chacun des trois hôpitaux
concernés, soit trois services tests (Saint-Eloi n'étant
pas concerné par ces achats).
Hôpitaux sélectionnés :
Hôpital Lapeyronie
Hôpital Arnaud de Villeneuve
Hôpital Gui de Chauliac
Un grand nombre d'achats est prévu en pédiatrie, en neuro-chirurgie
et au SAMU. J’ai du contacter donc les trois chefs de services (et les
surveillantes) afin de valider ce choix. Une prise de contact favorable
avec ceux-ci a conforté cette décision.
Services tests sélectionnés :
SAMU à l'Hôpital Lapeyronie
Service de Soins Intensifs, Pédiatrie II à l'Hôpital
Arnaud de Villeneuve
Service de Réanimation, Neurologie A à l'Hôpital
Gui de Chauliac
Sur les plans d'Equipement 98/99, 23 services sont concernés
par ces achats. Afin de ne pas négliger les 20 services qui n'effectueront
pas d'essais, ils recevront en même temps que le planning une feuille
d'évaluation. Je vais utiliser un coefficient de pondération
afin de minorer une évaluation ponctuelle comparée à
un essai de deux semaines.
Les sociétés :
Le faible délai entre la date limite de remise des plis (28 Juin
1999) et le mois d'Août perturbe le planning de test initial. J'envisage
comme solution d'anticiper les essais pour certaines sociétés.
Ils auront lieux pendant Juin et Juillet. Cela implique que la moitié
des sociétés effectuera des essais sans avoir communiqué
leur offre.
Connaître les sociétés susceptibles de répondre
afin d'anticiper des essais ?
Pour tout type de marché, chaque société qui retire
le cahier des charges doit laisser :
sa raison sociale,
son adresse,
le nom et le numéro de la personne qui le retire.
Cependant une partie de ces sociétés ne va pas répondre
(incompatibilité entre leur offre et la demande exprimée
par l'Hôpital).
Dans un Appel d'Offre Européen, des sociétés peuvent
postuler bien qu'elles ne disposent pas d'agence en France. Le risque est
de faire des essais avec une société qui ne répondra
pas (essais non concluant, coût trop élevé...). Dans
le cas où ceux-ci ont donné satisfaction, j'aurais du mal
à expliciter qu'une société effectue des essais sans
répondre. Pour éviter cela, j’ai sélectionne selon
les critères suivants :
la part de marché en nombre de scopes au sein du C.H.U.,
le chiffre d'affaire réalisé en France.
Durée des essais :
Ce type de moniteur est bien connu par les utilisateurs. Les paramètres
demandés utilisent des technologies maîtrisées par
le département biomédical. En prenant en compte le nombre
de sociétés qui peuvent répondre (une quinzaine en
Europe), je décide que la durée des essais n'excèdera
pas 2 semaines par société.
1. Prise de contact avec la société :
Le nom et le numéro de téléphone de la personne
à contacter apparaît sur le registre des sociétés
ayant retiré le cahier des charges. Après un contact téléphonique
avec le service commercial, j’ai sollicité un entretien préalable
à tout essais.
Les entretiens doivent être terminés le 1er Juin. Objectifs
de cet entretien :
s'assurer du marquage CE médical impératif à tout
essai,
s'informer sur l'offre industrielle, avoir un aperçu de l'adéquation
entre le matériel proposé par la société et
le matériel souhaité par le C.H.U.,
expliciter la procédure qui va régir ces essais,
proposer (et planifier) une démonstration technique au département
biomédical.
proposer (et planifier) un essai en service de soins anticipé
dans le moi de Juin.
A présent, un planning d'essais pour le mois de Juin peut être
établi (cf. annexe 7).
Au cours des mois de mai-juin, j'ai eu 15 entretiens avec des sociétés
au sujet des scopes. La durée moyenne d'un entretien se situe entre
une et deux heures.
Les essais techniques ont lieu en atelier électronique médicale
avec l'adjoint technique responsable des scopes. Quand le moniteur n'est
pas référencé au C.H.U., je demande à l'ouvrir
afin d'observer sa maintenabilité. Celle-ci s'exprime par la facilité
de changer la batterie, le nombre de cartes, la technologie en oxymétrie,
etc.. Cette approche ne semble pas habituelle vu les problèmes des
commerciaux à remonter les moniteurs.
Au cours du mois de juin, j'ai assisté à 10 démonstrations
techniques. La durée moyenne de deux heures m'a permis d'aborder
un aspect peu détaillé dans les documents constructeur :
la mise en réseau avec un écran central. Le réseau
sera de préférence non propriétaire (Ethernet) afin
de permettre l'adjonction de moniteurs de marques différentes.
Sociétés vues en démonstrations :
BAXTER
BRUKER
CRITIKON
DATEX
FRANCE MEDICAL
HEWLETT-PACKARD
MALLINCKRODT
(NELLCOR)
MARQUETTE
PHYSIO-CONTROL
SIEMENS
Protocole d'essais (cf. annexe 6):
Afin de formaliser son déroulement, j’ai rédigé
un protocole à l'attention des trois services tests et des vingt
services concernés. Il comprend :
le lieu et le nom des services tests
la durée des essais
la demande de remplir et de renvoyer la fiche de mise en prêt
ci-jointe
la demande de renvoyer la fiche d'évaluation après chaque
essai
la demande de renvoyer une fiche consécutive à la totalité
des essais avec le classement de chacun des moniteurs
Rapport de choix :
Structure du rapport :
I. Composition de chaque lot et enveloppe qui lui est attribuée.
II. Publicité.
III. Dates d'envoyé et de réception des plis.
IV. Date d'ouverture des plis par la Commission d'Appel d'Offres
V. Analyse des offres par ordre d'arrivée des plis
VI. Conclusion : attribution de chaque lot à une société
J’ai commencé par rédiger un tableau technique comparatif
entre tous les scopes proposés pour chaque lot. Les critères
de choix, puis la grille d'évaluation fournie aux services de soins
m'ont servi de structure pour la rédaction du tableau comparatif.
J’ai établi un tableau récapitulatif recensant tous les moniteurs
proposés dans les lots 1 à 11 en tant que synthèse.
J’ai également établi un comparatif du coût d’utilisation
pour chaque moniteur. Dans le C.C.T.P., nous avions spécifié
que la société doit répondre en estimant le coût
en consommables (pour une durée de trois ans. Cependant ce type
de matériel n’engendre pas de différences significative en
terme de consommables. Les différences se situent au niveaux des
structures de Service Après Vente.
Les moniteurs proposés du lot 1 à 11 par les sociétés
sont souvent identiques, il paraît donc possible de sélectionner
une société pour les onze premiers lots. Le lot n° 12
est plus spécifique, il concerne des moniteurs de capnographie portables,
seules trois sociétés ont répondu.
Cependant la rédaction du rapport de choix s'avère compliquée,
je dois synthétiser une multitude d'informations dues :
à un grand nombre de sociétés ayant répondu
(9),
au nombre considérable de lots (12),
à l'importance du marché (marché à bon de
commandes : 8 millions F TTC sur 3 ans).
Le fait d'avoir autorisé les variantes complique singulièrement
ce dossier (ex : Hewlett-Packard a proposé 8 offres au lot n°3).
Dans un but de simplification, je vais décrire tous les scopes
en détaillant leurs avantages et leurs défauts. Puis pour
chaque lot, j'y ferai référence afin d'argumenter le choix
de la société retenue.
Pour chaque lot, je débute par le moins disant et argumente l’offre
proposée. Quand l’adéquation entre le moniteur proposé
et les critères de choix apparaît, je spécifie que
la société est retenue.
Choix :
Le rapport de choix sera proposé à la Commission d'Appel
d'Offres le 16 Septembre. Elle peut valider ce choix directement ou demander
des informations supplémentaires (à l'ingénieur biomédical,
au service de soins...).
Le rapport n’étant pas encore visé par cette commission,
ma direction ne souhaite son introduction dans les annexes. C’est pourquoi,
je vous le communiquerais le 17 septembre, lendemain de la validation du
choix par cette commission.
Livraison, Installation et Mise en service
Pour des raisons similaires à celles exprimées ci-dessus,
je ne peut actuellement traiter cette partie.
(Retour Sommaire)
|
Partie
4 : APPORT DES AUTRES SUJETS TRATES
|
(Par ordre chronologique)
1.
Achat d'oxymètres de pouls : Avril-Mai
Type de marché : consultation (par fax)
L'objet de ce marché est l'achat de 12 oxymètres de pouls
répartis en 3 lots.
Essais durant 1 mois sur les 3 services concernés.
Apport : bien vérifier les devis qui comprennent souvent des
omissions. Sur ce marché la société retenue n'avait
pas fourni le raccord entre les capteurs pédiatriques et les oxymètres.
Le surcoût total est de l'ordre de 5000 F TTC. J'ai du contacter
le directeur commercial pour lui spécifier que la commande ne serait
pas réglée tant que ces accessoires ne seraient pas fournis.
Le dispositif doit être obligatoirement livré en état
de fonctionner.
(Retour Sommaire)
2.
Achat de trois lèves-malades avec pesée : Mai
Type de marché : consultation (par fax)
Essais durant 2 mois sur les 3 services concernés.
La pesée à fin médicale doit être homologuée
par la D.R.I.R.E.. Chaque année, le C.H.U. envoie à cet organisme
le résultat d’un contrôle externe concernant tous les instruments
de pesée.
La particularité de cet achat vient de la diversité des
services utilisateurs. Le plus contraignant est le service de réanimation
neurochirurgicale, les patients sont inertes ce qui nécessite une
civière rigide et une stabilité irréprochable du lève
malade.
(Retour Sommaire)
3.
Achat de 3 incubateurs d'attente + 1 incubateur de soins intensifs + 2
tables radiantes de réanimation + 1 incubateur de transport : Juin-Juillet
Type de marché : marché négocié avec mise
en concurrence.
Essais durant 1 mois et demi.
Les trois incubateurs d'attente sont renouvelés suite à
la lettre circulaire du 06 Octobre 1998 applicable avant le 06 Octobre
1999 spécifiant la nécessité d'une sonde de température
cutanée en plus de la sonde de température ambiante.
L'UGAP vient d'attribuer ses lots d'incubateurs à la société
DRAGER connue favorablement du C.H.U.. J'ai contacté le service
commercial de cette société qui m'a fait des propositions
équivalentes à celles de l'UGAP. J'ai poursuivi en sollicitant
un avis écrit de la part des chefs de services concernés
sur le matériel proposé. Leur réponse favorable et
la notion d'urgence m'ont conduit à passer un marché avec
l'UGAP.
Cet organisme ne référence pas de société
pour l'incubateur de transport. Le lot a été rendu infructueux
par l'UGAP car une des deux sociétés possibles n'a pas répondu.
Il y a l'obligation de rendre le lot infructueux s'il n'y a qu'un seul
candidat.
Ce matériel a un coût double de celui d'un incubateur classique.
Ces caractéristiques techniques sont différentes, il peut
être héliporté (24V), transporté en véhicule
(12V) et doit posséder une autonomie supérieure à
une heure.
J'ai donc rédigé les critères de choix puis le
CCTP que j'ai envoyé aux deux sociétés susceptibles
de répondre. J'ai ensuite créé une grille d'évaluation
que le service utilisateur (SAMU) m'a renvoyé à la fin des
essais.
(Retour Sommaire)
4.
Achat de 6 bras d'anesthésie : Mai-Juin-Juillet
.
Type de marché : marché négocié avec mise
en concurrence.
Ce projet est très instructif à traiter. Il fait intervenir
:
les services soins
le département biomédical
la direction technique
les infirmiers hygiénistes
la direction de l'établissement
Les anesthésistes souhaitent procéder à une inversion
dans les 6 salles du bloc de chirurgie thoracique et cardio-vasculaire.
Tout d'abord j'écris au chef de service afin qu'il me définisse
exactement ses besoins (fluides, électricité (onduleur),
charge utile...). En fonction de ses réponses je contacte 3 sociétés
pour voir quelles sont les caractéristiques techniques des bras
proposés. Un problème apparaît, les platines d'ancrages
ne supportent pas les futurs bras, elles seront donc à renouveler.
Le surcoût atteint 50 000 FTTC pour les six bras.
Avant de rédiger le CCTP, j'ai demandée aux 3 sociétés
de me fournir un schéma d'implantation pour chaque salle avec diverses
configurations (bras simples, doubles, à double articulation...).
J'ai organisé une réunion avec tous les interlocuteurs, l'objectif
étant de valider une configuration de salle (type de bras, emplacement...)
et de prévoir un planning de travaux avec la Direction des travaux
les hygiénistes et le service. Nous décidons de fermer les
salles 2 par 2, cela nécessite l'accord de la direction générale
La réglementation impose que les bras soient marqués CE
en classe IIb puisqu’ils véhiculent de l'oxygène, considéré
comme médicament. J'ai rédigé les critères
de choix puis le cahier des charges avec toutes ces informations. L'ouverture
des plis est prévue le 16 septembre 1999
(Retour Sommaire)
5.
Participation à la rédaction du C.C.T.P. de l'I.R.M.:
Type de marché : appel d'offres européen
Mon rapport de stage ne traitant pas d'imagerie, j'ai souhaité
participé à un projet sur ce sujet. M. Moreau, l'ingénieur
en chef responsable du département biomédical m'a proposé
de m'associer à lui pour rédiger le C.C.T.P. du renouvellement
d'une I.R.M. 1,5 tesla avec spectroscopie. J'ai du me documenter sur le
sujet pendant une semaine, puis j'ai contacté les 3 principales
sociétés (GEMS, SIEMENS, PHILIPS) afin de m'entretenir avec
un ingénieur support produit. L'objectif était de cerner
l'offre industrielle.
Nous avons du contacter les 3 professeurs concernés par cette
acquisition (Neuroradiologie, Imagerie, Médecine Nucléaire)
et la Direction des Travaux.
Après la rédaction des critères de choix, nous
avons commencé celle du C.C.T.P.. La particularité d'un tel
projet est d'intégrer :
les objectifs médicaux (E.P.I., Spectroscopie...)
les fonctionnalités du matériel souhaitées (conformance
statement, réseaux...)
les travaux (reprise de l'I.R.M. actuelle...)
la maintenance
Au cours de ce marché, le département biomédical
et sa direction ont conjointement décider de modifier tous les futurs
marchés. La raison vient de l'impossibilité d'acheter des
pièces détachées, des consommables ou des prestations
de service quand le seuil de 300 000 FTTC avec une société
est atteint.
M. DURAND-GASSELIN, ingénieur en chef responsable de la maintenance
et moi-même avons rédigé un marché générique
à utiliser pour tout achat. Chaque lot fourniture sera associé
à des lots bis et ter.
lot bis : prestation de service (maintenance)
lot ter : fourniture accessoire de matériels, de consommables
et de pièces détachées
Nouvelle structure de marchés
Les lots bis, ter et leurs annexes se trouvent à l’annexe 10.
lot fourniture
lot bis : prestation de service (maintenance)
Nature des différentes prestations : maintenance, contrôle...
Valorisation des prestations : analyse des coûts, conditions de
retour atelier
Rapport d'intervention : description, plus niveau de maintenance
Sous-traitance : nom des sociétés, devis gratuits...
Délais d'intervention
Conditions d'interventions : description...
Accès aux locaux
Résiliation
Mise en prêt de matériel : en cas d'immobilisation du dispositif
lot ter : fourniture accessoire de matériels, de consommables
et de pièces détachées
Obligation de fournir le certificat de marquage CE médical.
(Retour Sommaire)
6.
Achat d'un injecteur amagnétique de produits de contraste : Juin
Type de marché : marché négocié avec mise
en concurrence
Nous n'avons pas inclus ce dispositif dans le marché de l'I.R.M..
Ceci afin de pouvoir inclure dans le lot bis des clauses de contrôles
de performance spécifiques à ce dispositif.
(Retour Sommaire)
7.
Réunions sur l'accréditation
Réunions sur l'accréditation des hôpitaux La Colombière,
Bellevue et Antonin Balmes.
Ma présence à ces réunions est due à ma
position de Correspondant Local Matériovigilance. L'objectif est
une auto-évaluation sur divers critères dont la gestion des
risques et des vigilances. Cette évaluation précède
celle de l'Agence Nationale d'Accréditation et d'Evaluation en Santé.
(Retour Sommaire)
8. Réunion
hebdomadaire :
Réunion hebdomadaire de deux heures pendant six mois entre les
ingénieurs biomédicaux, les adjoints techniques classe exceptionnelle
et le corps de direction de la Direction des Equipements et de la Logistique.
Elles sont très profitables, elles permettent aux ingénieurs
de faire des choix quant à la politique de maintenance, d'achats
en ayant des avis diverses (chef de bureau spécialisé en
marché, directeur des équipements...).
(Retour Sommaire)
9. Réunion
AFIB :
Responsabilité juridique de l'ingénieur biomédical
:
Responsabilité administrative, responsabilité pénale
et responsabilité de la personne morale
Responsabilité de l'ingénieur au regard des marchés
publics, de la délégation de signature, de la garantie décennale,
la loi sur les produits défectueux et la problématique An
2000
veille réglementaire, sécurité sanitaire et contrôle
de la qualité des dispositifs médicaux
(Retour Sommaire)
10.
Réunion des Ingénieurs Biomédicaux :
Pompes d'analgésie PCA en vue de la prise en compte de la douleur
Indicateurs: l'ACCORB
(Retour Sommaire)
11. La matériovigilance:
Le décret 96-32 du 15 janvier 1996, relatif à la matériovigilance
exercée sur les dispositifs médicaux et modifiant le Code
de la Santé Publique définit les lignes directrices permettant
d'assurer la surveillance et la déclaration des incidents survenus
sur le matériel médical.
Obectifs :
Améliorer la santé et la sécurité des patients,
des utilisateurs et d'autres personnes en réduisant le risque de
voir se reproduire, à des moments et des endroits différents,
le même type d'incident préjudiciable.
Produits concernés :
Loi du 18 janvier 94 modifiée par la loi 95.116 du 4 février
95
"On entend par dispositif médical (D.M.) tout instrument, appareil,
équipement, matière, à l'exception des produits d'origine
humaine ou autre article utilisé seul ou en association, y compris
les accessoires et logiciels intervenant dans son fonctionnement, destiné
par le fabricant à être utilisé chez l'homme à
des fins médicales et dont l'action principale voulue n'est pas
obtenue par des moyens pharmacologiques ou immunologiques, ni par métabolisme,
mais dont la fonction peut être assistée par de tels moyens".
Tous les produits, stériles ou non stériles
- Matériel médico-chirurgical consommable,
- Ligatures, sutures, prothèses, pansements....
- Respirateurs, bistouri, pousse seringue, scanner...
Moyens mis en place :
Une commission Nationale de Matériovigilance
Des correspondants locaux (une pharmacienne est le correspondant local
matériovigilance, elle gère tous les D.M. stériles;
un ingénieur biomédical est le correspondant local suppléant
matériovigilance, elle gère tous les autres D.M.).
Les objectifs des correspondants locaux da matériovigilance
sont :
1) - Recueillir :
la prise en charge des alertes internes
Elles sont émises par les services de l'établissement.
Il appartient au département biomédical d'engager la pré-enquête
et de mettre tout en œuvre afin d'établir :
s'il s'agit réellement d'une alerte matérioviglance
de retrouver tous les paramètres nécessaires à
la reproduction du problème
la prise en charge des alertes émanant du Ministère
Le rôle du département biomédical est prépondérant
car il est le garant de la mise en œuvre de tous les moyens de sécurité,
il est en effet le seul à savoir si l'Hôpital possède
un matériel concerné par une alerte et l'endroit où
on peut le localiser dans les services (grâce à la Gestion
de la Maintenance Assistée par Ordinateur).
Il doit disposer de moyens techniques lui permettant de solutionner
rapidement tout problème concernant la matériovigilance.
la prise en charge des alertes émanant des sociétés
Le plus souvent, ce sont les sociétés qui envoient une
lettre au Correspondant Local Matériovigilance pour prévenir
un problème récurant sur un D.M.. Le département biomédical
doit avant tout à l'aide de la G.M.A.O. rechercher les D.M. incriminés
puis mettre en application les consignes préconisées.
Parfois les consignes de la société sont de retirer d'urgence
le D.M., une solution transitoire est de fonctionner quelques mois avec
un D.M. du même type si possible ou bien de commander un nouveau
D.M. en urgence (réduction des délais de publication de 36
à 15 jours) avec anticipation sur le Plan d'Equipement suivant.
2) - ORGANISER
Les flux d'informations concernant les divers incidents en faisant en
fonction de la gravité, une déclaration d'incident, sans
délai ou trimestrielle :
- au Ministère chargé de la Santé
- au Fabricant
Des procédures de matériovigilance sont mises en place
au C.H.U..
Matériovigilance sur l'année 1998 sur le CHU de Montpellier
ð
26 déclarations
d'incidents ont été répertoriées au niveau
des Dispositifs Médicaux non stériles sur l'année
1998. Sur ces 26 déclarations :
- 9 ne rentraient pas dans le cadre de la Matériovigilance,
- 19 portaient sur des Dispositifs de Fourniture Médicale et
de Consommables Biomédicaux,
- 8 ont été signalées au Ministère de la
Santé.
ð
Les notes d'alerte
émises par le Ministère, ou par les sociétés
directement, ont fait l'objet de 33 circulaires, dont 23 concernaient des
Dispositifs Médicaux utilisés sur le C.H.U. de Montpellier.
ð
Conséquences
financières
- Investissement : Renouvellement de 4 incubateurs dans le cadre
du prochain Plan
d'Equipement : 310.000 F
- Exploitation : Révision de tables d'opération
sur le site de Saint Eloi : 30.107 F
Achat de supports anti-escarres : 9.000 F
Révision laser : 1.500 F
Matériovigilance pendant la durée du stage (Avril à
Septembre) :
(cf. annexe 11)
ð
J'ai reçu
23 déclarations d'incidents répertoriées au niveau
des Dispositifs Médicaux non stériles. Sur ces déclarations
:
- 5 ne rentraient pas dans le cadre de la Matériovigilance,
- 14 portaient sur des Dispositifs de Fourniture Médicale et
de Consommables Biomédicaux,
- 4 ont été signalées au Ministère de la
Santé.
ð
En tant que
correspondant local matériovigilance, j'ai reçu 3 lettres
circulaire émises par le Ministère. Une seule concerne notre
établissement.
Les sociétés à travers leur correspondant matériovigilance
m'ont fais parvenir 6 notes d'alerte, toutes nous concernant.
On observe donc une augmentation du nombre de déclaration d’incidents.
En extrapolant sur unne année :
1998 : 26 déclarations
1999 : 55 déclarations (23*12/5)
On va certainement doubler le nombre de déclaration en 1999.
Cela ne signifie pas que les dispositifs sont moins bien maintenus, c’est
une plus grande implication des soignants dans la matériovigilance.
Les formations assurées par les correspondants matériovigilance
montrent leur efficacité.
ð
Conséquences
financières
- Investissements dus aux notes d'alerte provenant du ministère
ou des sociétés :
Budget affecté : investissement
Renouvellement d'un Electrocardiogramme dans le cadre du prochain
P.E. : 30 000 F TTC ;
Retrait d'un respirateur d'anesthésie depuis le mois de Mai
Investissements dus notifications internes :
Budget affecté : investissement
Achat d'un nouveau chariot d'anesthésie : 8 000 F TTC.
Renouvellement d'un Congélateur de Cryogénie ainsi que
de la station informatique associée en anticipation au prochain
Plan d'Equipement : 200 000 F TTC.
Budget affecté : exploitation
Renouvellement d'un Densimètre Urinaire dans le cadre du prochain
Plan d'Equipement
Rupture d'un marché concernant des électrodes
Retrait pour expertise de poches de recueil
Changement des gaines sur des amplificateurs radiologiques mobiles :
Coût : 3*20 000 = 60 000 F TTC.
Marché non renouvelé pour 2000 concernant des bonnets
de chirurgien
ð
Action
Présentation de la Matériovigilance et remise d'un questionnaire
par le Correspondant Local Matériovigilance (Pharmacienne) et par
le Correspondant Local Suppléant Matériovigilance (Ingénieur
Biomédical) aux surveillantes.
Je vais développer deux cas concrets, une note d'alerte d'une
société et une note d'alerte interne rapport à un
congélateur de cryogénie.
(Retour Sommaire)
Ce stage, effectué au sein d'une équipe dynamique et compétente,
a permis d'approfondir mes connaissances des appareils médicaux
et des procédures d'achats, de maintenance et de contrôle
du matériel. Il m'a apporté une culture hospitalière
ainsi qu'une meilleure vision du rôle de l'ingénieur biomédical
dans un établissement public. Il m'a montré les difficultés
de la gestion des personnes, de mise en place des procédures, ainsi
que le manque fréquent de communication entre différents
services.
Mon souhait concernant ce rapport est que la partie structurant un appel
d'offres européen soit utilisé comme une méthodologie
à tout marché. Ma vision sur le traitement de marchés
publics a beaucoup évoluée au cours de ce stage. Le rôle
d'un ingénieur spécialisé en achat me semble nécessaire.
La commission d'appel d'offres doit valider la méthodologie employée
(16 Septembre 1999) pour le marché à bons de commande sur
le monitoring. Ce qui engagera le C.H.U. pour une décennie (durée
d'amortissement de 7 ans pour les moniteurs, bons de commande durant 3
années consécutives). Des délais incompressibles (publication
en mai-juin) suivis des mois de juillet-aôut ont considérablement
compliqués la gestion de ce dossier. Cependant ce projet a pu être
mené à bien.
La gestion de la matériovigilance s'est avérée
consommatrice de temps et d'énergie (33 dossiers en 5 mois). Je
suis satisfait d'avoir pu vérifier la mobilisation du personnel
soignant et des sociétés dans ce nouveau type de vigilance.
C'est le résultat tangible de nombreuses formations assurées
par les correspondants matériovigilance.
(Retour Sommaire)
A.R.H. : Agence Régionale d’Hospitalisation
AFNOR : Agence Française de NORmalisation.
A.F.S.S.A.P.S. : Agence Française de la Sécurité
SAnitaire des Produits de Santé
C.M.P. : Code des Marchés Publics
C.S.P. : Code de la Santé Publique
I.N.S.E.R.M. : Institut National de la Santé Et de la Recherche
Médicale
I.S.O. : International Standard Organisation
J.O.C.E. : Journal Officiel de la Communauté Européenne
P.E. Plan d’Equipement
PMSI : Programme de Médicalisation des Systèmes d’Information.
Obligation légale pour tous les hôpitaux de fournir des informations
médico-administratives sur les séjours patients.
S.O.R. : Schéma Régional d’Hospitalisation
U.T.E. : Union Technique de l’Electricité
(Retour Sommaire)
Le support de cours m’a permis d’appréhender la plupart des dossiers
traité dans ce stage.
Documentations techniques constructeurs
Plans d’équipements annuels et tri-annuels du C.H.U. de Montpellier
Code des marchés publics
Internet :
P.M.S.I. : C.H.U. de Montpellier
Agence Régionale d’Hospitalisation : Agences
Régionales d'Hospitalisation
Schéma Régional d’Hospitalisation : le
Schéma Régional de l'Organisation de la Santé (S.R.O.S.)
Lettres circulaires : HOSMAT.
Agence Française de la Sécurité SAnitaire des Produits
de Santé : A.F.S.S.A.P.S.
Secrétariat d’état à la santé : secrétariat
d’état à la santé
Code de la santé publique : code
de la santé publique
Normes internationales : ISO
Normes françaises : l'Agence Française
de la NORmalisation.
Union Technique de l’Electricité : Union
Technique de l'Electricité
Institut National de la Santé Et de la Recherche Médicale
(l'I.N.S.E.RM.)
Sites des sociétés vues en démonstration :
BAXTER
DATEX
HEWLETT-PACKARD
MALLINCKRODT
(NELLCOR)
MARQUETTE
PHYSIO-CONTROL
SIEMENS
(Retour Sommaire)






