|
Traçabilité des dispositifs médicaux,
F. Botella, E. Marques, Projet DESS, UTC, 99-00,
|
||||
|
|
||||
|
|
|
| Si vous arrivez directement sur cette page sachez que ce travail est un rapport d'étudiant(e)s et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé lors de la période d'enseignement théorique à l'UTC et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part. L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
|
|
Traçabilité des dispositifs médicaux,
F. Botella, E. Marques, Projet DESS, UTC, 99-00,
|
||||
|
|
||||
|
|
Résumé : La stérilisation est une unité fonctionnelle importante de l'hôpital. Elle a pour fonction de produire des dispositifs médicaux stériles à usage de tous les services de l'établissement de soins. Le concept da^obligation de résultat en stérilisation
est une constante. La non-maîtrise du risque na^est pas concevable
dès la^instant où la santé du patient est engagée.
La mise en place d'un système d'assurance qualité est une
obligation d'ordre réglementaire. La synergie entre pharmacien et
ingénieur biomédical favorise le développement de
ce processus en stérilisation. Ils veilleront à assurer
Dans cet optique, nous avons réalisé une étude concernant les stérilisations assistées par ordinateur pour apporter des éléments de réflexion aux ingénieurs biomédicaux souhaitant améliorer la traçabilité des dispositifs médicaux dans une démarche d'assurance qualité en stérilisation. Summary : Sterilization is an important functional unit of the hospital. The primary function is to produce sterile medical devices for usage of all services of the establishment of cares. The concept of result obligation in sterilization is a constant.
The no-mastery of the risk is not conceivable from the instant where the
health of the patient is committed. The installation of a system of quality
insurance is an obligation of regular order. The synergism between
pharmacist and biomedical engineer favors the development of this process
in sterilization. They look to insure the traçability
In this optic, we have realized a study concerning computer assisted sterilizations to bring elements of reflection to biomedical engineers wishing to improve the traçability of medical devices in a step of quality insurance in sterilization. Resumen : La esterilización es una unidad funcional importante del hospital. Tiene como función de producir dispositivos médicos estériles para uso de todos los servicios del establecimiento. El concepto de obligación del resultado de esterilización es una constante. El no-dominio del riesgo no es concebible a partir del momento en el cual la salud del paciente está compremetida. La instalación de un sistema de seguro calidad es una obligación de orden reglamentario. La sinergia entre farmacéutico e ingenerio biomédico favorece el desarrollo de este proceso de esterilización. Velarán por la trazabilidad de los dispositivos médicos. Según esta óptica, hemos realizado un estudio
relativo a las esterilizaciones asistadas por ordenador para aportar unos
elementos de
Mots clés : santé, stérilisation, dispositifs médicaux, qualité, traçabilité, ingénieur biomédical. |
REMERCIEMENTS
Nous tenons à remercier particulièrement messieurs, Georges Chevallier et Gilbert Farges responsables d'étude du DESS Technologies Biomédicales Hospitalières, ainsique toutes les personnes ayant participer de près ou de loin à la réalisation de cette étude:Madame Benoît, Assistante Pharmacienne et Monsieur Dauchot, interne en pharmacie du groupe hospitalier Lariboisière-Fernand Widal à Paris pour le temps accordé
et leur accueil chaleureux,Monsieur Kaiser, pharmacien en chef et Madame Perniceni, surveillante de la stérilisation de l'hôpital Saint Joseph à Paris pour la visite commentée de leur service et
l'autorisation de photographier les locaux,Madame Aesculap, pharmacienne de l'hôpital Saint-Louis à Paris, pour ses explications et la visite de son service,
Madame Meynard, surveillante de la stérilisation de l'hôpital Val de Grâce à Paris pour sa disponibilité,
Monsieur Thivaud, Pharmacien à l'hôpital de Toulouse, pour son accueil et ses explications,
Monsieur Jullian, Ingénieur Biomédical au Ministère de la Santé, pour les informations communiquées,
Monsieur Ancenay du CETIM, pour nous avoir permis d'assister à la troisième journée des instruments de chirurgie,
L'ensemble des sociétés contactées et qui ont bien voulu nous répondre et plus particulièrement la société Lequeux par l'intermédiaire de Monsieur Gaudry et Monsieur Balageas.
|
|
PREAMBULEI. INTRODUCTION A LA STERILISATION
1.1) La stérilisation1.1.1) Définition
1.1.2) Historique1.2) Le domaine da^application de notre étude
1.3) L'environnement réglementaire et normatif1.3.1) La réglementation
1.3.2) La normalisation1.4) Les intervenants en stérilisationII . STERILISATION ET ASSURANCE QUALITE2.1) La chaîne de stérilisation2.1.1) La marche en avant2.2) Assurance qualité en stérilisation
2.1.2) Les différentes étapes2.2.1) Mise en place d'un système d'assurance qualité en stérilisation2.3) Traçabilité des dispositifs médicaux
2.2.2) Présentation de la norme ISO 9002 adaptée à la stérilisation
2.2.3) Le service Biomédical partenaire pour l'assurance qualité
2.3.1) La traçabilité2.3.1.1) Définition
2.3.1.2) Champ d'applicationIII . LES LOGICIELS DE STERILISATION2.3.2) Pourquoi tracer ?
2.3.3) Choix du domaine d'application de la traçabilité
2.3.4) Les phases de la traçabilité3.1) L'informatisation d'un système de traçabilité des dispositifs médicaux3.1.1) Informatisation de la stérilisation de l'hôpital Saint-joseph à Lyon
3.1.2) Intérêt d'un système informatisé
3.1.3) Les logiciels de stérilisation3.1.3.1) Tableau de synthèse3.2) Mise en place d'une traçabilité assistée par ordinateur3.2.1) Les principes de fonctionnement3.2.1.1) Le niveau de traçabilité
3.2.1.2) Les techniques de codage
3.2.1.3) Les différents procédés pour la^acquisition des donnéesCONCLUSION3.2.2) Descriptif de fonctionnement3.3) Coût d'investissement3.2.2.1) Phase de prédésinfection et de lavage
3.2.2.2) Phase de conditionnement
3.2.2.3) Phase de stérilisation
3.2.2.4) Gestion de la stérilisation3.5) L'expérience du Groupe Hospitalier Lariboisière Fernand Widal
|
|
«La stérilisation fait partie des procédés spéciaux pour lesquels les résultats ne peuvent pas être entièrement vérifiés par un contrôle final du produit effectué a posteriori. Pour cette raison, il convient de veiller à la validation des procédés de stérilisation avant leur mise en application, à la surveillance de leur fonctionnement en routine, ainsi qua^à la^entretien du matériel. Un pilotage continu des opérations et un respect permanent des procédures documentées sont nécessaires pour assurer la conformité aux exigences spécifiées » [6,11,18].
La^ingénieur biomédical, par sa maîtrise des référentiels normatifs, sa formation de base étroitement liée aux notions de Système Qualité, est un interlocuteur susceptible de sa^investir dans cette démarche qualité pour satisfaire au mieux les exigences de Qualité et de Sécurité des Soins permettant ainsi de lutter contre les infections nosocomiales et de contribuer à la veille de la sécurité sanitaire [9].
Notre étude est destinée aux ingénieurs biomédicaux
souhaitant s'intégrer dans une démarche qualité en
stérilisation ainsi qu'aux autres professionnels de santé
directement concernés. Compte tenu de l'obligation de résultat
liée à l'obtention de l'état stérile et son
maintien jusqu'à utilisation, nous avons consacré une partie
de ce projet à la description du marché en terme de logiciel
permettant da^assister la traçabilité de la stérilisation
plus particulièrement celle des dispositifs médicaux.
|
|
1.1.1) Définition :
La stérilisation est un processus complexe composé
de nombreuses étapes. Ces opérations consistent à
détruire les micro-organismes vivants sur un objet ayant au préalable
subi une prédésinfection.
L'exigence fixée par la Pharmacopée Européenne précise que la probabilité théorique qu'un micro-organisme viable sur ce dispositif soit égale ou inférieure à 10-6 [21]. Ce niveau apparaît tellement élevé, que seul la^obligation de moyens (contrôlés suivant des référentiels connus) permet da^assurer un niveau de qualité reproductible et le respect des limites.
Au sein des établissements de santé, le service de stérilisation
doté des moyens techniques a pour fonction de produire des dispositifs
médicaux stériles. Il met en place les moyens nécessaires
au maintien de la^état de stérilité jusqua^à
la^utilisation dans le service demandeur.
1.1.2) Historique :
La notion de conservation, pour les denrées périssables
ou la désinfection et conservation des cadavres embaumés
dans la^ancienne Egypte est depuis longtemps connue de nos ancêtres.
Mais ce n'est qua^en 1810 suite à la publication des travaux de recherches
de Nicolas APPERT sur : «La^art de conserver pendant plusieurs années
toutes les substances animales et végétales » que débute
l'ère de la stérilisation de la conserve.
Par la suite, le brevet de la pratique de stérilisation a été déposé le 28 Décembre 1852 sous le titre de "autoclave avec manomètre spécial" par Raymond CHEVALLIER-APPERT donnant ainsi naissance à ce qui deviendra les stérilisateurs actuels à vapeur.
Au cours de la seconde moitié du 19ème siècle, les procédés de stérilisation se diversifient, se développent en milieux industriels et hospitaliers.
Grâce au monde industriel, notamment celui de la conserve, on
connaîtra mieux les valeurs scientifiques de la thermobiologie, et
ce ne sera qua^en 1960 que I.J PFLUG de la^université du Minnesota
enseignera le concept de la valeur stérilisatrice F0.
1.2) Le
domaine da^application de notre étude
La stérilisation concernera uniquement les dispositifs médicaux
réutilisables (tels que les instruments chirurgicaux・.) mais aussi
certains dispositifs à usage unique subissant un cycle de stérilisation
après livraison et avant utilisation dans les services (par exemple
les compresses・).
1.3) L'environnement
réglementaire et normatif
La stérilisation hospitalière fait actuellement l'objet de profondes mutations qu'il importe de prendre en compte afin de garantir une prestation satisfaisante.
Ces mutations sont de trois ordres:
-ordre réglementaire (domaine qui devrait encore évolué au cours des prochains mois avec la publication de nouveaux textes)
-ordre normatif (en relation avec l'obligation réglementaire de qualité en stérilisation)
-ordre technique (rendant compte de l'évolution du fonctionnement
hospitalier et de ses approvisionnements).
1.3.1) La réglementation
Elle s'appuie essentiellement sur la circulaire n°97-672 du
20 Octobre 1997 relative à la stérilisation des dispositifs
médicaux dans les établissements de santé [6]. Elle
est élaborée à partir de différents textes
de lois tels que l'arrêté du 3 Octobre 1995 relatif aux modalités
d'utilisation et de contrôle des matériels [3], le Décret
96-32 du 15 janvier 1996 sur la matériovigilance [4]・
Cette circulaire s'est vue confortée par la loi n° 98-535 du 1er juillet 1998 qui précise à la^article 4 « Les établissements de santé mettent en place un système permettant da^assurer la qualité de la stérilisation des dispositifs médicaux répondant à des conditions définies par voie réglementaire» [7] .
(Une circulaire est une simple lettre entre hiérarchie
visant à sensibiliser les professionnels de santé.)
La circulaire du 20 Octobre 1997 préconise:
· la centralisation des opérations de stérilisation, par le regroupement des moyens et des compétences,
La centralisation permet en effet une rationalisation organisationnelle (des locaux et des circuits) garantissant la continuité et reproductibilité des opérations de stérilisation.
Par ailleurs, elle rend plus fiable la pratique de la stérilisation hospitalière, elle apporte une meilleure garantie quant à la stérilité des dispositifs traités et elle réduit les coûts de fonctionnement.
· la mise en place d'un système qualité en stérilisation,
Une telle mise en place constitue un aspect déterminant dans le cadre de la procédure d'accréditation. Elle suppose la désignation d'un Responsable Assurance Qualité en stérilisation; eu égard à ses missions et à ses responsabilités en matière de dispositifs médicaux stériles. Elle comporte la description des responsabilités et de l'organisation, ainsi que la mise en place de documents (procédures et instructions) , conformément aux normes en vigueurs. (se reporter § 2.2 assurance qualité en stérilisation)
· la mise en Cette traçabilité concourt à l'exercice de matériovigilance
(se reporter § 2.3 la traçabilité des dispositifs médicaux).
(Une norme est donc un texte de références non obligatoire,
elle est da^application volontaire, elle permet de démontrer la sécurité
et l'aptitude à l'emploi d'un produit à l'usage auquel il
est destiné.)
La stérilisation s'appuie sur des normes.
Il découle des normes NF EN ISO 9000 et 46000 [11,18] que la
stérilisation constitue un processus dit "spécial" pour lequel
le résultat ne peut pas être entièrement vérifié
par des contrôles et des essais effectués à postériori
et pour lesquels les déficiences peuvent apparaître qu'en
cours d'utilisation des produits traités. Dès lors, le processus
doit être conduit par des opérateurs qualifiés et doit
exiger un pilotage continu des opérations et la maîtrise permanente
des paramètres de processus, de matière à assurer
leur conformité aux exigences spécifiées.
La maîtrise de processus doit couvrir l'ensemble des opérations
concourant à la production du résultat défini (produits
ou services) pour répondre à un besoin particulier. Un projet
de normes (en cours d'élaboration) envisage la validation et le
contrôle de routine des processus de stérilisation, il sera
applicable aux utilisateurs hospitaliers.
En matière de stérilisation hospitalière, le
système d'assurance qualité porte donc sur l'ensemble des
processus :
- les circuits des dispositifs médicaux,
1.4) Les
intervenants en stérilisation
La stérilisation est un procédé qui met en scène
des acteurs pluridisciplinaires (agissant en étroite collaboration)
au service des PATIENTS.
Organigramme hiérarchique des intervenants: (retour sommaire)
2.1.1) la marche en avant, l'expérience
de la PSPH Saint-Joseph
Mise en place d'un système
qualité, l'expérience de la PSPH Saint-Joseph.
Avant d'aborder toute notion d'assurance qualité, un bref descriptif
de chaque étape de la chaîne de stérilisation est nécessaire
suivant le guide de bonnes pratiques de stérilisation [8] et la
circulaire du 20 Octobre 1997 [6].
ACHATS
Les procédures da^achats permettent de sélectionner avec
rigueur le bon produit pour la bonne utilisation. Les critères de
choix portent en priorité sur une société pouvant
justifier la^adoption de règlements normatifs de type ISO 9000 [11].
PREDESINFECTION
La prédésinfection fait l'objet d'une procédure
écrite validée par le Comité de Lutte contre les Infections
Nosocomiales. L'idéal est de la pratiquer immédiatement après
utilisation du dispositif médical. Cette étape est indispensable
pour la protection du personnel et la diminution de la charge microbienne.
COLLECTE
Distinction de plusieurs cas de figures :
-Le matériel provenant da^achats présente certains
risques de contamination tels que des produits résiduels de fabrication
(poussières, graisses・). Il est soumis à un cycle complet
de stérilisation.
-Le matériel provenant de différentes unités
fonctionnelles suit le cycle d'une stérilisation classique.
LAVAGE et SECHAGE
Tout dispositif médical collecté doit impérativement
subir le cycle de lavage pour poursuivre le processus de limitation de
la charge microbienne. Chaque phase du lavage et du séchage fait
l'objet d'une procédure écrite permettant da^identifier:
TRI SELECTIF
Un contrôle visuel permet de retirer du cycle de stérilisation
tout dispositif présentant des anomalies. Ces dispositifs suivront
une procédure de réparation ou d'élimination.
CONDITIONNEMENT
Les systèmes d'emballage, utilisés pour conditionner
les dispositifs médicaux, sont destinés à maintenir
leur stérilité [17]. Ils assurent une protection physique,
chimique et microbienne. Les systèmes d'emballage seront compatibles
avec le procédé de stérilisation (en présentant
une perméabilité suffisante à l'air ainsi qu'à
l'agent stérilisant).
STERILISATION
Durant la phase de stérilisation, le personnel de stérilisation
doit [ 10,12,16 ]:
CONTROLE
Durant la phase de déchargement, le personnel de stérilisation
vérifie:
- le virage des indicateurs,
Si tout est conforme, la charge est acceptée. Il lui sera apposée
une indication de stérilité, sous une forme indélébile
(liberté du support) ne pouvant mettre en cause la^intégrité
de la^emballage.
Le marquage devra comporter sur chaque unité [14 ] les données
suivantes:
« Vérifier la^intégrité du protecteur
individuel de stérilité avant usage »
ARCHIVAGE
Les conditions de résultats, autorisant la libération
de la charge, doivent être consignées et archivées
[8,11] :-diagramme de pression et de température,-test Bowie Dick,-indicateur
physico-chimique des lots considérés,Un archivage minimal
de 5 ans est effectué. Une limite plus longue pourrait être
légiférée pour des raisons médico-légales.
STOCKAGE DISTRIBUTION
Les conditions de stockage doivent être maîtrisées.
La manutention du produit est réalisée afin d'éviter
toute contamination de l'environnement des produits et du personnel.Un
circuit de distribution est défini clairement pour éviter
des liaisons croisées et cela jusqu'au patient.
UTILISATION SUR PATIENT
Le dispositif médical est utilisé suivant
sa destination. L'étiquette (ou l'annotation・) est reportée
sur le dossier patient da^une manière indélébile.
Pour améliorer le processus de la stérilisation centrale,
il est impératif de s'inscrire dans une démarche de
qualité.
2.2) Assurance
qualité en stérilisation
La loi n° 98-535 du 1er juillet 1998 précise à
la^article 4 [7]:
«Les établissements de santé mettent en place
un système permettant da^assurer la qualité de la stérilisation
des dispositifs médicaux répondant à des conditions
définies par voie réglementaire».
1 Responsabilité de la direction:
Le responsable de la stérilisation officialise la démarche,
la politique et les objectifs da^une démarche qualité au sein
du service.
2 Système qualité: La^organisation
du système qualité est consignée par écrit,
elle assure que le procédé de stérilisation est conforme
aux exigences .Les procédures pour chaque phase de la stérilisation
sont établies et prennent en compte la complexité des tâches
en accordant au personnel le niveau de formation requis.
3 Revue de contrat: Le service de stérilisation
est considéré comme un fournisseur de la structure hospitalière,
il devra donc établir des procédures pour les relations avec
les services.
4 Maîtrise de la conception: Ce point
de la norme est sans objet pour l'ISO 9002.
5 Maîtrise des documents et des données:
Le
responsable qualité maîtrise tous les documents en vérifiant:La
pertinence des procédures et leur disponibilité aux endroits
appropriés.Le traitement des documents périmés et
leur conservation.La mise à jour des documents extérieurs
tel que les normes, les contrats ・
6 Achats: Le produit acheté doit
être conforme aux exigences souhaitées et doit comporter toutes
les identifications prouvant le niveau de traçabilité et
da^assurance qualité du sous-contractant. Une évaluation des
sous-contractants sera effectuée par type de produit et consignée.
7 Maîtrise du produit fourni par le client:
Les services-clients sa^engagent à respecter les procédures
écrites. La stérilisation centrale informe de tout problème
survenant sur un dispositif médical appartenant à un service-client.
8 Identification et traçabilité du produit:
La^identification du produit est réalisée par code barre,
marquage laser sur la^instrument ou tout autre système pertinent.La
traçabilité est assurée manuellement mais elle peut
être informatisée.
9 Maîtrise des processus: Planification
des processus de production, da^installation et des prestations associées
ayant une incidence directe sur la qualité.
10 Contrôles et essais:
Réception : Le produit répond aux exigences de prédésinfection,
son apparence est jugée et son traitement correspond à des
procédures connues.En cours de stérilisation : La conduite
des opérations consiste à vérifier les températures,
les pressions・Essais finals : Les paramètres de libération
de la charge permettent la^apposition du marquage stérile.Enregistrement
: Tous les documents pouvant offrir la garantie de stérilité
du produit sont conservés.
11 Maîtrise des équipements de contrôle,
de mesure et da^essai: Les paramètres garantissant la
stérilisation sont contrôlés par des instruments de
mesure reliés impérativement à un étalon européen.
12 Etat des contrôles et des essais:
Tous les contrôles effectués sont consignés par écrit.
13 Maîtrise du produit non conforme:
Un dispositif ne pouvant répondre aux critères définis,
est déclaré non conforme. Des procédures écrites
décrivent les cas envisagés et la^attitude à adopter
lors de problèmes non recensés. Les décisions pour
action, en dernier lieu, appartiennent au responsable désigné.
14 Actions correctives et préventives:
Elles font la^objet da^enregistrements et sont de plusieurs ordres mais visent
toujours à la^amélioration du système. Elles peuvent
être la conséquence da^enquêtes de satisfaction menées
auprès des services clients, du traitement de non-conformités
répétées・
15 Manutention, stockage, conditionnement, préservation
et livraison: De la manutention à la livraison des produits
stériles, chacune de ces étapes est exécutée
en conservant la^intégrité du produit et son état stérile.
La^utilisation des outils (manutention, portage, étagères・)
doit être adaptée.
16 Maîtrise des enregistrements relatifs à
la qualité: Les procédures et enregistrements
sont tenus à jour, ils permettent de démontrer la conformité
de la production aux règles établies pour obtenir un dispositif
médical stérile. Il est conseillé de conserver les
enregistrements un minimum de cinq ans (à défaut de texte
précis).
17 Audits qualité internes: Des procédures
écrites quant à la planification et à la réalisation
des audits sont établies. Les résultats et les actions correctives
engagées à leur suite sont enregistrées.
18 Formation: Le personnel bénéficie
da^une formation adaptée à son poste. La planification des
formations est organisée suivant le profil de l' opérateur
et de son poste de travail
19 Prestations associées: Des prestations
associées sont envisagées pour la formation du personnel
hospitalier.
20 Les techniques statistiques: Les statistiques
permettent da^élaborer un tableau de bord pour juger et quantifier
les performances de la stérilisation et de son système qualité.
La mise en place de l'assurance qualité requiert les compétences
de différents professionnels pour satisfaire tous les chapitres
de la norme. Dans cette optique, le service biomédical est
un partenaire privilégié pour la stérilisation.
L'ensemble de ces contrôles, maîtrisés par l'ingénieur
biomédical, sont indispensables pour prouver le bon fonctionnement
du cycle de stérilisation [4].
Chez le constructeur: La chambre et le générateur
du stérilisateur subissent la^épreuve hydraulique réglementaire
et ont été poinçonné par la «Direction
Régionale de la^Industrie, de la Recherche et de la^Environnement»
qui établi un certificat.
Les documents établis suite à ces contrôles contribueront
à la traçabilité du dispositif médical stérilisé.
2.3) Traçabilité
des dispositifs médicaux
La circulaire n°672 du 20 Octobre 1997 précise "les besoins
en traçabilité sont identifiés en fonction des dispositifs.
La traçabilité des dispositifs médicaux stérilisés
au sein des établissements de santé est un élément
du système qualité et concourt à l'exercice de la
matériovigilance"[6].
La traçabilité est un outil de la matériovigilance.
-Le suivi des équipements (autoclaves, soudeuses, osmoseurs・.)
impliqués dans la stérilisation.
La traçabilité fait parti intégrante d'un système
qualité [11,18].
Elle donne des garanties à l'utilisateur et aux patients.
Dans le cadre da^une contamination liée ou non à la^utilisation
d'un dispositif médical stérilisé, ces données
permettent de définir à quel niveau se trouve la déficience.
Un établissement de soins ayant une bonne traçabilité
aura toutes les données nécessaires pour se justifier lors
da^un incident.
«la centralisation de la stérilisation,・ est à privilégier・»
et que «dans la^état actuel des connaissances, la stérilisation
par la vapeur da^eau saturée sous pression doit être la méthode
appliquée lorsque le dispositif le supporte» [6].
Le Responsable Qualité de la stérilisation veille à
l'archivage de tous les documents contribuant à la traçabilité
[6] :
-Les documents propres du stérilisateur :
-Documents du fabricant,
-Le cahier de stérilisation comprenant :
-Cahier de procédures,
La constitution de cette pyramide documentaire demande une charge
importante de travail aux différents intervenants de la stérilisation.
Pour simplifier le quotidien et améliorer la traçabilité,
certains logiciels sont apparus sur le marché.
3.1)
L'informatisation d'un système de traçabilité des
dispositifs médicaux
En matière de stérilisation, par exemple, tous les
actes furent quantifiés afin de calculer les coûts liés
à chaque produit et ainsi définir les tendances de consommation
de l'hôpital. La stérilisation est devenue une véritable
unité de production hospitalière. Cette démarche a
été possible suite à la traçabilité
assistée par ordinateur des dispositifs médicaux.
Forte de son expérience, Madame Marie-Odile Baume, pharmacienne
du Centre hospitalier Saint Joseph a eu l'occasion lors de la troisième
journée des instruments de chirurgie réalisé au SNITEM
le 27 Janvier 2000, de partager ses connaissances en matière de
traçabilité des dispositifs médicaux avec les différents
participants du colloque.
La^emploi de la^informatique en stérilisation est un sujet da^actualité
qui présente un grand intérêt dans la mesure où
il permet da^assurer une traçabilité optimale dans le cadre
des contraintes réglementaires tout en suivant les indications du
guide des bonnes pratiques de stérilisations [8].
Le tableau de synthèse suivant reprend pour chaque logiciel le
niveau de traçabilité et moyens dont il dispose. Ce tableau
est donné à titre indicatif pour montrer quelques logiciels
existants sur le marché.
3.2)
Mise en place d'une traçabilité assistée par ordinateur
Les logiciels du marché proposent deux alternatives souvent
modulaires :
1ère possibilité : assurer la traçabilité
de la prédésinfection jusqua^au patient,
- le principe du code barres
Le principe du code barres est utilisé comme principal support
de lecture pour chaque système informatique. Il a été
choisi pour sa fiabilité da^édition et sa facilité
de mise en - da^autres marquages
Afin da^assurer une traçabilité optimale, la^idéal
serait de développer une codification DATA MATRIX, DOT-MATRIX, PUCES,
TRANSPONDEUR, ALPHA-NUMERIQUE pour identifier à la^unité chaque
dispositif médical soumis à un cycle de stérilisation.
Toutefois, ils présentent certains inconvénients qu'il est
judicieux de prendre en compte.
-Les systèmes DATA MATRIX et DOT-MATRIX sont dépendants
du lecteur optique. En cas de non lisibilité du code, le dispositif
médical ne peut pas être identifié.
-Le système à PUCES est à exclure obligatoirement.
La puce intégrée ne supporte pas le passage à 134°.
-Le système à TRANSPONDEUR serait l'idéal s'il
ne coûtait pas plus chère que l'instrument qu'il doit tracer.
C'est un système utilisé pour recevoir un signal et le réémettre
sur une autre fréquence.
-Le système ALPHA-NUMERIQUE est proposé par les constructeurs
d'instruments (Braun, Aesculap...) suivant un codage UNICOS gravé
sur l'instrument. La lecture de ce code reste visuelle et ne peut se faire
automatiquement. Ces contraintes obligent le personnel à reconditionner
à l'unité les boîtes d'instrumentation, ce qui engendre
une perte de temps considérable et une charge de travail supplémentaire.
L'idéal serait de combiner un codage Data matrix et alpha numérique
compte tenu de leur complémentarité. L'informatisation de
la lecture, grâce au système data-matrix, diminue les contraintes
et optimise la traçabilité. En cas de non lisibilité
du code data-matrix, le gravage alpha numérique est une solution
de secours.
Outre les contraintes financières, dans la^état actuel
de nos recherches, il est totalement utopique de pouvoir mettre en place
un tel concept sans avoir franchi au préalable toutes les étapes
intermédiaires (et réglementaires) permettant da^affirmer
que 90% des stérilisations en France répondent correctement
à la circulaire du 20 octobre 1997 [6]. Il est certain qua^une certaine
proportion des stérilisations intégrerons ce concept dans
les dix ans à venir.
· Les lecteurs portables optiques : la transmission des données
entre le lecteur mobile et la^unité de stockage est effectuée
par faisceau UHF.
· Les lecteurs fixes : ils se trouvent sur le système
de stérilisation afin da^introduire les données directement
dans un réseau. Les données sont ainsi enregistrées
sur le serveur.
Les instruments «souillés» au bloc ou dans les services
de soins sont placés dans des paniers à mailles fines, équipés
d'une plaque inox gravée da^un code barre. La phase de prédésinfection
consiste à tremper les paniers dans un bain suivant un protocole
défini par le Comité de Lutte contre les Infections Nosomiales.
La durée du trempage, en fonction de la^agent désinfectant,
sera le paramètre de traçabilité.
2ème possibilité : Il existe aussi la possibilité
aux utilisateurs da^assurer une traçabilité à partir
du lavage.
Lors de la réception des produits prédésinfectés,
le contenu des unités à stériliser sera réparti
dans des paniers et subira un cycle de lavage.Comme précédemment,
chaque panier peut être doté da^un code barres. Il existe néanmoins
un autre principe da^identification des instruments qui consiste à
joindre dans chaque panier un support de données électronique
individuel résistant au lavage et à la désinfection.
Lors du déchargement, les données électroniques relatives
à chaque panier sont recueillies. Ces informations pourront être
jointes à la^étiquette code barres imprimée pendant
la phase de conditionnement.
La traçabilité des données du processus de lavage
et de désinfection sera ainsi assurée jusqua^au patient.
Toutes les données (désignant le produit, la date de stérilisation,
la date de péremption, le service de destination・) nécessaires
à la traçabilité sont imprimées sur une étiquette
conçue pour résister au passage en autoclave, quel que soit
le cycle.
Les étiquettes sont ensuite collées en deux exemplaires
sur les emballages «papiers» ou «containers» au
moment du conditionnement. Après utilisation de ces produits lors
da^une intervention chirurgicale par exemple, les étiquettes seront
scannées (à la^aide da^un lecteur) afin de compléter
le dossier informatique du patient. Parallèlement, un exemplaire
da^étiquette sera décollé de son emballage et joint
au dossier patient afin de conserver les archives papiers.
La^objectif commun de ces logiciels sera da^assurer la^historique des produits
stérilisés. Le Responsable Qualité pourra ainsi retrouver
toutes les informations relatives à chaque set concernant aussi
bien :
Microlog C de chez ATPM La^intérêt de ces procédés consistera à
augmenter la sécurité et la traçabilité par
un contrôle scientifique des paramètres, indépendants
de la^autoclave et relié à un étalon européen.
Le traitement de l'information par l'informatique ne dispensera pas pour
autant le service de stérilisation de procéder à un
archivage papier traditionnel.
-La traçabilité des paramètres physiques des stérilisateurs.
Certaines sociétés offrent en option des logiciels superviseurs
permettant d'assurer la traçabilité en temps réel
des paramètres physiques de la stérilisation. Des interfaces
informatiques proposent dans certains cas une récupération
de ces valeurs vers les logiciels de traçabilité présentés
précédemment. L'intérêt est d'établir une corrélation entre
les valeurs paramétriques du stérilisateur pour valider le
cycle de stérilisation [10].
Ils permettent à la fois :
- de suivre la production en temps réel (liste des articles stérilisés,
nombre et type de cycle réalisé, la distribution aux différents
services・),
- de gérer les stocks stériles (suivi des articles stériles
actuellement en stock au niveau de la stérilisation et en attente
da^être distribués aux services),
- de suivre les dysfonctionnements (liste de tous les cycles non validés
avec la répartition par autoclave, liste de tous les articles envoyés
au rebut),
- de suivre la maintenance en stérilisation.
Ils fournissent des données de suivi et de gestion relatives
aux coûts de fonctionnement imputés à chaque service
ou unité de soins. La transparence de ces données sensibilisera
tous les acteurs permettant ainsi une économie substantielle.
Une enquête auprès des différents fournisseurs a
été réalisée afin de définir le coût
des logiciels suivant le niveau de traçabilité envisagé
par l'établissement. Après lecture des propositions respectives,
nous les avons regroupées en deux catégories.
Niveau de traçabilité Tranches de Prix
Notre choix aura été d'établir deux deltas de prix
sans aucune indication permettant d'établir une correspondance avec
une quelconque société. L'intérêt est
de définir un ordre de grandeur à titre informatif. Les écarts
de prix sont fonction du matériel et du degré de technicité
de celui ci.
Parallèlement, une enquête de satisfaction a été
menée auprès d'un certain nombre de sites hospitaliers de
France équipés da^une stérilisation assistée
par
ordinateur.
Les résultats des services qui ont bien voulu participer en répondant
à notre questionnaire sont extrêmement encourageants. Selon
les utilisateurs, ces logiciels sont conviviaux et permettent de :
- Limiter la charge de travail du personnel,
3.5) L'expérience
du Groupe Hospitalier Lariboisière Fernand Widal
Lors de la visite de différents services de stérilisation,
nous avons pu découvrir une équipe particulièrement
dynamique au Groupe Hospitalier Lariboisière Fernand Widal encadré
par :
Monsieur le Pharmacien-Chef le professeur ROGER LEVERGE, Mme BENEDICTE
BENOIT pharmacienne assistante et Monsieur JEAN-MARC DAUCHOT interne en
pharmacie.
La stérilisation centrale du Groupe Hospitalier LARIBOISIERE
FERNAND WIDAL
Le personnel, 14 agents.
Cette unité est composée de 5 autoclaves de marque LEQUEUX:
1 autoclave 16 paniers,
Le plateau technique est composé de 6 disciplines opératoires
: ORL, Ophtalmologie, Neuro-Chirurgie, Gyneco-Obstétrique, Chirurgie
Digestive, Chirurgie Orthopédique.
En 1998, le volume stérilisé annuel a été
de 3200 m3.
Cet entretien sa^est déroulé sous la forme da^un interview
de Madame BENOIT et Monsieur DAUCHOT que nous tacherons de retranscrire
fidèlement. Le sujet abordé concerne la réalisation
interne de leur logiciel de traçabilité ( se reporter aux
annexes 3.1 à 3.3).
IBMH -«Dans le cadre de votre projet de traçabilité
assistée par ordinateur, nous aurions aimé connaître
les réflexions qui ont pu vous y conduire.
PHL -Suite à la parution ces dernières années
de différents textes réglementaires dans le domaine de la
sécurité sanitaire et à de récents jugements
en matière d'infections nosocomiales, notamment un arrêt de
la cour de cassation en juin 1999, nous avons cherché à améliorer
la traçabilité de notre production de dispositifs médicaux
stérilisés. La survenue d'une infection nosocomiale engage
la responsabilité de l'établissement qui doit pouvoir prouver
que toutes les précautions ont été prises et les bonnes
pratiques respectées (inversion de la preuve).
IBMH -Vous aviez pourtant des logiciels sur le marché
pouvant réaliser le suivi de votre stérilisation ?
PHL -En effet, au début de notre démarche,
il existait déjà des logiciels mais aucun da^eux ne nous satisfaisaient.
Ils ne permettaient pas da^associer les moyens informatiques de la^établissement
et la^analyse que nous avions faite de la traçabilité en tant
que professionnels utilisateurs.
IBMH -Quelles étaient vos préoccupations ?
PHL -Bien sûr en premier lieu, assurer de façon
fiable et réaliste une traçabilité des opérations
effectuées et donc améliorer les circuits de réception,
traitement et distribution. Les différentes étapes de la
construction de notre outil se sont faites grâce à l'adhésion
et à la contribution active de tout le personnel. L'outil que nous
avons construit permet d'être en accord avec notre manière
de travailler. L'informatique s'est adapté à nous et non
le contraire. Enfin, le logiciel se veut évolutif et, depuis sa
mise en service, il n'a cessé de s'améliorer devenant tous
les jours d'une utilisation de plus en plus simple.
IBMH -Pourriez-vous nous décrire les étapes
de ce projet ?
PHL -En l'absence de logiciel "institutionnel" proposé
par l'AP-HP et de logiciel "idéal" dans le commerce, nous avons
établi, forts de notre expérience, un cahier des charges
et avons contacté une société prête à
concevoir le logiciel adapté.
IBMH - Vous travaillez avec une société externe
à l'établissement ?
PHL -Oui, la société J.K Concept-Europ'92
a traduit nos désirs sur un système de gestion de base de
données 4D.
IBMH -Depuis notre dernier passage, nous avons observé
que vous aviez un nouveau lecteur de code barres portable, pouvez-vous
nous en parler ?
PHL -Il caractérise tout à fait notre volonté
de s'adapter à la pratique de terrain tout en respectant les choix
informatiques de notre hôpital. Vous avez devant vous le modèle
de terminal portable choisi par notre établissement pour la mise
en place du système de gestion institutionnel. Nous respectons ainsi
les critères de choix de l'AP-HP, les contraintes budgétaires
mais aussi celles de la maintenance. Pour l'instant, nous disposons de
deux terminaux portables, mais nous comptons doubler à très
court terme leur nombre pour poursuivre notre développement.Da^autre
part, si une défaillance intervient sur un code barres il est possible
da^identifier le produit grâce à un clavier alpha-numérique
situé en face avant.
IBMH -Comment avez vous pu adapter ce type de lecteur à
votre logiciel de traçabilité?
PHL -La société J.K. CONCEPT est rentrée
en contact avec la société prestataire du contrat des portables
et a réalisé sans problème apparent la passerelle.
Une prochaine adaptation de cette passerelle informatique va nous permettre
de pouvoir décharger automatiquement les portables, uniquement en
les reposant dans leur puits de décharge.
IBMH -Cela prouve votre désir da^évolution, mais
vers quel but voulez-vous tendre ?
PHL -Le maximum de facilité pour la^utilisateur, le
minimum de manipulation pour que cela ne devienne pas une charge trop importante
et fastidieuse.
IBMH -Pendant que nous parlions, un agent de la stérilisation
a ramené une imprimante da^étiquette, pouvez-vous nous en
parler ?
PHL -Nous sommes actuellement en cours da^essais sur des
étiquettes repositionnables permettant de résister aux agressions
dues à la chaleur et bien sur à la^humidité.
Nous avons revu entièrement notre système da^étiquetage.
Nous apposons une étiquette au conditionnement, ensuite à
la sortie de la^autoclave lorsque le matériel est stérile,
nous collons sur un endroit bien défini de la première étiquette
une seconde étiquette validant la stérilité du produit.
IBMH -Quel est votre perspective da^évolution à court
terme ?
PHL -Nous voudrions da^ici cet été établir
une passerelle informatique entre les autoclaves et notre logiciel. Cette
passerelle permettra de récupérer les informations de la
supervision LEQUEUX liant ainsi les paramètres de stérilisation
(température, temps de contact, pression etc・) à la charge
stérilisée. Des contacts avec la société LEQUEUX
et notre informaticien sont en cours.
IBMH -Combien de temps vous a-t-il fallu pour former votre
personnel à la^utilisation du logiciel ?
PHL -Passé une certaine réticence à
évoluer du tout écrit vers le tout informatique, il aura
fallu 3 semaines pour former 14 agents. Comme vous avez pu le constater
tout à la^heure, nous avons des agents qui devancent la mise en place
de certaines procédures, prouvant ainsi la facilité da^utilisation
du logiciel.
IBMH -Pensez-vous qua^il soit nécessaire da^organiser une
traçabilité à la^unité, avec par exemple un
gravage laser de la^instrumentation?
PHL -Tout marquer ? Non pas encore, nous en sommes relativement
éloigné, il vaut mieux préserver son énergie
pour réaliser ce qui est dans le domaine du possible.
IBMH -Une dernière question si vous le permettez. Comment
concevez-vous la maîtrise du risque en tant que responsable de la
stérilisation ?
PHL -Le pharmacien, responsable, doit avoir la maîtrise
de toutes les étapes et une relation de confiance avec son personnel
est obligatoire. Le personnel doit donc être formé en fonction
de la tache qu'il doit remplir. La maîtrise du risque ne peut se
faire qua^avec une centralisation optimale de toutes les phases de la stérilisation.
IBMH -Nous vous remercions da^avoir bien voulu répondre
à nos questions».
Une question importante reste à élucider : le coût
d'un tel système ?
Pour une version permettant de travailler correctement :
Si le projet voit le jour dans une perspective de marché au sein
de toutes les stérilisations de la^APHP (désireuses de se
doter da^un tel système), le coût du logiciel pourrait être
relativement bas ainsi que les portables négociés à
grande échelle.
Cette solution est très attractive compte tenu du prix du matériel,
nous avons aussi pu juger qua^en terme de fonctionnalité ce logiciel
est plus complet que certains proposés dans le commerce. Une piste
à suivre・en espérant que le prix du logiciel ne soit pas
un frein au développement de cet outil prometteur.
AP-HP : Assistance Publique des Hôpitaux de Paris
La stérilisation est une unité fonctionnelle importante
dans l'hôpital. Elle produit des dispositifs médicaux stériles
à usage de tous les services de l'établissement de soins.
Le concept da^obligation de résultat en stérilisation est
une constante. La non-maîtrise du risque na^est pas concevable dès
la^instant où la santé du patient est mise en jeu. Les
inspections décidées au niveau national et relayées
par les services déconcentrés (ARH, DRASS・), affichent une
volonté de ne pas tolérer les défaillances. Cette
politique doit inciter tous les acteurs de santé à se mettre
en conformité par rapport aux textes réglementaires et normatifs
afin d' améliorer en continu le niveau des prestations.
La mise en place d'un système d'assurance qualité est
donc une obligation d'ordre réglementaire. La synergie entre pharmacien
et ingénieur biomédical favorise le développement
de ce processus en stérilisation. Ils veillent à assurer
la traçabilité des dispositifs médicaux. Dans ce contexte,
nous avons réalisé une étude concernant les stérilisations
assistées par ordinateur.
Cette étude, associée aux visites de différents
services de stérilisation dotés de ces systèmes informatiques,
nous permet d'affirmer que cette solution est encourageante. L'outil
informatique allége la charge de travail journalière des
agents tout en fiabilisant et sécurisant les données. L'information
ainsi recueillie est informatisée, une traçabilité
montante et descendante pour chaque dispositif médical est garanti.
L'informatisation d'un service de stérilisation présente
de nombreux avantages mais un frein économique subsiste pour les
établissements de santé.
Dans cette perspective, il serait envisageable pour les prochaines promotions
du DESS Technologies Biomédicales Hospitalières de réaliser
un logiciel destiné à assurer la traçabilité
des dispositifs médicaux en stérilisation. Cette démarche
permettrait à l'Université de Compiègne de contribuer
à l'intérêt commun d'amélioration du système
de santé.
[ 1 ] Décret du 2 Avril 1926 Portant règlement sur
les appareils à vapeur autres que ceux placés à bord
des bateaux, J.O. 22 Avril 1926.
[ 20 ] Le pharmacien Hospitalier Informatisation da^une stérilisation
centrale, T.TERRACOL, M.O. BAUME, H. BORDAS, C.VRAY, dec.1989, vol. n°99,
p.25.
ANNEXES 1 :
Quelques outils techniques en stérilisation
Annexe 1.1 : Validation / Qualification
Annexe 1.2 : Fiche de suivi pour un produit ou un ensemble de produits
(non disponible)
Annexe 1.3 : Procédure de conditionnement (non disponible)
Annexe 1.4 : Procédure de stérilisation (non disponible)
Annexe 1.5 : Questionnaire technique d'un CCTP pour un stérilisateur
(non disponible)
ANNEXES 2 :
Les logiciels de traçabilité
Annexe 2.1 : Identification des différentes
sociétés
Annexe 2.2 : SUBTIL-CREPIEUX (non disponible)
Annexe 2.3 : LEQUEUX (non disponible)
Annexe 2.4 : A.T.P.M (non disponible)
Annexe 2.5 : MAQUET (non disponible)
Annexe 2.6 : S.P.S (non disponible)
ANNEXES 3 :
Le logiciel de traçabilité du Groupe Hospitalier LARIBOISIERE
FERNAND WIDAL (non disponible)
ANNEXES 1
Quelques outils techniques en Stérilisation
Annexe 1.1
La réception (ou qualification da^installation)
de la^autoclave
Le principe consiste à démontrer que le stérilisateur,
sa zone da^installation et les équipements annexes sont conformes
aux spécifications. L'équipement fonctionne dans les limites
prédéterminées lorsqua^il est utilisé conformément
au mode da^emploi.
La réception est validée et approuvée par le responsable
désigné par la direction de la^établissement de soins.
Cette réception donne lieu à la signature da^un procès
verbal de réception.
La qualification Opérationnelle Physique :
Le principe est d'obtenir la preuve que la^équipement réceptionné
fournit un produit acceptable lors de son utilisation selon les spécifications
du procédé.
La qualification opérationnelle est effectuée à
la suite de la réception de la^autoclave, elle permet de démontrer
que les conditions spécifiées sont atteintes dans toutes
les charges de stérilisation.
Ensuite, elle est pratiquée :
-pour toute modification de charge, da^emballage, da^équipement
ou de paramètre,
La qualification opérationnelle comprend :
-un contrôle de répartition des températures
dans la chambre vide (cartographie), pendant le temps de maintien, à
la^aide de capteurs de température répartis dans la chambre,
-la reproductibilité est à contrôler en réalisant
un minimum de 3 cycles,
-chaque procédé de stérilisation, de même
que chaque type de charge et chaque plan de chargement est spécifié
et documenté,
-la pression et la température aux points les plus froids, dans
la chambre du stérilisateur, sont surveillées et enregistrées
en permanence au cours du cycle de stérilisation.
La qualification opérationnelle peut également inclure,
sur demande, une qualification microbienne. Dans ce cas :
Qualification Opérationnelle = Qualification Physique +
Qualification microbiologique.
ANALYSE, INTERPRETATION DES RESULTATS ET RAPPORT
La norme EN554 fixe un certain nombre de critères :
La température et la pression restent constantes pendant
la durée du temps de maintien.
Durant le plateau, les températures mesurées :
-doivent être supérieures à la consigne de
stérilisation et inférieures à la limite supérieure,
qui est égale à la consigne +3°C,
Le temps da^équilibrage des sondes de températures
sur le plateau doit être :
-inférieur à 15 secondes si le volume de la^autoclave est
< 800 litres,
La vapeur présente une température comprise dans
la bande des températures de stérilisation. Elle correspond
à sa pression de vapeur (relation P/T pour analyser le respect de
la qualité de vapeur).
La pression durant la phase de séchage doit passer en dessous
du seuil de 70 mb (EN 285).
Le rapport de qualification opérationnelle est préparé
par des personnes officiellement chargées de la préparation,
de la^examen et de la^acceptation desdits rapports.
Le rapport doit comporter :
-une description du type de charge et de son plan de chargement,
Validation du procédé
Le rapport de qualification opérationnelle est analysé
et approuvé par un responsable désigné qui na^aura
pas effectué les essais ni rédigé le rapport.
Le responsable peut être le pharmacien, la^ingénieur biomédical,
le responsable qualité, le surveillant de la stérilisation・,
elle décide de la validation de son procédé.
Requalification opérationnelle
Requalification opérationnelle partielle
En cas de modification de charge, da^emballage et de paramètres
de cycle, la requalification est effectuée uniquement sur le point
où la modification est apportée.
Requalification opérationnelle annuelle
Elle est effectuée sur tous les cycles devant être revalidés
(identique à la qualification opérationnelle).
Une revalidation de la réception est effectuée, elle consiste
en une vérification complète du stérilisateur.
ANNEXES 2
Les logiciels de traçabilité
Annexe 2.1
LES PROFESSIONNELS AU SERVICE DE LA STERILISATION ET LEUR OUTIL INFORMATIQUE
Fournisseurs Logiciels
1.3.2) La normalisation
"La normalisation a pour objet de fournir des documents de références
comportant des solutions à des problèmes techniques et commerciaux
concernant les produits, liens et services qui se posent de façon
répétés dans les relations entre partenaires économiques,
scientifiques, techniques ou sociaux" [19].
- la limitation de la charge microbienne initiale (prédésinfection
et lavage),
- le contrôle de l'environnement,
- le conditionnement,
- la stérilisation proprement dite et ses contrôles de
procédés,
- le traitement des non-conformités et les actions correctives,
- la traçabilité.
Relation transversale
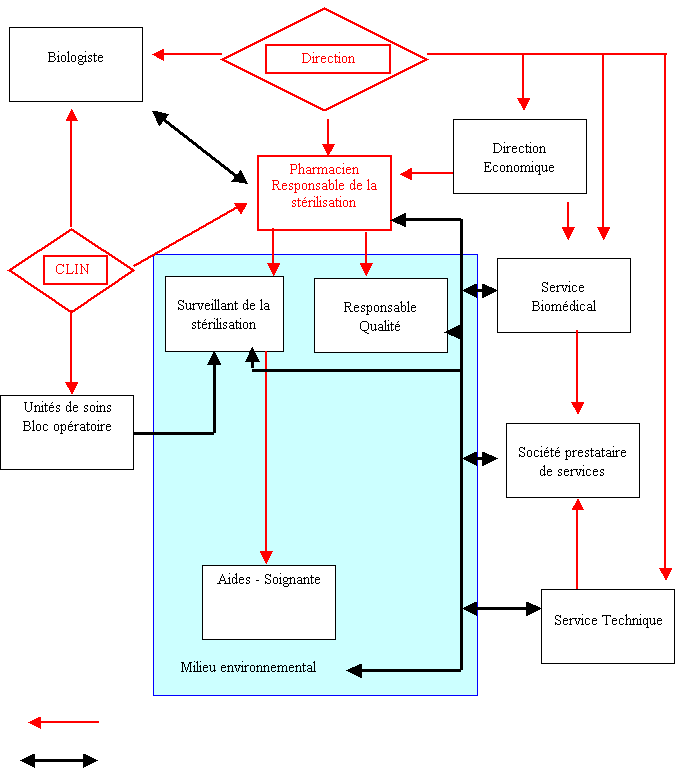
Décision unilatérale
CLIN : Comité de Lutte contre les Infections Nosocomiales
2.1) La chaîne
de stérilisation
-la qualité de la^eau,
-la qualité de la^agent lavant,
-la qualité de la^air du séchage (air médical),
technique de séchage,
-la position des dispositifs médicaux dans la machine à
laver (si machine à laver),
-le type de lubrifiant.
-Vérifier le bon déroulement de la stérilisation,
la lecture des différents indicateurs de pression et de température.
-Veiller aux contrôles journaliers :
-test de fuite,-vérification de la bonne pénétration
de la vapeur au c
-indicateur physico-chimique placé dans les unités
ou dans les charges suivant la destination du produit,
-enregistrement graphique de la température et
de la pression.
- la siccité de la charge (méthode subjective) [10],
- la^intégrité des emballages.
TRAITEMENT DES NON-CONFORMITES
Suite à l'apparition d'une non-conformité, il faut rechercher
les causes [11]. Cette démarche fait référence à
un processus écrit. Quelque soit le doute sur la stérilité
du dispositif médical, la production est refusée.
2.2.1)
Mise en place d'un système d'assurance qualité en stérilisation
Les exigences des normes ISO 9000 sont applicables dans la mise
en
2.2.2)
Présentation de la norme ISO 9002 adaptée à la stérilisation
Norme ISO 9002: Application en stérilisation
Les processus de production:
- Mise en place de procédures écrites, claires, approuvées,
contrôlées sur le lieu da^application et pilotées par
un responsable.
- Les équipements et la^environnement sont en adéquation
avec la production.
Les processus da^installation et les prestations associées
- Validation, contrôle annuel・sont conformes aux textes réglementaires
et normatifs.
2.2.3)
Le service Biomédical partenaire pour l'assurance qualité
L'ingénieur biomédical est partie prenante dans le
choix et l'achat du matériel de stérilisation. Il est
donc impliqué dans l'entretien et la conservation paramétrique
du stérilisateur. Le stérilisateur doit répondre à
des critères de contrôles pour valider la^étiquetage
de stérilité. La^ingénieur applique les aspects
réglementaires et normatifs correspondants.
![]() Matériel utilisé lors de la validation du stérilisateur
Matériel utilisé lors de la validation du stérilisateur
Un organisme de contrôle agréé, au vu du certificat
de da^épreuve et après un examen des dispositifs de sécurité,
délivrera une attestation de conformité.
Une déclaration da^appareil à vapeur placée à
demeure doit parvenir en deux exemplaires à la Préfecture.
L'Achat: Etude des besoins, rédaction des appels d'offres,
vérification des concordances du matériel avec les normes
en vigueur, participation au choix du matériel en commission (se
reporter à l'annexe 1.5), [11].
Validation: Elle regroupe la réception et la qualification
opérationnelle. Cette démarche sera suivi da^une certification
de validation faite par la personne désignée par la^organisme
(se
reporter à l'annexe 1.1), [10].
- Annuel: Requalification opérationnelle
Cette démarche sera suivi da^une certification de validation
faite par la personne désignée par la^organisme [10].
- Tous les dix-huit mois au plus: Contrôle par
un organisme agréé des dispositifs de sécurité
[1].
Tous les dix ans: Epreuve hydraulique par un organisme certifié
[1].
2.3.1) La traçabilité
La traçabilité est la^aptitude à retrouver la^historique,
la^utilisation ou la localisation da^une entité au moyen da^identifications
enregistrées.
2.3.1.1) Définition
Elle est indispensable dans le cadre de la matériovigilance
qui vise à assurer la sécurité des patients, utilisateurs
et tiers, en signalant tous les incidents liés à l'utilisation
des dispositifs médicaux [4].
-Le suivi du dispositif médical durant toute les phases de stérilisation
jusqu'au patient (annexe 1.2).
2.3.1.2)
Champ d'application
2.3.2)
Pourquoi tracer ?
La traçabilité permet de réunir en continu
les informations relatives à chaque étape de la stérilisation
pour chaque dispositif médical.
2.3.3)
Choix du domaine d'application de la traçabilité
Le choix du domaine étudié nécessite
un éclaircissement, il na^est pas sans signification et répond
à la circulaire du 20 octobre 1997 préconisant que :
2.3.4) Les
phases de la traçabilité
Au paragraphe 2.1, les étapes de la stérilisation
ont été identifiées. Le système de traçabilité
le plus communément rencontré, débute par l'identification
du produit de la phase de conditionnement jusqu'au dossier patient.
-Agrément de l'organisme vérificateur
( APAVE・.),
-Document de conformité C.E,
-Dossier de validation du procédé
lors de la réception,
-Cahier des résultats de contrôles,
-Cahier de maintenance.
3.1.1)
Informatisation de la stérilisation de l'hôpital Saint-joseph
à Lyon
A la fin des années 80, l'hôpital Saint-Joseph était
un établissement de 500 lits. Confronté rapidement à
de fortes dépenses de santé, la direction de l'hôpital
décide d'adopter une nouvelle stratégie [20].
3.1.2) Intérêt
d'un système informatisé
La stérilisation occupe une place importante et demande l'investigation
à temps complet d'un grand nombre d'intervenants afin de suivre
les différentes étapes.
3.1.3) Les logiciels
de stérilisation
Ces logiciels conçus par des entreprises commerciales sont
simples, ergonomiques et efficaces. Conviviaux et évolutifs, ils
sont utilisés sous le système da^exploitation Windows de Microsoft.
Ils apportent une aide non négligeable dans le cadre da^une démarche
da^assurance qualité permettant aussi de répondre à
certains critères dans la perspective de la^accréditation
et da^une certification ISO 9000 du service de stérilisation [9,11].
En annexes 2.1 à 2.6, vous pouvez consulter la liste des fournisseurs
qui ont bien voulu nous répondre ainsi qua^une présentation
de leur outil informatique.
3.1.3.1)Tableau de synthèse
Type de traçabilité
Traçabilité assurée
Sociétés
chips Sonde Code barres soudeuse
Décontamination Lavage Conditionnement Stérilisation
Stockage/Bloc Stockage/Unités de soins
LEQUEUX
Oui
Oui
Oui
Oui
MAQUET Oui
Oui
Oui
Oui Oui
Oui
Oui
Oui
SUBTIL C.
Oui
Oui
Oui
Oui
SPS
Oui Oui
Oui
Oui
Oui
Oui
Oui
OPTIM
Nous n'avons pas eu de réponse mais ce logiciel équipe les
stérilisateurs SUBTIL CREPIEUX
ATPM
Oui Oui
Oui
Oui Oui
Oui
Oui
Oui
3.2.1)
Les principes de fonctionnement
Chaque logiciel présente ses particularités, il permet
de «tracer» le dispositif médical da^une manière
plus ou moins exhaustive. Cependant, on retrouve un même principe
de fonctionnement défini suivant une chronologie particulière
da^un processus de stérilisation.
3.2.1.1) Le niveau
de traçabilité
Le responsable de stérilisation défini à partir
de quel niveau de la chaîne de stérilisation il assure la
traçabilité du dispositif médical. Quelque soit sa
décision, il veille à choisir un système évolutif.
2ème possibilité : assurer la traçabilité
du conditionnement jusqua^au patient.
3.2.1.2) Les techniques
de codage
Le personnel de stérilisation dispose des techniques suivantes
pour assurer l'identification des dispositifs médicaux.![]()
Chaque opérateur est équipé d'un badge comportant
un code barres la^identifiant, il lui suffira de le scanner avant toute
manipulation.
3.2.1.3)
Les différents procédés pour la^acquisition des données
![]()
La^acquisition des données peut se faire avec des lecteurs
portatifs ou fixes disponibles aux différents points stratégiques
afin d 'assurer la continuité de la traçabilité.
3.2.2) Descriptif
de fonctionnement
Cette réflexion est basée sur une synthèse
des documents relatifs aux différents systèmes informatiques
commerciaux présentés dans cette étude, mais aussi
par les différentes discussions organisées avec des professionnels
utilisateurs.
3.2.2.1)
Phase de prédésinfection et de lavage
![]()
1ère possibilité : La traçabilité
des dispositifs médicaux peut débuter dès la prédésinfection.
Pour assurer la traçabilité de ces instruments, le personnel
de stérilisation enregistre avec une douchette le code barres de
chaque panier avant da^entamer la prédésinfection. Il effectuera
la même opération à la sortie du bain.
3.2.2.2) Phase de conditionnement![]()
Pendant la phase de conditionnement, les dispositifs médicaux
sont regroupés suivant un inventaire détaillé et précis,
permettant ainsi au personnel de stérilisation d'assurer la composition
des sets à partir da^une base de donnée avec photos et descriptifs
; un code barres, soit un numéro individuel, sera attribué
à chaque unité de stérilisation afin de la^identifier
avant son passage dans la^autoclave. La soudeuse assure le conditionnement
des dispositifs médicaux, elle peut dans certains cas apposer un
code d'identification.
- la traçabilité montante (en retrouvant le numéro
de lot des compositions ayant servies à opérer un patient),
- que la traçabilité descendante (en retrouvant pour
un lot donné, les patients opérés avec des compositions
présentes dans un même cycle de stérilisation).
3.2.2.3) Phase de
stérilisation
![]()
Durant la phase de stérilisation, le personnel utilise
des indicateurs physico-chimiques comme procédé de contrôle
[16]. Des sondes ou des capteurs spécifiques embarqués sont
aussi proposés. Placés directement au c![]() Calivac de chez SPS
Calivac de chez SPS ![]()
![]()
Une entente entre les fabricants de stérilisateurs et les concepteurs
de logiciels de traçabilité semble nécessaire pour
adopter un standard commun. La récupération des données
de l'autoclave sera plus aisée et ne nécessitera pas d'investissement
supplémentaire de la part du client pour créer une interface.
3.2.2.4)
Gestion de le stérilisation
Les logiciels de traçabilité des dispositifs
médicaux sont aussi des outils performants pour la gestion de la^activité
de la stérilisation.
Pour un minimum de traçabilité allant du conditionnement
à la distribution Entre 70 000 et 180 000 Francs
Pour un maximum de traçabilité prenant en compte les
opérations de prédésinfection jusqu'à la gestion
de stocks. Entre 120 000 et 300 000 Francs
- Fiabiliser, simplifier, garantir la collecte et la^archivage des données,
- Augmenter la sécurité et la traçabilité
par un contrôle scientifique des paramètres de la^autoclave,
- Faciliter la recherche de la^information,
- Améliorer et simplifier la gestion quotidienne de la stérilisation,
- Formaliser la^ensemble des pratiques de stérilisation préalable
à une démarche qualité,
- Obtenir des analyses quantitatives pour la bonne gestion de la^activité
de stérilisation.
2 autoclaves 8 paniers,
2 autoclaves 6 paniers,
ainsi que da^un STERRAD 100 de la société JOHNSON et JOHNSON
pour la stérilisation à basse température. Cette unité
fonctionnelle est au service da^un groupe hospitalier de 1100 lits, dont
800 lits engendrent la charge de travail.
(les initiales PHL correspondant à Pharmacien Hospitalier
de Lariboisiére et IBMH à Ingénieur Biomédicale
Hospitalier).
Pour la^instant, le logiciel étant en phase da^évaluation
technique, le prix na^a pu être défini.
Mais, nous nous sommes prêtés à quelques calculs・
- 2 ordinateurs qui peuvent être négociés à
5000 francs unitaire,
- 3 portables pour un début, le prix suivant la négociation
varie de 5000 à 8000 francs. Nous prendrons 6500 francs pour prix
moyen unitaire.
- Une liaison filaire pour relier en réseau les ordinateurs
3000 francs.
- Une étiqueteuse 6000 francs.
- Total de 38 500 francs sans le logiciel qui reste la^inconnu et sans
la supervision, pour un calcul permettant une certaine marge da^erreurs,
il faudra compter environ 40 000 francs.
[ 2 ] Arrêté ministériel du 16 Février
1989 Relative à l'exploitation et aux contrôles périodique
des appareils à pression de vapeur à couvercle amovible,
J.O. 10 Mars 1989.
[ 3 ] Arrêté du 3 Octobre 1995 Relatif aux modalités
d'utilisation et de contrôle des matériels J.O. du 13
oct. 1995.
[ 4 ] Décret n°96-32 Relatif à la matériovigilance
exercée sur les dispositifs médicaux et modifiant le code
de la santé publique, 15 Janvier 1996.
[ 5 ] Ordonnance n°96-346 Portant réforme de l'hospitalisation
publique et privée, 24 avril 1996.
[ 6 ] Circulaire DGS sur VS2-DH/EM1/EO1/97 Relative à la stérilisation
des dispositifs médicaux dans les établissements de santé,
Ministère de l'emploi et de la solidarité, 20 octobre 1997,
n°672.
[ 7 ] Loi n° 98-535 Relative au renforcement de la veille
sanitaire et de la sécurité sanitaire des produits destinés
à la^homme, complète l'article L.711-1 du code la santé
publique, 1er juillet 1998.
[ 8 ] Brochure n° 5708 Stérilisateurs pour charges à
protection perméable. Ed. Commission centrale des marchés.
Guide et documents types-Annexes: "Bonnes pratiques de stérilisation",
J.O. 1993.
[ 9 ] ANAES Manuel da^accréditation, Direction de l'accréditation,
Fév. 1999.
[ 10 ] EN 554 (NF S 98105) Validation et contrôle de routine
pour la stérilisation à la vapeur da^eau, Ed. Afnor, Oct.
1994.
[ 11 ] NF EN ISO 9002 Modèle pour l'assurance de la qualité
en production, installation et prestations associées, Ed. Afnor,
Août 1994.
[ 12 ] EN 285 (NF S 90-320) Stérilisateurs à la vapeur
da^eau, grands stérilisateurs, Ed Afnor, Fév. 1997.
[ 14 ] EN 556 (NF S 98107) Stérilisation de dispositifs médicaux.
Exigences pour les dispositifs médicaux étiquetés
«stériles», Ed. Afnor, Fév.1995.
[ 15 ] EN 866 (NF S 98004) Systèmes biologiques pour la^essai
des stérilisateurs, Ed. Afnor, Juin 1997.
[ 16 ] EN 867 (NF S 98000) Systèmes non biologiques destinés
à être utilisés dans les stérilisateurs, Ed.
Afnor, Juin 1997.
[ 17 ] EN 868 (6 parties) Matériaux da^emballage pur la stérilisation
da^objets emballés, Ed. Afnor, Juil.1997.
[ 18 ] EN 46002 Systèmes qualité dispositifs médicaux
exigences particulières relatives à l'application de l'EN
ISO 9002, Ed Afnor, Déc. 1996.
[ 19 ] Recueil des normes Sécurité des dispositifs médicaux,
Ed. Afnor, 1997, p13.
[ 21 ] Pharmascopie Soins et Thérapie La stérilisation,
F.Galtier, Ed. Arnette Blackwell, Mars 1996.
[ 23 ] Centre d'Etudes et de Formation Hospitalières La stérilisation
en milieu hospitalier, Ed. Centre Européen de Prestations de Service
pour la Santé, Jan.1998.
[ 24 ] Hygiène en milieu Hospitalier Validation des procédés
de stérilisation, D.THIVEAUD, oct.1998, vol. n°11, p.21
[ 25 ] Hygiène en Milieu Hospitalier Supplément
La compilation des dossiers stérilisation la^initiative de la société
LEQUEUX S.A, Dominique THIVEAUD, Avr.1999.
[ 26 ] Techniques Hospitalières - V. de GRIVE - Système
Qualité en stérilisation: L'expérience du CHU de BESANÇON.-D.CABELGUENNE,
J.SIMOND, E.VERMEULEN, M.VOUTIER. Mise en place d'un système Qualité
à la stérilisation centrale du CHU de BOURGOIN-JALLIEU. Sept.1999,
vol n°639, p.32
Cette réception doit être documentée.
Les contrôles et essais de réception sont réalisés
conjointement par le fabricant et la^utilisateur.
-une fois par an minimum (voir requalification opérationnelle).
-un essais de pénétration de chaleur pour chaque
type de charge et da^emballage,
-ne représentent pas, sur chaque sonde, de variation
de plus de 1°C,
-ne diffèrent pas entre chaque sonde de plus de 2°C.
-inférieur à 30 secondes si le volume de la^autoclave
est > 800 litres.
-le cycle choisi,
-les valeurs et tolérances appliquées,
-la^emplacement de chaque sonde,
-la^emplacement du point le plus froid,
-les enregistrements de pression et de température,
-les valeurs maximales, moyennes et minimales en degré Celsius,
-le certificat da^étalonnage des instruments da^essais.
Subtil Crépieux5 rue Jean Mermoz69680 Chassieutel : 04
72 14 16 18 fax : 04 78 26 64 90Email: info@subtil-crepieux.com
OPTIM
A.T.P.M228 Boulevard Romain Rolland13010 Marseilletel : 04 91 79 18
19 fax : 04 91 79 10 39Email: atpm13@club-internet.fr TRAÇASTE
Lequeux17 rue de la Gaudrée ZI BP 10391415 Dourdan cedextel
: 01 60 81 84 00 fax : 01 60 81 84 84 SUPERVISION
S.P.S5 Rue montigny ZI BP 17077527 Coulommiers Cedex FranceTel : 01
64 75 60 00 fax : 01 64 75 60 07 STERIGEST
Maquet 38, rue Marbeuf75008 PARISTel : 01 56 69 10 70 fax : 01
56 69 10 71Email: maquet@wanadoo.fr STERECOGNITO