|
Avertissement |
|
Si vous arrivez directement sur cette page, sachez que ce travail est un rapport d'étudiants et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé pendant la période de formation et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part . L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
Traçabilité et gestion informatisee en
Stérilisation hospitalière
|
|
|
|
Anthony RICHARD |
|
Résumé Dans l’objectif d’amélioration continue des pratiques de stérilisation hospitalière et en réponse à une réglementation précise dans ce domaine, l’institut Jacques cartier s’est engagé sur la voie de la certification de son service de stérilisation centrale. Dans ce contexte, il m’a été demandé l’étude et la mise en place de traçabilité informatisée de cette activité, mais aussi la mise en place de solution à toutes difficultés ou anomalies rencontrées dans le fonctionnement et l’organisation de ce service, en se basant sur le guide des bonnes pratiques pharmaceutiques de stérilisation. Ce rapport présente les différents aspects de ces travaux, les problématiques posés en matière de stérilisation et les méthodologies employées. Il présente aussi les premiers résultats et améliorations amenés par l’informatisation de la traçabilité. Mots-clés : traçabilité, gravage, stérilisation, qualité,
organisation et management. |
|
Abstract In the aim of continuous improvement of
sterilisation units uses, l’institut Jacques Cartier is beginning the
implementation of quality assurance programs, in response of specific
legislation. In this
context, the study of computerization of a reliable and comprehensive record
tracking system and its starting up represents my works, based on right
sterilisation practises guide. This
study presents different viewpoints of this work, and also presents
difficulty and method, as well as results and improvement followed from
computerization. Key
words: tracking, engrave sterilisation, quality, organization and management. |
REMERCIEMENTS
- à Monsieur Chevallier pour son soutien et sa contribution,
- à Monsieur Farges pour son aide et ses conseils,
- à Monsieur Hoellard, Responsable Biomédical, pour son accueil et sa précieuse collaboration,
- à Monsieur Boudier, Directeur de l’Institut Jacques Cartier,
- à Madame Legros, pharmacien hospitalier pour l’attention et l’aide qu’elle m’a apporté,
- à Monsieur Labro, responsable du bloc opératoire,
- à Madame Edouard, ingénieur d’application, société Optim SA,
- à Monsieur DRIE, directeur général, société Optim SA,
- à Madame Vincent, pharmacien hospitalier, Hôpital Européen Georges Pompidou,
- à Monsieur Fort, consultant, société Hupfer,
- à Madame Basile, pharmacien hospitalier, hôpital privé d’Antony,
Et, bien sûr, toutes les personnes ayant aimablement collaboré lors de ce projet.
INTRODUCTION
1. PRESENTATION DE L’ETABLISSEMENT
1.1 Historique du groupe Générale De Santé
1.2 Historique de la clinique
1.3 Situation géographique
1.4 Activités
1.5
Le
service biomédical
1.6
Hiérarchie
du site
2. GENERALITES
2.1 Définition de la traçabilité
2.2 Finalité de la traçabilité dans le domaine hospitalier
2.3 Rappel des différentes étapes de stérilisation
2.4 Choix d’un logiciel et outil de traçabilité et de management
2.5 Tableau récapitulatif du cahier des charges
2.6 Descriptif du fonctionnement du logiciel
3. INITIATIVES ET TRAVAUX DE L’ETUDIANT
3.1 Un premier constat
3.2 Des efforts à réaliser
3.3.1 Proposition de modification
fonctionnelle de la zone de conditionnement.
3.3.2 Proposition de réagencement de la zone de conditionnement
3.3.3 Proposition de modification du mobilier de la zone de conditionnement
3.3.4 Proposition d’une fiche de retour de l’instrumentation
4. MISE EN SERVICE DU SYSTEME DE TRACABILITE
4.1 Les prés requis à l’installation d’Optim
4.2 Architecture réseau de l’installation Optim
4.3 Etapes de l’installation de la traçabilité
4.3.1 Suivi complet de l’installation et formation avec la société Optim SA
4.3.2 Saisie de la base de données et câblage. Durée : 1 mois environ
4.3.3 Finalisation de l’installation et formation à l’utilisation. Durée : 3 à 5 jours
4.4 Principe de fonctionnement du logiciel Optim Sté
4.4.1 Garantie des procédures et répétitivités
4.4.2 Illustration du fonctionnement du logiciel par les
procédures dégradées
4.5 Niveau de traçabilité et informations transmises
aux unités fonctionnelles
4.6 Cas concret de gestion d’activité :
productivité et ressources humaines
4.7 Les bénéfices et améliorations apportés
5. ETUDE DU PROCEDE DE TRACABILITE DATAMATRIX
5.1 Le principe du gravage DATAMATRIX
5.2 Les fonctions
5.3 Etude de faisabilité sur le site clinique de Massy
5.4 Conclusion transmise à la direction de l’Institut Jacques Cartier
CONCLUSION
BIBLIOGRAPHIE
ANNEXE
INTRODUCTION
Depuis que la sécurité des patients est devenue un enjeu majeur de santé publique, la politique d’assurance qualité à l’hôpital se présente aujourd’hui comme une priorité incontournable. Si cette notion est développée et intégrée dans l’esprit des industriels, le monde hospitalier le découvre et tente de l’appliquer à ces activités, dans un contexte réglementaire exigeant.
La stérilisation hospitalière fait partie de ces activités sur lesquelles une démarche d’assurance qualité est nécessaire. Elle s’appuie sur deux axes fondamentaux, le premier étant le guide des bonnes pratiques pharmaceutiques hospitalières, qui garantie la bonne exécution des procédés de stérilisation, le second étant la mise en place d’une traçabilité permettant l’identification de tous les éléments techniques, historiques et humains.(qui fait quoi quand et comment)
L’institut Jacques Cartier, conscient des exigences réglementaires lui incombant et conscient des limites de l’organisation actuelle de son activité stérilisation hospitalière, a fortement affiché sa volonté d’amélioration de ces pratiques et de progresser dans sa démarche qualité. L’établissement a donc décidé de se doter d’outil de gestion par ordinateur de la traçabilité. En parallèle, un effort important d’appliquer les bonnes pratiques de stérilisation, a conduit à l’ouverture d’autres sujets d’amélioration (réhabilitation des locaux, formation du personnel, achat de matériel, changement du mobilier…). Ces deux axes représentent la condition initiale et incontournable en vue d’une certification future de cette activité.
Dans ce contexte de changement et d’amélioration des procédés de stérilisation, ma mission fut l’analyse et l’évaluation des limites du système actuel, la proposition et la mise en place de solution de traçabilité assistée par ordinateur et enfin de mesurer l’impact et les résultats des investissements effectués.

Fig.1
Vue de l’entrée principale de l’institut Jacques Cartier
1. PRESENTATION DE L’ETABLISSEMENT
1.1
Historique du groupe Générale De Santé
Créée en 1987, la Générale de
Santé s'est imposée comme une entreprise de services, spécialisée dans l'offre
globale de soins dans le secteur de la santé. Aujourd'hui, elle est le leader
incontesté de l'offre globale de soins privés en France.
Ce groupe couvre tous les
métiers de l'hospitalisation garantissant ainsi au patient une prise en charge
globale et adaptée grâce à son réseau d'établissements unique en Europe. Des
établissements sont aussi implantés en Italie, au Portugal, ainsi qu’au Canada.
La réussite de Générale de Santé
se traduit par une forte croissance puisqu'en quinze ans son chiffre d'affaires
a été multiplié par quatre, passant de 300 millions d'Euros en 1987 à 1250,2
millions d'Euros en 2004, la Générale de Santé représente 11 % du marché
français de l'hospitalisation privée.
1.2
Historique de la clinique
L’Institut Hospitalier Jacques
Cartier est un établissement privé à but lucratif appartenant à un groupe
gestionnaire (Général de Santé) de même type. Il a été créé en 1996, par le
regroupement de trois établissements existants, la clinique de Massy, la
clinique La Francilienne aux Ulis et la clinique Vigier à Savigny-sur-Orge.
1.3 Situation géographique
Il est devenu le pôle de santé
de référence dans le grand sud parisien en raison de sa taille, de son éventail
d’activités comprenant un pôle en cardiologie. Situé à un emplacement
stratégique, au croisement de quatre départements (Essonne, Hauts de Seine, Val
de Marne et Yvelines) il répond aussi aux besoins d’une vaste population locale
estimée à plus d’un million d’habitants.
Les personnes traitées au sein
de l’institut hospitalier Jacques Cartier proviennent en grande majorité du
département de l’Essonne (75 %) dont 15 % de la ville de Massy, les autres
venant des départements limitrophes.
1.4 Activités
L’établissement dispose de 306 lits et places autorisés. La capacité utilisée est de 168 lits de chirurgie, 66 de médecine, 30 de gynécologie obstétrique et 22 places de prise en charge ambulatoire.
La cardiologie étant l’activité dominante, l’établissement dispose de services de chirurgie cardiaque adulte et pédiatrique et pratique la cardiologie interventionnelle.
D’autre part, l’établissement est doté d’une unité de proximité, d’accueil, de traitement et d’orientation des urgences, ainsi que d’un dépôt de produits sanguins labiles. Des prises en charge ambulatoires sont proposées dans les services de dialyse, de chimiothérapie et de réadaptation cardiaque.
Le plateau technique, architecturalement intégré au site, est composé, pour partie, d’entités juridiquement indépendantes. Il s’agit du secteur de l’imagerie médicale (radiologie, imagerie par résonance magnétique, scanner et angiographie) et du laboratoire d’analyses médicales. Les services de la pharmacie, de la stérilisation et des blocs opératoires sont propres à l’institut.
L’établissement a procédé à une extension récente de ses locaux. Les travaux, outre l’amélioration de l’hébergement, ont concerné les services de réadaptation cardiaque, du bloc opératoire général, de la réanimation, des urgences (6 nouveaux lits ouverts en juin 2005) et de la kinésithérapie.
Par ailleurs, l’institut a pris en charge la rénovation du laboratoire de biologie et la restructuration de cabinets médicaux hébergés.
1.5
Le
service biomédical
L’établissement a recruté son responsable biomédical, Monsieur Hoellard au début de l’année 2003, le service biomédical propre à la clinique a donc deux années d’existence. Il était jusqu’alors externalité à une société de prestation de maintenance biomédicale.
Le service biomédical est donc composé à ce jour d’une seule personne responsable biomédical de l’établissement. Elle assure toute seule les fonctions de gestionnaire du service ainsi que les fonctions de technicien répondant aux besoins des services de la clinique. Le recrutement de stagiaires permet d’assurer des fonctions logistiques, déchargeant ainsi ponctuellement le responsable biomédical. Depuis le début 2005, le service biomédical est situé au coeur de la clinique, au rez-de-chaussée à coté de l’accueil, sur le passage des personnels, des cadres, des commerciaux…
M. Hoellard fait parti du comité de direction, lui permettant ainsi de prendre part aux projets de l’établissement et de les intégrer dans la gestion de ses activités biomédicales.
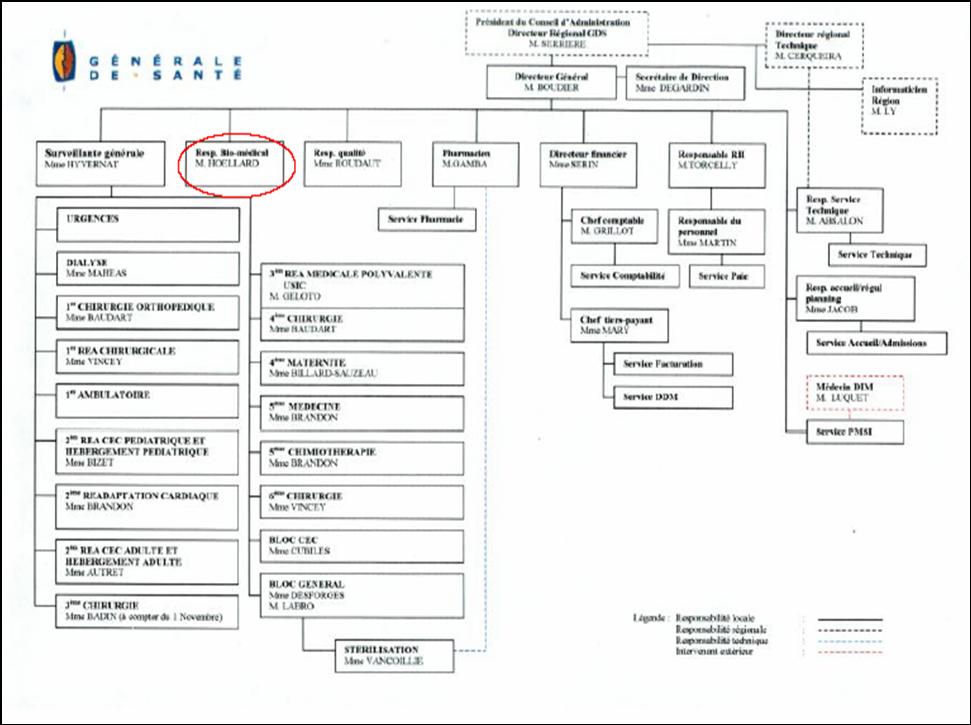
Fig. 2 Organigramme de l’établissement
1.6
Hiérarchie
du site
Président du conseil d’administration, Directeur Régional Général de Santé: M. Serrières
Directeur général de l’institut Jacques Cartier: M.Boudier
Secrétariat de direction : Mme Degardin
Ressources Humaines : M. Torcelly
Directeur financier : Mme Serin
Pharmacien : M. Le gros
Responsable Qualité : Mme ROUDAUT
Responsable biomédical : M. Hoellard
Responsable logistique : M. Labro
Surveillante générale : Mme Hyvernat
2. GENERALITES
2.1 Définition de la traçabilité :
De nombreuses définitions existent, aussi bien dans le domaine normatif relatif aux systèmes qualités que dans la réglementation hospitalière. En voici deux extraites de chaque domaine :
Norme NF EN ISO 8402:
La traçabilité est "l'aptitude à retrouver l'historique, l'utilisation ou la localisation d'un produit ou d'un processus de délivrance au moyen d'identifications enregistrées".
Circulaire DGS n° 672 du 20 octobre 1997 relative à la stérilisation des dispositifs médicaux dans les établissements de santé.
La traçabilité : « Les besoins en traçabilité sont identifiés en fonction des dispositifs médicaux. La traçabilité des dispositifs médicaux stérilisés au sein des établissements de santé est un élément du système qualité et concourt à l’exercice de la matériovigilance ».
2.2 Finalité de la traçabilité dans le domaine
hospitalier :
A propos de la traçabilité des dispositifs médicaux restérilisables, il faut distinguer la traçabilité des opérations qui relève des systèmes d’assurance qualité de la traçabilité des DMRS qui relève de la matériovigilance.
L’objectif de la traçabilité est de pouvoir, à tout moment, quelque soit la problématique :
-Remonter le processus pour identifier la cause du problème (élément ou événement)
-Chaîner la prestation en aval pour identifier les conséquences de ce problème afin de mettre en place des mesures correctives.
2.3 Rappel des différentes étapes de stérilisation :
Achat :
Les procédures d’achats permettent de sélectionner avec rigueur le bon produit pour la bonne utilisation. Les critères de choix portent en priorité sur une société pouvant justifier l’adoption de règlements normatifs de type ISO 9000 (4)
Pré désinfection :
La pré désinfection fait l’objet d’une procédure approuvée par le responsable du système qualité. Elle doit être effectuée immédiatement après l’utilisation du dispositif médical. Cette étape contribue à la protection du personnel et à la diminution de la biocharge. Cette étape ne relève pas de la stérilisation centrale.
Nettoyage et séchage :
Tout dispositif médical collecté doit impérativement subir le cycle de nettoyage afin qu'il soit fonctionnel et propre. Le nettoyage des dispositifs médicaux est réalisé chaque fois que possible dans un automate de lavage. Celui-ci est adapté à cet usage et qualifié. Quel que soit le mode de nettoyage, les opérations de rinçage et de séchage efficaces et non contaminantes du dispositif médical sont effectuées avant le conditionnement afin d'éviter toute nouvelle contamination.
Un contrôle visuel permet de retirer du cycle de stérilisation tout dispositif présentant des anomalies. Ces dispositifs suivront une procédure de réparation ou d'élimination.
Conditionnement :
Les systèmes d'emballage, utilisés pour conditionner les dispositifs médicaux, sont destinés à maintenir leur stérilité. Ils assurent une protection physique, chimique et microbienne. Les systèmes d'emballage seront compatibles avec le procédé de stérilisation.
Stérilisation :
Durant la phase de stérilisation, le personnel de la stérilisation doit vérifier le bon déroulement de la stérilisation grâce à la lecture des différents indicateurs de pression, de temps et de température.
Contrôles :
Pour la stérilisation à la vapeur d'eau, l'essai de pénétration de la vapeur est effectué avant chaque mise en service, au moins une fois par 24 heures.
Durant la phase de déchargement, le personnel vérifie :
- Le virage des indicateurs
- La siccité de la charge
- L'intégrité des emballages.
Lorsque l'ensemble des contrôles est conforme, la charge est libérée par la ou les personne(s) habilitée(s) désignée(s) par le pharmacien. La libération est attestée par la signature de la personne habilitée.
Suite à l'apparition d'une non conformité, il faut rechercher les causes.
Cette démarche fait référence à un processus écrit. Quelque soit le doute sur la stérilité du dispositif médical, la production est refusée.
Si tout est conforme, la charge est acceptée.
Archivage :
Les différents éléments ayant permis la libération de la charge, doivent être consignés et archivés. Un archivage minimal de 5 ans est effectué, sauf réglementation particulière.
Stockage et distribution :
Les conditions de stockage doivent être maîtrisées. Elles doivent être organisées pour éviter toute confusion entre circuit propre et circuit sale.
2.4 Choix d’un logiciel et outil de traçabilité et de
management :
Le cahier des charges précisant les caractéristiques voulues pour le choix d’un outil de traçabilité, a amené le groupe de travail « stérilisation » à choisir le logiciel Optim Sté 3 proposé par la société Optim SA.
2.5 Tableau récapitulatif du cahier des charges
|
Fonctionnalités |
Oui |
Non |
Observations |
|
Le logiciel prend-il en charge les différentes étapes de processus : Pré désinfection Lavage Conditionnement Autoclavage Validation de la stérilisation Dispensation Traçabilité des étapes opérationnelles |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
X |
|
|
|
|
Les fonctions liées à la pré désinfection
permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées au lavage permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées au conditionnement permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à l’autoclavage permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à la validation stérilisation/lavage permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à l’inactivation chimique permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à a séquestration permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à a remise en service permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions liées à a destruction permettent-elles de collecter toutes les informations décrites ? |
X |
|
|
|
Les fonctions d’administration permettent-elles d’assurer la gestion (création, suppression, modification) : Du fichier produit Du fichier des compositions Des dotations |
X |
|
|
|
|
|
|
|
|
Les fonctions de pilotages incluent-elles des outils : D’analyse des consommations De gestion des équipements D’analyse des non-conformités D’analyse des cycles non valides D’analyses des demandes des unités |
X |
|
|
|
Existe-t-il une procédure dégradée en cas de panne, permettant l’enregistrement manuel d’une étape de la stérilisation ? |
X |
|
|
|
Fonctionnalités |
Oui |
Non |
Observations |
|
Le système intègre-t-il un système de saisie et de traitement des demandent des unités fonctionnelles ? |
X |
|
|
|
Le système intègre-t-il un système de gestion des consommables ? |
X |
|
|
|
L’outil propose-t-il un système de gestion des droits d’accès avec Login et mot de passe ? |
X |
|
|
|
La documentation fournie est-elle conforme à la demande (support papier et CD, en français et destinée à l’administrateur, aux agents…) |
X |
|
|
|
Intégration |
|||
|
Est-il possible d’interfacer le module de gestion des consommables avec le logiciel de gestion de l’hôpital ? |
|
X |
POSSIBILTE DE DEVELLOPEMENT |
|
Cette interface existe-t-elle actuellement sur un autre centre hospitalier ? |
|
X |
|
|
Licence |
|||
|
Mode de licence par utilisateur |
X |
|
|
|
Mode de licence par poste de travail |
X |
|
|
|
Mode de licence site |
|
X |
|
|
Besoins en produit bureautique (nom, version logicielle minimum) |
|
|
SERVEUR + PC CLIENT (2) |
|
Nécessité autres logiciels (préciser version) |
|
|
SQL SERVEUR, WINDOWS SERVEUR 2000 |
|
Technique |
|||
|
Environnement supporté par le serveur |
|
|
LOCAL INFORMATIQUE CLIMATISE |
|
Les éditions supportées incluent-elles le format A4 ? |
X |
|
|
|
A3 ? |
X |
|
|
|
Les éditions supportées incluent-elles obligatoirement des couleurs ? |
|
X |
|
|
Le module de saisie de demande est-elle au format Web ? |
|
X |
POSSIBILITE DE DEVELOPPEMENT |
|
Faut-il dédiée une machine pour le serveur ? (indiquer les éventuelles restrictions) |
X |
|
PREFERABLE |
|
Les écrans tablettes et claviers supportent-il les opérations de décontamination liées à l’environnement ? |
X |
|
DECONTAMINATION DE SURFACE |
|
Quantité de consommables inclues nécessaires à la production d’étiquette d’identification codes à barres des compositions ? |
X |
|
3 MOIS |
|
Prestations |
|||
|
Prestations d’installation et de paramétrage ? |
X |
|
VOIR DEROULEMENT DE INSTALLATION |
|
Le paramétrage nécessite-t-il une saisie de la part des opérateurs ? Quelle en est une estimation de la charge et de la nature du travail associé ? |
X |
|
1 MOIS DE SAISIE |
|
Existe-t-il une possibilité d’importer des données ? |
|
X |
EXPORT EXCEL POSSIBLE |
|
Garantie/maintenance |
|||
|
Contrat de garantie ? |
X |
|
|
|
Nécessité de mise en place de télémaintenance ? |
X |
|
|
|
L’accès en télémaintenance peut –t-il s’effectuer au moyen d’un serveur d’accès distant ? |
X |
|
|
|
Contrat de maintenance couvre-t-il les évolutions et mises à jour logiciel ? |
X |
|
1 VERSION ANNUELLE MINIMUM |
|
Matériel/informatique |
|||
|
Marque |
|
|
|
|
Modèle |
|
|
|
|
Caractéristiques techniques |
|
|
|
|
Type de boîtier ? |
|
|
|
|
Mémoire vive |
|
|
|
|
Capacité mémoire vive |
|
|
|
|
Carte vidéo intégré ou non à la carte mère ? |
|
|
|
|
Carte réseau intégré ou non ? Type carte réseau |
|
|
|
|
Capacité disque dur ? vitesse ? |
|
|
|
|
Lecteur CD ? |
|
|
|
|
Lecteur disquette ? |
|
|
|
|
Ecran |
|
|
|
|
Marque Modèle type (FFT) ? |
|
|
|
|
Garantie |
|
|
|
|
Durée ? |
|
|
|
|
Sur site ? |
|
|
|
|
Délai intervention ? |
|
|
|
|
Délai réparation ? |
|
|
|
L’outil proposé par la société Optim, déjà installé dans de nombreux établissement offrait, en plus de la gestion de la traçabilité du processus de stérilisation, une interface de traçabilité à l’instrument par gravage appelé procédé Datamatrix, solution de traçabilité totale en cours de développement dont il m’a été demandé une étude en vue de son application sur le site de Massy (Voir chapitre 5).
2.6 Descriptif du fonctionnement du logiciel :
Dans un premier temps, le logiciel ne prend en charge que les étapes suivantes du processus de stérilisation :
-Lavage ou nettoyage
-Conditionnement
-Chargement et stérilisation
-Validation charge et déchargement
- Phase de pré - désinfection et de nettoyage
La traçabilité des dispositifs médicaux peut débuter dès la pré désinfection.
Les instruments «souillés» au bloc ou dans les services de soins sont placés dans des paniers à mailles fines, équipés d'une plaque inoxydable gravée d’un code barre. La phase de pré - désinfection consiste à tremper les paniers dans un bain suivant un protocole défini par le Comité de Lutte contre les Infections Nosocomiales. La durée du trempage, en fonction de l’agent désinfectant, sera le paramètre de traçabilité.
Pour assurer la traçabilité de ces instruments, le personnel de stérilisation enregistre avec une douchette le code barres de chaque panier avant d’entamer la pré - désinfection. Il effectuera la même opération à la sortie du bain de désinfection.
- Phase de nettoyage
La possibilité est donnée aux utilisateurs de débuter ou poursuivre une traçabilité à partir du nettoyage.
Lors de la réception des
dispositifs médicaux pré -désinfectés, ceux ci seront répartis dans chaque
panier doté d’un code barres pour subir un cycle de nettoyage. Il existe un
autre principe d’identification des instruments qui consiste à joindre dans
chaque panier un support de données individuel résistant au nettoyage et à la
désinfection lors du déchargement, les données électroniques relatives à chaque
panier seront recueillies. Ces informations pourront être jointes à l’étiquette
code barre imprimée pendant la phase de conditionnement.
La traçabilité des données du processus de nettoyage et de
désinfection sera ainsi assurée jusqu’au patient.
- Phase de conditionnement
Pendant la phase de conditionnement, les dispositifs médicaux
sont regroupés suivant un inventaire détaillé et précis, permettant ainsi au
personnel de stérilisation d'assurer la composition des sets à partir d’une
base de donnée avec photos et descriptifs ; un code barres, soit un numéro
individuel, sera attribué à chaque unité de stérilisation afin de l’identifier
avant son passage dans l’autoclave.
La soudeuse assure le scellage du conditionnement des dispositifs
médicaux, elle peut dans certains cas apposer un code d'identification. Toutes
les données (nom du dispositif médical, date de stérilisation, date de
péremption, le service de destination…) nécessaires à la traçabilité sont
imprimées sur une étiquette conçue pour résister au passage en autoclave, quel
que soit le cycle.
Les étiquettes sont ensuite collées en deux exemplaires sur
les emballages «papiers» ou «containers» au moment du conditionnement. Après
utilisation de ces produits lors d’une intervention chirurgicale par exemple,
les étiquettes seront scannées (à l’aide d’un lecteur) afin de compléter le
dossier informatique du patient. Parallèlement, un exemplaire d’étiquette sera
décollé de son emballage et joint au dossier patient afin de conserver les
archives papiers.
L’objectif commun de ces logiciels sera d’assurer l’historique
des produits stérilisés. Le Responsable Qualité pourra ainsi retrouver toutes
les informations relatives à chaque set concernant aussi bien :
La traçabilité ascendante (en retrouvant le numéro de lot des
compositions ayant servi à opérer un patient),
La traçabilité descendante (en retrouvant pour un lot donné,
les patients opérés avec des compositions présentes dans un même cycle de
stérilisation).
- Phase de stérilisation
Durant la phase de stérilisation, le personnel utilise des
indicateurs physicochimiques comme procédés de contrôle. Des sondes ou des
capteurs spécifiques embarqués sont aussi proposés. Placés directement au coeur
de la charge (dans des endroits définis par des procédures écrites), leur rôle
consiste à mesurer et à enregistrer les variables physiques pendant toute la
durée du cycle (pression, température…).
Les données relatives au cycle seront déchargées dans le
système informatique permettant ainsi de lier étroitement le produit stérilisé
à des valeurs contrôlant les paramètres de validation du cycle.
L’intérêt de ces procédés est d'augmenter la sécurité et la
traçabilité par un contrôle des paramètres indépendant de l’autoclave et relié
à un étalon européen. L’institut Jacques Cartier étudie ce procédé en vue d’une
acquisition prochaine.
Le traitement de l'information par l'informatique ne
dispensera pas pour autant le service de stérilisation de procéder à un
archivage papier.
- La traçabilité des paramètres physiques des stérilisateurs
Certaines sociétés offrent en option des logiciels
superviseurs permettant d'assurer la traçabilité en temps réel des paramètres
physiques de la stérilisation. Des interfaces informatiques proposent dans
certains cas une récupération de ces valeurs vers les logiciels de traçabilité
présentés précédemment, appelé communément supervision.
L'intérêt est d'établir une corrélation entre les différentes
valeurs paramétriques du stérilisateur afin de valider le cycle de
stérilisation.
Une entente entre les fabricants de stérilisateurs et les
concepteurs de logiciels de traçabilité est nécessaire pour adopter un standard
commun. La récupération des données de l'autoclave est aisée et ne
nécessiterait pas ou peu d'investissement supplémentaire de la part du client
pour créer une interface.
- Gestion de la stérilisation
Les logiciels de traçabilité des dispositifs médicaux sont
aussi des outils performants pour la gestion de l’activité de la stérilisation.
Ils permettent à la fois :
De suivre la production en temps réel (liste des articles
stérilisés, nombre et type de cycles réalisés, la distribution aux différents
services…),
De gérer les stocks stériles au niveau de la stérilisation
centrale,
De suivre les dysfonctionnements (liste de tous les cycles non
validés avec la répartition par autoclave, liste de tous les articles envoyés
au rebut),
De suivre la maintenance en stérilisation.
Ils fournissent des données de suivi et de gestion relatives aux
coûts de fonctionnement imputés à chaque service ou unité de soins. La
transparence de ces données sensibilisera tous les acteurs permettant ainsi une
optimisation de la maîtrise des coûts.
3. INITIATIVES ET TRAVAUX DE L’ETUDIANT :
3.1 Un premier constat : l’écart des pratiques
Dès mon arrivée à l’institut Jacques Cartier, plusieurs anomalies et disfonctionnements critiques me sont apparus lors d’une analyse sommaire et lors d’entretiens avec les responsables de différents services attenants au service de stérilisation.
En effet, suite aux différentes visites et entretiens effectués au niveau de la stérilisation centrale de l’institut Jaques Cartier, un premier constat a révélé un écart des pratiques de stérilisation par rapport aux guides bonnes pratiques de stérilisation hospitalières. Le pharmacien hospitalier qui venait quelques jours plus tôt d’intégrer l’établissement, Mlle Legros, prenait justement connaissance de ces disfonctionnement et nous entreprîmes de nous réunir pour faire le point sur les problèmes rencontrés et les solutions à apporter.
Il fut donc décider de réunir tous les mois le groupe de travail « stérilisation » composé de :
Le pharmacien, Mlle Marie Hélène Legros,
Le responsable du service de stérilisation, Madame Vancoilie,
Les responsables du bloc opératoire général : Madame Desforges et Monsieur Labro,
Le responsable du bloc opératoire de chirurgie cardiaque : Madame Cubiles.
Le responsable du service biomédical, Monsieur Hoellard
Le responsable qualité, Mademoiselle Roudaut
Et moi-même.
3.2 Des efforts à réaliser :
Alors que L’institut Jacques Cartier ambitionnait de mettre en place une traçabilité informatisée avec en point de mire une traçabilité à l’instrument par gravage Datamatrix (dont il m’a été demandé une étude avec une visite en Allemagne), le fonctionnement du service de stérilisation contrastait étrangement avec l’ensemble des autres unités fonctionnelles et sur de nombreux points. J’ai donc pris part à un projet plus vaste que la simple traçabilité en stérilisation, consistant à conduire et à accompagner les efforts engagés par la clinique sur l’ensemble des dossiers d’amélioration du service de stérilisation.
Des travaux à réaliser :
Toutes les zones du service de stérilisation ont demandé des travaux. Un nombre important de non conformités fut relevé.
La zone de lavage contenant du carrelage murale, des prises électriques non conformes, des coffrages inox sur des parties techniques à réaliser, un sas de transfert à revoir, des prises d’air comprimé à installer et le sol à refaire ainsi que les évacuations d’eau usagée.
La zone de déchargement et est à réorganiser, une installation d’un arsenal stérile mobile sur rail est en cours d’étude.
Mais la priorité aura été la réhabilitation de la zone de conditionnement. En effet, un point d’eau était à éliminer de cette partie de la stérilisation, des coffrages sont à réaliser, les postes de travail des agents de stérilisation à revoir et le sol et les murs défectueux. De plus, le mobilier présent étant non conforme, le remplacement du mobilier existant et les travaux ont donc été commandés, en débloquant un budget supplémentaire.
Le suivi du matériel :
Nous avons aussi constaté qu’aucun inventaire du matériel à jour n’existait et aucune maintenance de conteneurs stériles de conditionnement n’avait été réalisée. Il a donc été décidé d’inventorier le parc d’instrumentation et de conteneurs, et d’engager une maintenance des conteneurs d’instruments auprès de la société Braun Aescuplap.
La formation du personnel :
Il a été rapidement décidé de former le personnel à la formation conducteur d’autoclave. Les agents de stérilisation ont rapidement montré une motivation de formation et d’amélioration de leurs pratiques quotidiennes. Nous avons fait appel à monsieur Bassin de la société CBC qui a dispensé à l’ensemble des agents une formation aux bonnes pratiques de stérilisation. La surveillante de ce service, très réfractaire à la volonté politique de changement et d’amélioration des pratiques et de gestion informatisée de son service a elle aussi participé à cette formation. Cette personne, tout au long de ma mission ne validera pas le principe de la traçabilité informatique, et tiendra une position difficile face à sa direction.
Organisation du service et système qualité :
Malgré la rédaction et l’existence de procédure et document qualité, très peu de cas de traçabilité écrite du patient vers la stérilisation existe. La responsable du service semble avoir abandonné d’exiger du bloc opératoire ces documents. Ce point fera partie de discussions avancées avec les responsables des blocs opératoires et les membres du Comité de Lutte contre les Infections Nosocomiales pour la mise en place d’une fiche de retour des blocs, clairement et complètement renseignée.
Enfin, de nombreuses anomalies dans la gestion de ce service alimentent le mécontentement des services clients de la stérilisation, telles que la gestion des périmés, la perte de matériel ou d’instrumentation, la gestion hasardeuses des arsenaux stériles ou encore des conditionnements non optimisés.
3.3 Proposition d’améliorations :
La réponse à ces disfonctionnement passe par une forte volonté de changement de tous les acteurs dans leur façon quotidienne de procéder, mais aussi et surtout par un investissement financier important mais incontournable de la part de la direction. En effet, le projet initial de simple traçabilité informatique s’est alors transformé en projet de réhabilitation de ce service. L’investissement financier initial d’informatiser la gestion et la traçabilité du projet a donc doublé pour engager ces travaux, formations, maintenances et achat de mobilier.
3.3.1 Proposition de
modification fonctionnelle de la zone de conditionnement :
Sur la base d’une amélioration des pratiques avec en ligne de mire l’augmentation de la productivité du service de stérilisation, et suite à l’observation de la zone de conditionnement, je proposais une modification des lignes de flux de conditionnement. Cette solution attractive dispensait les agents de stérilisation de nombreux déplacement et ainsi un gain de temps et d’efficacité. Malheureusement, le fait de déplacer un laveur automatique et surtout la présence d’un pilier porteur au cœur de la zone de conditionnement, nous ont fais abandonné cette idée.
Néanmoins des solutions seront apportées, comme la mise en place de postes assis-debout pour le confort et l’ergonomie des agents, la modification de l’emplacement de postes de travail et des soudeuses de sachet, la mise en place de sachets prédécoupés qui évitent au personnel de nombreuses manipulations. Enfin, la mise en place de cadre et portique contribuent à l’ergonomie des opérateurs. Toutes ces modifications ont fait l’objet d’échange avec le personnel qui validait régulièrement ces travaux et qui possédait bien souvent les solutions aux problèmes constatés.
3.3.2 Proposition de réagencement de la zone de
conditionnement :
Les lignes fléchées schématisent les déplacements des agents et du matériel à conditionner. Les laveurs automatiques sont représentés par la lettre L, les soudeuses de sachet par la lettre S et les autoclaves par A. On observe sur ce schéma, la présence du pilier porteur sous le laveur 2 ou L2.
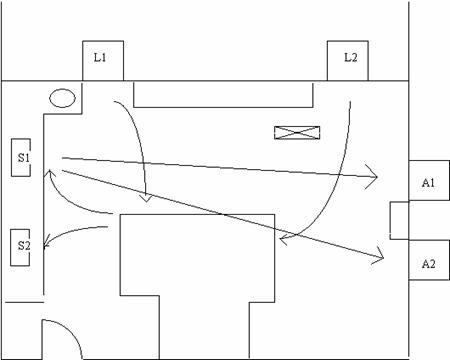
Fig. 3 Flux de conditionnement existant
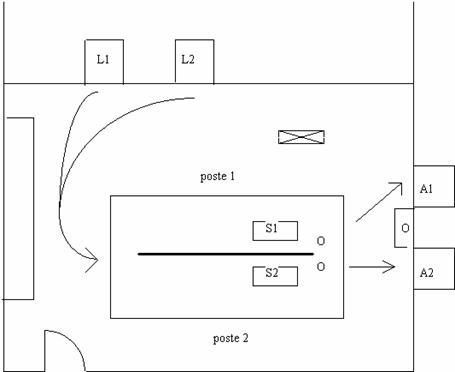
Fig. 4 La proposition de réagencement, non retenue pour cause de contrainte technique
3.3.3 Proposition de
modification du mobilier de la zone de conditionnement :
Le mobilier présent à mon arrivée sur le site, présentait de nombreuses anomalies (présence de bois, mauvais état de certaines armoires, nettoyage de surface difficile).
Le choix du prestataire fournisseur de mobilier s’est porté sur la société Hupfer, qui a réalisé à notre demande un mobilier de rangement, des postes de conditionnement équipés de portiques et de roues, permettant un nettoyage complet de la zone de conditionnement par simple mouvement de tout le mobilier. Un pont roulant entre les zones de lavage et de conditionnement a aussi été mis en place. Enfin, une armoire porte conteneur, des sièges assis-debout et une étagère mobile inclinée ont été mis à la disposition des agents. L’ensemble de ce mobilier a été choisi en inox pour son coté économique mais aussi pour faciliter les opérations de décontamination. En effet, Toutes les surfaces apparentes sont lisses, imperméables, sans fissures et sans recoins, afin de réduire l'accumulation et la libération de particules et de micro-organismes.
J’ai du choisir ce mobilier en concertation avec le pharmacien, et en écartant la responsable du service de stérilisation qui ne validait pas ces travaux, malgré les discussions et la diplomatie engagée envers cette personne.
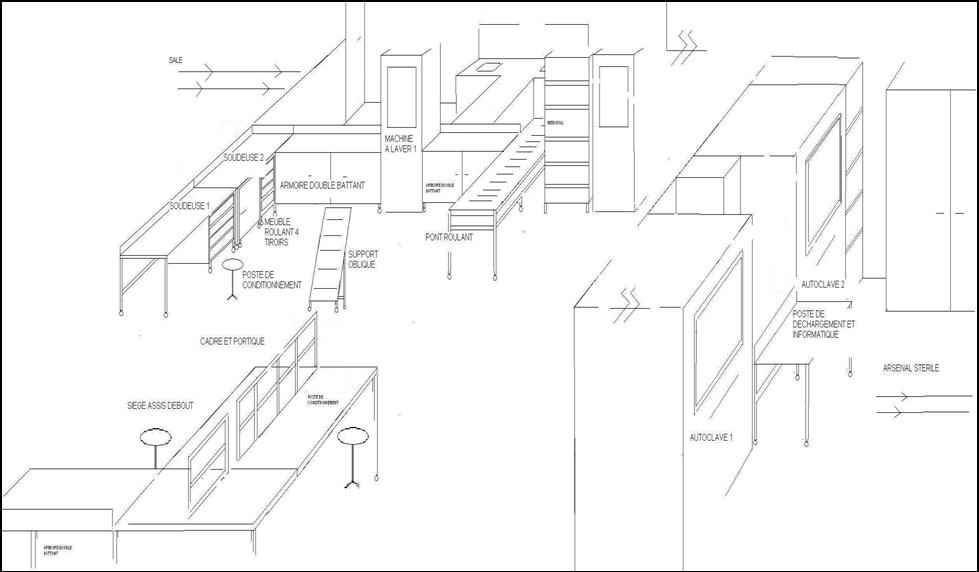
Fig. 5 Schéma représentant la zone de conditionnement
3.3.4 Proposition d’une fiche de retour de l’instrumentation :
Le Comité de Lutte contre les infections nosocomiales en parallèle de mes travaux, mettait en place, la rédaction d’une fiche de liaison des blocs opératoires vers le service de stérilisation. Je proposais alors une fiche de retour élaborée par la société Optim, comme base de travail.
4. INSTALLATION DU SYSTEME
DE TRACABILITE ET DU LOGICIEL OPTIM STE VERSION 3
4.1 Les prés requis à l’installation d’Optim :
Les prés requis à l’installation de ce système de traçabilité demandaient l’installation d’un serveur, de deux PC clients, d’un réseau Wifi et de support pour tablette PC. De plus, les maintenances des conteneurs, la mise à jour d’un inventaire le plus précis possible du parc d’instrumentation chirurgicale, les travaux techniques, la formation du personnel et l’installation du nouveau mobilier devais être terminés avant la mise en service du logiciel de traçabilité et de gestion.
Je mis alors au point un calendrier qui indiquait à chaque acteur les travaux à réalisés, en indiquant les étapes et le déroulement des phases jusqu’à la mise en service de ce système de traçabilité informatisé, depuis les formation administrateur système jusqu’à l’installation du matériel et la formation des agents de stérilisation de ce système, en passant par l’inventaire du parc et les travaux menés par le service technique. Basé sur la méthode du Qui, Quand, Ou, Quoi, Comment, Pourquoi, ce tableau faisait l’objet d’un compte rendu de l’état d’avancement des projets, distribué à l’ensemble des acteurs pendant les réunions mensuelles du groupe de travail « stérilisation ».
|
TRAVAUX |
Libellé |
Etapes |
Planifié |
Etat |
Qui |
Comment |
Autres/ montant devis |
|
Mise en place de la traçabilité « à
la boite » |
|
|
|
|
|
|
|
|
|
logiciel |
Paramétrage et formation au
paramétrage |
28/02/05 |
Fait |
Isabelle EDOUARD, Anthony RICHARD |
Formation à la saisie et à
l’administration du logiciel OPTIM STE 3 |
|
|
|
|
Formation des cadres
(Responsable stérilisation centrale et pharmacie) |
Avril
|
Fait |
Anthony RICHARD/ Nicolas
HOELLARD/ Marie Hélène LEGROS /Michel LABRO/ |
Mise en place des PC
Clients et formation personnes concernées par gestion de la stérilisation |
|
|
|
|
Etude et rédaction des
protocoles de saisie |
Mars |
Fait |
Anthony RICHARD |
Réunion qui définira les
modalités d’utilisation et de gestion de la Base de Donnés. |
|
|
|
|
Saisie base de données |
De
Mars à Juillet |
Fait |
Stérilisation, pharmacie,
biomédical, blocs opératoires, Anthony RICHARD |
Suite à la formation,
entrée des données essentielles à la mise en route de la traçabilité.
(inventaire) |
|
|
|
Matériel |
Achat serveur et PC client,
mise en service |
Mars |
Fait |
Service informatique, Service biomédical, société
SIRCOM |
Validation devis Sercom,
réception matériel et mise en œuvre installation réseau. |
|
|
|
|
Achat et installation
système WIFI |
Mars |
Fait |
Service informatique, Service biomédical, société
ARIT (câblage) |
Validation devis ARIT, mise
en place bornes et antennes réseau protégé. |
|
|
|
|
Mise en place tablettes
OPTIM |
Mai |
Fait |
Service informatique, Service biomédical, OPTIM,
service technique |
Suite installation réseau
hertzien (WIFI), installation complète et définitive OPTIM. |
VERIFIER LES ALIMTENTATION
(1 prise secteur par tablette + 4 pour PC BRAS ET SUPPORT |
|
TRAVAUX |
Libellé |
Etapes |
Planifié |
Etat |
Qui |
Comment |
Autres/ montant devis |
|
Etude et Mise en place de la traçabilité
« à l’instrument » |
|
|
|
|
|
|
|
|
|
Logiciel Et Matériel |
Etude |
juin |
Fait |
Marie Hélène LEGROS, Anthony RICHARD |
Etude des toutes les
défaillances possibles du système, anticipation et résultats pour
application. |
Visite site Allemagne |
|
|
|
Mise en place échantillon
et poste DATAMATRIX. |
juillet |
A faire |
Anthony RICHARD |
Etude et essai sur
échantillon. |
Annulé et reporté pour 2006 |
|
Réaménagement zone de stérilisation |
|
|
|
|
|
|
|
|
|
Conditionnement |
Destruction du mobilier en
bois aggloméré, destruction du point d’eau |
Avril |
Fait |
Service technique. |
Remise en conformité du
local |
Devis HUPFER mobilier |
|
|
|
Mise en place du mobilier
inox |
Avril
mai |
Fait |
Société Hupfer / Service
technique |
Remise en conformité du
local |
Revoir les procédures de
bio nettoyage |
|
|
|
Mise en place de postes de
travail |
Avril
mai |
Fait |
Société Hupfer, Anthony
RICHARD |
Apporter solution de
travail adaptée (position assise, manutention réduite) |
|
|
|
Lavage |
Mise en place table
roulante |
Avril
mai |
Fait |
Société Hupfer |
Transfert vers zone
conditionnement |
|
|
|
Stockage |
Etude rayonnage de stockage
dans arsenal stérile |
Avril |
En cours |
Société Hupfer |
Optimisation des volumes de
l’arsenal stérile. |
Planifié 2006 |
4.2 Architecture réseau de l’installation Optim :
L’une des mes attribution fut de superviser les installations et mise en place des supports informatiques en collaboration avec le service informatique et les services techniques pour répondre au volet réseau et communication du cahier des charges techniques.
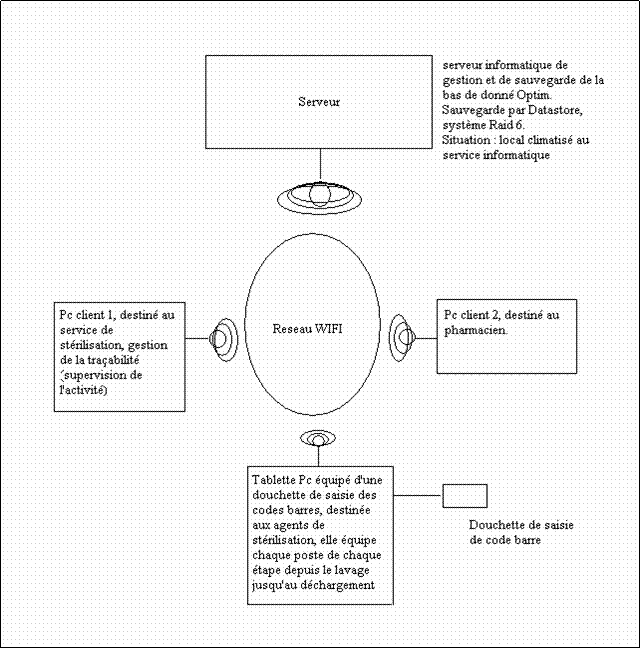
Fig. 6 Schéma du réseau Optim
4.3 Etapes de l’installation de la
traçabilité :
4.3.1 Suivi complet de
l’installation et formation avec la société Optim SA
Installation du logiciel et formation au paramétrage. Durée : 1 jour.
La mise à disposition d’un PC selon la configuration définie dans le contrat est requise.
Pour la société Optim, si l’installation est faite sur un serveur de l’établissement ou si plusieurs postes sont à installer, une personne du service informatique est demandée. J’assurais la prise en charge de cette installation.
Je définissais aussi sur chaque poste un compte Administrateur Optim afin de pouvoir effectuer l’installation en locale ainsi que les mises à jour ultérieures du logiciel. Le login sur ce compte devait être communiqué au formateur, madame Edouard, lors de son arrivée.
Une disponibilité totale pendant toute la journée de la personne chargée de la saisie de la base de données étant requise et les différents membres du groupe de travail, n’étant pas disponible, je fus chargé de cette tache.
4.3.2 Saisie de la base de
données et câblage. Durée : 1 mois environ.
Il s’agit d’une phase réalisée en interne et qui me fut donc confiée. En collaboration avec les différents responsables de blocs opératoires, un inventaire complet était établi en quelques semaines.
La saisie de la base de données se faisant sur la base du cahier de paramétrage joint par Optim, il était important de dédier une personne à la saisie afin de garantir la fiabilité du travail ainsi que des délais de réalisation raisonnables.
Enfin, la réalisation et la finalisation du câblage, ainsi que la fixation des postes de saisie ont été réalisé par les membres du service biomédical.
4.3.3 Finalisation de
l’installation et formation à l’utilisation. Durée : 3 à 5 jours.
La check-list comprend entre autre :
Câblage informatique et électrique adéquate terminé et testé.
Même pré requis concernant le réseau informatique que lors de la journée de formation au paramétrage
Les câbles de connexion des lecteurs code barre aux prises du réseau fait
Le matériel est livré et réceptionné par Optim (lecteurs codes barres, kit de démarrage, imprimante code barre…)
Disponibilité de l’équipe de stérilisation et de son responsable.
Disponibilité minimum du pharmacien pour Optim stérilisation. La phase de finalisation de l’installation dure en moyenne une demi-journée. Les autres jours sont consacrés à accompagner le personnel de la stérilisation plusieurs fois pour chacune des étapes afin de les familiariser avec la saisie code barres et avec la rigueur du système. C’est effectivement auprès des agents de stérilisation que je consacrais de nombreuses formations individuelles ou collectives. Ils permettent également de modifier la base de données en fonction des spécificités de fonctionnement mis en évidence lors de l’utilisation du système.
Du temps est également consacré à la formation des responsables si possible (Responsable de stérilisation et pharmacien) à l’utilisation du logiciel : paramétrage complémentaire, analyses, traçabilité (ces fonctions sont décrites dans le manuel du logiciel et le support Hotline permet d’apporter une assistance complémentaire…).
Il a été décidé que je serai le relais pour former les super utilisateurs et l’ensemble du personnel, pour assister et conduire le fonctionnement du service de stérilisation durant les étapes de mise en service du logiciel et du matériel de gestion et de saisie des codes barres. En effet, Optim SA évaluait à un mois la période de mise en fonctionnement totale de ce procédé. La baisse de productivité attendue durant cette phase critique, nous a amené à augmenter les équipes d’opérateurs pendant les deux premières semaines. Cette mise en place de ces nouveaux outils n’aura finalement pas nui au fonctionnement du service, et les agents hospitaliers ont très vite adopté ces procédés informatiques, qui présentent un aspect ludique et apportent une valorisation des postes de travail.

Fig. 7 poste de saisie avec douchette lecteur de code à barre
4.4 Principe de fonctionnement
du logiciel :
Le premier point pour l’utilisation de la gestion informatisée de la stérilisation est le renseignement des tables de fonctionnement. J’ai pris en charge et mené les inventaires que j’ai saisis dans la base de données, en collaboration avec les responsables de services :
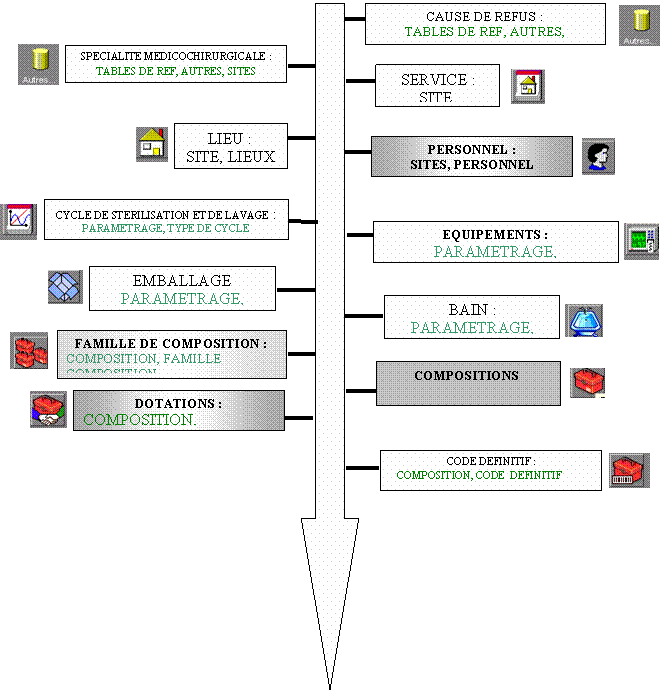
4.4.1 Garantie des procédures et répétitivités :
Une fois ces tables renseignées, nous possédons une base de
données qui donnent une image du fonctionnement du service de stérilisation. Le
superviseur va alors pouvoir intégrer des protocoles fonctionnels dont chaque
agent devra suivre les étapes, sachant que le logiciel autorise ou accepte les
demandes des agents.
En effet, les opérateurs qui disposent de poste de saisie
par douchette de lecture de code barre, identifie l’étape qu’ils effectuent sur
une fiche « protocole », par exemple le chargement d’un autoclave,
puis il s’identifient en douchant leur code barre nominatif. A ce niveau, si
l’agent identifié n’est pas autorisé à effectuer cette tache, le système
indique l’anomalie. De même en cas d’oubli ou de mauvaise manipulation
préalable au chargement, le système refusera de valider cette charge. Le
superviseur s’assure un pilotage
continu des opérations et un respect permanent des procédures documentées
nécessaires pour assurer la conformité aux exigences spécifiées. De même, la
répétitivité des actes est garanties
La stérilisation qui est un
"procédé spécial" aux sens des normes NF EN ISO 9001, 9002 et NF EN
46001, 46002. pour lesquels « les
résultats ne peuvent pas être entièrement vérifiés par un contrôle final du
produit effectué a posteriori, pour cette raison, il convient de veiller à la
validation des procédés de stérilisation avant leur mise en application, à la
surveillance de leur fonctionnement en routine ».
Dans ce cadre, une solution de pilotage de l’activité de
stérilisation par ce logiciel est une réponse aux exigences en vigueur et
réponds pleinement aux bonnes pratiques hospitalières.
4.4.2 Illustration du fonctionnement par procédures
dégradées :
Cas des procédures dégradées proposées, par Optim SA, sont
à utiliser en cas de panne total du système informatique. Elles illustrent
également la procédure suivie par les agents de stérilisation.
En cas de non utilisation du système OPTIM
STERILISATION, par exemple suite à une intervention de maintenance, cette
procédure permet :
D’assurer la traçabilité manuelle
nécessaire à l’obtention du cahier du stérilisation.
D’assurer à posteriori l’enregistrement
informatique des lots afin d’avoir une traçabilité informatique des lots
complète (pas de saut dans les numéros de lot).
Ces
informations suffisent à assurer la traçabilité des lots.
Au conditionnement :
L’opérateur de conditionnement note directement sur la composition :
Le code de référence OPTIM
de la composition ou le code définitif quand il s’agit d’un container / boîte.
La désignation de la
composition.
Afin que le service utilisateur puisse
identifier la composition. Cette information est par ailleurs nécessaire au
service utilisateur, principalement quand il ne peut pas en visualiser le
contenu avant de l’ouvrir.
Eventuellement, le nom de la personne ayant
réalisé le conditionnement.
Cette
information n’est pas nécessaire pour la récupération informatique des lots.
Cependant, elle peut être utile à l’utilisateur dans le cas où un litige se
présenterait.
Au chargement :
Information sur la
charge :
Le stérilisateur utilisé.
Le cycle utilisé.
Le numéro de lot de la charge réalisé.
Son nom.
La date de chargement.
L’heure de chargement.
Informations sur le contenu de
la charge
Code, nom et éventuellement opérateur de conditionnement précisés sur la composition.
Quantité de cette composition contenue dans la charge.
Au déchargement :
Informations sur la charge
Son nom
La date de déchargement
L’heure de déchargement
Validation ou non du diagramme
Validation ou non des intégrateurs
Le refus éventuel de la charge
complète avec la cause du refus
Informations sur le contenu de la charge
Pour chacune des compositions :
La quantité de la composition validée dans la case valide.
La quantité de la composition refusée dans la case refusé.
La cause de refus si une quantité est refusée.
Documents joints au dossier de traçabilité :
Diagramme
Intégrateurs
Une étiquette de lot est collée dans l’espace réservé à cet
effet
4.5 Niveau de traçabilité et informations transmises
aux unités fonctionnelles :
Présentation de l’étiquette de lot apposé sur
chacune des compositions stériles :

Fig.
8 Etiquette de traçabilité
Partie haute de l’étiquette :
Cette partie de l’étiquette va être collée par la panseuse sur le dossier patient. Elle
renseigne différentes informations concernant la composition et la charge à
laquelle elle a appartenu.
Entre accolades, est renseigné le code composition, qui est le code attribué à la composition par le logiciel. A côté, vous trouvez le nom (libellé) de la composition. Ici, il s’agit d’une composition d’ampli greffe 123.
En dessous, la date de péremption, la date de
stérilisation, le numéro de l’autoclave et l’identification de l’agent ainsi
que du service destinataire.
Sur la gauche, nous retrouvons le numéro de lot de
la charge. A partir de ce numéro de lot, il sera possible de retrouver le cycle
de l’autoclave, son diagramme et les intégrateurs conservés obligatoirement
sous forme papier.
Partie basse de l’étiquette :
Destinée à être collée sur la fiche de retour du
bloc opératoire vers le service de stérilisation, elle comporte le libellé de
la composition et un code barre, qui lorsqu’il sera douché par les agents, sera
reconnu par le logiciel Optim, ainsi que toutes les informations attenantes à
sa stérilisation.
4.6 Cas concret de gestion d’activité :
productivité et ressources humaines
Le contexte :
L’actuelle responsable du service de stérilisation demande
régulièrement du personnel supplémentaire pour cause de surcharge de travail le
soir et le matin. La direction de l’établissement me demanda donc s’il était
possible d’analyser la production de composition stérile de ce service. Grâce
au logiciel de gestion installé depuis quelques semaines, une étude fut
entreprise.
En effet, il devenait possible de donner la répartition de
la charge horaire de l’activité de stérilisation. Sur
un échantillon de dix jours comprenant un programme opératoire homogène, une
répartition horaire du conditionnement a été mesurée. En effet, deux fonctions
sont révélateurs de l’activité : le lavage, et le conditionnement.
L’installation du logiciel sur les postes de lavages n’étant pas effectives,
l’activité du conditionnement a été mise en évidence sur le graphique
suivant.
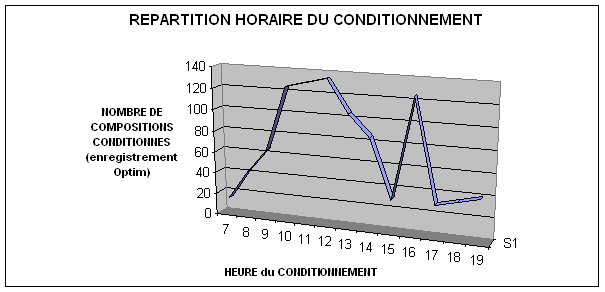
Fig.
9 Illustration de l’activité quotidienne en stérilisation
On retrouvera la même répartition horaire du conditionnement,
durant les dix jours de fonctionnement étudiés.
Plusieurs éléments ont retenu notre attention :
On observe une augmentation progressive de l’activité au
cours de la matinée. Cette activité correspond à l’augmentation progressive de
l’activité chirurgicale.
Puis, brutalement, la courbe de conditionnement s’effondre
entre 12 et 14 heures. Paradoxalement, c’est dans cette tranche horaire que
l’équipes de l’après midi rejoint l’équipe du matin. La responsable du service
ne pourra justifiée cette baisse d’activité, mais elle avouera que les deux
équipes déjeunent en même temps. La mise en évidence de ce phénomène par le
logiciel de gestion entraînera une modification du management et des plannings
des équipes, pour optimiser la production de la stérilisation.
Enfin, l’activité reprend tout aussi brutalement jusqu’à 16
heures, pour décroître à nouveau vers 17 heures. Ici, l’activité retrouve son
niveau normale jusqu’au départ de plusieurs membres du personnel. De 18 à 20
heures, seules deux personnes assurent le bon déroulement de la stérilisation,
là encore, une modification des ressources tendra à renforcer l’équipe du soir,
qui, régulièrement, ne peut faire face à la charge de travail demandé.
Il apparaît alors qu’une modification interne de l’organisation
des ressources humaines est à prioriser avant de conclure sur l’insuffisance de
l’effectif.
4.7 Les bénéfices et améliorations apportés par
l’informatisation de la gestion de la stérilisation :
Ce cas de figure illustre les possibilités que cet outil
procure, au-delà d’une traçabilité, il permet aussi :
- la garantie des procédures,
- la répétitivités d’un processus défini,
- la traçabilité (gestion des périmés, traçabilité
ascendante et descendante),
- l’analyses de l’activité,
- la gestion et le management du service, du matériel et du
personnel,
- la maîtrise des coûts de fonctionnements,
- l’optimisation des ressources.
Ces éléments sont autant d’avancées significatives sur
lesquelles les gestionnaires de ce service vont évoluer. L’installation récente
de ce matériel laisse déjà entrevoir les possibilités offertes, et ouvre la
voie d’une certification future, répondant ainsi aux attentes de
l’établissement.
5. ETUDE DU PROCEDE DE TRACABILITE DATAMATRIX
Le projet initial de gravage de l’ensemble du parc
d’instrumentation chirurgicale selon un procédé appelé Datamatrix, a fait
l’objet d’une étude de faisabilité sur le site de l’institut Jacques Cartier.
De nombreuses interrogations initiales ont été posées
concernant cette technologie. Il m’a été demandé une étude sur poste Datamatrix
avec une visite en Allemagne d’un site utilisant ce procédé.
5.1 Le principe du gravage DATAMATRIX :
Chaque instrument est identifié par une gravure
laser : le code Datamatrix fig.10 (équivalent d’un code barre, mais en
deux dimensions). Une lecture de ce code par une caméra spéciale (fig.13 page
39), permet l’identification de ce matériel. L’informatique traite ensuite
cette donnée et indique à l’agent de stérilisation toutes les informations pour
conditionner le matériel « douché ».

Fig.10 Le code Datamatrix gravé sur un instrument.
5.2 Les fonctions :
Le « système » code Datamatrix a pour fonctions la différenciation, l’identification, la reconnaissance de l’instrumentation, et permet l’optimisation du conditionnement.
5.3 Etude de faisabilité sur le site clinique de
Massy :
Dans un premier temps, un poste de lecture Datamatrix devait
me permettre de tester un échantillon d’instruments gravés en condition réel et
de le soumettre à une batterie de tests. Les résultats devant faire l’objet
d’une réflexion quant à l’application de ce procédé sur les 7000 instruments
chirurgicaux dénombrés dans cet établissement. Malheureusement ce projet, sensé
répondre aux interrogations légitimes de la direction de l’établissement, n’a
pu être concrétiser, le matériel nécessaire n’ayant pu être mis à disposition
par la société Optim SA. Une visite sur le site hospitalier de Freising proche
de Munich devra mettre en évidence les points forts et les faiblesses de
cette technologie.
Les entretiens réalisés avec Madame Florence Vincent, pharmacien hospitalier à l’Hôpital Européen Georges Pompidou, en charge de l’étude de la traçabilité à l’instrument pour son établissement, nous ont amené à nous poser de nombreuses interrogations sur l’aspect réglementaire du gravage de l’instrumentation. Madame Vincent qui terminait les essais sur le gravage et le procédé Datamatrix proposé par une autre société, n’était aucunement convaincu de la technologie étudiée. Pour elle, la caméra de lecture du code à barre posait problème. Monsieur Drie, directeur de la société Optim SA, nous assurait que la technologie proposée en Allemagne différait de celle étudiée par Madame Vincent, et était plus performante.
Aspect Réglementaire, questions soumises à Optim SA :
Le gravage de l’instrumentation chirurgical entraîne une modification de l’intégrité du dispositif. Quelle est la position des constructeurs et laboratoires face à cette modification (autorisation, accord, étude technique)?
Réponse d’Optim SA : aucune autorisation ou accord de la part des constructeurs et fournisseurs d’instrumentation ne serait nécessaire puisque les constructeurs utilisent cette technologie de gravage (au laser) pour y apposer les références produits.
Quant est-il du marquage CE ? Quels sont nos recours pour garantir l’intégrité de ce marquage (marquage CE de conformité de type I concernant ces dispositifs)?
Dans quelles mesures est-il possible d’apposer un marquage CE de conformité en interne ou par le biais de la société Optim?
Réponse d’Optim SA : l’intégrité du marquage CE ne serait pas remise en cause.
Quelles sont les avancées de l’AFNOR sur les nomenclatures de l’instrumentation ? (Il existe actuellement un groupe de travail AFNOR sur ce sujet, groupe dont Madame Vincent fait partie)
Aucune réponse satisfaisante ne nous sera fournie sur l’aspect réglementaire.
Aspect technique de la Gravure Datamatrix, questions posées à Optim SA :
Quel est le taux d’erreur lecture ? Dans des conditions normales ? En environnement « hostile », humidité, chaleur ou altération mécanique de la gravure.
Quelle est la profondeur du gravage, les dimensions du gravage. Alternative pour les instruments trop petits pour être gravés?
Qualité du gravage : société VANGUARD partenaire des différents industriels de l’instrumentation chirurgicale ?
Résistance à la chaleur (t° min, t °max), nombre de cycles ou temps moyen avant apparition erreurs de lecture ?
Estimation de la « durée » de vie de la gravure ?
Résistance à l’humidité ?
Résistance à l’oxydation ?
Résistance vapeur ?
Résistance rayure ?
Altération des couches d’instrumentation inox ou alliage ?
Aucune réponse satisfaisante ne nous sera fournie sur l’aspect technique de la gravure, aucune étude ne nous aura été communiquée.
Aspect technique de la caméra,
questions posées à Optim SA :
Principe de détection et lecture ? Temps d’acquisition et de lecture du Datamatrix ?
Les angles de lectures possibles ?
Lecture simultanée d’instrumentation ?
Environnement (ombre, vibration) ?
Taux d’erreur en lecture ?
Erreur possible, que se passe-t-il si lecture refusée ou impossible? Message d’erreur ?
Manipulation, les gestes à effectuer ?
Fixation ?
Autofocus ou distance mini et maxi pour lecture?
Distance de lecture ?
Même réponse qu’aux questions précédentes.
Aucune réponse satisfaisante n’a pu être produite par la société Optim SA, aucune étude précise n’étant disponible, il faudra nous contenter de la visite in situ à Freising (Allemagne), et suivre attentivement les tests qui seront prochainement réalisés par les services de stérilisation centrale de l’hôpital Européen Georges Pompidou, ou encore de l’hôpital de Cochin.
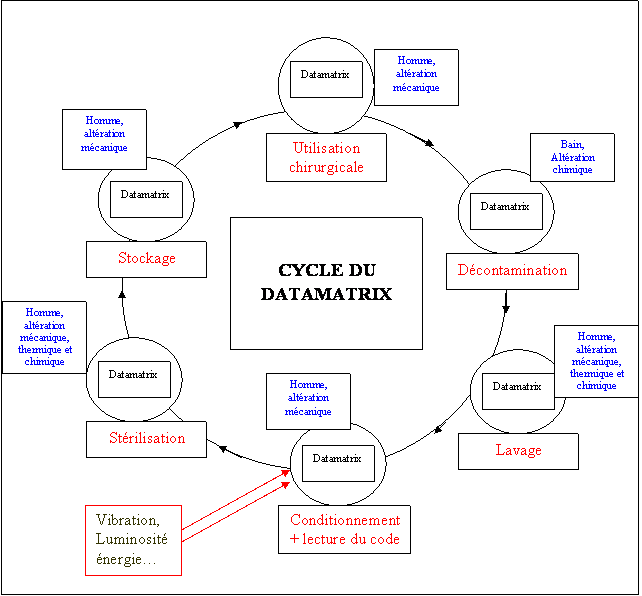
Fig.
11 Cycle du Code Datamatrix (instrument gravé), et impact de
l’environnement
5.4 Compte rendu de la
visite sur le site hospitalier de Freising (Munich)
Le contexte :
Le 20 juin 2005, Mme Marie-Hélène Legros, Pharmacien Hospitalier, accompagnée de M. Anthony Richard, Ingénieur Biomédical stagiaire, représentant l’institut Jaques Cartier, se sont rendu au centre hospitalier de Reising ( Munich), sur invitation de la Société Optim.
Le but de la visite était de découvrir la mise en place de la traçabilité à l’instrument dans un service de stérilisation centrale.
L’hôpital de Freising :
L’hôpital de Freising est un centre hospitalier public proche de Munich d’une capacité de 500 lits, le bloc opératoire comporte 5 salles d’opérations (chirurgie polyvalente), le service de stérilisation est doté de 6 machines à laver les instruments et de 5 autoclaves simple porte. Le parc d’instrumentation comporte 23000 DMR référencés et c’est une entreprise indépendante, la société VANGUARD, qui gère la stérilisation au sein de cet établissement. Le taux de rotation d’un instrument sur ce site est dix fois moindre qu’à l’Institut Jacques Cartier (en nombre de cycle en autoclave).
Les normes allemandes de stérilisation hospitalière dispensent les blocs de l’étape de trempage dans un bain de pré-désinfection en sortie de salle. Autre particularité, les cycles de stérilisation en autoclave (134°C, 3min ; 126°C, 10min ; 121°C, 15min) diffèrent des recommandations françaises (134°C, 18min).
Le procédé DATAMATRIX :
L’ensemble de l’instrumentation est marqué au laser et identifié par un code DATAMATRIX (équivalent d’un code barre définitif). La lecture de ce code par une camera permet l’identification de cet instrument et de toutes les données liées à ce DMR (composition, photo, fabricant, SAV, historique de stérilisation…)
Les points positifs du procédé DATAMATRIX :
Le logiciel peut gérer le conditionnement (outil particulièrement intéressant pour l’apprentissage du personnel), la flexibilité de la composition est réelle, le taux d’erreur de la composition est nul et la traçabilité est complète.
Les points critiques du procédé DATAMATRIX :
La manipulation est longue (2 à 3 secondes par instrument).
Le nombre d’erreur à la lecture est important : 15 à 20% de l’instrumentation n’a pas pu être normalement lue par la caméra lors de nos observations. La saisie du code se fait alors manuellement sur un poste informatique (Saisie : 10sec/instrument). On peut raisonnablement penser que ce taux d’échec sera plus important en France ou le traitement de l’instrumentation est plus agressive (trempage et temps de cycle plus important, altération de la lisibilité du gravage).
Autre point délicat, 10% de l’instrumentation n’est pas de dimension suffisante pour recevoir le gravage DATAMATRIX.
Enfin, l’intégrité du marquage CE n’est pas respectée lors de cette modification du DMR et aucune réponse satisfaisante ne nous a été fournie par la société Optim. En effet, un refus de prise en charge sous garantie par le constructeur est possible et, face à l’éventualité d’une matériovigilance, l’établissement devrait prendre seul ses responsabilités.
5.5
Conclusion transmise à la direction de l’Institut Jacques Cartier :
Il nous paraît évident que cette technologie est la solution qui répond aux problèmes de traçabilité et d’erreurs de composition. Néanmoins, le procédé proposé par les société Optim et Vanguard est délicat puisque les laboratoires et fabricants de Dispositif Médicaux Restérilisables commencent à appliquer le gravage Datamatrix sur leurs propres instruments (le marquage CE Médical est alors respecté). De plus, la norme définissant les nomenclatures de l’instrumentation est en cours d’élaboration. On peut donc raisonnablement penser que cette technologie arrivera à maturité dans une dizaine de mois et qu’il est souhaitable de laisser les fabricants nous proposer une solution commune en évitant une sous-traitance délicate.
Pour conclure, l’application de ce procédé sur le site de Massy avant ce délai nous paraît bien hasardeuse.

Fig. 12 Le poste de lecture et de conditionnement Datamatrix

Fig.13 La caméra de lecture du code Datamatrix
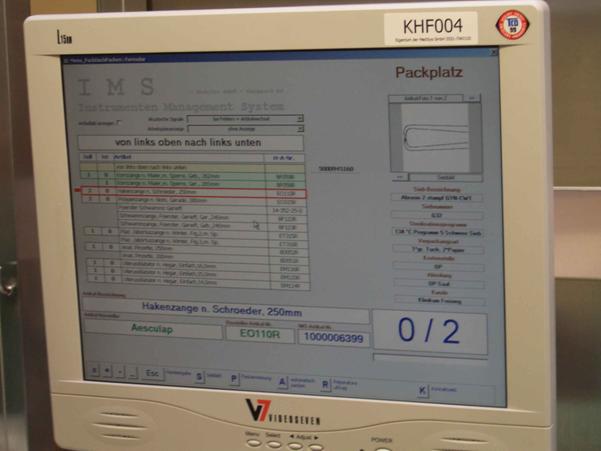
Fig. 14 Ecran de visualisation du logiciel Datamatrix
Le logiciel indique la composition de la boite, affiche une image de l’instrument scanné par le lecteur du code Datamatrix, indique les instruments déjà saisis et restant à saisir, leur nombre, donne tous les caractéristiques du Dispositif Médical Restérilisable (N° de série, nom, indication de taille, de forme, spécialité, chirurgien…).
Cette technologie est particulièrement attrayante pour les centres hospitaliers dont les infirmières de blocs opératoires effectuent le conditionnement des conteneurs. En effet, grâce à l’ergonomie et aux informations transmises par ce logiciel, n’importe quel agent hospitalier est capable d’effectuer parfaitement le conditionnement (étapes critiques de la stérilisation), à la condition d’avoir une base de données correctement renseignée. Les gestionnaires des ressources humaines des établissements publics y voient à juste titre un intérêt grandissant.
CONCLUSION
La mise en place de solutions faces aux écarts de bonnes pratiques rencontrées est le fruit d’une prise de conscience de ces écarts et d’une volonté d’amélioration des pratiques.
La capacité de l’ingénieur biomédical à organiser et manager, son approche rationnelle des problèmes rencontrés, sont reconnues et appréciées des professionnels hospitaliers. Il est impliqué dans les nombreuses actions d’améliorations entreprises et parfois son implication en stérilisation hospitalière l’amène à gérer un service de stérilisation centrale.
Aujourd’hui, l’institut hospitalier Jacques Cartier s’est engagé dans une démarche de valorisation et d’industrialisation de son service de stérilisation, et le rôle du service biomédical y est majeur :
La traçabilité de la stérilisation est complète et conforme aux exigences réglementaires. La traçabilité des dispositifs médicaux re stérilisables vers le patient sera bientôt assurée, et celle du boc opératoire vers la stérilisation est en cours.
L’acquisition d’un logiciel de gestion et de traçabilité en stérilisation a mis en évidence certaines non conformités, et les réponses à apporter. Cet outil incontournable pour la maîtrise et l’optimisation des pratiques répond ainsi aux premières attentes de l’établissement, décidé à poursuivre ses efforts d’investissement jusqu’à la certification de la stérilisation, un objectif pour la fin de l’année 2006.
BIBLIOGRAPHIE
Ministère de l'emploi et de la solidarité, ministère délégué à la santé
Bonnes pratiques de Pharmacie Hospitalière. 1ère édition - juin 2001
AFNOR
Norme NF EN ISO 8402
Management de la qualité et assurance de la qualité - Vocabulaire Juillet 1995
Ministère de l'emploi et de la solidarité, ministère délégué à la santé
Circulaire DGS/VS2 -DH/EM1/EO1/97672 du 20 octobre relative à la stérilisation des dispositifs médicaux dans les établissements de santé.
AFNOR
Norme NF EN ISO 9001 : Modèle pour l'assurance de la qualité en conception, production, installation et prestations associées. Août 1994.
AFNOR
Norme NFEN 868 : Matériaux d'emballage pour la stérilisation d'objets emballés. Juillet 1997.
AFNOR
Norme NFEN 554 : Validation et contrôle de routine pour la stérilisation à la vapeur d'eau. Octobre 1994.
AFNOR
Norme NF EN 285 : Stérilisateurs à la vapeur, grands stérilisateurs. Février 1997.
Guide et documents annexes : "Bonnes pratiques de stérilisation". JO
1993.
Réseau Régional d'Hygiène de Basse Normandie atelier traçabilité - jeudi 12 octobre 2000.
F.Botella, E.Marques
Traçabilité des dispositifs médicaux, Projet DESS, UTC, 99-00.
https://www.utc.fr/-farges/DESS_TBH/99-00/projets/tdm.htm
Dorothée Laure, François Gonnet, Didier Lemoine, Philippe Martineau,
Alain Vanneau, Georges Vanuxem,
REDACTION D'UN CAHIER DES CHARGES POUR L'ACQUISITION D'UN
LOGICIEL DE TRACABILITE EN STERILISATION CENTRALE,
UNIVERSITE RENE DESCARTES année 2002 – 2003,
Faculté des Sciences Pharmaceutiques et Biologiques.
ANNEXE
Extraits du guide des bonnes pratiques de pharmacie hospitalier (1ère édition, juin 2001) :
LIGNE DIRECTRICE PARTICULIERE N° 1
PREPARATION DES DISPOSITIFS MEDICAUX STERILES
1. PRINCIPE
L'objectif de la préparation des dispositifs médicaux stériles est de supprimer tout risque infectieux qui leur soit imputable. La stérilité est l'absence de tout micro-organisme viable. Pour qu'un dispositif ayant subi une stérilisation puisse être étiqueté "stérile", la probabilité théorique qu'un micro-organisme viable soit présent doit être inférieure ou égale à 1 pour 106.
Les étapes préalables à la stérilisation visent à réduire les contaminations microbiennes, chimiques et particulaires ainsi que la présence de substances pyrogènes.
L’inactivation des Agents Transmissibles Non Conventionnels (A.T.N.C.), dont l’agent responsable de la maladie de Creutzfeldt Jakob, fait l’objet de traitements spécifiques non décrits dans les présentes bonnes pratiques. Ces traitements spécifiques sont impérativement appliqués à chacune des étapes de la préparation des dispositifs médicaux stériles, en tant que de besoin.
2. GENERALITES
La mise en place d'un système permettant d'assurer la qualité de la préparation des dispositifs médicaux stériles est obligatoire. Pour cela, il convient de se référer également aux chapitres généraux ainsi qu’aux normes dont la liste est publiée par arrêté du ministre chargé de la santé.
L’établissement, après avis du pharmacien assurant la gérance, met en place une organisation de la préparation des dispositifs médicaux stériles adaptée à ses besoins.
Si un établissement de santé ou un syndicat inter hospitalier assure la préparation des dispositifs médicaux stériles, la pharmacie à usage intérieur doit disposer des moyens en locaux, personnel, équipements et systèmes d'information nécessaires. Pour faciliter la mise en place d’un système permettant d’assurer la qualité, la centralisation (si possible au voisinage des blocs opératoires) de la stérilisation des dispositifs médicaux, permettant le regroupement des moyens et des compétences, est à privilégier en particulier pour les nouvelles installations.
3. ORGANISATION GENERALE ET RESPONSABILITES
La stérilité d'un dispositif médical est déterminée par l'ensemble des opérations nécessaires à l'obtention et au maintien de l'état stérile de ce dispositif. Les opérations de stérilisation des dispositifs médicaux comportent, d’une part une étape de pré désinfection et, d’autre part, les étapes de préparation des dispositifs médicaux suivantes :
-le nettoyage,
-le conditionnement,
-la stérilisation proprement dite,
-les contrôles des différentes opérations,
-le stockage et la mise à disposition.
En dehors de la pré désinfection, ces opérations sont obligatoirement mises en oeuvre par la pharmacie à usage intérieur dans des locaux affectés à cette activité et visés dans l’autorisation d’ouverture de la pharmacie à usage intérieur pour cette activité.
La responsabilité de l'exécution de chaque opération de préparation des dispositifs médicaux stériles est définie et consignée par écrit. Un organigramme est établi afin de préciser les relations entre les personnes qui dirigent, exécutent et vérifient les tâches qui ont une incidence sur la qualité du dispositif médical stérile.
Le système permettant d’assurer la qualité de la stérilisation des dispositifs médicaux est organisé dans des conditions fixées par voie réglementaire.
4. RESPONSABILITES DANS LE DOMAINE DE LA STERILISATION
4.3. Qualité et attributions du responsable du système permettant d’assurer la qualité de la stérilisation des dispositifs médicaux
Ce responsable est désigné selon des modalités fixées par voie réglementaire. C’est une personne compétente et d’un niveau de qualification technique, dans le domaine de la stérilisation, au moins égal à celui du pharmacien ou de l’utilisateur médecin.
Dans la suite de cette ligne directrice cette personne est désignée sous le terme « responsable du système permettant d’assurer la qualité ».
Le responsable du système permettant d’assurer la qualité :
-s’assure de la mise en oeuvre du système permettant d’assurer la qualité de la pré désinfection et des opérations de préparation des dispositifs médicaux stériles, adapté aux besoins de l’établissement ;
-présente un rapport d’activité annuel au représentant légal de l’établissement ; -détermine, en accord avec le pharmacien, la durée de conservation des différents documents en fonction de la réglementation et de la durée de vie des appareils et dispositifs médicaux stérilisés ;
-approuve la procédure de pré désinfection des dispositifs médicaux à stériliser.
5. PERSONNEL
La qualité de la préparation des dispositifs médicaux stériles dépend, dans une grande mesure, de la compétence, de la formation et du comportement du personnel impliqué dans ces opérations.
Tout personnel intervenant dans les opérations de préparation des dispositifs médicaux stériles figure dans l'organigramme. Son activité fait l'objet d'une fiche de poste.
Toute fonction relative aux opérations de préparation des dispositifs médicaux stériles ne peut être remplie que par un personnel de compétence définie ayant bénéficié de la formation initiale et continue adéquates, déterminée, sur proposition du responsable du système permettant d’assurer la qualité, par le pharmacien, validée et enregistrée. Cette formation porte notamment sur la stérilisation, la conduite d’autoclave, le système permettant d’assurer la qualité en stérilisation, l'hygiène et la sécurité. Toute action de formation est consignée et conservée.
L’hygiène personnelle est essentielle et la nécessité et l'importance du lavage des mains sont rappelées périodiquement. Le personnel signale à l'encadrement, en liaison avec la médecine du travail, toute infection dont il serait porteur et qui pourrait constituer un risque de contamination afin que les dispositions nécessaires soient prises.
Le personnel en contact avec le dispositif médical à stériliser est vêtu pour chacune des opérations en fonction de l'objectif considéré et du risque qu’il encourt.
Le personnel affecté aux opérations de traitement des dispositifs médicaux avant conditionnement est protégé contre toute contamination ou blessure accidentelle dès lors qu'il manipule un matériel souillé.
Dans les zones où il convient de limiter les contaminations particulaires ou microbiennes, les cheveux et les barbes sont recouverts. L'utilisation de maquillage est déconseillée et le port de bijoux interdit. Les ongles sont coupés courts. Il est interdit de manger, de boire et de fumer en dehors des zones prévues à cet effet.
L’accès aux différentes zones concourant aux opérations de préparation des dispositifs médicaux stériles est limité, le déplacement du personnel dans ces zones est maîtrisé. Les consignes concernant l'habillage, le lavage des mains et la circulation sont respectées par toutes les personnes appelées à entrer dans ces zones.
Les personnes extérieures au service de stérilisation ne sont autorisées à pénétrer dans le service que si elles sont accompagnées et respectent les mêmes consignes.
6. LOCAUX
6.1. Généralités
Les locaux sont conçus et adaptés aux opérations effectuées ainsi qu’au volume d’activité.
Leur implantation permet une communication aisée avec les services utilisateurs, en particulier les blocs opératoires. Leur situation, leur conception et leur construction sont adaptées aux exigences de qualité de l’activité concernée et aux conditions de travail du personnel : ils permettent notamment le respect des procédures d'hygiène, d'habillage et de lavage des mains. La disposition des locaux et les procédures de circulation des dispositifs médicaux permettent d’éviter tout risque de confusion entre les dispositifs médicaux stérilisés et les dispositifs médicaux non stérilisés L’organisation des locaux permet de séparer physiquement les opérations de réception et de nettoyage des opérations de conditionnement. Le tri et le pliage du linge sont réalisés dans un local séparé.
Toutes les surfaces apparentes sont lisses, imperméables, sans fissures et sans recoins, afin de réduire l'accumulation et la libération de particules et de micro-organismes et de permettre l'usage répété de produits de nettoyage et de désinfection.
L’entretien de tous les locaux est essentiel. Des procédures précisent l'équipement de nettoyage, les méthodes et les produits à employer, la fréquence des nettoyages, des désinfections et des contrôles, le personnel désigné, les enregistrements effectués. L’entretien des zones où les contaminations particulaires ou microbiennes sont limitées est particulièrement important. Tout équipement de nettoyage susceptible de remettre en suspension la poussière est interdit.
Un système permettant d’éviter l’intrusion des animaux (insectes, animaux domestiques, rongeurs…) est mis en place.
6.2. Air
La propreté de l'air requis est précisée et dépend de la nature des opérations effectuées. Elle respecte au minimum les caractéristiques de la classe 8 de la norme NF EN ISO 14644-1 au repos dans toutes les zones de conditionnement. Les caractéristiques particulaires sont respectées en l'absence de personnel, à l'arrêt de toute activité, après un temps d'épuration de 20 minutes au minimum.
Des procédures précisent l’organisation et la fréquence des contrôles d’environnement par un personnel compétent et selon des méthodes validées.
LIMITES DE LA CLASSE 8 DE LA NORME NF EN ISO 14644-1 « au repos » particules de taille égale ou supérieure à 0,5 µm : 3 520 000
Nombre maximal autorisé particules de taille égale ou supérieure à 1 µm : 832 000 de particules par m³ particules de taille égale ou supérieure à 5 µm : 29 300
Pour atteindre la classe 8 de la norme NF EN ISO 14644-1, le taux de renouvellement de l'air doit être adapté au volume de la pièce ainsi qu'aux équipements et effectifs présents dans le local. Le système de traitement d'air doit être muni de filtres appropriés. La pression de l’air est contrôlée et maintenue au-dessus de celle des zones environnantes d’exigences inférieures pour éviter l’entrée d’air non filtré. Une maintenance préventive est assurée par un personnel maîtrisant l’installation. Les opérations de maintenance préventive et curative sont enregistrées.
Les équipements utilisés sont faciles à nettoyer afin d’atteindre le niveau de propreté requis.
Le pharmacien, en liaison avec le responsable du système permettant d’assurer la qualité, s'assure que les matériels sont qualifiés avant leur première utilisation et requalifiés en tant que de besoin et de façon planifiée.
Les appareils de mesure et d’enregistrement des paramètres critiques d’un équipement sont maîtrisés, étalonnés à intervalles définis avec des instruments de mesures raccordés aux étalons nationaux. Les documents relatifs à ces contrôles sont conservés.
Tout équipement est entretenu selon un plan de maintenance planifié et documenté. Un stérilisateur, pour être utilisé, a satisfait à toutes les opérations de qualification. Toute intervention préventive ou consécutive à un dysfonctionnement est signalée au pharmacien et au responsable du système permettant d’assurer la qualité ; elle est enregistrée. Le nom et la qualité de l’intervenant ainsi que la nature et la date des opérations sont enregistrés.
8. DOCUMENTS
Le système documentaire comprend :
a) les référentiels retenus ;
b) les procédures et les instructions, concernant toutes les opérations de préparation des dispositifs médicaux stériles et le maintien de l’état stérile, définissant les modalités d’intervention des différents prestataires hospitaliers ;
c) les contrats et conventions :
-les contrats de sous-traitance avec les entreprises industrielles ;
-les conventions de sous-traitance avec les établissements de santé ou les syndicats inter hospitaliers ;
-les contrats de maintenance des équipements et des installations, le cas échéant ;
d) les documents d’enregistrement, notamment :
-les comptes-rendus et enregistrements de validation, de contrôle et de maintenance ;
-les enregistrements des non conformités et des actions correctives ;
-les dossiers de stérilisation ;
e) les comptes-rendus des audits internes et externes ;
f) les rapports d'inspection ;
g) les spécifications techniques des dispositifs médicaux à stériliser et des matériels et produits utilisés pour la réalisation des différentes opérations de préparation des dispositifs médicaux stériles.
La maîtrise des documents est conforme au paragraphe « Documentation » du chapitre « Gestion de la qualité » des présentes bonnes pratiques de pharmacie hospitalière.
Le responsable du système permettant d’assurer la qualité détermine la durée de conservation des différents documents en fonction de la réglementation et de la durée de vie des appareils et dispositifs médicaux stérilisés, en accord avec le pharmacien.
10. CONDITIONNEMENT
Le conditionnement est effectué le plus précocement possible après le nettoyage. L’emballage primaire* constitue une barrière imperméable aux micro-organismes.
L’emballage secondaire assure la protection des dispositifs médicaux stériles dans leur emballage primaire. L’utilisation et les caractéristiques d’un emballage secondaire sont déterminées en fonction des risques de détérioration de l’emballage primaire jusqu’à son utilisation.
L’emballage est compatible avec le procédé de stérilisation, assure le maintien de la stérilité jusqu'à l’utilisation et permet l'extraction aseptique du dispositif. Il est choisi pour chaque catégorie de dispositif médical en fonction de ses caractéristiques physiques, de sa destination et des conditions d’utilisation. Il comporte obligatoirement un indicateur de passage.
Les matériaux et les systèmes d'emballage des dispositifs médicaux sont conformes aux normes et aux spécifications en vigueur. Ils sont conservés avant utilisation conformément aux recommandations du fabricant.
Le matériel de conditionnement est régulièrement vérifié, entretenu et contrôlé (par exemple température et force d’écrasement des soudeuses).
Avant stérilisation, chaque conteneur réutilisable fait l'objet d'un contrôle visuel et son aptitude au fonctionnement est vérifiée selon les recommandations du fabricant. Chaque conteneur est muni d'un système permettant d'indiquer clairement que l'intégrité de sa fermeture n'est pas compromise. Un plan de maintenance des conteneurs est établi et mis en oeuvre et le remplacement de tout élément est enregistré.
Afin d'assurer une stérilisation efficace, il peut être nécessaire de démonter tout ou partie de certains instruments, selon les recommandations du fournisseur.
La disposition des objets dans l’emballage permet la bonne pénétration de l'agent stérilisant et une extraction aseptique du dispositif médical stérile.
La fermeture de chaque emballage est contrôlée.
13. ETIQUETAGE
L’emballage permet d’identifier le dispositif médical. Il comporte les mentions permettant de tracer le processus de stérilisation et la date limite d’utilisation. Des conditions particulières de stockage et de manutention sont précisées si nécessaire. Le moyen de marquage n’endommage pas l’emballage.
14. DOSSIER DE STERILISATION
Le dossier de stérilisation, qui est conservé au moins 5 ans, sauf réglementation particulière, permet la traçabilité du procédé et contient :
-la date et le numéro du cycle ;
-l’identification du stérilisateur ;
-la liste des dispositifs contenus dans la charge ;
-les documents démontrant le respect des procédures des différentes étapes de la préparation des dispositifs médicaux stériles ;
-l’enregistrement du cycle ;
-le résultat des contrôles effectués ;
-le document de libération de la charge signé par la personne habilitée.
Si nécessaire, l’intégrité des emballages primaires est assurée lors du stockage par un emballage secondaire de protection (sachet plastique, caisse ou bac de protection ou tout autre moyen approprié). Cet emballage peut regrouper un ou plusieurs dispositifs médicaux selon la nature et la destination du dispositif médical. L’emballage secondaire de protection porte un étiquetage adapté.
