Tables
Des Figures
Fig.1:
La prostate [1] 8
Fig.2:
Traitement par radiothérapie externe [11] 11
Fig.3:
Traitement par radiothérapie interne [12] 12
Fig.4:
Pierre Curie [13] 13
Fig.5:
Paul Langevin [14] 13
Fig.6:
William Fry [15] 14
Fig.7:
Principe de la technologie HIFU [19] 15
Fig.8:
Formation de la lésion [20] 15
Fig.9:
Présentation de l’Ablatherm [21] 16
Fig.10:
Module de commande [21] 17
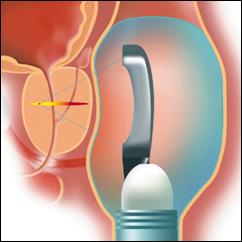
Fig.11:
Module de traitement [21] 17
Fig.12:
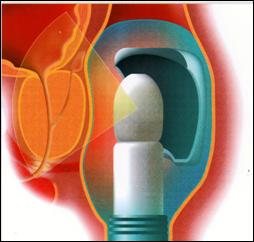
Sonde en position image [23] 19
Fig.13:
Sonde en position tir [23] 19
Fig.14:
Forme d’une lésion réalisée par les ultrasons
focalisés [21] 20
Fig.15:
L’absorption acoustique des ultrasons [22] 20
Fig.16:
Transducteur de la sonde à imagerie intégrée [24] 21
Fig.17:
Déplacement de la sonde à imagerie intégrée
[25] 21
Fig.18:
Ajustement de la sonde à imagerie intégrée [25] 22
Fig.19:
Les sous ensembles de la sonde à imagerie intégrée
[24] 23
Fig.20:
L’ensemble Ablapak [25] 25
Fig.21:
Fonctionnement du Mode A durant le traitement [28] 26
Fig.22:
Traitement dans un bloc opératoire [30] 28
Fig.23:
Repérage échographique [29] 28
Fig.24:
Formation des lésions par balayage [31] 29
Fig.25:
Visualisation des tirs [29] 29
Fig.26:
Répartition de la population de l’étude européenne
[33] 30
Fig.27:
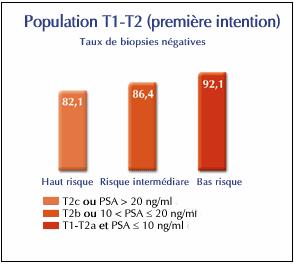
Pourcentage des biopsies négatives [33] 31
Fig.28:
Stabilité du taux du PSA après un suivi de 22 mois [34] 31
Fig.29:
Stabilité du taux de biopsies négatives [34] 32
Fig.30: Sonde Sonoblate 500 [37] 37
Fig.31:
Sonoblate 500 [37] 37
Fig.32:
Traitement par voie externe de la tumeur [38] 37
Fig.33:
ExAblate 2000 [39] 38
Fig.34:
Le Système FUS De Haifu [40] 38
Introduction
Retour Sommaire
Le cancer de la
prostate
représente le premier cancer de l’homme en France devant le
cancer des poumons.
Il est le plus répandu chez les hommes âgés entre
60 et 90 ans. Les ultrasons
sont fréquemment utilisés dans le domaine médical
pour fragmenter les calculs
des voies urinaires. Depuis 1993, les médecins ont de plus en
plus recours à la
technologie HIFU pour traiter le cancer de la prostate. La machine
Ablatherm
utilise la technologie des ultrasons focalisés pour brûler
la prostate.
L’objectif de cette
étude est
d’expliquer la technologie des ultrasons focalisés à
haute intensité de la
théorie à la pratique, tout en développant la
prise en charge et le suivi des
patients, son coût ainsi que les résultats cliniques et
leurs complications.
En premier lieu, un
rappel
d’anatomie et de physiopathologie de la prostate est
évoqué. Cette partie
permet de comprendre pour quels stades du cancer, le traitement par
Ablatherm
est efficace.
En deuxième
lieu, l’équipement Ablatherm
sera décrit dans son ensemble ainsi que les sondes qui
constituent la
composante clé de cette machine. De plus, l’environnement de la
sonde vis-à-vis
de la sécurité du patient sera élaboré dans
cette partie.
Les étapes du
traitement et le
suivi du patient ainsi que les résultats cliniques et leurs
complications seront
expliquées en troisième lieu.
Enfin, la
dernière partie donnera
une idée précise des normes appliquées sur
l’Ablatherm, de son aspect
économique et financier et de ses principaux concurrents.
I.
Cancer
de la Prostate
Retour Sommaire
Un bref rappel d’anatomie du cancer de la prostate
ainsi que
les différentes méthodes de diagnostic et de traitement
sont expliqués dans
cette partie.
I.1.
La
Prostate
La prostate est une glande de la
grosseur d'une châtaigne qui produit une partie du liquide qui
transporte le
sperme (cf. fig.1).
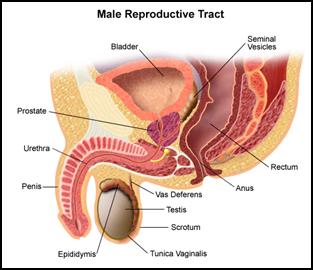
Fig.1: La prostate [1]
La prostate est un organe situé
dans le pelvis, sous la vessie, à grand axe oblique et en avant.
Il existe 4
zones prostatiques : une zone périphérique,
postéro-latérale, entourant en haut
la zone centrale et s’étendant jusqu’à l’apex ; une zone
centrale conique,
située en arrière de l’urètre proximal ; une zone
de transition constituée de 2
lobes bordant les faces postéro-latérales de
l’urètre proximal et entourée par
les zones centrales et périphériques. Cette division
anatomique n’est pas
totalement visualisée en imagerie. Au fur et à mesure que
l'homme vieillit, la
prostate grossit. Si elle devient assez grosse, elle peut exercer une
pression
sur l'urètre, tube qui transporte l'urine provenant de la vessie
[2].
Le cancer de la
prostate est le
cancer le plus fréquent chez l'homme. En France, c'est la
deuxième cause de
décès due à un cancer. Il a été
observé chez 15 à 30% des hommes âgés de 50
ans
et chez 60 à 70% des hommes âgés de 80 ans. Un
homme sur dix est atteint par
cette maladie [3].
Ce type de cancer a
une
croissance très lente, une tumeur double sa taille en 400 jours
environ.
D'autres types de cancer évoluent beaucoup plus rapidement.
Le cancer de la
prostate peut
s'étendre principalement à deux parties du corps, les
nœuds lymphatiques drainant
la prostate, puis les os et habituellement la colonne
vertébrales et les côtes.
Il existe trois
groupes de
cancers de la prostate : cliniquement localisé, localement
avancé et
métastasé [4] [5].
|
Cliniquement localisé
|
Localement avancé
|
Métastasé
|
|
T1 :
non palpable
|
T1a :<
5% des copeaux de résection
T1b :
> 5% des copeaux résection
T1c :
biopsie
|
N0 :
absence de métastase ganglionnaire
|
M0 :
absence de métastase à distance.
|
|
T2 :
palpable limité à la prostate
|
T2a :
atteinte d’un lobe < 50%
T2b :
atteinte d’un lobe > 50%
T2c :
atteinte des deux lobes
|
N1 :
atteinte ganglionnaire régionale.
|
M1 :
métastase à distance.
|
|
T3 :
extension au delà de la capsule
|
T3a :
extracapsulaire
T3b :
vésicules sémilaires.
|
-
|
-
|
|
T4 :
extension aux organes adjacents ou tumeur fixé
|
-
|
-
|
-
|
Tableau 1: Les
groupes du cancer de la prostate
A un stade
très avancé, le cancer
peut continuer à s'étendre au foie, aux poumons et
à la peau.
I.3.
Symptômes et diagnostics du cancer de
la prostate
A un stade
précoce, le cancer de
la prostate ne produit aucun symptôme, cependant la tumeur
grossit.
Les symptômes
pouvant apparaître
sont les suivants [6] [3]:
Ø
Difficulté à uriner
Ø
Besoin d'uriner fréquemment,
en particulier la
nuit
Ø
Douleurs fréquentes dans le
bas du dos, les
hanches et le haut des cuisses
Ils n'indiquent pas
nécessairement un cancer car ils sont aussi les indicateurs
d'autres problèmes
de la prostate. Mais, s'ils existent, il faut consulter
impérativement un
médecin.
Il est
conseillé aux hommes âgés
de plus de 50 ans de subir un examen de contrôle une fois par an,
surtout s'il
existe des antécédents familiaux de cancer de la prostate
ou du sein.
Le diagnostic du
cancer de la
prostate se fait de différentes façons. Les plus
courantes sont [7] [8]:
- L'examen du
toucher rectal :
Le médecin
vérifie que la
prostate ne présente pas de nodules ou
d'irrégularités. Pour détecter une
tumeur par ce moyen, il faut que la tumeur ait une taille suffisamment
importante.
- Echographie
endorectale de la prostate et biopsies
L'échographie
utilise des
ultrasons pour produire une image de la prostate, ces ultrasons sont
produits
par une sonde introduite dans l'anus.
Il s'agit d'un test
sanguin qui
mesure une substance produite par la prostate appelée
antigène prostatique
spécifique. Cette molécule est un marqueur de
l’activité de la prostate. Le
taux de PSA dans le sang est exprimé en nanogrammes par
millilitres et il est
considéré comme normal si le taux est inférieur
à 4 ng/ml. Plus le taux de PSA
est élevé en cas du cancer de la prostate, plus le risque
d'une extension à
distance est élevé. Cela signifie habituellement une
diminution des chances de
guérison ou de survie à long terme.
La biopsie est en
fait le seul
test permettant d'identifier clairement un cancer de la prostate. Elle
consiste
à prélever un échantillon de tissu prostatique
grâce à une aiguille traversant
la paroi rectale.
S'il existe une
tumeur, l'analyse
de cet échantillon permettra de déterminer si elle est
maligne et le stade d’avancement
du cancer.
La biopsie se fait
sous contrôle
échographique.
I.4.
Les traitements
Les
traitements à visée curative
sont habituellement envisagés seulement si le cancer est
localisé c'est-à-dire
les stades T1 ou T2 avec N0 et M0 (cf. tableau 1).
Les traitements ou
suivis des
patients les plus répandus sont la surveillance, la chirurgie et
la
radiothérapie. Une thérapie par hormones ou une
chimiothérapie pouvant venir
s'ajouter au traitement utilisé [9] [4] [5] [10].
I.4.1.
L'attente sous surveillance
Dans certains cas, il est
préférable de ne rien faire mais simplement surveiller la
progression du cancer
dans le cas des stades T1 et T2 (cf. tableau 1). Cette surveillance est
appliquée lorsque :
Ø
Le patient est âgé, un
traitement agressif ne
lui serait pas bénéfique mais plutôt néfaste.
Ø
Le cancer est à un stade
précoce, les symptômes
ne sont pas évidents.
Ø
Le patient à d'autres
problèmes de santé, un
traitement agressif pourrait les aggraver.
I.4.2.
La chirurgie
La chirurgie dans le cas du
cancer de la prostate signifie l'ablation complète de la
prostate. Elle est
habituellement appliquée aux patients les plus jeunes dont les
tumeurs sont
encore à un stade précoce. Mais ce traitement a des
conséquences importantes.
La prostatectomie
radicale est
donc un procédé chirurgical qui consiste à enlever
toute la glande prostatique,
les vésicules séminales et une partie de l'urètre.
Elle peut
entraîner une
impuissance et une incontinence dont le degré de gravité
varie d'un patient à
l'autre.
I.4.3.
La radiothérapie
Ce
traitement agressif utilise
les rayons X ou g
pour détruire les cellules cancéreuses. Les rayonnements
sont aussi utilisés
pour soulager les douleurs du patient lorsque le cancer de stade T1, T2
ou T3
et N0, M0 (cf. tableau 1) s'est étendu aux os ou simplement pour
réduire les
tumeurs les plus avancées.
Il existe deux types
de
radiothérapie, les radiothérapies externes et internes.
- La
radiothérapie externe :
Ce traitement
consiste à
focaliser un faisceau de rayons X ou g sur la tumeur pendant 3
minutes tous les jours. Les périodes de ce traitement peuvent
varier de six à
sept semaines.
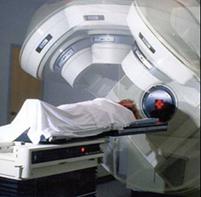
Fig.2: Traitement par
radiothérapie externe [11]
La
radiothérapie externe est
indolore mais elle entraîne les mêmes conséquences
que la chirurgie avec en
plus, des diarrhées et éventuellement des inflammations
temporaires du rectum
et de la vessie.
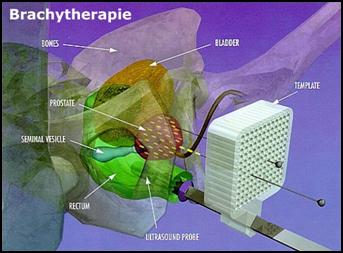
- La
radiothérapie interne ou brachythérapie :
Cette méthode
consiste à
implanter directement dans la prostate des implants radioactifs qui ont
la
taille et la forme d'un grain de riz.
Fig.3: Traitement par
radiothérapie interne [12]
Ils émettent
des rayonnements
pendant plusieurs mois et ne créent aucun inconfort. Bien que la
brachythérapie
soit considérée comme le traitement le plus
bénéfique car elle entraîne peu
d'effets secondaires, les problèmes d'impuissance et les
difficultés à uriner
sont toujours présents.
I.4.4.
Le
traitement hormonal
Le but du traitement
hormonal est
de s'opposer à l'action des hormones mâles qui stimulent
la prostate. Ainsi, la
diminution du taux de testostérone, principale hormone
masculine, bloque la
prolifération des cellules cancéreuses et diminue le
volume de la prostate. Le
traitement hormonal n'a qu'un effet transitoire, il bloque la
prolifération du
cancer sans le guérir.
I.4.5.
La
chimiothérapie
La
chimiothérapie est utilisée
pour le cancer de la prostate quand celui-ci a évolué
avec une extension extra
prostatique et qu'il ne répond plus au traitement hormonal. La
chimiothérapie
diminue la croissance tumorale et peut diminuer les douleurs
liées au cancer.
Un nouveau
traitement, toujours
considéré comme expérimental, est la
cryothérapie.
De l'azote liquide
est injecté à travers
le périnée, dans la prostate. Dès que les cellules
sont mortes, elles sont
absorbées et éliminées par l'organisme. Une courte
hospitalisation est
nécessaire pour effectuer le traitement. Cette méthode
paraît efficace mais des
études doivent encore être effectuées pour mieux
connaître les résultats à long
terme. 80% des hommes traités deviendraient impuissants et des
irritations de
la vessie et du rectum apparaîtraient.
Tous les traitements présentés
précédemment sont certes efficaces et permettent la
guérison de cancers
détectés assez tôt. Cependant, ils sont agressifs
et causent beaucoup de dégâts
irrémédiables. Des nouvelles techniques
thérapeutiques non invasive
utilisent des ondes ultrasonores focalisées, c’est l’Ablatherm
qui sera
développé en détails dans les chapitres suivants.
II.
La
Technologie HIFU
La technologie HIFU
est basée sur
les Ultrasons Focalisés de Haute Intensité. Cette partie
décrira l’historique
depuis la découverte de la piézoélectricité
jusqu'à l’application de la
technologie HIFU.
II.1.
Historique
En 1880 Pierre Curie
travaille
avec son frère Jacques qui prépare une thèse au
laboratoire de minéralogie au
laboratoire de Charles Friedel à la Sorbonne. Ils
découvrent la
piézoélectricité, propriété du
quartz de développer une polarisation électrique
sous l’effet d’une pression mécanique.

Fig.4: Pierre Curie [13]
Le
développement des ultrasons
commença réellement avec les travaux de Paul Langevin,
qui utilisa, au début du
XXème siècle, les propriétés
piézo-électriques du cristal de quartz pour
construire le premier sonar sous marin. Il fut également le
premier à constater
lors d’une expérience que la main placée dans un faisceau
d’ultrasons d’un Kilowatts,
subissait une vive douleur semblable à une brûlure.
Fig.5: Paul Langevin [14]
Il faudra attendre
les années 50,
pour que les frères Fry, Francis et William, imagine la
première application
médicale des ondes ultrasonores. Leurs travaux portaient sur le
traitement par
voie externe de troubles neurologiques, et notamment pour la maladie de
parkinson.
En utilisant un jeu
de
transducteurs d’ultrasons qu’ils dirigèrent sur la zone à
traiter, ils
s’aperçurent de l’apparition de minuscules lésions
biologiques localisées en
profondeur dans le cortex cérébral.
Néanmoins,
l’absence d’un dispositif
de visualisation suffisamment performant et précis interrompit
le développement
de ce type de thérapies.
Fig.6: William Fry [15]
Dans les
années 80, Lizzi, grâce
à une technologie plus avancée, créa un dispositif
pour le traitement du
glaucome et des tumeurs intraoculaires. Cette possibilité fut
rapidement
remplacée par le laser.
A la fin des
années 80, l’INSERM,
les Hospices civil de Lyon et Edap Technomed, initièrent un
programme de
recherche sur l’interaction des Ultrasons Focalisés de Haute
Intensité sur les
tissus.
L’objectif principal
de leurs
travaux était le développement d’applications pour
traiter les tumeurs
malignes. C’est ainsi que naquit le prototype de l’Ablatherm.
II.2.
Ultrason
et effet piézo-électrique
Les ultrasons et
l’effet piézo-électricité
sont définis dans le paragraphe suivant.
II.2.1.
L’ultrason
A la
différence de la lumière qui
est une onde électromagnétique, le son est une onde
mécanique qui nécessite un
support matériel de propagation.
Les
ultrasons sont des vibrations
mécaniques de la matière et possèdent des
fréquences supérieures à 20 000 Hz
inaudibles par l'oreille humaine. Ils se propagent à une vitesse
qui sera
fonction de la nature du milieu, indépendamment de la
fréquence de l'onde. Dans
l'organisme humain par exemple, les ultrasons vont se propager à
une vitesse
proche de 1500 m/s selon la nature des organes qu'ils traversent [16].
Dans la pratique,
l’effet
piézo-électrique est utilisé pour
générer des ondes ultrasonores.
II.2.2.
L’effet
piézo-électrique
Retour Sommaire
Le principe de
l’effet piézoélectrique
est basé sur les propriétés de certains
matériaux, comme les cristaux de
quartz. Ces derniers peuvent se charger lorsqu'ils sont
comprimés et se
comprimer lorsqu'ils sont chargés.
En appliquant un
courant
alternatif sur un cristal piézoélectrique, il se comprime
et se décomprime
alternativement en émettant un son. Grâce à une
impulsion électrique utilisée,
ce cristal entre en résonance et émet des ultrasons
à des fréquences qui
dépendent de l’épaisseur de ce dernier [17].
II.3.
Principe
de la technologie HIFU
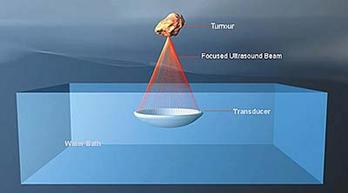
La technologie HIFU
utilise un
faisceau d’ultrasons convergeant de haute intensité. Elle se
repose sur
l'absorption acoustique des ultrasons par les tissus du corps humain.
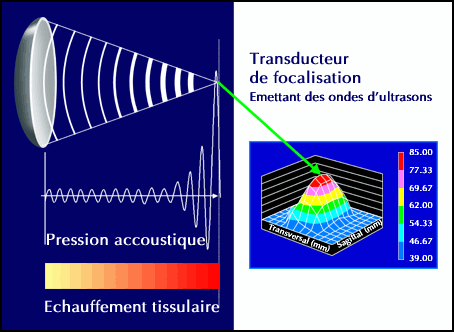
L’émission d’ondes ultrasonores est basée sur la
vibration d’un transducteur
qui produit des variations de la pression acoustique. Cette
dernière génère la
contraction et la dilatation tissulaire dont l’amplitude est
directement liée
au niveau de pression. Comme la réponse du tissu n’est pas
parfaitement
élastique, l’énergie perdue est convertie en chaleur [18].
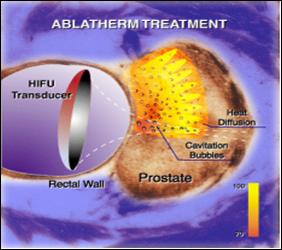
Fig.7: Principe de
la technologie HIFU [19]
Lorsqu’un
transducteur sphérique
est utilisé, le courant d’ultrasons se concentre sur le point
focal du
transducteur. Ceci conduit à une concentration maximale de la
pression sur ce
point. Comme l’échauffement du tissu est directement lié
au maximum de
pression, la nécrose se produit au point focal du transducteur.
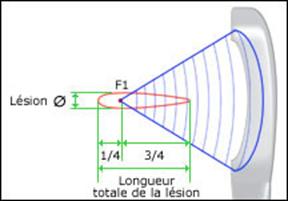
Fig.8: Formation de la
lésion [20]
La température
du tissu augmente
dans la zone focale, provoquant une nécrose. La lésion
s’étend
approximativement à 3/4 devant le foyer du transducteur et
à 1/4 derrière. La
hauteur de la lésion est fonction de la durée de
l’exposition. La lésion
commence dans le foyer du transducteur et progresse vers le
transducteur
pendant l’exposition.
III.
La
Machine Ablatherm
Les deux modules de
l’équipement Ablatherm
seront décrits par la suite ainsi que les sondes de
thérapie et leur
environnement.
III.1.
Description
générale
En 2000, le groupe
EDAP TECHNOMED
a mis sur le marché : l'Ablatherm. Cet
équipement est conçu pour traiter les tumeurs malignes au
niveau de la prostate
par voie endorectale en utilisant les Ultrasons Focalisés
à Haute Intensité.
Les ultrasons
focalisés
permettent, par une combinaison d'effets mécaniques et
thermiques, d'obtenir
une nécrose de la tumeur visée, sans endommager les
tissus traversés. C'est
donc une technologie non invasive qui devrait permettre un traitement
ambulatoire
et sans effet secondaire. [21]
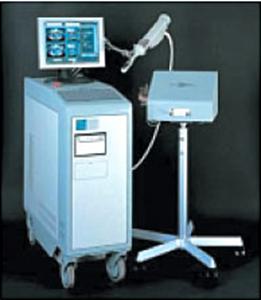
Fig.9:
Présentation de l’Ablatherm [21]
Cette machine est
constituée de
deux éléments :
- un module de
traitement
- un module de
commande
Il est commun à l’ensemble des produits intégrés
à la plate forme urologique.
Il permet à l’opérateur de piloter à distance les
différents traitements.
Fig.10: Module de commande
[21]
Il est composé
d’un PC qui reçoit
les images de la sonde échographique introduite dans le rectum
du patient. Le
médecin dispose d’une vue 3D de la prostate puisqu’il peut faire
appel à une
image transversale et longitudinale. Dans la vue longitudinale il va
indiquer
les deux extrémités de la prostate : apex et
« bladder neck ».
Ceci permettra à l’ordinateur de diviser la prostate en tranches
de 2mm
d’épaisseur. Dans la vue transversale, il va reprendre chacune
de ces tranches
et faire apparaître les zones à nécroser. En effet,
la chaleur part du point
focal de la sonde et se disperse en formant une lésion de 16mm
à 20mm de haut
et de 2mm de diamètre. Les volumes de tissus à
nécroser peuvent être aussi
définis.
C’est
également à partir du
module de commande que les différents paramètres de tir
sont gérés tels que: la
durée, la puissance acoustique [21].
- Le
module de traitement :
Le module de
traitement assure
les fonctions de support et de maintien du patient pendant le
traitement. Il
reçoit des différents équipements
électrotechniques nécessaires au contrôle du
traitement. Il comprend :
Retour Sommaire
Fig.11: Module de
traitement [21]
-
toute la partie mécanique de mise en
position de la
sonde,
-
le système de puissance telle que
l’amplificateur, le
générateur de fréquence et le wattmètre,
-
l’alimentation tels que le transformateur,
l’alimentation 24V,
-
un ordinateur «esclave »
du module de commande
-
une carte mode A qui mesure la distance
entre le
transducteur et la paroi rectale.
Son rôle est de
guider
convenablement la sonde, lésions après lésions et
tranches par tranches, afin
que les ondes focalisent sur les points que le médecin a
déterminés sur le
module de commande.
Les sondes
endorectales de la
machine Ablatherm seront décrites par la suite. En effet, elles
sont considérées
comme l’élément critique de l’équipement
puisqu’elles assurent la production
des ultrasons par leur transducteur de thérapie. [21]
III.2.
Les
sondes Ablatherm
Il existe deux types
de sondes
pour l’Ablatherm. Les anciennes sondes nommées sondes Maxis et
les nouvelles
appelées sondes à imagerie intégrée.
III.2.1.
Les sondes Maxis
Les sondes Maxis comportent un
transducteur de thérapie et une sonde échographique. Le
transducteur permet de
générer un faisceau ultrasonore focalisé de forte
intensité pour tuer les
cellules cancéreuses. La sonde échographique permet la
localisation de la
prostate. [22]
Principe
La technique consiste
à faire
converger des ondes acoustiques hautes fréquences de 3Mhz au
point focal. Ce
dernier est situé à 40 mm du transducteur de
thérapie dans le cas des sondes
Maxis. La variation de pression au point focal entraînera une
vibration des
structures moléculaires. Par conséquent, il y aura une
augmentation de la
température du tissu prostatique. Les cellules
cancéreuses portées à une
température d’environ 80°C se nécrosent et
disparaissent par voies naturelles.
[22]
Fonctionnement
La sonde est
positionnée dans le
patient par voie rectale. Ensuite, le médecin cherche à
visualiser la prostate.
Pour cela, la sonde échographique sort de son logement en
émettant des
ultrasons par son transducteur mono élément (cf. fig.
12). [22]
Fig.12: Sonde en
position image [23]
Une fois que la
prostate est
visualisée, la sonde échographique se retire et le
transducteur effectue une
rotation de 90º (cf. fig.13) et émet des tirs d’ultrasons
focalisés. Les tirs
sont émis de façon discontinue afin d’éviter
l’échauffement du transducteur et
de brûler la prostate. Le temps d’émission dure cinq
secondes. Cette durée est
le temps nécessaire pour que le tissu atteigne la
température 80°C. [22]
Fig.13: Sonde en position
tir [23]
Retour Sommaire
Ces ultrasons
focalisés forment
une lésion (cf. figure 14) dans la prostate de 22 mm de longueur
et de 2 mm de
diamètre.
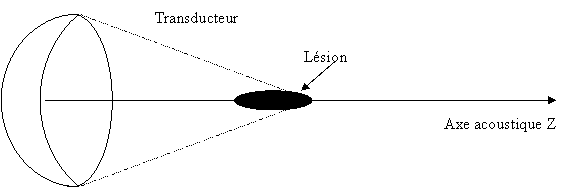
Fig.14: Forme
d’une lésion réalisée par les
ultrasons focalisés [21]
Le transducteur
ultrasonore se
présente sous la forme d'un élément en forme de
calotte sphérique. Il est
composé d'un matériau piézo-électrique de
puissance. Le transducteur est soumis
à une excitation sinusoïdale de fréquence 2,5 ± 0,5
Mhz. L’énergie
électrique requise par le transducteur se transforme en
énergie acoustique. Il
doit pouvoir délivrer une puissance acoustique supérieure
à 50 W, puissance
efficace pour le traitement. [21]
L’empreinte focale
est petite par
rapport au volume de la prostate. Pour pouvoir traiter toute la cible,
le
transducteur se déplace. C’est dans ce but qu’intervient la focalisation dynamique. Elle permet en
changeant le point focal de la sonde de traiter plus en avant ou plus
en profondeur.
De plus, le transducteur de thérapie peut pivoter afin de
balayer l’ensemble de
la prostate. [22]
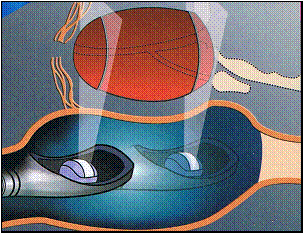
Fig.15: L’absorption
acoustique des ultrasons [22]
La figure précédente (cf. figure
15)
montre l’action de l’absorption acoustique des ultrasons. En effet,
Lors de
l’absorption acoustique des petites cavitations en forme de bulles
d’air se
produisent. La cavitation avec l’absorption cellulaire provoquent un
échauffement du tissu et ainsi sa destruction. Ce traitement
n’endommage pas
les tissus traversés tel que le rectum.
III.2.2.
Les sondes à imagerie
intégrée
La nouvelle version
de la sonde
endorectale appelée sonde à imagerie
intégrée fonctionne de la même façon que
les sondes Maxis. Par contre, elle permet grâce à la
cellule imagerie située au
centre du transducteur (cf. figure 16) de visualiser la prostate en
temps réel.
[24]
Fig.16: Transducteur de
la sonde à imagerie intégrée
[24]
La cellule imagerie
donne une
image 2D de la prostate lors du traitement des cellules
cancéreuses. Elle est
composée de 128 éléments
piézo-électriques pilotés électroniquement.
Le
balayage de ces éléments le long de la cellule imagerie
permet la construction
2D de l’image sur l’écran de l’échographe. [24]
Fig.17:
Déplacement de la sonde à imagerie intégrée
[25]
En pratique, la sonde
peut se
déplacer suivant les trois axes X, Y et Z (cf. figure 17). La
cellule imagerie
scanne toute la hauteur prostatique à l’aide du mouvement
longitudinal X. [24]
Fig.18: Ajustement de la
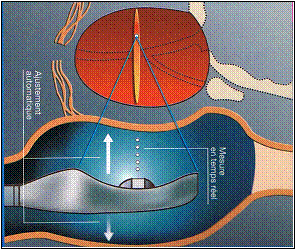
sonde à imagerie intégrée [25]
Une mesure en temps
réel de la
distance transducteur paroi rectale associé à un
réajustement automatique de la
position de la position du point focal permet un positionnement
sûr et précis
du transducteur.
Retour
Sommaire
En ce qui concerne le
transducteur de thérapie, ses caractéristiques sont
identiques à celles du
transducteur de la sonde Maxis. La seule différence est dans la
distance focale
qui est de 45 mm au lieu de 40 mm pour les sondes Maxis. Le
transducteur de
thérapie et la cellule imagerie sont deux éléments
indissociables. [24]
Description de la sonde à imagerie intégrée
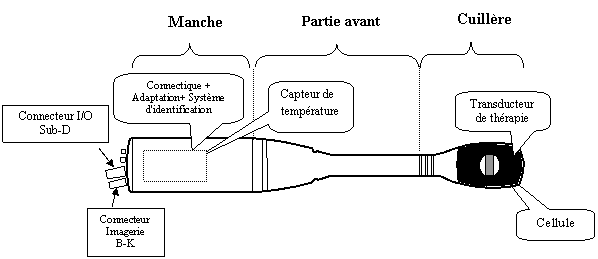
Fig.19: Les sous
ensembles de la sonde à
imagerie intégrée [24]
La sonde à imagerie intégrée
est composée de six principaux
sous ensembles :
§
Le transducteur de thérapie
§
La cellule imagerie.
§
Le capteur de température PT
100 situé dans la
partie manche de la sonde donne la température interne de la
sonde.
§
La partie électronique est
composée de la carte
d’identification, la carte d’adaptation et les connecteurs. La carte
d’identification stocke les paramètres de la sonde. Tandis que
la carte
d’adaptation sert à adapter l’impédance de sortie du
transducteur à 50 Ohms.
§
La partie mécanique est
constituée du châssis
interne, la partie avant cuillère et le manche qui sont en Inox.
§
L’ensemble hydraulique est
composé des
connecteurs qui assure la circulation de l’ablasonic dans la sonde. Ce
dernier
est un liquide utilisé lors du traitement pour refroidir le
transducteur de
thérapie. [24]
Il est important de
comparer les
deux sondes afin de synthétiser la différence entre elles.
III.2.3.
Comparaison entre les deux sondes
Le tableau suivant résume les
différences entre les sondes
Maxis et les sondes à imagerie intégrée [22] [24].
|
Caractéristiques
|
Sonde Maxis
|
Sonde à imagerie
intégrée
|
|
Distance
focale
|
40
mm
|
45
mm
|
|
Transducteur
de thérapie
|
Mono
élément piézoélectrique
|
Mono
élément piézoélectrique
|
|
Mode
imagerie
|
- Sonde échographique
- Visualisation par basculement tir/image
|
- Cellule imagerie
- Visualisation en temps réel
|
|
Puissance
acoustique
|
Puissance
|
Moins
de 10 % de la puissance de la sonde Maxis
|
|
Identification de la sonde
|
Identification
par numéro gravé sur de châssis. Aucune
mémorisation dans la sonde
|
Identification
de la sonde et mémorisation du nombre de tirs effectués
|
|
Réglage de l’écart entre la position du point
focal du transducteur et celle de l’image
échographique
|
Réglage
manuel lors du contrôle de la sonde
|
Compensation
par le software de la machine Ablatherm
|
Tableau 2 :
Comparaison entre la sonde Maxis et
la sonde à imagerie intégrée
Ces deux types de
sondes sont
contrôlés et calibrées avec un banc de test afin de
vérifier leur bon
fonctionnement [26] (cf. Annexes 1).
III.3.
Environnement
de la sonde
Plusieurs mesures de
sécurité
entourent la sonde ABLATERM afin d’assurer son bon fonctionnement et
surtout la
sécurité du patient.
III.3.1.
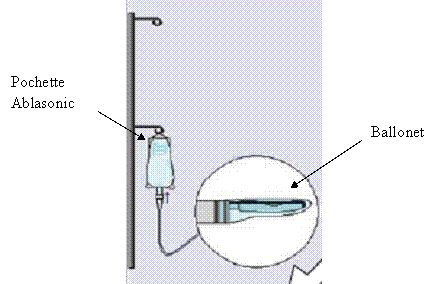
L’Ablapak
L’ensemble Ablapak
est constitué
d’un ballonnet, d’une ligature et d’une pochette appelée
l’Ablasonic. Cet
ensemble est à usage unique, et ne doit être
réutilisé sous aucune
circonstance. Le principal rôle de l’Ablapak est de refroidir la
paroi rectale
et le transducteur de thérapie lors du traitement. En effet, le
gonflement du
ballonnet va éliminer la présence d’air entre la paroi
rectale et le ballonnet.
Ceci est très important lors du traitement afin d’assurer la
transmission
totale des ultrasons vers la prostate [24].
Fig.20: L’ensemble Ablapak
[25]
Le liquide Ablasonic
est refroidi
par effet Peltier puis renvoyé vers la sonde afin d’absorber la
chaleur.
Ensuite, l’Ablasonic chaud est aspiré par une pompe afin de le
refroidir. C’est
un cycle continu tout au long du traitement.
Le ballonnet doit
être rempli avec
150 ou 200 ml de liquide Ablasonic fourni dans l’ensemble Ablapak. La
ligature
permet la fermeture du ballonnet pour empêcher la sortie du
liquide Ablasonic. Le
ballonnet livré avec l’Ablapak contient du Latex c’est à
dire du caoutchouc
naturel. Il faut savoir que des réactions allergiques graves aux
matériaux
contenant du Latex ont été signalées. Il est
conseillé aux professionnels des
soins de santé d’identifier les patients allergiques au latex
et, si
l’indication de traitement Ablatherm est maintenue, d’être
prêts à traiter
rapidement les éventuelles réactions allergiques. [25]
Il est
impératif aussi de
contrôler, au moment de la définition de la position de la
paroi rectale, qu’il
y a un bon contact entre le ballonnet et la paroi rectal. Si le
ballonnet n’est
pas en contact avec le rectum, il est impératif d’interrompre la
localisation
et le traitement.
Un des risques
majeurs d'un
traitement Ablatherm est la destruction de la paroi rectale suite
à un défaut
de positionnement du point focal du transducteur ce qui peut provoquer
des
fistules et de graves infections.
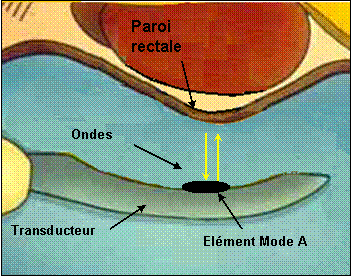
Le mode A est un
élément de
sécurité qui mesure la distance entre la paroi rectale et
le transducteur de
thérapie. En effet, ce mode facilite au médecin le
positionnement optimal du
transducteur de thérapie vis-à-vis de la paroi rectale
afin d’éviter sa
blessure ou sa brûlure [27].
Fig.21:
Fonctionnement du Mode A durant le traitement
[28]
Afin d’éviter
ce risque, il faut
mesurer par échographie Mode A, avant chaque tir, la distance
séparant le
transducteur d'émission ultrasonore de la paroi rectale du
patient. Pour
effectuer une mesure de distance, la carte Mode A envoie un signal
électrique
de faible puissance sur l’élément central du transducteur
de thérapie. Ce
signal excite l’élément piézo-électrique de
la sonde, générant ainsi une onde
ultrasonore. Celle-ci se réfléchit sur la paroi rectale
et revient alors vers
le transducteur. La carte mode A reçoit une impulsion
électrique qui permet de
déterminer le temps aller-retour du signal. L’information que
donne la carte
Mode A est donc la mesure du temps de vol de l’onde ultrasonore [28].
L’unité
centrale convertit
ensuite ce temps de vol, mesuré par échographie, en une
distance en se basant
sur la vitesse de l’onde dans son milieu de propagation. Lorsque la
distance
mesurée est en dehors de l’intervalle situé entre 15 mm
et 25 mm, le logiciel
de thérapie suspend le traitement [28].
III.3.3.
Capteur
de température
Pour mesurer la
température à
l’intérieur de la sonde, un capteur de température PT 100
est positionné dans
la partie Manche (cf. figure 19) de la sonde à imagerie
intégrée.
L’objectif est de
suivre
l’évolution de la température dans la sonde et
d’arrêter le traitement lors d’une
surchauffe ou lors d’une très basse température. [24]
Le capteur Pt 100 est
une sonde
en platine qui délivre une tension en fonction de la
température mesurée. Cette
dernière est enregistrée dans le logiciel puis
affichée en degré centigrade sur
l’écran de l’ordinateur.
La température
à l’intérieur de
la sonde doit être comprise entre 15 et 20 degré, sinon le
traitement sera tout
de suite arrêté.
Chacun de ces trois
contrôles de
sécurité sont associés à des alarmes
gérées par le software de la machine. Toute
alarme déclenchée introduit l’arrêt immédiat
du traitement. [24]
IV.
Les
étapes du traitement
Le traitement par
Ablatherm se
déroule sur trois jours. Le patient est préparé
à l’hospitalisation la veille
du traitement et sortira le lendemain [29].
IV.1.
Préparation
Une
préparation digestive
analogue à celle réalisée pour une coloscopie est
effectuée. Deux heures
environ avant le traitement, un lavement est réalisé pour
une préparation
colorectale.
Depuis mars 2000, il
est réalisé
une résection endoscopique du tissu adénomateux en
début d’anesthésie. Ce geste
associé réduit la durée du sondage
post-opératoire et a quasiment fait
disparaître les phénomènes d’obstruction par
élimination de débris nécrotiques
observé avant cette modification technique [29].
IV.2.
Phases
du traitement
Le traitement
s’effectue sur
plusieurs étapes.
IV.2.1.
Installation
du patient
Le traitement se
déroule dans
l’environnement du bloc opératoire ou à proximité
de ce dernier. Il se déroule
sous une rachi anesthésie par l’administration d’un
tranquillisant afin
d’obtenir l’immobilisation strict du patient. Le traitement par
ultrasons est
ensuite effectué en décubitus latéral droit.
Une stricte
mobilité est
nécessaire pendant le traitement [29].
IV.2.2.
Préparation
de la machine
En parallèle,
le personnel
soignant met en route l’Ablatherm en suivant les instructions
d’installation
suivantes [25] :
- Connecter la sonde
à la machine
- Mettre en place le
ballonnet de protection et remplir ce dernier avec du liquide dont ses
propriétés sont proches de celle de l’eau.
- Saisir les
coordonnées du patient.
Après ces
étapes, l’Ablatherm est
prête pour le traitement.
IV.2.3.
Repérage
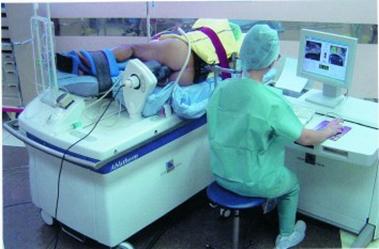
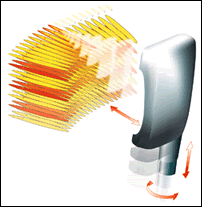
Le chirurgien urologue intervient
généralement durant cette phase. Il introduit le
transducteur de thérapie dans
le rectum.
Fig.22: Traitement dans un
bloc opératoire [30]
La prostate est
visualisée à
l’aide de la sonde échographique de l’Ablatherm. Le chirurgien
repère les
limites de la prostate dans le plan sagittale, et défini sur
l’écran de
contrôle la zone qu’il souhaite traiter.
Le traitement se
déroule environ
entre deux et cinq séquences selon le volume de la prostate.
Fig.23: Repérage
échographique [29]
Pour chaque tranche
de prostate,
l’opérateur défini à l’aide de la souris de
l’ordinateur la zone à traiter en
marquant la limite droite et gauche de la zone ciblée. Les
liaisons programmées
apparaissent sur l’écran de contrôle comme une
rangé d’ellipses [29].
A l’issue de la phase
de repérage
la phase de tir débute. Le logiciel de l’appareil détecte
la paroi rectale et
aligne automatiquement les tirs de la capsule postérieurs de la
prostate en
laissant une marge de sécurité par rapport à la
paroi rectale.
La position de la
sonde, la
puissance d’émission et la température à
l’intérieur de la sonde sont toujours
vérifiées avant chaque tir.
En cas d’anomalies,
le processus
de traitement est interrompu et l’utilisateur peut intervenir.
IV.2.5.
Durée
du traitement
La procédure
de traitement dure
environ 2h30 dont 1h 30 pour la phase de tirs elle-même.
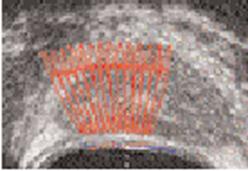
Fig.24: Formation des
lésions par balayage [31]
L’émission
ultrasonore entraîne
un échauffement localisé et une nécrose
irréversible du tissu prostatique.
L’ensemble de la prostate est traité par
répétition et juxtaposition des tirs.
(cf. figure 24)
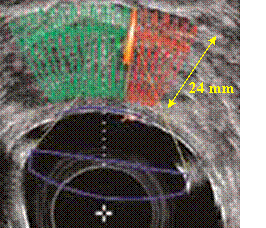
Fig.25: Visualisation des
tirs [29]
La zone
traitée par chaque tir
est de forme ovale et mesure jusqu’à 24 mm de long, pour un
diamètre inférieur
à 2 mm. En répétant les tirs et en
déplaçant le point focal entre chaque tir,
il est possible de détruire un volume comprenant toute la
tumeur. Un traitement
complet nécessite environ entre 400 et 600 tirs.
En fin du traitement,
la sonde
endorectale est retirée. Une sonde de Foley est mise en place et
le patient
peut regagner sa chambre [32].
IV.3.
Suivi
du patient
Les suites du
traitement sont
simples. Le patient peut se déplacer dans les heures qui suivent
le traitement
et reprendre son alimentation. Une antibiothérapie
prophylactique peut être
prescrite pour éviter la survenue d’une infection urinaire.
Il n’est
habituellement pas
nécessaire d’administrer de traitement antalgique ou
anti-inflammatoire, même
dans les suites immédiates du traitement d’Ablatherm. La sonde
de Foley est
généralement retirée 3 à 4 jours
après le traitement et le patient peut
regagner son domicile [29] [32].
V.
Résultats
cliniques et complications
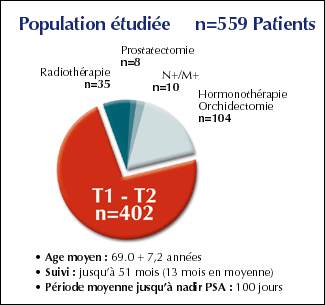
De 1995 à
1999, 559 patients ont
été inclus dans une étude européenne
multicentrique (cf. fig.26). 402 patients
étaient des patients stade T1 ou T2 traités avec
l’Ablatherm en première
intention.
Fig.26:
Répartition de la population de l’étude
européenne [33]
Dans cette population
T1 et T2,
des biopsies négatives ont été observées
chez 87,2% des patients. Au moins 50%
des patients présentaient un taux de PSA inférieur ou
égal à 0,1 après un
traitement complet.
Fig.27: Pourcentage des
biopsies négatives [33]
Retour Sommaire
À noter que
les résultats des
biopsies en fonction du niveau de maladie avec risque initial similaire
montrent que 92.1 % des patients à faible risque
présentèrent des biopsies
négatives au cours de leur suivi.
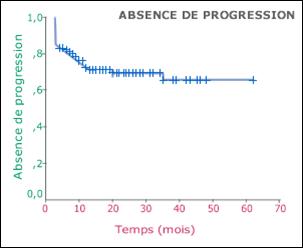
Fig.28:
Stabilité du taux du PSA après un suivi de 22
mois [34]
L'équipe du
Caritas Saint Joseph
en Allemagne rapporte 5 ans d'expérience depuis d'octobre 1997
jusqu’à novembre
2002 avec un série de 146 patients de stade T1 ou T2, N0 et M0,
ayant un PSA
inférieur à 15 ng/ml. Le PSA est de 0,07 ng/ml,
observé 3 mois après
traitement. Après un suivi moyen de 22 mois, le PSA est à
0,15 ng/ml, avec
93,4% des patients présentant des biopsies de contrôle
négatives. Pas
d'incontinence d'effort sévère n'a été
observée. Les érections étaient
préservées pour 47,3% des patients, et l'indice de
qualité de vie ne changeait
pas avant et après le traitement [4] [34].
Les résultats
obtenus montrent
l'efficacité et la faible morbidité associée
à l'HIFU. La technologie HIFU
semble être une option de traitement efficace pour les patients
qui ne sont pas
candidats à la prostatectomie ou qui ne veulent pas subir les
effets
secondaires d'une opération.
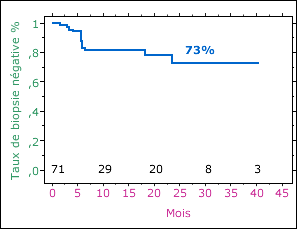
Fig.29:
Stabilité du taux de biopsies négatives [34]
Le professeur Albert
Gelet et
l'équipe du service d'urologie de l'Hôpital Edouard
Herriot à Lyon, ont été les
pionniers du traitement des récidives locales après
radiothérapie. Le récent
article du Docteur Gelet et du Docteur Guy Vallancien publié
dans la revue
Urology décrit une série de 71 patients traités
dans cette indication. Le
résultat local est très satisfaisant avec 80% de biopsies
de contrôle négatives
pour une morbidité acceptable dans cette population et un suivi
à plus de 7 ans
[4].
Les complications
observées dans
les différents hôpitaux européens utilisant
l'Ablatherm sont relativement
homogènes. Ci-dessous vous trouverez un tableau
présentant les principaux
effets secondaires liés au traitement du cancer de la prostate
par Ablatherm.
Il est important de souligner que l'indice mesurant la qualité
de vie des
patients ne varie pas avant et après le traitement [4].
|
|
Mort
|
Complication digestive
|
Infection urinaire
|
Incontinence
|
Impuissance
|
|
Suivi
à 5 ans
|
0%
|
0,7%
|
5,8%
|
5,8%
|
52,7%
|
|
HIFU
|
0%
|
0%
|
11,4%
|
6,9%
|
31,8%
|
Tableau
3 : Les principaux effets secondaires du
traitement Ablatherm
Les complications
digestives avec
le traitement Ablatherm sont représentées par le risque
de brûler le rectum. Ce
risque concerne principalement les patients qui ont été
soumis à des
traitements locaux répétés, et dont le rectum a
été fragilisé.
Presque tous les cas
d'incontinence sont légers. L'incontinence peut être
traitée généralement avec
des médicaments et/ou entraînement musculaire, et dure en
moyenne un mois [4].
Lorsqu'un cancer est
localisé de
stade T2a ou T2b dans un seul des lobes de la prostate, le risque
d'impuissance
est réduit après le traitement en se limitant à la
région de la prostate
affectée par la tumeur. Dans ce cas, une deuxième
séance de traitement est plus
fréquemment nécessaire qu'après un traitement
complet.
VI.
Normes
Plusieurs normes sont
appliquées
à la machine Ablatherm, le tableau suivant reprend toutes les
normes ainsi que
leur domaine d’application [35] [36].
|
Normes
|
Domaines d’application
|
|
IEC 601-1 1998
|
Equipement électrique – chap. 1-
conditions générales sur la sécurité
|
|
IEC 60601-1-1 2000
|
Chap.1-1 : conditions
générales sur la sûreté électrique de
l’équipement médical
|
|
IEC 60601-1-2 2001
|
Chap.1-2 : Compatibilité
électromagnétique, tests et conditions
|
|
IEC 60601-1-4- 2000
|
Chap.1-2 : conditions
générales sur la sécurité de la
programmation électrique de l’équipement médical
|
|
IEC 60601-2-37- 2004
|
Chap.2-37 : conditions
générales sur la sécurité du diagnostic
médical par ultrasons et le monitorage.
|
|
ISO 14971 : 2000
+ A1 : 2003
|
Equipements médicaux- management du
risque.
|
|
ISO 10993- 1 : 2003
|
Evaluation biologique des équipements
médicaux –chap.1 : test et évaluation
|
|
ISO 10993- 5 : 1999
|
Evaluation biologique des équipements
médicaux –chap.5 : test in vitro
|
|
ISO 10993- 10 : 2003
|
Evaluation biologique des équipements
médicaux –chap.1 : test
|
|
EN 540 : 1993
|
Investigation clinique des
équipements médicaux sur des sujets humains
|
|
ISO 14155-1 :2003
|
Investigation clinique des
équipements médicaux sur des sujets humains –
chap.1 : conditions générales
|
|
ISO 14155-2 :2003
|
Investigation clinique des
équipements médicaux sur des sujets humains –
chap.2 : plans cliniques d’investigation.
|
|
EN 980 : 2003
|
Symboles graphiques utilisés sur
l’équipement médical.
|
|
IEC 60905-1 :2001
|
Information technologique sur la
sécurité de l’équipement- conditions
générales.
|
|
IEC 61508- 1 à 7
|
Sécurité fonctionnelle du
système électrique, électronique et
l’électronique programmable.
|
|
IEC 61157- 1992
|
Conditions pour la déclaration du
rendement acoustique de l’équipement utilisant les ultrasons.
|
Tableau 4 :
Liste des normes appliquées à l’Ablatherm
A noter que selon la réglementation
européenne, l’Ablatherm
est classé en IIb.
Après avoir
étudié les résultats
cliniques et les normes de l’Ablatherm, il est nécessaire de
connaître ses
aspects économiques financiers. Cette partie va traiter les
coûts de traitement
du cancer de la prostate et celles des autres modalités
thérapeutique.
VII.Aspects
économique et financier
Le coût de la machine Ablatherm ainsi que le coût du
traitement comparé à d’autres modalités
thérapeutiques sont expliqués dans ce
paragraphe [4].
Retour Sommaire
VII.1.
Le
coût de l’Ablatherm
Le prix de
marché du système fixe
est de 500 000 €, le coût de la maintenance est de 42 000 € par
an et celui du Kit
Ablapak consommable est de 500 € par traitement.
L’acquisition d’un
système
mobile, qui pourrait être partagé entre plusieurs
hôpitaux ou cliniques,
engendre un surcoût par rapport au système fixe [4]:
Ø
Surcoût en termes
d’investissement de l’ordre de
15 %
Ø
Surcoût en termes de contrat
de maintenance
annuelle de plus de 55 %.
Ø
Coût de transport incluant le
déplacement,
l’installation du matériel et l’assistance technique sont
estimés à 6 200 € par
déplacement et par semaine.
VII.2.
Le
coût du traitement
En
général, le coût du traitement
n’est pas fixe dans tous les hôpitaux et les cliniques. La
tarification dans
les hôpitaux de Caen, de Lyon et de Marseille sera
évoquée par la suite.
Le coût du traitement à Caen
Le coût moyen
du séjour pour un
patient hospitalisé par ce traitement a été
estimé à 4 720 €. Ce coût prend en
compte les phases pré- opératoires, opératoires et
post- opératoires sur une
durée moyenne de quatre jours.
Le coût total
du traitement est
réparti en quatre proportions. Plus de 32 % pour l’Ablatherm et
sa maintenance,
30 % pour la phase opératoire, 20 % pour le service de
restauration et
logistique et 10 % pour le Kit Ablapak [4].
Le coût du traitement à Lyon
Le coût du
traitement à Lyon est
de 15 % plus élevé qu’à Caen estimé
à 5 500 €. Cette différence s’explique
principalement par la durée d’hospitalisation qui est plus
longue et le mode de
calcul utilisé par l’hôpital.
La phase
opératoire représente
plus de 60 % du coût total, incluant le consommable
spécifique de l’appareil et
de 20 % pour la machine et sa maintenance [4].
Le coût du traitement à Marseille
Le coût du
traitement à Marseille
est estimé de 6 450 €. La phase opératoire
représente 67 % du coût total, la
phase post- opératoire 23 % et la phase pré-
opératoire 10 %
En
résumé, le coût hospitalier d’un
traitement par Ablatherm est entre 4 720 € et 6 450 €. La phase
opératoire représente
plus de 60 % des coûts totaux, la phase pré-
opératoire entre 5 et 10 % et la
phase post- opératoire entre 20 et 30 % [4].
VII.3.
Coût
des autres modalités thérapeutiques
Retour Sommaire
Le tableau suivant
indique le
coût moyen des principales modalités thérapeutiques
afin de comparer le coût du
traitement Ablatherm avec celui des autres types du traitement [4].
|
Les types de traitements
|
Les coûts moyens de
prise en charge hospitalière pendant la première
année de traitements
|
|
La
prostatectomie
|
6
900 €
|
|
La
curiethérapie prostatique
|
7
200 €
|
|
La
radiothérapie
|
3
200 €
|
|
L’Ablatherm
|
5
585 €
|
Tableau
5 : Les coûts de différentes thérapies
D’après ce
tableau, la
radiothérapie est le traitement le plus économique. Mais
vu les effets
secondaires produits par cette dernière, l’Ablatherm
représente le mode thérapeutique
le moins invasif avec un prix convenable.
VII.4.
Financement
de la technique Ablatherm
L’acte de la
technique HIFU a
fait l’objet d’une évaluation par l’ANAES en vue d’une
inscription à la CCAM.
Suite au rapport d’évaluation, l’ANAES a classé l’acte en
recherche clinique,
et ne peut donc être prise en charge par la CCAM.
Par
conséquence, les Agences
Régionales de l’Hospitalisations ont pris en charge les
coûts des traitements
par Ablatherm de patients atteints de cancer localisé de la
prostate des
hôpitaux de Caen et de Lyon.
Ces demandes de
financement du
traitement des patients par Ablatherm ont été
motivées par des analyses
économiques effectuées à Caen et à Lyon [4].
VII.5.
Tarification
à l’activité T2A
Le coût moyen
d’un séjour pour le
patient qui rentre dans les groupes homogènes de séjour
GHS prostatectomie est
fixé entre 3390 € et 4514 € selon les complications majeures
associées. D’autre
part, le GHS nº 6451 qui concerne la curiethérapie et
autres irradiations
internes est facturé 2606 € [4].
Un mode de
financement
dérogatoire à la tarification permet de financer des
activités à fort impact
technologique dont l’Ablatherm fait partie et correspond a des missions
d’intérêt général, qui ne sont pas prises en
compte par les modalités classique
prévue par la reforme de la tarification.
VIII.
Parcs
installés et Concurrence
Ce paragraphe
évoque les différents parcs installés dans le
monde entier et les principaux
concurrents du groupe Edap-Technomed.
VIII.1.
Parcs
installés
En France :
Trente centres
utilisent l’Ablatherm.
Six centres disposent d’un système fixe, les autres se partagent
deux systèmes
mobiles, dont un à l’Assistance Publique des Hôpitaux de
Paris dans le cadre
d’un Programme Hospitalier de Recherche Clinique, partagé entres
les sites de la
Pitié, Saint Louis,
Tenon et Bicha. Le second est partagé entre les CHU de Reims,
Lille, Amiens,
Rouen, Nice, Toulouse Strasbourg, Montpellier, Tours, La Rochelle.
En Europe :
En Allemagne, trois
centres sont
équipés d’une machine fixe et sept autres se partagent
une machine
mobile ; quatre centres en Italie ; six centres en Suisse
partagent
un équipement mobile.
Dans le monde :
Quatre centres sont
équipés, en Arabie
Saoudite, Corée, Liban et Philippines.
Le nombre de
traitement a dépassé
les 6000 en Août 2005. Le nombre de traitements estimé
en France était de 1000 pour l’année
2004 [4].
VIII.2.
Les
principaux concurrents :
Plusieurs
sociétés développent
des applications de l’HIFU dans différentes indications. Le
Sonoblate 500,
développe en collaboration avec la société Focus
Surgery et fabriqué par la
société Misonix Incorporation, a été
surtout utilisé pour le traitement de
l’hypertrophie bénigne de la prostate. Il n’est pas
distribué en France mais il
a le marquage CE [37].
Fig.30:
Sonde Sonoblate 500 [37]
Fig.31:
Sonoblate 500 [37]
La
société Insightec, une société
israélienne associée à General Electric Medical
Systems commercialisent le
système ExAblate 2000 qui permet de traiter sous guidage IRM et
par HIFU
externe, les fibromes utérins, les cancers du sein, les
fibroadénomes et certains
cancers de la prostate. Ce système a été
marqué CE en 2002 et approuvé par la
FDA en 2004
Fig.32: Traitement
par voie externe de la tumeur [38]
Fig.33: ExAblate 2000 [39]
La
société chinoise Chongqing
Haifu développe la technologie HIFU sur des machines externes
pour le traitement
de différents cancers.

Fig.34: Le
Système FUS De Haifu
[40]
Le principe de
fonctionnement est
identique à celle utilisé par l’ExAblate. A ce jour des
essais cliniques sont
en cours pour le traitement du cancer de la prostate.
IX.
Prospectives
et Perspectives
Le service Recherche
et
développement du groupe Edap-Technomed travaille sur la seconde
génération d’Ablatherm ;
C’est un module compact qui intègre une image 3D de la prostate.
Créée
en Août 2004 par deux
anciens collaborateurs d’Edap-Technomed, la nouvelle
société Theraclion a
obtenu une licence exclusive et mondiale des brevets pour les
applications «
tête et cou » par HIFU, dont le traitement des nodules de
la thyroïde.
Après un
premier essai clinique
en cours avec des résultats encourageants, la
société entend lancer, dès 2006,
un essai multicentrique international en incluant notamment des sites
américains.
Parallèlement,
et en étroite
collaboration avec l’Inserm, un deuxième développement a
été initié, pour un
traitement conservateur des veines variqueuses par HIFU et un premier
brevet a
été déposé.
Conclusion
La technologie
HIFU est l’une des méthodes thérapeutiques la plus
efficace pour le cancer
localisé de la prostate. De plus, elle est simple, peu
douloureuse et rapide.
Tous les patients qui
souffrent
d’un cancer de la prostate de stade T1 ou T2 peuvent être
traités par Ablatherm.
La sonde de
thérapie est
l’élément critique de l’Ablatherm puisqu’elle assure la
production des
ultrasons focalisés par son transducteur de thérapie.
Pour cela, plusieurs
mesures de précaution sont mises en place afin d’assurer la
sécurité du patient
et la bonne utilisation de la sonde.
Le traitement par
Ablatherm se
déroule sur trois jours. Le patient est préparé
à l’hospitalisation la veille
du traitement et sortira le lendemain. Les résultats cliniques
sont satisfaisants,
aucun cas de mort n’a été signalé jusqu'à
présent. Quelques complications
apparaissent, selon les cas traités, comme l’infection urinaire.
Plusieurs normes sont
appliquées
en fabrication et en conception de l’Ablatherm afin de garantir la
sécurité des
patients et des personnels soignants.
Le coût du
traitement par Ablatherm
est classé en deuxième rang après le coût de
la radiothérapie. Mais vu les
effets secondaires produits par cette dernière, l’Ablatherm
représente le mode
thérapeutique le moins invasif avec coût raisonnable.
Il est difficile
d’imaginer
l’évolution de la technologie HIFU dans les dix ans à
venir, mais certainement
ses domaines d’application seront prometteurs.
Références
bibliographiques
Retour Sommaire
[1] Anatomie de la prostate
http://medicalcenter.osu.edu/patientcare/healthinformation/otherhealthtopics/ProstateHealth/AnatomyoftheProstateGland4948/
[2] Anatomie prostatique descriptive et
fonctionnelle
http://www.anamacap.fr/anatomie_prostatique01.php
[3] Cancer de la prostate et test PSA
http://www.malecare.org/toppage3.htm
[4] VERDEAUX S., BAFFERT S. & Coll.,
Centre d’Evaluation
et de Diffusion des Innovations Technologiques, traitement du
cancer
localisé de la prostate par le dispositif Ablatherm, octobre
2004.
[5] information sur le cancer de la prostate
http://www.edap-hifu.com/fr/patients/cancer_de_la_prostate/1e_info_classification.htm
[6] le cancer de la prostate : ce que
tout homme
doit savoir
http://www.health.state.ny.us/nysdoh/cancer/prostatebook/fr/prostate.htm
[7] Le cancer
http://www.mag-pluspharmacie.com/cancer.html
[8] Dépistage précoce du
cancer de la prostate :
Efficacité de 97%
http://www.scom.ulaval.ca/Au.fil.des.evenements/1996/04.11/prostate.html
[9] le cancer de la prostate
http://www.caducee.net/DossierSpecialises/cancerologie/cancer-prostate.asp
[10] effets secondaires du traitement du
cancer de la
prostate
http://www.uropage.com/ART_malpros2a.htm
[11] image de radiothérapie
http://www.ottawahospital.on.ca/sc/cancer/career-f.asp
[12] image brachythérapie
http://www.klinikum-neumarkt.de/images/prostata/
[13] pierre curie physicien français
1859-1906 source
bibliographique http://isimabomba.free.fr/biographies/chimistes/curie1.htm
[14] Paul Langevin physicien
français 1872-1946
souque bibliographique http://scienceworld.wolfram.com/biography/Langevin.html
[15] William Fry physicien américain
www.aium.org/aboutAIUM/presidents/presBio.asp?id=5
[16] L'Image Ultrasonore Bases Techniques
et Matériel
http://www.vet-lyon.fr/ens/imagerie/D1/11.Echo1/E1-notes.html
[17]
Introduction au phénomène de
piézo-électricité
http://www.cert.fr/dcsd/THESES/vincent/manuscrit_vincent/node175.html
[18] Les ultrasons focalisés de
haute intensité
(UFHI) en urologie
http://www.urofrance.org/pdf/TEXTF-PU-00-0010-1108.PDF
[19] A propos de l’HIFU, quel sont les
principes
physiques
http://www.edap.fr/fr/medecins/hifu/2c_hifu_principes_physiques.htm
[20] comment l’HIFU produit ils une
lésion ?
http://www.edap.fr/fr/medecins/hifu/2d_hifu_lesion.htm
[21] DESCHIZEAU Magali, Université
Joseph Fourier-
Grenoble 1, DESS techniques et applications de la physique, Méthodologie
de
caractérisation acoustique des transducteurs ABLATHERM,
rapport stage fin
d’études, Grenoble, Septembre 1998
[22] EDAP TECHNOMED, Dossier de
conception
ABLATHERM TMS 507 136, Vaulx-en-Velin, février 2000
[23] comment se réalise le
traitement
Ablatherm ?
http://www.edap.fr/fr/medecins/hifu/3c_traitement_description.htm
[24] TMS EDAP, Sonde HIFU
dédiée prostate TMS 508339
B, Cahier de charges, Vaulx-en-Velin, Novembre 2004
[25] EDAP TECHNOMED, Guide
d’utilisation de
l’Ablatherm, Vaulx-en-Velin, Avril 2005
[26] LESSAULT Thierry, Université
Joseph Fourier-
Grenoble 1, DESS techniques et applications de la physique, Méthodologie
de
caractérisation acoustique des transducteurs ultrasonore
à usage de thérapie,
rapport stage fin d’études, Grenoble, Septembre 1997.
[27] DONADEY Alain, Ingénieur de
Recherche Université
de Technologie de Compiègne, Support de cours sur
l’acquisition et la
construction des images échographiques, Octobre 2005.
[28] EDAP TECHNOMED, étude d’un
nouveau banc d’essai
avec mode A, Vaulx-en-Velin, Septembre 2002.
[29] déroulement d’un traitement
Ablatherm
http://www.hifu-thyroid.com/images/UST_FR_3.pdf
[30] traitement dans un bloc
opératoire
http://www.urofrance.org/lienbiblio.php?ref=PU-2003-00130060&type=HTML&lang=fra
[31] Formation des lésions par
balayage
http://www.edap-hifu.com/fr/medecins/hifu/3c_traitement_description.htm
[32] Résultats du traitement par
ultrasons focalisés
transrectaux du cancer localisé de la prostate
http://www.urofrance.org/BaseUrofrance/PU-2003-00130060/TEXF-PU-2003-00130060.PDF
[33] Répartition de la population de
l’étude
européenne
http://www.edap-hifu.com/fr/medecins/hifu/5a_resultats_standard.htm
[34] résultat clinique a long terme
http://www.edap-hifu.com/fr/medecins/hifu/5b_resultats_long_terme.htm
[35] PAGES Bruno, Manufacturer’s
Declaration of Compliance To Regulation and Quality Systems
Requirements,
EDAP TECHNOMED October 2005
[36] MOREL Claude & PAGES Bruno, Manufacturer’s
Declaration of Compliance To Technical and Safety Standards
Requirements,
EDAP TECHNOMED October 2005
[37] Sonde Sonoblate 500
http://www.prostate-cancer.org/education/novelthr/Chinn_TransrectalHIFU.html
[38] Société Insightec
http://www.insightec.com/
[39] ExAblate 2000
http://www.uterine-fibroids.org/mr_guided.html
[40] ExAblate 2000
http://www.gehealthcare.com/usen/mr/products/gfus.html
[41] Le Système FUS De Haifu
www.hifutech.com
Retour Sommaire