Sommaire
INTRODUCTION
I Généralités
1)
Principe de fonctionnement
2.
Applications médicales
a)
Applications à la TEP
b) Le
18F-FDG en cancérologie
c) La
protonthérapie
II Le cyclotron au sein d’un
établissement de santé
1)
Les cyclotrons en France
2)
Financement, installation et coût d’implantation
a) Le
cyclotron de Nancy [5]
b) Le
cyclotron de Nîmes [6]
c) Le
cyclotron de Clermont-Ferrand [7]
3)
Exploitation d’un cyclotron
4) La
réglementation
III Perspectives d’avenir : Les
Synchrotrons
1)
Fonctionnement [10]
2)Le
rayonnement synchrotron
3)
Applications en médecine [11]
4)
Enjeux de l’implantation du synchrotron Soleil en région
parisienne.
CONCLUSION
Annexe
Bibliographie et Sites Internet
Tables des illustrations
INTRODUCTION
De
nos jours l’emploi d’éléments radioactifs est quotidien
au sein d’un
établissement de santé qui pratique des examens utilisant
la
tomographie par émission de positons (TEP).
Il faut donc produire des isotopes radioactifs de
façon à pouvoir approvisionner ces établissements.
La technique employée pour la fabrication de ces
isotopes est l’accélération de particules via
l’utilisation d’un cyclotron.
Une
contrainte à laquelle il faut faire face est la durée de
vie de ces
éléments. En effet cette dernière est courte, ce
qui implique des
délais de livraison courts et une production en fonction de la
demande.
On
peut donc s’interroger sur l’avantage qu’auraient ces
établissements à
posséder leur propre cyclotron sur site, d’autant plus qu’il est
également utile en protonthérapie.
retour sommaire
dfdddddjjjuytruezatytyatyezgg
I
Généralités
1)
Principe de fonctionnement
Le
cyclotron est un accélérateur
électromagnétique de haute fréquence mis
au point en 1929 par E.O. Lawrence aux Etats-Unis [1].
Dans son
principe, le cyclotron utilise l’action combinée d’un champ
magnétique
et d’un champ électrique pour délivrer un faisceau de
particules
accélérées. Ces particules, électriquement
chargées, sont introduites
au centre d’une enceinte où règne un vide très
poussé. Sous l’action
combinée de champs électrique et magnétique
convenablement choisis,
elles décrivent une trajectoire en spirale depuis le centre du
cyclotron jusqu’aux bords tandis que leur vitesse s’accroît.
Elles
parcourent ainsi plusieurs tours avant d’être extraites de
l’accélérateur. Elles sont ensuite concentrées
à l’aide d’éléments
électromagnétiques puis projetées à
très grande vitesse sur une cible
située à quelques mètres de
l’accélérateur.
Dans le cyclotron, un filament chauffé
émet des ions H - qui sont ensuite
accélérés dans le vide par un champ
électromagnétique. Les protons sont extraits des ions H
- en
extrayant les deux électrons des ions avec une mince couche de
carbone.
Les protons porteurs d'une grande énergie, due à leur
vitesse, viennent
frapper une cible composée d'eau enrichie en oxygène 18 (
18 O,
isotope naturel stable non radioactif de l'oxygène). Du fluor
est
envoyé dans la cible par un tube capillaire, et on obtient,
après
bombardement, l'isotope fluor 18 ( 18 F)
dissout dans l'eau ( 16 O et
18 O).
Les fabrications sont réalisées à la demande et il
ne peut pas se
passer plus de huit heures entre la fabrication et l'injection
au
patient. Cette péremption est courte pour deux raisons :
- demi-vie très courte du 18 F (119
minutes) ;
- non prolifération bactériologique dans
le conditionnement final du produit injectable.
Le
cyclotron pendant sont fonctionnement émet des rayons X et gamma
et des
neutrons rapides. Ces rayons et particules sont arrêtés
par un blindage
de béton, y compris la porte d’accès.
Le cyclotron se compose de plusieurs
éléments tels que:
-
Le système radiofréquence : les particules sont
accélérées par une
cavité multi- électrodes alimentée par un seul
amplificateur, situé
dans la salle du cyclotron ; 
- L'aimant : l'aimant utilise deux bobines
classiques résistives. Le champ magnétique isochrone
guide le faisceau d'ions H - autour
du centre du cyclotron et ses propriétés assurent la
focalisation horizontale et verticale nécessaire;
- Source d'ions : le cyclotron est équipé
d'une source à cathode froide pour la
production des ions H - ;
- Système d'extraction des ions H
- (Strippers) : les protons
sont extraits
en strippant les 2 électrons ions H
-
avec une mince feuille de carbone ;
-
Chambre à vide : l'accélérateur est
caractérisé par un vide de très
haute qualité, nécessaire pour
l'accélération des ions négatifs. Pour
obtenir une bonne efficacité de transmission, 4 pompes
cryogéniques et
une pompe turbo moléculaire sont installées. Une pompe
mécanique est
utilisée pour le pompage primaire;
- Systèmes de commande et de contrôle :
les différents modules du cyclotron sont commandés
et contrôlés par informatique.
L'appareil
est formé de deux cavités en forme de demi cylindres,
(les "Dés"),
séparées par un petit intervalle. Un dispositif
émetteur de particules
chargées est situé au voisinage du centre. L'ensemble est
soumis à un
vide poussé et est placé entre deux
électro-aimants qui produisent le
champ magnétique désiré, comme indiqué sur
la figure suivante.
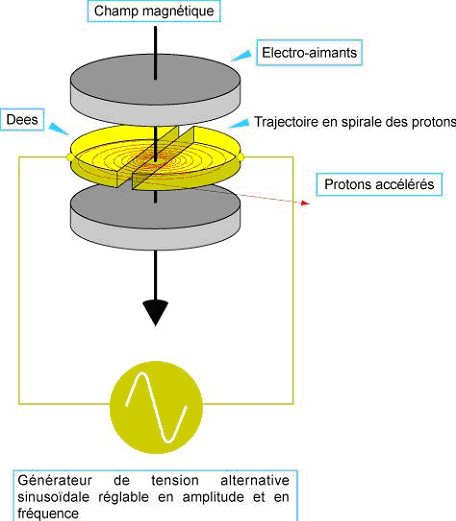
Figure 1: parties composant le
cyclotron.
Le
champ magnétique B (en bleu sur la figure 2), appliqué
perpendiculairement à la vitesse V, [2] courbe
le cheminement
des
particules, qui décrivent une trajectoire circulaire de rayon R
=
m*V/(q*B), à la vitesse angulaire w = q*B/m. (la vitesse des
particules
reste constante en module, car la force magnétique ne travaille
pas).
Cette
vitesse angulaire est indépendante du rayon de la trajectoire,
donc
finalement de la vitesse linéaire des particules. Quelle que
soit leur
vitesse, les particules mettent le même temps pour décrire
un cercle
(ou un demi-cercle...).
Le
champ électrique, E (en rouge sur la figure 2), dû
à une tension
alternative U appliquée entre les deux dés (figure 1),
règne uniquement
dans l'espace entre les dés. Il a pour effet
d'accélérer les
particules, qui reçoivent à chaque passage un "quantum"
d'énergie qU,
ce qui augmente leur vitesse (figure 2).
La
pulsation de cette tension a exactement la valeur qB/m ("pulsation
cyclotron"), et sa phase est telle que les particules subissent une
force maximum lorsqu'elles passent dans son champ d'action. Elles sont
donc accélérées deux fois par tour (une fois par
demi-tour).
Lorsqu'une
particule chargée (proton, ion...) est injectée au centre
du
dispositif, elle décrit une succession de demi-cercles de rayons
en
augmentation, jusqu'à ce qu'elle sorte du dispositif. Sa vitesse
est
alors directement liée au rayon du dernier demi-cercle. Elle
peut
atteindre une valeur proche de celle de la lumière.
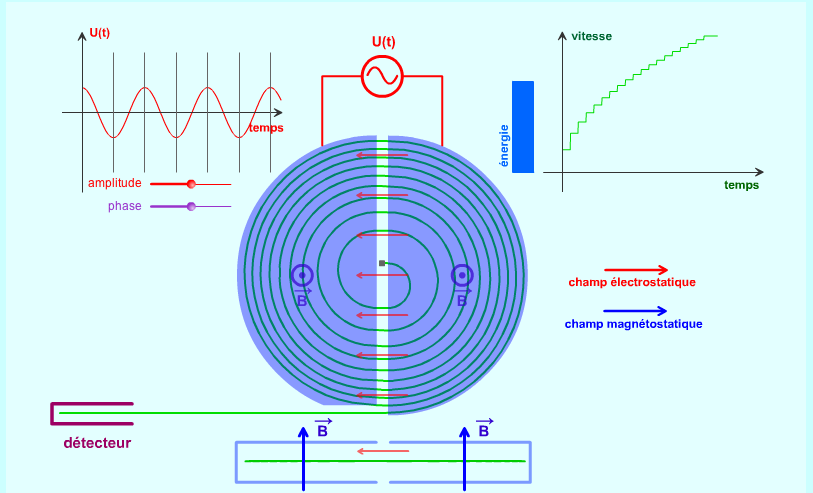
Figure 2: principe de
fonctionnement du
cyclotron.
Le
cyclotron permet de produire différentes catégories
d’isotopes
émetteurs de positons, tels que le Carbone 11, l’Oxygène
15, l’Azote 13
ou le Fluor 18.
On
utilise ces isotopes parce que le carbone, l'azote et l'oxygène
sont
déjà présents dans les molécules du corps
humain. En conséquence,
l'ajout de ces isotopes ne modifie pas de façon significative
les
propriétés chimiques de ces molécules. Bien que
les molécules
biologiques ne contiennent pas de fluor, celui-ci peut quand même
être
utilisé parce que ses atomes sont considérés comme
étant de densité
équivalente par rapport aux atomes d'hydrogène
présents dans le corps.
Les
isotopes ainsi obtenus sont ensuite incorporés à
différentes structures
chimiques ou à des molécules biologiques de façon
à en faire des
radiotraceurs.
Ils sont alors soit :
- fixés à des molécules d’eau pour
permettre d’observer des variations de débit sanguin ;
-
ancrés à une molécule proche du glucose, le FDG,
pour mesurer la
consommation de sucre et donc l’activité de certains organes ;
- liés à des acides gras pour
apprécier la synthèse protéique ;
- incorporés à des molécules
à usage thérapeutique pour localiser un médicament
et évaluer son efficacité.
Cette
activité nécessite des compétences
spécifiques en radiochimie ainsi que
des installations particulières, type salles blanches.
Ce
type d'instrument permet aux chimistes et radiochimistes de
remplir
les missions et objectifs scientifiques qui leur sont fixés:
- Assurer la production journalière d'isotopes
émetteurs de positons (Oxygène-15, Azote-13, Carbone-11
et Fluor-18) ;
-
Développer des méthodes de radiosynthèses
ultra-rapides (radiochimie ou
chimie "chaude") permettant d'incorporer efficacement ces
radio-isotopes et de marquer ainsi des fonctions chimiques
variées, en
accord avec la demi-vie de l'isotope utilisé (Carbone-11 : 20
minutes ;
Fluor-18 : 110 minutes) ; 
-
Rechercher, développer et préparer de nouveaux
radiotraceurs (molécules
marquées par des émetteurs de positons), susceptibles
d'être utilisées
en tomographie d'émission de positons (TEP). Cette
activité inclut la
mise en œuvre de synthèses organiques efficaces (chimie
"froide"), pour
fabriquer et fournir, d'une part, les précurseurs
nécessaires aux
radiomarquages, et d'autre part, les molécules cibles de
référence ;
-
Assurer la production journalière de radiopharmaceutiques
(validés et
utilisables en routine) requis par les protocoles d'études
cliniques
TEP.
Figure 3:
radioéléments produits
par le
cyclotron.
retour sommaire
2.
Applications
médicales
a)
Applications à la TEP
La
TEP repose sur l’utilisation de radiotraceurs, molécules
spécifiques
portant un atome radioactif émetteur de positons. Pour obtenir
ces
atomes radioactifs de courte durée de vie, il est
nécessaire de
recourir à un cyclotron.

Figure 4: exemple de cyclotron.
La
tomographie par émission de positons est une technique
d’imagerie
médicale qui permet, grâce à une caméra
spécifique, la détection d’un
radiotraceur émetteur de positons préalablement
administré au patient,
en général par voie veineuse.
Ce
radiotraceur est une molécule spécifique d’un organe,
tissu ou
processus biologique donné, dans laquelle un atome radioactif
émetteur
de positons a été incorporé. Ce dernier fait
office de balise pour
suivre le cheminement du radiotraceur dans l’organisme. 
Lors
de sa transformation radioactive, le positon émis s’annihile
avec un
électron, après un trajet de l’ordre du millimètre
dans un tissu
biologique. Cette réaction donne naissance à deux photons
émis
simultanément en ligne droite et dans deux directions
opposées. Ces
photons sont recueillis par une couronne de détecteurs de la
caméra à
positons située autour du patient.
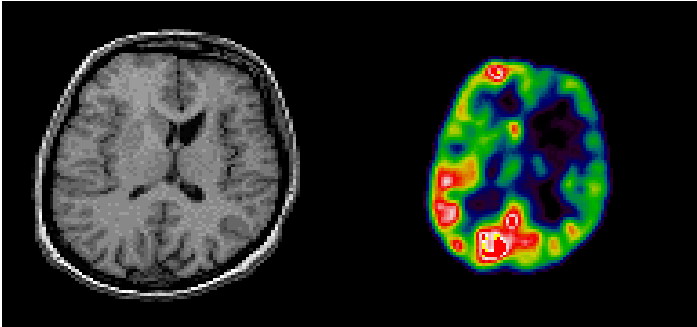
Figure 5 :
images du cerveau (gauche : IRM ; droite: TEP)
L’ensemble
des données enregistrées permet, à l’aide d’un
modèle mathématique, de
reconstruire et de quantifier la distribution du radiotraceur. La TEP
fournit ainsi une image tridimensionnelle du fonctionnement de certains
organes ou encore de l’efficacité d’un médicament.
Dans
son fonctionnement, la TEP doit prendre en compte la faible demi-vie
des atomes émetteurs de positons (demi-vie : temps au bout
duquel 50%
de ces atomes ne sont plus radioactifs, (20 minutes pour le carbone-11
et 2 minutes pour l’oxygène-15).
La
production de ces atomes dans un cyclotron, la synthèse chimique
et les
contrôles de qualité du traceur en laboratoire, puis
l’injection du
traceur au patient doivent être effectués dans un
délai relativement
court. A la différence des autres traceurs émetteurs de
positons qui
exigent d’être utilisés sur leur lieu de production, les
traceurs
marqués au fluor18 (d’une durée de vie de 110 minutes)
peuvent être
produits à quelques kilomètres du lieu d’utilisation.
retour sommaire
b)
Le 18F-FDG en cancérologie
Le 18 FDG
est un radio-isotope qui émet un positon (antiparticule de
l'électron)
lors de sa désintégration. Ce positon interagit avec un
électron en une
réaction d'annihilation qui se traduit par l'émission
simultanée de
deux photons de 511 KeV à 180° l'un de l'autre.
Si
deux détecteurs placés de part et d'autre du patient
détectent
simultanément un photon de 511 KeV, on sait alors qu'un positon
a été
émis quelque part, le long de la ligne joignant les deux points
d'impact sur les détecteurs.
En
accumulant un très grand nombre d'événements de ce
type sur une orbite
de 360° autour du patient, on peut reconstruire la distribution du
radio-isotope chez ce patient.
Une des caractéristiques de la cellule
cancéreuse étant l’augmentation de sa consommation en
glucose, la fixation du 18 FDG
s’accroît dans les cellules cancéreuses par rapport aux
cellules normales.
Ainsi, l’imagerie TEP de la distribution du
18 F-FDG
permet de différencier les tumeurs malignes et leurs
métastases des
tissus sains ou cicatriciels. Déjà utilisée en
routine clinique aux
Etats-Unis et dans quelques pays européens, la TEP au 18 F-FDG
se développe actuellement en France. Trente-cinq autorisations
de
caméras à tomographie par émission de positons ont
récemment été
accordées par le ministère de la santé.
Cet effort doit s’accompagner de l’implantation
de sites de production du 18 F-FDG,
afin de répondre tant quantitativement qu’en terme de
délais de
livraison aux besoins des services de Médecine Nucléaire
demandeurs.
L’accroissement attendu des besoins en
18 F-FDG
amène aujourd’hui à se doter de nouveaux cyclotrons, de
deux nouveaux
laboratoires de radiochimie et d’un local d’expédition, afin
d’augmenter la production.
retour sommaire
c)
La protonthérapie
Dans
le domaine du traitement par radiothérapie de certaines tumeurs
cancéreuses, l’utilisation de protons au lieu de photons comme
particules ionisantes a permis de mieux cibler les parties à
traiter et
par conséquent d’éviter l’irradiation des tissus sains.
A
l’heure actuelle, 65 % des tumeurs cancéreuses sont
traitées par
radiothérapie [3]. Le phénomène
thérapeutique consiste en la
désorganisation des chaînes moléculaires d’ADN du
tissu irradié par
l’ionisation que crée le passage d’une particule. Toutes les
particules
dotées de l’énergie suffisante s’avèrent
ionisantes à leur traversée
des tissus cellulaires.
La radiothérapie classique utilise des
photons X ou des électrons 
 qui
créent une ionisation décroissant exponentiellement avec
la profondeur
de pénétration, ce qui signifie que la dose reçue
par la peau est
toujours plus grande que celle déposée dans la tumeur ;
de plus, les
tissus sains situés au-delà son aussi irradiés.
qui
créent une ionisation décroissant exponentiellement avec
la profondeur
de pénétration, ce qui signifie que la dose reçue
par la peau est
toujours plus grande que celle déposée dans la tumeur ;
de plus, les
tissus sains situés au-delà son aussi irradiés.
La
protonthérapie est une radiothérapie
utilisant des faisceaux de protons. Les protons
présentent des propriétés balistiques avantageuses.
Lors
de la pénétration d’un faisceau de particules dans la
matière, les
particules déposent de l’énergie, on parle de «
dose » (exprimée en
Gray, 1 Gray = 1 Joule par kilo).
Le
proton est 1836 fois plus lourd que l’électron. A haute vitesse,
il
interagit peu avec la matière (peu d’influence des
électrons
rencontrés), en revanche à faible vitesse il interagit
fortement et
perd toute ton énergie sur un faible parcours.
La protonthérapie utilise le proton dont le dépôt
d’énergie
d’ionisation en fonction de la profondeur se situe essentiellement en
fin de parcours, à l’intérieur d’une zone étroite
appelée « pic de
Bragg », ce qui permet de cibler précisément la
partie à irradier. La
quantité d’énergie déposée par unité
de longueur entre la peau et la
tumeur ne représente que 22 % de celle déposée
dans la tumeur. Au delà
du pic de Bragg, les tissus sains sont complètement
préservés. La
variation de l’énergie permet de jouer sur la distance à
parcourir pour
atteindre la tumeur.
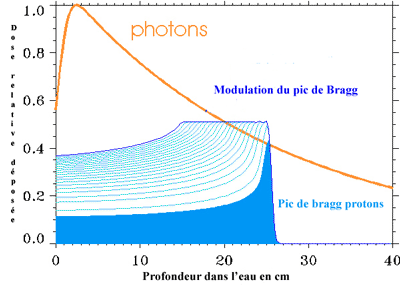
Figure
6 : dépôts de dose :la courbe de
dépôt de dose des protons
(bleue)réglable en largeur ou en profondeur s’avère plus
sélective que
celle des photons (orange).
Cette technique
nécessite de mettre en œuvre des technologies lourdes (un
accélérateur de particules à protons , une enceinte de
radioprotection ) et sophistiquées pour atteindre
la haute précision permise par leurs qualités balistiques
( des
systèmes de planification du traitement , de
conformation du
faisceau , et de positionnement
). Cette thérapie est relativement peu répandue car
elle nécessite un coût très
élevé.
La
protonthérapie s’avère pertinente pour les traitements
nécessitant une
très grande précision, par exemple lorsque l’on a affaire
à des tumeurs
dans le cerveau, dans des zones proches de la moelle
épinière ou encore
à l’intérieur de l’œil. De ce fait, la
protonthérapie présente un
avantage considérable sur la radiothérapie classique car
elle offre la
possibilité de traiter des tumeurs profondes ou situées
dans des zones
radiosensibles telles que les cancers de l’œil, du cerveau ou ceux
situés près d’organes vitaux. Avec des protons de 200
MeV, des
irradiations sont possibles jusqu’à 27 cm sous la peau, ouvrant
ainsi
la voie à une thérapie de grande précision pour
les tumeurs profondes.
Suivant
les différentes énergies que l’on utilise, on peut
comparer facilement
les pourcentages de doses reçues par le patient en fonction de
la
profondeur choisie.
Par
exemple, une irradiation aux Rayons X conviendra beaucoup plus
à des
tumeurs dites de surface, c'est-à-dire localisé proche de
la surface de
la peau.
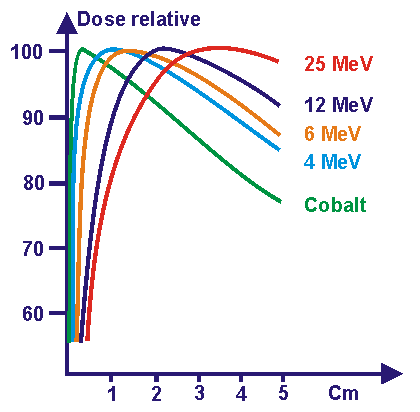
Figure 7 : dose relative
suivant la profondeur
pour les Rayons X.
En effet, on remarque que
les courbes de dose relative s’atténuent fortement avec la
profondeur du milieu traversé.
Si on irradie un patient avec
des électrons, on obtient le résultat suivant :
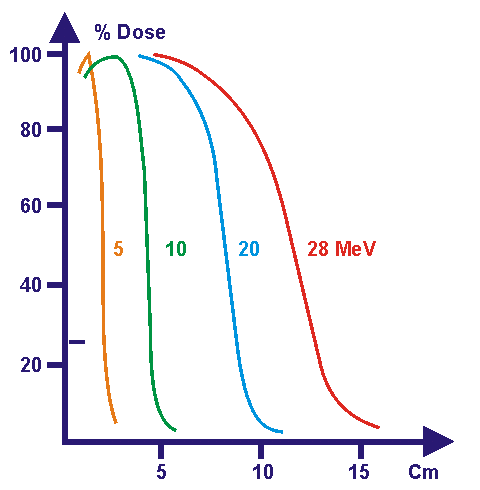
Figure 8: courbe de rendement
en profondeur pour les
électrons.
Suivant
leurs énergies, les électrons permettent d’aller à
une dizaine de cm en
profondeur mais on remarque qu’ils s’atténuent
extrêmement vite du
fait de leur faible masse.
De
plus, ils n’épargnent pas les tissus traversés
jusqu’à la cible,
contrairement aux protons qui permettent eux d’irradier une profondeur
donnée en épargnant les tissus traversés.
En
France, deux unités de traitement par protonthérapie, qui
ont toutes
deux démarré en 1990, fonctionnent actuellement. L’une
est le centre
Antoine Lacassagne à Nice avec une machine de 65 MeV permettant
des
traitements limités à 5 cm de profondeur ; l’autre, le
centre de
protonthérapie d’Orsay (CPO), a été lancée
grâce au don, par l’institut
national de physique des particules (IN2P3), du synchrocyclotron de 200
MeV de l’Institut de physique nucléaire d’Orsay. Dès la
création du
CPO, des collaborations se sont établies pour le
développement
d’instruments plus performants et d’un coût moindre.
Le
centre de protonthérapie d’Orsay, service de l’Institut Curie,
amorce
actuellement un projet d’extension et de modernisation qui va aboutir
en 2009 à une capacité de traitement de 650 patients par
an. Un
troisième centre, utilisant des ions carbone en plus des
protons,
devrait être mis en service à Lyon vers 2010. Il
coûtera environ 120
millions d’euros et occupera un bâtiment entier. Ces projets ne
permettront toutefois de répondre que partiellement aux besoins
en
matière de traitement. 
Toute
installation de radiothérapie se compose d’un
générateur de particules
et d’un système de dépôt de la dose, appelé
tête isocentrique, qui doit
permettre d’envoyer le faisceau sous tous les angles possibles vers la
tumeur. L’innovation technologique en protonthérapie concerne
ces deux
parties de l’instrument : le générateur de particules et
la tête
isocentrique.
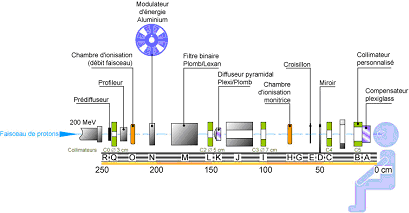
Figure 9 : banc optique de
conformation.
Pour
la protonthérapie la méthode de conformation du faisceau
traditionnelle
consiste à disposer des éléments
spécifiques sur le parcours du
faisceau.
Les
deux accessoires personnalisés situés en fin de ligne
(collimateur et
compensateur) sont réalisés sur place à partir du
fichier de
planification de traitement propre à chaque patient.
retour sommaire
Positionnement
du patient 
La
planification du traitement consiste, à partir des
données d'imagerie
du patient (Scanner, IRM), à choisir l'orientation et la nature
des
faisceaux de traitement. Le logiciel simule la dose
déposée dans les
tissus. L'optimisation est terminée lorsque les doses en tous
points
sont conformes au protocole de traitement.
La
précision permise par la balistique des protons exige un
positionnement
millimétrique. La solution choisie est basée sur des
billes implantées
sur le patient dès le début de la prise en charge. Par la
suite, le
recalage exact entre le patient virtuel utilisé pour la
planification
(imagerie Scanner et IRM) et le patient réel présent dans
la salle de
traitement se fera à partir de ces repères. Pour chaque
positionnement
sont effectués des clichés rayons X axiaux et
latéraux qui permettent
la localisation des billes. Un logiciel adéquat permet en une ou
deux
itérations d’avoir la position exacte souhaitée.
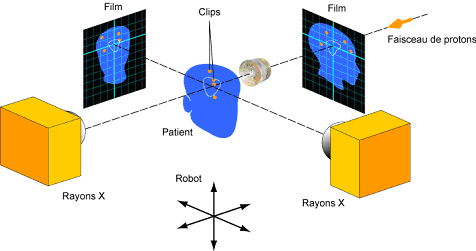
Figure 10: positionnement du
patient.
Aujourd’hui,
la protonthérapie est en évolution rapide dans le monde.
Après un
premier centre dédié, créé en 1990 à
Loma-Linda en Californie, d’autres
ont suivi : à Boston en 1994, puis en 1995 et 1996 au Japon.
Trois
nouveaux centres ont démarré aux Etats-Unis en 1997, et
le Japon
prévoit de se doter de dix nouveaux centres de thérapie
par ions
lourds. En Europe, le « Paul Scherrer Institut » de
Villingen en Suisse
a développé une tête isocentrique pour protons de
petites dimensions basée sur le mode de « spot scanning
». Le centre de physique
nucléaire GSI à Darmstadt en Allemagne a
déjà commencé à utiliser, à
titre expérimental pour le traitement de tumeurs
cérébrales, la
thérapie par ions lourds (des ions plus lourds que le proton, en
particulier le carbone). Par ailleurs, de grands projets, notamment
Tera en Italie et Austron en Autriche, visent à créer des
centres
hospitaliers réservés à la thérapie par
ions lourds. 
retour sommaire
II
Le
cyclotron au sein d’un établissement de santé
1) Les cyclotrons en France
Aujourd’hui
sur le territoire français, le cyclotron est utilisé dans
divers
domaines d’applications; tels la recherche, industrie pharmacologique,
biomédicale, résumées ci-dessous [4].
Figure 11: les cyclotrons en
France
retour sommaire
2) Financement, installation et coût
d’implantation
L’implantation
et l’exploitation nécessitent un investissement
considérable, tant sur
le plan humain que financier, c’est pourquoi cela donne lieu à
des
partenariats.
a) Le cyclotron de Nancy [5]
L’implantation
du Cyclotron de Nancy dans l’enceinte du centre hospitalier
universitaire (CHU) de Nancy-Brabois a été initiée
par l’université
Henri Poincaré (UHP), avec l’aide de l’Etat et des
collectivités
territoriales. Il est exploité par la société
CIS-bio international
pour ce qui concerne la production et la distribution de produits
radio-pharmaceutiques commerciaux et par l’UHP pour ce qui concerne les
traceurs destinés à la recherche clinique ou
expérimentale.
L’unité
de production qu’est le Cyclotron occupe une surface de 500 m2. Sa
construction débutée en 2001 a dû répondre
à des caractéristiques
techniques précises et satisfaire aux normes de radioprotection
en tant
qu’ « Installation Classée pour l’Environnement ».
L’unité comporte :
-
Un cyclotron pour la fabrication des radioéléments
placé dans une
enceinte de confinement dont les murs et plafonds sont en béton
de
2m d’épaisseur, doublés d’une paroi de 8 cm de plomb.
-
Une unité de radiochimie pour la synthèse des
molécules marquées ( 18 FDG)
avec enceintes blindées et ouverture de porte étanche.
- Un laboratoire de
mise en forme pharmaceutique.
- Un laboratoire de
contrôle qualité car, avant d’être injecté
à l’homme, le radiotraceur 18 FDG
doit satisfaire à certaines conditions réglementaires
drastiques.
-
Des laboratoires prévus pour la synthèse d’autres
radio-traceurs en
particulier pour les besoins de la recherche expérimentale et
clinique.
- Un dispositif de
sécurité entièrement automatisé.
Le Cyclotron de Nancy
fonctionne 5 jours par semaine. Il produira de l’ordre de 30 à
40 doses de 18 FDG
par jour livrées au Service de Médecine Nucléaire
du CHU de
Nancy-Brabois et prochainement aux CHU du Grand-Est : Strasbourg,
Besançon, Dijon et Reims.
Il
emploie actuellement quatre Equivalents Temps Plein : Pharmacien,
Technicien supérieur opérateur du Cyclotron, Gestion,
Secrétariat,
Expédition, sans compter les emplois induits. Ce dispositif
d’ingénierie et de recherche s’inscrit pleinement dans la loi
sur
l’innovation de 1999 concernant la valorisation et le transfert des
activités recherche des universités.
Ce
cyclotron résulte
d’un partenariat original entre l’Université Henri
Poincaré maître de
l’ouvrage et la société pharmaceutique Cis-bio
International,
spécialisée dans la production de marqueurs radioactifs
destinés à des
utilisations diagnostic en cancérologie et cardiologie et
accessoirement à la recherche scientifique et clinique.
Le
coût global de la maîtrise d’ouvrage
publique estimé à 2,1 millions
d’euros H.T. génie civil et équipements de laboratoire
confondu, auquel
il convient d’ajouter l’investissement en
matériel de production
apporté par CIS-bio International à hauteur de 2 millions
d’euros H.T,
a été financé grâce à un engagement
remarquable de l’Etat et des
collectivités locale.

Figure 12 : financement
du cyclotron de
Nancy
retour sommaire
b) Le cyclotron de Nîmes [6]
Dans
le cadre du plan cancer, le parc Georges-Besse et la ville de
Nîmes ont
été choisis pour l’installation du nouveau cyclotron
exploité par la
société CIS-bio international.
Le
cyclotron assure la production de Fluor 18, un traceur radioactif
utilisé pour le dépistage du cancer par imagerie
médicale.
La
durée de vie de ce produit n’excédant pas cent dix
minutes, le lieu
d’implantation de son unité de production doit être
étudié avec le plus
grand soin. La situation géographique du pôle
BiotechNîmes, au
carrefour des régions Languedoc-Roussillon/La Septimanie,
Provence-Alpes Côte d’Azur, avec un accès direct sur la
vallée du
Rhône, permettra d’alimenter à la fois les CHU de
Nîmes, Montpellier,
Marseille et Avignon.
Le
coût d’implantation du cyclotron, comprenant la construction d’un
bâtiment de 450 m2 et son équipement,
s’élève à 4,5 millions d’euros.
Près de 1,3 million d’euros a été investi par
l’Etat, la région
Languedoc-Roussillon/La Septimanie, la région Provence Alpes
Côte
d’Azur, le conseil général du Gard et la ville de
Nîmes pour financer
le bâtiment. La chambre de commerce et de l’industrie de
Nîmes, qui a
également participé au financement de ce projet, a fourni
le terrain et
assuré la maîtrise d’ouvrage ainsi que le suivi du
chantier. Locataire
de l’immeuble, la société CIS-bio international a
financé
l’installation de l’appareil cyclotron ainsi que tous les autres
équipements nécessaires à la production
pharmaceutique de Fluor 18.
retour sommaire
c) Le cyclotron de Clermont-Ferrand [7]
Voici
l’exemple de l’installation, du coût et du financement du
cyclotron de
St Beauzire en Auvergne. Ce cyclotron sera exploité par la
société
pharmaceutique Cyclopharma.
La zone du cyclotron d'une surface de 18 m
2
n'a aucune communication directe avec l'extérieur, hormis
:
- avec les deux ateliers de synthèse,
communication qui s'effectue en circuit étanche ;
-
avec l'atelier par une porte blindée de 1,9 m dont l'ouverture
est
contrôlée par l'arrêt du courant au niveau de
l'accélérateur ;
-
avec le système de traitement d'air qui permet de piéger
par des
filtres à charbon actif, toutes les particules ou gaz pouvant
être
produits dans la casemate.

Figure 13 :
enfouissement d’un cyclotron
Les
2 ateliers de synthèse constituent des lignes de fabrication
entièrement automatisées (pas d'intervention humaine). Le
liquide
extrait du cyclotron, après bombardement, est envoyé par
tube
capillaire, dans un kit de synthèse dans lequel s'effectuent
diverses
réactions chimiques, en particulier la fixation du fluor 18 sur
du
glucose, pour obtenir du fluorodéoxyglucose 18 FDG.
Les
réactions chimiques concernant l'isotope se font dans une
enceinte en
inox de 2x 0,90 m au sol et 2,30 m en hauteur. Cette enceinte est
placée dans un local de 4 m x 2 m au sol. Ce local est
blindé avec des
plaques de plomb de 7 cm d'épaisseur, il est ventilé en
permanence avec
de l'air stérilisé, recyclé à 80%. En cas
de fuites accidentelles de
produit radioactif, l'air pollué serait recyclé à
100% dans le local,
ce qui assurerait son confinement. Les éléments
radioactifs seraient
ensuite éliminés par filtration de cet air, sur charbon
actif.
Le
fluorodéoxyglucose est conditionné dans des flacons en
verre (diamètre
3 cm, hauteur 4 cm). Les flacons sont placés automatiquement
dans un
pot de plomb de 3 cm d'épaisseur (diamètre 12 cm, hauteur
15 cm), dans
l'atelier de synthèse. Le pot est placé ensuite dans un
conteneur
cylindrique en acier serti pour son transport. Le transport est
effectué, soit en voiture, soit en avion.
La
zone de déchets reçoit les déchets potentiellement
radioactifs issus de
la synthèse. Il s'agit d'un local spécifique
étanche (murs plombés)
pour attendre la décroissance de la radioactivité des
déchets [la durée
de vie du fluor 18 étant très courte, après dix
périodes, on obtient du
glucose. Aussi, ils sont stockés pendant une semaine puis
traités comme
des déchets non radioactifs. Dans cette zone seront
stockés les déchets
et équipements issus des ateliers de synthèse (kit de
synthèse) et du
cyclotron (cartouches de purification de l'eau irradiée, cibles
contenant de l'eau irradiée et constituées d'une partie
en Titane et
d'Argent et d'une autre partie en Inox). Le support de la cible est
rendu radioactif et l'inox dont il est fait a une durée de vie
de six
mois. A noter que les supports de cible ne sont pas des déchets.
Le
coût de tel support est de l'ordre de 70 000 €. De ce fait les
cibles
sont réutilisées après phase de
décontamination par décroissance
physique avant intervention technique. Le changement de support de
cible a lieu une fois par an.
Il
est prévu que l'installation de Saint-Beauzire produise chaque
jour 30
litres de déchets sous la forme de vêtements, filtres,
aiguilles,
seringues, fioles. Sont considérés aussi comme
déchets, les restes de
produits fabriqués ou ayant servis à la fabrication. Le
laboratoire
contient une atmosphère entièrement
contrôlée qui permet:
- la production et le conditionnement des
matières premières et du produit fini ;
- le contrôle qualité de tous les produits
entrant dans le schéma de synthèse et du produit fini.
On
trouve également un laboratoire de bactériologie
permettant de vérifier
la stérilité bactériologique du produit fini ;
ainsi que des
échantillons de tous les produits pharmaceutiques
fabriqués et de leurs
composants.
La
zone de manipulation de produits non radioactifs composée des
ateliers
et des bureaux, ainsi que de toutes les parties annexes : laverie,
local technique et d'une zone dépôt. Les différents
ateliers sont au
nombre de 6 et permettent de réaliser les différentes
étapes de
préparation des matières premières pour
l'activité pharmaceutique et
pour la synthèse du 18 FDG.
Le
local technique, situé au-dessus du cyclotron reçoit les
installations
du traitement d'air et les compresseurs. La laverie permet le
lavage
des ustensiles de laboratoire et des flacons (non radioactifs). La zone
de dépôt d'une surface de 173 m 2 ,
permet le stockage de matières premières (au maximum 500
m3).
L'alimentation
électrique du site s'effectuera par un transformateur de
puissance de
600 kVA. Le site n'utilisera pas le gaz naturel. L'usine sera
reliée
aux réseaux d'eau potable et d'eaux usées et pluviales de
la
collectivité. Le traitement d'air (réfrigération)
sera assuré par deux
compresseurs de puissance absorbée totale de 100 kW et un
compresseur
d'air de 5 kW assurera la production d'air comprimé.
Le
financement du programme d’investissement sera assuré par les
partenaires bancaires historiques de la société et par
des subventions
déjà accordées sur ce projet par la région
Auvergne (722 000 €), l’État
et l’Europe. Un partenariat entre des institutions Clermontoises, le
Centre Jean Perrin et l’institut national de la santé et de la
recherche médicale (INSERM) et les laboratoires Cyclopharma,
permettra
de développement de nouveaux traceurs, leur fabrication et leur
commercialisation à l’échelon mondial. Les principaux
clients de la
société sont les hôpitaux, les centres
anticancéreux et certains
services privés d’imagerie médicale.
3) Exploitation d’un cyclotron
Deux solutions peuvent
être envisagées pour l'approvisionnement des TEP en
radiopharmaceutiques [8] :
-
le recours
à un distributeur externe : c'est la seule
solution à court terme pour la fourniture en 18 FDG
des futurs TEP. Cet approvisionnement (environ 11 000 doses par an pour
les 6 TEP) représente un enjeu financier de près de 4.2M€
par an (entre
3 et 6 M€, selon l'activité TEP et les prix des doses de FDG).
Dans ce
contexte, il peut être envisagé d'utiliser de nouveaux
radiotraceurs
fluorés autres que le 18 FDG
tant en recherche qu'en pratique clinique du fait de leur
commercialisation par certains industriels. Cette solution permet de
s'affranchir d'un projet complexe au prix d'une certaine
dépendance vis
à vis des conditions de distribution et de prix proposées
par les
fournisseurs. En revanche, elle exclut toute activité de
recherche
utilisant les radiotraceurs de demi-vie courte et leur
éventuelle
utilisation en pratique clinique si aucun analogue fluoré ne
peut être
développé.
-
l'implantation
d'un cyclotron
permet d'envisager la production de radiopharmaceutiques
localement
tant pour la routine clinique qu'éventuellement pour la
recherche. La
production de 18 FDG
ne peut se faire réglementairement que dans le cadre d'un
partenariat
avec un des cinq industriels. Dans ce cas, les conditions juridiques et
financières du partenariat devront faire l'objet d'une
négociation
rigoureuse qui conditionnera l'intérêt financier d'une
telle solution.
Ce partenariat devrait permettre de partager les charges avec
l'industriel et d'obtenir des coûts par dose de FDG moins
élevés que
ceux proposés par le marché actuel. La production de
molécules à
demi-vie courte imposera un personnel compétent et très
spécialisé
(notamment radiochimistes et biomathématiciens). 
Il
ne faut pas oublier qu’un cyclotron a un coût de
fonctionnement en
exploitation qui est loin d’être négligeable. Ce
coût peut varier entre
un et deux millions d’euros suivant la structure et le personnel qu’il
requiert.
retour sommaire
4) La réglementation
L’arrêté
du 18 Décembre 2001 [9] (voir annexe) prévoit
que la France devra
s’équiper d’un appareil de tomographie par émission
de positons pour
chaque million d’habitants de ce pays, d’où la
nécessité de prévoir
l’implantation de futurs cyclotrons.
La
gestion des déchets s'effectuera conformément à la
circulaire DGS/DHOS
numéro 2001/323 du 9 juillet 2001, relative à la gestion
des effluents
et des déchets d'activités de soins contaminées
par des radionucléides.
Aucun déchet radioactif ne sortira du site ; compte tenu de la
durée de
vie relativement brève de la plupart des produits (sauf le
matériel de
la cible) mis en jeu, ceux-ci seront stockés dans un local
spécifique
étanche (murs plombés) pour attendre leur
décroissance naturelle. Une
fois cette décroissance constatée par des mesures
adaptées, ces déchets
seront traités dans les filières classiques.
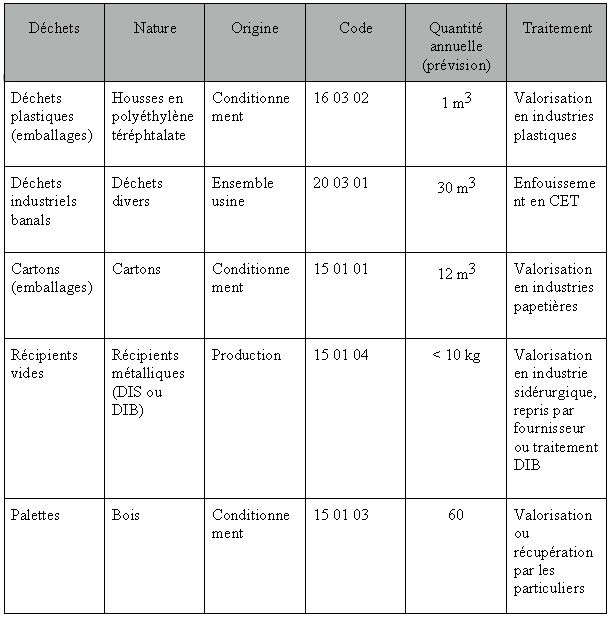
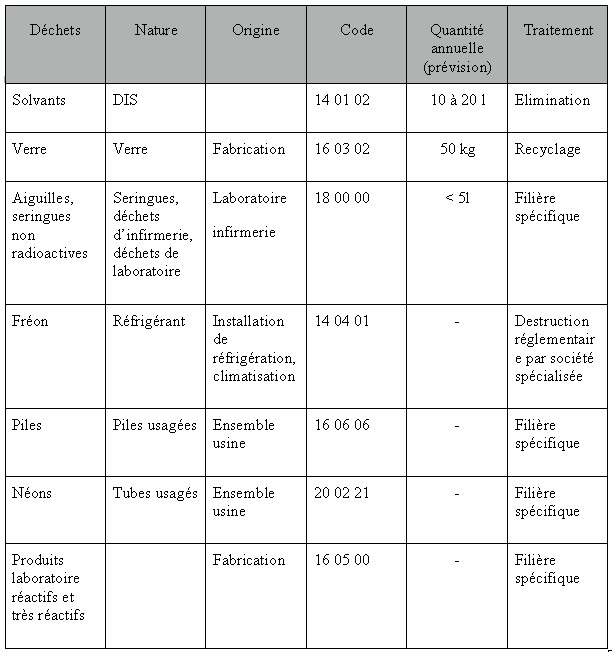
Figure 14 :
déchets produits
par
l’exploitation d’un cyclotron.
retour sommaire
III
Perspectives d’avenir : Les Synchrotrons
1)
Fonctionnement [10]
Un
synchrotron est un accélérateur d'électrons
destiné à produire un
rayonnement électromagnétique. Ce rayonnement est fourni
par un anneau
de stockage de qui peut atteindre plusieurs centaines de mètres
de
circonférence (354 m pour le synchrotron Soleil à Orsay
en France) dans
lequel des électrons de très haute énergie
circulent quasiment à la
vitesse de la lumière.
Cette
lumière est canalisée pour venir frapper la
matière à explorer. Les
applications concernent tous les domaines de la science.
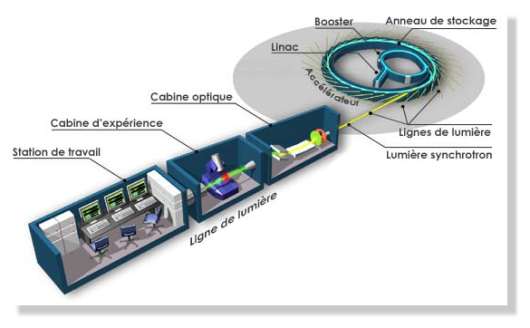
Figure 15 : composants
d’un synchrotron
Le
synchrotron est composé d'un anneau de stockage et d'un
accélérateur de
particules. Des électrons ou des positons sont
accélérés à une vitesse
proche de celle de la lumière et injectés dans l'anneau.
Ils génèrent
alors un rayonnement synchrotron qui sera exploité dans diverses
expériences. Ce rayonnement est collecté à
différents endroits de
l’accélérateur, ce que l’on appelle les lignes de
lumière.
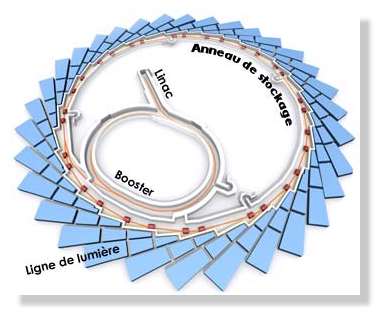
Figure 16 : lignes de
lumières du
synchrotron.
Chaque
ligne de lumière (jusqu’à 40 lignes de lumières
sur le synchrotron
Soleil) est ensuite traitée avec des lentilles et
monochromateurs afin
de sélectionner une ou plusieurs longueurs d'onde
précises. Au bout de
chaque ligne de lumière sont installés des appareils
(spectromètre de
masse, cristallographes,..) permettant d’effectuer des mesures et des
expériences. Suivant la taille de l'anneau, jusqu'à des
dizaines
d'expériences peuvent être menées
simultanément.
retour sommaire
2)Le rayonnement synchrotron
Le rayonnement synchrotron est
un rayonnement lumineux émis par des électrons qui
tournent dans un anneau de stockage.
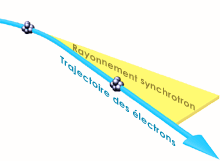
Figure 17 : rayonnement
du synchrotron
Le
rayonnement synchrotron de SOLEIL sera émis essentiellement de
l’infrarouge (1 eV) aux rayons X durs (50 keV) pour une énergie
des
électrons dans l’anneau de 2,75 GeV.
Cette lumière est si intense
(10000 fois plus intense que la lumière solaire) qu’elle
pénètre la
matière dans ses plus intimes recoins : les photons émis
viennent
frapper une cible, un objet, une matière, une molécule et
permettent
ainsi de l’étudier.
L'émission de rayonnement dépend
de la vitesse des électrons.
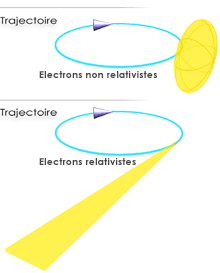
Figure 18 : trajectoire
du rayonnement
synchrotron
- Si
l'électron est non relativiste (sa
vitesse est bien inférieure à celle de la
lumière), l'émission de
rayonnement est isotrope autour de la direction
d'accélération.
- Si l'électron est
relativiste (sa
vitesse est proche de celle de la lumière, ce qui est le cas
dans un
synchrotron), l'émission de rayonnement se fait tangentiellement
à la
trajectoire et le faisceau est très collimaté.
retour sommaire
3) Applications en médecine [11]
L'utilisation
du rayonnement synchrotron concerne un très large ensemble
d'activités.
Il peut être utile en médecine, en
pétrochimie, micro technologie,
métallurgie, chimie, cosmétique, géophysique
appliquée et bien d’autres
domaines scientifiques.
En
ce qui concerne les activités médicales, deux
particularités des rayons
X délivrés par les synchrotrons améliorent
nettement le contraste des
radiographies. Tout d’abord, le spectre énergétique
continu permet de
travailler de part et d’autre du seuil d’absorption d’un atome marqueur
et, par soustraction des deux images, de visualiser
sélectivement le
marqueur. Développée pour
l’angiographie coronaire, cette technique
ne s’est jamais substituée à un examen conventionnel bien
qu’elle rende
l’examen non invasif. Elle connaît actuellement un regain
d’intérêt
grâce à son couplage avec la tomographie haute
résolution, conduisant
par exemple à des images spectaculaires de vascularisation
cérébrale.
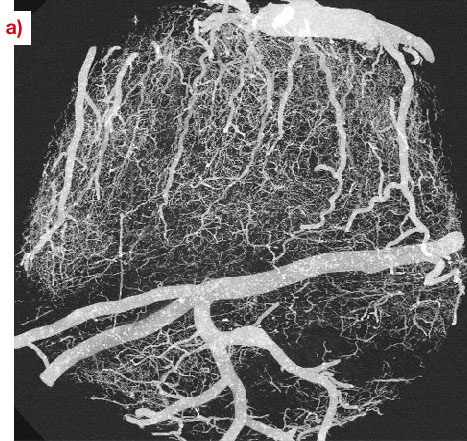
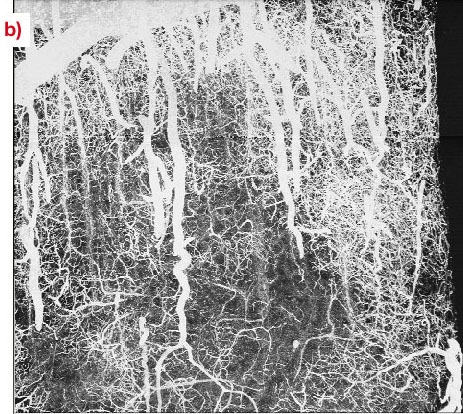
Figure
19: image du cerveau d’un rat auquel on a injecté du baryum
(600
mg/ml), obtenue à 20 keV en mode absorption avec un voxel de
1.4μm. Les
projections à intensité maximale ont étés
réalisées avec un volume de
x=1.5 mm, y=1.5 mm, z=1 mm.
(a): projection dans le plan x-y pour un
échantillon extrait du cortex fronto-central.
(b): projection
dans le plan x-z pour un échantillon extrait de
la région frontale .
Par
ailleurs, la cohérence partielle d’un faisceau monochromatique
synchrotron est à l’origine du développement
récent de deux techniques
de renforcement du contraste sur les interfaces entre organes.
-
Il s’agit de la D.E.I. ( Diffraction
Enhanced Imaging) ,
technique qui consiste à placer le détecteur loin de
l’objet
radiographié de manière à laisser se produire des
interférences entres
les faisceaux déviés à des angles
légèrement différents au niveau des
interfaces.
-
La seconde, R.E.I. (Refraction
Enhanced Imaging)
consiste à exploiter le même phénomène, mais
cette fois avec une
analyse fine des faisceaux déviés aux interfaces avec un
cristal
analyseur. L’apport de ces deux techniques par rapport à la
radiographie conventionnelle est illustré sur la figure 1. Une
étude
clinique de mammographie par D.E.I. est actuellement menée au
synchrotron Elettra de Trieste.
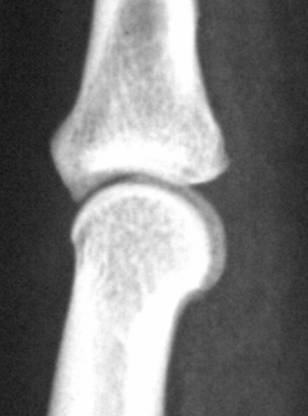
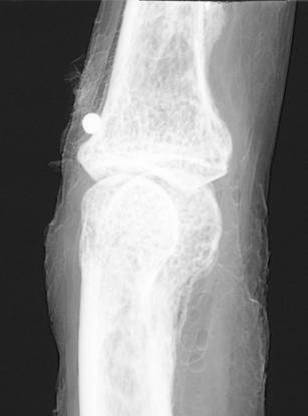
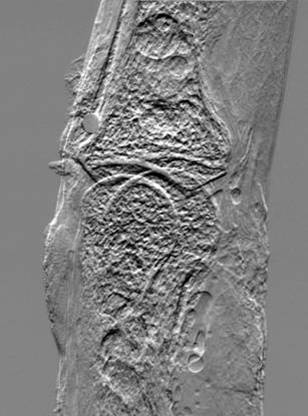
(a)
(b)
(c)
Figure 20:
radiographie du
doigt humain : (a) par technique conventionnelle; (b) par
DEI; (c) par REI.
retour sommaire
4) Enjeux de l’implantation du synchrotron Soleil
en région parisienne.
Le
Synchrotron SOLEIL est situé dans un environnement exceptionnel
de
partenaires publics et privés du domaine de la santé
(Assistante
Publique des Hôpitaux de Paris, Institut Curie, Institut Pasteur,
pôle
de compétitivité Méditech Santé...).
Le démarrage de ses activités en
2007 est l’occasion d’initier de nouveaux projets axés sur les
grands
enjeux de société, parmi lesquels la santé
publique.
Parmi
la vingtaine de lignes de lumière aujourd’hui programmées
à SOLEIL,
quelques-unes sont déjà partiellement
dédiées à des applications biomédicales ,
parmi lesquelles on trouve la microscopie infrarouge et la microscopie
UV.
Néanmoins, vu la qualité des faisceaux de lumière
qui seront délivrés à
SOLEIL, on peut légitimement afficher pour ce synchrotron une
ambition
bien plus élevée dans le domaine de la santé, ce
qui d’ailleurs
renforcerait son ancrage vers les enjeux de société.

Figure 21 : Synchrotron Soleil
vu du ciel
retour sommaire
CONCLUSION
En
conclusion, on a pu voir les différentes étapes de
la gestion d’un
cyclotron destinée à un usage médical, en passant
par son installation,
puis par son exploitation et pour finir, ses applications
médicales.
Devant
la forte demande en radio-isotopes qui est exprimé en
France, suite
notamment à l’arrêté du 18 Décembre
2001, on voit clairement que l’on
va devoir accentuer les efforts quant au développement de
nouvelles
structures type « cyclotrons » pour pouvoir ainsi
combler les demandes.
Les
cyclotrons sont des centres de recherches avant tout mais prennent
également de plus en plus de place dans le monde médical.
retour sommaire
Annexe
JO n° 297 du 22 décembre 2001 page 20401
Textes généraux
Ministère de l'emploi et de la solidarité
Arrêté
du 18 décembre 2001 fixant l'indice de besoins afférent
aux appareils
de diagnostic utilisant l'émission de
radioéléments artificiels (caméra
à scintillation munie de détecteur d'émission de
positons en
coïncidence, tomographe à émissions, caméra
à positons)
NOR: MESH0124368A
La ministre de l'emploi et de la solidarité et
le ministre délégué à la santé,
Vu le code de la santé publique et notamment les
articles L. 6121-2, L. 6122-1, R. 712-2, R. 712-6 et R. 712-15 ;
Vu l'avis du Comité national de l'organisation
sanitaire et sociale en sa séance du 13 décembre 2001,
Arrêtent :
Art.
1er. - L'indice de besoins afférent aux appareils de diagnostic
suivants utilisant l'émission de radioéléments
artificiels : caméra à
scintillation munie de détecteur d'émission de positons
en coïncidence,
tomographe à émissions, caméra à positons,
est fixé à 1 appareil pour 1
million d'habitants sur l'ensemble du territoire national.
Art.
2. - L'autorisation permettant l'implantation d'un nouvel appareil ne
sera accordée qu'aux établissements, disposant d'un
service de médecine
nucléaire, ayant une activité importante de traitement
des affections
cancéreuses et participant à un réseau de soins
pluridisciplinaire.
Art.
3. - Le directeur de l'hospitalisation et de l'organisation des soins
et les directrices et directeurs d'agence régionale de
l'hospitalisation sont chargés, chacun en ce qui le concerne, de
l'exécution du présent arrêté, qui sera
publié au Journal officiel de
la République française.
Fait à Paris, le 18 décembre 2001.
La ministre de l'emploi et de la solidarité,
Bibliographie et Sites Internet
[1]:
dossier de presse du 11 septembre 2002 : Présentation du
nouveau
cyclotron à usage médical du service hospitalier
Frédéric Joliot de
l’institut Curie. Site :
www-dsv.cea.fr/art/image/web_dsvdir/11sept-shfj.pdf
[2]:
Université de Nantes, UFR des Sciences et Technques.
http://www.sciences.univ-nantes.fr/physique/perso/gtulloue/Meca/Charges/cyclotron.html
[3] :
Dossier de presse 9 novembre 2005 : Centre de
protonthérapie de
l’institut Curie d’Orsay http://www.protontherapie-orsay.fr/
[4] :Dossier
de presse septembre 2004 « Lancement du projet du cyclotron
de Nantes »
[5] :
Dossier
de presse du 22 mai 2003 « Inauguration du cyclotron
de Nancy »
[6] :
Revue de presse : L’inter consulaire. Revue nationale des chambres
de
commerces et d’industries.
http://www.acfci.cci.fr/interconsulaire/archives/n87/initiatives/initiatives.html
[7] :
Demande d'autorisation d'exploitation d'une unité de production
d'isotopes radioactifs à usage médical à SAINT
BEAUZIRE, Puy de dôme.
[8] :
Recommandations du CEDIT. Opportunité d’acquisition d’un
cyclotron à
l’AP-HP.
http://cedit.aphp.fr/servlet/siteCedit?Destination=reco&numArticle=02.16/Av1/04
[9] :
Arrêté du 18 décembre 2001 fixant l'indice de
besoins afférent aux
appareils de diagnostic utilisant l'émission de
radioéléments
artificiels (caméra à scintillation munie de
détecteur d'émission de
positons en coïncidence, tomographe à émissions,
caméra à positons).
J.O n° 297 du 22 décembre 2001 page 20401. NOR: MESH0124368A
Source :
http://www.legifrance.gouv.fr/WAspad/UnTexteDeJorf?numjo=MESH0124368A#
[10]
: Synchrotron-Soleil, accélérateur
de
particules du futur
.
http://www.futura-sciences.com/comprendre/d/dossier516-1.php
[11] : Le synchrotron
soleil.
http://www.synchrotron-soleil.fr
retour sommaire
Tables des illustrations
[1]
Figure1 :
parties composant le cyclotron. Dossier de presse Septembre 2004
« Lancement du projet du cyclotron de Nantes »
[2]
Figure 2: principe de fonctionnement du cyclotron.
http://www.sciences.univ-nantes.fr/physique/perso/gtulloue/Meca/Charges/cyclotron.html
[3]
Figure 3:
radioéléments produits par le cyclotron .Le
cyclotron du CERMEP. http://www.cermep.fr/activite/cyclo.htm
[4]
Figure
4 : exemple de cyclotron. Site du constructeur
IBA : http://www.iba-worldwide.com
[5]
Figure 5 : images du cerveau (gauche : IRM ;
droite: TEP). Dossier de
presse du 11 Septembre 2002 : Présentation du nouveau
cyclotron à usage
médical du Service hospitalier Frédéric Joliot du
CE
[6]
Figure 6 :
dépôts de dose. Centre de protonthérapie Orsay http://www.protontherapie-orsay.fr/presentation/protontherapie/images/bragg-module.gif
[7]
Figure 7 : Dose
relative suivant la profondeur pour les Rayons X. Rapport LPES- CRESA
Université de Nice Sophia-Antipolis
[8]
Figure
8 : Courbe de rendement en profondeur pour les électrons.
Rapport LPES- CRESA Université de Nice Sophia-Antipolis.
[9]
Figure
9 : Banc optique de conformation.http://www.protontherapie-orsay.fr/presentation/protontherapie/images/banc-optique-intracranien.gif
[10]
Figure 10 : positionnement du patient. http://www.protontherapie-orsay.fr/presentation/protontherapie/images/postionnement-CPO.gif
[11]
Figure 11: les
cyclotrons en France. Dossier de presse Septembre 2004
« Lancement du projet du cyclotron de Nantes »
[12]
Figure 12 :
financement du cyclotron de Nancy. Dossier de presse du cyclotron de
Nancy du 22 Mai 2003
[13]
Figure
13:enfouissement d’un cyclotron. http://www.advancedcyclotron.com/images/cyclolowering.jpg
[14]
Figure 14 : déchets produits par l’exploitation d’un
cyclotron. Rapport
de la société Cyclopharma. Département du Puy de
dôme
[15]
Figure
15 : composants d’un synchrotron.
http://www.futura-sciences.com/comprendre/d/dossier516-1.php
[16]
Figure 16 : lignes de lumières du synchrotron.
http://www.futura-sciences.com/comprendre/d/dossier516-1.php
[17]
Figure 17 :
rayonnement du synchrotron.
http://www.futura-sciences.com/comprendre/d/dossier516-1.php
[18]
Figure
18 : trajectoire du rayonnement synchrotron.
http://www.futura-sciences.com/comprendre/d/dossier516-1.php
[19]
Figure 19:
image du cerveau d’un rat auquel on a injecté du baryum. http://www.synchrotron-soleil.fr/francais/applications-industrie/medecine/vascularisation_cerveau_microtomo-a.jpg
[20]
Figure 20:
radiographie du doigt humain. http://www.synchrotron-soleil.fr/francais/applications-industrie/medecine/RobLewis_doigthumain_conventionnel.jpg
[21] Figure 21 :
Synchrotron Soleil
vu du ciel. http://www.synchrotron-soleil.fr
retour sommaire