Sommaire
Table
des figures
Introduction.. 5
I. Présentation
du Groupe Sorin &
Ela medical.. 6
I.1.
Groupe
Sorin.. 6
I.1.1. Historique: 6
I.1.2. Organisation. 7
I.1.3. Les
entreprises du groupe Sorin. 8
I.2.
Ela
medical. 9
I.2.1. Historique: 9
I.2.2. Organisation. 10
I.2.3. Le
service des études et du développement mécanique
"EDM". 11
I.2.4. Les
produits d'Ela medical 11
II. Principes
généraux du fonctionnement
des dispositifs implantables.. 12
II.1. Stimulateurs
cardiaques. 12
II.2. Défibrillateurs
automatiques implantables. 14
II.3. Les
Sondes de stimulation cardiaque. 15
II.3.1.
Les moyens de fixation. 15
II.3.2.
La polarité des sondes. 15
II.3.3.
Bio Compatibilité des sondes. 17
II.3.4.
Les caractéristiques de l’électrode. 18
II.4. Les
sondes de défibrillation cardiaques. 19
II.4.1.
Structure interne. 20
II.4.2.
Fixation. 20
II.4.3.
Coil de défibrillation. 20
II.5. Complications
liées aux sondes. 22
II.5.1.
Déplacements secondaires. 22
II.5.2.
Modifications des seuils de stimulation et de
détection. 22
II.5.3.
Rupture de continuité électrique. 22
II.5.4.
Rupture d’isolant 23
III.
Problématique. 25
IV.
Contexte: 25
V. Rédaction
du cahier de charges.. 26
VI.
Banc d'abrasion existant.. 26
VI.1. Description.. 26
VI.2. Points
critiques: 27
VII. Nouveau
banc d'abrasion.. 27
VII.1. Description.. 27
VII.1.1. Le
modèle d'abrasion. 27
VII.1.2. La
machine d'abrasion. 31
VII.2. Qualification
du banc.. 32
VII.2.1. Mode
opératoire. 33
VII.2.2. Exploitation
des résultats. 33
VII.3. Validation
du banc.. 34
VIII. Autre
solution pour caractériser
l'abrasion.. 35
VIII.1.
Description.. 35
VIII.2.
Protocole
d'essai 36
VIII.3.
Résultats. 36
IX.
Transfert du site de la
stérilisation des sondes Swift.. 37
IX.1. Contexte. 37
IX.2. Rédaction d'un plan de développement.. 37
IX.3. Liste
des tâches à réaliser.. 37
IX.4. Validation
de la stérilisation pour les sondes Swift.. 39
IX.5. Comparaison
entre les sondes Swift et Isoline. 39
X. Perspectives
et prospectives.. 41
Conclusion.. 42
References
bibliographiques
Tables des Figures
Fig.1:
Organigramme du groupe Sorin 7
Fig.2 :
Organigramme de la
business unit CRM 10
Fig.3 :
Organigramme de la
direction des études et
du développement mécanique 11
Fig.4 :
Stimulateur
monochambre 12
Fig.5 :
Stimulateur double
chambre 13
Fig.6 :
Stimulateur triple
chambre 13
Fig.7 :
Sonde unipolaire 15
Fig.8 :
Sonde bipolaire 16
Fig.9 :
Connecteur d’une sonde
de stimulation 17
Fig.10 :
Sonde en stimulation 18
Fig.11 :
Sonde en
détection 19
Fig.12
: Isoline sonde à
double coil 19
Fig.13 :
Structure interne de
la sonde Isoline 20
Fig.15 :
Répartition du
courant sur les coils de
défibrillation 21
Fig.16 :
Rupture du conducteur 23
Fig.17 :
Rupture d’isolant 24
Fig.18 :
Sonde enroulée
sur boîtier du
défibrillateur.. 25
Fig.19 :
Banc d'abrasion
existant 26
Fig.20 :
Segment de la sonde
abrasée 28
Fig.21 :
La progression de
l’abrasion 29
Fig.22 :
Coupe verticale d'une
sonde 29
Fig.23:
La profondeur de l'abrasion
en fonction de
l'isolant abrasé 30
Fig.24:
La profondeur de l'abrasion
en fonction du temps 30
Fig.25
: Machine d'abrasion en vue
oblique 31
Fig.26:
Machine d'abrasion en vue
de face 32
Fig.27: Abrasimètre
linéaire 35
Fig.28 :
Liste des
tâches à exécuter par ordre
chronologique
38
Introduction
La
stimulation
cardiaque a entamé sa cinquième décennie
d’existence. La première implantation
date de 1958. Depuis, la technologie a connu une avancée rapide
et une
extension importante. Il existe 135 centres d’implantation du
stimulateur
cardiaque en France et le taux d’implantation est environ de 40000
unités par
an.
Les
sondes de
stimulation cardiaque jouent un rôle important dans la technique
de la stimulation
cardiaque. Elles assurent d'une part la stimulation par la conduction
électrique du boîtier de stimulateur vers le cœur et
d'autre part le retour
d'information par le même canal. Cependant ces sondes sont
soumises à des
fortes contraintes mécaniques telles que l’érosion et
l’usure. L’objectif de
mon stage se décline en deux parties indépendantes. La
première consiste à
caractériser l’abrasion des sondes cardiaques suivant un banc
d’essai pour
renforcer leur résistance au frottement. La deuxième
permet de transférer la
stérilisation des anciennes sondes cardiaques afin de simplifier
le management
de cette stérilisation et réduire son coût.
Ce
stage s’attache
à mettre en place un banc d’abrasion, le caractériser et
analyser ses fonctions
intrinsèques. Il faut donc étudier la répétabilité
et
la reproductibilité du process afin
de statuer sur la
capabilité du banc à
réaliser des mesures conformes.
Enfin, des modifications si nécessaires sont appliquées
pour l’optimiser.
Le
transfert de la
stérilisation des sondes nommées Swift consiste à
mettre en place un plan de
développement pour définir les tâches et les
intervenants. Ensuite il faut
négocier le nouveau contrat avec le nouveau sous traitant,
valider la
stérilisation avec leur nouvel équipement et effectuer le
transfert.
Le
groupe Sorin est le leader du
marché des dispositifs médicaux
cardiovasculaires en Europe. Un million de patients est traité
chaque année
avec ses équipements médicaux dans plus de 80 pays dans
le monde entier. Il est
le seul groupe européen qui offre une gamme complète de
thérapies et de
technologies pour traiter les maladies cardiovasculaires. Sorin
est spécialisé dans quatre grands secteurs
médicaux: la chirurgie cardiaque, le
management du rythme cardiaque, les thérapies vasculaires et les
nouveaux
technologies ainsi que la thérapie rénale. Il est le
leader mondial dans la
chirurgie cardiaque et un des principaux fabricants dans la gestion du
rythme
cardiaque tout en offrant des thérapies innovatrices pour le
dysfonctionnement
du rythme [1].
Group
Sorin emploie 4800 personnes servant plus
de 5000 centres
de soins publics et privés dans plus de 80 pays. 2700 personnes
en Europe, 1550
dans le nord de l'Amérique et 750 au Japon et le reste du monde,
travaillent au
sein du groupe [1].
Le groupe Sorin a une tradition
d'innovation et une culture
véritablement technologique.
1964:
Premier
pacemaker d'Ela medical
1964:
Premier pack
cœur poumon adapté aux besoins des clients de Cobe Cardiovascular
1967:
Premier
pacemaker de Sorin biomedica
1969: Première implantation humaine de Pyrolite,
valve cardiaque en carbone
fabriquée par Carbomedics
1973:
Première
machine modulaire cœur poumon de Stockert
1982:
Premier
système européen d'autotransfusion de Dideco
1986:
Première
valve mécanique rotatif en positions aortiques et mitrales de Carbomedics
1989:
Première
valve mécanique disponible pour la pédiatrie de Carbomedics
1989:
Premier
pacemaker à double chambre d'Ela medical
1998:
Première
implantation humaine de stent en carbone
de Sorin biomedica
2000:
Publication
de l'étude Mustic d'arrêt
cardiaque par Ela medical.
2001: Premier système d'autotransfusion
automatique avec surveillance de qualité de sang de Dideco
2004: Première valve mécanique de Carbomedics
avec 500 000 implantations sans aucune défaillance
post-opératoire.
2005: Le plus petit défibrillateur cardiaque
implantable
du monde entier fabriqué par Ela medical
[1].
Depuis janvier 2004
Sorin groupe a adopté une nouvelle
organisation basée
sur trois principaux piliers :
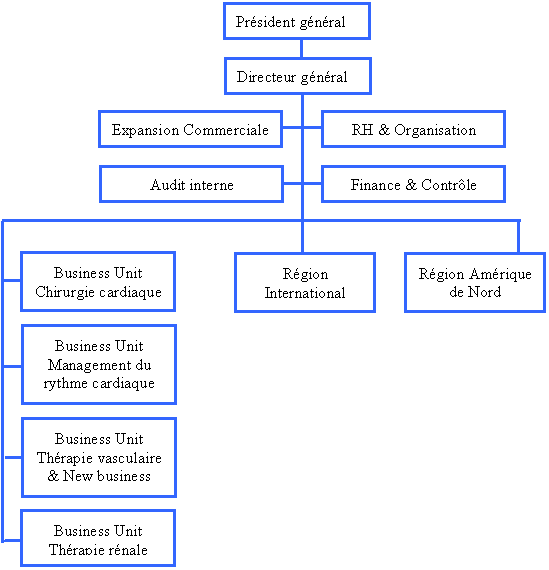
Fig.1:
Organigramme du groupe Sorin [1]
Corporate: englobe les cadres
supérieurs, le service Finance
& contrôle,
l'audit interne, la division général de l'expansion
commerciale, les ressources
humaines & Organisation pour établir des objectifs et pour
assurer des
synergies dans le groupe entier.
Business
Units: la chirurgie cardiaque, le
management du rythme
cardiaque, la thérapie vasculaire & new business et la
thérapie rénale reflètent
les secteurs thérapeutiques principaux où le groupe
effectue la recherche
active, développe et produit des thérapies innovatrices
[1].
Régions:
Les
service marketing et après vente du nord de l'Amérique et
des régions
internationales maximisent la concentration du groupe Sorin
sur les clients dans le monde entier.
Les
activités du
groupe Sorin sont divisées en
quatre grands secteurs
dont chacun regroupe plusieurs entreprises [1].
La chirurgie cardiaque:
CarboMedics:
fabrique les
valves cardiaques mécaniques et les anneaux plastiques
pour la réparation des valves natives. Son siège social
est situé à Austin,
Texas.
COBE
cardiovascular: fabrique les
oxygénateurs
pour les
procédures chirurgicales et distribue les machines de cœur
–poumons. Cobe est
un leader industriel aux Etats Unis.
Dideco:
leader mondial dans la
conception et la fabrication des oxygénateurs
et les systèmes de circulation extracorporelle du sang pour la
chirurgie du
cœur ouvert. Dideco fabrique aussi les
composants et
les systèmes pour le traitement thérapeutique du sang.
Elle est située à Mirandola
en Italie.
Stockert:
leader mondial dans
les machines cœur-poumon pour la circulation
extracorporelle du sang. Son siége sociale est situé
à Munich en Allemagne.
Sorin biomedica
cardio:
Leader spécialisé dans le secteur de la bio
ingénierie de la haute technologie
pour les dispositifs médicaux implantables. Elle produit aussi
les prothèses de
valves cardiaques.
Mitroflow:
produit les valves
innovatrices du tissu péricarde. Son siège social
est localisé à Vancouver au Canada.
Le management du rythme cardiaque:
Ela medical:
fabrique les pacemakers, les
défibrillateurs et les holter. Ela
est le leader
européen dans le management du rythme cardiaque. Elle est
localisée à Paris en
France
Sorin biomedica
CRM: est reconnue comme leader
dans la production des hautes technologies, elle prenne en charge la
production
des sondes et l'élaboration des programmes de pacemaker.
La thérapie vasculaire & new
business:
Sorin biomedica
cardio:
fabrique des stents coronaires et
périphériques ainsi
que les stents actifs pour la cardiologie interventionnelle et les dispositifs endovasculaires.
Dideco: leader mondial dans la
conception et la fabrication des oxygénateurs
et les systèmes de circulation extracorporelle du sang pour la
chirurgie du
cœur ouvert. Dideco fabrique aussi les
composants et
les systèmes pour le traitement thérapeutique du sang.
L’entreprise est située
à Mirandola en Italie.
La thérapie rénale:
Bellco:
Leader européen
dans la fabrication des équipements d'hémodialyse
avec tous les produits et les systèmes pour le traitement de
l'insuffisance
rénale chronique. Elle est localisée à Mirandola
et Saluggia
en Italie.
Soludia:
fabrique des poudres,
des solutions liquide concentrées et des
solutions d'infusion pour la dialyse et est située à
Toulouse [1].
I.2. Ela medical
Ela Medical
est un des cinq
leaders mondiaux
dans le management du rythme cardiaque. La société
s’occupe de patients
souffrant de désordres du rythme cardiaque, en apportant des
produits variés,
innovants, fiables et physiologiquement compatibles. ELA coopère
étroitement
avec des professionnels de la santé cardiaque pour
continuellement améliorer
les valeurs diagnostiques, thérapeutiques et économiques
de ses produits.
Elle
fabrique et
commercialise les implants cardiaques actifs comme les pacemakers et
les
défibrillateurs implantables [2].
Elle
emploie
environ 500 personnes réparties sur deux sites à Paris,
le site de la Boursidière et le
site de Montrouge. Le premier regroupe la
direction générale, le service marketing et la recherche
clinique alors que le
deuxième englobe la production et le service recherche et
développement où j'ai
effectué mon stage.
1945:
Création de
"l'électronique Appliquée"
1962:
Création
d'une division médicale en cardiologie
1964:
Lancement du
premier stimulateur
1972:
Premier
stimulateur à pile au lithium
1973:
Premier
boîtier en titane
1977:
La division
médicale devient Ela médical
1980:
Premier
stimulateur avec microprocesseur
1983-1986:
Acquisition progressive d'Ela par
Synthélabo
1989:
Lancement de
Chorus, stimulateur double chambre physiologique
1992:
Lancement de
Chorus RM, asservissement à ventilation minute
1995:
Création d'Ela recherche.
Première implantation du défibrillateur
Defender
1996:
Logiciel
d'assistance pour l'interprétation et diagnostic automatique:
AIDA
1998:
Lancement de
Talent avec asservissement Twin Trace,
double capteur
1999:
Fusion des
sociétés SANOFI et SYNTHELABO
2001:
Acquisition
d'Ela par SNIA
2004:
Détachement
de la branche médical de SNIA pour devenir le groupe Sorin.
Depuis
le 30 avril
2001, le groupe italien SNIA a acquis ELA Medical,
auparavant détenue par Sanofi-Synthelabo,
une
compagnie pharmaceutique française. SNIA est une entreprise
Italienne cotée en
bourse sur le marché italien depuis 1922. Ce groupe opèrait
dans trois domaines : la technologie médicale, la chimie et
l’énergie et les
filaments textiles.
En
2000, les
revenus consolidés atteignirent 1125 millions de dollars, une
croissance de
10.7% par rapport à 1999. 59.6 % des revenus venaient
d’opérations étrangères.
L’acquisition d’ELA Medical
renforce significativement l’activité de gestion du rythme
cardiaque de SNIA.
Le chiffre d’affaires combiné d’ELA Medical et SORIN Biomedica
devrait s’élever à environ 145 millions de dollars. SNIA,
déjà leader en
chirurgie cardiaque, deviendra donc un partenaire industriel fort des
cliniciens au travers du monde. En 2004, la branche médicale de
SNIA s'est
détachée pour devenir le groupe Sorin
[2].
Ela medical et Sorin biomedica
représente la "Business Unit" de
l'activité management du rythme cardiaque.
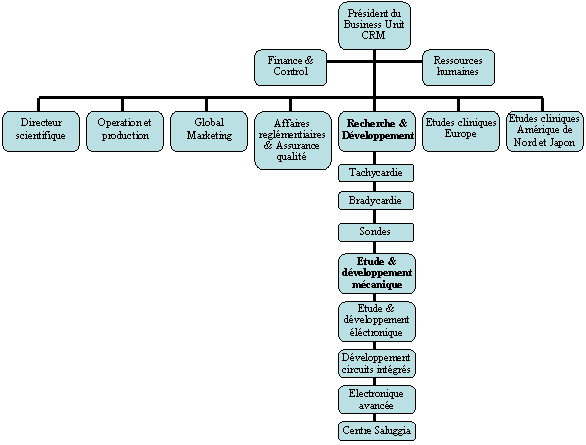
Fig.2 :
Organigramme de
la business unit CRM [3]
Cette
unité est
composée en plusieurs services localisés entre Paris et
le centre de Saluggia en Italie. Le
service recherche et développement
est organisé en structure matricielle c'est-à-dire
à la fois suivant des axes
produits « responsabilité transversale par ligne de
produits et à la fois
suivant des axes métiers « responsabilité
verticale par
technologie ». Par exemple, le service du R&D des sondes
dépend à la
fois hiérarchiquement du centre
d’excellence métier mécanique et a la fois du
système manager sondes.
retour sommaire
La
direction des
études et du développement mécanique est
divisée en plusieurs branches suivant
les produits à développer et comporte aussi le service de
la qualification
mécanique
ainsi que les
nouvelles technologies.
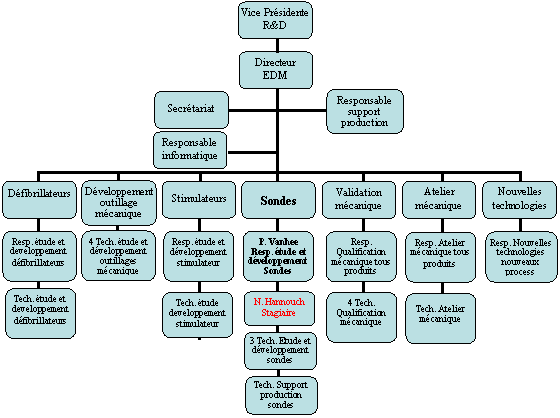
Fig.3 :
Organigramme de
la direction des études et du développement
mécanique [3]
Mon
stage a été
effectué au sein de ce service et plus précisément
sous la responsabilité du
responsable étude et développement des sondes.
retour sommaire
Ela medical
développe, produit et commercialise
des stimulateurs et des défibrillateurs cardiaques
utilisés dans le traitement
des bradycardies, tachycardies, de l'insuffisance cardiaque et de la
prévention
des fibrillations auriculaires. Ela
médical vend
également des Holter pour l'enregistrement et l'analyse des
données électrocardiographiques.
Les
stimulateurs et
les défibrillateurs cardiaques implantables seront
décrits par la suite afin de
se décliner sur la problématique de mon sujet de stage
[3].
Les
dispositifs
implantables comprennent les stimulateurs cardiaques ou pacemakers et
les
défibrillateurs automatiques implantés. Leurs indications
augmentent au gré des
études cliniques d’impact et des progrès technologiques.
II.
Principes
généraux du fonctionnement des dispositifs
implantables
Les
stimulateurs
cardiaques et les défibrillateurs automatiques implantables sont
constitués
d’un boîtier implanté habituellement dans la région
prépectorale,
et connecté à une ou plusieurs sondes mises en place par
voie veineuse
céphalique ou sous-clavière, jusqu’à la pointe du
ventricule droit et parfois
dans l’oreillette droite.
II.1.
Stimulateurs
cardiaques
Leur
fonction est
la stimulation électrique des cavités ventriculaires
et/ou auriculaires pour
palier un défaut d’activité nodale ou de conduction.
Leurs indications ont été
récemment étendues au traitement de l’insuffisance
cardiaque évoluée, de la
cardiomyopathie hypertrophique et de certaines fibrillations
auriculaires. Ils
sont « mono » « double » ou « triple
» chambre, selon qu’ils stimulent une,
deux ou trois cavités
[4].
Fig.4 :
Stimulateur monochambre [5]
Les
stimulateurs « monochambre »
sont ventriculaires, plus rarement
auriculaires, les stimulateurs « double chambre » sont
munis d’une sonde
auriculaire et d’une sonde ventriculaire qui stimule ces cavités
en l’absence
d’activité spontanée.
Fig.5 :
Stimulateur double chambre [5]
Ils
synchronisent
le stimulus ventriculaire à la dépolarisation auriculaire
grâce à la
programmation d’un délai atrio-ventriculaire.
Cela
leur confère un avantage hémodynamique par rapport
à la stimulation
ventriculaire « monochambre ».
D’une part ils
maintiennent la séquence auriculo-ventriculaire, d’autre part,
la fréquence de
stimulation est adaptable aux besoins physiologiques. Ils sont
indiqués chez
les patients conservant une activité physique, mais aussi chez
les sujets en
insuffisance cardiaque [4].
Fig.6 :
Stimulateur
triple chambre[5]
Actuellement,
les
stimulateurs cardiaques « triple chambre » sont partie
intégrante du traitement
de l’insuffisance cardiaque car ils réduisent sa morbimortalité.
Leur rôle est de resynchroniser la
contraction des
cavités ventriculaires droites et gauches,
désynchronisée lors de l’insuffisance
cardiaque évoluée. Cette stimulation « multi site
» s’adresse à certains
malades en insuffisance cardiaque de stades III ou IV sous traitement
médicamenteux optimal, en rythme sinusal prédominant,
avec des QRS de plus de
120 millisecondes, ne fraction d’éjection inférieure
à 35 % et une
désynchronisation mécanique inter ventriculaire
échographique. Le terme de «
triple chambre » porte à confusion : au niveau du cœur
droit, une sonde est
implantée dans chaque cavité, mais pour le ventricule
gauche, la sonde de
stimulation passe dans le sinus coronaire pour être
disposée dans une veine
latérale du cœur de manière à se trouver en regard
du ventricule gauche.
Les
modes de
stimulation sont décrits grâce à un code
international à cinq lettres qui
caractérise chaque stimulateur:
- La
première lettre
désigne les cavités stimulées : A signifie
atrium, V signifie ventricule,
D signifie double chambre,
- La
deuxième
correspond aux cavités où se fait le recueil A, V, D de
l’activité électrique,
- La
troisième caractérise
le mode de réponse du pacemaker à
l’événement recueilli, I signifie inhibition
de la stimulation, T déclenchement d’une stimulation, D
inhibition ou
stimulation, O aucune activité.
- La
quatrième lettre
indique si la réponse est asservie ou non en fréquence;
cette fonction permet
de faire varier la fréquence de stimulation avec
l’activité du patient.
- La
cinquième lettre
indique la localisation de la stimulation multi site, ou son absence [4].
Le
seuil de
stimulation correspond à la différence de potentiel
minimale nécessaire à
l’obtention de la dépolarisation du myocarde. Il dépend
des caractéristiques du
myocarde, de la sonde et de la qualité du contact entre la sonde
et le
myocarde. Il varie au cours du temps, en particulier juste après
l’implantation.
Son augmentation peut expliquer une perte de capture ventriculaire par
le
stimulateur. Le stimulateur recueille par l’intermédiaire des
sondes les
potentiels électriques endocavitaires,
cela permet au
dispositif de ne stimuler qu’en l’absence d’activité
électrique spontanée. La
sensibilité en mV définit la capacité de
détection par le stimulateur des
signaux intracardiaques transmis par l’intermédiaire de la
sonde. Le seuil de
détection en mV correspond à l’amplitude minimale
au-dessus de laquelle les signaux
électriques du cœur sont reconnus. Tous les courants d’amplitude
inférieure au
seuil de détection ne sont pas perçus. Les seuils de
stimulation et de
détection sont recueillis au moment de l’implantation et du
contrôle du
dispositif. L’intensité de stimulation est réglée
à deux ou trois fois le seuil
de stimulation [4].
Depuis
l’implantation du premier exemplaire en 1980, les
défibrillateurs automatiques
implantables contribuent à la réduction des troubles du
rythme ventriculaires
graves: ils diminuent la mortalité cardiovasculaire globale en
prévention
primaire et secondaire. Leur rôle est de surveiller et de
réguler la fréquence
cardiaque par deux types de thérapies [6] :
- La stimulation de
faible énergie, antitachycardique,
en rafales.
- Les
chocs de cardioversion sont de faible
énergie environ 10 Joules ou
de défibrillation ventriculaire environ 30-40 Joules ce qui
correspond environ
à 750-900 Volts.
Les
défibrillateurs
automatiques implantables possèdent également une
fonction antibradycardie.
Les chocs sont délivrés pour des arythmies rapides
engageant le pronostic
vital. Cela nécessite un recueil précis des potentiels endocavitaires
et une adaptation progressive des algorithmes diagnostiques aux
problèmes
posés.
La
fréquence
cardiaque détectée par le défibrillateur sert de
base diagnostique des
arythmies. Une ou plusieurs « zones » de tachycardie sont
programmables. Les
fréquences les plus élevées correspondent à
la « zone » de fibrillation
ventriculaire, qui, si elle est atteinte par la tachycardie, provoque
la
délivrance d’un choc électrique endocavitaire.
Les
fréquences moins élevées correspondent à la
« zone » de tachycardie
ventriculaire. La thérapie peut alors être soit une
stimulation antitachycardique, soit un
choc endocavitaire
de faible énergie, soit une abstention. Ces traitements sont
programmés et
spécifiques pour chaque patient. Une situation reste
problématique : la
fréquence d’une tachycardie sinusale ou d’une arythmie supraventriculaire
peut chevaucher la « zone » de tachycardie ventriculaire et
entraîner des chocs
inappropriés. La majorité des défibrillateurs
peuvent être programmés pour
augmenter la spécificité du diagnostic de tachycardie
ventriculaire. Ce
problème se pose en particulier avec les tachycardies supraventriculaires
avec bloc de conduction. Les défibrillateurs distinguent une
tachycardie
ventriculaire d’une tachycardie sinusale par son début brutal.
Ils la
distinguent d’une arythmie supra ventriculaire par sa stabilité
et la
dissociation auriculo-ventriculaire détectée par les
stimulateurs double
chambre [6].
Les sondes de stimulateur cardiaque
garantissent la
conduction des signaux
électriques pour assurer la stimulation ou la détection
cardiaque. Elles sont
composées d’une structure simple : un connecteur, un
conducteur et une
électrode
Les
sondes de stimulation sont composées d’un connecteur, d’un
conducteur et d’une
électrode. Le connecteur est celui qui lie la sonde de
stimulation au
stimulateur. Le conducteur assure l’arrivée du courant au cœur.
L’électrode est
l’élément en contact avec l’endocarde du cœur [7].
La
sonde est fixée par différents moyens. Initialement, il
n’y avait pas de
système de fixation, la sonde tenant place à l’apex
ventriculaire par le seul
fait de sa rigidité. Par conséquent, le taux de
déplacement des sondes et de
perforation myocardique restait important. Ensuite un cône de
silicone a été
conçu.
Aujourd’hui,
il existe deux types de sondes. La fixation passive et la fixation
active. La
première est basée sur la technique des excroissances du
matériau isolant
auprès de l’électrode distale. Ces excroissances sont
appelées barbes. Tandis
que la deuxième utilise la fixation par vis.
Grâce
à ces techniques de fixation, le déplacement des sondes
est très faible.
Cependant, les sondes à vis provoquent une petite
élévation de seuil de
stimulation au moment de l’implantation [7].
retour sommaire
II.3.2. La
polarité des
sondes
Les
sondes de stimulation sont de type unipolaire ou bipolaire.
Fig.7 :
Sonde unipolaire[5]
Dans
le type
unipolaire, l’électrode de la sonde agit comme un pole
négatif ou cathode.
Tandis que le boîtier de stimulation agit comme un pole positif
ou anode [7].
Fig.8 : Sonde
bipolaire[5]
En
configuration bipolaire, le pole négatif est situé
à l’extrémité de la sonde de
stimulation. Le pôle positif est situé entre 10 et 25 mm
en amont de
l’électrode (cf. Fig.8).
Les
deux pôles de
la sonde de stimulation bipolaire sont donc intracardiaques. Cependant,
dans le
système de stimulation unipolaire, le champ électrique
s’étend de l’électrode
de la sonde jusqu’au boîtier de stimulation [5].
Les avantages de la sonde
bipolaire sont:
Le
champ électrique est seulement intracardiaque et ne traverse pas
le thorax
comme dans le cas de stimulation unipolaire. En conséquence, les
signaux
d’origine musculaire n’ont virtuellement aucune interférence sur
la détection
bipolaire. Le risque d’inhiber le stimulateur ou de le
déclencher avec les myopotentiels
est minimisé. De même, la possibilité de
détection, des ondes T par une sonde ventriculaire et les ondes
R par une sonde
auriculaire, est atténuée. Enfin, les risques
d’interférences d’origine
extracorporelle sont moindres. À l’inverse, les contractions
musculaires
engendrées par la stimulation unipolaire ne sont pratiquement
jamais rencontrées
en stimulation bipolaire [7].
Les inconvénients de la
sonde de stimulation bipolaire sont :
Son
calibre est plus gros puisqu’elle comporte deux conducteurs
isolés. Ce qui
explique qu’elle soit beaucoup plus rigide et moins maniable que la
sonde
unipolaire.
Elle
ne peut pas être réparée en cas de fracture. Il
n’est pas recommandé de la
transformer en sonde unipolaire par abandon du conducteur
destiné à
l’électrode. Ceci peut provoquer l’altération de l’un des
conducteurs et par
conséquent l’altération de l’ensemble de la sonde [7].
Sur
l’ECG de surface, le pic de stimulation
peut avoir
une amplitude plus faible que celui de stimulation unipolaire. Ce qui
rend
difficile l’analyse du signal même en utilisant des filtres
particuliers.
L’amplitude
du signal cardiaque dépend donc de l’axe du dipôle de
détection par rapport à
l’axe de l’onde de dépolarisation. La détection peut
être compromise si l’axe
de dépolarisation d’un événement est
perpendiculaire au dipôle de détection de
la sonde.
L’intensité
du champ électrique est répartie entre les deux
électrodes de la sonde
bipolaire. Par conséquent, il est plus faible sur chacune des
électrodes que
l’intensité du champ électrique dans une électrode
dans une sonde unipolaire.
Pour réduire cette perte d’énergie, l’anode doit avoir
une grande taille et
être situé à grande distance de la cathode [7].
Le
connecteur de la sonde est en contact avec celui du stimulateur. Il est
indispensable de respecter une parfaite concordance entres les deux
systèmes.
Si cette concordance n’est pas fiable, il y aura risque de fuite de
courant
avec élévation des seuils de stimulation et de
détection.
Initialement,
la taille des connecteurs était de 6 mm puis 4,75 mm.
Actuellement, le diamètre
d’un connecteur est standardisé à 3,2 mm selon la
normalisation internationale
IS-1 L’avantage est la
réduction notable de la taille du système
spécialement en cas de sondes
bipolaires.
Ce
connecteur est composé de carbone ou platine qui ont une bonne
résistance
mécanique à long terme. La silicone constitue une couche
d’isolation qui couvre
le connecteur [4].
Fig.9 :
Connecteur d’une sonde de stimulation [4]
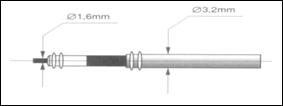
Le
standard IS-1 a un
diamètre de 3,2 mm au
niveau du connecteur et de 1,6 mm au niveau de la fiche terminale. Les
bagues
d’étanchéité sont sur la sonde. Le
réceptacle du stimulateur peut contenir ou
non des bagues d’étanchéité [7].
Le
conducteur est de multifilaire et hélicoïdal. Il assure une
grande flexibilité
et une plus bonne résistance mécanique que les sondes
monofilaires.
L’acier
inoxydable a été abandonné en raison de forte
tendance à la corrosion. Puis, il
a été remplacé par le platine iridium, le carbone
ou l’elgiloy.
Ce dernier est un alliage de cobalt, nickel, molybdène,
manganèse, chrome et
fer. Tous ces matériaux ont une meilleure résistance
à long terme. La
résistance électrique des sondes modernes est très
faible, de l’ordre de 10
Ohms.
Le
matériau isolant est d’une importance primordiale. Il doit
être biocompatible,
d’une parfaite tenue mécanique et chimique à long terme.
En plus, il ne doit
pas favoriser la thrombogénicité.
Il est constitué de
silicone ou de polyuréthane [4].
La
silicone possède d’excellentes biocompatibilité,
flexibilité et résistance
mécanique. Cependant, elle doit être épaisse car
elle se déchire facilement
mais elle est réparable. Par ailleurs, son indice de friction
est important.
Ainsi, deux sondes en silicone introduites par une petite veine sont
difficiles
à manipuler. Des traitements de surface à l’étude
peuvent supprimer cet
inconvénient [7].
Le
polyuréthane de dureté 80A utilisé dans les
premiers modèles de sondes a été
l’objet des ruptures. Des craquelures en surface résultant d’un
refroidissement
inégal de l’isolant lors de la fabrication ou bien à une
oxydation interne par
les sels d’argent.
Le
polyuréthane de dureté 55D est un matériau offrant
une grande résistance, un
faible indice de friction, une faible épaisseur. Par
conséquent, les sondes
sont de plus petits calibres que celles à la silicone. Par
contre, il reste
rigide et non réparable [4].
L’électrode
est l’élément en contact avec l’endocarde. Elle joue un
rôle important dans la
stimulation et la détection cardiaque. La forme, la surface et
le matériau
constituent les principales caractéristiques de
l’électrode.
L’objectif
des constructeurs du stimulateur cardiaque est d’optimiser la
consommation
d’énergie délivrée par la pile du pacemaker. Pour
cela, une diminution de la
surface de stimulation diminuera le seuil de stimulation et par
conséquent il y
aura une baisse de consommation d’énergie. Par contre, la
diminution de la
surface de contact avec le cœur va augmenter les pertes par
polarisation. Ces
pertes sont dues au mouvement massif des ions de sodium vers
l’électrode
pendant la stimulation, ainsi qu’au type du matériau
utilisé. De plus, la
diminution de la surface de l’électrode va aussi diminuer la
surface de
détection, ce qui n’est pas souhaitable [7].
Pour
résoudre ces problèmes les constructeurs ont mis en place
une surface poreuse
qui minimise la perte par polarisation en améliorant
l’efficacité de la
détection. En fait, au niveau des pores d’un matériau,
les charges électriques
géométriquement opposées s’annulent.
L’électrode est naturellement microporeuse
avec le carbone vitreux. Cependant, un matériau peut être
rendu
artificiellement poreux par la perforation au laser.
Fig.10 :
Sonde en
stimulation [5]
Ces
deux figures montrent bien la surface de l’électrode en
stimulation et en
détection. En stimulation, la surface est minimisée afin
de diminuer le seuil
de stimulation et la consommation d’énergie. Cependant en
détection, la surface
est maximisée afin d’augmenter la capacité
d’écoute [7].
Fig.11 :
Sonde en détection[5]
Un
constructeur a crée des électrodes munies d’un
réservoir central d’un
milligramme de dexaméthose sodium
phosphate fixé sur
silicone à diffusion passive [4]. La diffusion
est locale et non
générale. Le rôle
de ces électrodes est la réduction de la durée de
la réaction inflammatoire
dans l’interface cœur - électrode. Ce type des sondes est issu
de la famille
des sondes appelées sondes à stéroïdes [4].
Au
total, Les
avantages apportés par la porosité d’une électrode
sont: une faible
polarisation, une réaction inflammatoire plus faible, une
meilleure
colonisation de l’électrode par l’endothélium, une
impédance de détection plus
faible et un seuil de stimulation plus faible.
Les
sondes de
défibrillateur cardiaque implantables sont plus
sophistiquées que les sondes de
stimulation puisqu'elles transmettent un courant de 35 A du
boîtier au cœur
sous une tension de 800 Volts environ. Elles sont constituées
d'une électrode de
stimulation et d'une ou de deux électrodes de
défibrillation ou coils.
Généralement, les mêmes matériaux
biocompatible s
sont utilisés pour les sondes de stimulation et de
défibrillation.
Fig.12 : Isoline sonde à double coil [8]
En
effet, trois
principaux éléments sont caractéristiques d’une
sonde de défibrillation de
point de vue technique:
- Sa structure interne.
- Sa fixation.
- Ses coils de défibrillations.
II.4.1.
Structure
interne
Les sondes sont
fabriquées en silicone et polyuréthane. Une sonde
coaxiale est composée de
trois conducteurs concentriques:
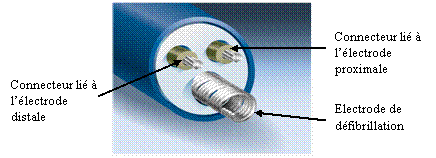
Fig.13 :
Structure
interne de la sonde Isoline [8]
Le
premier est
connecté à la l'éléctrode
distale, le deuxième à
l'électrode proximale et le troisième au coil
ou
électrode de défibrillation (cf.
figure 13). La
stimulation et la détection
sont assurées par les deux premiers conducteurs. [9]
La
nouvelle
technologie du silicone multi
lumière ouvre plusieurs
possibilités pour les sondes où le courant circule en
parallèle dans les
conducteurs. La conception du silicone multilumière permet une réduction
de diamètre des corps de
sondes qui peut améliorer la maniabilité des sondes et
diminuer aussi leur
tassement et leur usure.
Il
peut y avoir des
lumières vides dans la sonde conçues pour concentrer
l'effort entre les
lumières de conducteurs et les lumières
supplémentaires et non entre les
conducteurs eux mêmes [10].
La
forme isodiamétrique des sondes
avec le plus petit nombre de
transitions possibles jouent un rôle important et facilitent
l'insertion, le placement
et l'extraction des sondes [8].
La
fixation des
sondes de défibrillation est identique à celle des sondes
de stimulateur
cardiaque. Il existe deux types de fixation : active à vis
et passive à
barbes.
Avec
les sondes à
barbes le seuil de la stimulation est bas et stable. Cela signifie une
optimisation importante dans la consommation d’énergie. La
plupart des médecins
implantent ce type de sonde mains chez quelques patients la fixation
à l’apex
peut être difficile pour des contre indications [8].
La
structure de
défibrillation doit être bien conçue afin de
réduire au maximum le seuil de la
défibrillation ventriculaire. De ce point de vue, le
boîtier du défibrillateur
est utilisé comme électrode de défibrillation. Le
boîtier en titane est comme
une électrode de surface continue de basse résistance qui
permet une
défibrillation plus efficiente par la diminution de la
résistance d’impulsion
et l'augmentation de la densité de courant en retour [9].
Le
boîtier actif
offre deux différentes configurations pour la
défibrillation ventriculaire: une
configuration à deux électrodes et une autre avec trois
électrodes. Pour la
première, seul le coil du
ventricule droit et le
boîtier sont actifs, pour la seconde, il y a en plus le coil
de la veine cave supérieure pour mieux couvrir la zone du
ventricule. La
configuration à trois électrodes peut être
réalisée par une sonde à double coils
comme la sonde Isoline
d'Ela médical. Cette configuration a
réduit le seuil de
défibrillation ventriculaire de 10 Joules à 7-8 Joules [10].
Le
coil du ventricule a une longueur de 5 cm
environ pour
éviter qu'une partie entre à l'intérieur de
l'oreillette droite. Cependant, le coil de
la veine cave supérieure a une longueur de 7-8 cm
pour assurer une grande surface électrique. Pour la sonde
à double électrode,
il est important d'avoir une double connections proximale et distale
pour
assurer un équilibre dans l'énergie de
défibrillation fournie [10].
La
distance entre
l'apex et le coil du ventricule droit
s'appelle
"pullback". Ce dernier est influencé
par la
bipolarité de la sonde. Le pullback
d'une sonde à
dipôles indépendants avec deux électrodes
identiques au modèle bipolaire (cf.
figure 5) est plus grand qu'une sonde à dipôles
intégrés où le signal est
détecté par l'extrémité distale du coil de
défibrillation. La réduction du pullback
permet
d'améliorer la distribution du courant dans l'apex et d'avoir un
faible seuil
de défibrillation. Des études cliniques sur des animaux
ont montré que
l'augmentation du pullback de 2 cm permet
de relever
le seuil de défibrillation à 61% [10].
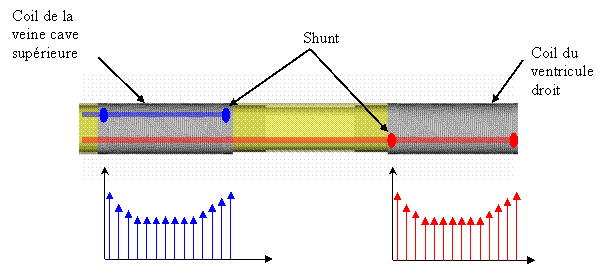
Fig.15 :
Répartition du
courant sur les coils de défibrillation [8]
Pour
qu'un choc de
défibrillation soit efficace, il faut délivrer une
énergie qui pénètre l'apex
le plus profondément possible afin d'obtenir la plus grande
distribution du
gradient de tension dans le cœur. Alors il est important de se statuer
sur la
méthode de terminaison du fil conducteur de l'électrode
distale.
Des
études ont
montré que les coils avec shunt
permettent de générer
un maximum du gradient de tension dans l'apex. Les coils
sans shunt délivrent moins que 7% du gradient de tension dans
l'apex comparé à
un coils avec shunt. La figure ci dessus
montre bien
une meilleure distribution de densité de courant tout en long du
coil [8].
Une
sonde de
défibrillation fiable est une sonde caractérisée
par: un faible seuil de
défibrillation, une meilleure maniabilité, un double coils
pour permettre de délivrer des chocs atriaux avec
différentes configurations,
une grande efficacité dans la stimulation et un petit
diamètre du corps de
sonde [8].
II.5.
Complications
liées
aux sondes
Les
complications peuvent être les déplacements secondaires,
les modifications des
seuils de stimulation et de détection et la rupture d’isolant et
de continuité
électrique.
II.5.1. Déplacements
secondaires
Ils
sont dus à une fixation fragile de sonde au niveau de son
introduction dans la
veine. Ils engendrent des pertes de détection et de stimulations
associées à
une élévation de l’impédance de stimulation. Par
conséquent, la sonde est
attirée vers son pôle proximal et de dégage de sa
fixation myocardique. Lors du
ré intervention, la partie de la sonde incluse dans la loge du
stimulateur doit
être soigneusement examinée. Les sondes dont leur isolant
ou leur conducteur
sont altérés seront plus utilisées. De même,
une sonde qui s’est enroulée sur
elle-même peut avoir des points de faiblesse mécaniques
qui entraînent des
complications plus tard.
Quel
que soit le mécanisme de son déplacement, il est rare de
devoir changer la
sonde par une sonde a fixation passive [4].
Plusieurs
paramètres peuvent modifier les seuils de stimulation et de
détection, tels que
les fluctuations physiologiques et les réactions inflammatoires.
Leur remède
est un traitement corticoïde qui n’apporte qu’une
amélioration temporaire. Par
contre, certaines élévations de seuil sont liées
à des perturbations
métaboliques comme le diabète dont la correction restaure
la situation
préalable. De même, les niveaux de seuils peuvent
être altérés par le
développement d’une cardiopathie comme un infarctus du myocarde.
A
part les causes aigues transitoires facilement reconnus, il faut avant
tout
suspecter une fracture du conducteur ou une rupture d’isolant [7].
retour sommaire
II.5.3. Rupture
de
continuité électrique
C’est
la cause la plus fréquente d’élévation des seuils
à la phase chronique. Une
fracture du conducteur à la sortie du connecteur du stimulateur
peut provoquer
une rupture de continuité électrique. Il en
résulte des plicatures de la sonde
au niveau de la jonction du connecteur rigide avec la partie souple de
corps de
sonde
[8].
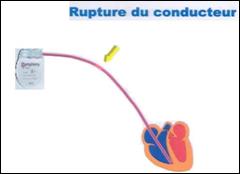
La fracture de la sonde
est
beaucoup plus rare
depuis que les sondes sont multifilaires. Elle entraîne une perte
d’efficacité
de stimulation et de détection. Les pics de stimulation peuvent
être totalement
absents sur l’ECG de surface.
L’impédance sur sonde
est très élevée, voire infinie [8].
S’il
ne s’agit que
de la fracture du conducteur anodique d’une sonde bipolaire, les
fonctions monopolaires peuvent être
respectées. Cependant cette
préservation de la conduction électrique cathodique
n’autorise pas à garder la
sonde. Elle doit être impérativement changée. La
fracture de conducteur peut
être visible en radiographie en un point quelconque du trajet de
la sonde.
Les
sondes de
stimulation épicardiques sont moins
fiables que les
sondes endocavitaires. Il faut donc les
surveiller
plus attentivement après dix années de fonctionnement ou
même les changer
systématiquement après ce délai [4].
retour sommaire
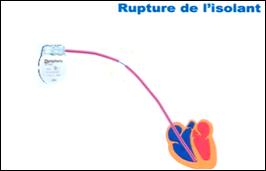
II.5.4. Rupture
d’isolant
Une
rupture d’isolant va se manifester diversement. Une stimulation
musculaire est
née lorsque la fuite du courant, induite par le défet
d’isolation, est située
sur le trajet de la sonde. Typiquement, il s’agit d’une stimulation
pectorale.
Le
diagnostic différentiel est une infiltration de liquide
physiologique dans le
connecteur du stimulateur par défaut
d’étanchéité. Cette complication peut
obliger à la ré intervention
pour assurer une
meilleure étanchéité. Elle peut être
évitée si la compatibilité des connecteurs
est respectée entre le stimulateur et la sonde [8].
Un
autre élément diagnostique de rupture d’isolant est électrocardiographique.
Si le défaut d’isolation se situe sur le conducteur à
destinée anodique,
l’augmentation notable de l’amplitude de pic de stimulation est
très suspecte.
Si le défaut d’isolant est interne entre les deux conducteurs
anodique et
cathodique, le court circuit empêche l’arrivée d’une
quantité de charge
importante au niveau des électrodes. Ceci est expliqué
par une amplitude très
faible de pic de stimulation sur l’ECG.
Ces
différents éléments impliquent une chute de
l’impédance de stimulation de plus
de 20% par rapport à la mesure en état stable [8].
Une
fracture d’isolant entraîne une diminution de l’impédance
totale de
circuit. L’absence d’isolant en un point quelconque de la sonde
provoque un
court circuit. Il en résulte une augmentation de la consommation
d’énergie du
stimulateur. De plus, du fait de la fuite du courant et compte tenu de
la
stabilité du niveau d’énergie minimale à la
stimulation efficace, le seuil de
stimulation s’élève [4].
Une abrasion de cet isolant peut
entraîner
aussi sa rupture. Ce problème d’abrasion fait l’objet de mon
sujet de stage et
sera expliqué dans les paragraphes suivants.
Les
sondes
implantées dans le corps humain sont soumises à de fortes
contraintes
mécaniques telles que l'érosion et l'usure. Pour faire
face à cela, la sonde
est fabriquée en silicone, un matériau biocompatible qui
assure une bonne
isolation de la sonde afin d'éviter la variation de
l'impédance
endocarde/électrode. Par contre ce
silicone ne possède
pas une bonne résistance à l'usure, d'où
l'importance d'étudier ses
caractéristiques d'abrasion sur plusieurs matériaux.
L'objectif
de mon
stage est de quantifier l'abrasion de sondes cardiaques
fabriquées en
élastomère et plus précisément en silicone
contre le boîtier en titane du
défibrillateur cardiaque implantable ou même contre
d'autres polymères comme le
polyuréthane.
retour sommaire
Les
sondes de
stimulation ou de défibrillation cardiaque ont une longueur
standard de 650 mm
environ. Pendant l'implantation, les cardiologues enroulent
l'excédent de la
sonde autour du boîtier en titane afin de protéger
l'électrode, fixée dans
l'endocarde, de tout risque de torsion. Alors il y a contact entre
boîtier en
titane et sonde en silicone, les mouvements respiratoires et les
battements
cardiaques sont suffisants pour que le frottement de l'interface
silicone/titane provoque l'usure de l'isolant et par la suite
l'arrêt du
fonctionnement du défibrillateur.
En
effet, il existe
d'autres types de frottements schématisés par l'interface
silicone/silicone ou
clavicule /sonde. Ils sont considérés secondaires par
rapport à l'interface
silicone/titane.
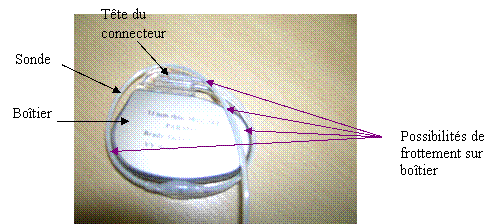
Configurations possibles et environnement de la sonde
Le schéma
suivant montre les différentes
configurations possibles de contact entre la sonde et son boîtier.
D'après
cette
configuration, les paramètres d'abrasion suivants ont
été considérés:
- Course: environ
de 3 à 4 mm
- Nombre
de
tours : 82000 à 620 000 000 de
cycles
- Fréquence
souhaitable: 1 ou 2 Hz
- Force
fixe de l'ordre
de 5 à 10 g
- Température
ambiante: 37°C
- Immersion
avec
une solution saline Na cl 9 g.l-1.
Ces paramètres sont
essentiels pour la rédaction d'un cahier de charges.
Le
cahier de
charges permet d'identifier notre besoin réel et de
déterminer les fonctions de
la machine d'abrasion ainsi que d'expliciter les exigences de chaque
fonction
prévue.
VI.
Banc
d'abrasion
existant
Un
banc a été conçu
il y a plusieurs années par le service étude et outillage
mécanique. Cependant les
résultats obtenus avec ce banc n'ont jamais été
satisfaisants.
VI.1.
Description
Ce
banc est composé
de plusieurs éléments :
- Un moteur de
translation qui fait déplacer horizontalement un chariot en
inox. Ce dernier
porte une barre de matériau abrasif qui vient frotter sur des
échantillons de
sondes fixées sur une plaque en bois. Une charge de dizaines de
grammes centrée
au milieu du chariot applique une force constante lors du frottement.
- Un compteur pour
compter le nombre d'aller retour du chariot.
Fig.19 :
Banc d'abrasion existant [11]
- Un courant
électrique passe dans le fil conducteur des échantillons
de sondes lors de la
manipulation. Une fois l'isolant est totalement usé, un rack I/O
relié à un PC
détecte une fuite de courant et fait arrêter le moteur. De
cette façon, le PC
mémorise le
nombre d'aller retour effectué pour l'usure totale.
Tout
l'ensemble du
banc est immergé dans un récipient rempli de solution
saline Na Cl 9g/l pour
simuler l'environnement du cœur [11].
Les points critiques de ce banc
sont :
- Le matériau utilisé
comme outil abrasif a un état de surface très rigide par
rapport aux
élastomères.
- Le poids du chariot
est lourd.
- La charge appliquée
sur le chariot n'est pas répartie sur toute la surface
abrasée, elle est plutôt
centrée au milieu.
- L'abrasion de deux
échantillons de sondes se fait en même temps contre le
même matériau abrasif
avec une force non identique sur toute la surface. Cela ne permet pas
de
comparer la résistance à l'abrasion des deux
échantillons.
- Lors des essais, une
déchirure de l'isolant des échantillons apparaît
toujours avant de détecter une
abrasion.
Pour
cela, il a été
décidé de concevoir un banc ou d'acheter un autre banc
adaptable à nos besoins
tout en respectant le cahier de charges.
En
cherchant des
informations sur les normes d'abrasion dans les laboratoires
extérieures et en
demandant plus précisément des renseignements sur les
exigences d'abrasion de
la FDA auprès de la filiale d'Ela
médical aux Etats
Unis, un banc d'abrasion a été trouvé dans cette
filiale. Ce banc était conçu
pour évaluer la résistance à l'abrasion des sondes
de cœur gauche entre elles.
Il a été demandé donc de l’expédier
à Ela médical en
France pour que je puisse l'étudier et voir s'il est adaptable
à notre besoin
sachant qu'aucun plan ou documentation ne m’a été
transmis avec ce banc et que
son concepteur est décédé depuis l’année
2004.
VII.1. Description
VII.1.1.
Le
modèle d'abrasion
Hypothèse:
Les frottements entre les sondes de
défibrillation
cardiaque et le Cœur entraînent une abrasion de force constante,
alors la même
quantité d’isolant est usée à chaque cycle de
frottement.
Pour
projeter la
durée de vie d’une sonde, il faut déterminer la
profondeur de l’abrasion à un
temps donné où le conducteur intérieur sera
exposé. Pour cela, il faut
comprendre la variation de la profondeur d’abrasion en fonction du
temps.
L’hypothèse ci dessus indique que l’abrasion se produit avec une
force
constante et que la même quantité d’isolant
disparaît à chaque cycle de frottement.
Cela ne signifie pas que la profondeur d’abrasion augmente constamment
dans le
temps parce que la forme de la sonde est cylindrique. En effet, comme
l'abrasion progresse, la superficie soumise à l’abrasion
augmente ayant pour
résultat une diminution de force par unité de surface
abrasée ainsi qu’une
diminution semblable en profondeur.
Cependant,
la
relation entre la quantité d’isolant disparue et la profondeur
d’abrasion peut
déterminer la résistance au frottement de la sonde.
Figures
1 et 2 permet
de comprendre la relation entre la profondeur de l’abrasion et le
matériau
abrasé.
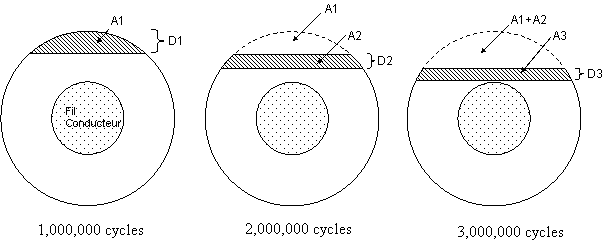
Fig.20 :
Segment de la
sonde abrasée[12]
Le
schéma ci dessus
montre un segment de la sonde abrasée ainsi qu’une coupe
verticale de cette
abrasion avec sa profondeur D et la surface usée A.
- À
1,000,000 cycles, une abrasion de profondeur
D1 est produite. A1 indique la surface totalement abrasée.
- À
2,000,000 cycles, la quantité
abrasée A2 est égale à A1, la surface
abrasée à 1,000,000 de cycles. Cependant, la profondeur
abrasée D2 est plus petite que la profondeur D1.
- À
3,000,000 cycles, la même
quantité A3 a disparu, avec une profondeur D3 encore plus petite.
Fig.21 : La
progression
de l’abrasion[12]
Le
schéma ci dessus
présente une hypothèse montrant la progression de
l’abrasion à travers une
section verticale de la sonde. Il renforce le concept que la même
quantité
d’isolant est enlevée à chaque cycle, la vitesse de la
pénétration diminue.
Chaque schéma montre l’abrasion après un nombre identique
de cycles ou battements
de cœur.
Pour
calculer la
résistance de la sonde à l’abrasion, il faut trouver la
relation mathématique
entre la quantité de l’isolant usée A et la profondeur de
l’abrasion D.
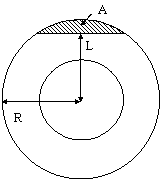
l’équation suivante donne la réduction en surface de
section de coupe en
fonction de la profondeur de l’abrasion [12].
Equation:
A = R2 * arccos
(L/R) – L * sqrt (R2
– L2)
En
appliquant
l'équation ci dessus, la profondeur de l'abrasion est
donnée en fonction de la
quantité de l'isolant usé.
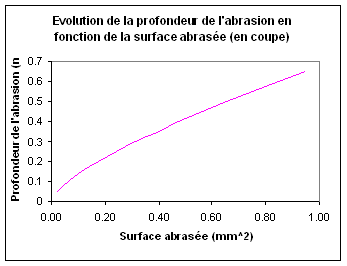
Fig.23: La
profondeur de
l'abrasion en fonction de l'isolant abrasé [12]
Dans
le cas
suivant, une sonde de diamètre 2,23 mm avec 0,65 mm
d'épaisseur est utilisée.
La courbe est limitée à 0,65 mm parce que
l'épaisseur de la sonde est
totalement usée à ce point. Cette courbe montre que la
quantité d'isolant usée
par cycle est constante et la vitesse de la pénétration
dans la sonde ralentie.
La
quantité du matériau
abrasée est constante par cycle ainsi que la vitesse de
battements du cœur, la
courbe ci dessus peut être modifiée pour montrer la
profondeur de l'abrasion en
fonction du temps [12].
Fig.24:
La profondeur de
l'abrasion en fonction du temps [12]
Cette
courbe est
identique à la courbe précédente. Pour trouver la
relation entre le temps et la
surface abrasée, il a été supposé que
chaque 0,01 mm2 de l'isolant
est enlevé chaque 1,000,000 de cycles
et que le cœur
bat à 60 battements par minute. Avec cette donnée ce
graphe a été tracé. Alors,
selon cette courbe, la résistance à l'abrasion de la sonde
est estimée à 37 mois parce
qu'elle
correspond à 0,65 mm de pénétration.
En
connaissant la
relation entre la profondeur de l'abrasion et la quantité
d'isolant abrasée et
en assurant que l'isolation est abrasée avec une vitesse
constante, la
résistance à l'abrasion d'une
sonde peut être
projetée avec un seule abrasion effectuée. Par
exemple, dans le cas où il est connu qu'après trois mois
d'abrasion, la profondeur
de l'abrasion est à 0,05 mm. En connaissant, le diamètre
d'origine de la sonde
2,23 mm, l'équation (cf. figure 22
) permet de calculer que 0,05
mm correspond
à 0,02 mm2 de surface abrasée en coupe
verticale de la sonde.
L'épaisseur de l'isolant est de 0,65 mm, au delà de cette
profondeur il y a
rupture d'isolant. De même, d'après l'équation
précédente, 0,65 mm de
profondeur correspond à 0,95 mm2 de réduction
en unité de surface
par coupe verticale de la sonde. Alors si 0,02 mm2 sont
abrasés en 3
mois, ma sonde résistera 143 mois pour abraser 0,95 mm2.
La
machine
d'abrasion est utile parce qu'elle permet d'accélérer le process
d'abrasion ainsi que de vérifier le modèle d'abrasion
présenté dans le
paragraphe précédent.
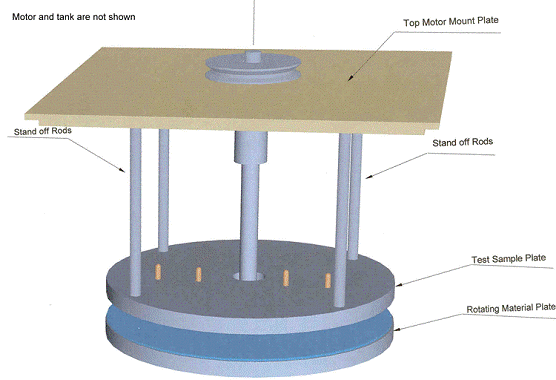
Fig.25 : Machine
d'abrasion en vue oblique[12]
La
machine est
composée de deux disques placés l'un sur l'autre et
séparés d'une distance de 1
inch. Le disque supérieur est
fixé par des tiges le
reliant au plateau supérieur du moteur. Les échantillons
de sondes sont montés
sur le disque stationnaire dans les trous. Un arbre
d'entraînement passe du
moteur, par un trou dans le plateau, et se relie disque tournant. Ce
dernier
tient une feuille plate de matériel contre laquelle les
échantillons d'essai
frottent. Un compteur dépiste le nombre de révolutions du
disque tournant. Tout
l'ensemble est immergé dans une solution saline [12].
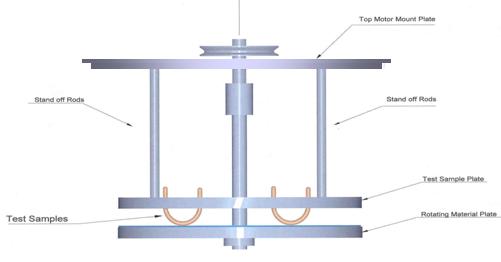
Fig.26: Machine
d'abrasion en
vue de face[12]
Dix
segments de
sondes sont placés dans le disque stationnaire et ajustés
en utilisant un
capteur de force pour qu'elles exercent une force de 5 g quand la
déflection
est de 1 inch. La force de contact entre
la sonde et
le disque est considérée minime et estimée
à 5 g. La distance entre les deux
disques doit être aussi de 1 inch.
Durant
le test, la
machine sera stoppée plusieurs fois suivant des intervalles
prédéterminés et
deux de dix échantillons seront enlevés. La profondeur
d'abrasion sera mesurée
par le microscope pour chacun d'eux. A la fin de test, deux
échantillons seront
abrasés jusqu'à l'abrasion totale de l'isolant [12].
Le banc d’abrasion est
qualifié par une étude
de répétabilité et de
reproductibilité [13].
L’objectif de cette étude
est de mesurer
l’aptitude d’un système de mesure. En effet, elle permet de le
déclarer capable
ou non selon certains critères.
Cette
étude a été
réalisée selon le protocole suivant :
- La caractéristique
à
mesurer est la profondeur de l’abrasion.
- Prendre cinq
échantillons au hasard de la partie connecteur des sondes
cardiaques.
- Faire mesurer la
caractéristique sur ces cinq échantillons par un premier
opérateur.
- Faire recommencer
deux fois cette série de 5 mesures.
- Faire de même
avec
le deuxième opérateur.
- Renseigner
le nombre
de pièces N, le nombre de répétition T et le
nombre d’opérateurs Op.
- Enregistrer les
résultats dans le tableau excel.
VII.2.1. Mode opératoire
Les
mesures de répétabilité
et de reproductibilité du banc reposent sur
les conditions suivantes :
- Les
mesures de répétabilité
sont effectuées en même temps sur le banc par le
même opérateur avec le même nombre de tours sans
modifier le positionnement des
sondes, sans variation des paramètres de la machine comme la
fréquence du
moteur et sans démonter les deux disques.
- Les
mesures de la
profondeur de l’abrasion s’effectuent à l’aide du microscope.
retour sommaire
Les
résultats de répétabilité
et de reproductibilité du banc d’abrasion sont
synthétisés par le tableau suivant :
|
Composante
|
Contribution en %
(connecteurs DF-1)
|
Contribution en %
(connecteurs IS-1)
|
|
Répétabilité
|
6,33 %
|
4,67 %
|
|
Reproductibilité
|
94 %
|
44 %
|
|
R et R
|
17,62 %
|
7,15 %
|
|
Pièces
|
32%
|
90%
|
Tableau
1 : Résultats de l’étude de répétabilité
et de
reproductibilité
Un
système de
mesure est capable si le taux de Répétabilité
et de
Reproductibilité est inférieur à 10%. Il est
considéré aussi capable si ce taux
est inférieur à 30 % et l’amélioration du
système de mesure est impossible.
La
composante répétabilité
représente une contribution inférieure à 10%
pour les deux types de connecteurs utilisés, cela indique que le
banc
d’abrasion est performant. La composante reproductibilité est
élevée parce que
les échantillons abrasés par le premier opérateur
ne peuvent pas être
réutilisés par le deuxième opérateur, elles
sont détruites. Pour cela, le
deuxième opérateur utilise d’autres échantillons
mais de mêmes
caractéristiques. Ceci est traduit par une contribution
élevée pour la
composante des pièces choisies. Dans l’ensemble, le
système de mesure est
adéquat car le taux de R&R est inférieur a 30% et le
banc d’abrasion est
alors capable.
Ces
tests ont aussi
montré que le silicone SMCT124 utilisé dans les
connecteurs DF-1 est moins
résistant à l’abrasion que le silicone SMCS430
utilisé dans les connecteurs
IS-1 pour le même nombre de tours effectués. Pourtant, le
premier a une
épaisseur de 0,85 mm tandis que le deuxième a 0,35 mm
d’épaisseur.
Le
nouveau banc
d’abrasion est validé par la comparaison de deux tubes de
silicone de
différents grades de dureté. Le
silicone SMCT124 et le
silicone SMCS 430. Ce dernier est connu plus résistant à
l’abrasion que le
premier.
L’objectif
est de
comparer l’état d’abrasion de chaque tube contre la même
couche abrasive avec
la même force appliquée et le même nombre de cycles
d’abrasion et de s’assurer
que le silicone SMCS 430 est le plus
résistant.
Résultats
Les
résultats de
cette validation sont donnés et expliqués dans l’annexe
2. Pour 47200 de cycles
d’abrasion avec 5 grammes de force appliqués contre du
polyuréthane, la surface
abrasée en coupe du tube silicone SMCS 430 est 5 fois plus
petite grande que la
surface abrasée du tube SMCT124. Cela montre que le
silicone SMCS 430 est 5 fois plus résistant que le silicone
SMCT124.
VIII. Autre
solution pour caractériser l'abrasion
VIII.1. Description
L’abrasimètre
linéaire 5750 de Taber
Industries permet de tester la résistance à l’abrasion
des produits finis de
toute taille et de toute forme. Il utilise un outil abrasif
monté sur un axe
flottant permettant de suivre le contour des pièces et
autorisant ainsi les
essais sur produits finis. Peu importe leurs tailles et leurs formes,
l’abrasimètre linéaire est idéal pour tester les
plastiques et les élastomères.

Une table de positionnement en option facilite le
positionnement des petites pièces ou des objets de forme
complexe. De plus, des
têtes d’essai optionnelles permettent de convertir
l’abrasimètre linéaire en
appareil d’essai à la rayure ou en Crockmeter.
L'abrasimètre linaire contient une tête support
pour
tampons, des poids de 250 g chacun, dix tampons abrasifs Cs-10, cinq
tampons
abrasifs H-18, un gabarit de profondeur des abrasifs, brosse.
Il utilise des outils abrasifs WearaserTM.
De forme et de taille similaire à un stylo gomme, les outils WearaserTM sont constitués des composants
abrasifs utilisés
dans la fabrication des meules utilisées dans le monde entier.
Il fournit des
résultats d’essai cohérents et représentatifs par
l’utilisation des outils
abrasifs Taber reconnus comme
référence
internationale. Cet abrasimètre suit la norme ASTM D4060.
Grâce aux ajustements des longueurs
d’évaluation, de
la vitesse, de la charge appliquée et par l’utilisation d’une
grande variété
d’outils abrasifs WearaserTM,
l’abrasimètre linéaire
permet de personnaliser les essais selon notre cahier de charge [14].
Quelques
caractéristiques de l’abrasimètre linéaire :
- Longueurs
d’évaluation variables : 1,25 ; 2,5, 5 ; 7,5 ; 10
cm.
- Vitesses
variables : 2, 15, 25, 40, 60 cycles par minute.
- Charges
variables
de 350 à 1600 grammes par incréments de 250 g.
VIII.2. Protocole
d'essai
Des
échantillons de
sondes sont envoyés chez Taber
Industries aux Etats
Unis pour effectuer des essais permettant de statuer sur les
résultats
d’abrasion obtenus par cet abrasimètre. En parallèle, un
agent commercial de
chez Taber nous a effectué une
démonstration sur la
machine pour comprendre son principe de fonctionnement.
Les
essais
d’abrasion se font entre la partie connecteur des sondes et le
boîtier de
défibrillateur en titane.
La
difficulté de
ces essais réside dans la fixation du boîtier et des
sondes dans une solution
saline. L’ingénieur d’application de Taber
industries
essaie de trouver une solution pour ce problème.
Les
tests
d’abrasion des sondes cardiaques contre le boîtier en titane par
la machine d’abrasion
de Taber Industries sont en cours
d’évaluation et les
résultats sortiront dans les prochains jours.
IX. Transfert
du site de
la stérilisation des sondes Swift
Confidentiel
Le
nouveau banc
d’abrasion a été validé et considéré
capable suite à l’étude de répétabilité
et de reproductibilité. Le matériau abrasif
utilisé dans toutes les mesures effectuées
précédemment par ce banc était le
polyuréthane. Dans le but d’évaluer l’abrasion des sondes
cardiaques contre
leur boîtier en titane, un disque de titane a été
commandé chez le sou traitant
d’Ela medical
aux états
unis. Les tests d’abrasion des sondes en silicone contre le titane vont
permettre au service Recherche et Développement des sondes de
prévoir la durée
de vie d’une sonde implantable. Enfin, une instruction d’utilisation de
ce banc
doit être rédigé pour faciliter son utilisation aux
opérateurs.
En
ce
qui concerne
le transfert du site de la stérilisation des sondes Swift, il a
décidé
d’effectuer la stérilisation chez Bioster
en Italie
après négociation du contrat avec l’entreprise Osypka
en Allemagne. Une comparaison entre la sonde Swift et la nouvelle sonde
Isoline a été faite afin
d’alléger les tests de validation
de la stérilisation. Les tests de validation devraient commencer
dans les jours
à venir.
Conclusion
La
stimulation
cardiaque est une des méthodes thérapeutiques les plus
efficaces en
cardiologie. De plus, sa technique d’implantation est simple, peu
douloureuse
et rapide.
La
résistance à l’usure des sondes cardiaques est
caractérisée par un banc
d’abrasion. L’étude de répétabilité
et de
reproductibilité a montré que ce banc est capable. Le
banc a été validé par
comparaison entre deux tubes identiques de silicone mais de
différentes
duretés. Les résultats d’abrasion des sondes contre du
polyuréthane ont montré
que le silicone SMCS430 est plus
résistant que le
silicone SMCT125. En effet, des tests sont en cours d’exécution
pour déterminer
l’état d’abrasion des sondes cardiaques contre leur
boîtier en titane.
Le
transfert de la stérilisation des sondes appelées Swift
m’a permis de rédiger
un plan de développement pour planifier les tâches et
impliquer la
responsabilité de chaque service dans ce transfert. Il a
été décidé de
transférer la stérilisation chez Bioster
en Italie.
Dans le but d’alléger les tests de validation de la
stérilisation des sondes
Swift, une comparaison technique a été faite entre la
nouvelle sonde Isoline et la sonde Swift.
Cette comparaison a prouvé que
tous les éléments en contact avec le sang de la sonde
Swift sont similaires à
ceux de la sonde Isoline et par la suite
tous les
résultats positifs des essais sur Isoline
restent
valables sur Swift. Cela a permis de réduire
énormément le temps et le coût de
ces tests.
retour sommaire
Références bibliographiques
[1]
Brochure commerciale,
Sorin group: at
the heart of medical technology. Et
le site web du groupe Sorin: http://www.sorin.com/eng/corporate_aboutus.asp?NC=68224
[2] VIALATTE François benoît, rapport
de stage fin d’études, master SCIA, septembre 2002
[3]
ELA medical,
Organisation chart of
Business Unit Cardiac Rhythm Management, Novembre 2005.
[4] RITTER Philipe, FISCHER Wilhelm,
Pratique
de la stimulation cardiaque, Springer–Verlag,
Paris, 1997.
[5] ELA Medical, Les bases de
la stimulation
cardiaque, Cours atelier initiation, Paris, 2003.
[6]
G.E Antoniolli,
Pacemaker
Leads 1997, Monduzzi Editore,
Proceedings of the third International Symposium Pacemaker Leads, Ferrera, Italie,
11-13 Septembre 1997.
[7]
E. Kulbertus,
Hein
J.J. Bourgeois & coll, Atrial
Fibrillation, Facts from yesterday – Ideas for tomorrow, Henri l, Bakken Research Center Series, publishing
company, New york,
1994.
[8]
J. Claude Daubert,
Alain Ripart & coll, Prevention of Tachyarrhythmias
with Cardiac Pacing, Futura
publishing company, New york,
1997.
[9] S. Serge Barold
& Jacques Mugica, Recent
Advances in cardiac Pacing, goals for the 21 st Century, Futura
publishing company, New york,
1998.
[10] A.E.Aubert, H.
Ector & coll, Cardiac
Pacing and
Electrophysiology, A bridge to the 21 st
century,
Kluwer Academic Publishers, Dodrecht,
the Netherlands,
1994.
[11] ELA medical, Direction des
études et du
développement mécanique, Mesure de l’usure des sondes
cardiaques, Meter 62B.
[12] ELA
medical, Supplement to Pre-IDE I000187, Left-ventricular
lead abrasion testing, décembre
2001.
[13] BAILLARGEON Gérald, Module R et R, Etude de répétabilité
et de reproductibilité, Aptitude du système de mesure,
Lavoisier, Paris,
Mars 2005
[14] Taber
industries, Abrasimetre
linéaire 5700, brochure
commerciale.
[15] ELA medical, Direction des
études et du
développement mécanique, Rédaction du plan de
développement, MD012.
[16] ELA Medical, Direction des
études et du
développement mécanique, validation des
stérilisations Sorin
des sondes ELA, Plan 206D.
[17] ELA Medical, Direction
des études et du développement mécanique, Nomenclature
mécanique et
Cahier de charges des sondes Isoline et
Swift.