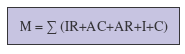|
Avertissement
|
Si vous arrivez directement sur cette page,
sachez que ce travail est un rapport d'étudiants et doit
être pris comme tel. Il peut donc comporter des imperfections ou
des imprécisions que le lecteur doit admettre et donc supporter.
Il a été réalisé pendant la période
de formation et constitue avant-tout un travail de compilation
bibliographique, d'initiation et d'analyse sur des thématiques
associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la
duplication est libre. Si vous avez des raisons de contester ce droit
d'usage, merci de nous en faire part .
L'objectif de la présentation sur le Web est de
permettre l'accès à l'information et d'augmenter ainsi
les échanges professionnels. En cas d'usage du document,
n'oubliez pas de le citer comme source bibliographique. Bonne
lecture... |
|
Définition
d'une stratégie de maintenance biomédicale basée
sur une analyse de risques
|

|
|
|
|
RESUME
Au
sein des
établissements de santé, le service biomédical
représente une entité à part
entière. Il remplit une fonction importante car les
répercussions de ses
actions jouent sur l’économie financière de
l’établissement et sur la qualité
des soins délivrés aux patients. Ces missions sont
nombreuses et diverses,
entre autre il assure la gestion des dispositifs médicaux, le
conseil à
l’achat, et l’organisation de la maintenance.
Confronté
à une
réglementation draconienne en matière de maintenance
préventive, il doit faire
des choix, réfléchir sur des orientations à
prendre, en associant contraintes
budgétaires et respect des exigences réglementaires.
Ce rapport
tente de résoudre cette problématique en proposant une
stratégie de maintenance
biomédicale, basée sur une analyse de risques, applicable
à l’ensemble du parc
de dispositifs médicaux du centre hospitalier de La
Rochelle.
Mots
clés :
Maintenance préventive,
achat, qualité, informatisation, règlemention, analyse de
risques.
|
|
ABSTRACT
Biomedical
unit is very important in hospital. It is
responsible for buying and ensure the safety of medical devices.
French
regulation is very strict, in fact the decree 2001-1154
of the five December 2001, impose on
hospital to realize preventive maintenance on medical devices which are
in
class IIb and III. For lack of money in hospital, its not possible to
follow
this obligation.
This
document is aimed at providing the La Rochelle’s hospital with a
reference tool to apply the decree of maintenance 2001-1154. Its
purpose is to
establish acceptability criteria according to medical devices. To do
this, a
risk analysis is an indispensable prerequisite.
Key
words
:
Preventive
maintenance,
medical devices, purchase, quality, computerization, regulations, risk
analysis.
|
Remerciements
Je
tiens à remercier la Direction
du Centre Hospitalier de La Rochelle pour m’avoir offert la
possibilité
d’effectuer mon stage de fin d’études au sein de son
établissement. Je remercie
également Philippe CUTTE, ingénieur biomédical,
pour m'avoir accueilli et
permis de faire mon stage à ses côtés.
Je
tiens aussi à exprimer mes remerciements à
Messieurs CHEVALLIER et FARGES de l'Université de Technologie de
Compiègne pour
l'attention et le suivi qu'ils nous ont accordés tout au long de
l'année
universitaire.
Je tiens également
à remercier mon
établissement d’origine, le Centre Hospitalier de
Châtellerault, pour m’avoir
offert la possibilité de partir pendant un an suivre cette
formation
qualifiante.
Sommaire
I.
Présentation du lieu de stage .
4
II.
Présentation de l’unité biomédicale . 5
III.
Définition des sujets de stage 7
Sujet N°1 : Achat de laveurs
désinfecteurs
d'endoscopes
I.
Introduction générale.
8
II.
Définition du sujet de stage. 8
III.
Etat des lieux, bilan de la situation actuelle. 8
IV.
Les laveurs désinfecteurs d’endoscopes. 10
V.
La procédure d’achat 13
VI.
Résultats discussions. 15
Sujet
N°2 : Application de la loi Informatique et
Libertés
I.
Introduction. 18
II.
Objectif du stage. 19
III.
La problématique. 19
IV.
Situation actuelle. 20
V.
Méthode d’analyse et de résolution de la
problématique. 21
VI.
Mise en œuvre des solutions. 21
VII.
Résultats et discussions. 21
VIII.
Perspectives d’avenir 22
IX.
Si c’était à refaire…. 22
Sujet N°3 :
Définition
d'une politique de
maintenance basée sur une analyse de risques
I.
Contexte règlementaire. 24
II.
Définition du sujet de stage. 26
IV.
Perspectives d’avenir 34
V.
Conclusion. 35
Bilan
général du
travail réalisé en fonction des objectifs initiaux
fixés.
Conclusion
générale.
Annexes
36 à 4
. 45 Références bibliographiques
I-
Présentation du lieu de stage
Le
Centre Hospitalier de La Rochelle est le plus gros
employeur du département avec environ 3 000 agents.
I-1)
Capacité d'accueil
Le
Centre Hospitalier de La
Rochelle est composé de deux sites et comprend cinq
établissements :
- Hôpital
général : médecine, chirurgie,
obstétrique
- Maison
de retraite
- Hôpital
Marius Lacroix : psychiatrie
- Centre
de moyen et long séjour
- Centre
d’aide par le travail
- Maison
d’accueil spécialisé
L’établissement
dans son ensemble dispose de 1.523 lits et
places installés dont 635 installés en M.C.O
(Médecine, Chirurgie,
Obstétrique).
I-2)
L'hôpital Saint Louis
Il regroupe les
principales spécialités de médecine,chirurgie et
obstétrique et accueille, suivant leur pathologie, les
patients :
¤en
hospitalisation complète,
¤en
hospitalisation de jour,
¤en
consultation externe.

Il est équipé
d'un plateau technique qui permet la réalisation d'examens
diagnostiques et thérapeutiques, d'interventions chirurgicales
et autres actes invasifs, d'examens de laboratoire et d'imagerie
médicale.
Il est
le siège
- du service d'accueil des urgences et du SAMU 17,
- de la direction générale du Centre Hospitalier, de la
direction du site
Saint-Louis et des différentes directions fonctionnelles de
l'établissement.
I-3)
Quelques dates
1976 : Inauguration du nouvel
hôpital saint Louis,
1980 : Création du centre d’aide
par le travail,
1981 : Ouverture du centre de Soins pour
personnes
âgées,
2003 : Ouverture des
centres d’oncologie et de
radiothérapie.
I-4)
Quelques chiffres
Budget :
* Section
d’investissement : 35 378 045
€
* Section
d’exploitation : 170 762 848
€
*
Budgets
annexes : 14 851 670 €
Effectif
personnel :
* Personnel médical 306 médecins
* Personnel
non médical : 2 976
agents
* Dont
Contrats emplois solidarité : 52 C.E.S
Activité :
- 52 000
entrées pour hospitalisation en MCO
- 37 000
passages aux urgences générales
- 34 000
entrées pour hospitalisation en service de psychiatrie
- 75 000
consultations externes en MCO
- 1 700 naissances
à la maternité.
II-
Présentation de l'unité biomédicale
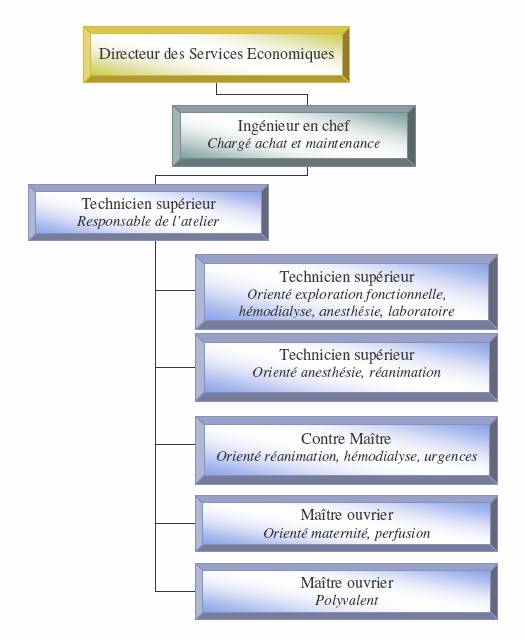
Le
service biomédical est constitué actuellement d’un
ingénieur en chef , de trois techniciens supérieurs
hospitaliers, de deux
maîtres ouvriers et d’un contre maître. Il gère un
parc de 3 886
équipements biomédicaux et dispose d’un crédit
d’investissement annuel de
1 700 000 €.
II-1)
Bilan maintenance biomédicale
Le
service biomédical réalise 2 303 interventions de
maintenance annuelles.Le budget de maintenance annuelle total est
d’environ
1 503 394 €. Il se
décompose comme suit :
- Budget
« contrat de maintenance » : 713 983.45€
- Budget
« intervention externe en régie » : 236 264.59€
- Charges
salariales : 230 000€
- Equipement de métrologie : 12 000€
- Frais de
fonctionnement atelier : 10 000€
- Formation
annuelle : 10 000€
- Frais
expédition : 12 500€
- Amortissement outillage : 2 000€
- Budget pièces détachées : 277 168€
Un
peu plus d’un tiers de la maintenance biomédicale est
externalisée (36%) et coûte près de deux tiers
(63%) du budget.
II-2)
Objectif du service biomédical : La
maîtrise du patrimoine
biomédical
En matière de
maintenance et de
contrôle qualité, organiser la prise en charge des
dispositifs médicaux de
manière planifiée, pour garantir leur
disponibilité dans des délais
raisonnables, compatible avec l’activité du service demandeur et
ce, dans le
respect des textes réglementaires, du contexte économique
et du projet
d’établissement du Centre Hospitalier de La Rochelle.
Il
dispose pour cela d’un
logiciel de GMAO AssetPlus, permettant de planifier les maintenances
préventives et, de suivre financièrement les maintenances
correctives des
dispositifs médicaux mais également de gérer les
pièces détachées.
II-3)
Organigramme de la structure
biomédicale du Centre Hospitalier
de La Rochelle

III-
Définition des sujets de stage
3
missions m’ont été confiées durant ma
période de stage, à
savoir :
1- Le pilotage d’une
procédure adaptée pour l’achat de 2 laveurs
désinfecteurs
d’endoscopes,
2- L’application de la loi
Informatiques et Liberté sur les DM utilisant des
bases de données patients,
3- La définition d’une
stratégie de maintenance biomédicale applicable à
l’ensemble des DM exploités dans l’établissement.
Les
sujets sont abordés dans ce
même ordre dans le rapport qui suit.
Durant
ma période de stage, la
priorité a été donnée au sujet N°3,
problématique sur laquelle l’ingénieur
biomédical souhaitait avancer en 2006. Ce
sujet, potentiellement intéressant pour toute le profession
constituera
l’essentiel de la soutenance orale, sanctionnant mon année
universitaire.
SUJET
N°1
I-
Introduction générale
Dans un
processus d’achat,
l’ingénieur biomédical a pour rôle d’assister et
conseiller les utilisateurs
afin de choisir un dispositif médical qui correspond à
leurs attentes
explicites et latentes ainsi qu’aux normes de sécurité et
de qualité liées à
l’exploitation du dispositif médical. Il est tenu de respecter
le code des
marchés publics [46]. Pour ce faire, il procède à
une définition précise des
besoins qui s’avère primordiale dans un tel processus.
L’ingénieur
biomédical a un rôle
important dans la fonction achat. Il réalise un plan annuel
d’investissement permettant de programmer le remplacement des
dispositifs médicaux avant qu’ils ne deviennent obsolètes.
II-
Définition du sujet de stage
II-1)
Objectif du stage
Au
centre hospitalier de La Rochelle, le plan
d’équipement 2006, prévoyait l’achat de 2 laveurs
désinfecteurs d’endoscopes
(LDE), fonctionnant à l’acide péracétique (APA),
pour le service de médecine de
gatro entérologie. L ’objectif de mon stage était le
pilotage de la procédure
d’achat relative à l’acquisition de ces machines. Le choix des
équipements
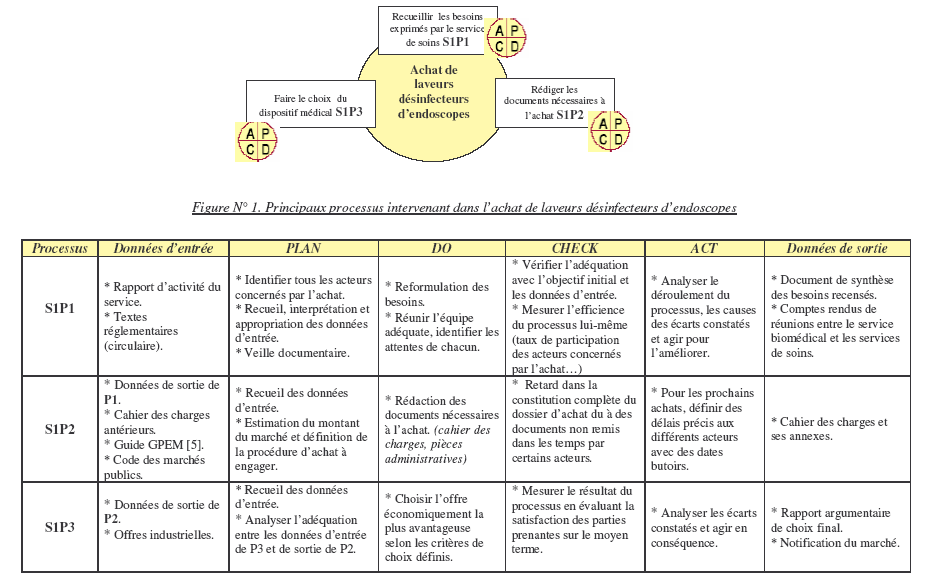
devait être validé début juin 2006. (descriptif
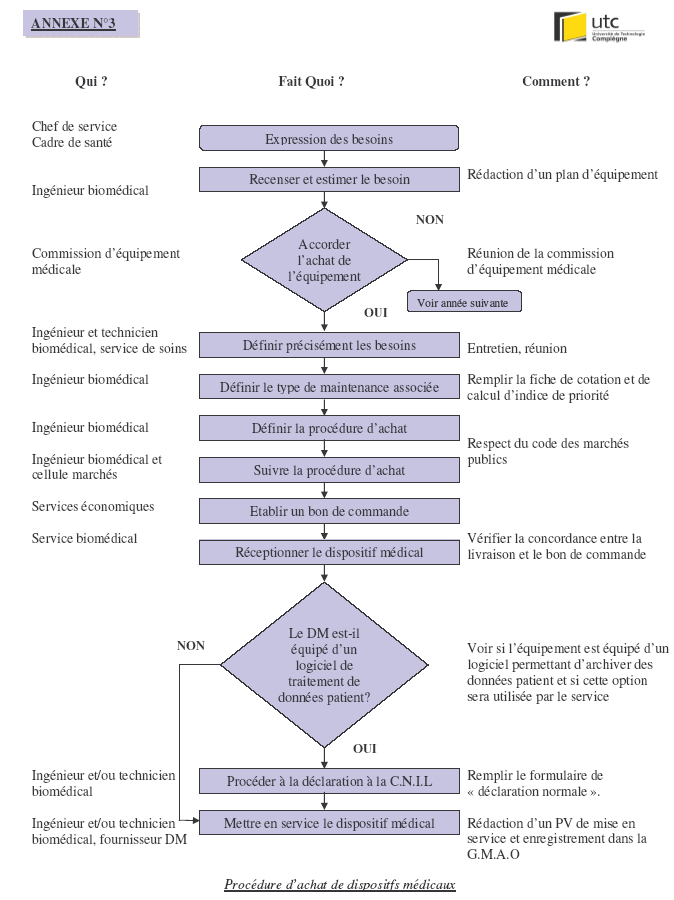
du processus figure N° 1).
Le
glutaraldéhyde a longtemps été utilisé
comme
produit de référence pour la stérilisation
à froid des endoscopes. Cependant, compte
tenu de son inefficacité vis-à-vis du
prion, et de son caractère particulièrement toxique pour
le personnel
utilisateur et l’environnement, son utilisation a été
remise en cause. C'est
pourquoi il est recommandé de le substituer par l’APA.
Le
rapport d’activité de la Société Française
d’endoscopie digestive (SFED) de mars 2002-2003[37], précise que
2.000.000 endoscopies sont pratiquées en
France chaque année.
Ainsi ,
l’enjeu majeur lié au passage à
l’APA constitue un élément de santé publique !
III- Etat des
lieux, bilan de la situation actuelle
III-1)
Activité du service
Le
service de médecine de gastro entérologie du centre
hospitalier de La Rochelle est ouvert du lundi au vendredi de 08H15
à 13H00 et
le mardi après-midi de 14H00 à 16H00.
Le
service dispose actuellement
de 2 laveurs désinfecteurs d’endoscopes, de marque BELIMED, non
asynchrones,
fonctionnant au glutaraldéhyde :
* l’un traite les endoscopes explorant les voies hautes
(duodénoscopes, gastroscopes) et
* l’autre, les endoscopes explorant les voies basses (coloscopes).
Le
service réalise environ 2.500
examens/an mais l’arrivée d’un nouveau praticien en septembre
2006 laisse
présager une augmentation de 20% de l’activité. Cette
donnée a été prise en
compte pour l’estimation des coûts d’exploitation annuels en
biocides
(détergent et désinfectant).
III-2)
Résultats attendus
Les
utilisateurs espèrent pouvoir
bénéficier de laveurs désinfecteurs ergonomiques,
permettant d’améliorer leurs
conditions de travail et plus particulièrement le confort
lié à un chargement
des endoscopes à hauteur
d’ « homme ».
D’autre
part, l’acquisition des
LDE va permettre une automatisation de la phase de nettoyage (1er
nettoyage), jusqu’alors effectué manuellement (10
minutes/endoscope). Sur la
base d’une activité moyenne de 12 examens/jour, cela
représente un gain de
temps de 120 minutes soit 2 heures/jour. Enfin, la programmation de
l’auto
désinfection de la cuve, évitera l’intervention
journalière d’une personne pour
lancer le cycle.
Ces
avantages vont permettre une
meilleure rotation des endoscopes plus adaptée à
l’activité du service.
En
terme de coût de cycle, une
évaluation économique au regard du fonctionnement
existant est difficile car
les produits sont communs aux services d’exploration fonctionnelle
respiratoire
(EFR) et de médecine de gastro entérologie. De plus, les
commandes de produits
ne sont pas reproductibles d’une année sur l’autre, donc aucune
exploitation
fiable des coûts n’est réalisable.
IV- Les laveurs
désinfecteurs
d'endoscopes
Les LDE sont des machines
automatisées,destinées
à laver et
désinfecter les surfaces externes et internes des endoscopes
souples, non
stérilisables à la vapeur d’eau. Les LDE sont
marqués « CE dispositif
médical », et répondent aux exigences
essentielles de la directive 93/42 .
Ils sont de classe IIa, conformément à la règle 15
(annexe IX) de la directive
européenne 93/42 CEE [20 ].
Les
endoscopes pouvant être traités dans ce type
de machine sont ceux utilisés dans les unités de
gastro-entérologie,
pneumologie et ORL.
Les
laveurs désinfecteurs sont des équipements
très sensibles. Pour preuve, les déclarations de
matériovigilance sur ces
équipements sont importantes [2] et l’Agence de
Sécurité Sanitaire des Produits
de Santé (AFSSaPS) a émis de nombreuses recommandations
pour l’utilisation de
ces équipements [17], et a demander à de nombreux
industriels de procéder à des
modifications de leur machine. D’autre part, un guide pour
l’utilisation des
LDE [9] a été publié en novembre 2003, par le
ministère de la Santé.
IV-2)
Description des cycles
De
façon générale, les LDE sont pourvus de 3
cycles
distincts :
*
Le cycle du
matin : il correspond à la désinfection de
l’endoscope qui a été stocké 12
heures ou plus. Il est réalisé avant le premier acte
endoscopique et comprend
les phases de désinfection, rinçage terminal et
soufflage.
*
L’autodésinfection
chimique ou thermique effectuée le matin en début de
séance avant le chargement
du premier endoscope. Elle doit permettre de désinfecter toutes
les
canalisations, cuve(s), réservoirs et autres composants de la
machine en
contact avec l’eau ou les solutions utilisées pour le lavage, la
désinfection
et le rinçage des endoscopes.
*
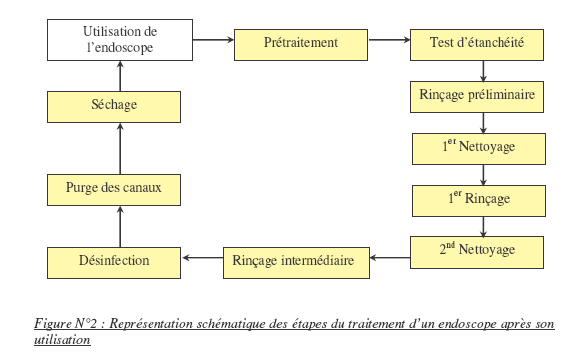
Le cycle
standard : effectué entre deux examens. Les phases du cycle
standard sont
décrites ci-dessous.
Immédiatement
après la fin du geste
endoscopique, sur le lieu de l’examen, l’endoscope doit subir un
prétraitement
qui consiste à essuyer l’endoscope, aspirer tous les canaux
de l’endoscope
et rincer abondant avec de l’eau de
réseau de distribution.
Puis,
un test d’étanchéité doit être
réalisé
avant l’immersion de l’endoscope car si la gaine distale est
percée, de l’eau
pourrait s’infiltrer dans l’endoscope et risquer d’endommager les
fibres
optiques et le capteur CCD.
Enfin, l’endoscope est
chargé dans le LDE.
IV-3)
Aspects réglementaires et normatifs en
France
La
complexité du matériel
endoscopique et le risque infectieux qui lui est lié, bien
qu’imparfaitement
évalué, sont à l’origine des nombreuses
recommandations concernant l’entretien
des endoscopes [23-25-27].
La
circulaire du 14 mars 2001
[25]mentionne de substituer, dès que possible, le
glutaraldéhyde par l’APA même
si la SFED rappelle qu’il n’y a aucun cas rapporté de
transmission d’encéphalopathies
spongiformes subaiguës transmissibles (ESST) par l’endoscopie
digestive[26].
Les
contraintes qui nous sont
imposées en matière de désinfection des endoscopes
ne font que croître en
raison de l’apparition d’une nouvelle menace due aux Agents
transmissibles Non
Conventionnels (ATNC) ou prion.
IV-3)a. Le
prion, c'est quoi?
Le
prion est responsable des ESST. Ce sont des maladies neuro -
dégénératives
d’évolution lente. On en connaît plusieurs formes, chez
l’homme, avec la Maladie de Creuztfeldt-Jakob (MCJ).
Le
prion est loin d’avoir livré tous ses secrets, c’est
une protéine modifiée qui devient infectieuse. Le
réel problème est que le
prion est doté d’une extraordinaire résistance, en
particulier aux modes de
stérilisation et de désinfection habituels. Seule
l’incinération à 800° permet
de le détruire.
Cependant
on a pu démontrer son
inactivation par la chaleur, via un cycle de stérilisation
à l’autoclave à
134°pendant 18 minutes. Certes, il n’est pas détruit mais on
ne peut plus
mettre en évidence une infectiosité.
C’est
justement parce que son mode de transmission est totalement
inconnu, que de nombreuses précautions sont
à prendre pour désinfecter les endoscopes.
En
réalité, dans
la pratique, se sont surtout les unités de neurochirurgie et
d’ophtalmologie
qui sont concernées par ce problème en effet, dans ces
spécialités, les
interventions portent sur un tissu à fort risque
d’infectiosité. Mais lorsqu’on
ne dispose pas de données scientifiques, on se fonde sur
l’opinion consensuelle
d’experts pour formuler une recommandation.
IV-3)b.
Qu'en est_il chez nos voisins européens?
D’après
des données de la société
Johnson&Johnson[14], il apparaît que la France raisonne
différemment des autres
pays. En effet, la majorité d’entre eux désinfectent les
endoscopes avec du
glutaraldéhyde, toutefois la tendance s’inverse rapidement vers
l’APA dans les
pays limitrophes à la France comme la Belgique ou la Suisse.
L’Angleterre
utilise un aldéhyde, et certains pays de l’est du dioxyde de
chlore. En
conclusion, la demande n’est pas homogène et les industriels
doivent s’adapter
et fabriquer des LDE compatibles avec les désinfectants
validés dans chaque
pays.
Sans
doute le prion, s’adapte-t-il
aux diverses réglementations, souveraines dans chaque pays…
IV-4)
L'acide péracétique versus
glutaraldéhyde [33]
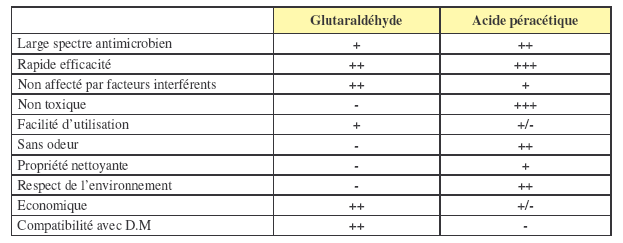
Les
effets secondaires
actuellement relevés de l’APA sur le personnel se limitent
à une odeur
désagréable (vinaigre) plus ou moins importante selon les
formulations. Le
glutaraldéhyde présente par contre une liste importante
d’effets secondaires
irritatifs et/ou allergiques qui ont pu entraîner des
arrêts de travail ou des
changements de poste des personnels en dépit de l’application
des
recommandations techniques et d’utilisation visant à limiter le
taux de
glutaraldéhyde dans l’air.
L’APA
permet de protéger
l’environnement, en effet il se dissocie rapidement en eau
oxygénée et acide
acétique. Son rejet à l’égout ne pose donc pas de
problème aux concentrations
auxquelles il est utilisé. Le glutaraldéhyde
présente par contre une
dégradation beaucoup plus lente par polymérisation.
Les véritables
obstacles à la
généralisation de l’APA restent certainement son prix de
revient estimé à 4
fois le prix de produits à base de glutaraldéhyde, et sa
mise en cause dans la
survenue d’incidents ou de dégradations d’endoscopes tels que
l’altération des
joints et poignée de béquillage, le plissage et la
fissure des gaines distales.
V- La
procédure d'achat
V-1)
Code des marchés publics
L’achat
de LDE doit être effectué
suivant les règles de publicité et de mise en concurrence
prévues par le code
des marchés publics [46].
Les
exigences du code des marchés
publics sont le respect des principes fondamentaux (liberté
d’accès à la
commande publique, égalité de traitement des candidats et
transparence des
procédures).
Le
montant du marché pour l’acquisition
et l’exploitation sur 3 ans des 2 LDE est estimé
inférieur à 150.000€ HT, la
passation de marché sera donc réalisée selon
une
procédure adaptée (MAPA).

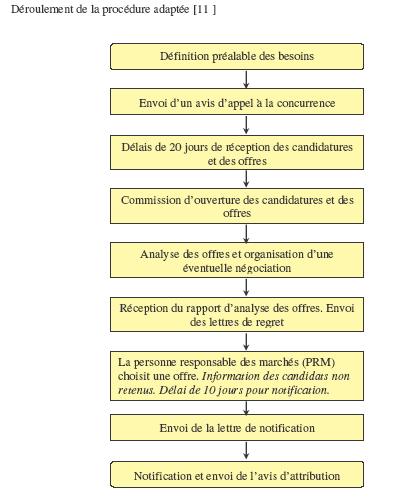
Le
rôle de l’ingénieur biomédical est décisif
car
l’analyse de offres vise à établir un classement des
offres, selon les critères
de jugements avec leur pondération définis
ci-dessous :
*
Critère N°1 : offre économique (investissement,
fourniture des consommables et des pièces
détachées sur 3 ans) . Pondération 60%.
* Critère N°2 : Fonctionnalités, aptitudes
à l’exploitation (capacité de traitement, ergonomie,
satisfaction du personnel soignant, convivialité du logiciel
informatique). Pondération 30%.
*
Critère N°3 : Formation du personnel soignant et des
techniciens biomédicaux, (contenu, suivi). Pondération
10%.
V-2)
Ce dont il faut tenir compte pour l'achat de LDE
Au niveau économique :
*
le coût des cycles standards,
*
le coût des cycles d’autodésinfection,
*
le coût des cycles du matin,
*
le coût des filtres,
*
le coût des kits de maintenance préventive, ou du contrat
de maintenance.
Au niveau de l’utilisation :
*
la durée des cycles,
*
la prise en charge de 1 ou 2 endoscopes simultanément
(système asynchrone ou non),
*
les possibilités en matière de traçabilité
informatique des cycles,
*
la facilité d’utilisation, la convivialité de l’interface
utilisateur,
*
la qualité des formations délivrées aux
utilisateurs et à l’unité hygiène.
Au niveau technique :
*
les sécurités, les contrôles, alarmes machine,
*
la qualité des formations techniques, les délais
d’obtention des pièces détachées.
Le
choix de LDE fait intervenir différents
partenaires : hygiénistes, pharmaciens, utilisateurs,
ingénieur
biomédical, Directeur des services économiques. La
décision finale doit
permettre d’ obtenir la meilleure corrélation entre les
performances techniques
et cliniques de la machine, et
l’approche économique et financière.
VI-
Résultats et discussions
Après
une implication forte dans un dossier
d’achat, il est regrettable de ne pas assister à l’installation
et la mise en
service des équipements.
Une
évaluation de la satisfaction des parties
prenantes (utilisateurs, cadre de santé, hygiénistes…)
pourra être réalisée,
deux mois après l’utilisation des laveurs, elle
représentera un bon indicateur
de réussite du processus d’achat. En fonction des
résultats, des améliorations
pourront être apportées au processus dont il faudra tenir
compte pour les
prochains achats.
VII-
Conclusion, proposition
Concernant
les modifications des
conditions de travail liés à l’automatisation du premier
nettoyage, une
proposition d’organisation du service avec les 2 machines retenues au
marché sur une journée d’activité
maximale a été réalisée. (cf ci-dessous)
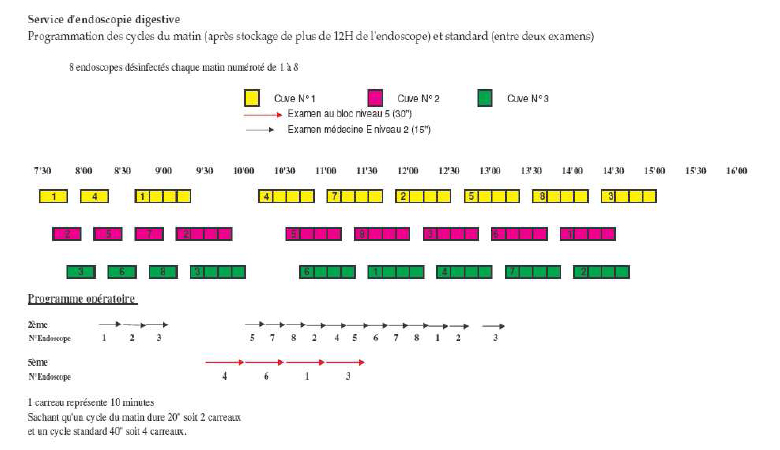
Des
travaux concernant la
compatibilité de l’APA sur les endoscopes
[38], montrent des altérations de ces derniers en particulier
lorsqu’ils
ont préalablement été traités par des
procédures utilisant le glutaraldéhyde.
Par
anticipation de ces désagréments, et afin de ne pas
immobiliser l’ensemble du parc
d’endoscopes, une proposition de synchroniser la maintenance
préventive avec le
remplacement de la gaine distale a été formulée et
retenue dans le cadre de
l’exécution d’un contrat de maintenance préventive.
VIII- Si c'était à refaire...
La difficulté dans ce dossier a
résidé dans le fait qu’au sein de la cellule
hygiène, mon interlocuteur
initial, a été remplacé par un autre, au mois de
mai.
Dans
un tel contexte, un procès
verbal de chaque réunion antérieure aurait du être
réalisé, il aurait permis
d’éviter certains désagréments et retards dans
l’exécution du marché.
Il aurait été intéressant de
joindre le plan de la salle de désinfection dans le cahier des
charges et de
demander aux industriels de proposer un aménagement des machines
dans le local.
Enfin, l’achat des LDE est
peut-être intervenu un peu tôt par rapport à la date
prévue de fin d’exécution
des travaux et les acteurs ne se sont impliqués que très
tardivement.
SOMMAIRE
SUJET
N°2
I-
Introduction
Instituée
en janvier 1978, la Commission nationale de
l’informatique et
des libertés C.N.I.L[3], est une autorité
administrative indépendante,
composée de 17 commissaires, dont :
* 4 parlementaires,
* 2 membres du Conseil économique et social,
* 6
représentants des hautes juridictions
*
5 personnalités qualifiées
désignées par le Président de l’assemblée
Nationale, par le Président du Sénat et
par le conseil des Ministres.
Elle
est chargée d’appliquer la
loi du 06 janvier 1978[32], modifiée par la loi du 06 août
2004[30], relative à
l’informatique, aux fichiers et aux libertés. Sa mission
générale est de
veiller à ce que l’informatique soit au service du citoyen et
qu’elle ne porte
atteinte ni à l’identité humaine, ni aux droits de
l’homme, ni à la vie privée,
ni aux libertés individuelles ou publiques.
La loi
s’applique à tout
traitement de données à caractère personnel
c’est-à-dire toutes les données
permettant l’identification d’une personne : données
figurant dans un
fichier telles que nom ou identifiant, mais aussi voix, images , et
données à
caractère biométrique.
La loi
Informatique et Libertés
définit des règles à respecter lors de la
collecte, du traitement, de la
conservation et de la transmission des informations nominatives.
Quelques
définitions :
« Constitue
une donnée à
caractère personnel toute information relative à une
personne physique
identifiée ou qui peut être
identifiée,
directement ou indirectement, par référence à un
numéro d’identification ou à
un ou plusieurs éléments qui lui sont
propres ».(art 2.2 de la loi N°2004-801).
« Constitue
un traitement de
données à caractère personnel toute
opération ou tout ensemble d’opérations
portant sur de telles données, quel que soit le
procédé utilisé, et notamment
la collecte, l’enregistrement, l’organisation, la conservation,
l’adaptation ou
la modification, l’extraction, la consultation, l’utilisation, la
communication
par transmission, diffusion ou toute autre forme de mise à
disposition, le
rapprochement ou l’interconnexion, ainsi que le verrouillage,
l’effacement ou
la destruction ». (art 2.3 de
la
loi N°2004-801).
I-2) Contexte hospitalier
L’informatique
tient une place
prépondérante dans le système d’information des
établissements de santé, elle
permet la gestion de l’ensemble des activités de gestion ,
logistiques administratives
et soins.
D’après
la revue « Le
Point », la base de données nationale du programme
médicalisé des systèmes
d’information (PMSI) , contient 12,5 millions de dossiers
médicaux informatisés
de patients, hospitalisés dans le secteur public, chaque
année ![40]
Le
dossier patient comporte des
informations administratives, sociales, médicales ou
paramédicales.
Parce
que ces informations
relèvent de l’intimité de la vie privée des
patients et que leur divulgation
est susceptible de porter atteinte aux droits et libertés des
personnes
concernées, elles doivent être particulièrement
protégées et en application de
la loi Informatique et Libertés, les établissements de
santé sont tenus de
déclarer ces logiciels informatisés nominatifs
auprès de la C.N.I.L.
En
plus de ces formalités
administratives, les établissements de santé qui
souhaitent mettre en œuvre des
traitements informatisés nominatifs, doivent se contraindre
à certaines
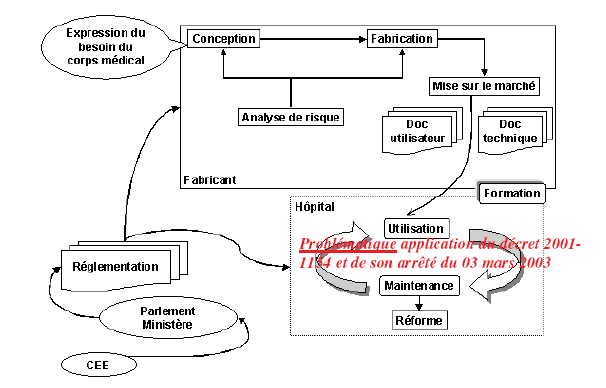
obligations, représentées dans le diagramme d’Ishikawa
ci-dessous.
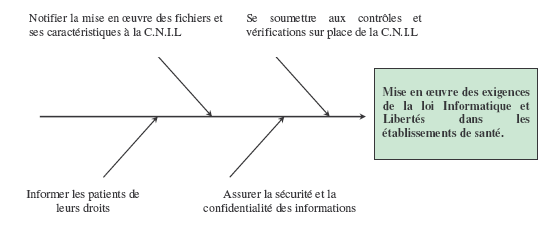
Le
développement perpétuel de
l’informatisation des examens ouvre donc de manière croissante
des
collaborations indispensables avec les services informatiques et des
obligations réglementaires.
Ceci
étant, la loi Informatique
et Libertés est cohérente avec les
référentiels du nouveau guide
d’accréditation des établissements de santé
[43-44] publié par la Haute
Autorité de santé (H.A.S)[4], lesquels recommandent
l’élaboration d’une
politique de sécurité du système d’information,
dont le respect de la
réglementation constitue le fondement le plus
élémentaire.
II- Objectif du
stage
L’intégralité
des logiciels
biomédicaux exploitant des données à
caractère personnel au centre hospitalier
de La Rochelle devaient être recensés. Un formulaire type
de déclaration devait
être rédigé, à titre d’exemple. L’objectif
de l’ingénieur biomédical est de déclarer
à la CNIL, l’ensemble des
applications, au dernier trimestre 2006.
III- La
problématique
Afin
de mettre en œuvre les
objectifs de la loi Informatique et Libertés, une organisation
interne est à
définir pour connaître les responsabilités et
rôles de chacun. La répartition
des tâches entre services biomédical et informatique doit
être clairement
précisée dans l’établissement.
Ceci
étant , la définition du DM,
d’après l’article L.5211-1 du code de la santé publique
[45] précise que les
« accessoires et logiciels » intervenant dans le
fonctionnement du DM
en font partie intégrante.
III-1)
Les différents aspects de la
problématique
Par rapport à
l'objectif initila formulé au chapitre II, la
problématique s'articule autour de la notification des fichiers
informatisés à la CNIL.

III-2) Les enjeux
Depuis
la loi du 06 août 2004
[30], la C.N.I.L se voit doter de pouvoirs de contrôle et de
sanction. En
effet, la formation restreinte de la commission composée de six
membres, peut
prononcer des sanctions allant de l’avertissement à l’amende,
à l’encontre des
responsables de traitement qui ne respectent pas la loi. La C.N.I.L
contrôle la
mise en œuvre des fichiers informatiques et elle peut procéder
à des vérifications
sur place.
Les
experts visiteurs de la H.A.S
peuvent, à l’issue de la procédure de
certification,
s’ils jugent que l’établissement de santé n’a
pas suivi les recommandations des référentiels du manuel
d’accréditation,
formuler des appréciations sous une forme graduée
déterminant des modalités de
suivi et la durée d’intervalle entre deux procédures de
certification.
III- Situation actuelle
Au sein de l’Association
Française de Ingénieurs Biomédicaux (AFIB)[2], le
sujet de la CNIL n’a pas fait
l’objet de travaux particuliers. Du coté du Syndicat National de
l’Industrie
des Technologies Médicales (SNITEM) [31], les industriels ne
procèdent à aucune
pré déclaration de leur logiciel avant la mise sur le
marché, c’est à l’exploitant, c’est-à-dire
à l’
établissement de santé, de s’en charger.
Au
sein du service biomédical du
centre hospitalier de La Rochelle, les logiciels exploités au
laboratoire et au
bloc opératoire ont déjà fait l’objet d’une
déclaration CNIL.
VI-
Méthode d'analyse et de résolution
de la
problématique
La déclaration
comporte
l’engagement que le traitement satisfait aux exigences de la loi.
Dans
le texte de 1978, les
fichiers publics étaient soumis à une autorisation
préalable, les fichiers
privés à une simple déclaration. Désormais,
le régime est le même pour les deux
catégories de fichiers. C’est la nature des données
collectées qui détermine le
régime applicable, déclaration ou autorisation mais, le
principe général est
celui de la déclaration. Au regard des obligations des personnes
responsables
dans les établissements de santé, les traitements des
données de santé à
caractère personnel relèvent du régime de la
déclaration à la CNIL. Seule
exception, les données génétiques qui sont soumis
au régime de l’autorisation.
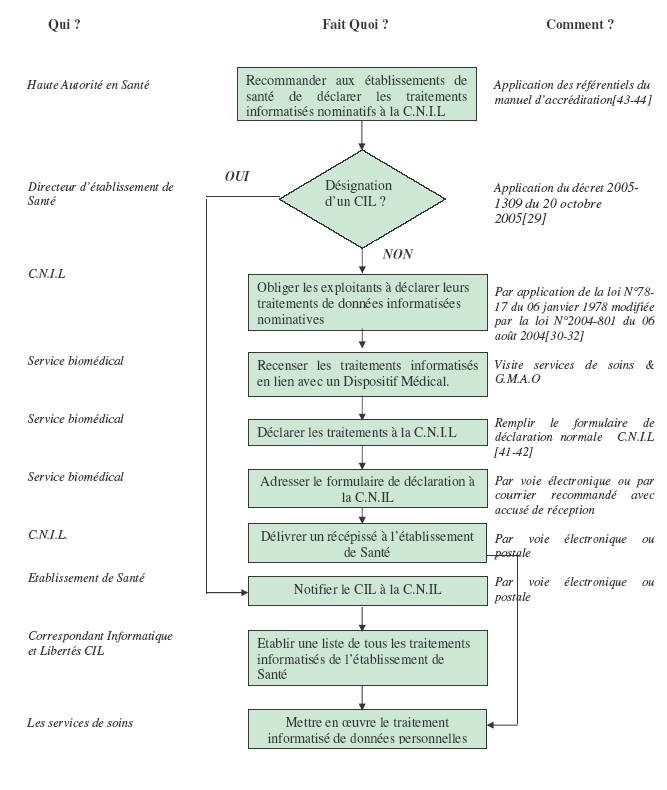
Il existe deux alternatives à la
résolution de la problématique , en effet
l’établissement de santé peut, soit
procéder à la déclaration de ces fichiers
informatisés nominatifs à la C.N.I.L,
soit depuis la parution du décret d’application
de la loi informatique et libertés le 20 octobre 2005 [29],
nommer un
correspondant informatique et libertés (CIL). La
désignation d’un correspondant
informatique et libertés permet de bénéficier d’un
allègement des formalités
déclaratives.
Les
possibilités et modalités de
mise en conformité avec la loi sont présentées
dans le logigramme ci-dessous.
V- Mise en
oeuvre des solutions
En réalité, la nouvelle loi
Informatique et Liberté rend nécessaire un travail
d’inventaire dans chaque
établissement de santé, destiné à recenser
la totalité des traitements
existants.
Deux
décisions ont été
prises :
1-
En priorité , procéder à la déclaration du
système PACS (Picture Archiving and Communication System)
utilisé en imagerie médicale pour le stockage des
images provenant de différentes modalités (scanner, IRM,
salle de radiologie vasculaire), dans la mesure ou la base de
données patients y est très importante.
2-
Déclarer uniquement les logiciels exploités dans
l’établissement. Certains services n’exploitent pas les
logiciels leur permettant d’archiver les examens patient.
Un
travail d’inventaire a été
engagé dans le cadre d’une collaboration avec les cadres de
santé. Tous les
services de soins qui tiennent un fichier informatisé de leur
patient, pour le
suivi médical, la consultation, la gestion des dossiers patients
doivent se
soumettre à cette formalité.
VI-
Résultats et discussions
La
déclaration du PACS devrait
être adressée la CNIL en juillet 2006.
Donc, dans l’immédiat aucun résultat ne peut être
donné sur ce sujet. Ceci étant,
l’hypothèse de la publication d’un article à RBM-ITBM
News, fin 2006, est envisagé.
Il a
été constaté un défaut
d’exploitation des solutions d’archivage et une méconnaissance
globale de la
part des services de soins de la possibilité d’exploiter
à posteriori ces
données médicales.
VII-
Perspectives d'avenir
Suite au constat
établi
ci-dessus, il conviendra au service biomédical d’insister sur la
formation
« utilisateur » pour la plupart des applications.
Une
proposition de logigramme
déployé intégrant dès la procédure
d’achat le recensement et la déclaration
C.N.I.L a été réalisée (cf Annexe 3)
. En effet, la déclaration doit être en théorie,
réalisée préalablement à la
mise en œuvre du logiciel et non pas à posteriori.
D’autre
part, à l’avenir, l’établissement
pourra s’interroger sur l’intérêt de nommer un
correspondant à la protection
des données, qui centraliserait l’ensemble des traitements
informatisés
nominatifs, avec un interlocuteur au service biomédical qui
ferait le « relais » jusqu’au
Correspondant.
Les
procédures administratives
liées à l’exploitation de logiciels biomédicaux et
utilisant des données
patients pourraient être intégrées dans le
processus de gestion des dispositifs
médicaux du Guide des Bonnes Pratiques biomédicales en
Etablissement de
Santé[12].
VIII.
Si C’était
à refaire…Ne
pas sous estimer la charge de travail à
fournir dans la réalisation d’un dossier. C’est ce qui fut le
cas pour ce
sujet, que je n’ai pas traité suffisamment tôt et que je
n’ai pu mener à terme.
Une
enquête commune auprès de la
communauté biomédicale aurait pu être
réalisée pour les sujets 2 et 3.
SUJET
N°3
I-
Contexte réglementaire
I-1)
Du côté des constructeurs de
dispositifs médicaux
Les
directives européennes
N°90/385/CEE du 20 juin 1990 et N°93/42/CEE du 14 juin 1993,
imposent aux
fabricants de respecter, à compter du 14 juin 1998, un certain
nombre
d’exigences essentielles applicables à leurs produits pour
apposer le marquage
CE nécessaire à la mise sur le marché
communautaire de leurs produits.
En
particulier, une analyse des
risques est un préalable indispensable aux procédures
d’évaluation de la
conformité prévue par la directive. La procédure
NF EN 1441 [] d’avril 1998 spécifie
une procédure permettant aux fabricants d’estimer la
sécurité d’un dispositif
médical en identifiant les dangers potentiels et en estimant les
risques
associés.
De
plus, l’annexe IX du livre 5
bis du code de la santé publique spécifie que les
constructeurs doivent
déterminer la classe des dispositifs médicaux qu’ils
souhaitent mettre sur le
marché. Il existe communément quatre classes : I,
IIa, IIb, III qui
correspondent à un niveau de risque croissant.
En
fonction de la classe à
laquelle appartient un dispositif médical, les modalités
d’obtention du
marquage CE ne sont pas les mêmes, elles sont évidemment
d’autant plus
contraignantes que la classe est élevée.
I-1)
Du côté des exploitants
de dispositifs
médicaux
Le
décret du 5 décembre 2001 [2] relatif à
l’obligation de maintenance
et au contrôle qualité des
dispositifs médicaux, complété par
l’arrêté du 3 mars 2003 [22] fixant les
listes des dispositifs médicaux soumis à l’obligation de
maintenance et au
contrôle de qualité décrivent les minima requis
pour l’exercice de la
maintenance des dispositifs médicaux dans les
établissements de santé publics
ou privés.
En
particulier, pour les dispositifs médicaux visés par ces
textes :
*
l’exploitant est responsable de la mise en œuvre de la maintenance et
des contrôles qualité ;
*
il doit disposer d’un inventaire des dispositifs médicaux, tenu
à jour ;
*
il doit définir et mettre en œuvre une organisation
destinée à s’assurer de l’exécution de la
maintenance et du contrôle qualité interne ou externe des
dispositifs médicaux dont il précise les
modalités, qui sont transcrites dans un document ; dans les
établissements de santé, cette organisation est
adoptée après avis des instances médicales
consultatives ;
*
il doit assurer la traçabilité des opérations de
maintenance et de contrôle qualité.
Un champ d’application
précisé, pour l’instant circonscrit :
1. Les dispositifs médicaux
soumis à l’obligation de maintenance sont les
suivants :
1.1 Dispositifs
médicaux nécessaires à la production et à
l’interprétation des images de
radiodiagnostic
1.2 Dispositifs
médicaux nécessaires à la définition,
à la planification et à la délivrance des
traitements de radiothérapie,
1.3 Dispositifs
médicaux nécessaires à la réalisation des
actes de médecine nucléaire,
1.4 Dispositifs
médicaux à finalité diagnostique ou
thérapeutique exposant les personnes à des rayonnements
ionisants en dehors des dispositifs médicaux mentionnés
ci-dessus
1.5
Dispositifs médicaux de classe IIb et III résultant des
règles de classification prévues à l’annexe IX du
livre V bis du code de la santé publique, autres que les
dispositifs médicaux mentionnés ci-dessus.
2.
Les dispositifs médicaux
soumis au contrôle de
qualité (interne ou externe) sont les suivants :
2.1 Dispositifs
médicaux nécessaires à la production et à
l’interprétation des images de radiodiagnostic
2.2 Dispositifs
médicaux nécessaires à la définition,
à la planification et à la délivrance des
traitements de radiothérapie,
2.3 Dispositifs
médicaux nécessaires à la réalisation des
actes de médecine nucléaire,
2.4 Dispositifs
médicaux à finalité diagnostique ou
thérapeutique exposant les personnes à des rayonnements
ionisants en dehors des dispositifs médicaux mentionnés
ci-dessus.
Avec
les restrictions budgétaires que connaissent les
établissements de santé, l’application de la
réglementation concernant la
maintenance préventive des dispositifs médicaux de classe
IIb et III est
difficilement réalisable en intégralité.
II-
Définition du sujet de stage
II-1)
Objectif du stage
Proposer
une méthodologie basée
sur une analyse de risques afin de définir une stratégie
de maintenance
applicable à l’ensemble des dispositifs médicaux du
Centre Hospitalier de la
Rochelle.
Le
souhait de définir une stratégie de maintenance
commune à l’ensemble des DM, quelque soit leur classe, est
apparu au regard
d’une part, de la forte pression économique s’exerçant
sur les budgets de
maintenance biomédicale, et d’autre part, du nombre croissant de
déclarations de matériovigilance sur les
DM de classe I, et plus particulièrement, sur le lit
médicalisé qui constitue
l’un des DM actifs les plus dangereux. Par ailleurs, il n’est pas rare,
voire
fréquent, de constater que pour deux DM à priori
équivalents, les fabricants
proposent des classes différentes.
Cette
définition d’une stratégie de maintenance s’inscrit
dans un processus de maîtrise des risques vers
lequel souhaite s’orienter le centre hospitalier de La Rochelle et
notamment l’ingénieur biomédical.
II-2)
Les enjeux
Pourquoi
est-il important de
définir une stratégie de maintenance
biomédicale ?
Avoir
une stratégie de maintenance biomédicale
claire et pertinente reposant sur une
méthodologie et des critères démontrables
c’est
:
*
Réduire
la fréquence et la gravité des incidents (principe de
prévention,
*
Prévenir
les plaintes, limiter et maîtriser les contentieux (principe de
précaution).
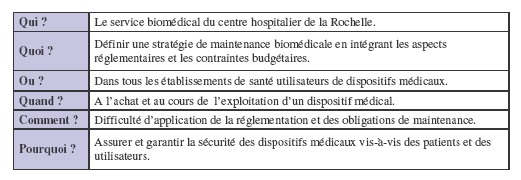
III- Approche
méthodologique
III-1)
Sélectionner le problème
Comment ? :
utilisation de l’outil qualité QQOQCP
III-2) Analyser les faits,
état de la situation actuelle
Comment? :
Réalisation d’une enquête
Une
enquête ( annexe N°1),
réalisée en mars 2006, auprès de 129
établissements
français de santé publics et privés a permis de
dégager des tendances sur la
politique de maintenance adoptée.
25,6%
de réponses ont été
enregistrées ce qui permet d’exploiter des données
crédibles, concrètes et
fiables.
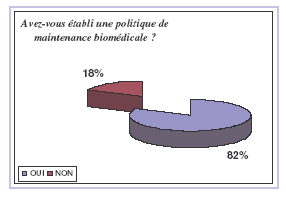
La
politique de maintenance
demandée au sens décret 2001-1154 du 05 décembre
2001[21] et de son arrêté du
03 mars 2003 [22] n’est pas établie dans tous les
établissements de santé
sondés (18% ne l’ont pas encore définie),
En
règle générale, la maintenance
préventive de l’ensemble des DM classés IIb n’est pas
réalisée, faute de moyens
humains et financiers (70% des réponses). Les DM
délaissés sont principalement les
équipements de perfusion, les moniteurs mono et bi
paramétriques.
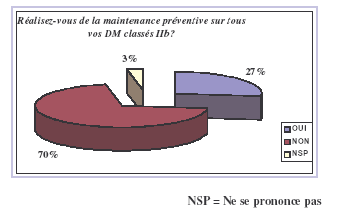
Les
outils qualité ne sont pas ou
peu utilisés, en effet beaucoup d’établissement ont
fondé leur politique de
maintenance sur leur expérience personnelle et leur
« bon sens » (42%
des réponses).
SOMMAIRE
III-3)
Analyser les causes racines
Comment?
:
En utilisant des outils qualité (Ishikawa et histogramme)
Concernant
la priorisation des
dispositifs médicaux, plusieurs facteurs avaient pu être
listés dans l’enquête.
(cf diagramme Ishikawa).
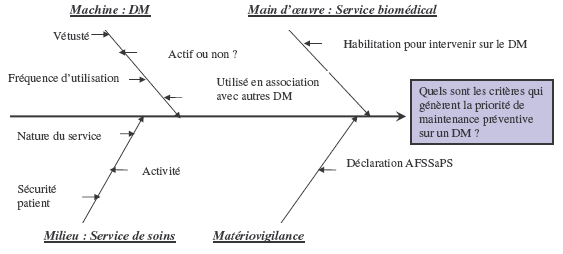
Les critères sont
classés ci
dessous en fonction du nombre de réponses enregistrées
pour chacun d’entre eux,
avec 100% pour le critère « Impact sur la
sécurité du patient »
puisqu’il a été mentionné comme étant
à prendre en compte dans tous les retours
d’enquête.
III-4)
Préparer les solutions
Comment :
Analyse quantitative
L’appréciation de la priorité
dans un établissement de santé engendre différents
facteurs, leur choix est
discutable, en contre partie il reflète une cohérence et
une logique entraînant
un résultat exploitable. La mesure de priorité permet
donc de mettre en
évidence les équipements sensibles sur lesquels doit
être axée en priorité la
politique de maintenance.
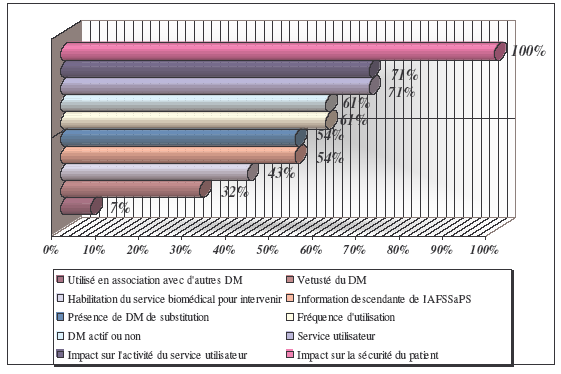
Les
facteurs les plus fréquemment
cités dans les retours d’enquête sont :
*
Impact sur la sécurité du patient (100%)
*
Service utilisateur (71%)
*
DM actif ou non (71%)
*
Fréquence d’utilisation (61%)
*
Présence de DM de substitution (54%)
*
Information descendante de l’AFSSaPS ou des industriels (54%)
De
manière arbitraire, il a été
décidé de retenir les facteurs suivants :
*
Impact sur la sécurité du patient (facteur de
gravité « G »)
*
Présence de DM de substitution (facteur de remplacement
« R »)
*
Fréquence d’utilisation (facteur de taux d’utilisation
« U »)
*
Information descendante de l’AFSSaPS (facteur de
matériovigilance « M).
Il
a été décidé de négliger les
critères suivants :
*
La nature du service utilisateur car une désignation
précise du dispositif médical permet de s’en dispenser.
(exemple : respirateur d’anesthésie).
*
L’impact du dysfonctionnement sur l’ activité du service
car en prenant en compte le facteur de remplacement
« R » on intègre déjà cette
notion, en effet si un DM est unique dans l’établissement, en
cas de panne, il en résulte automatiquement un arrêt de
l’activité du service.
*
DM actif ou non car tous les dispositifs médicaux sont
considérés comme potentiellement dangereux qu’ils soient
actifs ou non.
Dans
l’analyse
quantitative qui suit, les critères retenus sont
quantifiés sur une échelle
sans dimension de 1 à 10, selon des barèmes arbitraires
définis ci-dessous.
Avec
*
M pour la Matériovigilance
Un bilan du nombre et des
différentes catégories d’alertes émises, pour
chaque type de DM , sur le site
de l’AFSSaPS, depuis 2000 jusqu’à aujourd’hui, a
été réalisé.
Chaque
catégorie de texte a été
quantifiée selon une gradation établie en fonction du
degré d’importance de
chacun, à savoir qu’une information recommandation est
estimée moins importante
qu’ une circulaire.
Lorsqu’il
n’y a jamais eu de
déclaration de matériovigilance sur un dispositif
médical, son critère M est
estimé à 1.
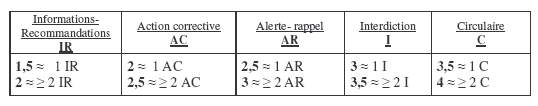
Le
critère de matériovigilance pour un DM correspond
à la
formule mathématique suivante :
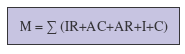
*
U pour le taux d’utilisation du DM
Ce
critère d’utilisation est
estimé en fonction des amplitudes horaires d’exploitation des
DM. Les rapports
d’activité des services de soins ainsi que les compteurs
horaires des DM
permettent d’évaluer ce critère.
Il
correspond au rapport du temps
réel d’utilisation du DM sur le temps d’utilisation maximum
possible en
fonction des amplitudes horaires du service.
10 ≈ U = 100%
7
≈ 80 % ≤ U ≤ 100%
1
≈ U < 40%
* R pour le critère de Remplacement
Ce
facteur indique la possibilité de remplacement ou non
d’un dispositif médical dans l’unité fonctionnelle ou
à proximité.
Avoir
du matériel de replis peut
permettre de faire baisser R.
10
≈
Equipement stratégique et unique, pas de délestage
possible (R = 1),
5
≈
Existence d’équipements similaires dans l’établissement
(2≤ R ≤5),
1
≈
Equipements multiples dans l’établissement (R ≥6).
*
G pour la Gravité
Ce
facteur détermine le risque
occasionné sur le patient en cas de défaillance du
dispositif médical. Cette
notion de gravité est défini par le corps médical.
Ce critère représente la
dangerosité clinique pour le patient, d’une défaillance
sur le dispositif
médical analysé.
Il
s’agit de refléter les
répercussions sur la santé du malade.
10
≈
Risque vital immédiat, conséquence mortelle ou grave
à court
terme (<24 heures). Exemple : décès.
7
≈
Risque vital non immédiat (>24 heures), conséquence
retardée mais lourde pour le patient, lésions ou
atteintes irréversibles.
Exemple : handicap permanent.
3
≈
Incident ou accident sans risque vital entraînant un inconfort
grave ou prolongé, perturbation à moyen terme,
lésion ou atteinte
réversible nécessitant un traitement médical.
Exemple : handicap temporaire.
1 ≈ Inconfort, perturbation ou incident
mineur. Lésion ou atteinte réversible ne
nécessitant pas d’acte médical.
Exemples : malaise, gêne.
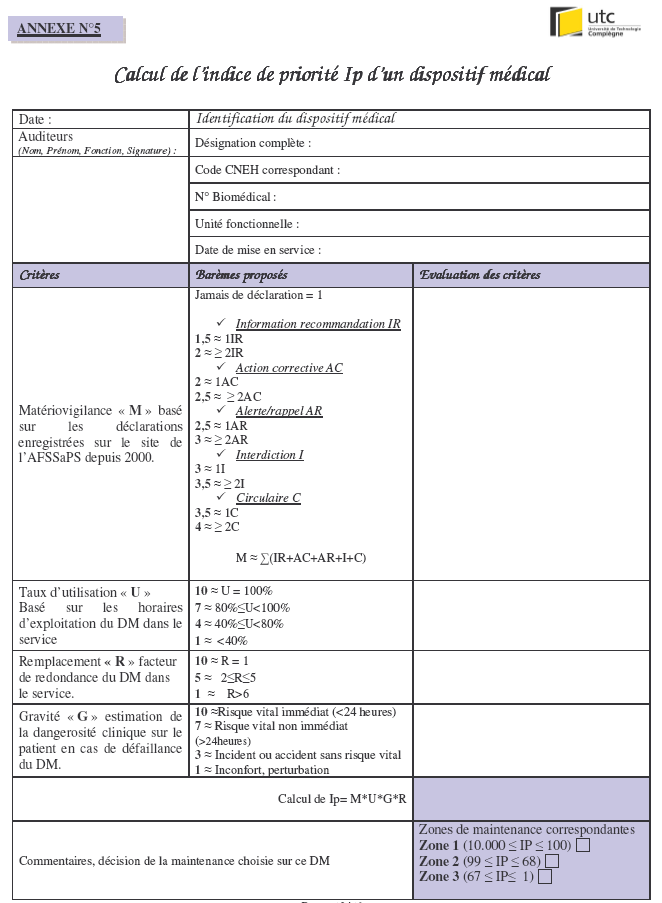
L’attribution
des notes permet par la suite de calculer un indice de
priorité Ip qui est égal à :

Le
barème minimum des critères
est fixé à 1 car Ip correspond au produit des quatre
facteurs et rendrait le
résultat nul si l’un des critères était à 0.
Exemple :
Un
dispositif médical sur lequel on n’a jamais enregistré de
déclaration de
matériovigilance (M=1),
utilisé à 70% des amplitudes horaires possibles (U= 4),
unique dans l’établissement (R=10)
, dont
une défaillance pourrait induire un risque vital non
immédiat sur le patient
(G=7), aura un indice de
priorité IP= 1*4*10*7 soit de
280.
Avec
les barèmes choisis, l’indice de priorité évolue
de 1 (1*1*1*1) à 10.000
(10*10*10*10).
Cet
indice de priorité va
permettre de mettre en évidence les équipements sur
lesquels doit être axée en
priorité la maintenance préventive.
III-5)
Mettre en oeuvre les solutions
Comment? :
Application de la méthode sur un service
« pilote »
Il a été
décidé d’engager la
démarche dans l’unité de réanimation, service
lourd et doté d’un panel
important et hétéroclite de dispositifs médicaux.
Le chef de service a estimé le
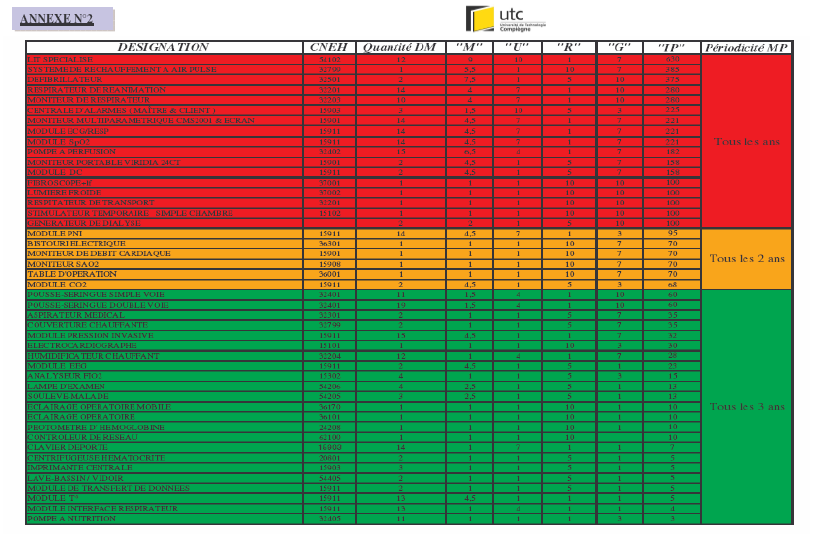
critère « G » sur l’ensemble des
équipements de son unité. Les
résultats sont donnés en annexe N°3.
SOMMAIRE
III-6)
Evaluer les résultats (audits)
La
pression budgétaire économique ne permettant pas de faire
ou faire faire une
maintenance préventive annuelle sur tous les dispositifs
médicaux de
l’établissement, un travail de hiérarchisation s’impose.
Il est fonction de
l’indice de priorité Ip calculé pour chaque dispositif
médical.
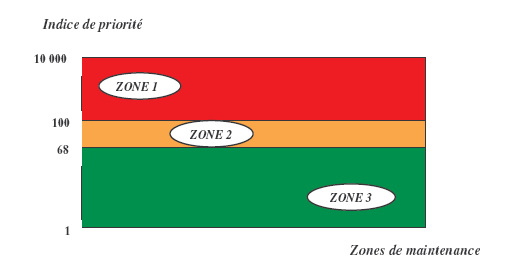
Trois
zones ont été définies et
réparties sur une échelle de priorité de 1
à 10 000.
Les
limites de chaque zone sont à
relativiser, elles varient d’une structure biomédicale à
une autre. Elles
pourront, par ailleurs, selon les résultats obtenus dans les
autres services,
être précisées et affinées
ultérieurement.
Zone
1 pour un indice de criticité allant de 100 à
10 000 :
Les
actions de maintenance
préventive comprise dans cette zone devraient être
réalisées avec une
périodicité minimale de douze mois, soit une fois par an.
Zone 2 pour un indice de
criticité allant de 68 à 99 :
Ici,
les actions de maintenance
préventive sont moins prioritaires, et peuvent être
réalisées tous les deux
ans.
Zone
3 pour un indice de 1 à 67 :
En
règle générale, les
défaillances analysées sur ce type de dispositif
médical ne présente pas de
risque vital pour le patient. Les dispositifs médicaux
concernés par cette zone
peuvent faire l’objet d’une maintenance préventive tous les
trois ans.
Après
compilation des résultats
obtenus pour chacun des services, pour chaque dispositif
médical, il faudra
appliquer en fonction de la valeur de l’indice de priorité Ip,
la périodicité
de maintenance préventive correspondante.
III-7)
Capitaliser le progrès
Cette
stratégie de maintenance
biomédicale doit comprendre des objectifs mesurables, être
visible et comprise
de tous. L’explication de la stratégie de maintenance devra
être faite systématiquement auprès de tous les
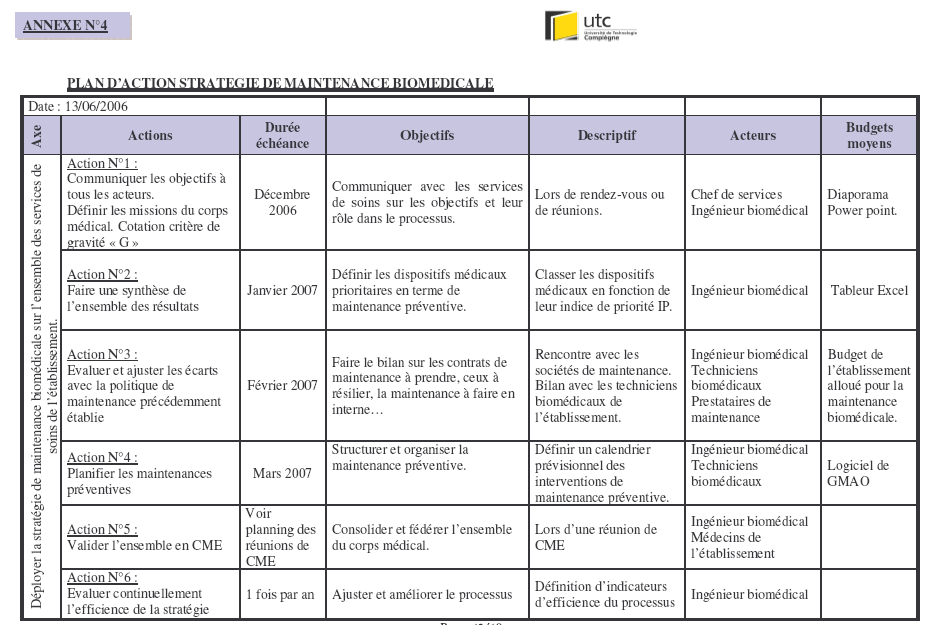
acteurs concernés dans l’établissement. Une proposition
de plans d’actions a
été réalisée en annexe N°4.
Le
bon fonctionnement et la
pérennisation du système passent par la mise en place
d’audits afin d’en
apprécier de manière périodique l’ensemble des
éléments qui le
constituent. Les audits doivent porter sur les
éléments formalisés, les
pratiques, et les résultats. (au moins une fois par an)
VI-
Perspectives d'avenir
La fiche de calcul de l’indice de
priorité IP, en annexe N°5, pourrait être mise en
relation avec la fiche
d’inventaire du dispositif médical via le lien possible sur le
logiciel de
Gestion de la Maintenance Assisté par Ordinateur (GMAO) Asset
plus de
l’établissement.
Le
calcul de l’indice de priorité
pourrait être réalisé dès la
procédure achat, pour savoir si il faut associer
un contrat de maintenance préventive à
l’équipement, dans le cas ou celle-ci ne
pourrait être réalisée en interne par les
techniciens du centre hospitalier.
Un
logigramme déployé reprenant
cette proposition est présenté en annexe N°3.
V- Conclusion
La
méthodologie proposée à
travers ces travaux pour la maintenance biomédicale permet
d’apporter une
réponse possible dans l’application des textes relatifs à
l’obligation de
maintenance, dans un contexte économique maîtrisé
et difficile.
Ces
travaux devront être périodiquement
réévalués en intégrant les retours
d’expérience, l’évolution des pratiques et
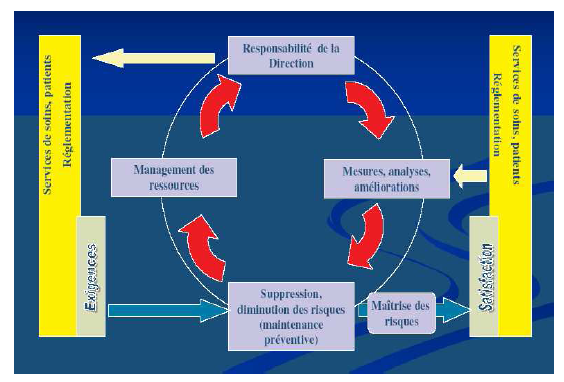
de la réglementation. Par conséquent, en adoptant cette
méthodologie,
l’établissement s’engage dans une
démarche itérative et une dynamique d’amélioration
continue de la
qualité et de la sécurité des DM.(cf processus
d’amélioration continue ci-dessous).
Amélioration
continue du système de management des risques
La validation écrite
de la
Direction Générale et des instances médicales
décisionnelles représentera une
preuve d’un réel engagement de la stratégie de
maintenance biomédicale
proposée.
Bilan
général du travail realise en
fonction des objectifs initiaux fixés
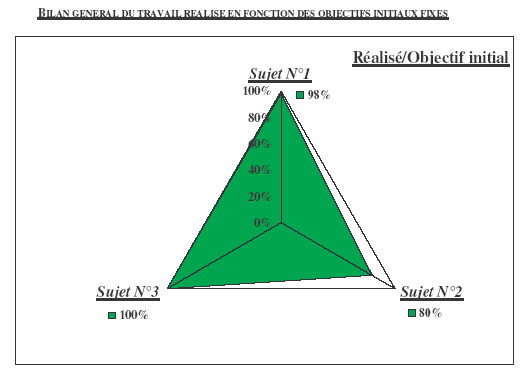
.
Conclusion
générale
Ce stage m’a conforté dans mon
orientation professionnelle. Il m’a
permis de découvrir une organisation hospitalière
différente avec des pratiques
transposables dans mon établissement de santé d’origine.
En
cela, il a répondu à mes
attentes personnelles.
Le
fait d’avoir traité trois
thématiques (achat, informatique, qualité) a permis
d’élargir mon champ
d’action et mes connaissances, et m’a confronté à une
certaine réalité de
terrain, en effet l’ingénieur biomédical doit
gérer au quotidien simultanément
plusieurs dossiers.
J’espère
avoir apporté une plus
value au service biomédical du centre hospitalier de La Rochelle.
Concernant le sujet N°1 :
un
constat clair est de dire que les achats sont difficiles surtout
lorsqu’ils
sont multidisciplinaires car il faut essayer de répondre aux
attentes de tous
les acteurs, faire le choix le plus juste en trouvant le compromis
idéal !
Concernant le sujet N°2 :
j’espère pouvoir publier un article dans la revue ITBM-RBM News.
Concernant le sujet N°3 sur la
stratégie de maintenance, M.Cutté et moi même avons
décidé d’engager une
démarche commune dans nos établissements respectifs et de
partager nos
résultats voire même les diffuser plus
généralement à la communauté
biomédicale
par le biais d’ un article courant 200
SOMMAIRE
ANNEXES :
Annexe N°1 : Enquête
à
l’attention des ingénieurs et responsables biomédicaux
chargés de la gestion de
la maintenance des dispositifs médicaux dans les
établissements de santé.



Annexe N°2 : Calcul des
indices de priorité des DM du service
de réanimation.
Annexe N°3 :
Procédure d’achat de dispositifs médicaux.
Annexe N°4 :
Proposition d’un plan d’actions 2006-2007 pour le service
biomédical.
Annexe N°5 :
Fiche de calcul de l’indice de priorité IP d’un dispositif
médical.
Références
bibliographiques
Site internet
[1]
Société Manumesure : http://www.manumesure.com/PSV/doc_psv/pl_fr_manumesure_ed4.pdf
[2]
Agence Française de Sécurité Sanitaire des
Produits en Santé :
http://agmed.sante.gouv.fr
[3]
Commission Nationale Informatique et Libertés : http://www.cnil.fr
[4]
Haute Autorité en Santé : http://www.anaes.fr
[8]
Droit médical : http://www.droit-medical.net/article.php?id_article=14
[17]
Société Johnson& Johnson : http://www.jnj.se
[31]
Syndicat National de l’Industrie des Technologies
Médicales : http://www.snitem.fr
Relative
à des guides
[5]
Guide de l’acheteur public sur les laveur désinfecteur pour
endoscopes – Achat
– Maintenance – Fourniture des consommables associés du Groupe
Permanent
d’étude des Marchés d’équipement et de fournitures
des centres de soins et des
laboratoires (GPEM/SL). http://www.minefi.gouv.fr/daj/guide/gpem/laveurs/laveurs.pdf
[6]
1993 : Guide pour la décontamination - nettoyage, la
stérilisation ou la
désinfection des endoscopes.(AFNOR)
[7]
Guide d’application de la
norme NF X 99-172. Gestion des risques liés à
l’exploitation des dispositifs
médicaux de type échographe.
[9]
Bonnes pratiques de désinfection des dispositifs médicaux
– Guide pour
l’utilisation des laveurs désinfecteurs d’endoscopes -
Novembre 2003.
http://www.sante.gouv.fr/htm/pointsur/nosoco/ide_def241103.pdf
[10]
Maintenance des dispositifs
médicaux, Guide pratique, Obligation et recommandation,
Direction régionale des
affaires sanitaires et sociales de Midi-Pyrénées, http://www.afib.asso.fr/_documents/articles/guide_midipyr.pdf
[ 11]
Guide de l’achat public
http://www.achat.caissedesdepots.fr/guide_formalites_guide_achat.htm
[12]
Guide des bonnes pratiques biomédicales
en établissement de santé, https://www.utc.fr/~farges/bonnes_pratiques/bpb_documents/guide_BPB/Guide_BPB_complet_v2002.pdf
Relative aux normes et projets de normes :
[13]
Norme NF S99-172 de septembre 2003. Exploitation des
dispositifs médicaux – Gestion des risques liés à
l’exploitation des
dispositifs médicaux dans les établissements de
santé.
[14 ]
Norme européenne NF EN 1441 Avril 1998. Dispositifs
médicaux - Analyse des risques.
[18]
Norme Iso 14971 du 30 novembre 2000 relative à l’analyse des
risques des dispositifs médicaux. Destiné au fabricant de
DM pour
constituer son dossier de marquage CE. A prévoir en début
de conception et de
développement du DM.
[19]
Norme NF S99-171 Maintenance des dispositifs médicaux -
Modèles
et définition pour l'établissement et la gestion du
registre sécurité, qualité
et maintenance d'un dispositif médical (RSQM).
[15]
Pr EN ISO 15 883-1 : Laveur désinfecteurs :
Exigences générales,
définition et méthodes d’évaluation.
[16]
Pr EN ISO 15 883-4 : Laveur désinfecteurs :
Exigences et tests
pour laveur désinfecteur, pour instruments réutilisables
thermosensibles incluant
les endoscopes. (WD pour endoscope).
Relative
aux textes réglementaires :
[20]
Directive 93/42/CEE du Conseil , du 14 juin 1993, relative aux
dispositifs
médicaux.
[46]
Décret N°2004-15 du 07 janvier 2004 portant code des
Marchés Publics.
[21]
Décret 2001-1154 du 05 décembre 2001 relatif à
l’obligation de
maintenance et au contrôle de qualité des dispositifs
médicaux prévus à
l’article L.5212-1 du code de la Santé Publique (3ème
partie :
Décrets), JORF N°284 du 07 décembre 2001.
[29]
Décret 2005-1309 du 20 octobre 2005. Mesures
générales
d’application de la loi « informatique et
libertés » modifiée par la
loi du 06 août 2004.
[22]
Arrêté du 03 mars 2003 fixant les listes des dispositifs
médicaux
soumis à l’obligation de maintenance et au contrôle de
qualité mentionnés aux
articles L.5212-1 et D.665-5-3 du code de la santé publique. JO
N°66 du 19 mars
2003, texte N°26. NOR : SANP0320928A.
[23]Circulaire
DGS/DH N°236 du 02 avril 1996 : désinfection des
endoscopes :
modalités de désinfection des endoscopes dans les lieux
de soins.
[24]
Circulaire N°672 du 20 octobre 1997 : stérilisation et
désinfection de
haut niveau.
[25]
Circulaire N°DGS/5C/DHOS/E2/2001/138 du 14 mars 2001 relative aux
précautions à
observer lors de soins en vue de réduire les risques de
transmission d’agents
transmissibles non conventionnels (ATNC).
[26]
Analyse de la circulaire DGS/DH/5C/DHOS/E2/2001/138 du 14 mars 2001
relative
aux précautions à observer lors de soins en vue de
réduire les risques de
transmission d’agents transmissibles non conventionnels http://www.sfed.org/pdf/Commentaire_circulaire138.pdf
[27]
Circulaire N°591 du 17/12/2003 relative aux modalités de
désinfection des
endoscopes dans les lieux de soins. (abroge
la circulaire N°236 du 02/04/1996). http://nosobase.chu-lyon.fr/legislation/desinfection
[28]
Lette circulaire DH/EM 1 N°98-7262 du 15 juillet 1998 relative
à la sécurité d’utilisation
des dispositifs médicaux. Recommandations relatives à
l’acquisition et à
l’utilisation de machines à laver et désinfecter les
endoscopes. Bulletin
officiel N°1998/32.
[30]
Loi N°2004-801 du 06 août
2004 relative à la protection des personnes physiques à
l’égard des traitements
de données à caractère personnel et modifiant la
loi N°78-17 du 06 janvier 1978
relative à l’informatique, aux fichiers et aux libertés.
[32]
Loi 78-17 du 06 janvier 1978 relative à l’informatique, aux
fichiers et aux libertés.
Relative
à des études diverses
[33]
Etude comparative APA et
Glutaraldéhyde. Caractéristiques des
désinfectants. Rapport SFED 2ème
réunion Paris. 05 octobre 2002.
[37]
Rapport d’activité de la SFED
http://www.sfed.org/pdf/Compte-rendu_AG2003.pdf
Relative aux travaux des étudiants
biomédicaux
[34]
Franck Lemistre, Yannick Rochais, Analyse de la criticité pour
l’optimisation des ressources biomédicales, Projet DESS
« TBH », UTC,
1999, URL : https://www.utc.fr/~farges/dess_tbh/98-99/Projets/ACORB/acorb.htm
[35]
J.Natan, D.Georgin, H.Szymczak, Méthodologie et critères
de choix
dans l’externalisation de la maintenance, Projet qualité,
UTC,
2004-2005.
Relative à des articles
[36]
L’acide péracétique : étude de son
efficacité pour la désinfection des
endoscopes digestifs. Techniques hospitalières 2002, 666 :
70-75.
[38]
Enquête sur la compatibilité APA/endoscopes,
résultats préliminaires, Acta
endoscopica, volume 2003, 33, N°2.
[39]
Michel Feugas, Réforme de la
loi Informatique et Libertés et données personnelles de
santé, Techniques
Hospitalières, mai juin 2005, N°691.
[40]
Tableau d’honneur des 50
meilleurs hôpitaux de France,Le point, juin 2006, N°1759
Relative
aux formulaires de déclaration C.N.I.L
[41]
Formulaire de déclaration
normale C.N.I.L, dans le cas d’une télé
déclaration, (déclaration en
ligne) http://www.cnil.fr/index.php?id=1974
[42]
Formulaire de déclaration
normale version imprimable http://www.cnil.fr/fileadmin/documents/declarer/teleprocedures/formulaires/formulaireDN.rtf
Relative
aux manuels
d’accréditation des établissements de santé
[44
]Manuel d’accréditation des
établissements de santé, deuxième procédure
d’accréditation, septembre
2004 : http://www.unaibode.com/manuel_v2.pdf
Relative au code de la santé
publique
[45]
Art. L. 5211-1 du code de la
santé publique, édition 2003.
Relative à des décisions de
l’AFSSaPS sur les LDE
[17]
Décisions de
l’AFSSaPS relatives à l’utilisation des LDE
http://afssaps.sante.fr/htm/alertes/filalert/dm040205.htm
SOMMAIRE
GLOSSAIRE
AFIB :
Association Française des
Ingénieurs Biomédicaux
AFSSaPS :
Agence Française de
Sécurité Sanitaire des Produits de Santé
APA :
Acide peracétique
ATNC :
Agent Transmissible Non
Conventionnel
CHU :
Centre Hospitalier
Universitaire
CIL :
Correspondant Informatique
et Libertés
CNIL : Commission Nationale Informatique et
Libertés
DM :
Dispositif Médical
ESST :
Encéphalopathies
Spongiformes Subaiguës Transmissibles
GERMANDE :
Groupe d’Évaluation et
de Recherche sur les Machines à Nettoyer et
Désinfecter les Endoscopes.
HAS :
Haute Autorité en Santé
LDE :
Laveur Désinfecteur
d’Endoscopes
MCJ : Maladie de
Creuztfeldt-Jakob
MCO :
Médecine, Chirurgie,
Obstétrique
MP :
Maintenance préventive
PMSI :
Programme Médicalisé des
Systèmes d’Information
SFED :
Société Française
d’endoscopie Digestive
SNITEM :
Syndicat National de l’Industrie des Technologies Médicales