REMERCIEMENTS
Je
tiens à remercier Mr Pascal Boulud, président directeur
général de Siemens
Audiologie, ainsi que Valérie Trubert, directeur administratif
et financier, et
Zamir Aziz, responsable des ressources humaines, qui m’ont donné
l’opportunité
de réaliser mon stage de fin d’étude au sein d’une
société telle que Siemens.
Je
remercie tout particulièrement ma tutrice de stage, Melle
Hélène d’Hordain,
responsable qualité, pour toute l’aide et tous les conseils
qu’elle a pu
m’apporter. De plus, j’ai pu participer grâce à elle
à
beaucoup de ses
activités. J’ai ainsi pu profiter de son expérience dans
d’autres domaines que
ceux imposés par ma mission.
Je
remercie également toute l’équipe de Siemens Audiologie
qui m’a permis de
travailler dans une ambiance excellente!
Enfin,
je remercie mon suiveur de stage de l’Université de Technologie
de Compiègne,
Mr Gilbert Farges, responsable du Master Management de la Qualité,
pour tout
l’enseignement qu’il a pu nous transmettre durant cette année
universitaire et
pour les conseils pertinents apportés lors de sa visite sur le
lieu du stage.
SOMMAIRE
TABLE DES
ANNEXES. - 3 -
LISTE DES FIGURES
INTRODUCTION
GENERALE. - 5 -
GLOSSAIRE. - 6 -
PREMIERE
PARTIE :Présentation de l’entrprise. - 7 -
1.
Introduction. - 7 -
2. Le
personnel de
Siemens Audiologie. - 8 -
3. Les
produits
proposés par Siemens audiologie France. - 8 -
3.1. Les
intra
auriculaires. - 8 -
3.2. Les
contours
d’oreille. - 9 -
4. La
conjoncture
économique - 9 -
5. Le
système de
Management de la Qualité de Siemens
Audiologie. - 9 -
5.1.
Certification. - 9 -
5.2. Les
exclusions et
non applications - 9 -
5.3. Le
pilotage des
processus. …- 10 -
5.4. Le
système
documentaire qualité. - 11 -
DEUXIEME
PARTIE :Les principales missions du stage. - 12 -
1.
Présentation
des missions. - 12 -
2.
Redéfinition
et amélioration de la veille
réglementaire « Produit ». - 13 -
2.1.
Intérêt et enjeux de la veille réglementaire. - 13 -
2.2.
Problématique. - 13 -
2.3.
Objectif de la
mission. - 13 -
2.4.
Risques et
alternatives de la mission. - 14 -
2.5.
Spécification du besoin. - 14 -
2.6.
Méthode
utilisée. - 14 -
2.7.
Indicateurs de
performance. - 16 -
2.8.
Difficulté
rencontrée. - 16 -
2.9.
Perspectives
d’amélioration. - 16 -
2.10.
Conclusion. - 17 -
3.
Préparation
de l’audit externe et suivi des remarques
d’amélioration. - 17 -
3.1.
Intérêt et enjeux de l’audit externe. - 17 -
3.2.
Problématique. - 17 -
3.3.
Objectifs de la
mission. - 17 -
3.4.
Risques et
alternatives de la mission. - 17 -
3.5.
Méthode
utilisée. - 18 -
3.5.1.
Audit sur la
méreologie. - 17 -
3.5.2.
Audit sur le
marquage CE et la matériovigilance. - 17 -
3.5.3.
Evaluation
annuelle des fournisseurs et des
prestataires de service. - 17 -
3.5.4. Mise
en place des
remarques d’amélioration. - 18 -
3.6.
Indicateurs de
performance. - 23 -
3.7.
Difficultés
rencontrées. - 24 -
4. Audits
qualités internes. - 24 -
4.1.
Intérêt et enjeux des audits internes. - 24 -
4.2. Etude
du
déroulement des audits internes en France
et à l’étranger - 24 -
4.3.
Objectifs de la
mission. - 25 -
4.4.
Risques et
alternatives de la mission. - 25 -
4.5.
Méthode
utilisée. - 26 -
4.6.
Indicateur de
performance. - 27 -
4.7.
Rédaction
du compte rendu d’audit - 27 -
4.8.
Difficultés
rencontrées lors des audits internes. - 27 -
TROISIEME
PARTIE :Les expériences apportées par le
stage. - 29 -
1. Les
diverses
expériences acquises. - 29 -
2. Les
apports pour
Siemens audiologie. - 29 -
3. Les
principales
difficultés rencontrées. - 30 -
3.1.
Difficulté
pour rencontrer les personnes. - 30 -
3.2.
Difficulté
de compréhension des textes. - 30 -
4. Les
améliorations qui auraient pues être apportées aux
missions. - 30 -
4.1.
Amélioration sur la préparation à l’audit externe. - 30 -
4.2.
Amélioration des audits internes en général - 31 -
4.3.
Recherches
à l'étranger
5. Les
différents aspects du métier de responsable
qualité
CONCLUSION
GENERALE
BIBLIOGRAPHIE. .- 33 -
TABLE
DES ANNEXES
Sommaire
Figure n°12 : Tableau des indicateurs et des
résultats obtenus pour la mission n°3
Dans le cadre de
leurs études,
les élèves de deuxième année de Master de
Management de
la Qualité
de l’Université
de technologie de Compiègne (UTC), doivent réaliser un
stage de fin d’étude pour
acquérir de l’expérience professionnelle dans le domaine
de la qualité et pour
mettre en pratique les connaissances qu’ils ont acquises. Ce stage a pu
être
effectué au sein de la société Siemens Audiologie
qui doit répondre à une
réglementation stricte car elle fabrique et commercialise des
dispositifs
médicaux. L’obtention du marquage CE et
de
la certification des produits et du système de management de la
qualité est
très importante pour les entreprises fabricant des dispositifs
médicaux. En
effet, elle permet non seulement la conformité aux lois
françaises et aux directives
européennes, la mise sur marché des produits mais permet
aussi d’instaurer une
confiance vis à vis des clients sur la qualité et la
sécurité du produit.
Avant la
présentation du sujet du
stage ainsi que la réalisation des travaux effectués, il
est important de
présenter l’entreprise de manière plus
détaillée pour mieux comprendre le cadre
dans lequel se sont déroulées les différentes
missions. Les pensées
personnelles du stage, les difficultés rencontrées et les
améliorations qui
auraient pu être apportées seront quant à elles
présentées par la suite.
Sommaire
AFSSAPS :
Agence française de sécurité sanitaire des
produits
de santé
BTE:
Behind the ear
CEPS: Comité
économique des produits de santé
CEPP: Comité
économique d’évaluation des produits et prestations
CRM:
customer relation ship management
DEEE:
Déchets des équipements électriques et
électroniques
ERP: Enterprise
resource planning
FAB:
Fabrication
ISO:
international standard organization
ISO 9001:2000: Norme ISO 9000, version 2000
ISO 13485:2003 : Norme ISO 13485, version 2003
ITE :
in the ear
LC :
Laboratoire des coques
MAG :
Magasin-atelier
MàJ,
MAJ : Mise à jour
PG :
Procédure général
PLM:
Product life management
Processus
& IT: processus et système d’information
S.A.F: Siemens
Audiologie
France
S.A.T: Siemens
Audiologische Technik
SAVC :
Service après vente des contours d’oreille
SAVI :
Service après vente des intra auriculaires
SCM:
supply chain management
S.H.I:
Siemens Hearing
Instruments
S.M.I: Siemens
Medical Instruments
SNITEM :
Syndicat national de l’industrie des technologies
médicales.
UV :
Ultra violet
Sommaire
Siemens AG est un
grand groupe industriel
allemand qui fabrique des produits électroniques et
informatiques [1] et
qui possèdent des filiales dans plusieurs pays, notamment dans
le milieu
médical [2].
Siemens
Audiologie
France (SAF) commercialise
des aides auditives ainsi que leurs services associés
auprès des
audioprothésistes en tenant compte de leurs attentes et en
accord avec les
objectifs de la maison mère, Siemens Audiologische Technik
(SAT), filiale
allemande du groupe Siemens medical solution. Elle
bénéficie à ce titre, de la
dynamique d’un groupe mondialement connu. Le groupe Siemens
Audiologische
Technik, est présent dans le monde à travers 11 filiales
présentes notamment en
Europe (SAF en France), aux Etats Unis et en Asie [3]
(voir figure n°1).
Figure n°1 :
Organigramme
du groupe Siemens
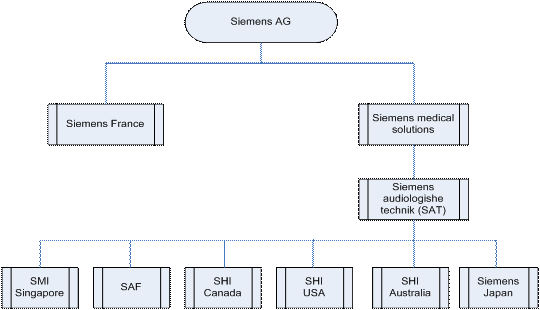
Source : Siemens
Audiologie
Liste des figures
Légende :
S.A.T : Siemens Audiologische
Technik, filiale
de Siemens Medical Solutions
S.M.I : Siemens Medical
Instruments, Singapour,
filiale de S.A.T.
S.H.I : Siemens Hearing
Instruments, USA,
filiale de S.A.T.
S.A.F : Siemens Audiologie
France, filiale de
S.A.T.
Siemens medical
solutions : Filiale du groupe
Siemens AG.
Le personnel de Siemens
audiologie est
estimé à environ 130
personnes réparties dans les services suivants :
-
La direction (dont
fait partie le service qualité)
-
Le service commercial
-
La comptabilité
-
La logistique
-
Le laboratoire des coques
-
La production
-
Le service après vente des intra
auriculaires
-
Le service après vente des contours
d’oreille
-
Le service marketing
-
Le service client
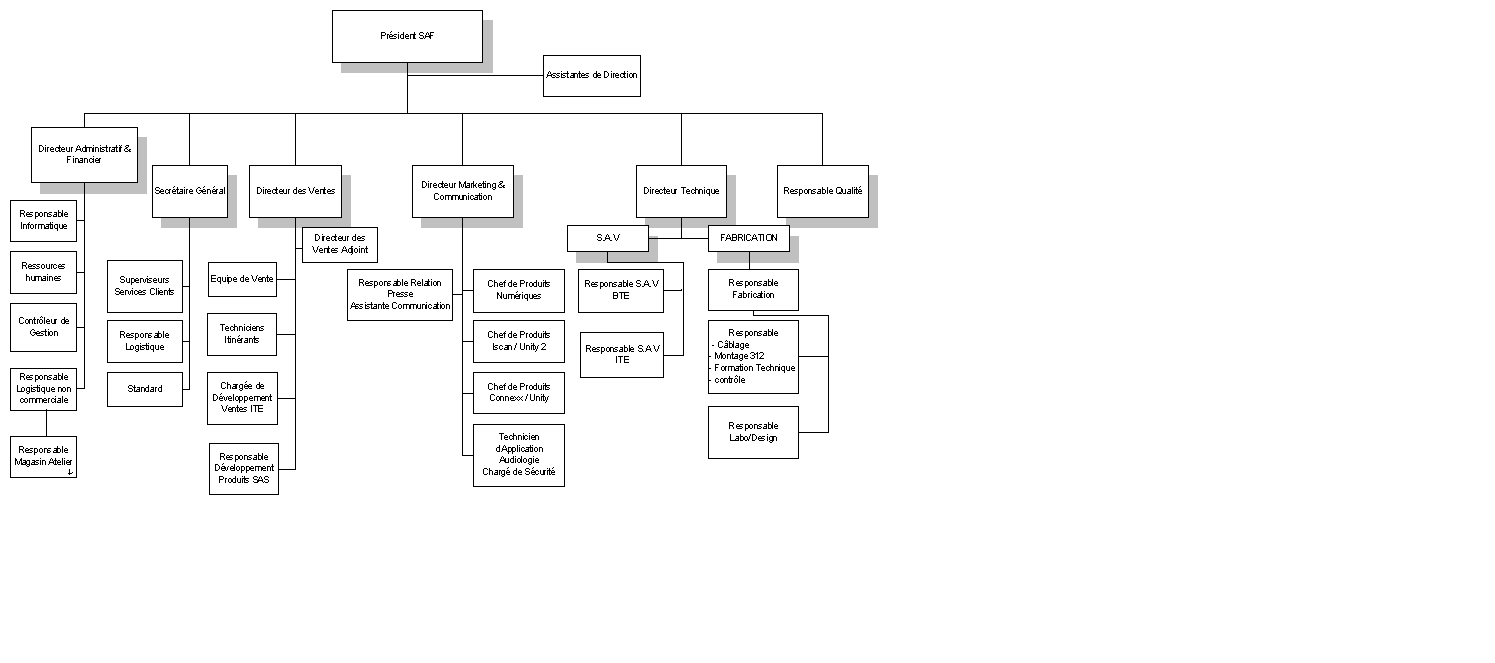
Un organigramme
référencé
parmi les documents de Siemens
Audiologie décrit les responsabilités et les
autorités de l’entreprise (voir
l’organigramme en
annexe 1).
Sommaire
Siemens
audiologie
France (SAF) assure la distribution de
deux types d’appareils auditifs : les intra auriculaires
(ITE : in
the ear), et les contours d’oreille (BTE : behind the ear) ainsi
que les accessoires
associés (télécommandes, piles, embouts…). De
plus, il existe plusieurs
catégories d’intra auriculaires et de contours d’oreille (Cielo,
Acuris,
Artis…) différenciés par les circuits
électroniques qui les composent, toujours
de plus en plus performants. Siemens, qui développe des aides
auditives depuis
1878, fait donc preuve d’une innovation
permanente
et offre une large gamme de produits de haute technologie
pour répondre aux besoins et attentes des
déficients auditifs [4].
Les intra
auriculaires (ITE) sont des appareils fabriqués grâce
à une empreinte de l’oreille du patient fournie par
l’audioprothésiste. Cette
empreinte permet au laboratoire des coques de réaliser une coque
sur mesure à
l’intérieur de laquelle sera introduit au service production le
circuit
électrique amplificateur de sons. Le service après-vente
des intra auriculaires
assure leur réparation.
Figure
n° 2 :
photographie d’un intra auriculaire [5]
Source :
Catalogue 2006 de Siemens Audiologie
Liste des figures
Les contours
d’oreille (BTE) sont des appareils fabriqués
par SMI à Singapour. Siemens Audiologie assure leur distribution
sur le
territoire français ainsi que leur réparation par le
service après-vente des
contours d’oreille.
Figure
n°3 :
Photographie d’un contour d’oreille [6]

Source :
Catalogue 2006 de Siemens Audiologie
Liste des figures
Sommaire
Sur
l’année
2004-2005, Siemens
Audiologie a effectué un chiffre d’affaire de 62 997 K€ et
obtenu 34,1 %
des parts de marché. Selon une enquête
réalisée en juin 2005, le taux de
satisfaction des clients atteint 75%.
Sommaire
Siemens
Audiologie
est certifié
ISO 9001:2000 [8]concernant
le système de management de la
qualité et
ISO 1385:2003 [9] spécifique aux
dispositifs médicaux. Les produits
de Siemens audiologie mis sur le marché ainsi que leur
accessoires, sont
également soumis au marquage CE pour assurer la
sécurité des patients et des
utilisateurs et leur libre circulation sur le territoire de l’Union
Européenne [10].
Le marquage CE est imposé par la directive 93/42/CEE [11] relative aux dispositifs
médicaux et dont la
mise en œuvre est facilitée par les
exigences de l’ISO 13485 [12].
Siemens
Audiologie
n’a pas d’activité de conception et
exclut le chapitre 7.3 « Conception et Développement
» de l’ISO 9001:2000 et de
l’ISO 13485:2003 de son périmètre de certification. La
conception des appareils
auditifs Siemens se fait aux Etats Unis par l’intermédiaire de
la filiale Siemens
Hearing Instrument (SHI) et en Allemagne au sein de la maison
mère Siemens
Audiologische Technik (SAT).
Les produits
fabriqués par SAT ne sont pas stériles :
ainsi les exigences liés aux produits stériles ne sont
pas applicables (paragraphes 7.5.1.3 et 7.5.2.2 de l’ISO 13485:2003).
Les produits
fabriqués par SAT ne sont pas implantables,
ainsi le paragraphe 8.2.4.2 « Exigences particulière
pour les dispositifs
médicaux implantables actifs et les dispositifs médicaux
implantables » de
l’ISO 13485:2003 n’est pas applicable.
Comme il existe un
contrôle qualité final des produits, le paragraphe 7.5.2
« Validation des
processus de production et de préparation du
service » de l’ISO 9001:2000 et
de l’ISO 13485:2003 n’est pas applicable.
Le
Système de
Management de la
Qualité et de la Sécurité
de
Siemens Audiologie France est basé sur les valeurs du groupe
Siemens AG, la
politique Qualité de Siemens Médical Solutions et celle
de SAT. Il s’appuie
également sur l’approche processus dont la cartographie est
représentée
ci-dessous :
Figure n°4 : Cartographie
des
processus de Siemens audiologie
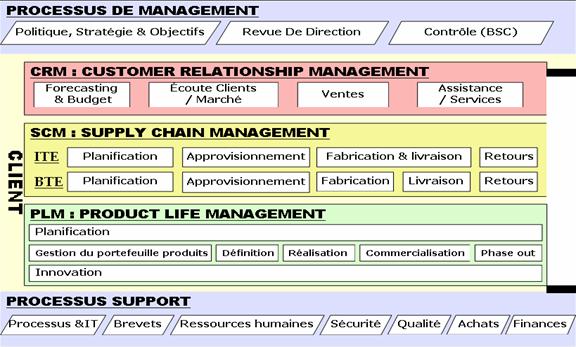
Source :
Manuel de Management de la Qualité et de la
sécurité de Siemens Audiologie
Liste des figures
La
cartographie des
processus est constituée de 5 macros
processus :
-
Le macro processus de management
-
Le macro processus de management de
la relation
avec la clientèle (CRM)
-
Le macro processus de management de
la chaîne
d’approvisionnement (SCM)
-
Le macro processus de management de
la durée de
vie du produit (PLM)
-
Le macro processus support
Chaque
macro
processus est constitué de sous
processus (voir la cartographie).
Les sous
processus
PLM « planification », « Définition »,
« Réalisation », « Innovation » et le
processus support « Brevet » sont pilotés
par SAT.
5.4. Système
documentaire qualité [3]
Le
système documentaire qualité de Siemens Audiologie
s’appuie sur le Manuel de Management
de la Qualité
et de la
Sécurité, mais aussi sur des
procédures, des modes opératoires
et des documents de travail référencés :
- Procédure
: Règle écrite d'organisation qui définit les
modalités de fonctionnement et les démarches à
entreprendre pour parvenir à un but.
- Modes
opératoire : Document qui décrit la
méthodologie adoptée par l'entreprise pour
réaliser une tâche définie.
- Document
de travail : Document évolutif décrivant la
planification du système de management de la qualité et
l’organisation
Tout le
personnel de
Siemens Audiologie peut consulter la
documentation qualité sur l’intranet de Siemens Audiologie.
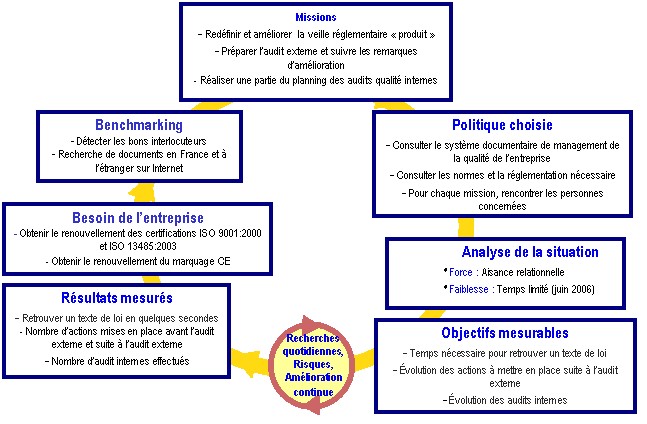
Le
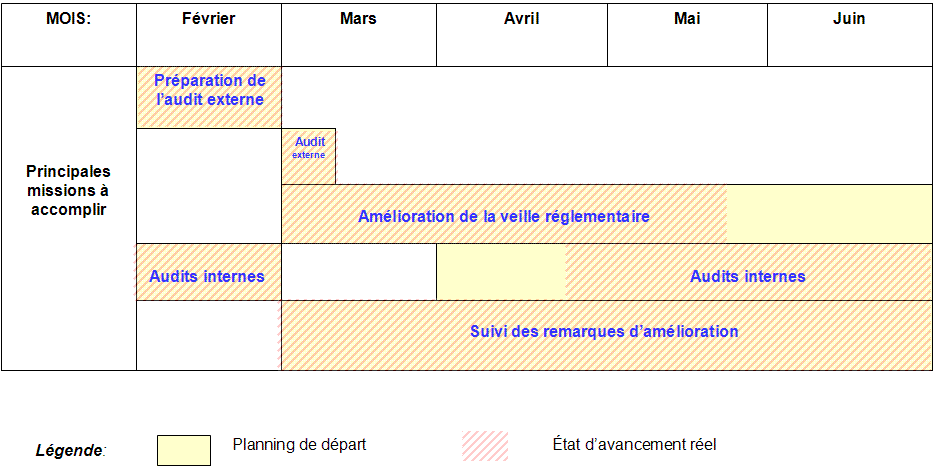
stage de 5 mois s’est déroulé de fin janvier
à fin juin (voir le
planning en annexe 2) et
comportait 3
missions principales (voir figure
n°5) :
-
Mission
n°1 :
Redéfinition
et amélioration de la veille réglementaire
« Produit »
-
Mission
n°2 :
Préparation
de l’audit externe et suivi des remarques d’amélioration
-
Mission
n°3 :
Réalisation
d’une partie du planning d’audits internes 2005/2006
Figure n°5 : Planification
dynamique
stratégique des missions
Sommaire
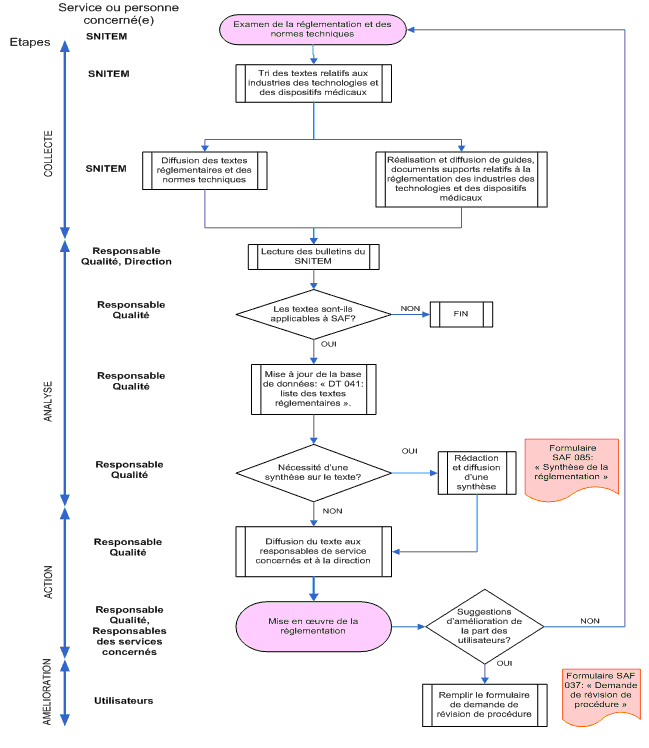
Il est
important que
l’organisme sache à quelle
réglementation sont soumis ses produits car le marché des
dispositifs médicaux
est un secteur très réglementé tant au niveau
international, européen, qu’au
niveau national.
Par
exemple, ils sont soumis à la directive 93/42/CEE
[11]
relative aux
dispositifs
médicaux qui impose le marquage CE [13]. La veille réglementaire
permet donc de
diminuer le risque de ne pas identifier les changements ou les
nouveautés
réglementaires.
De plus,
conformément au chapitre 7.2.1
« détermination des exigences relatives au
produit » des normes ISO
9001:2000 et ISO 1385:2003,
l’entreprise
doit déterminer les exigences réglementaires et
légales relatives au produit.
Siemens
Audiologie
est abonné au
SNITEM, syndicat national de l’industrie des technologies
médicales [14]. Cette
organisation
professionnelle créée en 1987 regroupant la majeure
partie de l’industrie des
technologies et des dispositifs médicaux envoie par mail
à la direction et au
service qualité ces différents documents :
-
Les nouveaux textes de loi relatifs
aux
industries des technologies et aux dispositifs médicaux.
-
Les normes techniques.
-
Les projets de textes relatifs aux
industries
des technologies et aux dispositifs médicaux.
-
Des documents supports explicatifs
(guides,
fiches thématiques) pour faciliter la compréhension des
textes de loi.
Le
responsable qualité effectue ensuite un tri et garde seulement
les textes en
rapport avec les produits de Siemens Audiologie. Ils sont ensuite
analysés afin
de mettre en œuvre les moyens nécessaires pour répondre
à cette réglementation.
La
réglementation concernant les
dispositifs médicaux étant en évolution constante,
il est important de suivre en
permanence la législation afin de mettre en œuvre les actions
qui s’imposent.
Or, l’organisme ne possédait pas d’outil adapté pour la
gestion de veille
réglementaire. En effet, ces textes réglementaires ainsi
que les documents
supports étaient conservés dans un fichier
électronique. Cependant, ils
n’étaient pas du tout classés et certains étaient
même devenus obsolètes au fil
des ans. Il existait également d’autres textes sous format
papier dans les
différents services de l’entreprise, notamment au service
qualité et à la
direction générale. Le risque qu’un texte de loi soit
oublié et ne soit pas
suivi devenait probable. De plus, il était devenu difficile de
retrouver
rapidement un texte de loi.
Le but de la
mission
était
d’organiser une veille réglementaire commune et accessible
à tous les membres
de l’entreprise. Pour ceci, il a fallu :
-
Centraliser les textes
réglementaires et les
documents supports
-
Les trier par type de texte
(directives, lois,
arrêtés, décrets…)
-
Les classer également par
thème suivant le sujet
dont traite les textes
-
Retrouver les versions
électroniques des textes
sous format papier grâce au site Internet du gouvernement :
Légifrance [15].
-
Identifier les versions en vigueur
et les textes
abrogés
Les risques potentiels ainsi que les
alternatives
envisagées
sont représentés ci-dessous :
Figure n°6 : Tableau
des risques et alternatives de la mission n°1
|
RISQUES
|
ALTERNATIVES
|
|
Ne pas bien comprendre ce dont traite les
textes de loi et donc de ne pas réussir à les classer
Ne pas savoir quels textes sont devenus
obsolètes
|
·
Lire les fiches explicatives
si elles existent
·
Se renseigner sur Internet.
·
Se renseigner auprès du
responsable qualité
|
|
Ne pas recevoir un nouveau texte de loi
envoyé par le SNITEM en cas d’absence du responsable
qualité
|
Le SNITEM envoie les nouveaux textes a deux
personnes dans l’entreprise: au responsable qualité et au
président directeur général. En cas d’absence
d’une des deux personnes, il y a toujours quelqu’un pour fournir les
nouveaux textes.
|
|
Ne pas correspondre au besoin de l’entreprise
|
·
Faire valider la veille
réglementaire par le responsable qualité et la direction
·
Prendre en compte les
remarques des utilisateurs et faire évaluer le support
|
L’évaluation
du besoin concernant
la veille réglementaire s’est faite avec le responsable
qualité et l’assistant
de la direction générale car il a été
montré que les principaux intéressés par
cette veille sont la direction et le
service qualité.
La
réorganisation des textes s’est
effectuée grâce à la création d’un nouveau
fichier Excel qui reprend tous les
textes de loi sur 4 onglets suivant la nature du texte :
·
Directives, lois
·
Décrets
·
Arrêtés, circulaires,
ordonnances
·
Projets de textes
Tous les textes
réglementaires et
documents supports sont enregistrés sur cette base de
données : le
document de travail DT 041 « Liste des textes
réglementaires » qui
permet de retrouver un texte selon sa nature ou selon son thème.
Il est
possible d’accéder par lien hypertexte à chaque texte de loi mais aussi
à des
répertoires contenant les listes des textes abrogés ou
les listes des documents
supports en français ou en anglais (voir
des extraits de la veille réglementaire en annexe 3).
Figure n° 7 : Diagramme
d’Ichikawa [16] représentant
les thèmes
des différents types de textes réglementaires
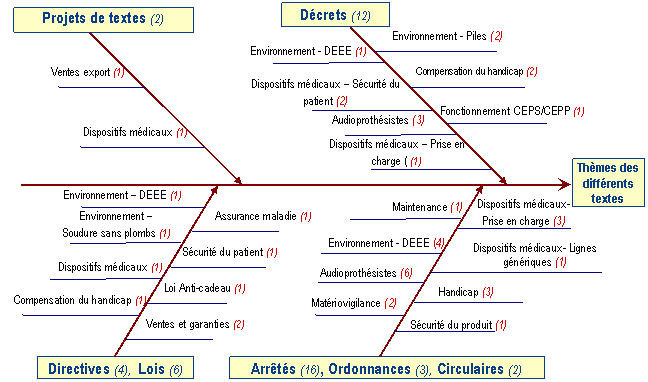
Les
Numéros entre parenthèse représentent les
nombres de textes attribués à chaque catégorie.
Liste des figures
Les indicateurs
de
performance et
les résultats obtenus sont présentés dans le
tableau ci-après.
Figure
n° 8 : Tableau des indicateurs et des
résultats
obtenus pour la mission n°1
|
INDICATEURS
|
RESULTATS OBSERVES
|
|
Nombre de textes classés dans la
veille réglementaire
|
·
4 directives et 5 lois
·
12 décrets
·
16 arrêtés, 6
ordonnances, 2 circulaires
·
2 projets de textes
·
32 arrêtés
abrogés concernant la prise en charge des aides auditives
·
28 documents supports en
français
·
10 documents supports en
anglais
|
|
Temps nécessaire pour retrouver un
texte
|
Quelques secondes
|
La principale
difficulté
rencontrée fut l’identification des textes abrogés et la
compréhension des
textes de lois. En effet, certains arrêtés modifient
certaines parties de
Codes, d’arrêtés ou de décrets et il est alors
difficile de garder un fil
conducteur global des exigences légales.
Cette veille
réglementaire étant
destinée à évoluer au fil des ans, il sera donc
nécessaire de la tenir à jour
en vue d’une amélioration continue, c’est pourquoi, une
procédure fixant les
responsabilités et les méthodes d’utilisation de la
veille réglementaire a également
été rédigée (voir le
logigramme créé pour
cette procédure en annexe 4).
Les remarques
des
utilisateurs
seront également prises en compte puisqu’il est
spécifié dans la procédure de
gestion de la veille réglementaire que tout
opérateur utilisant la procédure peut concourir à
son amélioration. Il peut en
effet transmettre ses suggestions au service qualité, par le
biais du document
SAF 037 "Demande de Révision de procédure" disponible sur
l'intranet.
Les suggestions des opérateurs sont ensuite analysées et
une réponse leur est
faite quelques temps après.
Il
sera également possible d’élargir la veille
réglementaire aux normes
techniques qui sont transmises elles aussi par le SNITEM.
La
réorganisation de la veille
réglementaire a donc donné naissance à un nouvel
outil référencé parmi les documents de
travail de Siemens Audiologie recensant
tous les textes réglementaires et documents supports liés
à la réglementation
qui ont pu être trouvés. Cette veille
réglementaire, beaucoup mieux ordonnée,
permet de retrouver et de comprendre plus facilement un texte car les
documents
supports explicatifs y sont directement accessibles.
Une fois ce nouvel outil
terminé, il a pu être
diffusé par le biais de l’intranet et consultable par tous les
membres de
l’entreprise.
Sommaire
L’audit externe
s’est
déroulé
début mars par un organisme notifié, le TUV [17], pour le
renouvellement de la certification ISO 9001:2000, ISO 13485:2003 et du
marquage
CE des appareils auditifs. Il s’avérait très important
pour l’organisme
d’obtenir ces certifications et le marquage pour deux raisons
primordiales :
-
Demeurer un organisme de
qualité qui s’assure de
la santé et de la sécurité de ses clients et des
utilisateurs
-
Continuer à vendre ces
dispositifs sur le marché
européen
Certaines tâches importantes qui
n’avaient
pas encore été
réalisées ont du être menées avant le
déroulement de l’audit externe tierce
partie:
-
Audit interne sur la métrologie
-
Audit interne sur le marquage CE et la
matériovigilance
-
Evaluation des fournisseurs et des
prestataires de service
Les deux principaux objectifs de la mission
sont
les
suivants :
-
Préparer l’audit externe
-
Mettre en place des actions suite
aux remarques
d’amélioration suggérées lors de l’audit externe
Les risques et les alternatives de la mission
sont
représentés
dans le tableau ci-après.
Figure n°9 : Tableau
des risques et alternatives de la mission n°2
|
RISQUES
|
ALTERNATIVES
|
|
Métrologie :
Ne pas reconnaître les
différents équipements de mesure de métrologie.
Oubli d’un appareil.
|
Demander des renseignements aux responsables
des services contenant ces équipements ou
aux techniciens.
Vérifier au moins deux fois tous les
différents types d’appareil.
|
|
Marquage CE :
Difficulté de compréhension de
la directive 93/42/CEE.
|
·
Se renseigner sur Internet.
·
Demander au responsable
qualité des explications.
|
|
Evaluation des
fournisseurs :
Personnes en contact avec les fournisseurs
non disponibles.
|
·
Prendre rendez vous avec les
personnes concernées à un moment où elles sont
disponibles.
·
Expliquer que
l’évaluation des fournisseurs s’effectue grâce à un
formulaire à remplir en quelques minutes seulement.
|
|
Suivi des remarques
d’amélioration :
Ne pas savoir quelles actions mettre en
place suite à certaines remarques.
|
·
Se renseigner sur Internet.
·
Organiser des réunions
avec les employés concernés pour trouver des solutions.
·
Prendre le temps de se
renseigner pour mettre en place ces actions dans l’année.
|
3.5. Méthode
utilisée
3.5.1. Audit
sur la métrologie
Plusieurs
services de Siemens Audiologie contiennent des équipements
utilisés pour la
fabrication, la réparation et le contrôle qualité
des appareils auditifs mis
sur le marché. Il est donc nécessaire que ces appareils
soient identifiés,
vérifiés, étalonnés afin de
préserver la conformité du produit.
Les
services audités contenant des appareils de surveillance et de
mesure sont les suivants :
-
Lignes de fabrication
-
Service après vente des intra
auriculaires
(SAVI)
-
Service après vente des
contours d’oreille
(SAVC)
-
Service qualité,
possédant les étalons de référence
-
Laboratoire des coques
Ces
équipements sont répertoriés dans une base de
données ACCESS, créée 4 ans
auparavant et jamais revue depuis.
Cette
base permet
l’enregistrement et la traçabilité des opérations
de maintenance et
d’étalonnage. Elle est
contrôlée une
fois par semaine par le responsable qualité qui vérifie
que les travaux de
maintenance et d’étalonnage ont bien été
effectués. De plus, les appareils sont
étalonnés avec des étalons de
référence appartenant au service qualité, eux
mêmes vérifiés à intervalle régulier
par des laboratoires extérieurs.
PLAN (préparation
de l’audit) :
-
Mener l’audit selon le paragraphe
7.6 de l’ISO
9001 et 13485 :« Maîtrise des dispositifs de
surveillance et de
mesures », le paragraphe
4.2.4 :« Maîtrise des
enregistrements »
et des remarques effectuées lors de l’audit
précédant.
-
Lire la procédure PG 007
« Maîtrise des
dispositifs de surveillance et de mesure ».
-
Utiliser la base ACCESS
répertoriant tout le
matériel utilisé ou mis hors service.
DO (faire) :
-
Répertorier les appareils
dans chaque service.
-
Repérer les appareils qui ne
sont pas référencés.
-
Prendre rendez-vous avec les
responsables de
chaque service pour explication si nécessaire sur le
matériel et pour leur
rappeler de l’étalonner.
-
Identifier les difficultés et
la bonne
réalisation des opérations de métrologie.
-
Rédiger le compte rendu
d’audit et le diffuser
aux personnes auditées.
CHECK (vérifier) :
Vérifier
que
tous les appareils possèdent une étiquette avec leur
référence et qu’ils sont
bien étalonnés.
ACT (Agir) :
- Référencer le
matériel qui ne l’était pas.
- Demander au responsable de service
d’étalonner
tous les appareils qui ne l’étaient pas encore.
- Proposer des actions
d’amélioration pour les
difficultés rencontrées (voir le compte
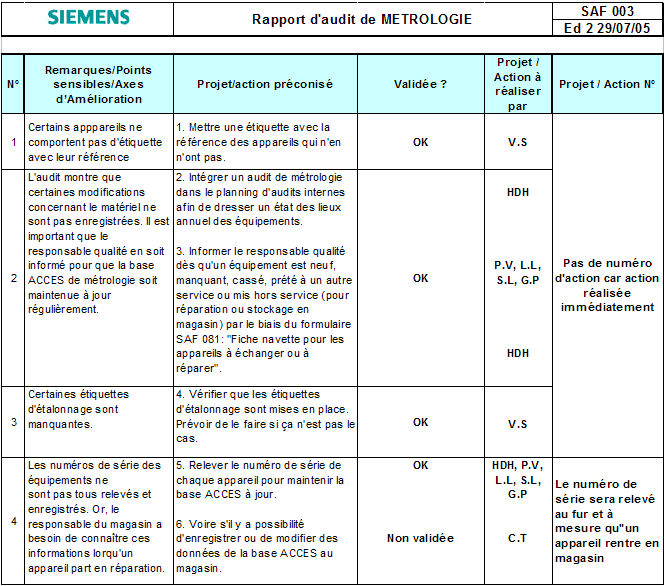
rendu d’audit en annexe 5).
En
partie
grâce à certains acteurs concernés, il a
été déterminé pour améliorer le
système de métrologie :
-
De répertorier le
matériel une fois par an
-
De créer un formulaire
référencé permettant de savoir
quel appareil revient ou part en réparation et doit être
échangé, afin de
maintenir la base ACCESS à jour (voir le
formulaire vierge en annexe 6).
3.5.2.
Audit sur le marquage CE et la matériovigilance
Il était très
important d’effectuer un audit interne pour vérifier que
l’organisme était bien
en accord avec la directive 93/42/CEE relative
aux dispositifs médicaux afin
d’obtenir
le renouvellement du marquage CE lors de l’intervention de l’organisme
notifié,
le TUV. L'objectif de cette directive axée
principalement sur les
exigences de sécurité pour les utilisateurs et sur les
exigences de performance
des matériels, tout au long de la durée de vie du
dispositif [18], est
d'harmoniser les
réglementations en Europe, afin de faciliter
la libre circulation des dispositifs médicaux [12].
Pour démontrer la
conformité aux exigences essentielles de la directives 93/42/CEE
et obtenir le
marquage CE, l’organisme doit mettre en place un « mode de
preuve »
qui comporte :
-
Un
système d’assurance qualité de la production qui comporte
l’ensemble des
méthodes et documents mis en œuvre dans la fabrication des
produits permettant
d’assurer qu’il est conforme aux spécifications définies
dans la documentation
technique des appareils [19].
-
Une
déclaration CE de conformité pour chaque famille
d’appareil dans laquelle l’entreprise
déclare que ces produits sont conformes aux exigences de la
directive [20].
La directive
93/42/CEE permet de disposer de produits dont l’utilisation ne
compromet pas
l’état clinique et la sécurité des patients et des
utilisateurs. La maîtrise
des risques doit donc permettre leur réduction à un
niveau acceptable en regard
des bienfaits apportés par le dispositif. De plus, l’entreprise
doit mettre en
place un système de collecte de données appelé la
matériovigilance, qui
consiste à prévenir l’autorité compétente
lors d’un incident ayant entraîné la
mort ou la dégradation de santé d’un utilisateur [21], [22] .L’autorité
compétente, l’AFSSAPS (Agence Française
de Sécurité Sanitaire
des Produits de Santé) est
alors chargée d’analyser l’incident et de décider s’il
faut prendre des mesures
appropriées telle que de retirer le
produit du marché [23].
PLAN (préparation
de l’audit) :
- Lire la directive 93/42/CEE
concernant les
dispositifs médicaux et relever tous les éléments
que Siemens Audiologie doit
posséder et démontrer.
- Lire les procédures PG
028 « Marquage
CE » et PG
027 « Matériovigilance ».
-
Préparer un plan d’audit.
- Prendre un rendez-vous avec le
responsable
qualité.
DO (faire) :
-
Chercher les modes de preuve.
- Rédiger le compte rendu
d’audit.
CHECK (vérifier) :
Vérifier
que
le système d’assurance qualité de la production est en
accord avec les
exigences de la directive.
ACT (Agir) :
Une
seule
remarque d’amélioration a pu être préconisée
lors de l’audit qui consistait à
continuer de maintenir à jour les procédures du
système de management de la
qualité car selon la directive, elles doivent être revues
et tenues à jour, ce
qui n’était pas le cas pour toutes. Cependant, ce processus
était en cours de
réalisation (voir le plan d’audit en
annexe 7).
3.5.3.
Evaluation annuelle des fournisseurs et des prestataires de service
Selon le
chapitre
7.4.1 :
« Processus achat » de la norme ISO 9001:2000,
« l’organisme
doit évaluer et sélectionner ses fournisseurs en fonction
de leur aptitude à
fournir un produit conforme ». Pour ceci, « les
critères de
sélection, d’évaluation et de réévaluation
doivent être établis. Les
enregistrements des résultats des évaluations doivent
être conservés ».
PLAN (préparation
de l’audit) :
- Lire le chapitre 7.4.1 de la norme
ISO 9000:2000
- Lire le mode opératoire
« Evaluation des fournisseurs
et des prestataires ».
- Identifier tous les fournisseurs
et
prestataires
de service à évaluer.
- Se renseigner grâce à
l’organigramme de Siemens
Audiologie et auprès du responsable qualité, pour savoir
quelles personnes de
l’entreprise sont aptes à évaluer les fournisseurs.
- Prendre un rendez-vous avec ces
personnes.
DO (faire) :
Cette
évaluation a été menée
grâce à une liste répertoriant les fournisseurs et
les prestataires de service remise
par le responsable qualité.
11 personnes ont
été interrogées,
pour la plupart au service achats à la comptabilité et au
service
Marketing :
1. La
secrétaire générale
2. La chef de produit Unity2/Iscan
3.
Le directeur marketing et commercial
4. Le
directeur technique
5. Le
responsable des ressources humaines
6. Le
responsable achats
7. Le
comptable fournisseurs
8. Le
chef de produit Connexx
9. La
coordinatrice logistique
10. La responsable relation presse
11. Le responsable du SAV des contours
d’oreille
Cette
évaluation consistait à recueillir
l’évaluation des personnes interrogées suivant un
formulaire pré-établi à compléter.
Grâce à un système de notation suivant
les cases cochées, chaque fournisseur a pu être
évalué selon des critères
différents :
-
Notation selon 5 critères
différents pour les
fournisseurs : le délai de livraison, la fiabilité
des délais annoncés, la
conformité des documents de livraison, le conditionnement
adapté et la qualité
du produit.
-
Notation selon 4 critères
différents pour les
prestataires de service : la qualité de la prestation, le
respect des
durées et des délais annoncés, la qualité
de la facturation et la
communication.
Pour chaque
critère, les
fournisseurs obtiennent :
-
5 points si le critère est
satisfaisant
-
3 points si le critère est
moyennement
satisfaisant
-
1 point si le critère est
mauvais
Il suffit
ensuite de
sommer tous
les points obtenus et d’établir la moyenne pour chaque
fournisseur et
prestataire. On obtient ainsi la catégorie à laquelle
appartiennent les fournisseurs :
-
Classe
A - Moyenne comprise entre 3 et 5 points : fournisseur ou
prestataire
privilégié, à conserver.
-
Classe
B - Moyenne comprise entre 3 et 1,5 points : fournisseur
ou
prestataire moyen, à surveiller.
-
Classe
C -Moyenne intérieure à 1,5 : fournisseur
ou prestataire mauvais,
à statuer.
Ces formulaires
ont
ensuite été
tous rassemblés pour la constitution du dossier
d’évaluation annuelle des
fournisseurs et des prestataires de service.
CHECK (vérifier) :
Le
système de
notation permet de voir si certains fournisseurs ont obtenu une
mauvaise
évaluation. Or, il s’est avéré que Siemens
Audiologie était plutôt satisfait de
ses fournisseurs puisque aucun fournisseur ou prestataire de service
n’a obtenu
de mauvaise évaluation.
ACT (Agir) :
Pour
améliorer la prochaine évaluation annuelle des
fournisseurs, il faut revoir le
formulaire car certaines personnes interrogées ont
suggéré de rajouter des critères
intéressants à évaluer, celui de la communication
et de l’innovation des
produits. En effet, le critère de communication était
déjà présent pour
l’évaluation des prestataires de service mais pas pour celle des
fournisseurs (voir la nouvelle version du formulaire
vierge en annexe 8).
3.5.4. Mise
en place des remarques d’amélioration
Suites aux
remarques
de l’audit
externe, plusieurs actions d’amélioration ont pu être
mises en place (voir le détail des actions
déléguées en
annexe 9) dont les
principales comportaient :
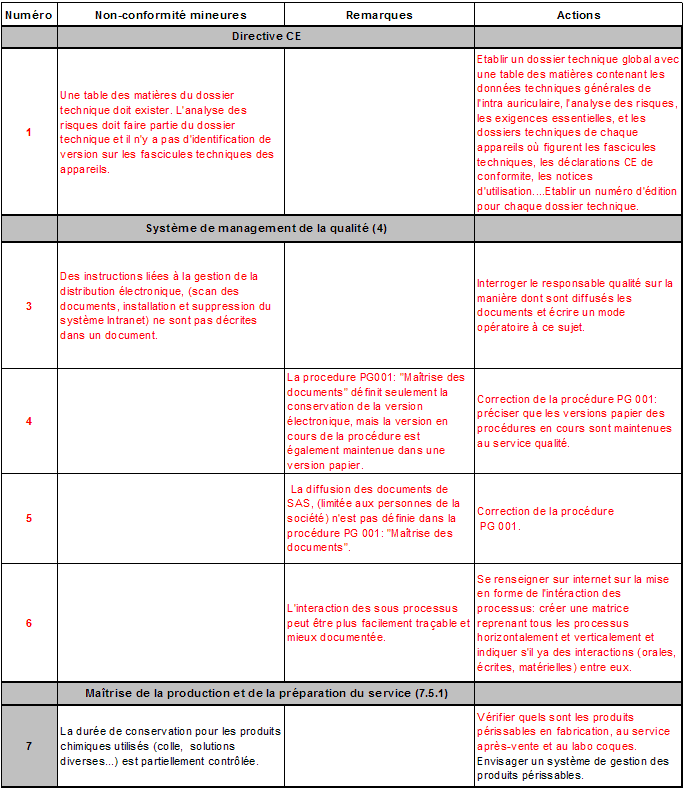
- La
création de 3 matrices : l’une pour l’interaction des
processus et deux autres pour s’assurer que tous les sous processus et
les champs des audits couvrent bien tous les chapitres des normes ISO (voir un extrait en annexe
10).
- La
réalisation d’un dossier technique global des intra auriculaires
comprenant l’analyse des risques, les exigences essentielles à
la directive 93/42/CEE et les dossiers techniques de chaque type
d’appareil dans lesquels figurent les déclarations CE de
conformité, les fascicules techniques et les notices
d’utilisation.
- La
modification et la correction de certaines procédures.
- La
vérification des produits
périssables au laboratoire des coques, en fabrication et au
service après vente même si un système de gestion
des produits périssables n’a pas encore été mis en
place.
Les indicateurs
de
performance et
les résultats obtenus sont présentés dans le
tableau ci-après :
Figure
n° 10 : Tableau des indicateurs et des
résultats
obtenus pour la mission n°2
|
INDICATEURS
|
RESULTATS OBSERVES
|
|
Préparation de l’audit
externe :
Nombre d’action de préparation
à l’audit externe
Audits métrologie et
marquage CE :
- Nombre d’appareils
référencés et qui ne l’était pas
- Nombre d’actions
d’amélioration validées
Evaluation des
fournisseurs :
- Nombre de fournisseurs à
évaluer
- Nombre de prestataires de
services à évaluer
- Nombre de personnes
évaluatrices
|
3 préparations :
- Audit sur la métrologie,
- Audit sur le marquage CE
- Evaluation annuelle des
fournisseurs et des prestataires de service.
- Une quarantaine d’appareils
référencés
- 5 actions pour la
métrologie
- 1 action pour le marquage CE
- 7 prestataires de service
- 11 personnes évaluatrices
|
|
Suivi des remarques
d’amélioration :
- Nombre d’actions
d’amélioration déléguées à mettre en
place
- Nombre d’actions
d’amélioration mises en place
|
- 19 actions d’amélioration
déléguées
|
Liste des figures
Pour la
métrologie, il fut
difficile au départ d’identifier les différents
équipements de mesure (par
exemple les fers à souder, les pistolets UV, les
polymérisateurs, les
voltmètres, les pieds à coulisse, les moteurs à
polir, etc.…). Il a également
été difficile de convenir de rendez-vous avec les
responsables de service à
cause de leur manque de disponibilité.
Même si la
plupart des actions
ont pu être réalisées, il a cependant
été difficile de trouver le temps
nécessaire pour mettre toutes les actions d’amélioration
préconisées suite à
l’audit externe, car la fin du stage touchait à son terme.
Seules deux actions
n’ont pas pu être mises en place :
-
Un système de gestion des
produits périssables
-
S’assurer que le service des
ressources humaines
a bien pris en compte les remarques concernant le document global de
formation
Sommaire
Selon le
paragraphe
8.2.2 des
normes ISO 9001:2000 et ISO 13485:2003,
« l’organisme doit mener des audits internes à
intervalles planifiés ».
Siemens audiologie a donc mis en place un planning des audits internes
pour
l’année 2006 (voir planning des audits en
annexe 11).
La pratique
des
audits internes
étant non seulement obligatoire, elle donne à une
organisation une assurance sur le degré de maîtrise de ses
opérations et lui
apporte des conseils pour les améliorer tout en contribuant
à créer de la
valeur ajoutée.
Remarque : Suite
à l’audit externe, le
planning
des audits internes
n’a pas exactement été suivi puisque les auditeurs du TUV
avaient déjà passé en
revue certains champs d’audit interne et apporté des remarques
d’amélioration.
Les efforts se sont donc concentrés sur les champs d’audit
interne qui
n’avaient pas été développés par manque de
temps lors de l’audit externe.
Pour le bon
fonctionnement de la
mission, il était important de se renseigner sur la façon
dont se déroule les
audits internes en France [24], [25], et
à l’étranger [26], [27],
[28], pour
pouvoir
s’en inspirer et anticiper les problèmes les plus
fréquents. Une recherche sur
Internet s’est donc révélée
bénéfique et très intéressante sur le
processus [27],les
protocoles d’audits [28] et sur les
problèmes fréquemment rencontrés en audit [25].
Le but de la
mission
était de
réaliser en tout 5 audits :
-
L’audit
interne sur la
métrologie
-
L’audit
interne sur le
marquage CE et la matériovigilance
-
L’audit
interne sur le
processus CRM assistance et services (service de la hotline)
-
L’audit
interne sur le
processus SCM ITE et BTE :
Livraison - Magasins (Stockage- Réception, Expédition)
-
L’audit
interne du
service après vente des BTE
Pour anticiper
certains événements,
il était important d’envisager à l’avance les risques
potentiels liés à l’audit
interne et de se renseigner sur Internet à ce sujet [25] afin
de procéder à des audits qualité bien
acceptés. En
effet, les audits dépendent de la coopération de
plusieurs acteurs et peuvent
parfois engendrer quelques tensions, le but n’étant
pas de remettre en question le travail des personnes mais de trouver
ensemble
des points d’amélioration.
Figure
n° 11 : Tableau des risques et alternatives
de la
mission n°3
|
RISQUES
|
ALTERNATIVES
|
|
Personne à auditer non disponible
|
·
Convenir d’un rendez-vous
à un moment où les activités de la personne ne
seront pas trop perturbées.
·
Si la personne est absente
plusieurs jours, mener l’audit avec une autre personne du même
service qui saura également répondre aux questions.
|
|
Manque de coopération de la part du
service ou du personnel audité
|
·
Ne pas négliger la
communication et les explications pour une meilleure
compréhension.
·
Campagne de sensibilisation
à prévoir sur les exigences des normes et du
système de qualité de l’entreprise.
|
|
Difficulté à faire adopter les
actions d’amélioration
|
·
Organiser des réunions
qualité pour que les personnes du service audité puissent
opter avec le responsable du service pour les solutions qui leur
semblent les plus appropriées
·
Accompagnement de la conduite
au changement à prévoir si nécessaire.
|
Il
s’est révélé nécessaire de détecter
les bons interlocuteurs à auditer,
notamment grâce à l’organigramme de Siemens Audiologie (voir annexe 1)
qui précise la fonction du
personnel clé de
l’entreprise et des différents responsables. La
méthode utilisée suit la
roue de Deming appelée également «méthode du
PDCA» :
PLAN (préparation
de l’audit) :
-
Connaître
les
exigences des normes ISO 9001:2000 et ISO 13485:2003 concernant le
thème de
l’audit.
-
Connaître
les procédures
ou les modes opératoires en rapport avec le thème de
l’audit.
- Lire
les
fiches des
processus en rapport avec l’audit.
- Lire
la
procédure PG
004 « Audits internes qualité ».
- Lire
le
document de
méthodologie d’audits internes de Siemens Audiologie pour
s’inspirer des
questions à poser.
-
Préparer
le plan
d’audit.
- Lire
le
compte rendu
d’audit de l’année précédente.
-
Prendre
un rendez-vous
avec la personne à auditer.
DO
(faire) :
- Poser les questions en prenant des
notes sur les
réponses apportées.
- Poser des questions
supplémentaires si
nécessaires.
- Demander des modes de preuve.
- Proposer des actions
d’amélioration mais aussi
prendre en compte celles qui sont suggérées.
- Rédiger le compte rendu
d’audit.
- Diffuser le compte rendu d’audit
aux
personnes
auditées et au responsable de service.
- Organiser une réunion de
clôture de l’audit avec les
personnes auditées et le responsable
du service afin de désigner les pilotes des actions
d’amélioration retenues et
à mettre en place.
CHECK (vérifier) :
- Vérifier que les exigences
des normes ISO
s’appliquent.
- Vérifier si les
procédures en cours s’appliquent.
- Vérifier que tout ce qui
est
dit par la personne
auditée peut être prouvé par des supports
écrits.
- Vérifier que les supports
écrits sont bien des
documents référencés dans le système
documentaire de Siemens Audiologie.
- Vérifier si les remarques
de
l’audit précédent
ont été prises en compte.
ACT (agir) :
- Discuter avec la personne
auditée pour savoir
quelles actions d’amélioration pourraient être mises en
place.
- Opter pour les solutions
d’amélioration à mettre
en place durant la réunion de clôture. La décision
est à prendre avec les
personnes concernées, le responsable du service et le
responsable de l’audit.
- Suivre le cours de la mise en
place
de ces
actions d’amélioration
Les indicateurs sont résumés
dans le
tableau
ci-dessous :
Figure
n° 12 : Tableau des indicateurs et des
résultats
obtenus pour la mission n°3
|
INDICATEURS
|
RESULTATS OBSERVES
|
|
5 audits
internes à réaliser
|
3 audits internes réalisés
|
|
Temps nécessaire pour réaliser
un audit interne
|
Environ une heure par personne
auditée
|
|
Nombre de personnes auditées
|
8 personnes auditées
|
|
Nombre d’actions d’amélioration mises
en place
|
- 5 actions pour la
métrologie
- 1 action pour le marquage CE
- 14 actions pour l’audit
assistance et services
|
Liste des figures
Suite à
chaque
audit, un rapport
par personne auditée reprenant les principaux
éléments de réponse a pu être
réalisé et conservé électroniquement. Ces
rapports ont permis de garder une
trace des principaux éléments de réponse pour
faciliter la réalisation du
compte rendu final qui est un document référencé
de Siemens audiologie. Les
points forts du champ de l’audit ainsi que les axes
d’amélioration à envisager
et la conclusion de l’audit figurent sur ce compte rendu (voir
le compte rendu d’audit de métrologie en annexe 5). Il est
ensuite envoyé par mail aux participants ainsi qu’au responsable
de service qui
décide quelles actions d’amélioration il peut mettre en
place durant l’année. Elles
seront suivies en parallèle par le
responsable qualité.
Un audit
révélant quelques dysfonctionnements dans un
service a particulièrement été difficile car en
tout, 4 personnes ont dû être
interrogées et elles n’étaient pas toutes d’accord sur
les actions
d’amélioration à mettre en place. Une réunion de
clôture avec le chef de
service et les membres du service audité a donc
été organisée afin de trouver
un terrain d’entente entre tous les acteurs puisque certains
étaient mêmes
réticents à changer quelque peu leur façon de
travailler. Il est alors
important de ne pas négliger la communication pour expliquer au
personnel les
raisons de ces changements.
Globalement, il
était également difficile d’obtenir des
rendez-vous avec les personnes auditées car elles avaient
souvent beaucoup de
travail et peu de temps à consacrer à l’audit. Certains
audits internes ont
donc été difficiles à planifier et ont même
duré plusieurs semaines, le temps
de pouvoir rencontrer toutes les personnes concernées selon
leurs
disponibilités. C’est pourquoi seuls 3 audits sur
5 ont pu être réalisés.
De
plus, il est
difficile de mener l’audit en pensant à
tous les éléments ci après sans faire quelques
oublis :
-
Les exigences des normes
-
L’application des procédures
-
Demander systématiquement des
modes de preuves
-
Penser à poser les bonnes
questions au bon
moment
-
Vérifier que les supports
écrits sont référencés
-
Vérifier les remarques de
l’audit précédent
Sommaire
Outre les
missions
principales présentées en deuxième
partie, il a également été intéressant de
participer à d’autres activités
telles que :
- La rédaction de 2
procédures et de 4 modes
opératoires divers, aussi bien pour la fabrication, le service
après-vente que
pour le service qualité et la comptabilité.
- La traduction d’une
procédure
de réparation en
anglais qui avait été rédigée par
l’Allemagne
afin d’optimiser la compréhension des techniciens
à ce propos.
- La sensibilisation des techniciens
sur le port
du bracelet antistatique et sur sa fréquence de
vérification.
- La remise à jour de
certains
documents de
travail référencés parmi la fabrication, le
service après vente et le
laboratoire des coques.
Le fait
d’observer le
fonctionnement global d’une
entreprise telle que Siemens Audiologie et de participer à son
amélioration est
très instructif. De plus, ce stage a permis de rencontrer
diverses personnes
dans des domaines différents (fabrication, service après
vente, service
marketing, service achats, comptabilité, direction, etc.) et de
réaliser
parfois des procédures pour ces services, ce qui a permis de
mieux comprendre certaines
activités, et d’élargir ainsi son niveau de connaissance
aux différents domaines
professionnels présents en entreprise.
Les personnes
rencontrées lors des audits ou même lors de
rédaction de mode opératoire et de procédures ne
connaissaient pas forcément le
domaine de la qualité et il a fallu adapter son langage aux
différentes
personnes et aux différents contextes et même leur
expliquer parfois certains
points de fonctionnement de la qualité ou des normes ISO.
Sommaire
Les différents
apports
pour l’entreprise
durant la durée du
stage ont été principalement les suivants :
-
Préparation de l’audit externe
-
Mise en place d’actions
d’amélioration suite à
l’audit externe
-
Avancement du planning d’audits
internes
-
Ecriture de procédures et de
modes opératoires
utiles pour l’entreprise
-
Amélioration de la veille
réglementaire
-
Uniformisation des documents de
travail dans
plusieurs services
-
Sensibilisation du personnel au port
du bracelet
antistatique
Siemens
Audiologie
privilégie
beaucoup le contact et la communication avec les clients et c’est
pourquoi il
existe de nombreux services en interface avec les clients pour
répondre à leurs
besoins et à leurs exigences. Il est donc difficile d’obtenir
des rendez-vous
avec des personnes dont la fonction consiste à répondre
aux clients. Le seul
moyen était d’organiser les réunions à des moments
où les clients téléphonent
le moins pour ne pas être dérangé par les appels
téléphoniques, ou encore que
les personnes auditées transfèrent ces appels vers les
autres opérateurs à ces
moments.
D’autres
personnes
avaient
également beaucoup de travail et peu de temps à consacrer
aux entrevues pour
des renseignements, les audits internes ou pour l’écriture de
procédures et de
modes opératoires. Pour effectuer ces différentes
tâches, il a donc fallu attendre
qu’elles aient un moment de libre, et donc de discuter avec elles de
leurs
disponibilités éventuelles.
Outre la
compréhension de
certains textes de loi, il est parfois difficile de comprendre des
termes
techniques en anglais lors de la traduction d’une procédure
provenant de
l’Allemagne concernant les réparations électroniques des
appareils. En effet,
la manière dont ces termes sont employés en
français par les techniciens n’est
pas forcément une traduction mot à mot de l’anglais.
Sommaire
Avec le recul, il aurait
été intéressant de
préparer l’audit interne sur le marquage CE en se basant d’une
part sur la directive
93/42/CEE et d’autre part sur la norme ISO 13485:2003, toutes deux
relatives
aux dispositifs médicaux. En effet, l’application des normes
n’est pas obligatoire
mais elles apportent présomption de conformité aux
exigences essentielles des
directives de la nouvelle approche d’harmonisation dont fait partie la
directive 93/42/CEE et a donc une influence directe sur la
qualité du marquage
CE [12].
Malgré l’audit interne sur le
marquage CE et la
matériovigilance, certains points ont tout de même
été soulevés par les
auditeurs externes. En effet, les données techniques
générales des intra
auriculaires SIEMENS, l’analyse des risques et les dossiers techniques
de
chaque appareil contenant leur déclaration CE de
conformité, leur fascicule
technique et leur notice d’utilisation étaient des documents
différents, ce qui
pouvaient mener à la longue à des erreurs
d’identification. Un dossier
technique unique a donc été créé avec une
table des matières reprenant tous les
éléments cités (voir les remarques de
l’audit externe en annexe 9).
Il est parfois
difficile de mener l’audit en pensant à tous
les éléments cités précédemment en
même temps et quelques oublis se sont
parfois fait ressentir. Il aurait été judicieux
d’augmenter le nombre des modes
de preuve afin d’obtenir un compte rendu final le plus robuste possible.
Il aurait pu
être intéressant de
se renseigner d’avantage sur ce qui est couramment fait à
l’étranger sur les
différentes missions (benchmarking). Cependant, il est assez
difficile de
trouver des renseignements sur chaque sujet, c’est pourquoi seul le benchmarking sur les audits internes
a pu être détaillé.
Il a
déjà été montré que la
démarche qualité et de certification implique un suivi
permanent de l’évolution
de la réglementation et des normes. Par ailleurs, le
séjour en entreprise
permet de réaliser quelles sont les autres aspects du
métier de responsable
qualité. Outre le fait de mettre en place le système
qualité, les tâches
peuvent être diverses pour améliorer continuellement le
système et le
responsable qualité est présent dans diverses missions en
relation avec les
différents services aussi bien dans des milieux
différents tels que la
comptabilité ou la production, d’où la capacité
à s’adapter à tous les milieux.
De plus, la
communication et la
persévérance sont des facteurs très importants
pour vaincre les résistances que
peuvent engendrer la mise en place d’un système qualité,
d’où l’importance du
soutien de la direction pour faire adhérer le personnel à
un tel système. Il
est donc nécessaire d’accompagner les personnes durant un
changement et de les
sensibiliser à certains aspects importants de la qualité.
En effet, il était primordial
que le personnel adhère au système qualité et
comprenne qu’il ne s’agit pas
d’une contrainte mais qu’il permet une meilleure organisation interne,
et que
la certification et le marquage CE des produits sont des
éléments très
importants pour la société dans laquelle il travaille.
Par ailleurs,
L’expérience acquise durant ce stage aura montré que les
acteurs présents sur
le terrain jouent un rôle très important dans la
résolution de certains problèmes
en entreprise et dans la suggestion d’idées pour
l’amélioration du système.
Sommaire
Ayant un
cursus
en
biologie et
santé à l’origine, il est très intéressant
de réaliser un stage dans une
entreprise fabricant des dispositifs médicaux où les
connaissances en santé et
en qualité pouvaient toutes deux être nécessaires.
En espérant avoir été le
plus utile possible pour l’entreprise, il a été
très instructif de réaliser ce
stage dans un organisme où le système qualité est
plutôt complet et possède de
l’importance. Malgré cela, il est indispensable de
réaliser qu’il peut
continuellement être amélioré pour optimiser
l’organisation générale de
l’entreprise et pour répondre à la satisfaction des
clients.
Satisfaite
du thème de stage car il a permis d’effectuer différentes
missions très
intéressantes, mais aussi ravie d’avoir pu profiter de
l’expérience acquise sur
le terrain, il reste tout de même important, pour que le
système qualité puisse
fonctionner, de sensibiliser le reste du personnel à la
qualité qui ne connaît
pas forcément bien ce domaine. Or, il s’avère souvent que
se sont les acteurs
de l’entreprise qui aient l’idée des meilleurs actions à
mettre en place, d’où
l’intérêt de les faire participer à la mise en
place du système qualité et de
les sensibiliser à se sujet.
Sommaire
[1]: Site
Internet de Siemens AG (Siemens global site): http://www.siemens.com
[2]: Site
Internet
de Siemens Medical Solution : http://www.medical.siemens.com
[3]: Manuel
de Management
de la Qualité
et de la
Sécurité de Siemens Audiologie France
[4]: Site
Internet de
Siemens hearing solutions (France): http://www.siemens-audiologie.fr
[5]: Photographie
d’un intra auriculaire, page 8, Catalogue
Général 2006 de Siemens Audiologie
« L’audition unit les Hommes aux Hommes »
destiné aux
audioprothésistes.
[6]: Photographie
d’un
contour d’oreille, page 12, Catalogue
Général 2006 de Siemens Audiologie
« L’audition unit les Hommes aux
Hommes » destiné aux audioprothésistes.
[7]: Compte rendu de la revue de direction
de
décembre 2005.
[8]: Norme NF
EN ISO
9001:2000- Systèmes de management de la qualité - Exigences, édition AFNOR.
[9]: Norme NF
EN ISO
13485:2003 - Systèmes de management de la qualité - Exigences à des fins
réglementaires - Dispositifs médicaux, édition AFNOR.
[10]: Site
Internet euro
info centre de Paris : http://www.eic.ccip.fr/informations/marquage/index.html
[11]:
Directive 93/42/CEE du Conseil, du 14
juin 1993, relative aux dispositifs médicaux.
[12]:
Site Internet
de l’Agence Française de Normalisation : http://www.afnor.fr/sante/dispositifs_medicaux/dispositifs_medicaux_directives.html
[13]:
Article 17
« Marquage CE», directive 93/42/CEE du
Conseil, du 14 juin 1993,
relative aux dispositifs médicaux.
[14]:
Site
web du syndicat national de l’industrie des technologies
médicales :
http://www.snitem.fr
[15]: Site du gouvernement : http://www.legifrance.gouv.fr
[16] : Shoji Shiba, Alan Graham, David
Waldes,
édition Dunod, Paris
1997, Chapitre 6 « le diagnostic par l’encadrement des
7 étapes de
l’amélioration corrective » : Le diagramme
cause-effet (Ishikawa)
dérivé du Pareto, page 121, Manuel d’apprentissage
et de mise en oeuvre du
système. TQM (management par la qualité totale) : 4
Révolutions du
Management par la Qualité
Totale.
[17]:
Site Internet du TUV Saarland
France : http://www.tuv-saarland.fr/cadre.htm
[18]:
Annexe I
« Exigences essentielles », directive
93/42/CEE du Conseil, du
14 juin 1993, relative aux dispositifs médicaux.
[19]:
Article 11
« Evaluation de la conformité », directive
93/42/CEE du
Conseil, du 14 juin 1993, relative aux dispositifs médicaux.
[20]:
Annexe
7 « Déclaration CE de
conformité », directive
93/42/CEE du Conseil, du 14 juin 1993, relative
aux dispositifs médicaux.
[21]: Site Internet sur la
matériovigilance : http://www.materiovigilance.com
[22]: Site
Internet du Ministère
de la Santé et des Solidarités : http://www.sante.gouv.fr/htm/pointsur/materio/index.htm
[23]:
Site Internet de l’agence française de
sécurité sanitaire des produits de santé : http://afssaps.sante.fr/htm/10/mv/indmv.htm
[24]: Site interne de l’Université
Henry Pointcarré: Outils pour la qualité dans les
services: http://www.cyber.uhp-nancy.fr/demos/QUAL-004/cha_2/index.html
[25]:
Rapport sur le
séminaire Q2 sur les audits qualités interne : Réaliser des audits
qualité à forte valeur ajoutée, efficaces et bien
acceptés, Doucet
Conseil : http://www.doucetconseil.fr/DOUCET/Fichiers_joints/formations/Q2_audit.pdf
[26]:
Site Internet IIA (the
institute of internal auditors): http://www.theiia.org/index.cfm?doc_id=5402
[27]:
Site Internet
IA (Internal audit):
http://internal-audit.web.cern.ch/internal-audit/method/process.htm
[28]:
Site Internet de l’Université
de Melbourne : The University of Melbourne , Internal audit : http://www.unimelb.edu.au/audit/about/protocol.html