Avertissement |
Si vous arrivez
directement sur cette page, sachez que ce travail est un rapport
d'étudiants et doit être pris comme tel. Il peut donc
comporter des imperfections ou des imprécisions que le lecteur
doit admettre et donc supporter. Il a été
réalisé pendant la période de formation et constitue
avant-tout un travail de compilation bibliographique, d'initiation
et d'analyse sur des thématiques associées aux concepts,
méthodes, outils et expériences sur les démarches
qualité dans les organisations. Nous ne faisons aucun usage commercial et la duplication
est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part . L'objectif
de la présentation sur le Web est de permettre l'accès à l'information
et d'augmenter ainsi les échanges professionnels. En cas d'usage
du document, n'oubliez pas de le citer comme source bibliographique. Bonne
lecture... |
Amélioration
du Système de Management de
la Qualité
à GEHC Buc
|
|
|
|
|
RESUME
La qualité à GEHC passe par trois axes principaux :
- La satisfaction des clients: Collecte de la voie du client
«VOC» (Voice Of the Customer), cela permet de concevoir
et produire des
équipements qui répondent aux besoins des clients,
règle de base dans l’approche processus proposé par
l’ISO 9001:2000 et la culture 6 sigma.
- Le respect des lois et des réglementations: qui assurent la «compliance»,
par suite la sécurité des produits distribués
sur le marché européen et mondial.
- L’amélioration continue: basée sur les audits
(internes et externes) et le suivi d’indicateurs appropriés
pour mieux gérer les CAPA. Cela permet de repérer
les facteurs qui empêchent l’atteinte des objectifs
qualité souhaités et par suite d’identifier
les opportunités pour assurer l’amélioration
continue.
Mots clés :Qualité, satisfaction
client, réglementations, amélioration
continue, CAPA, Conformité |
ABSTRACT
Quality at GEHC
passes by three main axes:
- Customer satisfaction:
this is maintained by collecting the VOC (Voice Of the Customer),
which insures design and production of equipment responding to
customer needs, main rule in the process approach proposed by
the ISO 9001:2000 and 6 sigma culture.
- Respect of laws
and regulations: this insures compliance to the different regulations
and standards applicable in GEHC, therefore security of products
distributed in the European as well as the international market.
- Continuous improvement:
based on audits (Internal and external), and tracking of the
appropriate metrics that allow monitoring in the best way possible.
Combined, audits and CAPA identify the vital few factors that
prohibit reaching the desired quality objectives, therefore,
identifying any opportunity for continuous improvement
Key words : Quality, customer satisfaction, regulations,
continuous improvement, CAPA, Compliance
|
Remerciements
Je tiens à remercier M. Christian CAMPION, Quality System Management
(QMS) manager GEHC International, ainsi que Mme Valérie DEBAIX, CAPA
site Leader GEHC Buc, qui m’ont donné l’opportunité de
réaliser mon stage de fin d’étude au sein d’une
société telle que General Electric Healthcare et pour toute
l’aide et tous les conseils qu’ils ont pu me rapporter.
Je remercie également toute l’équipe Assurance
Qualité et Affaires Réglementaires de GEHC Buc qui m’a
permis de travailler dans une ambiance excellente
Enfin, je remercie mon suiveur de stage à
l’Université de Technologie de Compiègne, M Gilbert FARGES,
responsable du Master Management de
la Qualité, pour tout l’enseignement qu’il a pu nous transmettre
durant cette année universitaire et pour les conseils pertinents apportés
lors de sa visite sur le lieu du stage.
Sommaire
. 5
I. Présentation
de l’entreprise GEHC
.. 6
1. Introduction. 6
2. P&L
et modalités de GEHC Buc. 6
3. GEHC:
Manuel de Management de la Qualité (International) 7
4. Politique
Qualité. 7
5. Cartographie
des Processus. 8
6. Le système
documentaire Qualité
. 9
II. Les missions
du stage
. 9
1. Présentation
des missions. 9
2. Planification
Dynamique et Stratégique (PDS)
10
CHAPITRE 1 – Affaires Réglementaires
. 11
1. Introduction. 11
2. Le
marquage CE. 11
3. Directive(s)
"Nouvelle Approche". 11
4. Marquage
CE des dispositifs médicaux. 11
5. Exigences
essentielles, importance des normes et leur utilisation. 11
6. Est-ce
que le marquage CE suffit pour assurer la sécurité des
produits sur le marché?. 12
7. Problématique
et propositions d’amélioration. 13
7.1. Proposition
du 5S.. 14
7.2. Comment
mesurer l’efficacité du 5S?
8. Conclusion
. 17
CHAPITRE 2 – ASSURANCE QUALITE
. 18
1. Définitions
et aspects normatifs. 18
1.1. Compliance. 18
1.2. CAPA.. 18
2. Cartographie
du processus CAPA.. 19
3. Amélioration
du suivi des indicateurs. 19
3.1. Identification
de la problématique (QQOQCP) 19
4. Spécification
du besoin (CDCF) 20
5. Déploiement
du projet 22
5.1. Planning
prévisionnel 22
5.2. Identification
des causes ( diagramme d’ISHIKAWA) 23
6. Risques
projets et alternatives. 24
7. Conclusion
. 25
Troisième partie –
Expériences
. 25
III. Conclusion
. 25
GLOSSAIRE
. 26
Bibliographie
. 26
Documentation. 27
Site Web. 27
. 28
. 28
. 28
retour sommaire
1. Introduction
GE Healthcare offre des technologies et services médicaux révolutionnaires
ouvrant une nouvelle ère dans les soins médicaux. Leur vaste
gamme de produits et services, ainsi que leur expertise dans les domaines
de l’imagerie médicale et des technologies de l’information,
les diagnostics médicaux, les systèmes de monitoring patient,
l’amélioration de performances, la mise au point de nouveaux
médicaments et les technologies de fabrication de produits biopharmaceutiques
aident les cliniciens du monde entier à
réimaginer des méthodes permettant un diagnostic précoce
et plus fiable ainsi qu’un meilleur traitement du cancer, des maladies
cardiaques, des maladies neurologiques et autres pathologies.
GE Healthcare offre une large gamme de services dans le but d’améliorer
les soins et d’aider les médecins à exceller dans leurs
diagnostics, leurs traitements et la gestion de leurs patients.
General Electric Company, 152.4 milliards de dollars de chiffre d’affaires,
plus de 310 000 salariés est l’un des premiers groupes mondiaux,
aux activités diversifiées dans le domaine de l’industrie,
de la technologie et des services.
GE Healthcare, est une branche de General Electric Company qui pèse
17 milliards de dollars, soit 11% du Chiffre d’affaires total, elle
emploie à
travers le monde plus de 46 000 personnes (15% du total des employés
de GE Company) engagées dans la prestation de services aux professionnels
de la santé
et à leurs patients dans plus de 100 pays [C].
retour sommaire
2. P&L
et modalités de GEHC Buc
En France, le site de Buc (78) est le centre d’excellence mondial
de GE Healthcare pour les systèmes vasculaires, la mammographie
et les logiciels d’applications cliniques.
Il est essentiellement un site DI (Diagnostic Imaging), mais a la
particularité d’avoir d’autres P&L (Business Units)
qui regroupent plusieurs modalités et qui ont des activités
bien spécifiques, mais quelles sont ces activités?
Pour répondre à cette question, revenons au fait que
le site de GEHC Buc est un centre d’excellence, c’est à dire
qu’il est le responsable de la conception, production ou assemblage
et de la distribution d’une gamme de produit qui servent à faire
de l’imagerie médicale (Diagnostic Imaging), cela regroupe:
Les systèmes de mammographie, les tubes à
rayon X, Advantage Window qui sont des stations de travail servant à voir
des images, archiver et faire des calculs.
.
En parallèle on trouve
la Business Unit CS (Clinical Systems) qui a le rôle de fabriquer les
systèmes de monitoring, les couveuses et les défibrillateurs.
Les produits offerts par GEHC sont nombreux et touchent plusieurs
applications dans le secteur de la santé, par exemple Life Sciences
font des marqueurs, IT (Information Technology) se
focalisent sur la création des réseaux d’images
comme PACS (Picture Archiving and Communications) système qui permet
de sauvegarder les images et les archiver pour les retrouver facilement,
les réseaux hôpitaux qui permettent de gérer les
hôpitaux et les systèmes de santé
retour sommaire
3. GEHC:
Manuel de Management de
la Qualité (International)
Etre un centre d’excellence a des avantages mais cela entraine
des responsabilités!
Le fait que GEHC soit une «Regulated Industry», ces responsabilités
se présentent essentiellement au niveau de la distribution des produits
sur les marchés nationaux et internationaux.
Leurs équipements doivent respecter les réglementations
et les exigences de sécurités imposées par chaque
pays, pour cela GEHC a établit le Manuel de Management de
la Qualité
(International) dans le but d’assurer que tous les centres d’excellences
de GE dans le monde utilisent la même démarche pour la gestion
de leur système qualité.
Chaque site adapte ce manuel qualité selon ses activités
en faisant des exclusions et des addendum.
Le Manuel de Management de
la Qualité ( Global Quality Management System Manual), est un document
qui assure la conformité aux deux normes ISO 9001:2000 et ISO 13485:2003,
le système de management de la qualité de GEHC est composé de
ce manuel global, des procédures qualités globales et locales.
Le système de management de la qualité assure que GEHC
fournit:
- Des produits et des services qui répondent régulièrement
aux besoins des clients et les réglementations applicables aux équipements
biomédicaux et les services associés.
- L’amélioration continue [9] et l’efficacité [7]
du système de management de la qualité
Il décrit aussi les moyens pour s’assurer de l’application
des conditions citées ci-dessus et il est supposé satisfaire
aux exigences des législations concernant le contrôle des
dispositifs médicaux dans les pays où GEHC fabrique et distribue
des produits et services.
4. Politique
Qualité
La politique qualité liste les engagements qualité de
GEHC:
- La satisfaction des clients
- Le respect des lois et des réglementations
Elle est affichée partout dans l’entreprise pour rappeler
que tous les employés sont impliqués dans la qualité et
pour lister les responsabilités et les autorités.
Elle est signée par le CEO (Chief Executive Officer) et le
Chief Quality Officer de GEHC.
retour sommaire
5. Cartographie
des Processus
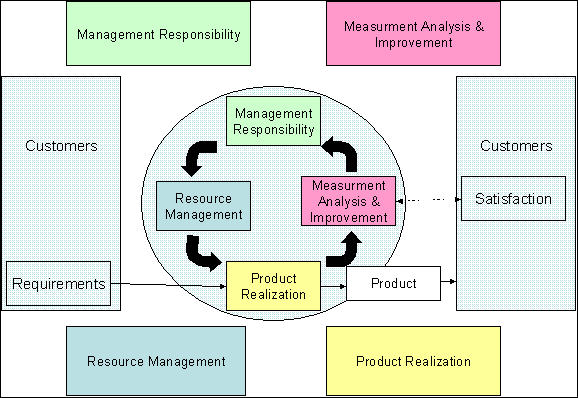
Figure 1: Cartographie des Processus
La figure 3 montre l’interaction entre les processus pour maitriser
la gestion de la qualité.
L’importance des clients est clairement visible, le cycle de
production de n’importe quel produit commence par l’identification
des besoins des clients, avant de passer en phase de production et ne s’arrête
pas ici! Après la phase production il est primordial de mesurer
la satisfaction des clients par des outils appropriés afin de s’assurer
de la conformité aux besoins et détecter toutes opportunités
d’amélioration.
retour sommaire
6. Le
système documentaire Qualité
Le système documentaire qualité de GEHC Buc est constitué de
quatre niveaux qui sont schématisés dans la figure 2:

Figure 2: Hiérarchie
du Système documentaire qualité
(Auteur: Christian Campion--GEHC Buc)
- Global Quality Policy: Document visuel qui montre les
engagements qualités des employés et du management
- Global quality manual: Contient le manuel qualité de
GEHC et le manuel qualité de GEHC Buc qui contient les exclusions
et les addendum, il contient aussi la cartographie des processu
- Global Quality Procedures: Ce sont les procédures
générales de haut niveau qui doivent
être appliqués à GEHC
- Local Quality Procedure et Functional Quality Procedures:
Ce sont les procédures locales et les différents mécanismes
opératoires qui sont appliqués au niveau de GEHC Buc
retour sommaire
II. Les
missions du stage
1. Présentation
des missions
- Participer activement à l’amélioration
du Système de Management de
la Qualité en accord avec l’équipe centrale d’Assurance
Qualité et en fonction des contraintes spécifiques au site
de Buc
- Apporter un soutien au leader SMQ du site pour le suivi
de l’amélioration du système qualité (actions
de formation, mise à jour du système qualité et
mise en place d’indicateurs appropriés)
- Apporter un soutien au leader CAPA (Corrective Action – Preventive
Action) du site de Buc sur les actions ponctuelles et sur la mise en
place de nouveaux mécanismes opératoire
- Participer aux différentes revues de suivi des
actions qualité
retour sommaire
2. Planification
Dynamique et Stratégique (PDS)
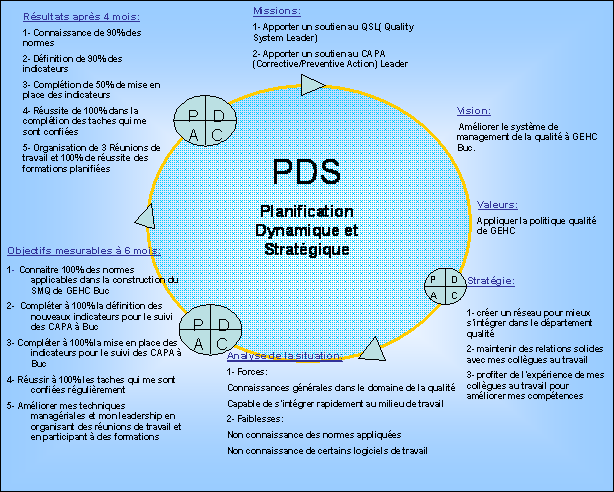
Figure 3: Planification
Dynamique et Stratégique
CHAPITRE
1 –
Affaires Réglementaires
retour sommaire
1. Introduction
La qualité est généralement liée
à la qualité du produit de point de vu fiabilité, optimisation
et rendement
Mais la qualité a un autre aspect, c’est le coté réglementaire
qui exige aux fabricants de respecter les normes et réglementations
et assure aux clients et aux patients que les équipements qu’ils
utilisent et avec lesquels ils sont soignés, répondent aux
exigences de sécurité imposées pour leur protection.
La question qui se pose est: comment peuvent les réglementations être
au service des fabricants, utilisateurs et patients?
2. Le
marquage CE
Véritable passeport pour la circulation des produits sur l’ensemble
du marché européen, le marquage CE est réglementairement
obligatoire pour de nombreux produits parmi lesquels on trouve les dispositifs
et
équipements biomédicaux.
Garantie de sécurité pour les utilisateurs et les consommateurs,
le marquage CE est le symbole visuel qui atteste que le produit est conforme
aux exigences essentielles de sécurité d’une ou plusieurs
directives dites
"Nouvelle Approche" adoptées par l’Union européenne.
retour sommaire
3. Directive(s)
"Nouvelle Approche"
Les directives “Nouvelle Approche" fixent de manière
réglementaire et obligatoire des exigences essentielles de sécurité,
de santé et d’environnement aux produits des 29 pays membres
de
l’Union européenne et des autres Etats de l’Espace
Economique Européen (Norvège, Liechtenstein, Islande)
4. Marquage
CE des dispositifs médicaux
Un guide de marquage CE est destiné à fournir aux fabricants
toute l’information utile pour tirer le meilleur parti possible des
compétences que les Organismes Notifiés (LNE/G-Med) peuvent
mettre à leur disposition pour l’application des directives
européennes relatives aux dispositifs médicaux et aux dispositifs
médicaux.
GEHC Buc répond aux exigences de la directive 93/42/CEE du
22 juillet 1993, paru au JOCE numéro L169 du 12 juillet 1993 [2]
5. Exigences
essentielles, importance des normes et leur utilisation
Toutes les directives font des exigences essentielles les conditions
techniques auxquelles doivent satisfaire les dispositifs médicaux
pour pouvoir
être mis sur le marché.
Ces exigences essentielles concernent:
- Propriétés physiques, chimiques et biologiques
- Infections et contamination microbienne
- Propriétés relatives à la fabrication
et à l’environnement
- Dispositifs ayant une fonction de mesurage
- Protection contre le rayonnement
- Exigences pour les dispositifs médicaux raccordés à une
source d’énergie ou équipés d’une telle
source
- Informations fournies par les fabricants
- Etablissement des données cliniques
Compte tenu de la généralité des exigences essentielles
car elles s’appliquent à l’ensemble des dispositifs
médicaux concernés et de la difficulté qu’il
y a à garantir une démarche commune à tous les fabricants
et à
tous les Organismes notifiés, la "Nouvelle Approche" donne un rôle
et une importance particulière aux normes.
Celles-ci ne sont pas d’application obligatoire pour la mise
sur le marché
dans l’EEE.
Il faut noter que le guide du marquage CE ne cite pas ces normes,
cependant les plus importantes normes horizontales (relatives à des
caractéristiques communes à de nombreuses catégories
de dispositifs) qui possèdent le statu de normes européennes
harmonisées sont citées dans certaines de ces chapitres.
retour sommaire
6. Est-ce
que le marquage CE suffit pour assurer la sécurité des
produits sur le marché?
Le marquage CE sur les équipements garantit aux utilisateurs
le respect des normes et réglementations, cela n’empêche
pas d’avoir des problèmes de sécurité
ou de fonctionnement après la distribution.
Ces problèmes sont identifiés suite à
des audits externes ou internes, la figure 4 montre les étapes à suivre
dans les deux cas:
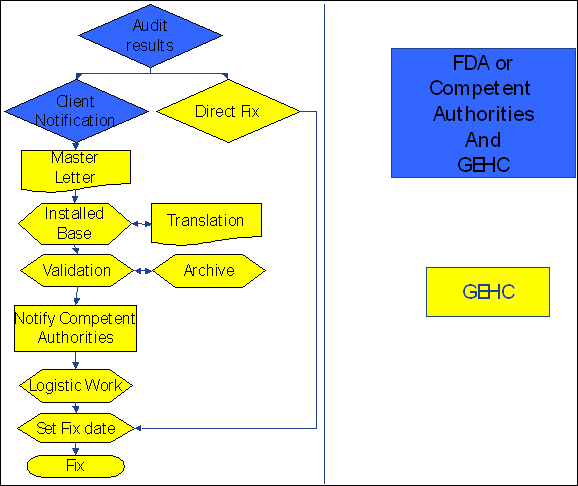
Figure 4: Processus de gestion des problèmes (Post-Market)
retour sommaire
7. Problématique
et propositions d’amélioration
La procédure explique comment réagir face
à des problèmes pareils, mais entre la théorie et la
pratique il existe un certain
écart! Quel est cet écart et Quelles sont les difficultés
rencontrées?
Les difficultés rencontrées sont surtout dans les phases
pré-notification des clients et exécution (notification des
clients)
La phase pré-notification commence par la réception
des lettres à envoyer et se termine à la phase notification
des autorités compétentes (Figure 4) la phase exécution
comprend le travail logistique, c’est à
dire impression des lettres, préparation des adresses, contact de
la société responsable pour faire l’envoi des lettres,
archiver les évidences d’envoies des lettres pour assurer la
traçabilité au cas d’un audit etc.
Face à ces problèmes il était indispensable de
mettre en place un mécanisme opératoire pour assurer le bon
déroulement du travail, surtout dans la phase exécution pour
cela une procédure 5S a été
élaboré pour s’assurer de la propreté du lieu
de travail, cela est primordial pour garantir la qualité du travail
et des taches exécutées.
7.1. Proposition
du 5S
Dans le but de standardiser et par suite d’améliorer
le mécanisme opératoire qui existe actuellement un 5S, tiré de
l’esprit du Lean Six Sigma
était proposé.
C’est quoi un 5S et comment peut-il servir dans ce cas?
Un 5S est une méthode de nettoyage utilisé
essentiellement sur les lignes de production dans le but de standardiser
et ranger le milieu du travail.
Si dessous quelques extraits du 5S qui a été
proposé
retour sommaire
S1: Sort
Goal: remove all items from the workplace that are not needed for
current production or tasks
It does not mean that you remove only the items that you know you
will never need
It does not mean that you simply arrange things in a neater fashion
When you sort, you leave only the baring essentials-“when in
doubt, move it out”
Identify, “red tag” the move potentially unneeded items:
Question the need for each item in that quantity in the workplace.
Typical items marked for removal include:
Unneeded files, reference manuals and paperwork
Outdated files and documents
Put a red tag to any item that is not essential to doing the work
and move it to a holding area.

Fig 5: Red Tag
retour sommaire
Evaluating and dealing with red-tagged (unneeded) items
After one week in a holding area, tagged items should be:
Disposed of, if determined unnecessary
Kept, if determined necessary
S2: set in order (simplify)
Set in order means to arrange needed items in the area and to identify
or label them so that anyone can find them or put them away
Goal: to arrange all needed work items in line with the physical workflow,
and make them easy to locate and use
Draw a current-state map
Show the location of all materials, supplies, forms … needed
in this workplace
Draw a future state map
Draw a picture of how you think the workspace could be laid out for
better efficiency and effectiveness. Make the map large enough so people
can post improvement ideas on “5S tags”. The new map should:
Be based on the principles of motion economy (everything is within
arm’s reach, body motion kept to a minimum, stored in the sequence
used, etc.)
Visually organize the workplace
Draw borders to differentiate work areas
Provide a “home address” for each bordered area
Put a corresponding label on each item; the label should include the
name of item and item’s home address.
S3: Shine
Shine emphasizes on removing
the dirt, grime and dust from the work area. This is a program
for keeping the work area swept and clean of debris.
Determine the shine targets
Safety: report unsafe conditions; clean up spills on the floor
Waste: empty trash can, remove excess supplies from area
Cleanliness: keep workplace clean
Set a housekeeping schedule and assign responsibilities
List responsibilities in
detail, including which areas to be cleaned, at which times of the day, and
“what”
cleaning involves. Assign responsibility for completing housekeeping chores.
retour sommaire

Fig 6: Customer
Informing Handling Assignments
S4: standardize
Standardize means creating a consistent way of implementing the tasks
performed daily, including sort, set in order, and shine. It means
“doing the right things the right way every time.”
S5: Sustain
Sustain means that the 5S program has a discipline that ensures its
continued success.
Create 5S audit form or radar chart for summarizing results.
Establish a standard for the format.
Establish periodic schedule for conducting audits
Minimum of weekly for area supervision, monthly for management
Participation of management
in reviewing and using checklists is critical
With 5S ANYONE should be
able to tell the difference between normal and abnormal conditions
Celebrate accomplishments and continue improving
Keep everyone aware of 5S and its benefits by giving recognition where
it is due
Make time each week to brainstorm and implement improvement suggestions”
retour sommaire
7.2. Comment
mesurer l’efficacité du 5S?
Implémenter un 5S n’est pas facile, il demande l’implication
de tous en passant par les employés, jusqu’au management,
pour cette raison, il était essentiel de définir et de mesurer
les critères de succès!
Une grille d’audit était proposé, la figure 7
montre le check List:

Figure
7: Grille d’audit 5S
8. Conclusion
Les affaires réglementaires sont essentielles pour assurer
la conformité
aux réglementations et les normes, le chapitre 1 montre le processus
de gestion
«externe» de l’entreprise face à des problèmes
sur les produits déjà sur le marché.
En effet GEHC ne se contente pas de régler les problèmes
en externes!
Comment font-ils en interne? La réponse est dans l’ISO
13485:2003 [7] et le FDA 21 CFR Part 820.11 [8], ce sont les CAPA!
retour sommaire
CHAPITRE 2 – ASSURANCE QUALITE
1. Définitions
et aspects normatifs
1.1. Compliance
Compliance: Conformité (Larousse Unabriged Dictionnary)
Pour une entreprise telle que GEHC qui a des activités diverses
dans un domaine aussi délicat et compliqué tel que le domaine
médical, la compliance signifie la conformité à toutes
les normes et les réglementations spécifiées dans
le GQMSM, ainsi que la satisfaction continue des clients en fabriquant
des produits qui répondent à leurs besoins.
1.2. CAPA
CAPA : Corrective Action/ Preventive Action process
Les actions correctives et préventives sont prises
à la base de l’analyse des indicateurs appropriés dans
le but de trouver les opportunités d’amélioration.
Le FDA 21CFR part 820 Subpart J § 820.100 décrit le processus
de gestion des CAPA [8]
Quant à L’ISO 13485:2003 [7] les CAPA sont mentionnées
dans le chapitre 8 §
8.5 et sont divisées en deux sous chapitres qui précisent l’obligation
d’avoir une procédure documentée qui définit et
répond à des exigences bien spécifiques.
- § 8.5.2 Action Corrective:
L’objectif est de prendre des actions pour éliminer les
causes des non-conformités dans le but d’empêcher leurs
occurrences.
Les actions correctives doivent
être appropriées aux effets des non-conformités
rencontrées.
- § 8.5.3 Action préventive:
L’objectif est de prendre des actions pour éliminer les
causes des non-conformités potentiels dans le but d’empêcher
leur occurrences.
Les actions correctives doivent être appropriées aux
effets des problèmes potentiels.
retour sommaire
2. Cartographie
du processus CAPA

Figure 8: Cartographie du processus CAPA
retour sommaire
3. Amélioration
du suivi des indicateurs
3.1. Identification
de la problématique (QQOQCP)
Dans le but d’améliorer le processus de suivi des indicateurs
CAPA, il a fallut cerner la problématique avec
la CAPA leader du site de Buc, le QQOQCP schématisé dans le tableau
si dessous montre les résultats:

Figure 9: Description de la problématique
QQOQCP
retour sommaire
4. Spécification
du besoin (CDCF)
Suite à la problématique figure9, la solution proposée était
de construire un outil de calcul qui permet le suivi automatique des indicateurs.
Cela a fait l’objet d’un Cahier des Charges Fonctionnel
qui avait comme objectif de définir l’ensemble des éléments
constitutifs nécessaires à la réalisation de l’outil
de calcul des indicateurs CAPA du site de BUC.
Ces indicateurs seront nécessaires pour fournir des informations
pertinentes et consistantes lors des revues de management et pour assurer
le suivi du processus CAPA au niveau du site et de ses modalités.
Le but étant de définir et de suivre facilement les
indicateurs, il était donc primordial de les classer par groupes et
de définir les critères de criticités afin d’agir
sur les CTQ (Critical to Quality)
Le groupement était fait en tenant compte des caractéristiques
d‘un bon indicateur, trois groupes étaient identifiés:
1. Indicateurs
de performances: ils permettront de porter une appréciation quant à la
capacité à atteindre les objectifs (efficacité et efficience)
2. Indicateurs
de pilotage: ils permettent de rapporter sur l’évaluation positive
ou négative du processus au regard de ces objectifs
3. Indicateurs
opérationnels: s’assurer que le processus est dans un état
d’opérationnalité
satisfaisant, à la base de la surveillance des événements à risque
qui pourraient compromettre l’atteinte des objectifs
Les caractéristiques d’un bon indicateur sont:
1. Etre
fidèle et représentatif au critère à
mesurer
2. Mettre
en
évidence les évolutions du critère à mesurer
3. Donner
une information juste
4. Etre
fiable (confiance dans les mesures successives)
5. Etre
facile
à établir, alimenter et utiliser
6. Etre
compatible avec les autres indicateurs du système mis en place afin
de permettre les comparaisons et les analyses et l’ajout d’informations
7. Etre
compatible avec l’environnement de Powersuite et consistent avec la
procédure CAPA
retour sommaire
5. Déploiement
du projet
5.1. Planning
prévisionnel
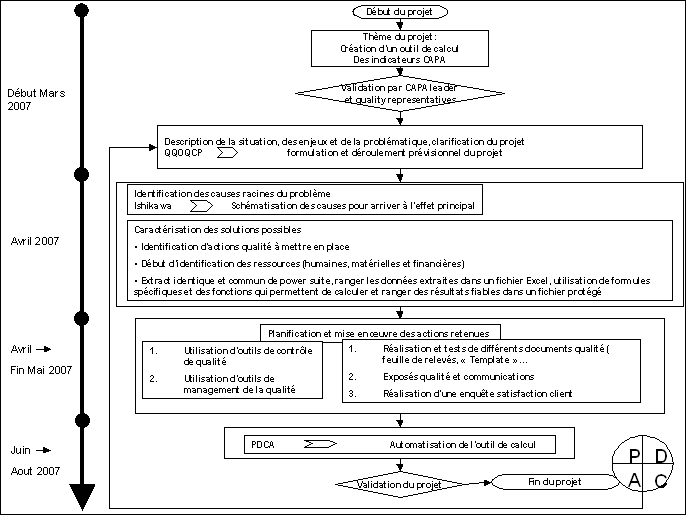
Figure 10: Planning Prévisionnel
retour sommaire
5.2. Identification
des causes ( diagramme d’ISHIKAWA)
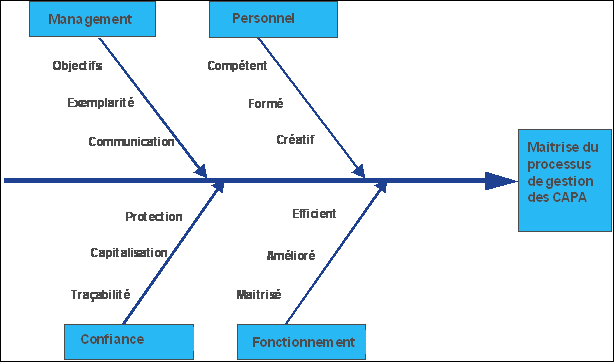
Figure
11: Diagramme D’ISHIKAWA (Maitrise du processus de gestion des CAPA)
retour sommaire
Le diagramme d’ISHIKAWA (figure 11), montre les causes essentielles
pour arriver à maitriser le processus de gestion des CAPA, les résultats
se présentent de la manière suivante:
Objectifs: Le Management doit définir des objectifs qualité,
et s’assurer de l’atteinte de ses objectifs
Exemplarité: Le Management doit montrer l’exemplarité en
appliquant la politique qualité et en démontrant son engagement
quand des obstacles risquent d’empêcher l’atteinte des
objectifs
Communication: Le Management doit s’assurer que les objectifs
définis sont compris par tous ceux qui sont responsables de les atteindre
Compétent: Le personnel responsable de l’exécution
des taches doit avoir les compétences nécessaires pour atteindre
les objectif
Formé: Le personnel doit être formé
à 100% et les évidences de formations doivent être documentées
et archivées
Créatif: Le personnel doit être créatif pour détecter
toute possibilité
d’amélioration
Maitrisé: Le fonctionnement des outils nécessaires à la
gestion des CAPA doit être maitrisé
Amélioré: Le fonctionnement des outils nécessaires à la
gestion des CAPA doit être amélioré à chaque fois
que les possibilités d’amélioration et d’optimisation
sont détectées
Efficient: Le fonctionnement des outils nécessaires
à la gestion des CAPA doit être efficient pour minimiser le temps
et l’énergie d’obtention des résultats
La traçabilité: les résultats d’analyse
des indicateurs doivent être documentés pour servir comme évidence
de compliance au cas d’un audit
La capitalisation: les résultats d’analyse des indicateurs
doivent être accessibles à tous et capitaliser sur l’intranet
de l’entreprise
La protection: les résultats d’analyse des indicateurs
doivent être protégés pour éviter toute mauvaise
manipulation
6. Risques
projets et alternatives
Les risques identifiés pour la gestion de ce projet
étaient nombreux, d’une part il fallait surmonter les difficultés
d’utilisation des outils informatiques, d’autre part, il fallait
s’adapter à la complexité imposer par le changement de
l’organisation qualité qui a eu lieu pendant cette période,
cela a entrainé le changement des procédures applicables et par
suite les définitions des indicateurs ainsi que le changement des critères
de criticité.
La figure 12 montre les risques majeurs et leurs alternatives:
retour sommaire
Figure 12: Risque projet
et alternatives
7. Conclusion
retour sommaire
Le Système de Management de
la Qualité
(QMS) regroupe le processus global qui est lié aux
évènements et/ou les observations provenant de plusieurs sources.
Une meilleure pratique impose l’utilisation d’un QMS unique
et capable de s’améliorer en continue en utilisant une approche
globale et harmonisée.
L’implémentation d’un système de management
de la qualité global et harmonisé
peut induire des changements dans l’organisation concernant
- Comment piloter le processus CAPA
Le succès de l’implémentation d’un QMS peut
être établi en utilisant des systèmes informatiques adéquats,
une approche d’harmonisation et une équipe de gestion de projet
bien organisée.
Il faut noter que CAPA n’est pas seulement Corrective Action
et Preventive Action!
Toute opportunité pour améliorer la qualité est
un CAPA! [D]
retour sommaire
Troisième partie – Expériences
Les expériences acquises
et les enseignements tirés de ce stage sont nombreux, autant au
niveau personnel qu’au niveau professionnel, elles se caractérisent
par:
- Capacité
à s’intégrer rapidement dans un milieu professionnel
nouveau et complexe
- Capacité
à maintenir des relations professionnelles de haut niveau avec mes
collègues de travail
- Capacité
à résister et savoir comment se comporter face à des
situations de crise
- Capacité
à être multitâche et savoir gérer mon temps et
mes priorités
- Capacité
à travailler en équipe aux niveaux interne et international
- Développement
de mes compétences en informatique bureautique surtout en Excel
et Access
- Développement
d’un savoir être et un savoir-faire indispensables pour devenir
un futur leader dans le domaine de la qualité
- Développement
de mes connaissances en qualité appliquée au secteur biomédical
(Normes, Réglementations etc.)
- Capacité
à s’adapter à un milieu ou il y a eu un changement d’organisation
retour sommaire
III. Conclusion
L’amélioration de
la qualité est vitale pour une entreprise comme GEHC qui est considéré comme
«Regulated Industry», d’où l’importance d’assurer
en permanence la conformité
aux lois et réglementations et par suite tirer les leçons pour
s’améliorer.
L’objectif de ce travail
était d’améliorer le système de management de la
qualité à GEHC Buc!
Après avoir cerner la problématique
figure 9, la solution était de construire un outil informatique
qui permet le suivi automatique des indicateurs CAPA, pour cette raison
il fallait définir
- les critères de criticité
- la méthode de présentation des données
Les difficultés rencontrées étaient
surtout au niveau de la définition des indicateurs, cela était
dû au changement de l’organisation ce qui a impliqué le
changement des procédures. Il fallait donc passer par une phase
intermédiaire entre l’annulation de l’ancienne procédure
et la mise en application de la nouvelle.
En plus du travail sur l’amélioration
du suivi des CAPA, un travail d’urgence avait eu lieu, et c’est
là
où l’expérience
était la plus riche. La solution proposée était de standardiser
le travail dans le but de l’améliorer ultérieurement, d’où
l’idée du 5S qui a été proposé.
Le travail dans une entreprise
assez grande comme GEHC demande une certaine flexibilité, il faut
savoir gérer les priorités et rester factuel surtout face à des
situations d’urgences!
retour sommaire
GLOSSAIRE
GE: General Electric
GEHC: General Electric Healthcare
P&L: Profit & Loss
DI: Diagnostic Imaging
CS: Clinical Systems
QMS: Quality Management System
ISO 9001:2000: Norme ISO Version 2000
ISO 13485:2003: Norme ISO Version 2003
QARA: Quality Assurance/Regulatory Affairs
CAPA: Corrective Action/ Preventive Action
FDA: Food and Drugs Administration
CFR: Code of Federal Regulations
21 CFR Part 11: Electronic Records; Electronic Signatures
21 CFR Part 820: FDA Quality System Regulation
SMQ: Système de Management de
la Qualité
PDS: Planification Dynamique et stratégique
PDCA: Plan Do Check Act, Cycle de Deming
GQMSM: Global Quality Management System Manual
CDCF: Cahier Des Charges Fonctionnel
CTQ: Critical To Quality
LNE: Laboratoire National de métrologie
et d’Essais
JOCE: Journal Officiel des Communautés
Européennes
EEE: Espace Economique Européenne
Bibliographie
Documentation
[1] Exigences en matière de système qualité pour
les dispositifs médicaux, Manuel de référence à
l’intention des fabricants qui vendent des dispositifs médicaux
en Europe, au Canada et aux
Etats-Unis/ No de catalogue C2-362/2001F-IN
ISBN 0-662-86694-
053671 F Version 2001
retour sommaire
[2] Marquage CE des dispositifs
médicaux - Mode d’emploi LNE/G-Med Edition 2005
[3] The Lean Six Sigma Pocket
Tool Book/ Mc Graw Hill/ ISBN 0-07-144119-0
[4] Six Sigma For MANAGERS/
Greg BRUE/ Mc Graw Hill/ ISBN 0-07-138755-2
[5] Sun Tzu The Art of War
for managers/ Gerald A Michaelson/ ISBN-10: 1-58062-459-6
[6] Taiichi Ohno-Toyota Production
System-Beyond Large Scale Production-Productivity Press / ISBN 978-0-915299-14-0
[7] ISO 13485:2003(E) Second
edition http://sagaweb.afnor.fr
[8] Code of federal regulations,
Food & Drug Administration Revised as of April 1, 2005/ GEHC Internal audit
team proprietary and confidential/ published Feb. 2006
[9] ISO 9001: 2000 http://sagaweb.afnor.fr
Site Web
[A] Le guichet Internet unique pour les entreprises de l’Union
européenne :
http://www.europa.eu.int/business/fr/index.html
[B] AFNOR (Association Française de Normalisation)
http://www.afnor.fr
[C] Site de GE Healthcare
http://www.gehealthcare.com/frfr/company/commitment.html
[D] CAPA System/ Steve Cagle/
Sparta Systems
www.google.com
retour sommaire
. 24












