Je tiens à
remercier toutes les personnes avec qui j’ai travaillé durant ce
stage pour leur accueil et leur disponibilité.
Je tiens tout particulièrement à remercier Mme le Docteur
Claire
Espanel, chef de service et tutrice de stage ainsi que Mme Christelle
Bourson, Directrice qualité pour leurs conseils, leur dynamisme
et le
partage de leurs expériences durant la durée de notre
collaboration.
J’ai mené à bien cette mission grâce à la
collaboration du service
biomédical, je tiens à remercier M. Patrick Thiesset, M.
Claude Miens,
M. Laurent Bègue et M. Anthony Hamon pour leur participation et
pour
les riches échanges que nous avons pu avoir.
Merci aux enseignants du Master Management de la qualité pour la
qualité des cours et particulièrement à M. Gilbert
Farges, mon tuteur
enseignant, pour les conseils apportés lors du suivi de stage
qui ont
contribués au bon déroulement de la mission.
Afin de se mettre en
conformité par rapport à cette
norme, le laboratoire a fait appel à un stagiaire qualité
pour la partie relative à la gestion des équipements
comprenant la métrologie.
L'enjeu est important puisque depuis janvier 2010, l'ordonnance n°
2010-49 relative à la biologie médicale rend obligatoire
d'ici 6 ans l'accréditation des laboratoires d'analyses de
biologie médicale pour la totalité des analyses
réalisées.
Alors que l'hôpital de
Compiègne vient d'être audité en vue de sa
certification V2010, le laboratoire d'analyses de biologie
médicale au sein de ce même hôpital entame une
démarche d'accréditation selon la norme ISO15189.
1.
LE
CONTEXTE
1.1.
Présentation du Centre Hospitalier de
Compiègne [1]
Le Centre Hospitalier de
Compiègne (CHC) est un établissement public de
santé placé sous la tutelle de l'Agence Régionale
de l'Hospitalisation de Picardie (ARH), représentant le
Ministère de la Santé.
Il est, avec Soissons, l'un des 2 hôpitaux "pivots" du territoire
de santé sud-est de la Picardie et dessert un bassin de vie de
près de 220 000 habitants.
Le CHC est dirigé par un Conseil d’Administration (CA). Ce
dernier est composé du Maire de Compiègne
(président du CA), de représentants d’instances locales,
de professionnels de la santé non hospitaliers, de
représentants des personnels de l’hôpital et de
représentants des usagers.
Cette instance délibérative définit la politique
générale de l’établissement.
Le Directeur du CHC est chargé de l’exécution des
décisions et délibérations du CA et assure la
gestion et la conduite générale de l’hôpital. Le
directeur préside également le Conseil Exécutif,
structure de concertation médico-administrative, chargée
de concevoir le pilotage stratégique de l'établissement
et de définir les projets. Il est assisté dans ses
missions par une équipe de directeurs adjoints.
Le CHC est découpé en 2 pôles de gestion
(Stratégie et Ressources) et 5 pôles cliniques et
médico-techniques (Médico-chirurgical A,
Médico-chirurgical B, Femme-enfant, Support, Gériatrie).
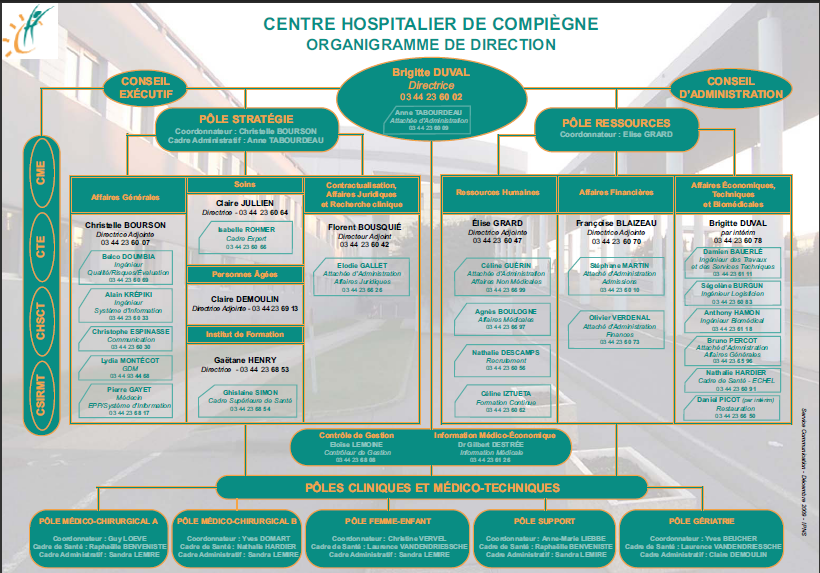
Figure 1 - Organigramme de la
Direction du CHC
[1]
Les chiffres clés (pour l'année 2008) :
56 000 passages aux urgences
21 000 entrées: environ 60
nouveaux patients chaque jour
6 600 interventions au bloc
opératoire
4 à 5 naissances par jour
1815 personnes travaillent au CHC
1.2.
Présentation du Laboratoire d'Analyses de
Biologie Médicale
Le laboratoire est rattaché au pôle Support qui se compose
des activités suivantes :
Figure 2 - Structure du pôle
Support
[2]
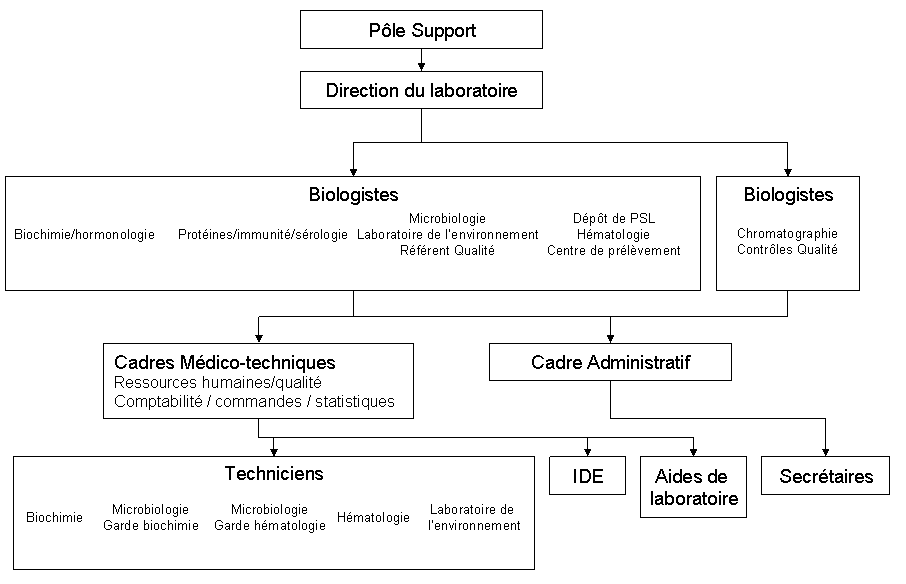
Il est composé de 56 personnes réparties selon
l'organigramme ci-dessous.
Figure 3 - Organigramme du
laboratoire du CH de Compiègne
[13]
Le laboratoire gère des
analyses de biologie médicale des patients hospitalisés,
des consultations externes et des patients de ville. En 2008, il a
réalisé près de 25 200 000 B en traitant 400
dossiers jour en moyenne. Il comprend un centre de
prélèvement et de dépôt de délivrance
de Produits Sanguins Labiles (PSL), assurant le stockage et la
délivrance de PSL pour le CHC et les urgences vitales de la
clinique St Côme.
Le laboratoire du CHC réalise les analyses dans les domaines
suivants:
- Biochimie : Sodium,
potassium, calcium, ….
- Hématologie et
immuno-hématologie : Numération Formule Sanguine,
myélogramme, groupe sanguin, ….
- Immunologie : anticorps
antinucléaires, antithyroïde, ….
- Microbiologie :
Bactériologie : ECBU,
ponction lombaire, coproculture, ….
Sérologie / Virologie :
Sérologie hépatite B, hépatite C, VIH …, anticorps
antinucléaires, antithyroîde, ….
Mycologie : Recherche de mycoses
Parasitologie : Recherche paludisme,
toxoplasmose, …..
1.3. La qualité
dans les laboratoires
hospitaliers
1.3.1.
La certification V2010
Soucieux de la qualité de
ses prestations délivrées aux patients, le CHC a
développé une démarche interne
d'amélioration de ses services. Ces efforts lui ont permis
d'être le Premier Établissement Public de Santé de
Picardie accrédité en 2000, puis à obtenir la
certification par la Haute Autorité de Santé (HAS) en
janvier 2006.
En janvier 2010, le CHC a été l’un des premiers
établissements à accueillir les experts visiteurs sur la
base du manuel V2010.
La certification des établissements de santé est une
procédure d’évaluation externe
[3],
indépendante
de
l’établissement
de
santé et de ses organismes de
tutelle, effectuée par des professionnels de santé au nom
de la Haute Autorité de Santé (HAS), concernant
l’ensemble de son fonctionnement et de ses pratiques.
Elle apprécie non seulement le système de management de
la qualité, mais également des aspects spécifiques
de l’organisation des soins et les démarches d’Évaluation
des Pratiques Professionnelles (EPP).
Cette procédure a pour objectifs :
- d’améliorer la qualité et la
sécurité des soins délivrés au patient,
- de promouvoir des démarches d’évaluation et
d’amélioration,
- de renforcer la confiance du public par la communication des
résultats.
En complément de la certification V2010 de la totalité de
l'établissement, le CHC a deux unités certifiés
ISO9001 : Les unités de préparation des
médicaments du cancer et de stérilisation.
retour
sommaire
1.3.2.
Le
guide
de
bonne
exécution des analyses
Le guide de bonne exécution
des analyses (GBEA) est un texte réglementaire qui décrit
les conditions d'exécution des analyses de biologie
médicale et pose les bases d'une démarche d'assurance
qualité pour les laboratoires. Un arrêté
ministériel a rendu l'application de ce guide obligatoire en
1994
[4].
Le GBEA est centré sur l’acte de biologie médicale et
fait apparaître une responsabilité accrue des biologistes
dans les activités pré-analytiques (conditions de
prélèvement, transport des échantillons
biologiques, organisation des centres de tri) et post-analytiques
(élimination des déchets). L’application du GBEA dans les
laboratoires est surveillée par la Haute Autorité de
Santé.
Quinze ans après sa mise en application, le GBEA n'est pas
appliqué dans son intégralité dans les
laboratoires. Selon une enquête menée dans
l'inter-région Ouest par 15 pharmaciens inspecteurs de
santé publique sur une période de 30 mois (4ème
trimestre 2005 jusqu’au 1er trimestre 2008), seuls 31% des laboratoires
inspectés sont conformes au GBEA
[5].
1.3.3.
L'accréditation ISO 15189 [6]
En 2003, les laboratoires ont
été incités à entreprendre une
démarche qualité selon une des trois normes ISO 9001
[9],
ISO 17025
[8] ou ISO 15189
[7]. Un sondage réalisé en
2003 par l’Agence Française de Sécurité Sanitaire
des Produits de Santé (AFSSAPS) montre que sur 4774 laboratoires
sondés, 40% d’entre eux avaient au moins 10% de leurs
résultats hors limites
[10].
En avril 2006, un rapport de l’Inspection Générale des
Affaires Sociales (IGAS) dresse un état des lieux de la biologie
médicale présentant des données de ces trente
dernières années
[10]. La
France dénombre 3900
LABM privés et 1300 LABM hospitaliers et seulement 2% d’entre
eux sont accrédités ISO 17025 ou ISO 15189. Le nombre de
prescriptions ne cesse d’augmenter (de 2001 à 2004 les actes
prescrits ont augmenté de 3% pour les glycémies
jusqu’à 21% pour les explorations d’anomalie lipidique). Les
prélèvements effectués sur les patients ne pouvant
se rendre au laboratoire échappent souvent au biologiste or
certains travaux ont montré qu’entre 5 et 20% des
prélèvements transmis pouvaient être non conformes
et que les erreurs (transcription, étiquetage, etc.)
étaient fréquentes à ce stade.
Depuis 2009, suite au rapport sur la réforme de la Biologie
Médicale de M. Michel BALLEREAU, Conseiller
Général des établissements de santé
[11],
les LABM sont incités à engager une démarche
d’accréditation selon la norme ISO 15189 sur la totalité
de l’activité. Cette accréditation sera
délivrée par le Comité Français
d’Accréditation (COFRAC).
Le 13 janvier 2010, la Ministre de la Santé et des Sports a
présenté une ordonnance relative à la biologie
médicale selon laquelle tous les laboratoires, privés et
publics, universitaires et non universitaires, devraient prouver leur
entrée dans une démarche qualité d’ici novembre
2013 et être accrédités avant le 1er novembre 2016.
La biologie médicale est devenue aujourd’hui un
élément du parcours de soins déterminant pour le
diagnostic de la majorité des pathologies et le suivi des
thérapeutiques
[12].
2.
LA GESTION DES EQUIPEMENTS
2.1.
Description
de
la
mission
2.1.1.
Intérêts
et
enjeux
de
la mission
Le laboratoire doit entamer une
démarche d'accréditation selon la norme ISO15189 et devra
le prouver avant le 1er novembre 2013. La preuve pouvant être
apporté par l'accréditation partielle du laboratoire, la
discipline "Hémostase" a été choisie pour
être la première activité accréditée.
Pour la partie technique de cette paillasse, le niveau qualité
est jugé satisfaisant par contre les activités
transversales, comme la gestion des équipements, sont à
définir.
La gestion des équipements incluant une partie Métrologie
et le centre hospitalier de Compiègne ne possédant pas de
compétence en Métrologie, il a fait appel à un
stagiaire qualité afin de répondre aux exigences de la
norme dans ce domaine.
La mission a donc un double intérêt :
- développer cette compétence en intégrant
le personnel du laboratoire dans la démarche,
- permettre de finaliser l'accréditation partielle de
l'hémostase,
- avancer le projet d'accréditation totale.
La mission portant à l'origine sur la métrologie s'est
élargie à la gestion des équipements.
Figure 4 - Processus de la mission :
Gestion des équipements selon la norme ISO15189
[13]
retour
sommaire
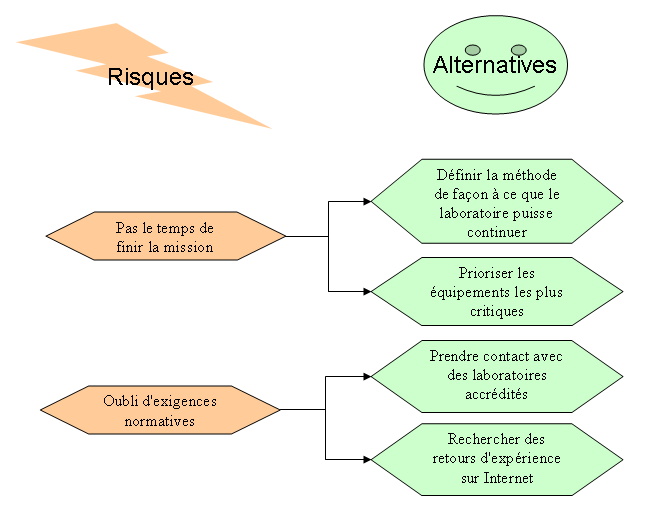
2.1.2.
Risques et alternatives
Figure 5 - Risques et alternatives
de la mission
[13]
retour
sommaire
2.2.
Etapes
de
la
mise
en place
2.2.1.
Etat des lieux initial
De façon à connaître à la fois les exigences
normatives et à la fois l'existant au sein du laboratoire, une
grille d'autodiagnostic a été conçue puis mise en
pratique.
Les 126 exigences de la norme ISO15189 en matière de gestion des
équipements ont été listées puis
regroupées par thème : "Management des ressources",
"Confirmation métrologique", "Processus de mesure" et "Analyses
et Améliorations".
Après leur regroupement, les exigences ont été
fusionnées en 72 questions affirmatives.
L'évaluation a été réalisée pour les
4 secteurs du laboratoire : "Hématologie", "Biochimie",
"Immunité-Sérologie" et "Microbiologie".
Les résultats sont présentés sous la forme d'un
graphe radar qui indique la moyenne et les écarts types entre
les 4 secteurs pour chacun des 4 thèmes.
Figure 6 - Résultats de
l'autodiagnostic initial "Gestion des équipements"
[13]
Le niveau du laboratoire se situe
à 32% de façon équilibrée dans les 4
thèmes. Le laboratoire réalise un travail quotidien
d'analyses tout à fait correct dans chacun des secteurs mais
doit prendre du recul et développer une vision globale des
activités. Il doit standardiser les méthodes
transversales au niveau des ressources et des matériels comme la
gestion du personnel, des équipements, ou encore des
dysfonctionnements.
Nous constatons un fort écart type au niveau de l'axe "Analyses
et améliorations". Cet écart s’explique par la
différence entre 2 secteurs : Hématologie et Biochimie,
le secteur Hématologie étant le plus avancé en
matière de gestion des non conformités et celui de
Biochimie étant le moins avancé. La priorité est
donnée au secteur Hématologie car il est le secteur
"pilote" et l'activité Hémostase sera la première
accréditée.
retour
sommaire
2.2.2.
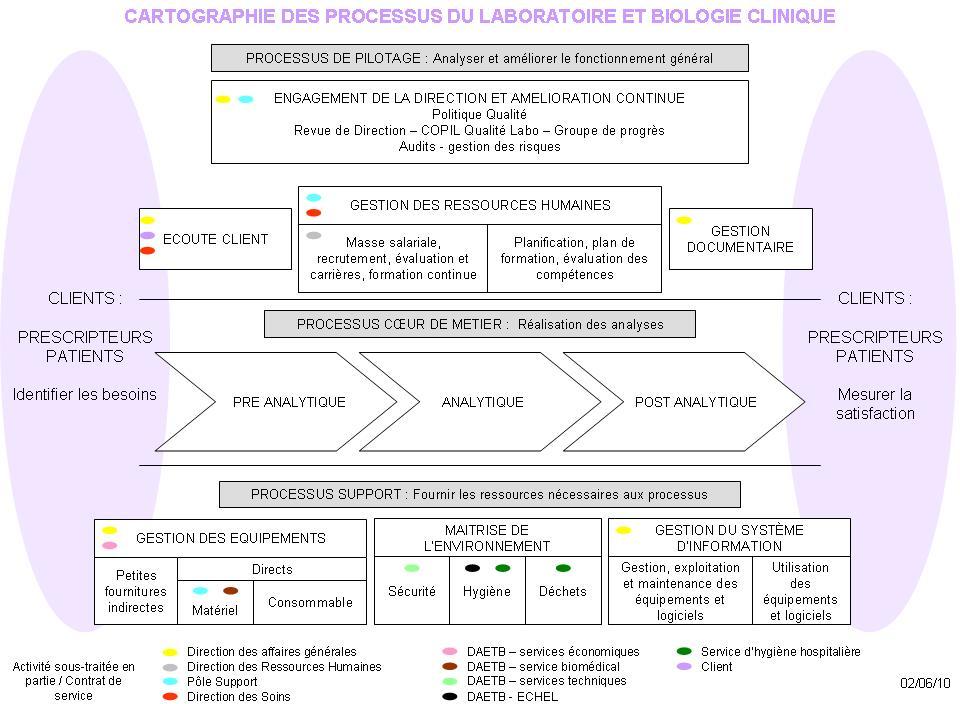
Définition des processus du laboratoire
Le laboratoire devant
améliorer la vision globale de ses activités et la
mission étant intégrée dans le projet
d'accréditation, les processus du laboratoire selon la norme
ISO15189 devaient être définis.
Les biologistes et le cadre du laboratoire ont été
formés à l'approche processus puis 3
séances de réflexion ont permis de valider la
cartographie des processus.
La cartographie a été conçue pour la
présentation sur le modèle du service
Stérilisation du CHC qui est certifié ISO9001. Les
processus ont été adaptés ou créés
par le groupe de travail.
Figure 7 - Cartographie des
processus du Laboratoire du CH de Compiègne
[13]
2.2.3.
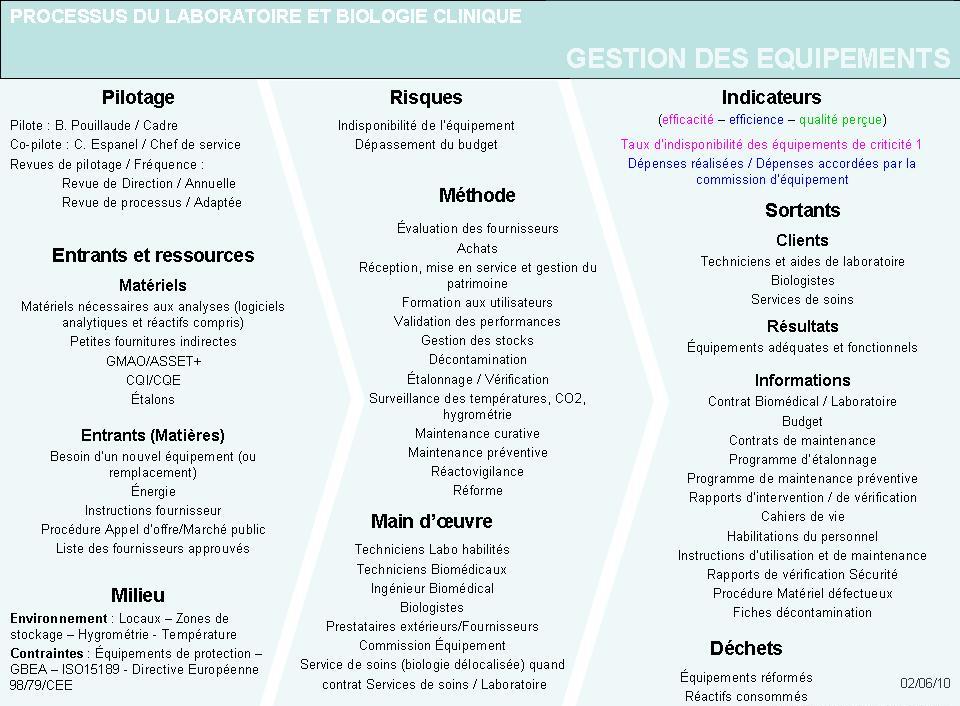
Définition du processus "Gestion des équipements"
Chacun des processus identifiés sur la cartographie est ensuite
décrit dans une Fiche Processus, la fiche du processus "Gestion
des équipements" est présentée ci-dessous :
Figure 8 - Fiche descriptive du
processus "Gestion des équipements"
[13]
Cette fiche processus a
été réalisée à partir de
différents modèles provenant de la formation DU
Qualité d'un biologiste et de diverses entreprises.
A partir de la cartographie, une fiche processus a été
ouverte pour chacun des processus.
Un pilote a été désigné par le groupe de
travail en accord avec le chef de service.
Chaque pilote a complété les fiches attribuées
puis celles-ci ont été analysées une à une
par les biologistes, le cadre et le qualiticien.
Ces revues ont permis de vérifier la cohérence entre tous
les processus et avec la norme ISO15189.
2.2.4.
La
préparation
de
la
mise en œuvre du processus
Les
limites de la mission
Les équipements peuvent être classés en
catégories (Cf Figure 7 - Cartographie
des processus du
Laboratoire du CH de Compiègne) :
- Petites fournitures indirectes : bureautique, ménage, …
- Matériels : Dispositifs médicaux et accessoires
(DMA)
- Consommables : Réactifs, CQI, CQE
L'étude s'est limitée à la catégorie des
DMA.
Les
différentes
méthodes
Une fois défini, le processus de gestion des équipements
peut être mis en œuvre de différentes façons.
Par étapes :
| 1 -
Evaluation des fournisseurs |
7 -
Décontamination |
| 2 - Achats |
8 -
Etalonnage / Vérification |
3 -
Réception, mise en service et gestion du patrimoine
|
9 -
Surveillance des températures, CO2, hygrométrie |
| 4 -
Formation aux utilisateurs |
10 -
Maintenance curative |
5 -
Validation des performances
|
11 -
Maintenance préventive |
| 6 - Gestion
des stocks |
12 -
Réforme |
Par type d'équipement :
1 - pipettes
2 - incubateurs
3 - hottes à flux laminaires
4 - automates
5 - centrifugeuses
Par analyses/paillasses : Hémostase,
groupe
sanguin,
…
Par secteur d'analyses :
Hématologie, biochimie, microbiologie, auto-immunité
Par référent :
1 technicien référent par automate ou type
d'équipement
Le
comparatif des différentes méthodes
|
Avantages
(+)
/
Inconvénients
(-)
|
Pour
la
mise
en
œuvre
|
Pour
la
sensibilisation
du
personnel |
Par
étape
|
- long : tout sera
commencé,
risque de s'éparpiller
- synchronisation des équipements : certains plus rapides que
d'autres |
- pas de vue globale du
processus |
Par type
d'équipement
|
+ contrats par type
équipements
+ priorisation des équipements critiques |
+
tout le personnel sensibiliser en même temps
+ meilleure assimilation du processus
|
Par analyse
/ paillasse
|
- contrats des
équipements |
- répétition car
le
personnel réalise plusieurs analyses
+ 1 référent par analyse |
Par secteur
d'analyse
|
- contrats des
équipements |
+ répétition
minimisée |
Par
référent
|
- contrats des
équipements
- risque d'oubli d'équipements
|
+ pas de
répétition |
Le
choix de la méthode
La méthode la plus
adaptée est "Par étape" pour
les étapes de 1 à 4 et 12. Pour les autres étapes,
la méthode par « type d'équipement" est la
plus adaptée.
retour
sommaire
2.2.5.
La
mise
en
œuvre
du processus
Une analyse précise de la
grille d’autodiagnostic a permis d’identifier les actions à
réaliser afin d’avoir des équipements répondants
aux exigences de la norme ISO 15189.
Cette analyse a été complétée par une
étude du guide de métrologie à l’usage des LABM
[14] qui présente les aspects
théoriques de la
métrologie et des exemples pratiques relatifs au raccordement en
température, temps, masse, vérification de
centrifugeuses, pipettes, et cartographie d’enceintes.
Le
contrat
Biomédical / Laboratoire
Le laboratoire étant un
laboratoire d’un centre hospitalier, certaines activités sont
prises en charge totalement ou partiellement par d’autres services de
l’hôpital.
Pour les activités relatives aux DMA, un contrat entre le
service biomédical et le laboratoire a été
élaboré par les 2 services.
Ce contrat décrit les engagements de chacun des services pour
mener à bien toutes les étapes du processus sauf les
étapes de « gestion des stocks » et de «
validation des performances » qui sont uniquement pris en charge
par le laboratoire (
Annexe 4).
Ce contrat a été réalisé sur la base du
contrat type du pôle support et du contrat Biomédical /
Stérilisation existants.
5 séances de travail rassemblant l'ingénieur
biomédical, le chef du servie du laboratoire, le cadre du
laboratoire et le qualiticien ont permis de valider ce contrat.
Un plan d'action a été ouvert afin de mettre en place les
éléments nécessaires à l'application de ce
contrat.
La traçabilité des
matériels de mesure
Un inventaire physique a permis
d’établir une liste de l'ensemble des DMA présents dans
le laboratoire.
Afin d’assurer leur traçabilité, chaque équipement
doit avoir un numéro d’identification unique. 36% des
équipements étant identifiés par un numéro
« CH » se composant de « année d’acquisition
»/ « numéro d’ordre », les 64% restants ont
été identifiés de la même façon.
Les 330 DMA listés ont été enregistrés dans
le logiciel de Gestion de la Maintenance Assistée par Ordinateur
(GMAO). La GMAO permet d’assurer l’identification unique, la fiche de
vie et la traçabilité des interventions de chacun des DMA.
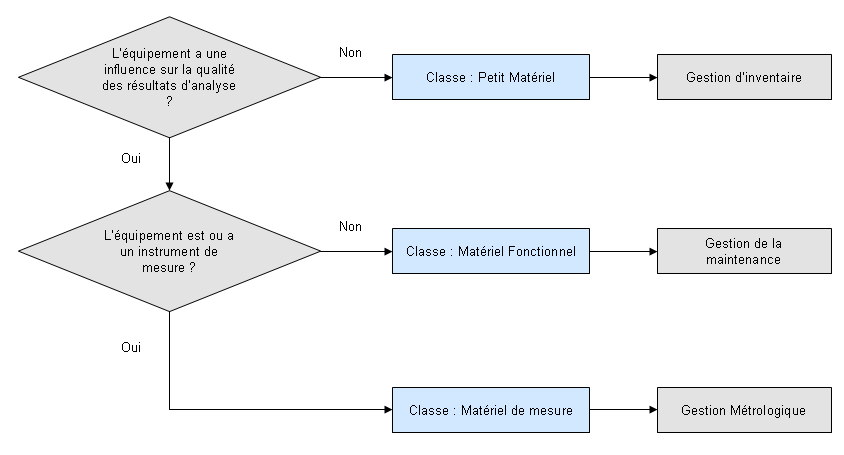
Les exigences relatives à la métrologie s’appliquant
qu’au matériel de mesure, les 330 DMA ont été
classés en catégorie "Petit matériel",
"Matériel fonctionnel" ou "Matériel de mesure" en
fonction de leur utilisation selon le logigramme suivant :
Figure 10 - Logigramme de
détermination de la classe des
équipements
[13]
La
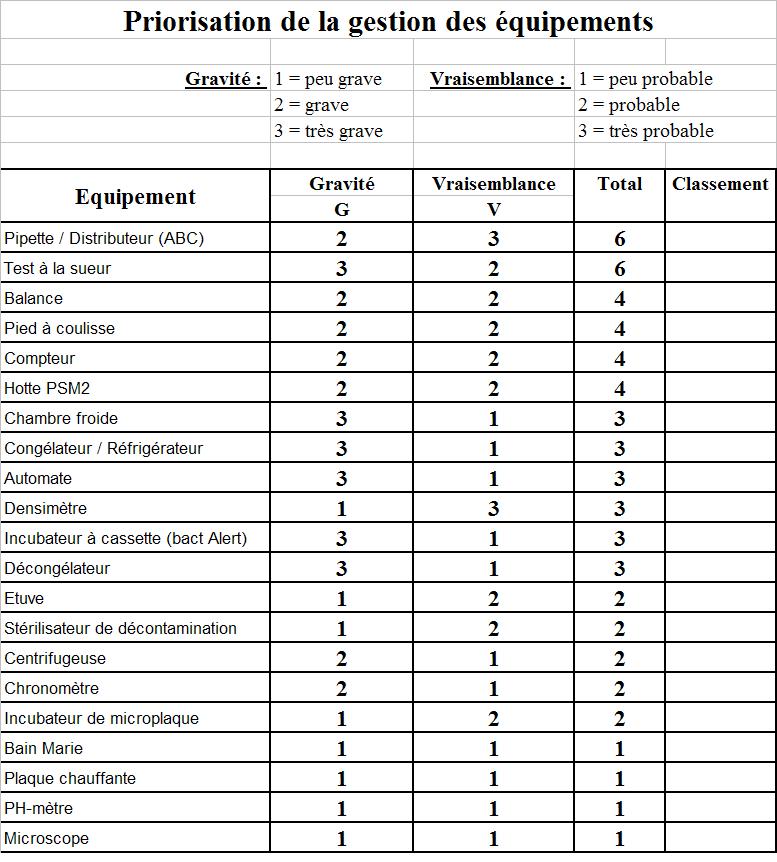
priorisation des matériels de mesure
Afin de déterminer l'ordre
dans lequel les DMA classés en
"Matériel de mesure" seront étudiés, ils ont
été évalués par rapport au risque sur les
résultats d'analyses sur 2 critères : La gravité
et la vraisemblance.
Le critère Gravité correspond à l'influence qu'un
mauvais fonctionnement de l'équipement peut avoir sur le
résultat de l'analyse. Celui de Vraisemblance correspond
à la probabilité que l'équipement fonctionne mal.
Le risque est évalué en multipliant la gravité par
la vraisemblance. Le résultat de cette priorisation est
présenté en
annexe 1.
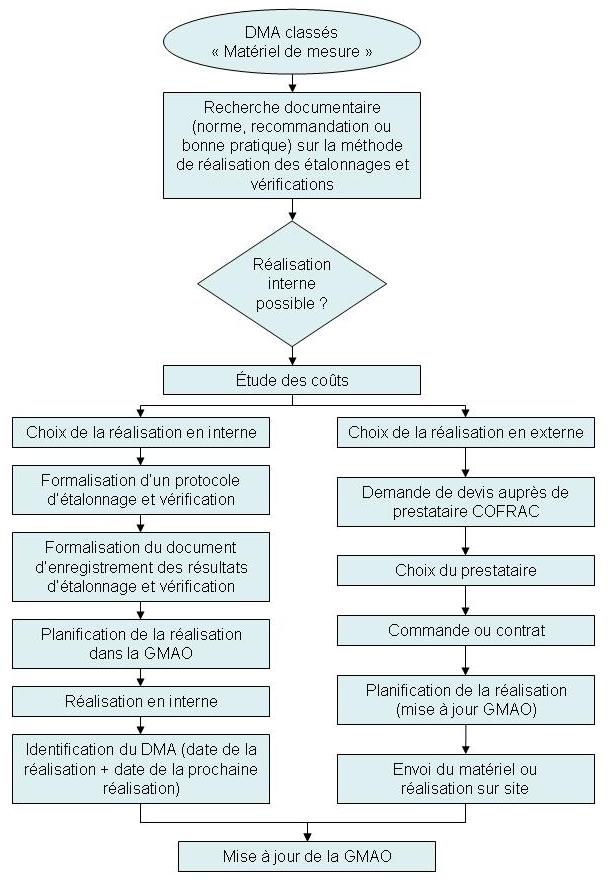
L'étalonnage
et la vérification des matériels de mesure
Les principes de base de la
métrologie relatifs à
l'étalonnage et aux incertitudes ont été
présentés à l'ensemble du personnel lors d'une
réunion de service.
L'étalonnage et la vérification des matériels de
mesure sont réalisés suivant le logigramme suivant :
Figure 11 - Logigramme de
réalisation d'un étalonnage et
d'une vérification
[13]
Exemple pour la
vérification des pipettes :
La vérification des pipettes
se fait selon la norme NF EN
ISO 8655.
La réalisation en interne est possible car le matériel
nécessaire est accessible.
Une étude de coûts a
donc été menée
en prenant en compte les éléments suivants :
Pour une réalisation interne :
- Coût d'achat du matériel
nécessaire (étalons)
- Coût annuel
d'étalonnage/vérification du matériel
nécessaire
- Temps annuel de réalisation
Pour une réalisation externe :
- Coût unitaire
- Coûts de transport
- Temps d'indisponibilité
- Frais d'évaluation (si réalisé
sur site par le prestataire)
Des devis ont été demandés à 4 prestataires
accrédités COFRAC pour la vérification
volumétrique des pipettes.
Dans le cas des pipettes classées en matériel de mesure,
il a été décidé de réaliser dans un
premier temps en externe une vérification annuelle puis de
s'équiper progressivement pour pouvoir réaliser des
vérifications intermédiaires en interne. Le coût
d'achat du matériel est élevé (18 000€) mais une
seule vérification annuelle est insuffisante par rapport
à leur utilisation pour garantir la qualité des
résultats d'analyses.
Un protocole de vérification des pipettes ainsi qu'un formulaire
d'enregistrement des résultats a été
formalisé (
Annexes 2 et
annexe 3).
3.
LES RESULTATS OBTENUS
3.1.
Autodiagnostic final de la gestion des équipements
Afin de vérifier la
cohérence des actions
réalisées dans le cadre de la mission et les exigences de
l'ISO 15189, un autodiagnostic a été
réalisé.
Figure 12 - Résultats de
l'autodiagnostic final "Gestion des
équipements" [13]
Le niveau qualité du
laboratoire est passé de 32%
à 63%. Cette progression, visible dans les 4 thèmes est
principalement du à la définition des processus. Les
fiches processus ont permis d'accroître la visibilité de
l'organisation du laboratoire et de définir des méthodes
de travail transversales. L'étude sur le processus "Engagement
de la Direction et Amélioration continue a permis notamment
d'organiser la revue de direction et les groupes d'amélioration
(COPIL Labo et Groupe de progrès).
|
Situation
initiale |
Situation
finale |
Processus Gestion des équipements |
Non
défini
|
1 Fiche processus |
Evaluation
de la fonction métrologique
|
Non
définie
|
1 grille d'autodiagnostic |
Outil informatique de la gestion des
équipements
- Nombre d'équipements
identifiés par un numéro CH
- Nombre d'équipements
enregistrés dans la GMAO
|
Non
défini
36% des
équipements
50% des
équipements
|
GMAO
100% des équipements
100% des équipements |
| Documentation
Métrologique |
Non
définie
|
Définie : Protocole et
formulaire des pipettes à déployer |
Sensibilisation du personnel
- Personnel ayant des notions de
métrologie
- Personnel ayant des notions de
système qualité
- Personnel ayant des notions sur
l'accréditation
|
1 technicienne de laboratoire
1 biologiste
1 cadre
1 biologiste
1 cadre
< 5% |
1 session de formation : 90% du personnel du
laboratoire
1 session de formation : 3 biologistes
1 cadre
Article dans le journal interne : 100 % du personnel du CHC |
4.
CONCLUSION
Grâce à
l'identification des processus, le laboratoire
peut désormais rattacher chacune de ses activités
à un processus et mener une réflexion globale de ses
activités.
Le processus Gestion des équipements a été mis en
œuvre principalement en utilisant l’existant et peut désormais
servir de processus pilote pour le déploiement des autres
processus. La documentation créée pour les pipettes peut
servir de modèle aux autres équipements de mesure.
Les biologistes et le cadre du laboratoire se sont fortement
impliqués dans la démarche en vivant cette période
comme une chance de progresser et non comme une obligation amenant une
surcharge de travail.
La mission a permis d’utiliser et d’appliquer les théories vues
en cours. Diverses expériences du monde industriel ont
également servi pour mener à bien cette mission.
La réussite de cette mission montre la grande possibilité
d'adaptabilité qu'apporte la formation "Mater Management de la
Qualité ".
retour
sommaire
[1]
http://www.ch-compiegne.fr/sites.php,
site
consulté
le
05/03/10
[2] site intranet du centre hospitalier de Compiègne, site
consulté le 05/03/10
[3] Procédure de certification des établissements de
santé, HAS, 17 décembre 2008,
http://www.has-sante.fr/portail/upload/docs/application/pdf/2009-01/20081209_procedure_certification_v2010.pdf,
page
consultée
le
05/03/10
[4] Guide de Bonne Exécution des Analyses de biologie
médicale, Dominique Gillot, Arrêté du 26 novembre
1999,
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000778935&fastPos=1&fastReqId=1112274498&categorieLien=id&oldAction=rechTexte,
site
consulté
le
20/01/10
[5] Les analyses de biologie médicale dans l'inter-région
ouest : Bilan des inspections sur la qualité de la phase
pré-analytique, Ministère du travail, des relations
sociales, de la famille, de la solidarité et de la ville,
Ministère de la santé et des sports, DRASS de Basse
Normandie, DRASS de Bretagne, DRASS des Pays de la Loire, Janvier 2009,
http://basse-normandie.sante.gouv.fr/docs/sante/pharma/pre_analytique.pdf,
page
consultée
le
12/04/10
[6] Outil d’autodiagnostic basé sur la norme ISO 15189 pour les
Laboratoires d’Analyses de Biologie Médicale (LABM), Fatima De
FRONDAT, Valérie DELAHAYE, Christophe PODLUNSEK, Papa-James
GOMEZ, Projet d'Intégration, MASTER Management de la
Qualité (MQ), Mastère Spécialisé
Normalisation, Qualité, Certification, Essai (NQCE), UTC,
2009-2010,
https://www.utc.fr/master-qualite,
rubrique
«
Travaux
»
n°127, site consulté le 12/01/10
[7] NF EN ISO 15189, Laboratoires d'analyses de biologie
médicale - Exigences particulières concernant la
qualité et la compétence, Association Française de
Normalisation (AFNOR), Edition 2007,
http://www.boutique.afnor.org,
site
consulté
le
20/01/10
[8] NF EN ISO/CEI 17025, Exigences générales concernant
la compétence des laboratoires d'étalonnages et d'essais,
Association Française de Normalisation (AFNOR), Edition 2005,
http://www.boutique.afnor.org,
site
consulté
le
20/01/10
[9] NF EN ISO 9001, Normes pour le management de la qualité et
l'assurance de la qualité - Partie 1 : lignes directrices pour
leur sélection et utilisation, Association Française de
Normalisation (AFNOR), Edition 1994,
http://www.boutique.afnor.org,
site
consulté
le
20/01/10
[10] La biologie médicale en France : Bilan et perspectives,
Inspection Générale des Affaires Sociales (IGAS), Avril
2006,
http://www.sante-jeunesse-sports.gouv.fr/IMG/pdf/rapport_IGAS_2006.pdf,
pages
consultées
le
12/01/10
[11] Rapport sur un projet de réforme de biologie
médicale, Michel BALLEREAU, 2008,
http://www.sante-jeunesse-sports.gouv.fr/la-reforme-de-la-biologie-medicale-2008.html,
site
consulté
le
16/01/10
[12] Conseil des Ministres, Service de presse de la Présidence
de la République, 13/01/10,
http://www.gouvernement.fr/gouvernement/conseil-des-ministres,
site
consulté
le
05
mars 2010
[13] Accréditation ISO15189 : Le processus de gestion des
équipements, Valérie DELAHAYE, stage professionnel de fin
d'études, MASTER Management de la Qualité (MQ-M2), UTC,
2009-2010,
https://www.utc.fr/master-qualite,
rubrique
«
Travaux
»,
référence n°156
[14] Guide de Métrologie à l’usage des Laboratoires
d’Analyses de Biologie Médicale, Collège Français
de Métrologie, édition 2003,
http://www.cfmetrologie.com,
site consulté le 04/06/10
retour sommaire
ANNEXE
1
:
Tableau
de priorisation des DMA
ANNEXE 2 : Sommaire du protocole de
vérification des pipettes

Annexe 3 : Formulaire de vérification
des pipettes

Annexe 4 : Sommaire du contrat entre le service
Biomédical et le Laboratoire