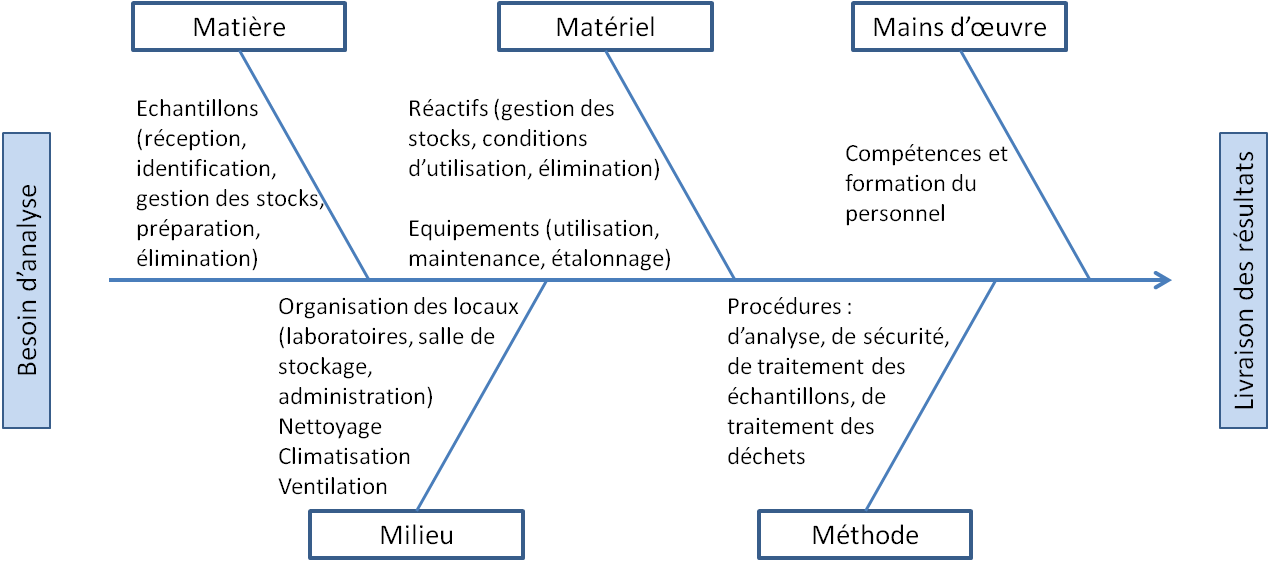
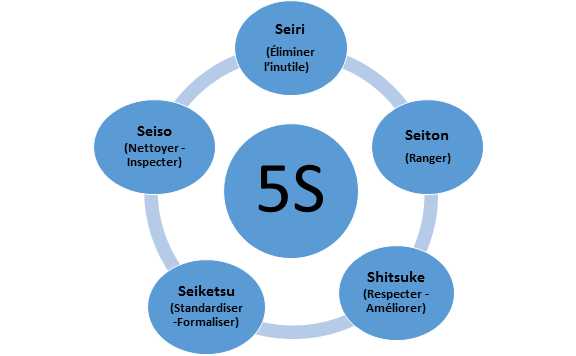
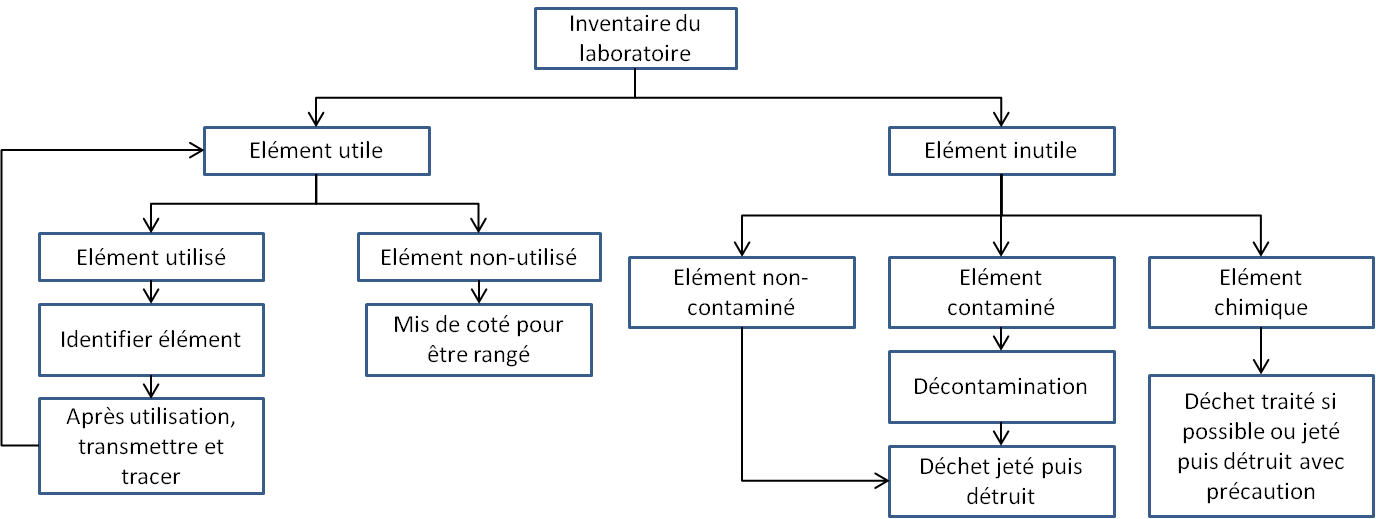
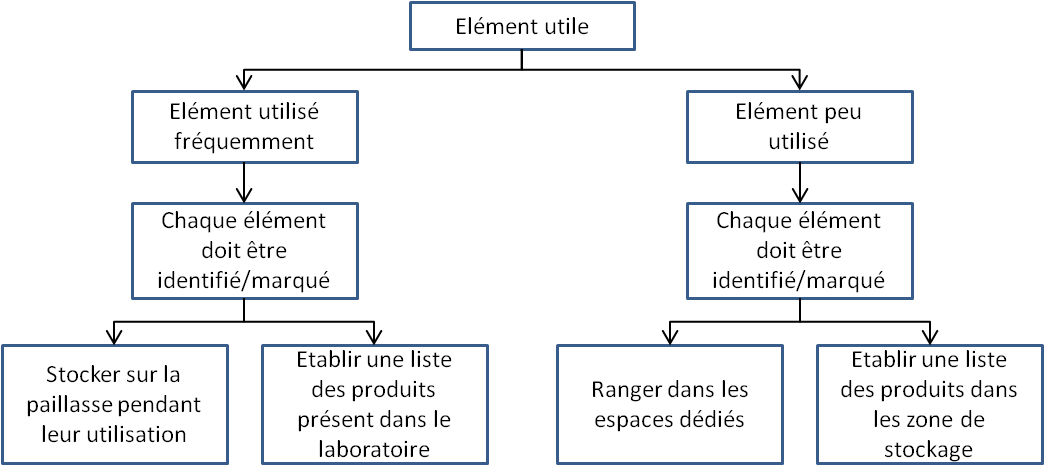
Figure 6 : Ranger/Ordonner 6
Cette étape de rangement est une action quotidienne qui
doit être réalisé par tous les manipulateurs. Il faudra
également veiller à tenir à jour les listes de produits,
d’échantillons et de matériels pour ne pas égarer
d’éléments. Si cette étape est bien réalisée cela va
permettre d’éviter l’encombrement du lieu de travail et de
perdre du temps en cherchant du matériel. Par ailleurs
cela permettra aussi de prévenir les risques de
renversement d’échantillons ou de produits chimiques ainsi
que le risque de perte d’échantillons.
Nettoyer/décontaminer
Dans les laboratoires de biologie, l’utilisation d’agents
pathogènes rend l’étape de nettoyage particulièrement
critique et bien souvent il sera nécessaire de procéder à
une étape préliminaire de décontamination. On peut
distinguer plusieurs secteur de nettoyage : les locaux, le
matériel, le personnel.
Les sols et les paillasses doivent être nettoyés
quotidiennement. Il est absolument nécessaire pour éviter
toutes propagation des pathogènes que ce nettoyage soit
effectué avec des produits d’entretien qui vont permettre
une désinfection comme de l’eau de javel. Il n’est pas à
exclure qu’un échantillon soit renversé accidentellement.
Si cela ce produit il ne faut pas attendre le nettoyage de
fin de journée pour intervenir. Il est donc opportun de
mettre en place une procédure d’urgence.
1. Mettre des gants
2. Délimiter la zone concernée
3. Désinfecter la zone
4. Nettoyer la zone
5. Décontaminer le matériel
6. Jeter les déchets dans les poubelles
appropriées
7. Faire remonter l’incident
Ne pas nettoyer consciencieusement son laboratoire peut
amener le personnel à se contaminer par contact avec un
élément infecté (paillasse, poignée de porte…). Par effet
domino, le personnel pourra alors transporter ces agents
pathogènes à l’extérieur du laboratoire.
Dans le nettoyage, il faut également prendre en compte les
équipements.
- La verrerie sera, après chaque
utilisation, désinfectée, lavée puis stérilisée avant
d’être rangée ou réutilisée.
- Les appareils d’analyse doivent
être désinfectés, nettoyés et étalonnés régulièrement
en fonction des recommandations des fabricants.
Si ces équipements ne sont pas bien nettoyés, cela pourra
entrainer des erreurs dans les analyses pouvant amener à
la communication de résultats erronés auprès des
clients/patients/pouvoir public.
Enfin, dans cette étape de nettoyage, le personnel est
également à prendre en compte. En effet, ce dernier doit
se laver les mains avec du savon avant chaque sortie du
laboratoire, pour éviter d’emporter avec lui un agent
pathogène et ainsi éviter sa propagation à la population.
Formaliser/Former
Afin de transmettre les bonnes pratiques décrites
ci-dessus il est nécessaire de les formaliser sous forme
de procédure et de les transmettre au personnel. Ce
dernier devra également être formé régulièrement au
respect des bonnes pratiques.
Il faudra également formaliser les procédures de bonne
utilisation du matériel et de bonne réalisation des
analyses.
Un dernier point concernant la protection du personnel n’a
pas été abordé. Elle concerne le port des équipements de
protection individuel, ce qui est l’une des procédures les
plus importantes à mettre en place :
- Blouse
- Lunettes
- Gants
- Sur-chaussures
Il est primordial de mettre ces éléments à disposition du
personnel de laboratoire. Ils doivent être portés en
permanence et être ranger dans un endroit, à l’écart des
vêtements civils.
Corriger/améliorer
Afin d’améliorer en continu le fonctionnement du
laboratoire il est important de mettre en place une
politique de retour d’expérience. Pour cela il doit être
demandé au personnel de reporter tout les incidents afin
de pouvoir corriger plus rapidement les problèmes et ainsi
éviter que ces incidents ne se transforment en accident.
Maintenant que des règles de bonne pratique ont été
établies, il est nécessaire de les faire respecter. Pour
cela, une simple observation du laboratoire au quotidien
va permettre de corriger les écarts mineurs. Des rappels à
l’ordre plus ou moins formels selon la gravité des faits
doivent être effectués. Il est important de bien
sensibiliser le personnel au respect de ces bonnes
pratique en le responsabilisant pour qu’ils ne vivent pas
cela comme une contrainte. Par ailleurs, un audit,
semestriel ou annuel, sur la sécurité pour être réalisé
afin de pouvoir quantifier les écarts et les comportements
à risque.
Le 5S Biologie décrit ci-dessus est une méthode visuelle
qui va permettre de répondre à la problématique des règles
d’hygiène dans les laboratoires de biologie. Cependant,
nous ne pouvons prétendre avec cette méthode régler tous
les problèmes, ni apporter une réponse à tout les risques
présent en laboratoire. En effet, il leur tiendra de
mettre en place les procédures nécessaires à la bonne
réalisation des analyses ainsi qu’à la bonne utilisation
des appareils de mesure.
Nous avons vu les différents axes que doivent prendre en
compte le 5S biologie. Nous devons, maintenant, nous
interroger sur la meilleure méthode à utiliser pour
transmettre cette information.
II.3. Comment
diffuser le 5S biologie ?
De nos jours, les moyens de communications sont multiples
et il est très facile de pouvoir diffuser une information.
Afin de savoir quel est le canal le plus approprié pour la
diffusion du 5S biologie au plus grand nombre de
laboratoire, nous avons comparé différentes méthodes
répertorié dans le tableau ci-dessous. (
Tableau
4)
|
Moyen de
diffusion
|
Avantages
|
Inconvénients
|
|
Envoi d’un
formateur dans chaque laboratoire
|
Construction
d’une formation ciblée
Suivi
personnalisé de chaque laboratoire
|
Nécessite
d’avoir des formateurs
Prix
|
|
Organiser une
session de formation commune à plusieurs
laboratoires
|
Création d’un échange
entre les laboratoires
Possibilité de
communiquer avec un formateur pour avoir des
conseils personnalisés
|
Prix
Nécessite d’avoir des
formateurs
Une ou deux personnes
par laboratoires reçoivent la formation
|
|
Distribution d’un
guide physique
|
Document
consultable par tous
Document
consultable à tous moment
Prix
|
Pas
de conseils ciblés
Document
lourd d’utilisation
Risque
de rester au placard
Evolution
difficile
|
|
Création d’une
plateforme dématérialisée sur internet
|
Document consultable
par tous
Document
consultable à tous moment
Prix
Facile d’évolution
Peu prendre la forme
de plusieurs support (audio, vidéo…)
|
Pas de conseils ciblés
Risque de ne pas être
consulté
Connexion
internet obligatoire
|
Tableau 4 : Comparaison de
différents moyens de diffusion de l’information 6
Après analyse de ces différents moyens de diffusion, nous
pensons qu’il est plus judicieux de créer une plateforme
sur internet où il sera possible de trouver une formation
au 5S biologie ainsi qu’un outil d’auto-évaluation pour
que les laboratoires puissent s’auditer. Cependant cela ne
nous semble pas suffisant et nous pensons qu’il serait
opportun de proposer sur ce site du contenu téléchargeable
comme un guide d’application au 5S Biologie. Enfin nous
pensons qu’à long termes, la mise en place d’un forum de
partage pourrait permettre la création d’un réseau de
professionnel pouvant s’entre-aider.
Nous venons de définir cette nouvelle approche 5S
Biologie, ainsi que les moyens pour diffuser à terme cette
information. Nous pensons qu’il est également important de
construire un outil d’auto-évaluation, permettant aux
utilisateurs de se positionner par rapport à la démarche
5S Biologie.
Chapitre
III : Un outil d’auto-évaluation pour le 5S
biologie
Dans le chapitre précédent, Le 5S biologie a été défini
comme des bonnes pratiques à mettre en place dans un
laboratoire afin d’optimiser, la sécurité du personnel,
l’intégrité des résultats et d’éviter au maximum toute
propagation d’agents pathogènes à l’extérieur du
laboratoire. Nous avons également vu qu’il serait
pertinent, à terme, de créer une plateforme dématérialisée
sur internet afin d’y proposer des outils de formation.
Dans un premier temps, nous nous proposons de créer un
outil d’auto-évaluation, pour que chaque laboratoire qui
le souhaite puisse se situer par rapport à la démarche 5S
biologie.
III.1.
Présentation de l’outil
Cet outil d’auto-évaluation a été réalisé en utilisant le
logiciel Excel. Nous avons choisi de nous porter sur ce
programme, car il est maitrisé par l’ensemble du groupe et
nous a donc permis de gagner du temps dans la conception
de l’outil. Par ailleurs les fichiers .xlsx sont
compatibles avec les logiciels en libre accès comme open
office. Notre outil pourra donc être lu sur tous les
ordinateurs sans obligation d’être connecté sur internet
une fois téléchargé.
La mission de cet outil est de permettre aux laboratoires
qui l’utiliseront de mesurer leur progression par rapport
à la démarche 5S biologie qui a été décrite précédemment.
Cette démarche a été conçue dans le but d’aider les
organismes à mieux se manager, afin de réduire les risques
d’accidents et, par extension, d’assurer l’intégrité des
résultats. Cette démarche étant, avant tout, pédagogique,
il est important que notre outil le soit aussi. Nous avons
donc choisi d’avoir une grille d’auto-évaluation divisée
en cinq catégories pour chaque thème du 5S Biologie.
Chaque thème comporte une série de critère à évaluer en
choisissant l’état de résolution correspondant à celui
constaté dans le laboratoire. Une note est alors attribuée
qui permettra de tracer un graphe radar montrant de
manière visuelle l’état d’avancement du laboratoire dans
la démarche 5S Biologie. (
Figure 7)
Figure 7 : Echelle de véracité
présente dans l’outil d’auto-évaluation 6
III.2.
Utilisation de l’outil d’auto-évaluation
III.2.1. Mode d’emploi
Le premier onglet « mode d’emploi », répertorie l’objectif
de l’outil. Ensuite, les utilisateurs sont invités à
remplir les informations concernant l’évaluation (date ;
nom du laboratoire ; nom des évaluateurs ; fonction des
évaluateurs ; coordonnées) afin de permettre une bonne
traçabilité des différentes évaluations qui seront
réalisées. (
Figure 8)
Figure 8 : En-tête de l’outil
d’auto-évaluation 6
Les utilisateurs peuvent alors lire le mode d’emploi de
l’outil. Dans un premier temps, ils sont invités à en
prendre connaissance et à regarder les critères
d’évaluation. Pour réaliser l’auto-évaluation, il faudra
ensuite, pour chaque critère, choisir dans un menu
déroulant le niveau de véracité observé. Les évaluateurs
pourront alors observer leurs résultats et constater leur
niveau de conformité au 5S biologie. Enfin il est demandé
aux utilisateurs de remplir un formulaire de retour
d’expérience sur l’utilisation de l’outil. Cela permettra,
dans une logique d’amélioration continue, d’analyser le
fonctionnement de l’outil et ainsi il pourra être
amélioré. (
Figure 9)
Figure 9 : Mode d’emploi de
l’outil d’auto-évaluation 6
Enfin, est présenté l’échelle de véracité qui va permettre
de compléter la grille d’auto-évaluation ainsi qu’une
échelle de conformité qui va permettre de mesurer le
niveau de conformité au 5S Biologie. (
Figure
10)
Figure 10 : Ensemble des
échelles utilisées dans l’outil d’auto-évaluation
6
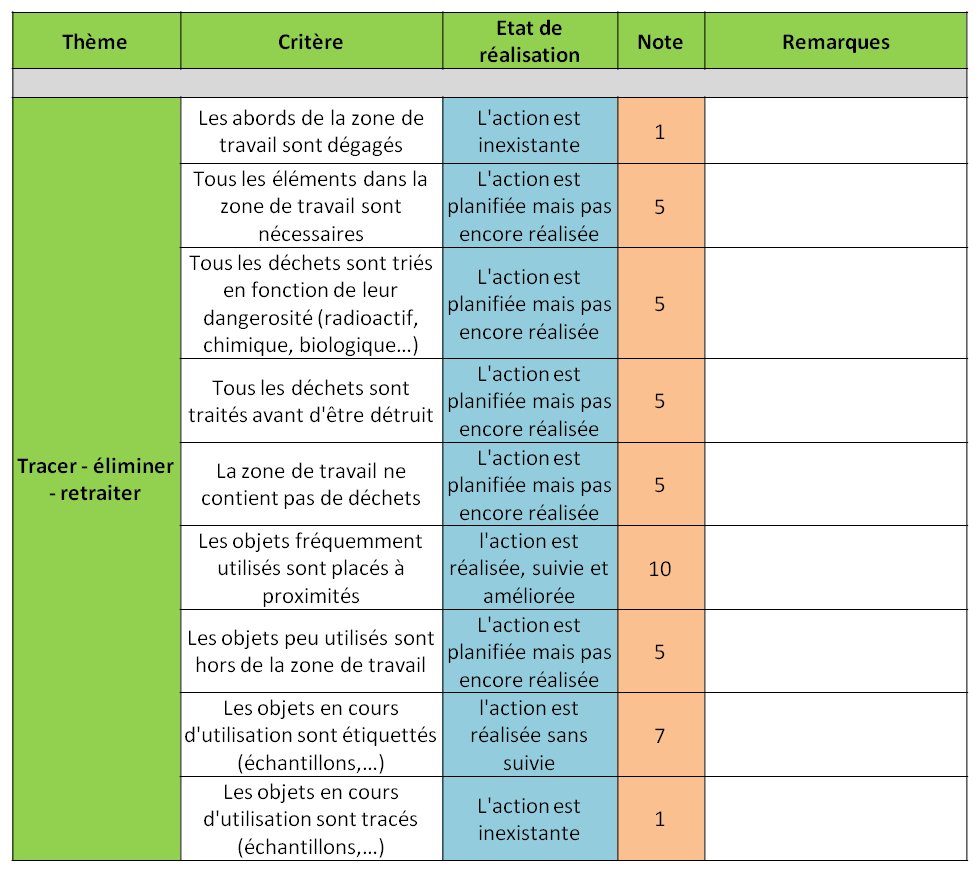
III.2.2. Grille
Dans un premier temps, nous demandons à
l’utilisateur de rappeler les métadonnées, l’évaluation
peut ensuite avoir lieu. La grille est constituée de cinq
colonnes : (
Figure 11)
- Thème : qui correspond à la
thématique du 5S Biologie qui est étudiée
- Critère : des affirmations qu’il
faut contrôler dans le laboratoire
- Etat de réalisation : un menu
déroulant, où l’on peut choisir à quel niveau se situe
le laboratoire
- Note : une note est générée
automatiquement en fonction de l’état de réalisation
- Remarques : Pour que l’évaluateur
note ses observations
Figure 11 : Extrait de la
grille de l’outil d’auto-évaluation 6
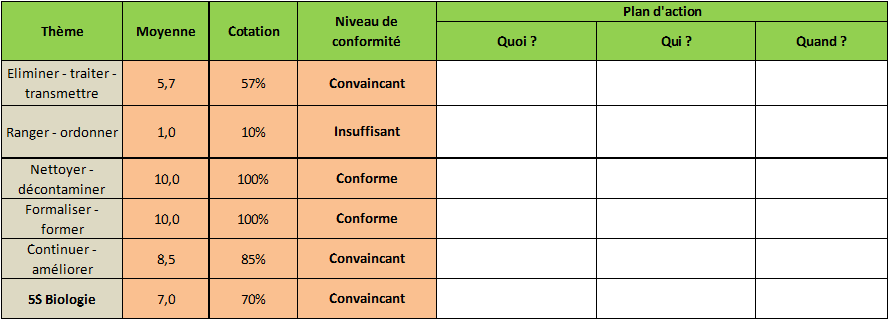
III.2.3. Résultat – Plan d’action
Après avoir rappelé les métadonnées ainsi que l’échelle de
conformité, l’utilisateur va obtenir une synthèse des
résultats obtenus pour chaque thème. Tout d’abord la
moyenne de chaque critère est calculée pour chaque thème.
Cela permet alors de définir un niveau de conformité qui
est généré automatiquement. Ce même calcul est réalisé
pour obtenir une note globale sur l’ensemble du 5S
Biologie. Enfin, pour corriger les écarts, il est proposé
pour chaque thème de concevoir un plan d’action en
répondant aux questions « Quoi ? », « Qui ? » et « Quand ?
». (
Figure 12)
Figure 12 : Résultats obtenus
après l’évaluation 6
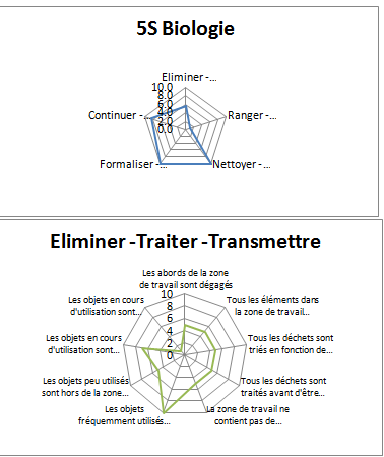
Sur ce même onglet, différents graphes radar sont
également présentés. Ils vont permettre de visualiser d’un
coup d’œil la situation du laboratoire. Nous avons générés
un graphe pour chaque thème qui reprend chacun des
critères associés, ainsi qu’un graphe global pour
l’ensemble des thèmes du 5S Biologie. (
Figure
13)
Figure 13 : Graphe radar (en
haut : global ; en bas : pour l’un des thèmes) obtenu
après évaluation 6
III.2.4. Retour d’expérience
Ce dernier onglet, propose à l’utilisateur de
remplir un formulaire d’évaluation de l’outil avec des
questions précises quant à son déroulement. Il aura
ensuite la possibilité de communiquer d’une manière plus
libre sur les problèmes rencontrés ainsi que la
possibilité de suggérer des améliorations. (
Figure
14)
Figure 14 : Extrait du
formulaire de retour d’expérience 6
Afin d’éviter le risque d’effacer les formules de
certaines cellules, les différents onglets ont été
verrouillés. Néanmoins, nous n’avons mis aucun mot de
passe car nous souhaitons que chaque laboratoire puisse,
s’il le souhaite, modifier le formulaire.
Nous avons souhaité créer un outil qui puisse permettre
d’évaluer rapidement l’ensemble des points critiques d’un
laboratoire décidant de mettre en place une démarche 5S
Biologie. Le risque majeur que nous avons autour de
l’utilisation de cet outil est qu’il soit trop simpliste
et donc, a fortiori, peu révélateur du niveau de
conformité du laboratoire. Afin de diminuer ce risque il
est donc important de mettre en place une campagne de
tests.




 sous format
.xls
sous format
.xls