Master Qualité - Communication
publique des résultats d'un stage de fin d'études
Master Qualité
- UTC - rue du docteur Schweitzer - CS 60319 - 60203
COMPIEGNE Cedex - France - master-qualite@utc.fr - Téll : +33 (0)3 44 23 44 23 |
|
Avertissement : Si vous arrivez directement sur cette page, sachez
que ce travail est un rapport d'étudiants et doit être
pris comme tel. Il peut donc comporter des
imperfections ou des imprécisions que le lecteur doit
admettre et donc supporter. Il a été réalisé pendant
la période de formation et constitue avant-tout un
travail de compilation bibliographique, d'initiation
et d'analyse sur des thématiques associées aux
concepts, méthodes, outils et expériences sur les
démarches qualité dans les organisations. Nous ne
faisons aucun usage commercial et la duplication est
libre. Si, malgré nos
précautions, vous avez des raisons de contester ce
droit d'usage, merci de nous
en faire part, nous nous efforcerons d'y
apporter une réponse rapide. L'objectif de la
présentation sur le Web est de permettre l'accès à
l'information et d'augmenter ainsi les échanges
professionnels. En cas d'usage du document, n'oubliez
pas de le citer comme source bibliographique.
Bonne lecture... |
Questionnaires
d'évaluation des formations Qualité - Opérateurs de
production - Industrie pharmaceutique
|

Cécile
PITON
|
Référence
bibliographique à rappeler pour tout usage :
Questionnaires d'évaluation des formations
Qualité - Opérateurs de production - Industrie
pharmaceutique, Université de
Technologie de Compiègne, Master Qualité et
Performance dans les Organisations (QPO), Mémoire d'Intelligence Méthodologique du stage
professionnel de fin d'études, juin 2016, www.utc.fr/master-qualite,
puis "Travaux", "Qualité-Management", réf n°370 |
RESUME
La
formation du personnel est un des piliers des Bonnes
Pratiques de Fabrication. Il est essentiel de respecter
les règles établies pour sécuriser ses actions au
quotidien et ainsi garantir, tout au long du processus
de fabrication, un produit de qualité pour le patient.
Pour cela, le parcours de formation qualité des
opérateurs arrivant en production est complet et dense.
Il est donc judicieux, quelques temps après avoir suivi
ce parcours de formation, d’évaluer ce qui a été retenu.
Le but de cette évaluation est de se focaliser sur les
points essentiels et, le cas échéant, de faire des
rappels sur ce qui n’a pas été assimilé.
Cela permettra de réduire le nombre de déviations et
ainsi d’améliorer la qualité des produits et
l’efficience de la production.
Mots clés : Bonnes Pratiques de
Fabrication, qualité, formation
|
ABSTRACT
Staff
training is one of the pillars of Good Manufacturing
Practices. It is essential to follow the rules
established to secure the daily actions and thus
guarantee a quality product for the patient.
For this, the quality training for new operators is full
and dense. It is therefore advisable, shortly after
completing this training course, to assess what has been
learned. The purpose is to evaluate each operator by
focussing on essentials and, if necessary, by reviewing
what has not been assimilated.
This is a way to reduce the number of deviations and
thus improve product quality and production efficiency.
Keywords: Good Manufacturing
Practices, quality, training
|
REMERCIEMENTS
J’adresse tout d’abord ma gratitude à mon
tuteur en entreprise, Madame Pascale Bassino, responsable AQP,
qui m’a apporté toute l’aide et les connaissances dont j’avais
besoin pour remplir mes missions dans les meilleures conditions.
Mes remerciements vont ensuite aux équipes d’Assurance
Qualité Produits, Systèmes et aux responsables de production,
qui m’ont fait bénéficier de leur soutien professionnel, de leur
disponibilité et de leurs conseils, nécessaires pour atteindre
mes objectifs.
Je remercie également Matthieu Rozanski, Directeur
Qualité, ainsi que toutes les personnes qui ont contribué
directement ou indirectement à la réussite de mon travail. Elles
m’ont permis, jour après jour, de m’enrichir tant sur le plan
professionnel que personnel.
D’autre part, je souhaite faire part de ma
reconnaissance à Monsieur Gilbert Farges et toute l’équipe
d’intervenants du Master 2 QPO de l’UTC de Compiègne pour leurs
enseignements d’une grande richesse culturelle et
professionnelle.
SIGLES
GLOSSAIRE
TABLE
DES FIGURES
INTRODUCTION
CONTEXTE
- Le groupe Sanofi [5] [6]
- Les unités de production du site de Compiègne
- Formation : exigences
- Parcours de formation d’un opérateur de
production
PROBLEMATIQUE
ENJEUX
METHODOLOGIE
: ELABORATION DES QUESTIONNAIRES
- Méthodologie
- Recueil des données
- Approche terrain
- Elaboration des questionnaires
RESULTATS
- Présentation des questionnaires au personnel AQP et aux
responsables de production
- Tests auprès des opérateurs
- Déploiement
CONCLUSION
BIBLIOGRAPHIE
ANNEXES
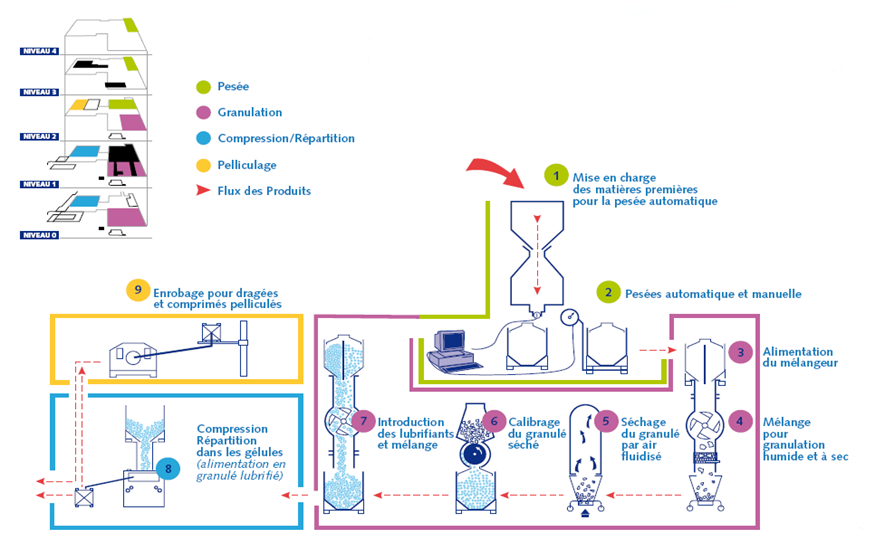
- Annexe 1 : UPM – Schéma d’un processus de
fabrication
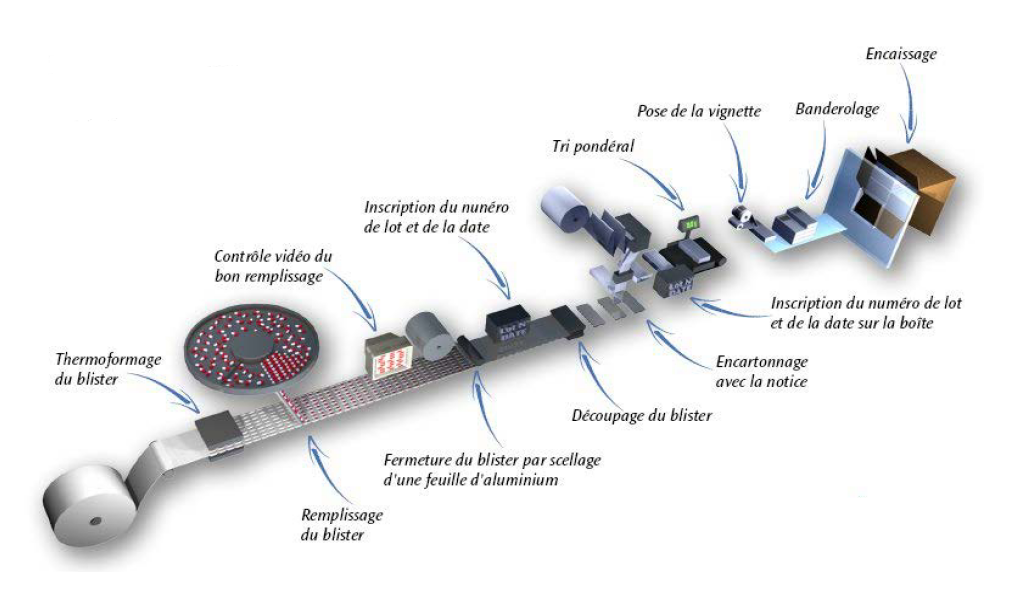
- Annexe 2 : UPP – Schéma d’un processus de conditionnement
blister [11]
SIGLES
• AMM : Autorisation de Mise sur le Marché
• ANSM : Agence Nationale de
Sécurité du Médicament et des produits de santé
• AQP : Assurance Qualité Produits
• AQS : Assurance Qualité Systèmes
• BPF : Bonnes Pratiques de
Fabrication
• cGMP : current
Good Manufacturing Practices
• FDA
: Food and Drug Administration
• IPC : In
Process Control
• OJT : On
Job Training
• PDS : Planification
Dynamique Stratégique
• QPO : Qualité et
Performance dans les Organisations
• SWOT :
Strenghts (forces)
Weaknesses (faiblesses)
Opportunities (opportunités)
Threats
(menaces)
• UPC : Unit
Production Cephalosporines
• UPM : Unit
Production Manufacturing
• UPP : Unit Production Packaging
retour sommaire
• Assurance
Qualité : somme totale des mesures d'organisation
prises afin de garantir que les médicaments sont de la qualité
requise pour l'usage auquel ils sont destinés.
• Autorisation de Mise
sur le Marché : l’Autorisation de Mise sur le
Marché (AMM) constitue un préalable obligatoire à toute
possibilité de commercialisation d’une spécialité pharmaceutique.
Elle est également indispensable avant la demande d’inscription au
remboursement par l’assurance maladie. En France, l'AMM est
délivrée par l’Agence Nationale de Sécurité du Médicament et des
produits de santé (ANSM).
• Bonnes Pratiques de Fabrication : élément d'assurance de la qualité qui garantit que les médicaments
sont fabriqués et contrôlés de façon cohérente selon les normes de
qualité adaptées à leur emploi.
• Qualité du médicament
: dans chaque dose, les bons produits et les
bonnes quantités garantissent l’efficacité du médicament. Aucun
élément étranger ne le contamine. Le médicament ne doit pas
entraîner de risques pour le patient dont l’organisme est
fragilisé. Il parvient chez le patient avec toutes les
informations nécessaires à son utilisation et maintenu en parfait
état de conservation.
retour sommaire
Figure 1 : SANOFI - activités
principales
Figure 2 : SANOFI Monde – chiffres clés
2014
Figure 3 : SANOFI France – chiffres clés 2014
Figure 4 : SANOFI Compiègne – plan du
site
Figure 5 : Parcours de formation qualité –
opérateur de production
Figure 6 : Problématique – Planification
Dynamique Stratégique
Figure 7 : Enjeux – SWOT
Figure 8 : Métholologie
Figure 9 : Bilan 2015 – % de déviations par
secteur
Figure 10 : Bilan 2015 – % de déviations origine
main d’œuvre par secteur
retour sommaire
Depuis 20 ans, je travaille dans l’industrie
pharmaceutique au sein du site Sanofi de Compiègne (Oise). Issue
d’un BTS de chimie, j’ai passé 19 années en tant qu’analyste
dans les laboratoires de contrôle qualité. Motivée depuis de
nombreuses années par les métiers de l’assurance qualité, des
missions telles que la formation des nouveaux arrivants au
laboratoire, l’organisation d’audits ou encore la gestion
documentaire m’ont été confiées, en plus de mes missions
d’analyste.
Souhaitant aujourd’hui développer mes compétences dans ce
domaine, j’ai intégré le master 2 QPO de l’UTC de Compiègne en
formation continue ; ceci dans le but d’obtenir par la suite un
poste correspondant à mes attentes et ainsi quitter ma fonction
d’analyste.
J’ai choisi d’effectuer ce stage au sein du service Assurance
Qualité Produits (AQP). Cela m’a permis d’approcher les secteurs
de la production que je ne connaissais pas et d’acquérir de
nouvelles connaissances, afin de diversifier mon expérience
professionnelle.
La qualité des
médicaments fabriqués est un enjeu majeur pour la
sécurité des patients.
Afin de garantir cette qualité, les établissements
pharmaceutiques sont soumis à une législation très stricte.
Ainsi, le site de Compiègne, comme tout établissement
pharmaceutique installé dans un pays membre de l’Union
Européenne, doit respecter scrupuleusement les exigences
réglementaires en vigueur concernant la fabrication et le
contrôle des médicaments.
La Commission européenne, via la directive 2003/94/CE [1], a
établit les principes et les lignes directrices des Bonnes
Pratiques de Fabrication (BPF) [2] pour les médicaments à usage
humain. Depuis de nombreuses années,
la fabrication des médicaments se
déroule conformément à ces lignes directrices
et n’est pas régie par les
normes CEN/ISO.
Le guide des BPF est composé de chapitres tels que : personnel,
locaux et matériel, documentation, production, ou encore
contrôle de la qualité.
En France, l’autorité compétente chargée de faire respecter les
BPF, de mener les inspections sur les sites de production, et de
délivrer les autorisations de mise sur le marché est l’ANSM [3].
De plus, le site de Compiègne produisant des médicaments
destinés au marché américain, il doit se soumettre à la
législation des current Good Manufacturing Practices (cGMP).
L’autorité compétente est ici la FDA [4].
Les exigences en termes de formation du personnel sont issues
des BPF et déclinées dans des référentiels internes sur le site
de Compiègne.
Le parcours de formation des opérateurs en fabrication est régi
par de nombreux supports et déjà très complet. De nombreux
éléments étant à assimiler dans les semaines suivant l’arrivée,
il est judicieux, quelques temps après avoir suivi ce parcours
de formation, d’évaluer ce qui a été retenu.
Pour cette raison, la création de questionnaires d’évaluation
des formations Qualité permettra de cibler les points essentiels
à retenir et, par la suite, de faire des rappels sur ce qui n’a
pas été assimilé.
Le présent mémoire sera structuré de la façon suivante : après
une présentation de l’entreprise et des unités de production, la
problématique sera explicitée ainsi que les enjeux qui en
découlent. La méthodologie d’élaboration des questionnaires sera
ensuite détaillée étape par étape jusqu’à leur déploiement
final.
Le groupe Sanofi [5] [6]
Dans le monde
Sanofi est un leader mondial de la santé
centré sur les besoins des patients, engagé dans la recherche,
le développement, la fabrication et la commercialisation de
produits de santé, avec une o¬ffre diversifiée de médicaments,
de vaccins et de solutions thérapeutiques innovantes.
o Mission : Œuvrer pour protéger la
santé, améliorer la qualité de vie et répondre aux espoirs et aux
besoins potentiels des 7 milliards de personnes vivant dans le
monde.
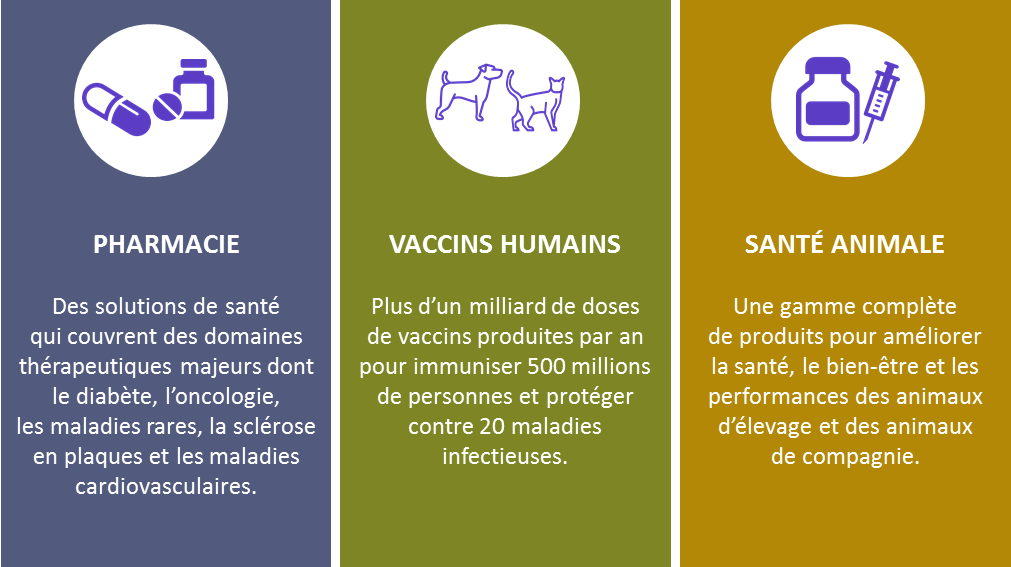
o Trois activités principales :
Figure 1 : SANOFI - activités principales
[5]
o Réseau industriel :
Le réseau industriel est un pilier essentiel
du développement de Sanofi. Il accompagne sa stratégie de
croissance mondiale et ses choix sont en adéquation avec la
mission du Groupe “être centré sur les besoins des patients”.
Ainsi, la maîtrise de la chaîne de fabrication et de
distribution permet de garantir aux patients la qualité et la
sécurité des médicaments.
o Responsabilités sociétales de l’entreprise
:
- Améliorer l’accès aux médicaments
- Réduire les inégalités en matière de santé
- Promouvoir des soins de qualité en luttant
contre les médicaments contrefaits
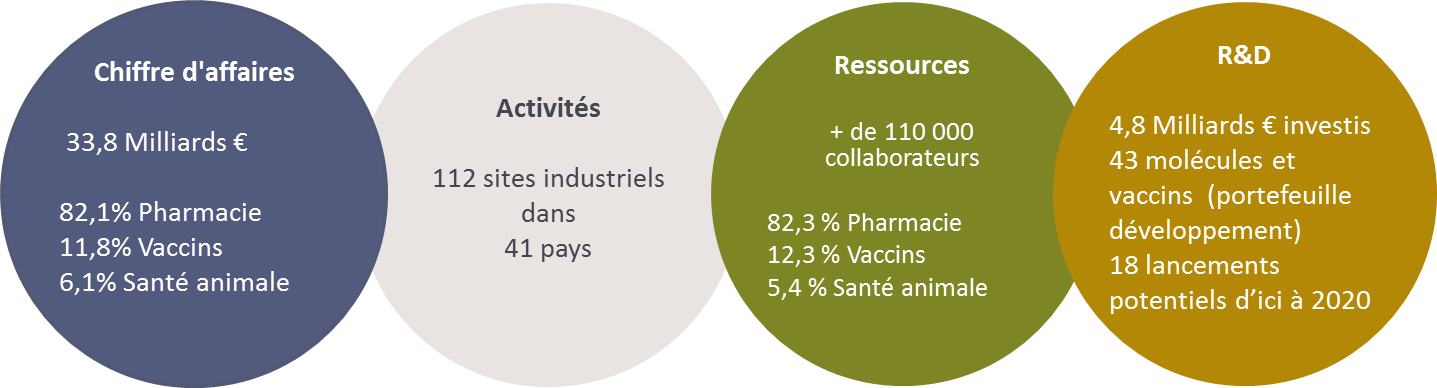
o Chiffres clés 2014 :
En France
Sanofi développe en France un savoir-faire dans les
domaines de la santé humaine (les vaccins, les traitements pour le
diabète, le cancer, la douleur, la sclérose en plaques ou les
maladies rares), des services de santé et de la santé animale
ainsi qu’une expertise sur l’ensemble de la chaîne du médicament.
L’outil de production s’appuie sur une politique
industrielle dont la stratégie vise à maitriser l’intégralité de
la chaîne de production des médicaments et des vaccins, de la
production de principes actifs à la mise en forme galénique,
jusqu’à la distribution, pour en garantir les plus hauts
standards de qualité.
Sanofi produit en France pour la France et pour le
monde entier. Avec Sanofi Pasteur, la France propose la plus
grande capacité de production de vaccins au monde.
Le siège mondial des activités industrielles est basé
en France.
Figure 3 : SANOFI France – chiffres clés 2014
[6]
retour sommaire
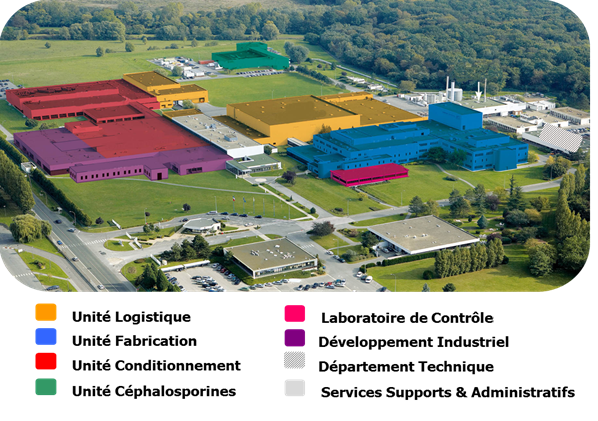
Sur le site de production de
Compiègne
Inauguré en 1966, le site de production de Compiègne fabrique des
médicaments à destination des marchés français (40% de la
production) et étrangers (dont l’Europe, les Etats-Unis, la Russie
et le Japon).
Le site est spécialisé dans la fabrication de médicaments sous
formes solides orales (comprimés, gélules et poudres) et dans leur
conditionnement (blisters, flacons, sachets).
Il possède un atelier dédié à la fabrication de céphalosporines
(classe spécifique d’antibiotiques).
Le site héberge le centre mondial de l’Académie LEAN et un centre
de développement industriel, consacré à l’innovation et au
développement de plusieurs gammes de produits du groupe.
Il emploie 489 personnes, fabrique plus de 4 milliards de
comprimés et de gélules et conditionne 160 millions de boîtes pour
le monde entier.
Les unités de production
du site de Compiègne
Plan du site
Figure 4 : SANOFI Compiègne – plan du site
[6]
retour sommaire
Les unités de production
Le site de Compiègne est organisé en 3
unités de production. Au niveau de chaque unité, les
différentes opérations pharmaceutiques sont effectuées dans des
locaux confinés appelés boxes de production.
L’unité de fabrication UPM :
C’est l’atelier de fabrication des comprimés et des gélules.
C’est le principal atelier du site de Compiègne. On compte 3
secteurs : la pesée/pelliculage, la granulation et la
compression/répartition.
• La pesée : sont pesés le principe actif
ayant un effet direct sur la guérison (exemple : paracétamol) et
les excipients, substances inactives d’un point de vue
thérapeutique mais facilitant l’administration du principe actif
ou encore assurant la stabilité et la conservation du
médicament.
• La granulation : opération au cours de
laquelle de petites particules s’associent entre elles pour
former des agglomérats solides.
• La compression : les comprimés sont des
préparations solides contenant une unité de prise d’une ou de
plusieurs substances actives. Ils sont obtenus en agglomérant
par compression un volume constant de particules.
• La répartition : c’est l’action de répartir
les agglomérats solides issus de la granulation dans des
gélules.
• Le pelliculage : il permet de masquer une
saveur ou une odeur ou encore de protéger les comprimés des
agressions extérieures.
Le schéma d’un processus de fabrication est présenté en annexe
1.
L’unité de conditionnement UPP :
Sa fonction est de répartir les médicaments provenant de l’UPM
dans leurs conditionnements primaires, secondaires et
tertiaires, permettant ainsi de les protéger et les conserver.
• Conditionnement primaire : il protège le
produit et est en contact direct avec lui (blister, flacon,
bouchon, sachet…).
• Conditionnement secondaire : il n’est pas
encontact direct avec le produit mais il contribue à son
identification (étui, étiquette, notice…).
• Conditionnement tertiaire : il permet le
regroupement des étuis pour l’expédition.
Tous les éléments utilisés lors du conditionnement d’un
médicament sont appelés articles de conditionnement.
Le schéma d’un processus de conditionnement blister est présenté
en annexe 2.
L’unité de production des céphalosporines UPC :
Cette unité de production est exclusivement dédiée à la
fabrication et au conditionnement d’antibiotiques oraux
appartenant à la famille des céphalosporines (Bétalactamines) et
est séparée physiquement du reste du site, en raison du risque
allergène que représente cette classe thérapeutique. Les
médicaments produits à l’UPC se présentent sous deux formes :
des comprimés conditionnés en blisters et des granulés pour
suspension buvable conditionnés en flacon de verre.
retour sommaire
Formation :
exigences
Exigences des référentiels réglementaires
• Les Bonnes Pratiques de Fabrication :
Le chapitre 2 des BPF traite de la formation
du personnel.
Le personnel amené à travailler dans les zones de production
doit être formé à son arrivée sur les aspects théoriques et
pratiques du concept d’assurance de la qualité et des bonnes
pratiques de fabrication. L’efficacité des formations doit être
vérifiée.
Des formations métier ciblées sur les tâches quotidiennes
doivent également être dispensées.
La formation continue doit être assurée et évaluée
périodiquement.
• Les current Good Manufacturing Practices
[7] :
Les cGMP reprennent les mêmes exigences que les Bonnes Pratiques
de Fabrication européennes. Elles précisent en plus que la
formation doit être dispensée par des personnes habilitées.
Exigences des référentiels
internes [8]
La politique de formation du site de Compiègne découle directement
des exigences des référentiels BPF et cGMP. Il en résulte la mise
en place d’un processus de formation qui doit permettre à chaque
membre du personnel de suivre des modules BPF et d’acquérir la
maîtrise des compétences requises dans les différents postes de
travail.
Les actions de formation sont mises en place selon les besoins de
chaque salarié et sont réévaluées en fonction de l’évolution des
besoins (ex : changement de poste).
Les formations BPF sont régulièrement programmées de façon à
maintenir un niveau suffisant de connaissances. Tous les ans,
chaque salarié réalisant des opérations pharmaceutiques doit
suivre une formation BPF.
Chaque formation fait l’objet d’un test d’évaluation et/ou d’une
vérification des connaissances au poste de travail.
Parcours de formation d’un
opérateur de production
Modules qualité
Figure 5 : Parcours de formation qualité –
opérateur de production
[12]
• Formation d’accueil BPF :
Tout nouvel arrivant reçoit une formation générale aux Bonnes
Pratiques de Fabrication. Les grandes lignes des BPF appliquées
sur site de Compiègne sont détaillées :
- Environnement du médicament
- Règles d’hygiène et d’habillage
- Comportements à avoir dans les locaux
- Risques majeurs et moyens de prévention
- Documentation et règles de remplissage
- Comportement en cas d’anomalie
- Assurance de la qualité
• Formation BPF secteur concerné :
Ce module d’accueil spécifique à l’unité de production vient en
complément de la formation BPF générale. Il est décliné pour
chacune des unités de production (UPM/UPP/UPC). Ce module a été
mis en place pour que chaque nouvel arrivant soit dès le départ et
le plus rapidement possible sensibilisé au respect des règles BPF
sur le terrain. Il permet d’expliquer les règles liées à la
production, les procédures générales et l’organisation des unités.
Il permet aussi de s’assurer que les informations sont transmises
de manière uniforme et complète. Cette formation se fait au moyen
d’un livret d’accueil qui est présenté par un responsable de
production au nouvel arrivant.
• Formations spécifiques à un sujet donné :
Les formations spécifiques à un sujet donné concernent certaines
étapes critiques de la production, comme la façon de réaliser des
prélèvements, par exemple. Il y a des points communs mais
également des différences entre chaque unité de production.
• Prise de connaissance des documents qualité
:
Pendant sa période de formation, le nouvel arrivant doit prendre
connaissance des documents qualité applicables à son poste. Par
exemple, à l’UPM, cela représente une centaine de documents.
Le système documentaire Qualité est constitué de procédures
générales dites organisationnelles communes aux différentes unités
de production (ex : gestion des déviations) et de modes
opératoires spécifiques à l’unité et/ou au secteur concerné (ex :
utilisation d’un équipement).
• Formations annuelles BPF :
Ces formations permettent de développer continuellement les
compétences de chacun. Elles peuvent être des formations BPF sur
un thème précis, des formations métiers, techniques et diverses.
Chaque unité de production détermine le thème en fonction des
problématiques rencontrées au cours de l’année et des récurrences
des déviations.
• On Job Training [9] :
Un OJT est dispensé pour :
- un rappel individuel des personnes impliquées
dans une déviation
- une formation au poste de travail
- une information ou sensibilisation d’un groupe
de personnes
Les OJT ne sont pas intégrés dans le plan de formation et ne sont
pas gérés selon les modalités définies dans la procédure générale
de formation.
Les formations sont évaluées par l’intermédiaire de QCM avec score
minimal à atteindre.
retour sommaire
Formations spécifiques au
secteur/au poste de travail [10]
La formation au poste de travail consiste en
une période d’observation, de travail en double d’une durée
variable sous le contrôle d’un opérateur habilité et de prise de
connaissance des documents qualité liés au poste, jusqu’à
l’obtention d’une habilitation permettant au nouvel arrivant de
travailler seul.
L’évaluation au poste de travail est formalisée par le biais de
grilles d’évaluation et surtout axée sur les aspects pratiques
du métier, notamment en ce qui concerne l’utilisation des
équipements et les tâches du quotidien.
Une habilitation est valable 3 ans. Passé 3 ans, le responsable
pourra reconduire cette habilitation sur la base d’une
réévaluation au moyen des grilles d’évaluation.
retour sommaire
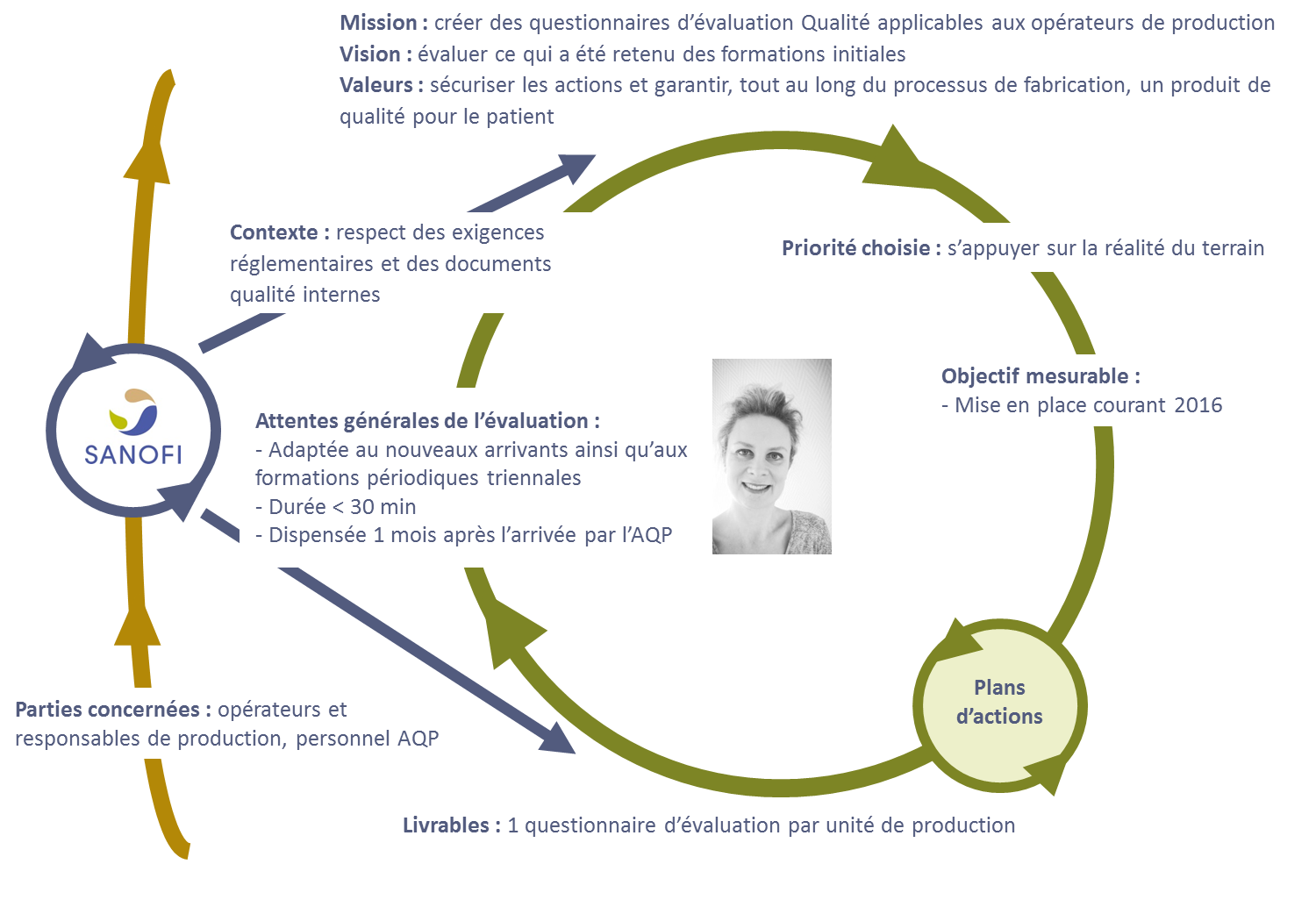
Afin de clarifier la problématique, une Planification
Dynamique Stratégique a été établie.
Figure 6 : Problématique – Planification
Dynamique Stratégique
[12]
La création de questionnaires d’évaluation qualité
permettra de s’assurer que les points essentiels abordés lors des
formations initiales ont été retenus, et, le cas échéant, de faire
des rappels sur ce qui n’a pas été assimilé.
Pour cette raison, cette évaluation se fera quelques semaines
après l’arrivée de l’opérateur et une fois que la majorité des
formations initiales aura été dispensée.
Le but de cette évaluation est également de sensibiliser les
opérateurs sur le pourquoi de leurs tâches et les impacts que
peuvent avoir leurs actions sur la qualité du produit fabriqué.
Les métiers étant différents entre les 3 unités de production, 3
questionnaires seront établis.
Ils seront dispensés par un membre de l’Assurance Qualité
Produits. L’AQP s’assure que toutes les opérations liées aux
produits sont réalisées conformément aux documents qui régissent
la fabrication. Les équipes AQP assurent la revue des dossiers de
lot en vue de la libération des produits, la gestion des
déviations dans les unités de fabrication, la mise en place des
actions associées, ou encore les autres activités d’amélioration
continue de la qualité.
De ce fait, c’est le service le plus adapté pour évaluer les
connaissances des opérateurs en qualité.
Une fois les questionnaires établis, il pourront également servir
de rappel qualité lors de formations périodiques triennales, qui
sont déjà mises en place pour les formations au poste de travail
(voir paragraphe 6.4.2).
Afin d’orienter la méthodologie à déployer, une matrice
SWOT a été établie. Elle permet de prendre en compte l'ensemble
des facteurs identifiés de manière à maximiser les potentiels des
forces et des opportunités et à minimiser les effets des
faiblesses et des menaces.
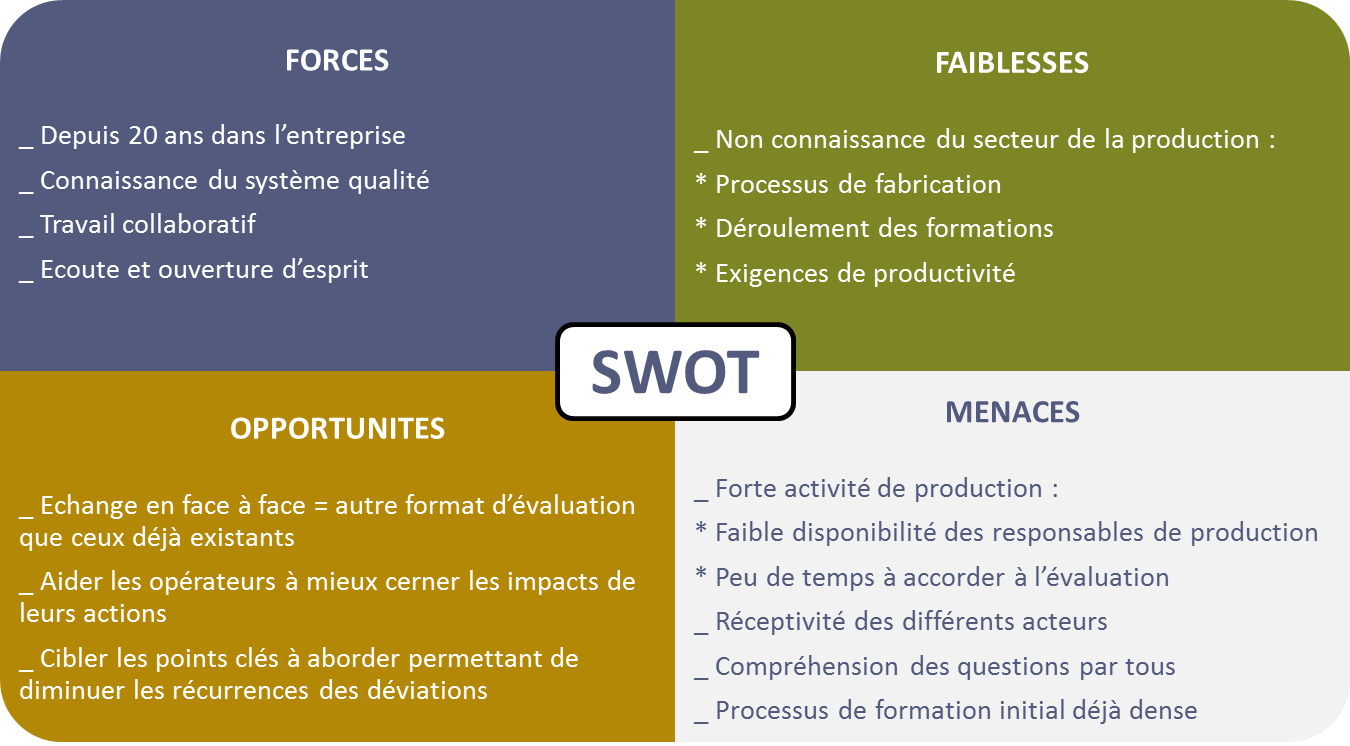
Figure 7 : Enjeux – SWOT
[12]
Le SWOT a mis en évidence une menace majeure qui est la
disponibilité des parties prenantes. En effet, on est sur le
terrain et donc confronté aux contraintes de la production. Il
faut tenir compte du planning, de la possibilité de mobiliser à la
fois des opérateurs, des responsables de production et le
personnel AQP.
Concernant les opportunités, le nouveau format d’évaluation, qui
est l’échange en face à face avec un technicien de l’AQP, va
permettre d’instaurer une relation de proximité avec l’opérateur
et l’aider à mieux comprendre le pourquoi des tâches qui lui sont
confiées. Cela renforcera les liens entre le personnel de la
production et les équipes d’assurance qualité.
L’enjeu majeur de ces questionnaires est de diminuer les
récurrences des déviations d’origine main d’œuvre, et ainsi
d’augmenter la qualité des produits et l’efficience de la
production.
METHODOLOGIE
: ELABORATION DES QUESTIONNAIRES
Méthodologie
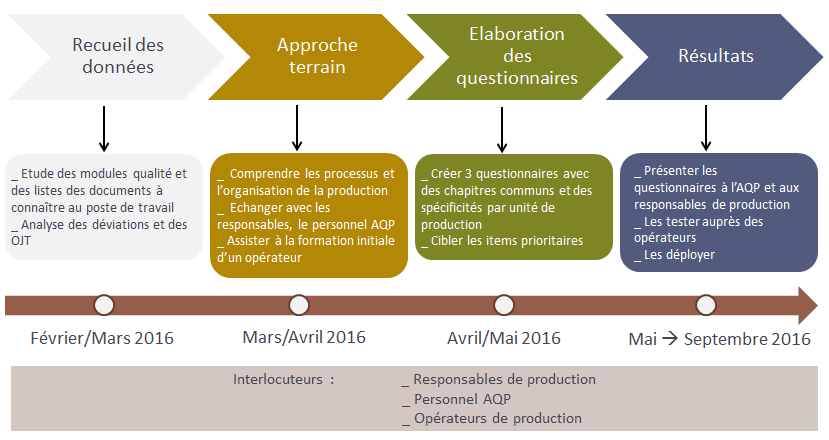
Figure 8 : Métholologie
[12]
Recueil des données
Modules et documents qualité à
connaître au poste de travail
• Modules qualité : formation d’accueil
BPF, formation BPF secteur concerné, formation spécifique à un
sujet donné, formations annuelles BPF
Avant de construire les questionnaires, l’état des lieux des
modules qualité dont disposent les unités de production a été
effectué ; ceci dans le but d’apprécier la nature des formations
dont bénéficient déjà les opérateurs. Cela permettra de leur
apporter des éléments/explications complémentaires.
En reprenant l’ensemble du parcours de formation et en axant
l’état des lieux sur les formations qualité uniquement, les points
principaux et récurrents abordés ont été identifiés :
- Comment réagir en cas d’anomalie ?
- Nettoyage des équipements et des locaux
- Etiquetage
- Mentions mobiles
- Prélèvements et contrôles en cours de production
- Risques majeurs et moyens de prévention
- Bonnes pratiques documentaires
- Erreur humaine
- Vide de ligne
- Conditions environnementales
- Comportement
• Documents qualité à connaître au poste de
travail :
L’étude des documents qualité à connaître au poste de travail a
permis de comprendre et de regrouper par thèmes les activités
quotidiennes des opérateurs. En dehors des modes opératoires
métiers d’utilisation des équipements, on retrouve les points
principaux énoncés dans le paragraphe précédent.
Analyse des déviations et des
OJT
• Analyse des déviations :
Une déviation est un écart par rapport aux référentiels
documentaires (BPF, cGMP…) et aux référentiels internes
(procédures, modes opératoires…) applicables sur le site. Il
s’agit de tout évènement imprévu pouvant présenter un lien avec
une opération pharmaceutique.
Chaque déviation émise va conduire à une enquête dont le but est
d’en déterminer les causes afin de prévenir les récurrences.
Les déviations sont classées selon les 5M (Méthode, Milieu, Main
d’œuvre, Matériel, Matière).
L’étude des déviations a été effectuée sur les années 2014 et
2015. Les déviations étudiées sont celles ayant une origine main
d’œuvre, ce qui permettra de sensibiliser les opérateurs lors du
déploiement du questionnaire en face à face.
Ci-après sont présentés les chiffres de l’année 2015. Ceux de
l’année 2014 sont semblables.
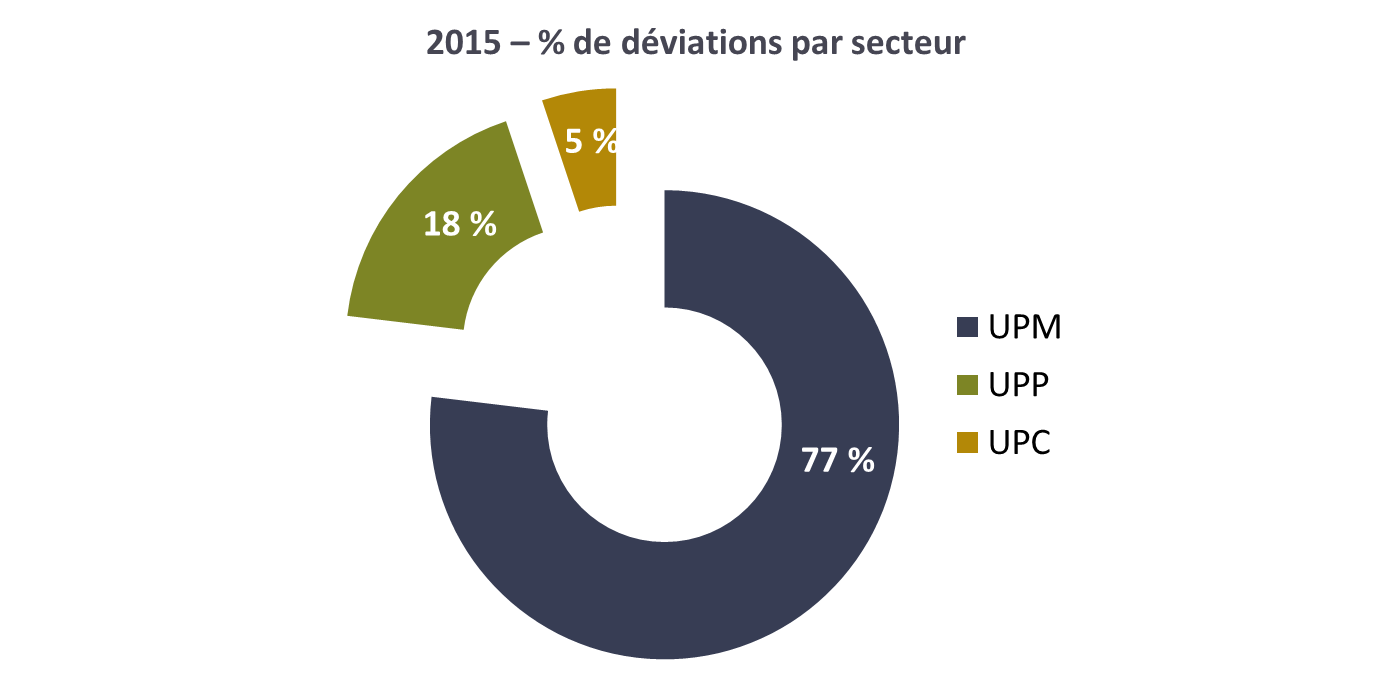
Figure 9 : Bilan 2015 – % de déviations par secteur [12]
Figure 10 : Bilan 2015 – % de déviations
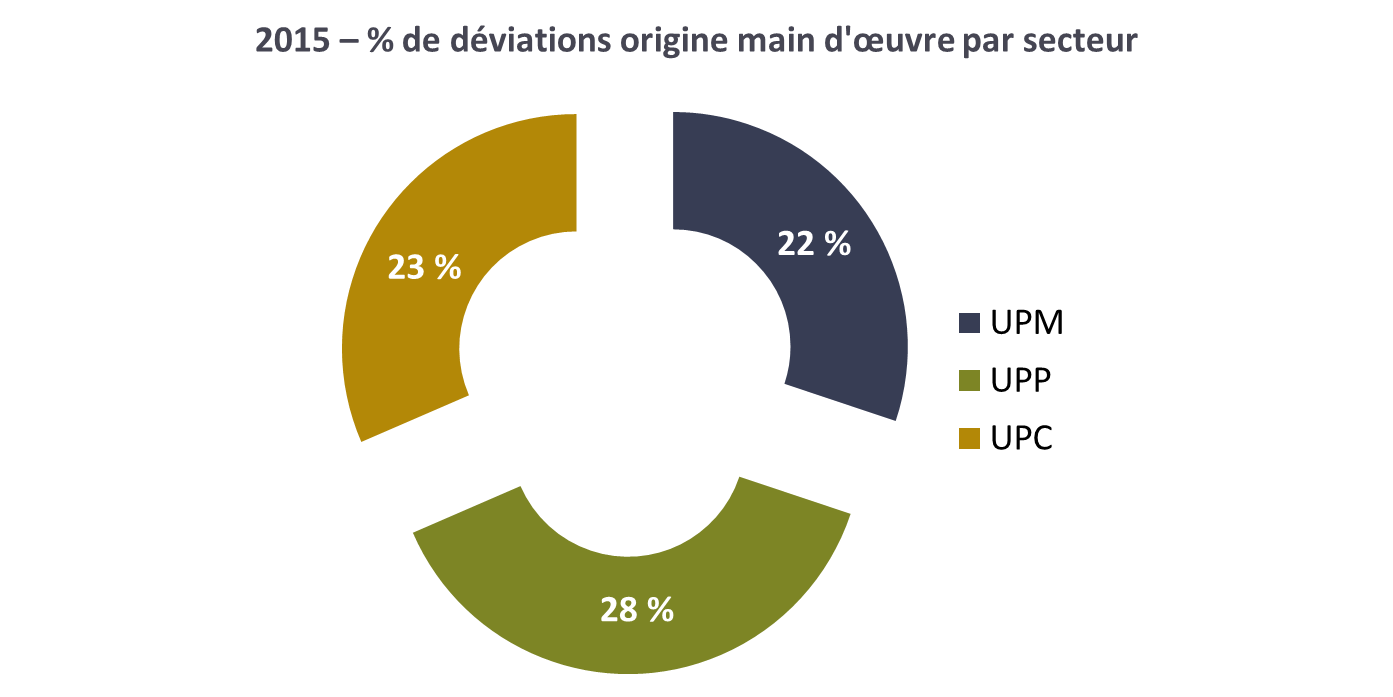
origine main d’œuvre par secteur
[12]
La proportion des déviations d’origine main d’œuvre est
en moyenne de 25 %, toutes unités de production confondues. Cela
confirme l’utilité de la mise en place des questionnaires pour
sensibiliser le personnel et, par la suite, faire baisser ces
pourcentages.
L’analyse des déviations d’origine main d’œuvre permet de faire
ressortir les récurrences suivantes :
UPM : Documentation
non respectée
UPP : Documentation
non respectée
Mauvais réglages
Erreurs de mentions mobiles
UPC : Documentation
non respectée
• Analyse des OJT :
Les OJT de type « rappel individuel des personnes impliquées dans
une déviation » ont été étudiés.
Cela a permis de recenser les erreurs types effectuées par les
opérateurs afin de définir des questions précises à mettre dans
les questionnaires.
Approche terrain
Il s’agit de prendre connaissance des activités des différentes
unités de production en allant sur le terrain et en assistant à
certaines opérations pharmaceutiques ; ceci afin de comprendre les
processus de fabrication et de conditionnement et ainsi de
minimiser les faiblesses identifiées dans le SWOT (non
connaissance du secteur de la production). Cette étape a été
facilitée par le recueil préalable des données qui a déjà révélé
les grandes lignes des opérations et des défaillances pouvant leur
être liées.
Cette approche terrain s’est déroulée en 3 étapes :
1. Comprendre globalement le fonctionnement des
équipements, des locaux et l’organisation du personnel.
2. Dialoguer avec le personnel de l’AQP et les
responsables de production pour leur présenter le concept des
questionnaires et recueillir leurs avis ; poser des questions
cibles :
- Que pensez-vous du choix du questionnaire dispensé par
l’AQP en face à face ?
- Quels sont les messages importants à faire passer aux
opérateurs ?
- Quelles sont les erreurs humaines récurrentes que vous
constatez ?
- Quelles sont les opérations pharmaceutiques qui posent le
plus de problèmes aux opérateurs ?
3. Assister à la formation intiale d’un
opérateur, notamment la formation BPF secteur. La formation est
dispensée par un responsable de production. Des points importants
et complexes sur lesquels il faudra revenir dans les
questionnaires ont été identifiés, comme, par exemple, le
traitement des anomalies.
Cette présence sur le terrain a permis d’établir une liste d’items
sur lesquels il faudra insister lors du déploiement des
questionnaires et ainsi de définir une grande partie de leur
contenu. Globalement, ce format d’évaluation a été bien perçu,
d’autant qu’il s’agit là d’un outil supplémentaire pouvant amener
à la baisse des déviations d’origine main d’œuvre donc à un gain
de productivité permis par le gain de temps passé à traiter les
déviations.
La contrainte majeure est qu’il ne faut pas que l’échange prenne
trop de temps, à la vue des objectifs de productivité.
Elaboration des
questionnaires
Pour élaborer les questionnaires, il restait à faire la synthèse
des informations terrain recueillies, couplée à celle de l’étude
préalable des divers documents (modules de formations, déviations,
OJT…) pour identifier les opérations critiques et les risques
ayant un impact direct sur la qualité des produits et qu’il faut
maîtriser. Ce travail collaboratif avec les futurs utilisateurs
des questionnaires, c'est-à-dire les responsables de production et
les membres de l’AQP, permet de mieux adapter les questions à la
réalité du terrain. Par ailleurs, la formulation des questions
doit être claire et sans ambiguïté pour l’ensemble des
participants. Pour certains chapitres, certaines informations
seront données par la personne réalisant l’évaluation afin de
rendre les réponses à certaines questions plus aisées.
Ci-après sont exposés les chapitres retenus.
Chapitres communs aux 3 UP
• Ecarts/Anomalies
De nombreuses anomalies peuvent survenir en cours de production.
Il est indispensable de réagir rapidement et efficacement. Cela
permet de limiter les dérives et les conséquences sur la qualité
des produits. Pour cela, le processus de traitement des anomalies
doit être parfaitement maîtrisé.
• Double-Check
Les opérations estimées critiques pour le produit lors du
processus de production (impact sur la qualité du produit) doivent
être vérifiées visuellement par une deuxième personne afin de
s’assurer que l’opération soit conforme. Cette vérification se
doit d’être méthodique et rigoureuse.
• Documentation
Le respect des documents qualité est fondamental. Cela permet de
garantir que les opérations sont organisées et réalisées toujours
de la même façon, d’un individu à un autre et d’un moment à un
autre. Ceci est rappelé ici pour toutes les UP car la récurrence
commune en termes d’erreurs main d’œuvre dans les déviations est
le non respect de la documentation. Il est également important de
respecter les règles des bonnes pratiques documentaires (BPD) qui
visent à expliquer comment remplir correctement les documents (ex
: remplir immédiatement les documents après avoir réalisé une
action, ne pas détruire de données primaires...).
• In Process Control (IPC)
Les IPC sont des contrôles en cours permettant de suivre la
qualité du produit tout au long des étapes de production et de
garantir la conformité aux spécifications déposées/validées. Il
est donc important de respecter les fréquences des IPC et de
savoir comment réagir en cas de non-conformité.
• Etiquetage
Une étiquette est une « carte d’identité » qui accompagne en
permanence une matière, un matériel ou un local. Les opérateurs
ont une responsabilité importante dans la vérification de
l’étiquetage.
Une erreur d’étiquetage peut avoir de graves conséquences. En
effet, si une étiquette indique que le matériel est propre alors
qu’il ne l’est pas, il y a des risques que ce même matériel
contamine le produit suivant par des particules du produit
précédent. Plus grave, une étiquette produit se trouvant sur une
cuve alors que celle-ci contient un autre produit conduit
forcément à un mélange.
Les produits doivent donc être étiquetés au fur et à mesure et ne
jamais être utlisés sans avoir vérifié leur étiquette.
• Nettoyage
Il faut rappeler aux opérateurs que, dans l’industrie
pharmaceutique, bien nettoyer est aussi important que bien
produire. Le nettoyage est le principal moyen pour éviter les
contaminations.
Il est important de rappeler certaines règles comme la protection
et l’identification du matériel nettoyé. Par ailleurs, l’opérateur
devra vérifier visuellement la propreté d’un matériel avant de
l’utiliser.
• Maîtrise des conditions environnementales
La maîtrise de l’environnement est indispensable pour éviter tout
type de contamination. Pour cela, le contrôle des pressions est
permanent. Les boxes de production sont en dépression par rapport
aux couloirs, ce qui empêche l’entrée/la sortie de poussières des
boxes. Les couloirs sont propres et doivent le rester. La
surveillance des pressions est assurée par un système de
monitoring qui les enregistre et les affiche en temps réel. Ce
système possède également des alarmes qui se déclenchent en cas de
non-conformité. La conduite à tenir en cas d’anomalie doit être
rappelée. Les valeurs de température et l’humidité sont aussi
contrôlées pour certains produits sensibles tels que les comprimés
effervescents.
• Sécurités pharmaceutiques
Les sécurités pharmaceutiques résident en un ensemble de tests
permettant de s’assurer que les équipements sont fonctionnels et
que les non-conformités sont bien détectées.
Avant de commencer la production, il est impératif de s’assurer du
bon fonctionnement du matériel et de la fiabilité des systèmes
automatiques de contrôle : il s’agit d’avoir confiance dans les
équipements.
• Comportement
En conclusion, plusieurs règles de comportement sont rappelées aux
opérateurs car c’est la base de leur métier. Le comportement doit
être exemplaire et pour cela, il est primordial, par exemple, de
conserver un esprit critique, de ne pas travailler de mémoire, de
travailler avec méthode et rigueur…
Chapitre spécifique à l’UPM
• Contamination par un corps étranger
Un corps étranger est un élément non pharmaceutique se retrouvant
dans le produit. Les principaux corps étrangers risquant d’être
retrouvés sont des liens, des joints, des morceaux de saches
plastiques, des morceaux de gants… Il faut donc sensibiliser les
opérateurs sur les précautions à prendre pour que cela n’arrive
pas.
Chapitres spécifiques à l’UPP
• Mentions mobiles
Les mentions mobiles sont des mentions imprimées sur les
conditionnements des produits (ex : date de fabrication, numéro de
lot, date de péremption…). La vérification de ces mentions doit
être rigoureuse. Par exemple, une mauvaise date de péremption peut
mettre en danger le patient.
Les chapitres ci-dessous n’ont pas été identifiés comme faisant
partie des récurrences des déviations mais le responsable de l’UPP
a choisi de les faire figurer dans le questionnaire afin de
dispenser des rappels sur les bonnes pratiques.
• Prélèvements
Il s’agit de prélever une quantité de produit permettant de
réaliser dessus des tests IPC. Ceci dans le but de surveiller les
étapes les plus critiques d'une production (ex : début ou fin d'un
procédé de fabrication) et les caractéristiques du produit. Cela
permet de garantir la qualité et l'homogénéité du lot ; pour cette
raison, le mode opératoire de réalisation des prélèvements doit
être rigoureusement suivi.
• Contamination croisée
Présence non visible à l'œil nu d'un produit étranger (ex :
pollution par des poussières pharmaceutiques). Un rappel informel
sera dispensé, notamment pour l’utilisation de matériel dédié par
produit.
• Mix-Up
C’est la présence visible d’un produit étranger. Par exemple, un
comprimé/étui de conditionnement étranger au milieu d’autres
comprimés/étuis. L’accent va être mis sur les moyens de prévention
comme, par exemple, le vide de ligne. C’est la toute première
étape après la fin de la fabrication et/ou du conditionnement d’un
produit et avant la mise en œuvre du produit suivant. Le vide de
ligne consiste à éliminer toute trace du produit précédent ; ceci
dans le but d’éviter un mix-up ou une contamination croisée avec
le produit suivant. Pour verrouiller cette opération, une
check-list de vide de ligne est utilisée. Elle contient tous les
éléments et les zones critiques à vérifier.
Chapitres spécifiques à l’UPC
Cette unité étant à la fois une unité de fabrication et de
conditionnement, il n’y a pas de chapitres spécifiques
supplémentaires à ajouter par rapport à ceux déjà détaillés
ci-dessus.
Par contre, un risque propre à la ligne de conditionnement en
flacons, la présence de morceaux de verre dans les granulés ou
encore la casse de flacons, est à rappeler. Cela représente un
risque très grave pour la sécurité des enfants, les flacons étant
destinés à une utilisation pédiatrique.
Présentation des
questionnaires au personnel AQP et aux responsables de
production
Les questionnaires sont présentés au personnel AQP et aux
responsables de production des 3 unités pour recueillir leurs
avis.
Les retours sont très positifs, le format d’échange en face à face
va permettre d’instaurer une relation de confiance entre
l’opérateur et le technicien AQP. Le but de cette communication
entre acteurs est de conduire à une meilleure compréhension des
objectifs et des contraintes de chacun. Ainsi, l’opérateur, en
cernant plus les impacts de ses actions, sera davantage
sensibilisé à l’importance de garantir un produit de qualité pour
le patient. Grâce à cela, le nombre des déviations d’origine main
d’œuvre devrait être amené à diminuer, permettant ainsi
d’augmenter la qualité des produits et l’efficience de la
production.
L’absence d’évaluation notée de type QCM permettra de réaliser cet
échange sans sentiment d’être jugé sur les réponses apportées. En
effet, seul un rappel sur les points non complètement maîtrisés
sera effectué le cas échéant.
Tests auprès des opérateurs
Les questionnaires ont été testés auprès d’un opérateur dans
chacune des unités de production.
Les objectifs des questionnaires leur ont été présentés, en
insistant sur le fait qu’il n’y a pas de réponse « figée » à
donner, qu’il s’agit juste de s’assurer de la compréhension des
questions pour qu’ils participent efficacement à l’échange et
qu’ils en tirent le maximum de connaissances.
La durée du face à face peut prendre plus de 30 minutes mais ne
dépasse pas 1 heure. Cela a été jugé acceptable par les
responsables de production.
Déploiement
Les 3 questionnaires ont été créés. Ils seront déployés
progressivement courant 2016 dans chacune des trois unités de
production. Le moment jugé le plus propice est entre 1 et 2 mois
après l’arrivée de l’opérateur.
Après quelques mois de test, la question de les utiliser pour des
formations périodiques triennales sera étudiée.
La création d’un questionnaire supplémentaire pour les opérateurs
de maintenance est à l’étude.
Comme tout processus intervenant dans un site de
production pharmaceutique, le processus de formation ne doit pas
être figé mais soumis à une démarche d’amélioration continue. Cela
impose d’avoir en permanence un esprit critique par rapport à ce
qui est déjà en place et une capacité de proposition et
d’innovation.
Le déploiement des questionnaires est un moyen d’aborder et de
mettre l’accent sur des sujets qui posent concrètement problème
sur le terrain.
La présence dans les unités de production m’a permis de comprendre
l’organisation et la mise en œuvre de différents procédés
pharmaceutiques, ce qui me sera utile dès la fin de ce stage,
étant amenée à être assistante assurance qualité au développement
industriel, secteur pluridisciplinaire dont les activités
s’étendent de la fabrication au conditionnement des spécialités
pharmaceutiques, incluant les analyses de laboratoire.
Cela m’a permis, comme je le souhaitais au départ, de diversifier
mon expérience professionnelle dans des secteurs que je ne
connaissais pas.
Les métiers de la qualité ne peuvent se faire indépendamment de la
réalité du terrain et des contraintes de productivité. La
collaboration étroite entre tous les acteurs est essentielle.
[1] « Directive 2003/94/CE de la commission du 8
octobre 2003 » - Journal officiel de l’union européenne [En
ligne]. Disponible sur «
http://ec.europa.eu/health/files/eudralex/vol-1/dir_2003_94/dir_2003_94_fr.pdf
». [Consulté le : 5-avr-2016].
[2] Bonnes Pratiques de Fabrication - Bulletin officiel No
2014/1 bis – Agence nationale de sécurité du médicament et des
produits de santé.
[3] « Plaquette de présentatation de l’ANSM du 4 septembre 2015 ».
[En ligne]. Disponible sur : « http://ansm.sante.fr/ ». [Consulté
le : 10-avr-2016].
[4] « http://www.fda.gov/ ». [Consulté le : 19-avr-2016].
[5] « http://www.Sanofi.com ». [Consulté le 4-avr-2016].
[6] « Présentation groupe et site 2016 Sanofi ». Document PDF
interne.
[7] « Current Good Manufacturing Practices (cGMP’s) : 21CFR
211/Subpart B: Organization and Personnel » [En ligne]. Disponible
sur : «
http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?CFRPart=211
». [Consulté le : 5-avr-2016].
[8] « CMP-PRG-00175 v8.0 Organisation générale de la formation du
personnel ». Document interne.
[9] « CMP-MO-00900 v5.0 Gestion des OJT (On Job Training) ».
Document interne.
[10] « CMP-MO-00981 v4.0 Formation/Evaluation au poste de travail
dans les unités de production et logistique ». Document interne.
[11] « CMP-FORMATION-00010 v2.0 Livret d’accueil BPF unité
conditionnement ». Document interne.
[12] « Questionnaire d’évaluation des formations Qualité », PITON
Cécile, Université de Technologie de Compiègne, Master Qualité et
Performance dans les Organisations (QPO), Mémoire d'Intelligence
Méthodologique du stage professionnel de fin d'études,
www.utc.fr/master-qualite , puis "Travaux" "Qualité-Management",
réf n°370, juin 2016.
Icônes fournis par Freepik sur www.flaticon.com.
Annexe 1 : UPM – Schéma
d’un processus de fabrication
Annexe 2 : UPP –
Schéma d’un processus de conditionnement blister [11]


 Téléchargez
le mémoire en format .pdf
Téléchargez
le mémoire en format .pdf