|
Master Qualité - Communication
publique des résultats d'un stage de fin d'études
Master Qualité
- UTC - rue du docteur Schweitzer - CS 60319 - 60203
COMPIEGNE Cedex - France - master-qualite@utc.fr
- Téll : +33 (0)3 44 23 44 23
|
|
|
Avertissement
: Si vous arrivez directement sur cette page,
sachez que ce travail est un rapport d'étudiants et
doit être pris comme tel. Il peut donc comporter des
imperfections ou des imprécisions que le lecteur doit
admettre et donc supporter. Il a été réalisé pendant
la période de formation et constitue avant-tout un
travail de compilation bibliographique, d'initiation
et d'analyse sur des thématiques associées aux
concepts, méthodes, outils et expériences sur les
démarches qualité dans les organisations. Nous ne
faisons aucun usage commercial et la duplication est
libre. Si, malgré nos
précautions, vous avez des raisons de contester ce
droit d'usage, merci de
nous en faire part,
nous nous efforcerons d'y apporter une réponse
rapide. L'objectif de la présentation sur le
Web est de permettre l'accès à l'information et
d'augmenter ainsi les échanges professionnels. En cas
d'usage du document, n'oubliez pas de le citer
comme source bibliographique. Bonne lecture...
|
|
PME : LES CLÉS POUR
RENDRE LE SYSTÈME DU MANAGEMENT DE LA QUALITÉ CONFORME AUX
EXIGENCES
|

Cristina
EQUISOAIN
|
Référence
bibliographique à rappeler pour tout usage :
PME : Les clés pour rendre le système du management de la qualité conforme aux exigences,
EQUISOAIN Cristina, Université de Technologie de Compiègne,
Master Qualité et Performance dans les Organisations (QPO), Mémoire d'Intelligence Méthodologique du stage
professionnel de fin d'études, juin 2016, www.utc.fr/master-qualite,
puis "Travaux", "Qualité-Managem ent",
389
|
RÉSUMÉ
Le nombre de certifications des normes du
système management qualité sont en augmentation ces
dernières années, notamment l’ISO 9001 et l’ISO 13485,
cette dernière concernant les dispositifs médicaux.
Le maintien de ces normes est un processus continu,
surveillé pour les organismes notifiés et exposé aux
changements de version. De ce fait, le renouvellement du
système management qualité est, de temps à autre,
indispensable pour s’adapter aux exigences des normes et
conserver les certifications.
Pour les PME ce processus de maintien et renouvellement
représente un grand investissement en ressources dans un
délai d’action court.
Cette démarche offre aux PME certifiées ISO 9001 et/ou ISO
13485 une méthode adapté et agile qui aborde le
renouvellement du SMQ en minimisant les ressources
nécessaires et en enrichissant les performances de
l’entreprise.
La démarche a été menée dans une PME de dispositifs
médicaux, qui a réussi, non seulement à conserver ses
certifications ISO 9001, ISO13485 et le marquage CE des
dispositifs médicaux, sinon également, à renforcer une
culture du travail partagée et à améliorer l’efficacité de
la gestion de fournisseurs et de la gestion des
compétences et formation.
Mots clés : PME, dispositifs médicaux, conformité,
ISO 9001, ISO 13485, amélioration, performance
|
ABSTRACT
The last few years, the number of quality
management system (QMS) standard certifications is
increasing, like ISO 9001 and ISO 13485, the latter
concerning medical devices.
The conservation of these standards is a continuous
process controlled by the notified bodies and exposed to
version changes. Because of that, quality management
system renewal is, every now and then, indispensable for
being adapted to standards exigencies and for keeping
certifications.
For SMEs, the conservation and renewal process represent a
high investment in resources within a short period of
action time.
This project proposes to ISO 9001 and/or ISO 13485
certified SMEs an adapted agile method which addresses QMS
renewal minimizing the required resources and improving
the enterprise performance.
This approach was carried out in a medical devices SMEs
who succeeded, not only in ISO 9001, ISO 13485 and CE
marking standards conservation but also in a shared work
culture strengthen and, training, skills and suppliers’
management efficiency improvement.
Keywords: SMEs, medical device, conformity, ISO
9001, ISO 13485, improvement, performance
|
RESUMEN
El número de certificaciones en normas de
sistemas de gestión de la calidad están en aumento estos
últimos años, como por ejemplo la ISO 9001 et la ISO
13485, esta última referida a dispositivos médicos.
Mantener estas normas es un proceso continuo, controlado
por los organismos notificados y expuesto a cambios de
versiones. Por ello, la renovación del sistema de
gestión de la calidad es, cada cierto tiempo,
indispensable para adaptarse a las exigencias de las
normas y poder conservar las certificaciones.
Para las pequeñas y medianas empresas (PYMES) este
proceso de mantenimiento y renovación del sistema
representa una
gran inversión en recursos en un breve tiempo de
acción.
Este proyecto propone a las PYMES certificadas en las
normas ISO 9001 y/o ISO 13485 un método adaptado y ágil
que engloba la renovación del sistema de gestión de la
calidad minimizando los recursos necesarios y mejorando
el rendimiento de la empresa.
El proyecto ha sido llevado a cabo en una PYME de
dispositivos médicos, que ha conseguido, no solo
conservar sus certificaciones ISO 9001, ISO 13485 y el
marcado CE de dispositivos médicos, sino también,
reforzar una cultura de trabajo cooperativa y mejorar la
eficacia de la gestión de proveedores y de la gestión de
competencias y formación.
Palabras clave: PYMES, dispositivos médicos,
conformidad, ISO 9001, ISO 13485, mejora, eficacia
|
Remerciements
Mes remerciements s'adressent dans un premier temps à ma
responsable de stage pour m’avoir accordé sa confiance, pour son
suivi, pour sa compréhension et toutes les connaissances qu’elle a
bien voulu partager avec moi au cours de ce stage.
De même, je remercie tout le personnel de l’entreprise, pour le
bon accueil qu’il m’a donné dès le début, pour toute l'aide qu’ils
m'ont apporté afin de me permettre de mieux cerner le travail à
réaliser, pour leur amabilité, et leur disponibilité tout au long
du projet.
Mes remerciements vont également à Mr Gilbert Farges et Mr Arnaud
Derathé, pour leur implication au Master QPO, leur suivi, et leur
partage de connaissances.
Je remercie aussi ma promotion du Master QPO 2016-2017 pour toute
l’aide qu’elle m’a apportée, la bonne ambiance et les bons moments
partagés avec eux.
Enfin, je tiens à remercier ma famille et mes amis pour leur
encouragement, pour la confiance qu’ils me portent et pour avoir
toujours été là.
Merci à tous !
retour sommaire
Abréviations
CA : Chiffre d’affaires
MIM : Mémoire d’Intelligence Méthodologique
ISO: International Organization for Standardization
PME : Petite ou moyenne entreprise
DM : Dispositif médical
SMQ : Système management qualité
ANSM : Agence Nationale de Sécurité du Médicament et des
produits de santé
ON : Organisme Notifié
Glossaire
Non-conformité : non satisfaction d’une
exigence.
Fournisseur : englobe fournisseurs, sous-traitants
et toute autre partie qui fournit un service à l’entreprise.
Compétences : aptitude à mettre en pratique des
connaissances et des savoir-faire pour obtenir les résultats
escomptés.
Communication transversale : forme de communication qui
favorise les échanges entre les différents acteurs de
l’entreprise, dans la perspective de partager les connaissances
et d’intégrer tous les salariés dans la prise de décision.
Introduction
Ce mémoire d’intelligence
méthodologique aborde le renouvellement du système management de
la qualité dans une petite ou moyenne entreprise pour
obtenir ou conserver la certification aux normes ISO 9001 et/ou
ISO 13485 concernant les dispositifs médicaux.
Le renouvellement du SMQ surgit lors
la détection des non-conformités dans le système. Ces
non-conformités peuvent apparaitre durant le changement de la
version des normes, ou lors des audits, entre autres.
La conservation des certifications
oblige à rendre le SMQ conforme aux exigences des normes. Pourtant
pour les PME il suppose un grand coût en termes de ressources et
économiquement.
La méthode proposée dans ce MIM est
adaptée aux caractéristiques spécifiques des PME tout en essayant
de minimiser les ressources nécessaires pour le renouvellement.
À travers cette méthode la gestion
de fournisseurs et la gestion des compétences et formations ont
été abordées.
retour sommaire
Les PME sont des entreprises avec
des caractéristiques particulières qui ont besoin d’un traitement
spécial par rapport aux grandes entreprises. La connaissance des
caractéristiques spécifiques de la PME est importante pour pouvoir
agir conformément et, par conséquent, d’une façon plus
performante.
Dû à l’insuffisance des ressources
que les PME ont habituellement, une certification suppose un grand
sacrifice à long terme. Ainsi une étude de la rentabilité et des
bénéfices de la certification doit être fait avant de décider de
mener cette démarche qualité.
Les principaux objectifs des PME
sont la pérennisation et l’augmentation du chiffre d’affaire, où
le client joue le rôle le plus important. La certification permet
d’augmenter la confiance client et d’attirer de nouveaux clients.
Une connaissance générale des normes
ISO 9001 et ISO 13485 facilite la planification de la démarche
qualité et des ressources nécessaires pour la mener à bien.
La norme ISO 13485 est spécifique aux dispositifs médicaux,
auxquels il faut faire une mention particulière car ceux-ci ont
une réglementation stricte en France.
1.1. PME :
CARACTÉRISTIQUES ET CHIFFRES CLÉS
Une PME (Petite et Moyenne Entreprise) est une
entreprise qui occupe moins de 250 personnes, et qui a un chiffre
d'affaire annuel inférieur à 50 millions d'euros [1].
1.1.1.
CARACTÉRISTIQUES DES PME
Les différents PME ont des caractéristiques
très variées mais, généralement, les objectifs des PME, sont la
pérennité, la croissance et l’autonomie. Les PME sont fortement
liées à leur environnement dont elles cherchent à maîtriser les
turbulences et les dépendances. Plus l’environnement est turbulent
et instable, plus la structure doit être flexible, et plus
celui-ci est paisible, plus la division des tâches dans
l’entreprise doit être claire.
Les résultats des choix stratégiques
dans la PME peuvent être déterminants de la vulnérabilité et la
dépendance à son environnement. Les objectifs et valeurs futurs de
l’entreprise vont dépendre de cette vulnérabilité et dépendance [2].
C’est important d’identifier les
particularités de la PME concernée pour pouvoir appliquer plus
efficacement un système management qualité adapté à ses besoins.
1.1.2. CHIFFRES
CLÉS
Les PME sont une partie fondamentale
de l’économie française.
En 2012 en France 99,8% des
entreprises sont des PME ce qui représente 3,1 millions, dont 1
000 PME sont sur les dispositifs médicaux. Aussi, le chiffre
d’affaires réalisé par les PME est de 36% (1 300 Mds €) soit un
peu plus d’un tiers du CA total des entreprises françaises [3] [4].
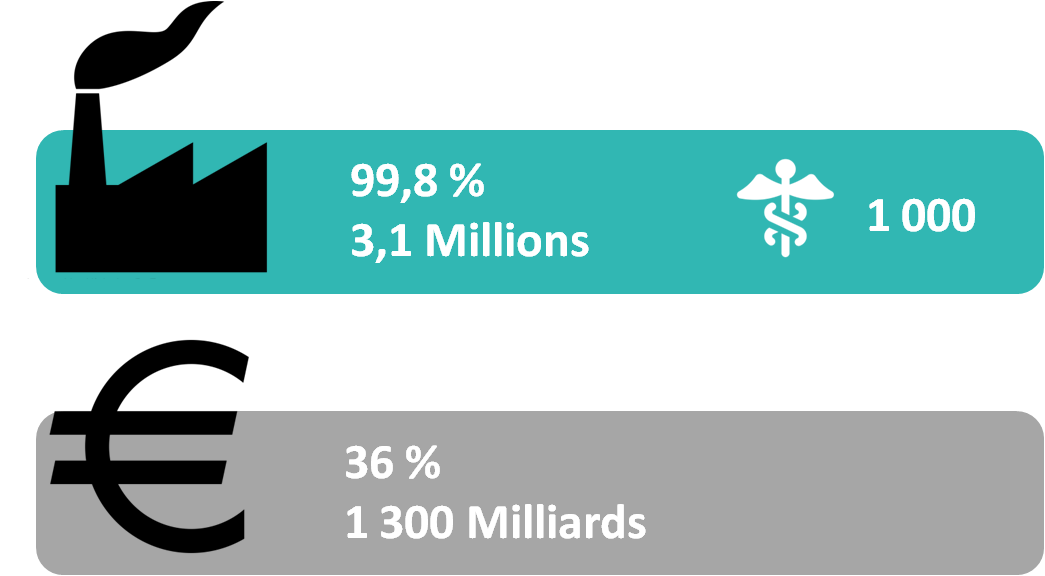
Figure 1. Nombre et chiffre d'affaires des PME en France [source :
Auteure]
retour sommaire
1.2.
L’ISO 9001 : DÉFINITION ET POINTS CLÉS
L’ISO 9001 est une norme qui établit
les exigences relatives à un système management qualité (SMQ). Le
SMQ est l’ensemble d'éléments corrélés ou en interaction d'un
organisme, utilisés pour établir des politiques, des objectifs et
des processus de façon à satisfaire des exigences [5].
La norme ISO 9001 est une des normes
le plus connues en France. Ces dernières années le nombre de
certifications de cette norme a augmenté (Figure 2). Cette
augmentation peut être liée au besoin de démarcation dans le
marché due à la forte concurrence qu’il y a de nos jours ; aux
avantages et à l’importance d’avoir un système management qualité
formalisé dans une entreprise, entre autres.
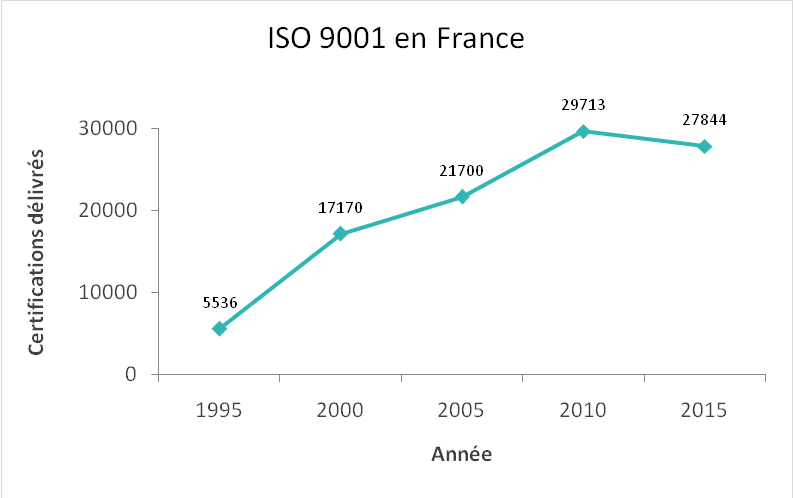
Figure 2. Évolution du nombre de certifications de la norme ISO
9001 en France [6]
1.2.1. LES
PRINCIPES DE L’ISO 9001
Cette norme est basée sur sept
principes décrits ci-dessous qui vont donner une vision globale de
la norme. L’importance de ces principes peut varier dans le temps
et entre différentes organismes [7].

Figure 3. Sept principes de la norme ISO 9001 [source : Auteur]
ORIENTATION CLIENT
Le principal objectif du management
qualité est la satisfaction des exigences client.
La confiance des clients et des
autres parties intéressées donnent de la valeur ajoutée à
l’entreprise. De même, l’interaction avec eux et la compréhension
de leurs besoins présents et futurs contribuent à la pérennité de
l’entreprise
L'orientation client se traduit par
la mise en place d'un véritable processus de communication avec
eux, une analyse prospective de leur besoin, une évaluation
régulière de leur niveau de satisfaction et le traitement de leurs
réclamations [8].
LEADERSHIP
Le responsable du management de la
qualité doit créer, entre le personnel, un environnement
d’implication pour atteindre les objectifs qualité de l’organisme.
La stratégie, la politique, le processus et les ressources doivent
être en cohérence avec ces objectifs qualité.
IMPLICATION DU PERSONNEL
L’implication du personnel est
indispensable pour la progression de l’entreprise et l’atteinte
des objectifs qualité.
Un personnel compétent, habilité et
impliqué à tous les niveaux de l’organisme est essentiel pour
améliorer sa capacité à créer et fournir de la valeur. La
reconnaissance, l’habilitation et l’amélioration des compétences
facilitent l’implication du personnel.
APPROCHE PROCESSUS
Un système constitué de processus
corrélés permet à un organisme d’optimiser ses performances et
d’obtenir des résultats cohérents et prévisibles de manière plus
efficace et efficiente.
AMÉLIORATION
Le succès d’un organisme repose sur
une volonté d’amélioration continue.
L’amélioration est essentielle pour
conserver ses niveaux de performance, réagir aux variations du
contexte interne et externe et créer de nouvelles opportunités.
PRISE DE DÉCISION FONDÉE SUR DES
PREUVES
La pris de décision est un processus
complexe. Une analyse de données d’entrée et d’informations ainsi
qu’une évaluation des conséquences possibles augmentent
l’objectivité et la confiance dans la pris de décision.
MANAGEMENT DES RELATIONS AVEC LES
PARTIES INTÉRESSÉES
La gestion des relations avec les
parties intéressées a une influence sur les performances d’un
organisme. Les relations avec les parties intéressées doivent être
gérées de manière à optimiser leur impact sur les performances.
1.3.
DISPOSITIFS MÉDICAUX ET RÉGLEMENTATION APPLICABLE
Un dispositif médical est tout
instrument, appareil, équipement, logiciel, matière ou autre
article, destiné par le fabricant à être utilisé chez l’homme à
des fins, notamment, de diagnostic, de prévention, de contrôle, de
traitement, d’atténuation d’une maladie ou d’une blessure [9].
La réglementation applicable pour
les DM est la directive 90/385/CEE relative aux dispositifs
médicaux implantables actifs et la directive 93/42/CEE relative
aux dispositifs médicaux. La mise sur le marché d’un DM est
conditionnée à l’obtention, préalablement à sa commercialisation,
du marquage CE qui reflète la conformité du DM aux exigences de
sécurité et de santé énoncées dans le directives européennes [10].
En France l’organisme qui inspecte
le respect de la réglementation des DM est l’Agence Nationale de
Sécurité du Médicaments et des produits de santé (ANSM). C’est un
établissement public financée par une subvention pour charge de
service public reçue de l’État dont sa mission est de garantir la
sécurité des produits de santé tout au long de leur cycle de vie [11].
retour sommaire
1.4.
L’ISO 13485 : DÉFINITION ET CARACTÉRISTIQUES
La norme ISO 13485 est une norme
harmonisée (à caractère non contraignant) permettant aux
fabricants de dispositifs médicaux de répondre aux obligations
réglementaires en matière de système de management de la qualité
(SMQ).
Le nombre de certifications ISO
13485 délivrées a expérimenté une croissance depuis l’année 2005
jusqu'à nos jours (Figure 4). Les raisons de cette augmentation
peuvent être l’assurance de la bonne application de la partie
qualité de la réglementation, le besoin d’une démarcation dans le
marché dû à la forte concurrence, et l’importance de la
conservation de la confiance client, entre autres.
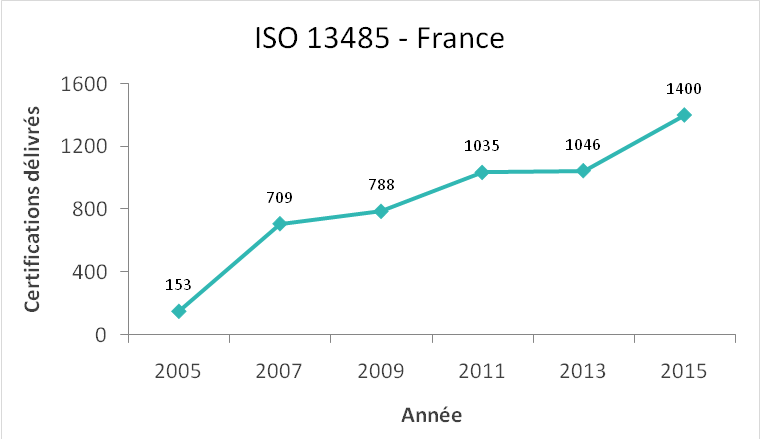
Figure 4. Évolution du nombre de certifications de la norme ISO
13485 en France [6]
1.4.1.
CARACTÉRISTIQUES DE L’ISO 13485 : 2015
La norme ISO 13485 est construite à
partir de la norme ISO 9001:2003, par conséquent les 7 principes
de l’ISO 9001 sont aussi valables pour l’ISO 13485. D’autre part,
la norme ISO 13485 souligne 3 aspects fondamentaux : les
exigences réglementaires, les enregistrements et les risques. Ces
aspects sont décrits ci-dessous.
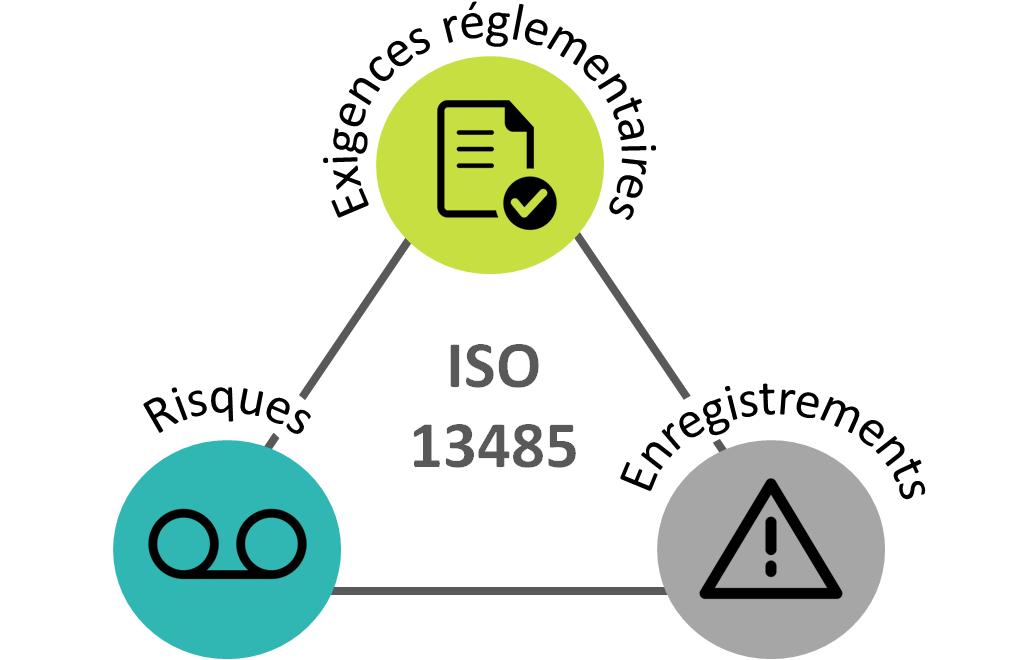
Figure 5. Aspects fondamentaux de la norme ISO 13485 [source :
Auteure]
EXIGENCES RÉGLEMENTAIRES
Les exigences réglementaires
applicables doivent être respectées par le fabricant. L’ISO 13485
met en évidence la définition des exigences pour les différentes
modalités décrites dans la norme.
ENREGISTREMENTS
Un enregistrement est un document
faisant état de résultats obtenus ou apportant la preuve de la
réalisation d'une activité [5].
L’importance des enregistrements est
basée sur la démonstration de la conformité aux exigences.
RISQUES
Un risque est la probabilité que
survienne un élément et la sévérité de ses conséquences.
Pour être conforme à la norme,
l’organisme doit appliquer une approche fondée sur les risques en
ce qui concernent les exigences réglementaires, de sécurité et de
performance.
retour sommaire
1.5.
ENJEUX
L’objectif principal du projet est
l’obtention ou la conservation des certifications aux normes ISO
9001 et/ou ISO 13485. Un renouvellement du système doit être fait
pour rendre conforme le SMQ aux exigences des dites normes.
Les principales causes du
renouvellement du système de management qualité sont le changement
de version de la norme où peuvent surgir des difficultés
d’interprétation des nouvelles exigences, l’apparition de non
conformités lors des audits internes, ou des audits del’ON tout au
long de l’obtention de la certification, etc…
Pour faciliter la compréhension des
enjeux du projet, une planification dynamique et stratégique de
cette démarche qualité est représentée dans la Figure 6.
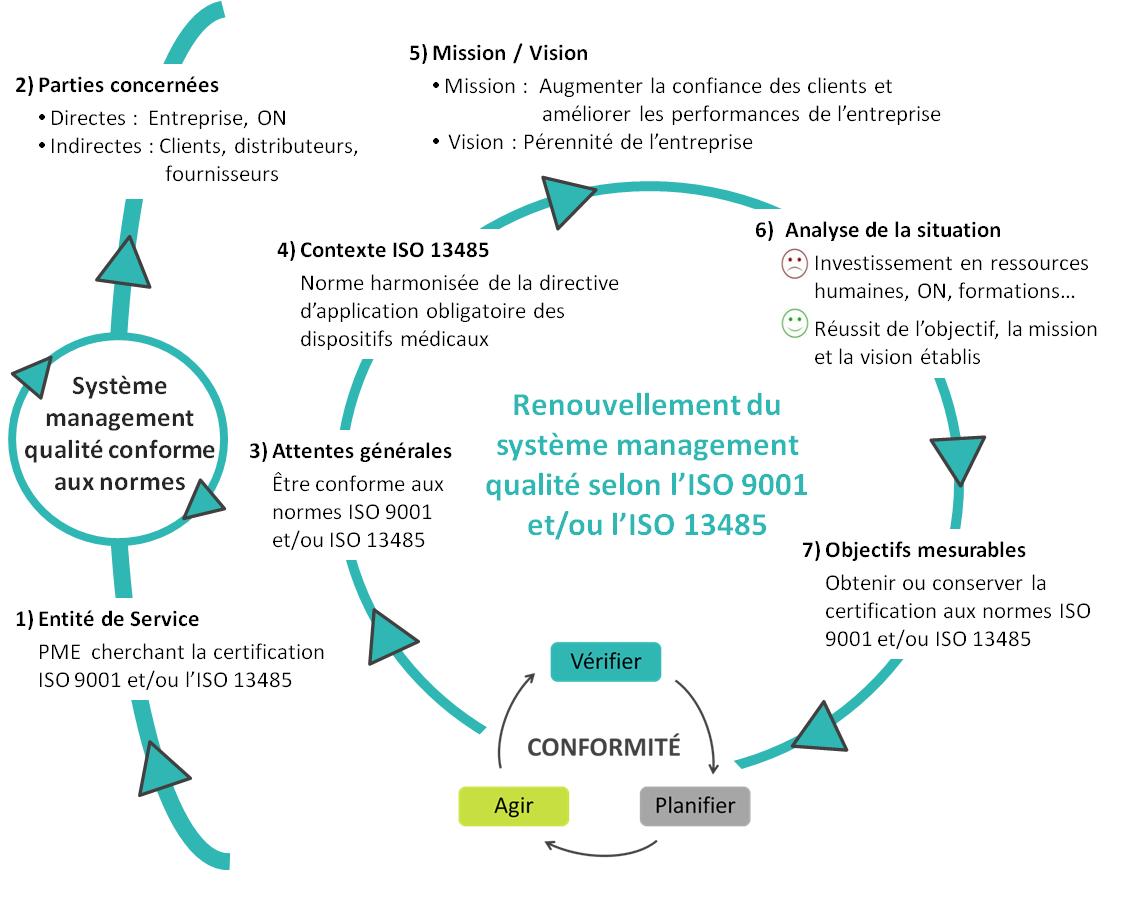
Figure 6. Planification Dynamique et Stratégique de la démarche
[source : Auteure]
Pour cette démarche, l’entreprise et
l’organisme notifié tiennent un rôle fondamental. La PME est la
responsable de l’application des normes conformes aux exigences et
l’ON est l’organisme qui va évaluer cette conformité et le seul
qui a le pouvoir de donner la certification.
Les autres parties concernées sont
les clients, les distributeurs et les fournisseurs. Ils font
partie du SMQ de l’entreprise qui cherche à renforcer et
formaliser la relation avec eux.
Pour adapter cette démarche qualité
aux PME spécifiques, il faut prendre en compte les particularités
suivantes qui peuvent les différencier des autres entreprises de
taille plus grande :
- Ressources limitées : En règle générale, les PME ont
des ressources souvent limitées, ce qui peut affecter leurs
performances face aux projets et aux changements. De plus,
l’investissement qu’elles doivent faire pour obtenir et/ou
conserver une certification suppose un pourcentage élevé de son
capital total. Pour toutes ces raisons, l’exploitation des
ressources doit être efficace et elle doit être optimisée au
maximum.
- Communication transversale : Les PME ont
habituellement une communication qui implique tous les acteurs
concernés, peu importe leur hiérarchie. La favorisation des
échanges entre les différents acteurs, dans la perspective de
partager les connaissances et d’intégrer tous les salariés dans
la prise de décision, fait que la communication est plus
efficace, rapide et directe.
- Manque de communication formalisée : Il est assez
courant dans les PME de ne pas formaliser des réunions,
informations transmises…, ce qui peut défavoriser la
transmission de l’information et provoquer parfois des
malentendus, tout en diminuant l’efficacité de la communication.
Tout ceci peut affecter les entreprises qui n’ont pas un système
de communication bien défini.
- Implémentation rapide de changements : La gestion des
changements est souvent un processus complexe qui varie d’une
entreprise à l’autre. Dans les PME les changements sont
implémentés, habituellement, plus rapidement que dans les
grandes entreprises grâce au faible nombre d’acteurs impliqués,
la communication plus directe et la faible complexité et
quantité des procédures concernant la gestion de changements.
La PME concernée par ce projet a
toutes ces particularités. En plus, elle a un délai d’action
limité, dû à l’établissement de la date d’audit de vérification,
établi par l’ON.
Pour conclure, il est important de noter que la réussite de cette
démarche est indispensable pour l’augmentation de la confiance des
clients et pour l’amélioration des performances de la PME, ce que
contribue à sa pérennité.
retour
sommaire
Chapitre
2 : MÉTHODOLOGIE DE LA DÉMARCHE
Pour aborder cette démarche qualité
et rendre le SMQ conforme aux normes, il faut prendre en
considération la situation et les caractéristiques spécifiques de
la PME.
De ce fait, la méthode choisie est
dite agile, tout en essayant de minimiser les ressources
nécessaires et d’avoir des résultats en un minimum de temps.
Les deux non-conformités plus
importantes qui ont été traitées dans le PME ont été la gestion de
fournisseurs et la gestion de compétences et de formation.
2.1. SITUATION INITIAL
DE LA PME DU PROJET
Cette démarche qualité a été menée
dans une PME de dispositifs médicaux certifiée ISO 9001 et ISO
13485.
Des non-conformités ont été
détectées lors d’un audit de suivi. Pour conserver ses
certifications, la PME était obligée d’adopter un plan d’action
pour rendre son SMQ conforme aux exigences.
Pour la correction des non-conformités, les particularités de la
PME, cités dans les enjeux, ont été prises en compte. Parmi
celles-ci, la plus significative a été le court délai d’action
donné pour l’ON.
2.2.
DESCRIPTION DE LA MÉTHODE DE RENOUVELLEMENT DU SMQ
Pour affronter cette démarche, la
méthode choisie a été un cycle continu composé de trois phases :
vérifier, planifier et agir dont l’objectif principal était la
conformité aux exigences des normes.
Cette méthode se caractérise pour
être agile, tout en essayant d’avoir des résultats dans un délai
le plus court possible, en gagnant du temps réduisant les nombres
des phases.
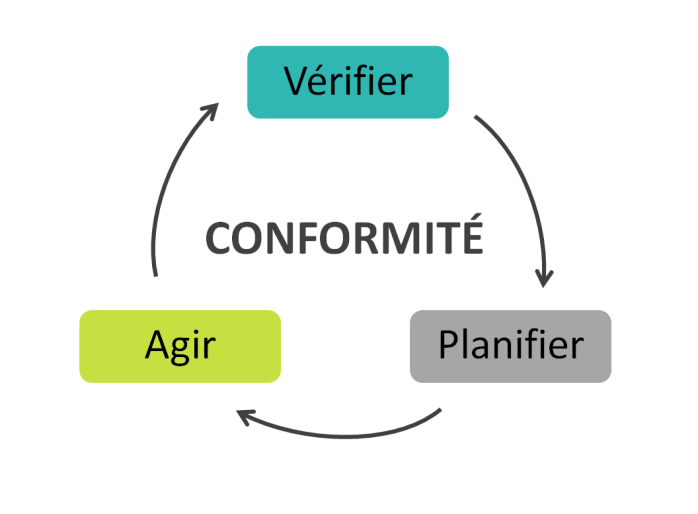
Figure 7. Méthodologie de la démarche qualité du projet [source :
Auteure]
retour sommaire
2.2.1.
VERSIFICATION
La vérification est la première
étape de cette démarche.
Le point de départ était les
non-conformités apparues dans le système de management de la
qualité lors de l’audit de suivi.
Pour avoir une vision plus claire du
rayon d’action, était nécessaire de lister toutes ces
non-conformités à attendre et les analyser une par une pour
repérer les points à améliorer pour atteindre la conformité.
Parmi les non conformités détectées,
la gestion de fournisseurs et la gestion de compétences et
formation ont été soulignées. Ces deux systèmes ont été renouvelés
complètement en améliorant ses performances.
LA GESTION DE FOURNISSEURS
Le système de gestion de
fournisseurs établi dans la PME avant l’audit était un
système peu efficace. Après une analyse détaillée du
système, les causes de ce manque d’efficacité et, par conséquence,
les points à améliorer ont été :
- La non-adaptation aux besoins de l’entreprise des actions à
mener selon l’importance du fournisseur.
- La non-efficacité de l’évaluation des fournisseurs due aux
faibles critères d’évaluation établis. Les résultats obtenus
étaient toujours satisfaisants, ce qui ne permettait pas de
mettre en œuvre des actions d’amélioration.
LA GESTION DE COMPÉTENCES ET
FORMATION
Le rapport d’audit de suivi faisait
référence au système de gestion de compétences et formation. Il
marquait l’absence d’un système de détection du besoin de
formation.
En plus, l’analyse de cette
non-conformité a fait ressortir la complexité de compréhension et
mise à jour du système de gestion de compétences et l’incohérence
entre l’organigramme, les fiches de poste, les fiches métier, le
tableau de polyvalence et la matrice d’habilitation.
2.2.2.
PLANIFICATION
Le manque de temps, de ressources et
de la formalisation de la communication a fait de la planification
une étape très importante.
En partant de la liste des
non-conformités à atteindre et les principaux points à aborder
pour chacune d’entre elles, les non-conformités ont été classées
par priorité selon son impact sur la qualité du produit.
Dû à la courte disponibilité du
délai d’action, seules les tâches absolument nécessaires pour
atteindre la conformité ont été repérées. Pour cela, des
non-conformités comme la gestion de la maintenance, parmi
d’autres, n’ont pas été traitées avant l’audit de vérification.
Le dernier pas de cette étape était
l’anticipation des ressources nécessaires pour mener à bien cette
démarche. Pour cela, les ressources dont on allait avoir besoin et
les ressources disponibles ont été localisées, pour planifier,
selon la priorité des actions déjà établies, les ressources
essentielles.
Pour les deux non-conformités
traitées dans ce MIM, il fallait planifier du temps pour la
réflexion, la rédaction, l’implémentation et la vérification des
systèmes et des procédures associés et, aussi, la disponibilité
des employés concernés.
Pendant toute l’étape de la
planification la formalisation de la communication a eu une
importance particulière, ce qui a permis de renforcer cette
formalisation qui a elle-même favorisé les autres étapes.
2.2.3. ACTION
La dernière étape était la mise en
œuvre des actions planifiées en se servant, si cela était
pertinent, des ressources établis. La communication transversale
et la rapidité d’implémentation de changements ont permis de
gagner du temps et d’améliorer l’efficacité des actions.
Les points clés pour la mise en
œuvre de cette démarche dans la PME ont été :
- Nouvelles méthodologies de travail : développement de
nouveaux systèmes de travail afin d’atteindre les exigences des
normes.
- Rédaction des procédures : revue globale des
procédures existantes et création des nouvelles procédures.
- Formation du personnel : caractérisée surtout pour la
formation du responsable qualité et personnes concernées aux
principaux points de non-conformité et pour la formation aux
nouvelles procédures créées ou modifiées.
Une fois cette étape clôturée ou
lorsque cela était jugé nécessaire, on a continué avec le cycle de
la méthode, et on est passé de nouveau à la première étape de
vérification pour s’assurer que les actions mises en place étaient
conformes aux exigences de la norme.
Les deux principales non-conformités
ont été traitées selon le planning établi et ses conformités ont
été vérifiées à temps avant l’audit de vérification.
retour sommaire
2.3.
POINTS DE SUPPORT DE LA DÉMARCHE
Le SMQ est un système complexe qui
doit être mise à jour constamment et qui englobe tous les
départements et personnel de l’entreprise. Pour cela, la
communication, la coopération et la coordination ont été
essentielles tout au long de ce projet (Figure 8).
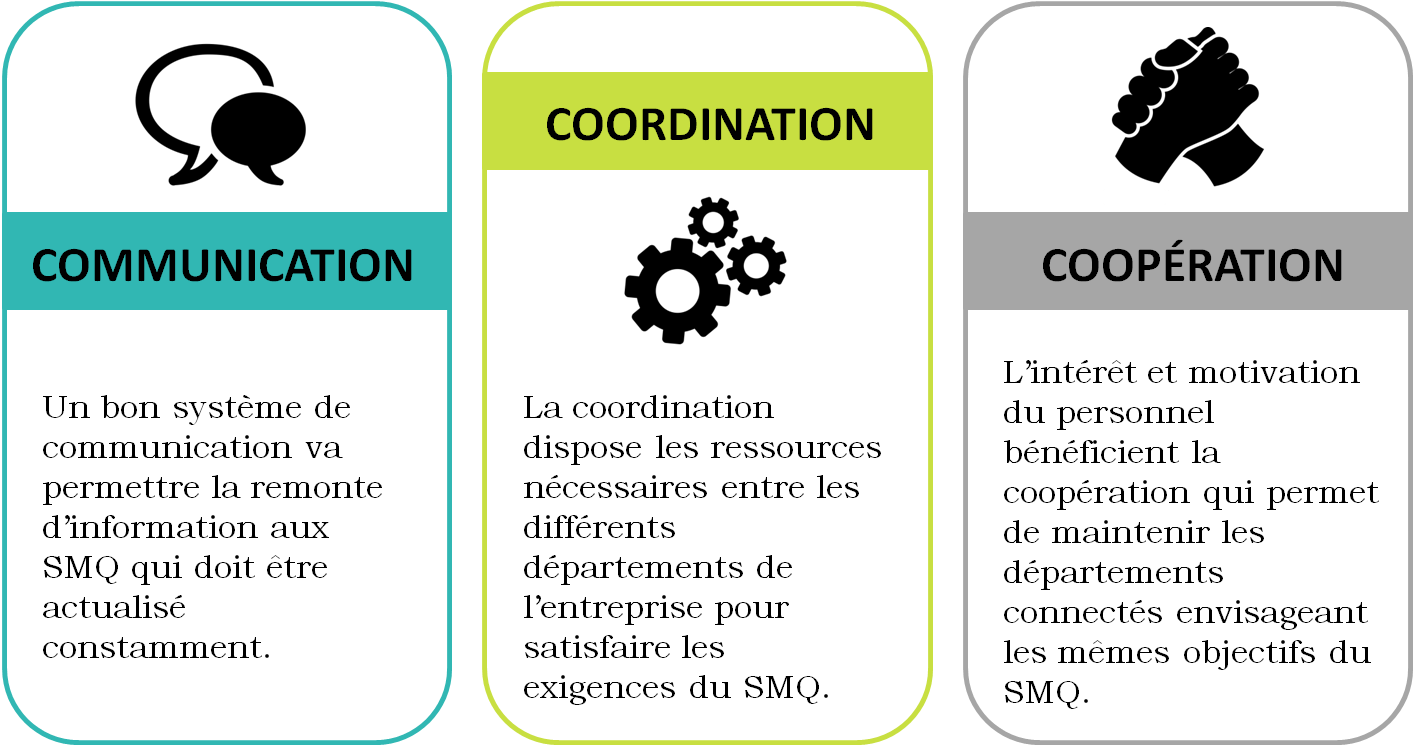
Figure 8. Éléments clés de réussit de la démarche [source :
Auteure]
Les 3 éléments interagissaient,
chacun d’entre eux a été le support des autres. Par exemple, la
gestion de compétences et formation demandaient une bonne
communication, coordination et coopération du personnel qui devait
planifier de réunions pour la description de leurs activités
quotidiennes et leur intégration dans le tableau de polyvalence de
tâches.
En conclusion, le renforcement d’une
culture de travail partagé a été indispensable pour atteindre les
objectifs du SMQ et de cette démarche qualité, et a contribué à
l’amélioration des performances de l’entreprise.
retour sommaire
2.4.
CARTOGRAPHIE DE PROCESSUS DE LA DÉMARCHE
L’application de cette démarche
qualité est représentée, en forme de cartographie de processus,
dans la Figure 9. Il faut signaler que les 7 principes de l’ISO
9001 appartiennent aussi à la norme ISO 13485.
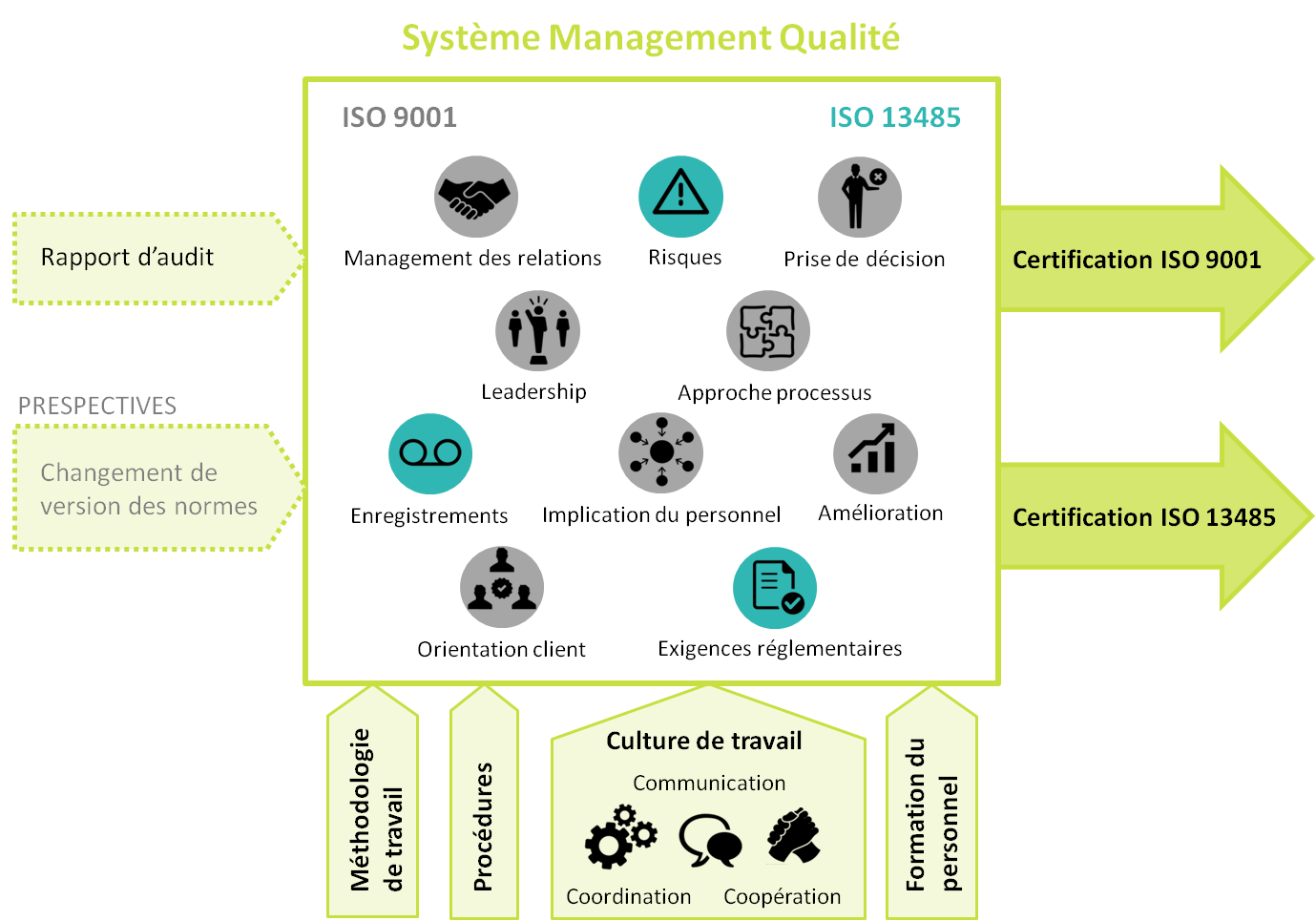
Figure 9. Cartographie de processus suivi dans la PME [source :
Auteure]
Cette méthode agile a permis
l’amélioration de la visibilité sur la performance et les
dysfonctionnements de l’entreprise, ainsi que le renforcement
d’une culture de travail partagée et une organisation développée.
retour sommaire
Chapitre 3 : RÉSULTATS OBTENUS
Cette méthode a été appliquée au
sein d’une PME des dispositifs médicaux où les résultats escomptés
ont été atteints et les performances de l’entreprise ont été
améliorées. Ainsi, un développement personnel et professionnel a
été acquis toute au long de cette démarche qualité.
3.1. RÉSULTATS OBTENUS
Dans le premier audit de suivi, 16
non-conformités avaient été détectées. Pour la correction de ces
non-conformités, la méthode décrite dans le chapitre précédent a
été menée, ce qui a permis de réduire les 16 non-conformités (5
majeurs et 11 mineurs) à 8 (2 majeurs et 6 mineurs) lors de
l’audit de vérification. Cette valeur suppose une diminution du
50% de non-conformités. Après cet audit de vérification, l’ON a
donné un délai d’un mois pour corriger ces 8 non-conformités
restantes qui ont été corrigées dans le délai établi.

Figure 10. Évolution des non-conformités tout au long de la
démarche menée [source : Auteure]
GESTION DES FOURNISSEURS
Le système de gestion des
fournisseurs a été revu et adapté aux besoins de l’entreprise.
Deux aspects du système ont été modifiés, ce qui a permis de
corriger la non-conformité concernée.
Le premier point amélioré a été le
rétablissement des actions à mettre en place selon la criticité du
fournisseur. Grâce à cette modification, des contrats avec des
fournisseurs déterminés ont été établis pour la première fois, et
le nombre d’évaluations réalisées a été diminué en un 20% en se
concentrant sur les fournisseurs les plus importants.
Le deuxième point amélioré a été la
modification des critères d’évaluation, ainsi que la
classification du résultat et les actions à mener selon la
classification obtenue. Ces changements ont permis la dispersion
de résultats qui avant, étaient toujours satisfaisants, voir
Figure 11, et le passage de 3 résultats possibles (très bon, bon
et moyen) à 4 (ajout du résultat mauvais).
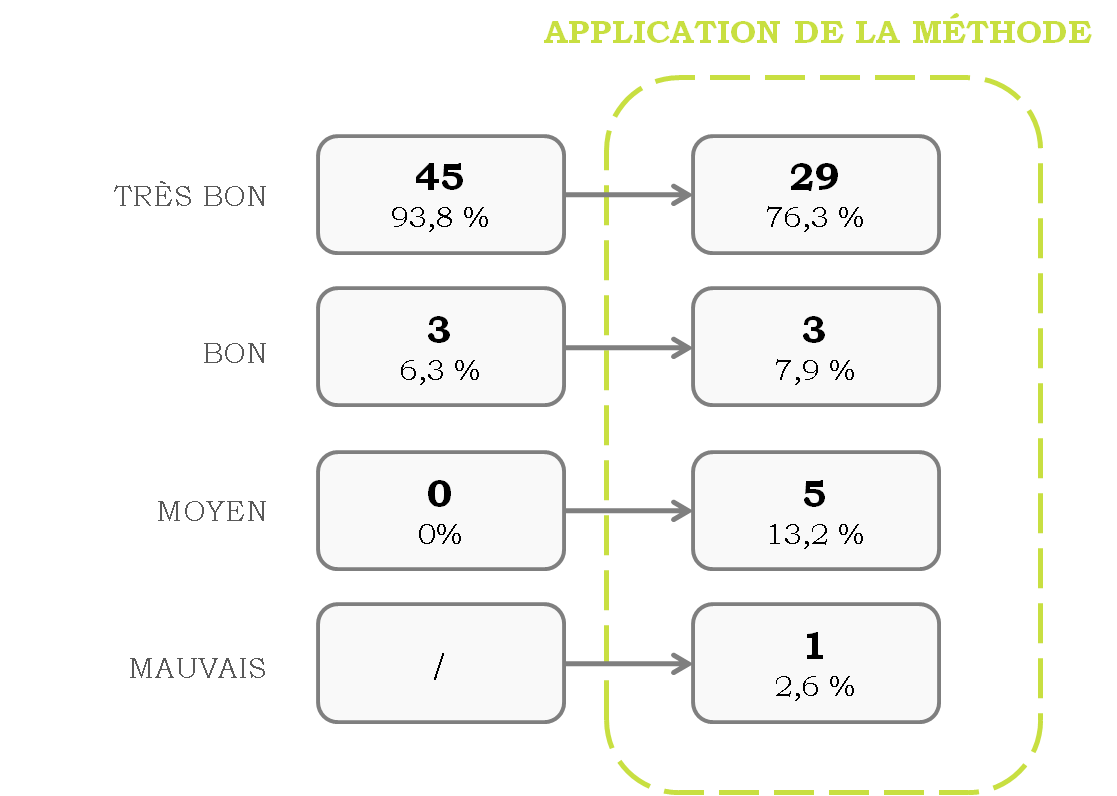
Figure 11. Résultats des évaluations fournisseurs avant et après
les modifications [source : Auteure]
Pour la première fois, après d’une
évaluation, des actions d’amélioration ont été mises en place aux
fournisseurs classifiés de moyen et mauvais. Grâce à ces actions
mises en place l’efficacité du système a été augmentée et
l’amélioration continue a été favorisée.
GESTION DE COMPÉTENCES ET
FORMATION
Un renouvellement complet du système
de gestion de compétences et formation a été effectué.
Un nouveau système plus simple a été
créé, où les fiches métier ont été supprimées, et la détection du
besoin de formation a été intégrée au tableau de polyvalence. De
plus, ce tableau a été mis en cohérence avec les fiches de poste
et avec la matrice d’habilitation.
Grâce à ce nouveau système, 12
besoins de formation ont été ressortis, parmi lesquels 7 affectent
directement la qualité du produit, les cinq autres affectant de
manière indirecte.
La formation plus importante détectée grâce à ce renouvellement de
la gestion de compétences et formation a été la maintenance qui a
été planifié pour l’année à venir 2017/2018.
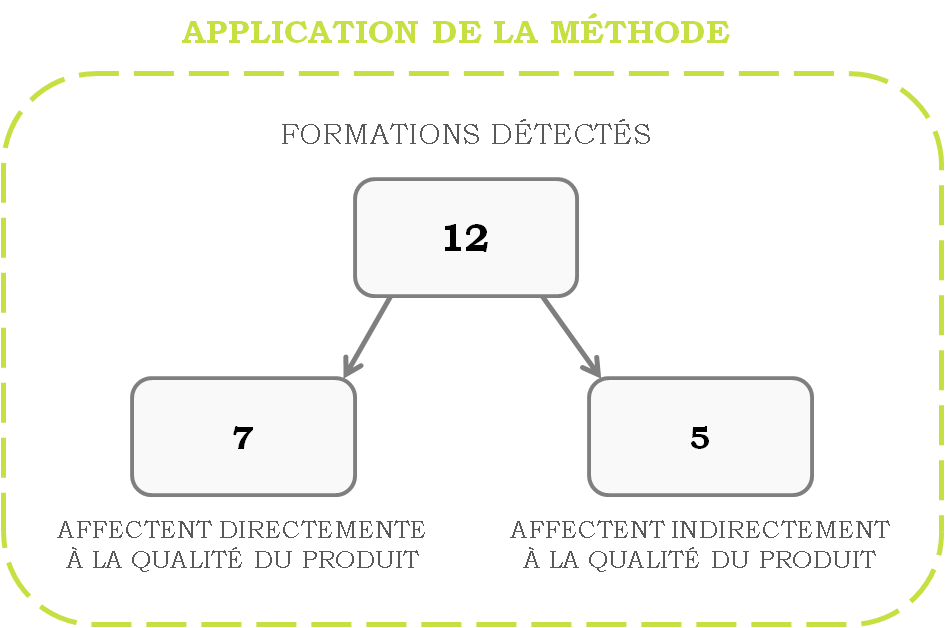
Figure 12. Formations ressorties grâce au renouvellement de la
gestion de compétences et formation [source : Auteure]
DIFFICULTÉS RENCONTRES
Pendant toute la démarche qualité
menée à bien, certaines difficultés sont apparues.
Le manque de temps entre l’audit de
suivi et l’audit de vérification n’a pas permis de corriger tous
les non-conformité à temps. Cependant, l’organisme notifié a donné
un mois de délai, à compter à partir de l’audit de vérification,
pour corriger les non-conformités détectées lors de ce dernier
audit. Grâce au travail réalisé entre les deux audits, les
non-conformités restantes ont pu être corrigées dans ce mois de
délai.
L’autre difficulté surgie pendant ce
renouvellement du SMQ a été la formalisation de la communication.
Ce manque de formalisation a provoqué une perte de temps, due à la
répétition des informations, la mauvaise compréhension du sujet,
etc. Ce point a été travaillé pendant la démarche, néanmoins il
reste encore des améliorations à faire.
En dépit des difficultés
rencontrées, la PME a réussi à corriger tous les non-conformités
du système et, par conséquence, conserver ses certifications aux
normes et son marquage CE.
3.2.
PERSPECTIVES
Le travail réalisé a permis la
conservation des certifications grâce à la correction des
non-conformités. Le renouvellement constant et la mise à jour du
système vont permettre de conserver la conformité du SMQ aux
normes et d’éviter l’augmentation des non-conformités lors des
prochains audits.
Il faut également faire attention
aux changements de versions des normes SMQ et réglementation de
DM. Cette démarche va démarrer dans la PME l’année 2018, pour
laquelle la méthode de vérification, planification et action, déjà
mise en œuvre et réussie est envisagée encore une fois.
retour sommaire
3.3.
GAINS PERSONNELS ACQUIS
Mener ce projet entraîne de
connaissances basiques sur les normes certifiées et son
interprétation et application, la réglementation, le SMQ, les
audits, les entreprises et son fonctionnement. Pour sa réussite,
il faut aussi avoir des capacités pour la réflexion, la création
des nouvelles méthodes, la vision au court et long terme, le
relationnel, parmi d’autres.
Aussi bien les connaissances que les
capacités nécessaires peuvent être développées tout au long de la
vie professionnelle. Cependant, cette démarche qualité a supposé
le renforcement de toutes ces aptitudes indispensables pour tout
bon qualiticien.
Ce projet a été fait sur mesure, dû
aux nombreuses non-conformités rencontrées lors de l’audit de
suivi qui avaient mis en jeu la perte des certifications.
Le travail réalisé par le
département qualité en collaboration avec le reste de départements
de la PME durant ces derniers mois a permis non seulement la
conservation des certifications et marquage CE mais aussi
l’amélioration des performances de l’entreprise, grâce à la revue
et le renouvellement des systèmes de gestion de fournisseurs et la
gestion de compétences et formation, ainsi que d’autres actions
mises en place pour la correction des non-conformités.
En outre, grâce à ce projet
l’élargissement de la vision du monde de l’entreprise et la
qualité, et l’acquisition de nouvelles compétences nécessaires
pour tout bon professionnel dans le domaine de la qualité a été
possible.
Références
bibliographiques
[1] « Définition
petite et moyenne entreprise / PME », INSEE (Institut national de
la statique et des études économiques), 13-oct-2016. [En ligne].
Disponible sur:
https://www.insee.fr/fr/metadonnees/definition/c1962.
[2] L. GARDES, «
Méthodologie d’analyse des dysfonctionnements des systèmes pour
une meilleure maîtrise des risques industriels dans les PME :
application au secteur du traitement de surface », Institut
national des sciences appliquées de Lyon et école nationale
supérieure des mines de Saint-Étienne, 2001.
[3] G. PROMÉ, «
Dispositifs médicaux: les chiffres en France », 27-mai-2017. [En
ligne]. Disponible sur:
http://www.qualitiso.com/dispositifs-medicaux-chiffres-france/.
[4] « Les rôles des
TPE/PME dans l’économie française », ressources, 27-mai-2017. [En
ligne]. Disponible sur:
http://resources.grouperandstad.fr/economie-que-pesent-reellement-les-pme-et-tpe-en-france/.
[5] AFNOR, « NF EN ISO
9000:2015 ». 30-mars-2017.
[6] « L’étude ISO », ISO
(Organisation Internationale de Normalisation). [En ligne].
Disponible sur:
https://www.iso.org/fr/the-iso-survey.html.
[7] « Principes de
management de la qualité ». Organisation internationale de
normalisation (ISO), 23-mars-2017.
[8] « Les 8 principes du
management de la qualité », Axess qualité, 23-mars-2017. [En
ligne]. Disponible sur:
http://www.axess-qualite.fr/management-qualite_m.html.
[9] A. to E. U. law
EUR-lex, « Directive Européenne 93/42/CEE ».
[10] Direction générale
de la santé, « Ministère des Affaires Sociales et de la Santé -
Dispositifs médicaux », 06-mai-2017. [En ligne]. Disponible sur:
http://social-sante.gouv.fr/soins-et-maladies/autres-produits-de-sante/article/les-dispositifs-medicaux.
[11] « L’ANSM, agence
d’évaluation, d’expertise et de décision ». [En ligne]. Disponible
sur:
http://ansm.sante.fr/L-ANSM2/Une-agence-d-expertise/L-ANSM-agence-d-evaluation-d-expertise-et-de-decision/(offset)/0.
retour sommaire

 sous
format .pdf
sous
format .pdf










