 http://www.arcomed.com/
http://www.arcomed.com/INTERNALISATION DE LA MAINTENANCE PREVENTIVE DES EQUIPEMENTS DE PERFUSION AU PÔLE SANTE SUD LE MANS
RESUME
L'obligation de la maintenance préventive des équipements de perfusion, oblige les établissements de santé à mener une politique de contrôle sur leurs dispositifs. Ce rapport traite de l'internalisation de la maintenance préventive au Pôle santé Sud Le Mans, celle-ci est actuellement sous traitée par une société de tierce maintenance. L'étude comparative entre la réalisation de la maintenance par les techniciens du site et la société externe, a nécessité la création de protocoles de test sur le logiciel ANSUR. Ces protocoles sont mis à disposition sur cette page web par téléchargement, au profit de la communauté biomédicale.
Mots clés : Maintenance préventive, Contrôle qualité, Protocole de maintenance, Dispositif de perfusion.
ABSTRACT
The obligation of the preventive maintenance of the equipment of perfusion, obliges the establishments of health to follow a policy of control on their devices. This report treats internalization of the preventive maintenance, currently under treated, of the equipment of perfusion, within the Pole Southern Health Mans. The comparative study enters the realization of maintenance by the technicians of the site and the company of third party maintenance, required the creation of protocols of test on software ANSUR. These protocols are placed at the disposal on this Web page by remote loading, with the profit of the biomedical community.
Key words : Preventive maintenance, Quality control, Protocol of maintenance, Device of perfusion.
Je remercie Mme Ayraud Isabelle, Ingénieur biomédical au Pôle Santé Sud Le Mans pour la confiance qu’elle m’a accordé, pour sa disponibilité, sa gentillesse et pour son aide précieuse à l’élaboration de mon rapport.
Je remercie Messieurs Bertin Christophe, Blet Guillaume et Carou Tangi, techniciens biomédicaux au Pôle Santé Sud Le Mans, pour l’aide qu’ils m’ont apporté à l’étude de mon projet, leur disponibilité et sympathie.
Je remercie Mme Chenevier Cécile, Ingénieur en assurance qualité au Pôle Santé Sud Le Mans pour ses conseils lors de l’utilisation des outils qualités.
Je remercie les techniciens de la société de tierce maintenance, pour les échanges sympathiques que nous avons eu et les informations qu’ils ont divulguées sur leur prestation.
La mission qui m’a été confié dans le cadre de mon stage pratique de validation du diplôme de Technicien supérieur en Ingénierie biomédicale, est l’évaluation des moyens nécessaires à la mise en oeuvre de l’internalisation de la maintenance préventive au Pôle Santé Sud le Mans.
Cette maintenance est actuellement réalisée par une société de tierce maintenance.
Il faudra faire un état des lieux du parc des dispositifs médicaux concernés et des ECME à disposition, estimer les ressources tant matérielles qu’humaines et de faire une étude financière comparative entre la maintenance externe et interne.
Il sera nécessaire de définir la périodicité de la maintenance préventive, d’élaborer des protocoles de maintenance, de contrôle qualité et de sécurité électrique, de proposer une organisation pour la maintenance préventive et en complément avoir une réflexion sur les contrôles à réaliser dans le cadre de la maintenance curative.
Nota : A la demande de l'ingénieur biomédical du Pôle Santé Sud, les chiffres de l'étude financière doivent rester confidentiels et n'apparaitront pas dans ce rapport.
Depuis février 2008, le CMCM, constitué des anciennes cliniques Les Sources, Saint-Côme et Sainte-Croix, la Clinique du Tertre-Rouge et des centres médico-techniques indépendants partagent un plateau technique commun.
Ils se sont regroupés au sein du Pôle Santé Sud sur un site de huit hectares au sud du Mans.
En 2009 est venu s’ajouter le Centre Gallouedéc, centre de soins de suite et réadaptation.
Le Mans est le chef lieu du département de la Sarthe, c’est une ville connue principalement pour son circuit automobile (24 heures auto et moto) et ses équipes sportives (football, basket), sa population est de 293 159 (recensement 1999) [3].
Le Pôle Santé Sud, c’est une offre de soins complète réunissant :
Le CMCM (http ://www.cmcm.fr/) : médecine et chirurgie
CHIFFRES Capacité de 373 lits et places
• 173 lits en chirurgie
• 97 lits en médecine
• 50 lits en psychiatrie
• 43 places en ambulatoire
• 3 lits en hospitalisation à temps partiel en médecine
• 17 salles d’opération120 médecins & 450 salariés
PÔLES DE COMPETENCES
• Département d’anesthésie et réanimation
• Département de chirurgie
• Département de médecine
• Département de psychiatrie
• Urgences : 24h/24
• Prises en charge spécifiques (Soins palliatifs, Stomathérapie)
Le CMCM appartient au groupe VEDICI (http ://www.vedici.fr/groupe-sante.html) fondé en janvier 2000 par le Dr Michel Bodkier et Mr Jérôme Nouzarède.
Le groupe VEDICI regroupe 18 établissements privés dans toute la France.
Le CMCM a obtenue la certification version 1 en mars 2005, il est en procédure de certification V2.
La certification des établissements de santé est une procédure d’évaluation externe, indépendante de l’établissement de santé et de ses organismes de tutelle, effectuée par des professionnels de santé, concernant l’ensemble de son fonctionnement et de ses pratiques.
La certification des établissements de santé est suivie et dirigée par la Haute autorité de Santé (HAS) (http ://www.has-sante.fr./).Le Tertre Rouge (http ://www.tertrerouge.fr/) : maternité, obstétrique et urologie.
CHIFFRES Capacité de 134 lits et places
• 12 salles de bloc obstétrical
• 1 salle de césarienne
• 4 salles d’opération 20 médecins, 200 salariés.PÔLES DE COMPETENCES
• L’Obstétrique
• La Néonatologie
• L’Aide à la procréation
• L’Urologie
• La Chirurgie gynécologique
• La Chirurgie plastique
La clinique du Tertre rouge appartient au groupe Cliniques du Maine, qui est un regroupement avec la clinique du Pré du Mans.
Elle a obtenue la certification version 1 en septembre 2002, la certification version 2 en octobre 2006, elle est actuellement en procédure d’accréditation V2010.
Le CMCM et Le Tertre rouge ont élaborés un groupement de coopérative sanitaire (GCS), ce groupement consiste à mettre en commun des moyens relatifs à : [4]
• La démarche qualité et la gestion documentaire
• La pharmacie à usage intérieur et la stérilisation (externalisée)
• L’anesthésie, la chirurgie ambulatoire et la chirurgie urologique
• Le bloc opératoire et les salles de soin post interventionnel
• Le brancardage
• Les services techniques, biomédical et la sécurité incendie
• Le système d’information
• La restauration, l’hôtellerie, le bio nettoyage et le linge
• La gestion des déchets
• L’économatLe Centre Médical François Gallouédec (http://www.centre-gallouedec.com/) est un établissement à but non lucratif participant au service public hospitalier.
Sa capacité est de 144 lits en hospitalisation complète et 50 places en hospitalisation de jour.
Ses activités médicales concernent les soins de suite et de réadaptation.
Il est géré par l’Association d’Hygiène Sociale de la Sarthe (http://www.ahs-sarthe.asso.fr), qui gère aussi six autres établissements et services.
Il a obtenue la certification version 1 en août 2003 et la certification version 2 en 2007, il est actuellement en procédure d’accréditation V2010.Un centre d’imagerie (Radiologie, Scanner, IRM, Mammographie, Echographie et Doppler)
Un laboratoire d’analyses médicales
Un centre de Dialyse et de Néphrologie
Un pôle de consultations paramédicales
Le service biomédical fait partie du groupement de coopération sanitaire établit entre le CMCM et le Tertre Rouge, il se trouve au niveau de leur plateau technique commun.
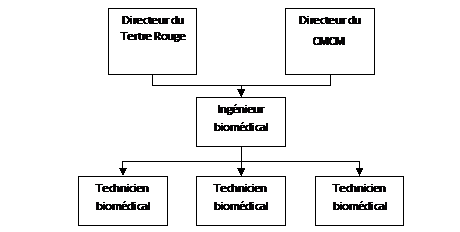
Il intervient uniquement pour ces deux établissements, il est constitué :D’un ingénieur, qui a obtenu un diplôme d’ingénieur en génie biologique spécialité biomédicale, suivie d’un mastère IBMH (Ingénieur BioMédical Hospitalier) effectué à l’université technologique de Compiègne.
De trois techniciens supérieurs qui ont une licence professionnelle en Ingénierie et Maintenance Biomédicale obtenue à l’université de Bretagne sud de Lorient.
L’Ingénieur et deux techniciens sont salariés au CMCM alors que le troisième est salarié au Tertre Rouge.
Figure 1: Organigramme hiérarchique
Missions du Technicien Biomédical [5] :
• Assurer la maintenance des dispositifs médicaux dans tous les domaines technologiques dont il possède les compétences techniques.
• Assurer la planification des contrôles et de la maintenance des dispositifs médicaux.
• Assurer la traçabilité des maintenances sur la GMAO.
• Utiliser les appareils de contrôle, de mesure et d’essai du département biomédical.
• Assurer le suivi des opérations effectuées par des fournisseurs ou prestataires de maintenance sur site ou en externe.
• Informer et former les utilisateurs sur l’usage des dispositifs médicaux.
• Gérer le stock de pièces détachées et accessoires.
• Assurer des petits travaux de tous types en fonction de sa qualification et de se habilitations.
• Effectuer les enregistrements qualité et de maintenance.
• Participer à l’amélioration continue de la qualité de la maintenance en proposant des solutions.
• Participer à des réunions d’information et de formation afin d’assurer la veille technologique du Pôle Santé Sud.
• Informer les responsables et utilisateurs des risques liés aux disfonctionnements des dispositifs médicaux.L’amplitude horaire du service est de 10 heures, deux techniciens sont présents de 8 heure à 16 heure et le troisième de 10 heure à 18 heure.
Les dispositifs médicaux n’étant pas communs aux cliniques du CMCM et du Tertre rouge, les techniciens biomédicaux doivent avoir une grande rigueur.
Il leur faut bien différencier le parc, les pièces détachées et les interventions de l’une ou de l’autre clinique.
Le service dispose d’une GMAO Optim EMS version 4 [Annexe 2] (http://www.optim.fr/) pour réaliser l’inventaire de ses dispositifs médicaux, la traçabilté des interventions internes et externes, la gestion des contrats et la gestion des pièces détachées.
La GMAO dispose d’un module optimweb [Annexe 3] de demande d’intervention via une interface internet, ce module est en phase de déploiement au CMCM après avoir été testé dans deux services pilotes (les urgences et l’unité de soin intensive de cardiologie).
Les demandes d’intervention des autres services se font par un formulaire [Annexe 4] faxé par les cadres ou les infirmières dans le service biomédical.
Ces deux modes de demande d’intervention permettent d’assurer la traçabilté des demandes.
Le service biomédical réalise la maintenance préventive sur certains dispositifs médicaux :
• Moniteurs multiparamétriques Pro 1000 de chez Géneral Electric
• Moniteur Procare de chez Géneral Electric
• Réchauffeurs pour matelas chauffant Warmtouch 5800, 5900 de chez Covidien
• Moniteurs de saturation en oxygène N550 de chez Covidien
• Lits d’accouchement Optima plus de chez Merivaara
• Insufflateurs mécaniques Neopuff de chez Fisher et Paykel
Il dispose d’une gamme d’ECME pour contrôler les performances de ses équipements.
Liste des ECME disponible au service biomédical :
• Testeur de défibrillateur QA 40 M de chez Fluke biomédical (http://global.flukebiomedical.com/), distribué par la société Gamida (http://www.gamida.net/)
 [Image 1]
[Image 1]
• Simulateur de SpO2 Index 2 de chez Fluke Biomédical
 [Image 2]
[Image 2]
• Testeur de sécurité électrique ESA 620 de chez Fluke Biomédical
 [Image 3]
[Image 3]
• Testeur de perfusion IDA 4 plus de chez Fluke biomédical
 [Image 4]
[Image 4]
• Simulateur pression non invasive Rigel 311 de chez Rigel Medical (http://www.rigelmedical.com/) distribué par la société Intégral Process (http://www.integral-process.fr)
.jpg) [Image 5]
[Image 5]
• Simulateur de patient 214 A de chez Dynatech Nevada
[image 6]
Le service biomédical dispose d’un logiciel, ANSUR [Annexe 5] fourni par la société Fluke biomédical qui permet d’informatiser des protocoles de maintenance.
Le logiciel permet également de piloter automatiquement des ECME grâce à des modules d'extensions. C’est le cas du testeur de sécurité électrique ESA 620.
Les appareils sont étalonnés annuellement par la société Manumesure (http://www.chauvin-arnoux.fr/) qui établit un certificat d'étalonnage selon la norme AFNOR FD X 07-12.
Ce document atteste du raccordement de l’appareil visé aux étalons nationaux.
Le Certificat d’Etalonnage AFNOR précise notamment [6]:
• la désignation et le type de l’appareil vérifié
• le numéro de garantie individuelle de l’appareil
• la méthode de mesure
• les moyens de mesure utilisés (avec leur numéro de certificat d’étalonnage)
• les valeurs relevées sur l’appareil
• les incertitudes de mesure sur les points relevés
La société Manumesure est accréditée par le COFRAC (http://www.cofrac.fr/).
Le COFRAC, COmité FRançais d’ACcréditation, créé en 1994 sous l’égide des pouvoirs publics, est une association loi 1901 à but non lucratif dont les membres représentent l’ensemble des partenaires concernés : pouvoirs publics, professionnels, laboratoires et organismes accrédités, groupements de consommateurs et utilisateurs, acheteurs publics.
Les statuts du COFRAC prévoient la participation de représentants de l’État au fonctionnement de ses différentes instances : assemblée générale, conseil d’administration et sections d’accréditation [7].Le service biomédical du Pôle Santé Sud possède les ECME nécessaires pour réaliser la maintenance préventive, le contrôle qualité et le test de sécurité électrique des dispositifs médicaux de perfusion dans ses locaux.
A. Maintenance préventive
1. Définition :
La maintenance préventive est définie comme la maintenance effectuée selon des critères techniques prédéterminés, indiqués dans les notices d’instruction d’utilisation ou les documentations techniques des fabricants, dans l’intention de réduire la probabilité de défaillance d’un bien ou la dégradation d’un service rendu.
Elle est différenciée de la maintenance « utilisateur », effectuée par la personne qui emploie le dispositif et qui à en assurer l’entretien requis quotidiennement et la propreté d’usage, ainsi qu’à vérifier ou changer les consommable en vue de la bonne utilisation du dispositif médical sur le patient.
2. Objectifs :
Les visites et interventions de maintenance préventive ont pour but de réduire les risques de pannes et de maintenir dans le temps les performances des dispositifs médicaux à un niveau proche de celui des performances initiales en vue d’en assurer une utilisation satisfaisante et sûre. Elles doivent donc permettre :
• Une conservation des dispositifs médicaux en bon état de fonctionnement.
• Une maîtrise des coûts de maintenance.
• Un maintien en conformité avec la réglementation en vigueur.3. Description :
La maintenance préventive implique l’inspection, le remplacement des pièces de rechange critiques et le contrôle de la fonctionnalité du dispositif médical à partir de critères comme :
• Les recommandations constructeur.
• Le temps en opération au total.
• Le taux d’utilisation des services de soins utilisateurs.
• Le niveau de criticité du dispositif pour les utilisateurs.
• Les ressources et les moyens de contrôle disponibles.
• Les habilitations éventuelles nécessaires.
• Les protocoles validés par le fournisseur et l’ingénieur biomédical.
• Les résultats de contrôles qualité antérieurs.
• Le taux de panne ou d’indisponibilité, etc.Le service biomédical s’assure que toute la maintenance préventive fait l’objet d’un rapport d’intervention comportant toute information pertinente comme par exemple :
• Dates et intervenants.
• Identification des dispositifs médicaux.
• Activités techniques réalisées.
• Pièces et main d’œuvre.
• Ecarts, défauts, dysfonctionnements corrigés.
• Test et contrôles effectués et leur conformité.
• Date de la prochaine maintenance préventive.
Les dispositifs médicaux sont remis en exploitation et l’utilisateur est informé sur l’activité réalisée et la période prévisionnelle de la prochaine maintenance préventive.
Le service biomédical classe le rapport d’intervention et le rend facilement accessible à toutes personnes autorisées.
Le plus souvent possible, et obligatoirement pour les dispositifs soumis à réglementation, un contrôle qualité est effectué suivant une procédure écrite.
Les résultats obtenus sont valisée par l’opérateur habilité (signature de fiche de contrôle).
B. Contrôle Qualité
1. Définition :
On entend par contrôle qualité d’un dispositif médical l’ensemble des opérations destinées à évaluer le maintien des performances revendiquées par le fournisseur où, le cas échéant fixées par le directeur général de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) [9].
Le contrôle qualité est dit interne s’il est réalisé par l’exploitant ou sous sa responsabilité par un prestataire. Il est dit externe s’il est réalisé par un organisme indépendant de l’exploitant, du fournisseur et de celui qui assure la maintenance du dispositif.2. Objectif :
Les moyens dont dispose le service biomédical doivent permettre d’assurer, sur les dispositifs médicaux dont il a la charge, les contrôles et essais nécessaires avant leur première mise en service, ou à leur mise à disposition après une maintenance, ou de manière périodique.
3. Description :
Pour réaliser un contrôle qualité les points suivant sont à prendre en considération :
Le service biomédical possède tous les éléments nécessaires (techniques, méthodologiques humains, budgétaires et organisationnels) à l’exécution correcte des contrôles qualités internes des dispositifs médicaux.
Les équipements de contrôle de mesure et d’essai sont inclus dans un programme d’étalonnage, compatible avec le planning de maintenance préventive. Il est réalisé par un organisme spécialisé selon les exigences réglementaires.
Le personnel responsable des contrôles qualité est habilité et qualifié par les autorités compétentes (habilitation par la direction ou le responsable biomédical, qualification par un organisme de formation agrée, le constructeur du dispositif médical).
Les résultats des contrôles qualités réalisés sur les dispositifs médicaux sont documentés de telle façon que la traçabilité nécessaire soit obtenue. Le service biomédical s’assure que tout contrôle qualité fait l’objet d’un rapport d’intervention comportant toute information pertinente comme par exemple :
• Date du contrôle réalisé et date du précédant contrôle.
• Intervenant et habilitation.
• Dispositif médical concerné.
• ECME (équipement de contrôle de mesure et d’essai) utilisés et leur validité.
• Méthode utilisée (si nécessaire).
• Résultats qualitatifs et quantitatifs des contrôles effectués.
• Déclaration de conformité ou non.
• Date ou période prévisionnelle du prochain contrôle qualité, etc.Le dispositif médical déclaré « conforme » est remis en exploitation et l’utilisateur est informé sur les résultats du contrôle qualité et de la date prévisionnelle du prochain contrôle.
Un dispositif non conforme retourne en maintenance après information de l’utilisateur. Il n’est pas remis en exploitation. Une substitution est effectuée si nécessaire et si possible.
Le service biomédical classe le rapport d’intervention et le rend facilement accessible à toutes personnes autorisées.
A. Réglementations et obligations de maintenance sur les dispositifs médicaux
Des textes réglementent la maintenance préventive sur les dispositifs médicaux, notamment le décret du n ° 2001-1154 du 5 décembre 2001 complété par l’arrêté du 3 mars 2003.
Cette réglementation prévoit un contrôle préventif sur les dispositifs médicaux de classification ΙΙB notamment.
Les dispositifs de perfusions sont classifiés ΙΙB.Classification des dispositifs médicaux
La classe du dispositif médical est déterminée en fonction de l’utilisation à laquelle le fabricant destine le produit. Pour déterminer à quelle classe d’un dispositif appartient, il faut consulter l’annexe IX de la directive 93/42/CEE qui décrit les règles de classification applicables.
Textes en vigueur
a. Arrêté du 3 mars 2003 fixant les listes des dispositifs médicaux soumis à l'obligation de maintenance et au contrôle de qualité mentionnés aux articles L5212-1 et D665-5-3 du code de la santé publique (JO n°66 du 19 mars 2003 page 4848 texte n° 26)[10]
b. Décret n°2001-1154 du 5 décembre 2001 relatif à l'obligation de maintenance et au contrôle de qualité des dispositifs médicaux prévus à l'article L. 5212-1 du code de la santé publique (troisième partie : Décrets)[11]
c. Norme AFNOR XPS 99-170 publiée en septembre 2000, elle apporte les exigences et les recommandations nécessaires à la mise en place d'un système qualité pour la maintenance des dispositifs médicaux en priorité au sein du service biomédical d'un établissement de santé. Elle s'applique également aux autres acteurs tels que les fabricants, les distributeurs et les sociétés de maintenance. [12]
d. Directive européenne 98/79/CEE du 27 octobre 1998, elle spécifie dans son article 21 l'obligation de maintenance pour les dispositifs médicaux. [13]
e. Loi 98-535 du 1er juillet 1998 relative au renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits destinés à l'homme. Titre V Article 14 - Art L.665-5, l'exploitant est tenu de s'assurer du maintien des performances et de la maintenance du dispositif médical. [14]
f. Décret 96-32 du 15 janvier 1996 relatif à la matériovigilance exercée sur les dispositifs médicaux et fixant les missions des correspondants locaux : articles R.665-48 à R.665-64. [15]
g. Arrêté du 3 octobre 1995 relatif aux modalités d'utilisation et de contrôle des matériels et des dispositifs médicaux. [16]
h. Directive 93/42 CEE du 14 juin 1993 relative aux dispositifs médicaux. [17]B. Situation de la maintenance préventive des dispositifs de perfusion au Pôle Santé Sud
La maintenance préventive, le contrôle qualité et le test de sécurité électrique des dispositifs de perfusion du Pôle Santé Sud, sont actuellement réalisés annuellement sur site par une société de tierce maintenance.
Cette société est certifiée ISO 9001 : 2000[18] depuis 2003.
Après ses interventions sur les dispositifs médicaux du Pôles Santé Sud, elle fournit un cd rom qui contient les rapports d’intervention de chaque appareil vérifié.
A.Objectifs :
• Etudier l’internalisation de la maintenance préventive, le contrôle qualité et le test de sécurité électrique des dispositifs de perfusion au Pôle Santé Sud.
• Créer les protocoles de maintenance préventive, de contrôle qualité et de test de sécurité électrique.
• Avoir une réflexion sur les contrôles à effectuer après des maintenances curatives.B.Enjeux :
A terme cela permettra de :
• Rentabiliser les ECME déjà acquis par le service.
• Avoir une meilleure maîtrise des coûts de maintenance, enjeu majeur de l’internalisation.
• Avoir aussi une meilleure maîtrise grâce à une meilleure connaissance des dispositifs de perfusion.
La problématique est de bien évaluer les besoins humains, matériels et financiers pour réaliser la maintenance préventive, le contrôle qualité et le test de sécurité électrique en interne.
Cette évaluation est primordiale dans l’orientation d’une internalisation de la maintenance préventive.
Il faut que cette étude soit suffisamment documentée et argumentée pour apporter une aide à la prise de décision de la politique de maintenance à mener au Pôle Santé Sud.
Voici le processus de la méthodologie réalisé pour l’étude du projet.
Figure 2 : Processus de la méthodologie de l'étude
Au préalable, il faut distinguer dans cette étude les dispositifs du CMCM et du Tertre Rouge, et voir s’ils ont des intérêts communs.
La première étape consiste à lister les dispositifs médicaux de perfusion sous contrat de maintenance préventive avec la société de tierce maintenance, et de relever le montant de ces contrats au global et par établissements.
Le Pôle Santé Sud dispose de pompes volumétriques, de pousses seringue, de PCA (pousse seringue analgésique) et de pousses seringue d’anesthésie comme dispositifs de perfusion.
Le parc, de par l’historique, regroupement des deux cliniques avec leurs propres dispositifs médicaux, n’est pas homogène et est relativement ancien [Tableau 2].Tableau 1 : Liste des dispositifs médicaux de perfusion du PPS
Marque
Modèle
Désignation
Quantité Totale
Quantité CMCM
Quantité Tertre Rouge
Cardinal Health (Alaris)
PCAM
Pousse seringue analgésique
X
X
X
Cardinal Health (Alaris)
P6000 TIVA
Pousse seringue d’anesthésie
X
X
X
Arcomed
Syramed µSP6000
Pousse seringue
X
X
X
Arcomed
Volumed µVP5000
Pompe à perfusion
X
X
X
Arcomed
Volumed µVP5005
Pompe à perfusion
X
x
X
Arcomed
Syramed µSP6000 PCA
Pousse seringue analgésique
X
X
X
B Braun
Perfusor Compact
Pousse seringue
X
X
X
Graseby
3000
Pompe à perfusion
X
X
X
Graseby
G3300
Pousse seringue analgésique
X
X
X
Graseby
G3400
Pousse seringue
x
X
X
Graseby
G3500
Pousse seringue d’anesthésie
x
X
X
IDF
ID2S
Pousse seringue
x
X
x
Foures
Phoenix D
Pousse seringue
x
x
x
Foures
Phoenix M
Pousse seringue
x
x
x
Vial
Optima MS
Pompe à perfusion
x
x
x
Vial
Pilote C
Pousse seringue d’anesthésie
x
x
x
3M sante
Avi 200
Pompe à perfusion
x
x
x
3M sante
Avi 270
Pompe à perfusion
x
x
x
Total hors frais fixes
X
X
X
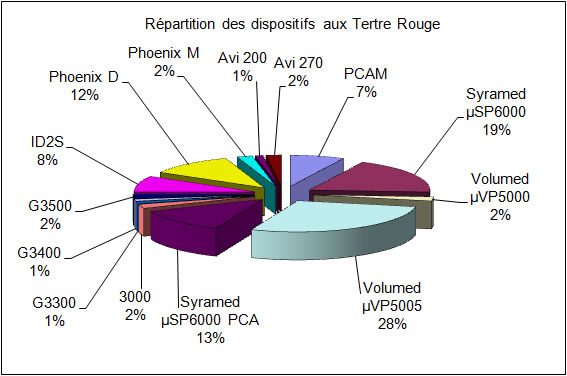
Il y a X dispositifs médicaux de perfusion répartis comme suit :
Figure 3 : Répartition des dispositifs de perfusion entre le CMCM le Tertre Rouge
Figure 4 : Répartition suivant les modèles au CMCM
Figure 5 : Répartition suivant les modèles au Tertre Rouge
Coût des contrats de la société de tierce maintenance :
Les coûts des contrats de maintenance annuels pour le CMCM et le Tertre rouge ne seront pas divulgués, ils sont CONFIDENTIELS. [19][20]
Ces contrats comprennent un forfait par appareil ( il existe deux forfaits différents suivant le type ou le modèle), les frais fixes d’intervention et l'option de remise à niveau. Les frais fixes comprennent les repas, le déplacement et l’hôtel, l’option de remise à niveau comprend la remise à niveau des appareils défectueux hors pièces détachées, ils sont calculés au prorata du nombre de DM sous contrat.
Pour la suite de l’étude il a été convenu avec l’ingénieur biomédical de ne pas prendre en compte, les appareils de marque IDF qui sont en attente de réforme et les appareils de marque Vial, Graseby et 3M qui sont en nombre insuffisant par rapport à l’investissement lié à leur maintenance. [Tableau 2]
La seconde étape consiste à définir le processus d’élaboration des protocoles de contrôle préventif, de contrôle qualité et de test de sécurité électrique.
Il est important de noter que pour les dispositifs médicaux de perfusion, la maintenance préventive se résume souvent à un contrôle qualité et à un test de sécurité électrique, aucun constructeur n’a de liste d’éléments critiques à remplacer, si ce n’est le changement périodique de la batterie.
Figure 6 : Logigramme du processus d'élaboration des protocoles
Détails du processus :
• Etudier la documentation des appareils de perfusion et des appareils de test (contacter les constructeurs ou les rechercher sur internet si elles ne sont pas présentes).
• Etudier les dispositifs médicaux [voir tableau 1], les appareils de test (pour la perfusion seuls sont concernés les testeurs de perfusion IDA 4 plus et le contrôleur de sécurité électrique ESA 620) et le logiciel ANSUR qui le pilote.
• Etudier les protocoles de contrôle de maintenance préventive, de contrôle qualité et de test électrique (contacter les constructeurs ou les rechercher sur internet s’ils ne sont pas présents). Si ces protocoles ne sont pas disponibles il faudra les créer, s'ils existent il faudra si besoin les adapter et ensuite les formaliser avec le logiciel ANSUR.
• Faire valider les protocoles par l’ingénieur biomédical.
La troisième étape consiste à réaliser le processus pour créer les protocoles. Le tableau récapitule les renseignements fournis par les constructeurs pour réaliser la suite de l’étude, apparaissent aussi les appareils non retenues dans l’étude.
Tableau 2 : Données réunies auprés des constructeurs
Marque |
Type d’équipement |
Nombre d’équipement CMCM/Tertre Rouge |
Année de mise sur le marché |
Périodicité des contrôles (mois) |
Changement des batteries (année) |
Formation du personnel faite |
Coût de formation €HT |
Coût du kit d’étalonnage €HT |
Temps de réalisation MP et CQ (minute) |
Protocole constructeur présent |
|
CARDINAL HEALTH ALARIS |
PCAM |
x |
x |
1994 |
12 |
2 |
NON |
x |
Outils de calibration x |
30 |
Protocole simplifié, le véritable fournit après formation |
CARDINAL HEALTH ALARIS |
P6000 TIVA |
x |
x |
1998 |
12 |
2 |
NON |
x |
30 |
||
ARCOMED |
SYRAMED SP6000 |
x |
x |
2000 |
24 ou 10 000 H |
4 ans maximum |
Oui pour deux Technicien |
Offerte |
PAS DE KIT |
45 |
OUI |
ARCOMED |
SYRAMED SP6000PCA |
x |
x |
2003 |
24 ou 10 000 H |
4 ans maximum |
Oui pour deux Technicien |
Offerte |
45 |
OUI |
|
ARCOMED |
VOLUMED VP5000 |
x |
x |
1998 |
24 ou 10 000 H |
4 ans maximum |
NON |
Offerte |
45 |
OUI |
|
ARCOMED |
VOLUMED VP5005 |
x |
x |
1998 |
24 ou 10 000 H |
4 ans maximum |
NON |
Offerte |
45 |
OUI |
|
B BRAUN |
PERFUSOR COMPACT |
x |
x |
1999 |
24 |
2 ans |
NON |
x |
Outils de calibration x |
20 sans test de débit (Technicien dépendant) |
OUI [Annexe 6 ] |
GRASEBY |
3000 |
x |
x |
2005 |
12 |
Pas de préconisation |
NON |
x |
Compresseur de labo, manomètre, régulateur de pression non fournit à trouver chez un fournisseur |
120 |
NON |
GRASEBY |
G3300 |
x |
x |
> 10 ans |
12 |
3 |
NON |
x |
Calibre de taille seringue x, Jauge d’ouverture chariot x et un micromètre pour test de débit x |
120 |
NON |
GRASEBY |
G3400 |
x |
x |
>10 ans |
12 |
3 |
NON |
x |
120 |
NON |
|
GRASEBY |
G3500 |
x |
x |
>10 ans |
12 |
3 |
NON |
x |
120 |
NON |
|
FOURES |
PHOENIX D |
x |
x |
1992 |
12 |
Pas de préconisation |
NON |
x |
Kit d’étalonnage x capteur d’effort x |
90 MP + 60 CQ |
OUI |
FOURES |
PHOENIX M |
x |
x |
1992 |
12 |
Pas de préconisation |
NON |
45 MP + 30 CQ |
OUI |
||
3M SANTE |
AVI 200 |
x |
x |
Pas d’information sur ce matériel (trop ancien) |
NON |
Pas d’information sur ce matériel (trop ancien) |
|||||
3M SANTE |
AVI 270 |
x |
x |
NON |
|||||||
En vert, les kits d’étalonnages nécessaires aux protocoles constructeurs pour le contrôle préventif concernant leurs appareils.
Plusieurs contraintes ont conduit à adapter et réécrire les protocoles par rapport aux ceux des constructeurs.
• L’absence au sein du service biomédical des kits d’étalonnage et des capteurs d’effort nécessaires aux mesures de contre pression [voir tableau 2]
• Le manque d’harmonisation des protocoles de contrôles des constructeurs (il n’existe aucune normalisation dans le domaine).
• Les informations quelquefois différentes d’une documentation à l’autre d’un même appareil.Certains ont été étoffés afin de les rendre plus exhaustifs. Des points de contrôles ont été ajoutés (le contrôle de la batterie n’étant pas toujours indiqué). Des valeurs ont été modifiées pour plus de cohérence (exemple la société Foures qui demande un test de débit à 100ml/h alors que les appareils sont limités à 99,9ml/h).
Deux constructeurs, FOURES et CARDINAL HEALTH préconisent un étalonnage systématique de leurs appareils lors de la maintenance préventive, cette procédure n’est pas prise en compte pour l’élaboration des protocoles, il faudra, si l’option d’étalonner est choisie, les modifier après la formation des techniciens biomédicaux en cas d’internalisation de la maintenance.Ci-dessous le tableau des valeurs modifiées par rapport aux données constructeur.
Tableau 3 : Récapitulatifs des valeurs modifiées par rapport aux données constructeur
Débit de test et tolérances relevées sur les documentations des constructeurs |
Débit de test d’occlusion et valeurs de pression ou force relevées sur les documentations des constructeurs |
Débit (ml/h) de test et tolérances retenues pour les protocoles |
Débit d’occlusions et valeurs de pression retenues pour les protocoles |
|
PCAM |
20ml/h |
20ml/h |
20±2% |
20ml/h plus déclenchement de bolus |
P6000 Tiva |
100ml/h |
100 ml/h |
25 ±2% |
100ml/h |
SYRAMED SP6000 |
25ml/h |
300 ml/h |
25 ±5% |
100ml/h |
SYRAMED SP6000PCA |
25ml/h |
300 ml/h |
25 ±5% |
25ml/h plus déclenchement de bolus |
VOLUMED VP5000 |
100ml/h |
400 ml/h |
100 ±3% |
400ml/h |
VOLUMED VP5005 |
100ml/h |
400 ml/h |
100 ±5% |
400ml/h |
PERFUSOR COMPACT |
Débit pas indiqué ±3% |
Pas de vitesse de débit donnée |
25 ±3% |
99,9ml/h
|
FOURES D/M ancienne génération |
100ml/h ( ? vitesse max 99,9)
|
30 ml/h |
25±3% |
99,9ml/h |
FOURES D/M (D-CP/M-CP) |
100ml/h ( ? vitesse max 99,9) |
30 ml/h |
25 ±3% |
99,9ml/h |
Les valeurs d’occlusions ont toutes été converties en mmHg pour pouvoir réaliser le contrôle avec le testeur IDA 4 plus.
Les valeurs de débit ont été fixées à 25 ml/h pour les pousses seringue dans un souci d’harmonisation entre toutes les marques, mais aussi pour accentuer la qualité des tests, en effet plus le débit est bas, plus ses déviations sont importantes et cela permet de mieux déceler s’il sort des tolérances.A l’issue de la réalisation du processus onze protocoles différents ont été réalisés et validés [voir un exemple en Annexe 7].
• Protocole PCAM (téléchargement)
• Protocole P6000 TIVA (téléchargement)
• Protocole Syramed SP6000(téléchargement)
• Protocole Syramed SP6000 PCA (téléchargement)
• Protocole Volumed VP 5000 (téléchargement)
• Protocole Volumed VP 5005 (téléchargement)
• Protocole Perfusor Compact (téléchargement)
• Protocole Phoenix D (téléchargement)
• Protocole Phoenix M (téléchargement)
• Protocole Phoenix D ancienne génération (téléchargement)
• Protocole Phoenix M ancienne génération(téléchargement)Les protocoles sont sous format rar, il faut les décompresser et les extraire dans un fichier avec un dezippeur (téléchargement).
Pour les utiliser il faut le logiciel Ansur (téléchargement). Une fois téléchargé, décompresser et extraire les fichiers, lancer l'autorun puis Install Ansur Executive et Install Ansur Plugin ESA620.
L'étude de la Fiche SNITEM (Syndicat National de l'Industrie des Technologies Médicales) de contrôle qualité des dispositifs de perfusion a été source d'inspiration pour la création des protocoles[21]
Ils ont été construits en suivant ce modèle.
Figure 7 : Contrôles effectués sur les dispositifs de perfusion

Deux points importants ont été définis pour la maintenance préventive au sein du Pôle Santé Sud :
• Les batteries seront changées tous les deux ans.
• Les contrôles préventifs seront réalisés une fois par an.
Les protocoles apporteront aussi une aide importante lors des maintenances curatives, il suffira de les suivre pour déceler les pannes des DM. Ils amèneront de la rigueur, tous les points critiques des dispositifs seront ainsi contrôlés et cela évitera de ne pas diagnostiquer des dysfonctionnements.
La quatrième étape consiste à réaliser les protocoles pour évaluer le temps des contrôles en interne pour chaque type d’appareils.
Tableau 4 : Temps de réalisation des protocoles par appareil
|
PCAM |
P6000 TIVA |
SYRAMED SP 6000 |
SYRAMED SP 6000 PCA |
VOLUMED VP 5000/VP 5005 |
Perfusor Compact |
PHOENIX D ancienne et nouvelle génération |
PHOENIX M ancienne et nouvelle génération |
Temps donné par les sociétés d’après leurs protocoles (mn) |
30 |
30 |
45 |
45 |
45 |
20 |
90 MP (avec étalonnage) plus 60 CQ |
45 MP (avec étalonnage) plus 30 CQ |
Temps réalisé en suivant les protocoles internes (mn) |
60 |
60 |
60 |
60 |
60 |
60 |
60 |
60 |
A titre d’information apparaissent dans le tableau ci-dessus les temps mis par les techniciens des sociétés à réaliser les maintenances préventives. On remarque d’importantes variations de ces temps suivant les marques du fait de protocoles complètements différents d’un constructeur à l’autre. Les temps diffèrent aussi de ceux réalisés en interne du fait que les protocoles ont été réévalués.
Dans ces temps, ne sont pas n’inclus la durée des tests de débit et de batterie, car ils ne nécessitent pas la présence du technicien. Cela permet à celui-ci, de gérer d’autres interventions pendant que les tests se déroulent.
L’harmonisation des protocoles internes permet d’avoir des temps quasiment identiques pour tous les dispositifs. Pour éviter une sous estimation des coûts, les temps ont été légèrement majorés et ramenés à soixante minutes pour tous les appareils, en effet les tests restent technicien dépendant et n’ont été effectués que par une seule personne lors de l’évaluation.
Il sera nécessaire de rajouter trente minutes par appareil, ces minutes correspondent au temps de récupération et de restitution des dispositifs de perfusion auprès des services.
D’après ces données, le temps d’une maintenance préventive, d’un contrôle qualité et d’un test de sécurité électrique réalisé au sein du PPS est de quatre vingt dix minutes par appareils.
La cinquième étape consiste à évaluer les coûts de réalisation de la maintenance en interne.
Il n’y a pas besoin d’investir en ECME pour réaliser les contrôles en interne, le testeur de perfusion IDA 4 et le testeur de sécurité électrique ESA 620, utiles pour les contrôles tels qu’ils ont étaient définies dans les protocoles, sont présent au Pôle Santé Sud.
Les investissements supplémentaires sont le coût de formation des techniciens biomédicaux chez les constructeurs, le coût du technicien qui réalise les contrôles et les kits de calibration.
Investissements en formation et en kits [Tableau2]
CONFIDENTIEL
Coût de maintenance préventive annuelle fait en interne
Le coût de maintenance annuel pour un DM est le taux horaire moyen d’un technicien multiplié par le temps d’une maintenance : Ce coût étant CONFIDENTIEL il ne sera pas divulgué.
La sixième étape consiste à comparer les coûts de maintenance externe et de maintenance interne.
Dans le coût de maintenance externe sont retirés les appareils de marque Graseby, IDF, Vial et 3M, ceux-ci n’entrant pas en ligne de compte dans l’étude (voir première étape de l’étude).
Il a fallu enlever trois appareils pour le CMCM et dix sept appareils pour le Tertre Rouge.
Pour le calcul des frais fixes une règle de trois a été appliquée, les nouveaux frais fixes sont égales aux anciens frais fixes multipliés par le nombre de DM réduit et divisés par le nombre de DM total.Il faut rajouter pour la première année les coûts de formations et le coût des kits de maintenance.
Les chiffres étant soumis à confidentialité, voici les resultats sous graphique, des économies réalisées en internalisant la maintenance. Ils sont exprimés en pourcentage :Figure 8 : Economies réalisées en pourcentage
La première année il y a une économie de 28,8% pour le CMCM et 26,6% pour le Tertre Rouge, les années suivantes 59,8% pour le CMCM et 58,7% pour le Tertre Rouge.
Pour compléter l’étude il faut mettre en avant le temps qu’il faudra libérer pour un technicien à réaliser le préventif, comme vu précédemment ce temps sera d’une heure trente multiplié par le nombre d’équipement qui est de 211 :
Ce qui donne : 316,5 heures reparties comme suit 168 heures pour le CMCM et 118,5 heures pour le Tertre Rouge.
Sachant que le temps annuel d’un technicien est de 1820 heures cela correspond à 0,174 équivalent temps plein.
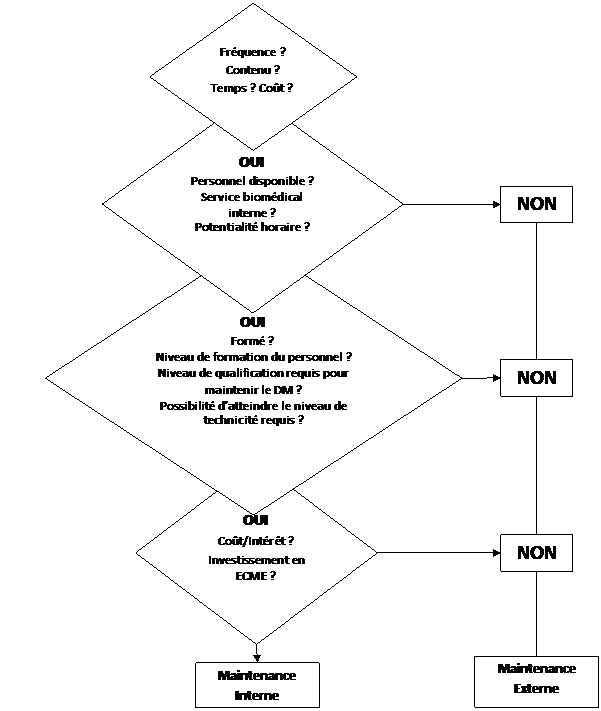
La dernière étape est la phase décisionnelle.
Cette phase décisionnelle concerne les Directions du CMCM et du Tertre Rouge en concertation avec l’ingénieur biomédical. Voici les questions que les décideurs doivent se poser, et auxquels ce rapport tente d’apporter des réponses :
Figure 9 : Processus décisionnel [22]
L’étude démontre un gain financier important en cas d’internalisation de la maintenance préventive au sein du Pôle Santé Sud. Cependant il faut avoir une vision globale avant de prendre une décision.
Pour que cela soit possible il faudra, soit libérer les techniciens de tâches administratives tel que la gestion de l’instrumentation du bloc opératoire, soit recruter un nouveau technicien.
Celui-ci n’étant occupé qu’un jour par semaine, le coût de son embauche pourrait être compensé en menant une politique de maintenance préventive interne sur d’autres équipements mais aussi par les économies déjà réalisées.
Les protocoles élaborés pendant cette étude apporteront une aide aux techniciens biomédicaux du Pôle Santé Sud. Ils pourront être réalisés aussi bien pour le contrôle préventif que pour le contrôle curatif des dispositifs de perfusion. En les appliquant aussi lors des maintenances curatives, les techniciens contrôleront tous les points critiques, cela permettra de diagnostiquer des dysfonctionnements et de déceler plus rapidement la cause des pannes. Le test de sécurité électrique inclus aux protocoles sera aussi réalisé lors des contrôles curatifs. Tous les tests réalisés garantiront la sécurité du patient.
L’intérêt de ce projet, au delà de l’étude financière, est la réalisation des protocoles, qui auront un impact sur la manière d’aborder la maintenance préventive et curative des dispositifs de perfusion, au Pôle Santé Sud Le Mans.
Etant technicien dans la fonction publique, ce stage m’a permit de voir le fonctionnement d’une structure privée, et de le comparer avec celui de l’hôpital où je suis salarié.
Je me suis enrichi des points forts du service biomédical, tel que la parfaite exploitation de la GMAO mais aussi par la grande rigueur et le professionnalisme qu’insuffle Mme Ayraud. J’ai pu aussi par le sujet de mon étude, découvrir et utiliser de nouveaux outils, tel que le logiciel ANSUR, la GMAO Optim et une gamme d’ECME très complète.
Le travail effectué lors de ce stage me sera très précieux, et je pourrai le mettre en application dans mon établissement.
AFNOR : Association Française de NORmalisation
CMCM : Centre Médico-Chirurgical du Mans
COFRAC : COmité FRançais d’ACcréditation
CQ : Contrôle Qualité
DM : Dispositif Médical
ECME : Equipement de Contrôle, de Mesure et d’Essai
GMAO : Gestion de Maintenance Assistée par Ordinateur
ISO : Organisation Internationale de Normalisation
MP : Maintenance Préventive
PCA : Patient Controlled Analgésia
PSS : Pôle Santé Sud
TSE : Test de Sécurité Electrique
Bibliographie
[1] Livret d’accueil 2009 CMCM
[2] Livret d’accueil 2009 du Tertre Rouge
[3] http://www.universalis.fr/ consulté le 24 avril 2009
[4] Règlement intérieur du GCS version 2
[5] Fiche de fonction du technicien de maintenance biomédicale version 02 du PSS
[6] http://www.chauvin-arnoux.com/ consulté le 04 mai 2009
[7] http://www.industrie.gouv.fr/ consulté le 05 mai 2009
[8] Guide des bonnes pratiques biomédicales hospitalières ITMB-RBM Ed.Elsevier (http://www.utc.fr/~farges/bonnes_pratiques/)
[9] AFSSAPS (http://www.afssaps.fr/Produits-de-sante/Dispositifs-medicaux)
[10] http://www.legifrance.gouv.fr/ consulté le 16 avril 2009
[11] http://www.legifrance.gouv.fr/ consulté le 16 avril 2009
[12] http://www.alliance-biomedicale.fr/ consulté le 16 avril 2009
[13] http://admi.net/ consulté 1e 16 avril 2009
[14] http://www.legifrance.gouv.fr/ consulté le 16 avril 2009
[15] http://www.sante.gouv.fr/ consulté 16 avril 2009
[16] http://www.sante.gouv.fr/ consulté le 16 avril 2009
[17] http://admi.net/consulté le 16 avril 2009
[18] http://www.iso.org/ consulté le 16 avril 2009
[19] Contrat de maintenance préventive n°8E7201-1 passé entre le CMCM et la société de tierce maintenance
[20] Contrat de maintenance préventive n°9E7202 passé entre la clinique du tertre rouge et la société de tierce maintenance
[21] Fiche SNITEM ( http://www.snitem.fr/documents/telecharge/15_perfusion.pdf) consulté le 18 avril 2009
[22] Guide pratique Maintenance des dispositifs médicaux Conception-Réalisation : DRASS Midi-Pyrénées-mars 2005 (http://www.midipy.sante.gouv.fr/) consulté le 21 avril 2009
Images
[Image 1] http://www.vastell.com/ consulté le 17 avril 2009
[Image 2] http://www.technologies-biomedicales.com/ consulté le 17 avril 2009
[Image 3] http://global.flukebiomedical.com/ consulté le 17 avril 2009
[Image 4] http://www.technologies-biomedicales.com/ consulté le 17 avril 2009
[Image 5] http://www.rigelmedical.com/products/ consulté le 17 avril 2009
[Image 6] Image prise par l'auteur
Figures
[Figure 1] Organigramme hiérarchique du service biomédical
[Figure 2] Processus de la méthodologie de l'étude
[Figure 3] Répartition des dispositifs de perfusion entre le CMCM le Tertre Rouge
[Figure 4] Répartition des DM suivant les modèles au CMCM
[Figure 5] Répartition des DM suivant les modèles au Tertre Rouge
[Figure 6] Logigramme du processus d'élaboration des protocoles
[Figure 7] Contrôles effectués sur les dispositifs de perfusion
[Figure 8] Economies réalisées en pourcentage
[Figure 9] Processus décisionnel
Tableaux
[Tableau 1] Liste des dispositifs médicaux de perfusion du PPS
[Tableau 2] Données réunies sur les DM auprés des constructeurs, concernant la maintenance préventive
[Tableau 3] Récapitulatifs des valeurs modifiées par rapport aux données constructeur
[Tableau 4] Temps de réalisation des protocoles par appareil
Perfusorâ compact
HOSPITAL CARE Fiche de contrôle de qualité
Pour effectuer le contrôle de qualité, se conformer à la notice d’utilisation et à la notice technique. Ce contrôle est à effectuer tous les 24 mois.
Les accessoires utilisés et leurs documents d’accompagnement doivent être inclus dans la procédure de test. Toutes les valeurs mesurées doivent
être documentées. N’utiliser que des équipements de test étalonnés.
Client
Numéro de série
Référence
8714827
0086031M
Numéro de dossier SAP
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
1. Inspection visuelle
(propreté, intégrité, dommages)
verrous et supports de seringue, détecteur de présence piston
clavier
connecteur secteur, cordon secteur, contacts
MFC (Multi-fonction-connecteur)
cordon et connecteur
piles/batterie rechargeable
compartiment et contacts
pieds caoutchouc
support noix de fixation
barrettes d’assemblage
cache vis
verrou de seringue, chariot
Case cochée = OK
2. Contrôle fonctionnel
Mettre l’appareil sous tension
auto-test écran et test de l’alarme sonore
renvoi alarme
(avec clé de service MFC)
concordance valeur programmée/affichée
auto-test en mode batterie ou pile
affichage d’état :
000 b avec des piles
xxx A avec une batterie
alarme du verrou de piston de seringue
alarme du verrou de corps de seringue
3. Pression d’occlusion
Utiliser la jauge de test 7701616
Mesure des pressions
niveau 1 < 40 N
niveau 2 < 59 N
niveau 3 < 75 N
4. Seringues
présence et lisibilité liste seringues sous l’appareil
tous les codes seringues peuvent être programmés
5. Contrôle sécurité électrique
Selon IEC/EN 60601-1
voir Résultats des Tests / doc. Joint
6. Vérification des accessoires
MFC, batterie, renvoi d’alarme, etc….
7. Contrôle de débit
voir Graphe / doc. Joint
Résultat du contrôle :
Dysfonctions / dommages mettant en danger le patient, l’utilisateur ou l’environnement
non
oui, actions correctives requises : réparation / maintenance
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Remarques, documentations :
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Copier et ajouter au dossier de suivi de l’équipement
Contrôle effectué par :
……………………………….
Date / signature
Date prochain contrôle
…………………………….
Etabli par C. Morèle et C. Menut Vuillemin, le 17/02/2004