|
Avertissement
|
Si vous arrivez
directement sur cette page, sachez que ce travail est
un rapport d'étudiants et doit être pris comme tel. Il
peut donc comporter des imperfections ou des
imprécisions que le lecteur doit admettre et donc
supporter. Il a été réalisé pendant la période de
formation et constitue avant-tout un travail de
compilation bibliographique, d'initiation et d'analyse
sur des thématiques associées aux technologies
biomédicales. Nous ne
faisons aucun usage commercial et la duplication
est libre. Si vous avez des raisons de contester
ce droit d'usage, merci de nous
en faire part . L'objectif de la
présentation sur le Web est de permettre l'accès à
l'information et d'augmenter ainsi les échanges
professionnels. En cas d'usage du document, n'oubliez
pas de le citer comme source bibliographique. Bonne
lecture...
|
|
État des lieux et
préconisations de maintenance au laboratoire
d’assistance médicale à la procréation en vue de
l’accréditation selon la norme NF EN ISO
15189
|

|

Matthieu
PAROIS |
|
|
|
|
RÉSUMÉ
Dans un contexte de
réforme de la biologie médicale, le gouvernement
oblige tous les laboratoires à se faire accréditer par
le COFRAC selon la norme NF EN ISO 15189 d’ici le 1er
novembre 2020.
L’objectif de ce stage à été d’apporter une pierre à
l’édifice en faisant un inventaire complet des
équipements du laboratoire d’assistance médicale à la
procréation et en listant les préconisations de
maintenance, de métrologie et de contrôles
réglementaires.
Ces éléments doivent concourir à l’élaboration du
planning de maintenance exigé par la norme.
Mots clés : Laboratoire, accréditation,
qualité, biologie médicale.
|
ABSTRACT
In a context of a
medical biology reform, the government makes
compulsory for all the laboratories to be accredited
by the COFRAC, under the NF EN ISO 15189 standard
before the 1st of november 2020.
The aim of this internship was to contribute to the
process by doing a complete inventory of the medical
assistance procreation laboratory's equipments and by
listing the maintenance and metrology recommendations,
so as the regular controls.
These elements must contribute to the development of
the maintenance schedule required by the standard.
Key words : Laboratory, accreditation,
quality, medical biology.
|
Remerciements
Je tiens à remercier l’ensemble des
personnes qui m’ont permis de réaliser ce stage, en
particulier :
- Madame Anne-Laure
GILLIER, ingénieur biomédical, pour son dynamisme, sa
disponibilité et pour m’avoir accueilli au sein de son
service.
- Madame Marie-Laure LANGLOIS, docteur en biologie
médicale et responsable du centre d’aide médicale à la
procréation pour m’avoir fait découvrir son métier.
- Madame Virginie DUVEAU, technicienne de laboratoire, pour
son accueil et son professionnalisme.
- Monsieur Quentin PICHAUD, technicien biomédical, pour son
accueil et son soutien.
- L’ensemble du personnel de la clinique Jules Verne pour leur
hospitalité.
- Monsieur Pol-Manoël FELAN, responsable pédagogique de la
formation ABIH, pour ses conseils lors de sa visite de suivi.
Sommaire
GLOSSAIRE
INTRODUCTION
1. PRÉSENTATION DE LA STRUCTURE
D’ACCUEIL
a) Historique
b)
Activité
c) Contexte
d) Problématique
2. ENJEUX ET OBJECTIFS
a) Pourquoi un laboratoire doit se
faire accréditer
?
b) Quel est l’intérêt pour le patient ?
c) Quels sont les enjeux pour
l’établissement de santé si le laboratoire n’est pas
accrédité
?
3. ÉTAT DES LIEUX DU LABORATOIRE
D’ASSISTANCE MÉDICALE A LA PROCRÉATION
a) Présentation du laboratoire
b) Démarche du projet
4.
BILAN
5. CONCLUSION
BIBLIOGRAPHIE
LISTE DES FIGURES
ANNEXE
GLOSSAIRE
:
AMP/PMA : Aide Médicale à la Procréation/Procréation
Médicalement Assistée.
CIVG : Centre d’Interruption Volontaire de Grossesse
CHU: Centre Hospitalier Universitaire
COFRAC : COmité FRançais d’ACcréditation
DM : Dispositif Médical
EA : European cooperation for Accreditation
FIV : Fécondation In Vitro
GBEA : Guide de Bonne Exécution des Analyses médicales
HPST : Hôpital, Patient, Santé et Territoire
ICSI : Intra Cytoplasmic Sperm Injection
ILAC : International Laboratory Accreditation Cooperation
ISO : International Organization for Standardization
LBM : Laboratoire de Biologie Médicale
MCO : Médecine Chirurgie Obstétrique
SBM : Service Biomédical
SI : Système International
INTRODUCTION :
Afin de garantir la qualité des soins
délivrés aux patients, la législation relative à la biologie
médicale impose depuis l'ordonnance du 13 janvier 2010
(adoptée par la loi du 30 mai 2013) la mise en place de
l'accréditation de tous les laboratoires de biologie médicale
(LBM) en France. Tous les LBM, publics et privés doivent être
accrédités par le Comité Français d’Accréditation (COFRAC) sur
la totalité de leur activité au plus tard le 1er novembre
2020, date à laquelle le régime des autorisations
administratives prend fin.
Le référentiel utilisé pour cette démarche
d’amélioration continue de la qualité est la norme NF EN ISO
15189 [8] fixant les
« exigences concernant la qualité et la compétence » des LBM.
Ce stage a été effectué à la clinique Jules Verne à
Nantes (44) dans le cadre de la Certification professionnelle
d’Assistant Biomédical en Ingénierie Hospitalière de
l’Université de Technologie de Compiègne. Cette certification
a pour but de former des futurs techniciens biomédicaux.
L’objectif de ce stage sera donc d’accompagner le
laboratoire d’AMP dans la démarche d’accréditation en faisant
un état des lieux des équipements du laboratoire et en listant
les préconisations de maintenances et contrôles réglementaires
afin de répondre aux exigences de la norme NF EN ISO 15189. Il
s’agira également de lister les prestataires de maintenances
susceptibles de réaliser ces opérations.
1. PRÉSENTATION
DE LA STRUCTURE D’ACCUEIL :
a) Historique
:
La clinique Jules Verne [12] s’ouvre en mai 2004.
Elle est le résultat de la fusion de deux établissements
privés de la région nantaise : la clinique de la Haute Forêt
et la clinique de l’Espérance et deux centres appartenant au
groupe des mutuelles de Loire-Atlantique : les cliniques de
Mellinet et de St Sébastien sur Loire.
Ce projet de regroupement souhaité par l’Agence
Régionale de l’Hospitalisation (ARS) permet d’améliorer la
prise en charge des patients de l’Est de Nantes et de créer le
quatrième pôle hospitalier de l’agglomération. Son périmètre
d’action est supérieur à celui des quatre cliniques avec le
même nombre de lit.
La Clinique Jules Verne est membre du Groupe Hospitalier
de la Mutualité Française (GHMF), réseau de santé privé
d’hospitalisation à but non lucratif. Elle
appartient au réseau de santé de la mutuelle nationale :
Harmonie Mutuelle.
Les médecins qui exercent dans les différents secteurs
de la clinique forment une seule et même communauté médicale.
Ils mettent leurs talents et leur expertise en commun pour
élaborer un projet médical ambitieux et offrir à la population
de l’est de l’agglomération nantaise, avec l’ensemble des
professionnels de l’établissement, une prise en charge de
qualité dans des espaces confortables et fonctionnels et avec
un plateau technique moderne et performant.
Situation géographique :
|
Figure 1: Situation
géographique de la clinique Jules Verne
|
La clinique Jules Verne est située au nord est de
Nantes. Elle est desservie par la route de Paris qui est une
des grandes artères de la ville. Facile d’accès, la clinique
Jules Verne s’étend sur une surface de 28000 m² et possède une
capacité d’accueil de 318 lits, ce qui en fait le quatrième
pôle de santé de l’agglomération Nantaise. Elle possède
également un centre de soins de suite et de réadaptation
délocalisé situé au sud-est de la ville, à Saint Sébastien sur
Loire.
b)
Activité :
La clinique Jules Verne est un établissement de santé
pluridisciplinaire de type MCO (Médecine, Chirurgie,
Obstétrique) et SSR (Soins de Suite et de Réadaptation).
Le laboratoire d’analyses médicales et le service
d’imagerie sont des services privés n’appartenant pas à la
clinique mais présents dans le bâtiment pour permettre, avec
toutes les spécialités de la clinique, une prise en charge
globale du patient.
Un second laboratoire est présent sur le site de la
clinique, celui du service d’Assistance Médicale à la
Procréation (AMP).
Ce laboratoire est une antenne du Centre Hospitalier
Universitaire (CHU) de Nantes. C'est-à-dire que le laboratoire
appartient à la clinique Jules Verne mais que l’agrément
délivré par l’Agence Régionale de Santé (ARS) pour exercer
l’assistance médicale à la procréation est détenu par le CHU
de Nantes.
La clinique possède également un centre de soins de
suite et de réadaptation délocalisé et situé à Saint Sébastien
sur Loire.
La clinique Jules Verne propose les spécialités
suivantes :
• Chirurgie : Digestive,
Oto-rhino-laryngologique, orthopédique et traumatologique du
sport, plastique, reconstructrice et esthétique,
stomatologique, gynécologique, pathologie du sein, vasculaire,
urologique, proctologique, générale.
• Médecine : Anesthésie, réanimation,
angiologie, cardiologie, endocrinologie, diabétologie,
maladies métaboliques, gastro-entérologie et hépatologie,
médecine physique, neurologie, pneumologie, rhumatologie,
médecine polypathologique, Soins de Suite et de Réadaptation
(SSR).
• Cancérologie (en coopération avec le Centre
Catherine de Sienne): Consultations et hospitalisation de jour
de chimiothérapie, consultations de radiothérapie.
• Femme et enfant : Assistance Médicale à la
Procréation – Fertilité, préparation à la naissance,
obstétrique, pédiatrie néonatale, échographie - Diagnostic
anténatal, gynécologie médicale, centre de planification
familiale et d’Interruption Volontaire de Grossesse (IVG),
addictologie.
• Soins de support : Consultation d'éthique
clinique, consultations d'annonce et d'accompagnement,
consultations en diététique, service social, psychologues.
• Secteur médico-technique : Imagerie médicale
(groupe IRIS-GRIM), laboratoire de biologie médicale
(Bioliance), équipe opérationnelle d'hygiène, pharmacie.
Voici comment sont réparties les ressources de la
clinique :
La clinique Jules Verne :
Les équipes :
• 770 professionnels (Clinique Jules Verne
et la maternité) dont 132 médecins
• Plus de 30 spécialités
Les équipements :
• 160 lits de chirurgie hospitalisation
complète
• 84 places de chirurgie ambulatoire
• 18 lits de médecine
• 9 lits de surveillance continue
• 7 places d’hospitalisation de jour dédiées à la
réalisation des protocoles de chimiothérapie
• 90% de chambres individuelles
• 22 salles d’opération
• 2 salles d’intervention en soins externes
• 3 salles de surveillance post-interventionnelle
L’activité :
• 150 interventions chirurgicales par jour
• 42 000 séjours par an
• 68 000 consultations par an
• 52% des séjours pris en charge en ambulatoire
• 3 500 séjours de cancérologie par an
La Maison de la naissance – Maternité de la Clinique
Jules Verne :
Les équipes :
• 112 professionnels dont 11 gynécologues
obstétriciens, 6 pédiatres et 40 sages-femmes
Les équipements :
• 9 salles de naissance
• 50 lits à la maternité
• 1 unité de néonatologie niveau de 2 A comptant 6
lits
• 1 centre d’Interruption Volontaire de Grossesse et
de planification familiale
L’activité :
• 3 300 accouchements par an
• 3 500 séjours par an
• 23 500 consultations par an
• Moins de 500 césariennes par an soit 13% des
accouchements
• 81% : taux de péridurale sur le nombre total
d’accouchements par voie basse
• 15% : taux de sorties précoces à domicile
• 59% : taux d’allaitement maternel en sortie de
maternité
La préparation à l’accouchement :
- Préparation globale, sophrologie, préparation
ballon «Autour de la naissance»,
Aquatique prénatale, Chant prénatal.
L’Assistance Médicale à la Procréation –
Fertilité :
• 390 séjours par an
• 3 300 consultations par an
• Un laboratoire d’Assistance Médicale à la
Procréation (AMP)
Le Centre de Planification et Centre IVG «Clotilde
Vautier» :
• 2 235 consultations
Le Centre de Soins de Suite et de Réadaptation :
Les équipes :
• 67 professionnels dont 4 médecins
Les équipements :
• 85 lits dont 4 lits identifiés de soins
palliatifs
• 2 salles de Kiné
• 91% de chambres individuelles
• 2 salles à manger, 1 salon des familles
L’activité :
• 750 séjours par an
• 29 580 journées d’hospitalisation complète par an
c)
Contexte :
Quatrième pôle de santé de la région Nantaise, la
clinique Jules Verne offre un parcours de soins complet grâce
à une activité pluridisciplinaire dont l’objectif est une
prise en charge globale du patient.
Forte d’une dynamique d’amélioration continue de la
qualité des soins délivrés aux patients, la clinique Jules
Verne s’est fait certifiée en mai 2014 par la Haute Autorité
de Santé (HAS v2010) [10].
Cette nouvelle version (troisième) doit permettre notamment de
donner une information claire au public, aux autorités de
tutelles mais aussi aux autres établissements de santé sur :
• La mesure du niveau de qualité et de
sécurité des soins de l’établissement
• Le niveau d’engagement de l’établissement dans les
actions d’amélioration de la qualité et de la sécurité des
soins
De façon générale, la certification de la HAS déployée
en France depuis 2010 a joué et continue de jouer un rôle
essentiel dans le développement de la qualité et de la
sécurité dans les établissements de santé. Elle a eu un impact
significatif sur la structuration et l’organisation des
démarches d’amélioration de la qualité, la mise en place de
bonnes pratiques professionnelles.
Toujours dans la démarche d’amélioration continue de la
qualité des soins délivrés aux patients, le gouvernement à
rendu obligatoire, par la loi du 30 mai 2013, l’accréditation
de tous les laboratoires de biologie médicale (article L6221-1
du code de la santé public [3])
selon les exigences de la norme NF EN ISO 15189 et en respect
de l’arrêté du 26 novembre 1999 [4] relatif au Guide des Bonnes Exécutions
d’Analyses (GBEA).
La réforme de la biologie médicale a pour objectif de
permettre à chacun d’avoir accès à des examens de qualité
prouvée, payés à leurs justes prix et ce dans un cadre
européen.
Définitions :
La biologie médicale est une spécialité médicale
dont le but est avant tout la réalisation d’examens permettant
de mesurer les différents constituants des liquides
biologiques (sang, urine, liquide céphalo-rachidien…). La
valeur des résultats des examens varie selon l’âge, l’état du
patient, certains constituants n’existent qu’en cas de
pathologie.
Les examens réalisés permettent de déceler ou de
concourir à l’identification d’une maladie. On considère que
la biologie médicale contribue actuellement à environ 60-70%
des diagnostics réalisés.
Elle joue également un rôle primordial dans le suivi
d’une maladie et la surveillance d’un traitement.
L'accréditation est une procédure d'évaluation
externe à l'établissement de santé, effectuée par des
professionnels, indépendante de l'établissement et de ses
organismes de tutelle, évaluant l'ensemble de son
fonctionnement et de ses pratiques.
Auparavant, l’accréditation des laboratoires était de
nature volontaire. Le Comité Français d’Accréditation (COFRAC)
accréditait sur demande les laboratoires d'analyses de
biologie médicales selon un référentiel qui leur est propre :
l’arrêté du 26 novembre 1999 relatif au GBEA.
Créé en 1994, le COFRAC a été désigné comme unique
instance nationale d’accréditation par le décret du 19
décembre 2008, reconnaissant ainsi l’accréditation comme une
activité de puissance publique. Il s’est doté le 1er octobre
2009 d’une section Santé Humaine, essentiellement dédiée, à
l’accréditation des LBM selon la norme NF EN ISO 15189. Cette
accréditation est une reconnaissance des compétences
techniques du laboratoire.
Par ailleurs, depuis 2011, un laboratoire de biologie
médicale qui souhaiterait ouvrir ses portes ne pourra pas
invoquer de délai et devra être accrédité à l'ouverture.
De plus, le COFRAC étant signataire des accords de
reconnaissance de l’European cooperation for Accreditation
(EA) et de l’International Laboratory Accreditation
Cooperation (ILAC) [11],
cela assure à l’accréditation du laboratoire d’être reconnue
de la même façon dans tous les pays tiers signataires de ces
accords.
Rappel
chronologique :
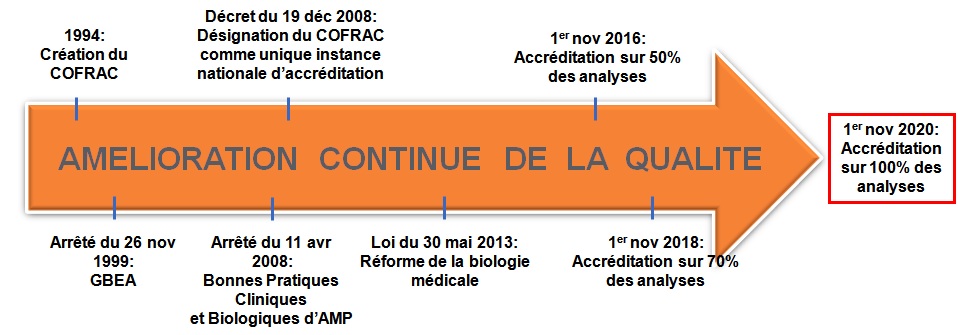
|
Figure 2:
Chronologie sur l'accréditation des laboratoires
|
Le
référentiel d’accréditation des laboratoires : la norme NF
EN ISO 15189
La norme NF EN ISO 15189 est une norme internationale
publiée par l’ISO en 2003 (révisée en 2007 et 2012) qui
spécifie les exigences de qualité et de compétence propres aux
laboratoires de biologie médicale. Cette norme est spécifique
aux Laboratoires de Biologie Médicale à la différence de la
norme ISO/CEI 17025 (dont elle est dérivée) qui concerne
les laboratoires d'essais. Le système de management de la
qualité est fondé sur la norme ISO 9001 et doit prendre en
compte les nombreuses exigences réglementaires liées au
secteur de la biologie médicale.
Cartographie
des processus de la norme NF EN ISO 15189:
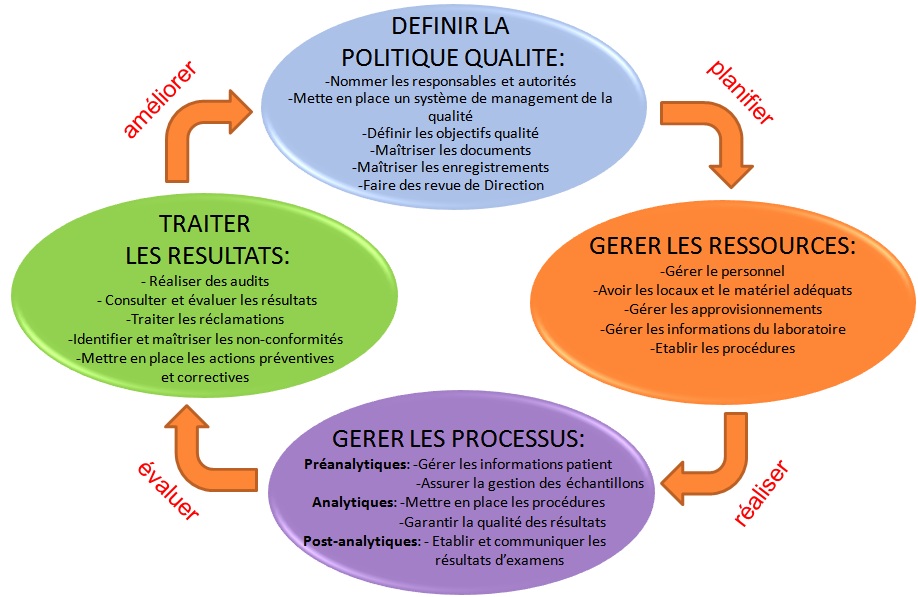
|
Figure 3: Cycle
d'amélioration continue de la qualité au laboratoire
|
retour
sommaire
d)
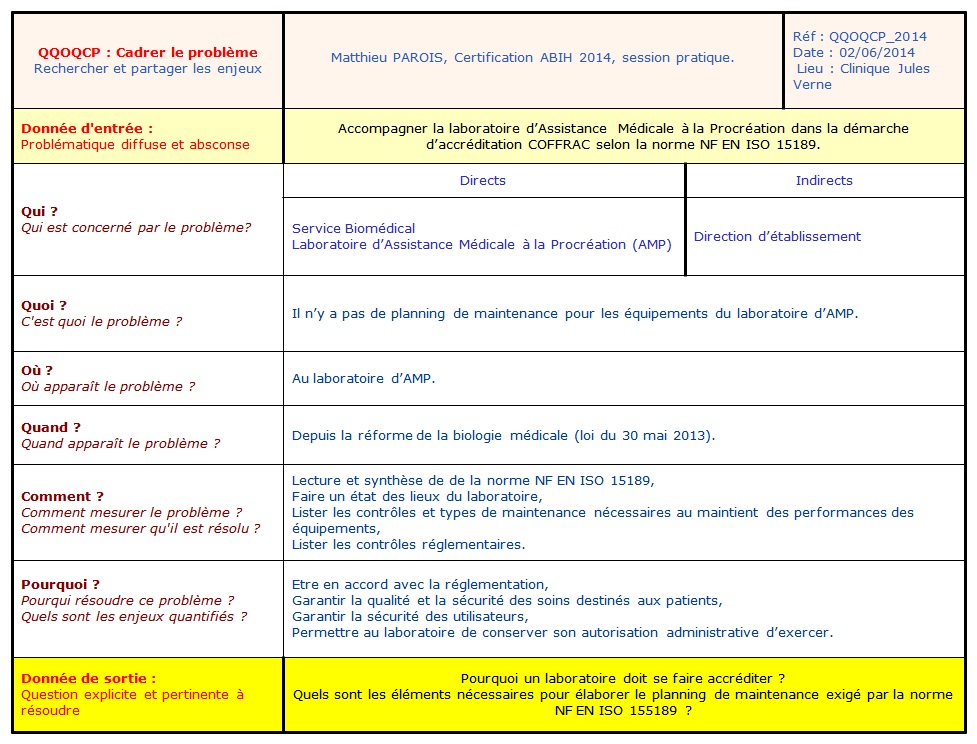
Problématique :
Afin de cadrer la problématique et
pouvoir proposer un livrable au laboratoire pour
l’accompagner dans la démarche d’accréditation, un
outil qualité a été utilisé.
Cet outil qualité, appelé QQOQCP (Qui, Quoi, Où,
Quand, Comment, Pourquoi) permet la résolution de
problème. Cela consiste à répondre à 6 questions
essentielles pour clarifier une problématique diffuse.
Ce QQOQCP a permis d’obtenir deux questions importantes
pour déterminer les enjeux de l’accréditation et les
objectifs de ce stage :
- Pourquoi un laboratoire doit se faire
accréditer ?
- Quels sont les éléments nécessaires pour
élaborer le planning de maintenance exigé par la
norme NF EN ISO 15189 ?
2. ENJEUX ET OBJECTIFS:
a) Pourquoi un laboratoire doit se
faire accréditer ?
Cette démarche d’amélioration continue de la qualité est
établie dans le seul intérêt du patient [18].
Elle permet notamment :
• D’optimiser le fonctionnement du
laboratoire
• De favoriser la reconnaissance de la compétence
auprès des patients, des cliniciens, des instances et de
l’industrie des produits de santé
• D’avoir une reconnaissance des pairs en terme
de savoir faire
• De garantir la qualité des examens
• D’obtenir ou de conserver l’autorisation
administrative d’exercer
b) Quel est l’intérêt pour le patient ?
La qualité au laboratoire peut être définie comme la
justesse, la fiabilité des résultats d’analyses. Les résultats
d’examens doivent être aussi précis que possible. Tous les
aspects des activités de laboratoire doivent être fiables et
le rendu des résultats doit être correct afin d’être utilisé à
des fins cliniques ou de santé publique.
Lorsque des analyses sont pratiquées, il existe toujours
un certain degré d’inexactitude. Le défi est de réduire autant
que possible le niveau d’inexactitude, en tenant compte des
limites des systèmes d’analyse. Un niveau d’exactitude de 99%
peut apparaître à première vue comme acceptable, mais le 1%
d’erreur en découlant peut devenir particulièrement grand dans
un système dans lequel de nombreux événements se produisent,
cas typique du laboratoire d’analyse.
Les laboratoires produisent des résultats d’analyses qui
sont largement utilisés à des fins cliniques ou de santé
publique, et les bénéfices pour la santé dépendent de la
justesse de ces analyses et du rendu des résultats.
Si des résultats inexacts sont rendus, les conséquences
peuvent être graves :
• Traitements inutiles
• Complications du traitement
• Traitement inapproprié
• Retard dans l’établissement d’un diagnostic correct
• Analyses supplémentaires et inutiles
Ces conséquences entraînent une augmentation en coût, en
temps, en ressources humaines et n’apportent aucun bénéfice au
patient.
Dans le but d’atteindre le plus haut niveau d’exactitude
et de fiabilité, il est essentiel d’exécuter tous les
processus et les procédures au laboratoire de la meilleure
façon possible. Le laboratoire est un système complexe,
impliquant beaucoup d’étapes dans la réalisation des activités
ainsi qu’un grand nombre de personnes.
La complexité du système exige que tous les processus et
procédures soient exécutés correctement. Par conséquent, un
modèle de système de gestion de la qualité englobant le
système dans son ensemble est primordial afin d’assurer un bon
fonctionnement du laboratoire [19].
c) Quels sont les enjeux pour
l’établissement de santé si le laboratoire n’est pas
accrédité ?
L’accréditation ne porte pas sur le laboratoire dans sa
globalité, mais sur chacun des examens réalisés par le
laboratoire (ex : formule leucocytaire, héparinémie, recherche
d’anticorps, etc.). Dans le cas où le laboratoire ne
répondrait pas aux exigences de la norme NF EN ISO 15189 sur
un type d’analyses, il se verrait contraint d’arrêter cette
prestation jusqu’à remise en conformité.
D’autre part, un laboratoire qui ne tiendrait pas son
engagement dans la démarche d’accréditation se fera retirer
son autorisation administrative d’exercer. Dans ce cas précis,
les conséquences pourraient être :
• Fermeture ou rachat du laboratoire
• Licenciement du personnel
• Perte d’image du laboratoire donc de l’établissement
de santé
• Perte financière pour l’établissement de santé
• Contrainte pour le patient obligé
d’aller faire ses examens sur un autre site
Il y a aujourd’hui sur le site de la clinique Jules
Verne, un laboratoire d’analyses médicales et un laboratoire
d’Assistance Médicale à la Procréation. Ces deux laboratoires
font parti des quelques 5100 laboratoires (dont 1200 publics),
en France, concernés par la loi sur la réforme de la biologie
médicale.
Cependant, seul le laboratoire d’AMP appartient à la
clinique. Le laboratoire d’analyses médicales appartient à la
société Bioliance.
L’objectif de ce stage est donc d’accompagner le
laboratoire d’AMP dans la démarche d’accréditation en faisant
un état des lieux des équipements du laboratoire et en listant
les préconisations de maintenances et contrôles réglementaires
afin de répondre aux exigences de la norme NF EN ISO 15189. Il
s’agit également de lister les prestataires de maintenances
susceptibles de réaliser ces opérations.
Ces éléments, associés à une évaluation de la criticité
des équipements, doivent permettre d’élaborer le planning de
maintenance exigé par la norme.
3. ÉTAT DES
LIEUX DU LABORATOIRE D’ASSISTANCE MÉDICALE A LA PROCRÉATION :
a) Présentation du
laboratoire:
Le Laboratoire d’AMP a ouvert ses portes en 2009 après
avoir obtenu l’agrément de l’Agence Régionale de Santé (ARS)
pour le traitement de l’infertilité et l’aide à la
procréation. C’est une antenne du CHU de Nantes composé d’un
docteur en biologie médicale et d’une technicienne de
laboratoire. Il fait partie de l’équipe pluridisciplinaire du
centre d’aide médicale à la procréation qui permet la prise en
charge complète de l’infertilité.
L’assistance médicale à la procréation définie des
pratiques cliniques et biologiques permettant l’insémination
artificielle et la conception in vitro, le transfert
d’embryons, ainsi que de toute technique d’effet équivalent
permettant la procréation en dehors du processus naturel.
En 2012, 151 naissances ont eu lieu grâce aux services
du laboratoire.
Comme explicité précédemment, le laboratoire d’AMP est
concerné, au même titre que les LBM, par l’accréditation
COFRAC selon la norme NF EN ISO 15189 et en référence à
l’arrêté du 11 avril 2008 [5] (modifié par l’arrêté du 2 juin 2014)
relatif aux « Règles de Bonnes Pratiques Cliniques et
Biologiques d’Assistance Médicale à la procréation »
(Équivalent du GBEA pour les LBM).

|
|
Figure 5
: Microscope de laboratoire
|
Figure 6:
Intra Cytoplasmic Sperm Injection
|
b) Démarche du projet :
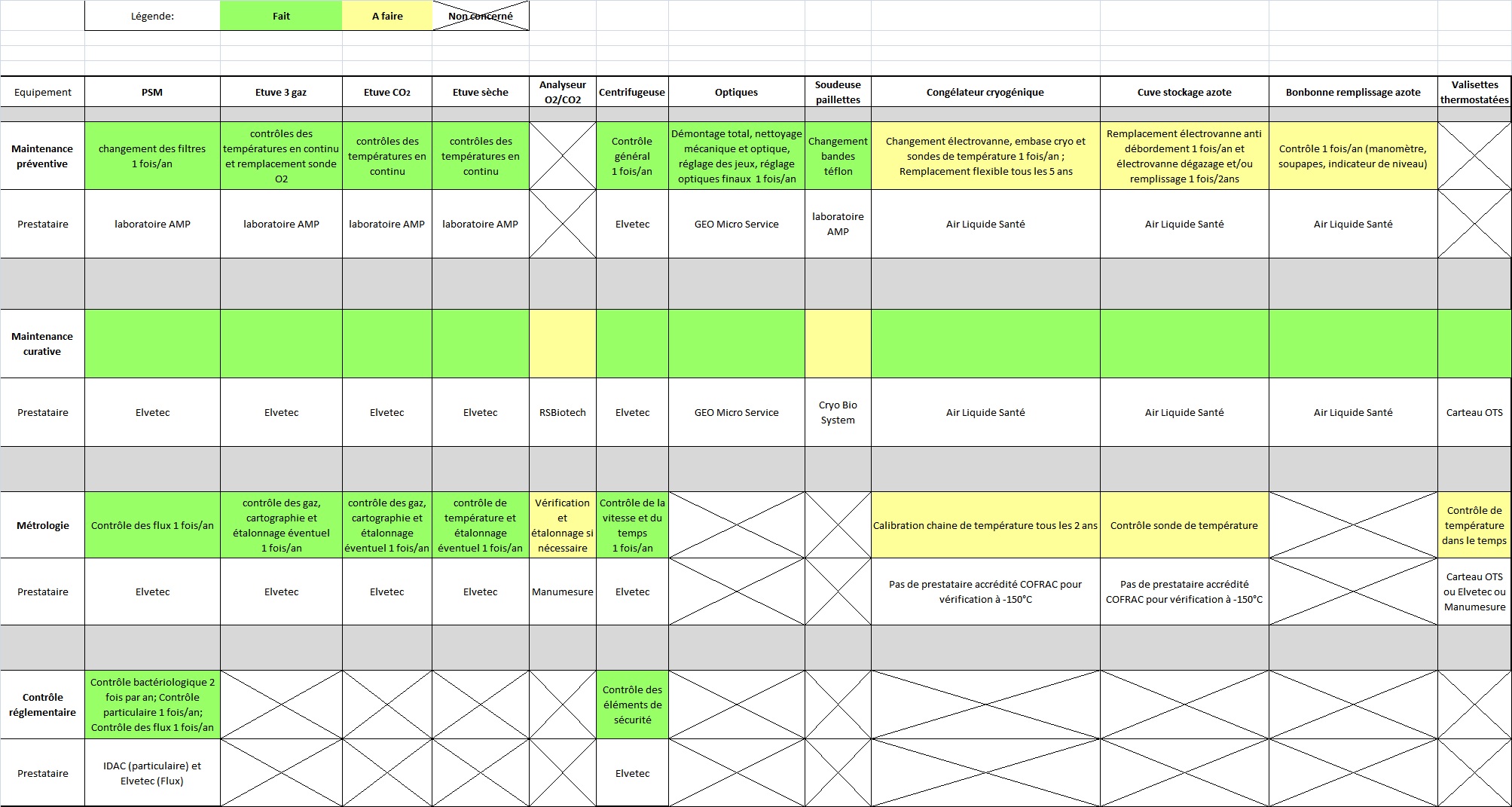
1ère étape : Inventaire des équipements du
laboratoire
Actuellement, il n’existe pas d’inventaire précis des
équipements du laboratoire. 54% d’entre eux sont répertoriés
dans la GMAO et 76% font l’objet d’une maintenance :
- préventive assurée par une
société de tierce maintenance
- curative assurée soit par le fournisseur,
soit par les utilisateurs eux-mêmes
Voici l’inventaire physique des équipements :
• 3 postes de sécurité microbiologique de
type II
• 2 étuves à CO2/O2/N2
(pour la culture embryonnaire)
• 4 étuves à CO2
(pour les fécondations in vitro)
• 1 étuve sèche pour le matériel de prélèvement
• 1 contrôleur de gaz (O2
et CO2)
• 1 centrifugeuse
• 2 microscopes
• 3 loupes binoculaires
• 1 soudeuse de paillette
• 1 congélateur -150°C
• 2 bonbonnes d’azote pressurisées pour le stockage
des embryons et des paillettes
• 4 cuves d’azote liquide
• 3 valises thermostatées pour le transport des
éprouvettes
A la fin de ce stage, 100% des équipements présents au
laboratoire d’AMP sont référencés dans la GMAO font l’objet
d’une maintenance régulière. La GMAO fera, dans ce cas, office
de Registre de Sécurité Qualité et Maintenance (RSQM). La
disponibilité de ce document est exigée lors des audits
d’accréditation.
2ème étape : Quels types de contrôles mettre en place
? [16]
Conformément à la certification v2010 de la HAS, la
norme NF EN ISO 15189 stipule que ces équipements doivent
faire l’objet d’un entretien périodique établi en fonction de
leur criticité et répondant au minimum aux préconisations de
maintenance du constructeur. Il s’agit donc de faire, à
minima, un contrôle qualité et si nécessaire, une maintenance
préventive propre aux équipements.
Dans le cadre de ce projet, chaque constructeur a été
démarché afin d’obtenir les manuels techniques de chaque
équipement du laboratoire d’AMP et ainsi lister les
préconisations de maintenance de ceux-ci.
L’objectif de cette démarche consiste également à
réaliser une veille technique, normative et réglementaire des
dispositifs médicaux utilisés au laboratoire d’AMP.
Un suivi métrologique des différents équipements
doit se faire suivant l’analyse de risques établie par le LBM
et en conformité avec l’arrêté du 11 avril 2008 (modifié par
l’arrêté du 2 juin 2014) relatif aux règles de bonnes
pratiques cliniques et biologiques d’assistance médicale à la
procréation.
A partir du moment où le laboratoire a estimé des grandeurs
critiques pour ses analyses, il doit faire vérifier et
éventuellement étalonner ses équipements mesurant une grandeur
physique (temps, masse, température, …) par des prestataires
accrédités (autant que faire se peut) et utilisant des
équipements de contrôle de mesure et d’essais (ECME) raccordés
aux étalons COFRAC.
Le choix de faire appel à un prestataire accrédité par
le COFRAC doit dépendre de deux critères :
• l’évaluation de la criticité des
équipements
• l’incertitude des mesures (tolérances) établie par
la biologiste du laboratoire
Définitions :
La métrologie est une branche de la physique concernant
la science des mesures et ses applications. Elle comprend tous
les aspects théoriques et pratiques des mesurages, quels que
soient l'incertitude de mesure et le domaine d'application.
Le mesurage est un processus consistant à obtenir
expérimentalement une ou plusieurs valeurs que l’on peut
raisonnablement attribuer à une grandeur. Le résultat d’un
mesurage est le mesurande.
La métrologie légale est la partie de la métrologie se
rapportant aux activités qui résultent d'exigences
réglementaires et qui s'appliquent aux mesurages, aux unités
de mesure, aux instruments de mesure et aux méthodes de mesure
et sont effectuées par des organismes compétents.
La métrologie légale concerne toutes les activités de
mesure relevant d'exigences définies par une réglementation.
Ce sont, par exemple, les mesures effectuées dans le cadre de
transactions commerciales (mesure du volume de carburant,
pesage des lettres et colis, mesure de l'énergie électrique
consommée par une habitation...), les mesures effectuées pour
définir le prix d'une taxe ou d'une amende (cinémomètres,
éthylomètres...), les mesures des rejets de polluants
(analyseur de gaz d'échappement de véhicule automobile...),
les mesures liées à la santé (lit pèse-malade, balance de
laboratoire, PH-mètre...)[15].
La métrologie légale inclut quatre activités principales :
• l'établissement des exigences légales
• le contrôle/l'évaluation de la conformité de
produits réglementés et d'activités réglementées
• la supervision des produits réglementés et des
activités réglementés
• la mise en place des infrastructures nécessaires à
la traçabilité des mesures réglementées et des instruments
de mesure
Faire une mesure, c'est comparer une grandeur physique
(ou chimique) inconnue avec une grandeur de même nature prise
comme référence à l'aide d'un instrument.
Qui dit mesure, dit référentiel, donc unité. Auparavant,
il existait de nombreuses unités qui n'avaient souvent que peu
de rapports les unes avec les autres. Il a fallu attendre la
révolution française pour qu'un premier système d'unités
cohérent voit le jour : le système métrique. Ce système fût
consacré sur le plan international par la Convention du mètre
du 20 mai 1875, traité diplomatique.
En 1960, lors de la onzième Conférence générale des
poids et mesures, apparaît le Système International d'unités
(SI). A ce jour, le SI est constitué de sept unités de base
(entre parenthèse le symbole qui la représente de façon
unique)[14] :
• le mètre (m)
• le kilogramme (kg)
• la seconde (s)
• l'ampère (A)
• le kelvin (K)
• la candela (cd)
• la mole (mol)
Tout mesurage effectué en relation avec la santé obéit à
une méthode prédéfinie. Simples dans certains cas (mesure de
la température du corps, de la fréquence cardiaque et de la
pression artérielle ou de la quantité de principe actif que
doit contenir un comprimé), les mesurages peuvent être
beaucoup plus complexes dans d’autres cas (détermination des
doses de rayons X ou de rayonnement d’un appareil d’imagerie
médicale).
Il est capital que les équipements de mesure et d’essai
soient conformes à des normes ou à des spécifications
reconnues, de façon à générer les mêmes résultats quel que
soit l’endroit où sont réalisés les mesurages. Mettre en œuvre
des orientations et des réglementations concernant les
méthodes et les équipements médicaux n’est possible que si les
mesurages utilisés pour vérifier leur conformité sont exacts,
traçables à des étalons de mesure de référence reconnus au
niveau international et effectués au moyen d’instruments
homologués et correctement étalonnés.
Les professionnels de santé et les experts en évaluation
des risques font confiance à l’exactitude des mesurages liés à
la santé pour diagnostiquer des maladies et prescrire des
traitements ou des actions, de telle sorte que les patients
reçoivent un traitement efficace, sûr et rentable. Appliquer
la dose exacte de la bonne substance, au bon endroit et au bon
moment : la réussite du traitement en dépend [13].
Contrôles réglementaires [17] :
L'article L4321-1 du Code du Travail [2] impose que les équipements de travail et
les moyens de protection mis en service ou utilisés dans les
établissements doivent être conçus, équipés, installés,
utilisés, réglés et maintenus de manière à préserver la
sécurité et la santé des travailleurs.
Seuls la centrifugeuse et les postes de sécurité
microbiologique font l’objet d’un contrôle réglementaire. Les
cuves et bonbonnes d’azote liquide font l’objet de
recommandations.
Le décret n°2008-244 [1]
du 7 mars 2008 relatif au code du travail fixe les mesures
d'organisation, les conditions de mise en œuvre et
d'utilisation applicables aux équipements de travail et aux
moyens de protection.
Le contrôle réglementaire doit comprendre au
minimum:
- L'examen visuel de l’état physique du
matériel.
- L'examen des sécurités et des éléments en
mouvements.
- La vérification des organes mécaniques en
mouvements.
- La vérification des organes de commandes.
- Les postes de sécurité microbiologique :
Le laboratoire d’AMP possède trois postes de sécurité
microbiologique de type II. Ce sont des hottes à flux
laminaire qui génèrent un air purifié en particules et surtout
sans perturbations aérauliques.
La norme NF EN 12469 (2000) [9]
est consacrée à la description des performances des Postes de
sécurité microbiologique (PSM) qui sont des hottes a flux
laminaires verticales ou horizontales selon le type,
généralement utilisées pour la maitrise des risques
biologiques et bactériologiques.
La norme définit trois types de PSM :
- PSM de type I : protège l'opérateur et l'environnement, flux
d'air en aspiration par une ouverture frontale permettant la
manipulation à l'intérieur du poste. Le flux d'air sortant est
lui aussi filtré.
- PSM de type II : protège l'opérateur, la manipulation
et l'environnement. Le flux d'air est soufflé verticalement à
travers un filtre HEPA sur le plan de manipulation (l'air est
de ce fait « propre » et donc empêche la contamination des
échantillons). Des perforations de reprises, ou du plan de
travail selon les fabricants aspirent le débit l'air soufflé
du filtre plus un débit supplémentaire provenant de
l'ouverture frontale de manipulation. Ce débit d'air frontal
aspiré par la hotte permet de protéger le manipulateur en
évitant toute sortie de danger microbiologique. Enfin l'air
est rejeté au travers d'un autre filtre HEPA protégeant
l'environnement de toute éventuelle pollution.
- PSM de type III : enceinte complètement fermée assurant une
séparation physique totale entre le manipulateur et
l'intérieur de la hotte. Les manipulations se font par le
biais de gants, d'où le nom de « boîtes à gants ». À
l'intérieur l'air est filtré et donc « propre ». L'air rejeté
est également filtré de manière à empêcher toute pollution
Ce type d’équipement est soumis à la réglementation
selon l’arrêté du 8 octobre 1987 [6] relatif aux contrôles périodiques des
installations d'aération et d'assainissement des locaux de
travail.
Le contrôle réglementaire doit comprendre au minimum :
- Contrôle des flux
- Contrôle bactériologique
- Contrôle particulaire
- Les cuves et bonbonnes d’azote liquide :
Les cuves et bonbonnes d’azotes ne sont pas soumises à
l’arrêté du 15 mars 2000 [7] relatif à la réglementation des
équipements sous pression.
Cepandant, Selon l’Agence Nationale de Sécurité Sanitaire de
l’alimentation et de l’environnement et du travail (ANSES) il
est recommandé :
- De veiller à maintenir un taux minimal de
19 % d’oxygène en vue de prévenir l’apparition d’effets liés
à l’hypoxie
- De ne pas manipuler et stocker de l’azote liquide
dans des locaux de volume inférieur à 20 m3 (correspondant à
une surface de 8 m2 pour une hauteur sous plafond de 2,5 m)
- De ne pas utiliser de locaux souterrains ni pour le
stockage ni pour le travail avec l’azote liquide. Il est
important que les locaux ne communiquent pas par des trappes
ou d’autres ouvertures (ex : gaine technique) avec des
locaux situés à des niveaux inférieurs
Les locaux doivent être équipés, en particulier,
d’appareils de détection et de mesure du taux d’oxygène, d’un
système d’alarme et d’une ventilation mécanique adaptée à deux
vitesses. Le taux de renouvellement d’air minimal nécessaire
en continu peut être estimé par l’utilisation de l’abaque
figurant dans le rapport d’expertise collective.
Les locaux où est manipulé l’azote liquide devront être
clairement identifiés. Ils devront en outre être dotés d’une
signalisation des dangers et des équipements de protection
individuelle requis, via les pictogrammes correspondants.
L’azote, est l’un des constituants majeur de l’air, et
ne présente pas intrinsèquement de toxicité particulière. Les
principaux dangers liés à l’azote liquide sont les gelures et
l’asphyxie (conséquence de l’hypoxie). Si le premier est bien
connu du fait de la température extrêmement basse de l’azote à
l’état liquide (-196°C), le second l’est beaucoup moins, bien
qu’il puisse être fatal. Le risque hypoxique de l’azote
liquide est lié à la capacité de l’azote liquide à générer
rapidement, par évaporation, un important volume d’azote
gazeux, provoquant ainsi une réduction du taux d’oxygène de
l’air par déplacement et dilution de l’oxygène.
Les risques dus à l’utilisation de l’azote liquide sont
difficilement quantifiables du fait de la grande hétérogénéité
des situations de travail et des configurations de locaux.
La GMAO permet aujourd’hui le suivi des
maintenances préventives et curatives et des contrôles
réglementaires et métrologique de tous les équipements
présents au laboratoire d’AMP.
Dans le cadre de l’accréditation du laboratoire, des
procédures écrites et documentées doivent être établies pour
les trois types de contrôles (contrôle qualité, métrologie et
contrôle réglementaire) et chaque équipement doit faire
l’objet d’une traçabilité appropriée.
3ème étape : Trouver les prestataires pour la
maintenance et les contrôles
Afin d’effectuer tous les contrôles nécessaires au
maintien des performances et de la sécurité des
dispositifs médicaux, le choix du prestataire est primordial.
Deux solutions sont possibles :
• Le service biomédical de la clinique
intervient sur les contrôles dont il a la compétence et les
ECME nécessaires à leur réalisation
• Le service biomédical fait appel à une société de
tierce maintenance dont la compétence est reconnue (Par le
COFRAC pour la métrologie et les contrôles réglementaires)
Le choix du prestataire dépend surtout, comme pour la
périodicité déterminée, de la criticité des équipements du
laboratoire.
La métrologie demande à être réalisée avec
des ECME raccordés aux étalons COFRAC. Un équipement jugé très
critique doit être vérifié par un prestataire accrédité par le
COFRAC dans le domaine correspondant
(température, masse, temps,…), selon la plage de mesure et
l’incertitude de mesure établie par l’utilisateur.
4ème étape : Évaluation de la criticité
La criticité est la combinaison de la sévérité d’un
effet et de la fréquence de son apparition.
La défaillance des équipements du laboratoire peut avoir des
conséquences graves sur la qualité des examens, sur le
personnel, l'environnement et le respect de la réglementation.
L’évaluation de celle-ci permet de :
• Faire l’analyse de risque des équipements
• Définir la politique de maintenance
• Définir le planning de maintenance
Comme expliquer précédemment, la périodicité des prestations
de maintenance et du suivi métrologique va dépendre
directement de la criticité du dispositif médical. Elle va
également influer sur la réactivité du prestataire de
maintenance si un mode dégradé n’est pas possible.
A ce jour, l’évaluation de la criticité des dispositifs
médicaux de la clinique n’est pas établie de façon formelle
(écrite). Elle est cependant dans les projets de l’ingénieur
biomédical.
Dans le cadre de mon sujet de stage, une étude de la
criticité des équipements du laboratoire a été proposée à la
biologiste (responsable du laboratoire) afin de pouvoir
affiner les devis de prestation sur les types de maintenance
et la périodicité.
Pour cette étude, la méthode PIEU à été choisie car elle
permet une évaluation rapide de la criticité.
La criticité s’exprime par la formule suivante :
C = P x I x E x U
= 0 à 81
0 détermine un dispositif très critique et 81, un dispositif
peu ou pas critique.
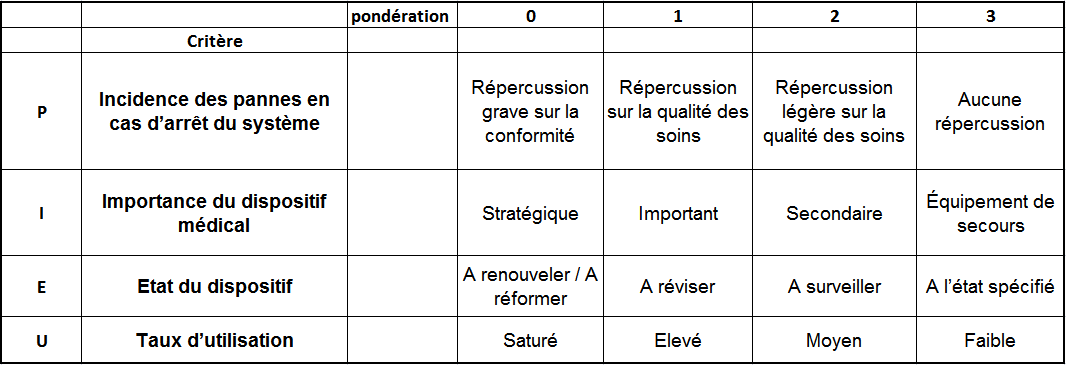
|
Figure 9: Tableau
d'évaluation de la criticité par la méthode PIEU
|
Voici les résultats de cette analyse faite par la
biologiste et classés par criticité croissante :
• Cuve azote pour stockage du sperme : C=54
• Contrôleur de gaz O2/CO2 : C=18
• Etuve sèche (stockage matériel de prélèvement): C=12
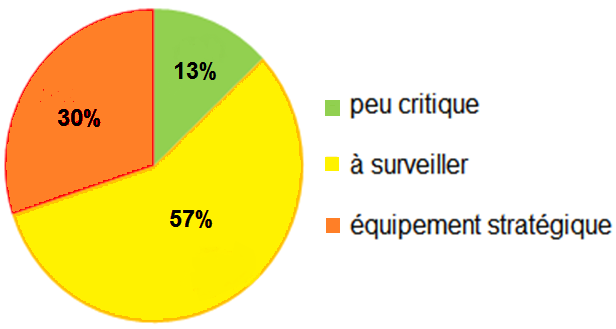
|
Figure
10: Résultat de l'évaluation de la criticité
|
• PSM ICSI : C=8
• PSM sperme : C=4
• 3 loupes binoculaires : C=4
• Etuve sperme : C=4
• 3 Valisettes thermostatées : C=4
• 3 Etuves CO2 : C=2
• PSM ovocytes/embryons : C=2
• 2 Etuves 3 gaz pour la culture embryonnaire: C=0
• Congélateur cryogénique : C=0
• Cuve azote pour stockage embryon : C=0
• Microscope inversé ICSI : C=0
• Microscope sperme : C=0
• Centrifugeuse : C=0
L’évaluation qui à été faite révèle 30% d’équipements
jugés « très critiques ». Cela veut dire que le suivi régulier
du maintien de leurs performances et de leur sécurité est
indispensable pour l’activité du laboratoire.
4.
BILAN
Toutes les informations collectées lors de ce stage ont
été classées dans un fichier Excel afin d’avoir une vision
globale des équipements, des contrôles nécessaires au maintien
de leurs performances et des prestataires compétents pour
réalisés ses contrôles.
Ce document a été réalisé en collaboration avec les
utilisateurs du laboratoire:
Les cases vertes correspondent à ce qui est déjà en
place et qui répond aux exigence de la norme NF EN ISO 15189.
Les cases jaunes correspondent à ce qui doit impérativement
être mis en place pour satisfaire aux exigences de la norme.
5. CONCLUSION
Le travail réalisé pendant ce stage va permettre au
laboratoire d’AMP de faciliter leur démarche d’accréditation
en ayant à ce jour un inventaire complet de leurs équipements.
Un listing des prestataires compétents pour la réalisation de
la maintenance a été fait afin de permettre un suivi
rigoureux, établi de façon formelle et répondant aux exigences
de la norme NF EN ISO 15189.
L’évaluation de la criticité des équipements et l’intégration
de l’inventaire dans la GMAO va permettre au service
biomédical d’établir le planning de maintenance exigé par la
norme NF EN ISO 15189 afin de faire un suivi des contrôles
réalisés et d’assurer, si nécessaire, une veille réglementaire
et normative des équipements du laboratoire.
BIBLIOGRAPHIE
[1]Décret n°
2008-244 du 7 mars 2008 relatif au code du travail;
Légifrance, juin2014.
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000018254394
[2]Code du travail,
« article L4321-1, 4ème partie, livre 3, titre 2, chapitre 1,
section 1 »; Légifrance, juin 2014.
http://www.legifrance.gouv.fr/affichCodeArticle.do?idArticle=LEGIARTI000006903209&cidTexte=LEGITEXT000006072050
[3]Code de la santé
publique, « article L6221-1, 6ème partie, livre 2, titre
2, chapitre 1 »; Légifrance, juin 2014.
http://www.legifrance.gouv.fr/affichCodeArticle.do?cidTexte=LEGITEXT000006072665&idArticle=LEGIARTI000006691266&dateTexte=&categorieLien=cid
[4]Arrêté du 26
novembre 1999, « Guide des Bonnes Exécutions d’Analyses
»; Légifrance, juin 2014.
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000580061
[5]Arrêté
du 11 avril 2008 modifié par l’arrêté du 2 juin 2014, «
Règles de Bonnes Pratiques Cliniques et Biologiques
d’Assistance Médicale à la Procréation »; Légifrance, juin
2014.
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000029069103&dateTexte=&categorieLien=id
[6]Arrêté du 8
octobre 1987, « Contrôle périodique des installations
d'aération et d'assainissement des locaux de travail »;
Légifrance, juin 2014.
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000863044
[7]Arrêté du 15
mars 2000, « exploitation des équipements sous pression
»; Légifrance, juin 2014.
http://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000763528
[8]Norme ISO
15189 version 2012: « Laboratoires de biologie médicale
-- Exigences concernant la qualité et la compétence »; ISO,
mai 2014.
http://www.iso.org/iso/fr/catalogue_detail?csnumber=56115
[9]Norme NF EN 12469
Juillet 2000 « Biotechnologie - Critères de performance
pour les postes de sécurité microbiologique » ; Afnor, juin
2014.
http://www.boutique.afnor.org/norme/nf-en-12469/biotechnologie-criteres-de-performance-pour-les-postes-de-securite-microbiologique/article/668574/fa044208
[10]HAS : «
Contribuer à la régulation par la qualité et l’efficience »;
juin 2014.
http://www.has-sante.fr/portail/jcms/fc_1249693/fr/piliers
[11]ILAC :
International Laboratory Accreditation Cooperation; mai 2014.
https://www.ilac.org/home.html
[12]Clinique
Jules Verne; mai 2014.
http://www.cliniquejulesverne.fr/clinique-nantes/
[13]Organisation
Internationale de La Métrologie Légale : « La métrologie
légale et la santé »; mai 2014.
https://www.oiml.org/fr/a-propos/metrologie-legale/sante
[14]Les
unités de mesures; mai 2014.
http://www.metrologie-francaise.fr/fr/si/unites-mesure.asp
[15]Définition
de la métrologie; mai 2014.
http://fr.wikipedia.org/wiki/M%C3%A9trologie#M.C3.A9trologie_l.C3.A9gale
[16]Vérification
et métrologie des instruments de laboratoire; mai 2014.
http://www.mc2lab.fr/verification-et-metrologie-des-instruments-de-laboratoires
[17]Association
Française des Ingénieurs et responsables de Maintenance
: « Principales vérifications réglementaire concernant la
sécurité »; mai 2014.
http://www.afim.asso.fr/actifs/reglementation/verif-per.asp
[18]Accréditation
et biologie médicale : enjeux et perspectives en 6
questions; mai 2014.
http://www.cofrac.fr/communication/brochures/cofrac_leaflet_sante.pdf
[19]Vue
d’ensemble des systèmes qualité : « L’importance de la
qualité au laboratoire »; mai 2014.
http://www.who.int/ihr/training/laboratory_quality/1_b_content_introduction_fr.pdf
LISTE
DES FIGURES:
Figure
1: Situation géographique de la clinique Jules Verne
(source: google
maps)
Figure 2: Chronologie de
l'accréditation des laboratoires en France (source: création
Matthieu PAROIS)
Figure 3:
Cartographie des processus de la norme NF EN ISO 15189
(source: création Matthieu PAROIS)
Figure 4:
Outil qualité: QQOQCP (source: création Matthieu PAROIS)
Figure 5:
Photographie d'un microscope (source: pixabay)
Figure 6:
Photographie d'une injection intra-cytoplasmique de
spermatozoïde (source: photo Matthieu PAROIS)
Figure 7:
Image d'un chronomètre (source: pixabay)
Figure 8:
Image d'un mètre ruban (source: pixabay)
Figure 9:
Tableau d'évaluation de la criticité d'un dispositif médical
(source: création Matthieu PAROIS)
Figure
10: Résultat de l'évaluation de la criticité (source:
création Matthieu Parois)
Figure 11: Tableau
récapitulatif (source: création Matthieu Parois)
ANNEXE
Service biomédical :
Le service
biomédical de la clinique Jules Verne est composé d’un
ingénieur biomédical diplômé de l’Université Technologique de
Compiègne et de deux techniciens biomédicaux diplômés de
l’Institut Universitaire Technologique de Lorient.
Les principales missions des deux techniciens sont :
• Maintien des performances des DM
(curatif et préventif)
• Gestion des prestations externes
• Formation et assistance du personnel utilisateur
• Contrôles qualité des DM
• Gestion du stock de pièces détachées
L’un des techniciens s’occupe en particulier de la
réception et de la mise en service des équipements neufs
tandis que l’autre a en charge la maintenance préventive des
DM (y compris l’accompagnement des sociétés de maintenance
externe).