Projet DESS "TBH", UTC, 99-00, pp 90 , URL : https://www.utc.fr/~farges/DESS_TBH/99-00/Projets/IQ/rapport.htm
Définition des éléments essentiels de l'outil GMAO
face au contexte réglementaire et à l'attente des services biomédicaux.

|
|
|
Si vous arrivez directement sur cette page sachez que ce travail est un rapport d'étudiant(e)s et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé lors de la période d'enseignement théorique à l'UTC et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part. L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
|
|
Projet DESS "TBH", UTC, 99-00, pp 90 , URL : https://www.utc.fr/~farges/DESS_TBH/99-00/Projets/IQ/rapport.htm Définition des éléments essentiels de l'outil GMAO face au contexte réglementaire et à l'attente des services biomédicaux. |
||
 |
|
|
|
|
|
|
|
Afin d'assurer le suivi des
dispositifs médicaux dans le cadre de
l'amélioration de la sécurité
sanitaire, les services biomédicaux hospitaliers, se
dotent de Logiciel de Gestion de Maintenance Assisté
par Ordinateur (GMAO). Cepandant, cet "outil" correspond-il
à l'évolution de la réglementation et
aux attentes réelles des
utilisateurs? |
|
In order to insure the tracking of
médical devices, to improve medical safety,
biomedical hospital services endow with Computerized
Maintenance Management System (CMMS). However, does CMMS
"tools" still correspond with the regulation improvement and
with biomedical services
expectations? Keywords: CMMS, biomedical,
regulation, maintenance, accreditation, Hospital Information
System, hospital computerized maintenance and information
system. |
Nous tenons à remercier Monsieur G. FARGES pour nous avoir encadré et guidé tout au long de ce projet. Nous remercions également Monsieur E. JULLIAN pour ses conseils et sa disponibilité. Enfin, nous remercions l'ensemble des services biomédicaux qui ont eu l'amabilité de répondre à notre enquête, ainsi que l'ensemble des acteurs qui ont participé à cette étude.
I.1. Etude de la réglementation en vigueurI.1.1 ) Le GBEA
I.1.2 ) L'arrêté du 03 octobre 1995
I.1.3 ) Le marquage CE
I.1.4 ) La matériovigilance (décret 96/32 du 15 janvier 1996)
I.1.5 ) L'accréditation
I.1.6 ) La loi du 1er juillet 1998 (n° 98-535)
I.1.7) Lettres circulaires diverses émanant de la direction des hôpitaux
I.1.8) La réglementation émanant du ministère de l'industrie
I.1.9 ) Le code du travail
I.1.10 ) Les normes obligatoires
II. LES BESOINS DES SERVICES BIOMEDICAUX
II.1 Enquête auprès d'un échantillon de services biomédicauxII.1.1) Présentation de l'enquête
II.1.2) Analyse et interprétation des résultats de l'enquêteII.2) Synthèse des besoins définis par les services biomédicaux
III. ETUDE DES PRINCIPAUX LOGICIELS DE GMAO DISPONIBLES
III.1. IntroductionIII.2 Les logiciels rencontrés dans l'industrie
III.2.1) Présentation
III.2.2) Tableau des logiciels rencontrés dans l'industrieIII.3 Les logiciels dédiés aux services biomédicaux
III.3.1) Présentation
III.3.2) Tableau des logiciels dédiés aux services biomédicauxIII.4 Analyse comparée entre les besoins et les outils proposés
IV. VERS UNE NORMALISATION DE LA G.M.A.O
IV.1. Présentation et intérêt de la normalisationIV.1.1. Définition de la normalisation
IV.1.2. Intérêt d'un normeIV.2. Différents axes d'études
IV.2.1 Définition des fonctions minimales
IV.2.2. Définition d'aptitude et fonctionnalités complémentaires
IV.2.3. Définition de spécifications techniques importantes.
IV.2.4.Définition d'un environnement commun.
La préoccupation grandissante et légitime de la population et de nos gouvernants à l'égard de la sécurité des patients, a entraîné ces cinq dernières années une augmentation significative des textes réglementaires sur le sujet. Ces textes imposent notamment aux établissements de soins, de mettre en place " une organisation " leur permettant d'assurer la sécurité et la qualité des soins.
Les services biomédicaux sont directement concernés par ces évolutions. Aussi, ils doivent se doter " d'outils ", leurs permettant d'améliorer leurs performances en terme de gestion de la fonction maintenance biomédicale.
Parmi ces outils, les logiciels de GMAO (Gestion de Maintenance Assistée par Ordinateur) sont aujourd'hui couramment rencontrés.
Par conséquent, dans sa première partie, ce projet se propose de définir les principales fonctionnalités que doivent intégrer les différents logiciels de GMAO en vertu de la réglementation.
La deuxième partie s'intéresse, par le biais d'une enquête, à recueillir les attentes, relatives à la GMAO, de services biomédicaux.
Ensuite, une analyse comparée des principaux logiciels disponibles avec les critères définis dans les deux parties précédentes permet d'évaluer l'offre disponible.
Enfin, la dernière partie de cette
étude évoque la mise en place d'une norme d'objectif
afin de définir les spécifications minimales des
logiciels de GMAO.
Ce chapitre à pour but d'extraire les principales fonctionnalités d'un logiciel de Gestion de Maintenance Assistée par Ordinateur (GMAO), à partir de l'analyse des exigences liées aux principaux textes réglementaires rencontrés dans le secteur de la santé, et plus particulièrement, au niveau des dispositifs médicaux1 et de leur environnement.
Chaque sous paragraphe présente un texte ou une famille de textes réglementaires et suit, en général, le schéma suivant :
- Le type ou la classe d'équipement concerné,
- Les actions à mener,
- Leur périodicité,
- Par qui,
- Le type d'enregistrement13,
- A disposition de qui.
Ainsi, à partir de la collecte de ces éléments, un second tableau a pu être réalisé. Il défini les fonctionnalités que doit intégrer l'application de GMAO.
Un tableau de synthèse, en partie deux de
ce chapitre, reprend les différentes fonctionnalités
à prendre en compte, pour une application de GMAO, dans le
cadre du contexte réglementaire.
I.1.
Etude de la réglementation en vigueur
I.1.1 ) Le GBEAa) Présentation
Le GBEA pour Guide de Bonne Exécution des Analyses de Biologie Médicale est un arrêté du 02 novembre 1994 applicable à l'ensemble des laboratoires d'analyses médicales (structures publiques et privées) depuis le 01 janvier 1995.
Le GBEA instaure le début d'un
système qualité dans les laboratoires d'analyses
médicales. Il s'articule autour de cinq grands chapitres
:
|
|
|
|
Les règles de fonctionnement |
Porte sur l'organisation, l'installation et sur l'instrumentation du laboratoire. |
|
L'exécution des analyses |
Porte sur la rédaction des procédures, la gestion des spécimens ainsi que le traitement des résultats. |
|
L'assurance Qualité |
Définit le responsable de l'assurance qualité au laboratoire (Le biologiste responsable du service). |
|
Le stockage et conservation des archives |
Porte sur les conditions de stockage et de conservation des archives (résultats d'analyses, procédures, Contrôle Qualité, documents relatifs à l'enlèvement des déchets ou encore relatifs aux équipements et à leur maintenance) |
|
Examens de laboratoire destinés à la recherche |
Traite du cas particulier des examens de laboratoire réalisés dans le cadre de la recherche biomédicale. |
Le GBEA concerne bien plus que le principal intéressé qui est le laboratoire. Il incite, au sein de structures telles que les hôpitaux, à l'implication des services de soins, administratifs, logistiques et techniques.
Nota : Une version remaniée est paru
fin décembre 1999 (GBEA 2).
b) Conséquences
Les conséquences, en terme de maintenance, sur les services biomédicaux des établissements de santé sont nombreuses. Les appareils doivent, notamment, être périodiquement et efficacement inspectés, entretenus et vérifiés selon des procédures opératoires établies d'après les recommandations des fabricants.
Le tableau de l'annexe 1, reprend les principaux éléments de l'arrêté, du 2 novembre 94, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
I.1.2 ) L'arrêté du 03 octobre 1995
a) Présentation
L'amélioration de la sécurité de l'anesthésie et de ses suites constitue, depuis de nombreuses années, une des préoccupations des responsables de la Santé Publique et du Corps Médical .
Avant l'arrivée de cet arrêté, de nombreuses recommandations ont été publiées par la Société Française d'Anesthésie Réanimation (SFAR) d'une part et d'autre part, des dispositions législatives ont été prises avec notamment le décret n° 94-150, du 5 décembre 1994, relatif aux conditions techniques de fonctionnement des établissements de santé en ce qui concerne la pratique de l'anesthésie.
L'arrêté du 03 octobre 1995 porte sur les modalités d'utilisation et de contrôle des matériels et dispositifs médicaux assurant les fonctions et actes cités aux articles D.712-43 et D.712-47 du code de la santé publique (CSP), soit les matériels de monitoring, de ventilation, d'arrivée de fluides médicaux, de défibrillation cardiaque, de réchauffement patient...etc.
En fait, ce texte n'est rien d'autre que la description d'un système d'assurance de la qualité en anesthésie et en maintenance biomédicale des équipements d'anesthésie, même si le mot n'apparaît pas explicitement !
On retrouve ainsi les termes d'organisation,
documents, procédures, mises à jour, propres au domaine
de la qualité. Il est ainsi aisé de rapprocher les
chapitres de la norme ISO 9002 :production, installation et
prestations associées aux différents articles du
présent arrêté. Ceux-ci détaillent les
étapes du suivi des dispositifs et matériels depuis la
réception jusqu'à la maintenance en passant par les
contrôles quotidiens avant utilisation.
b) Conséquences
Les conséquences sur les services biomédicaux des établissements de santé ne sont bien évidemment pas négligeables ! Là encore, la fonction maintenance est fortement impliquée.
Le tableau de l'annexe 2, reprend les principaux éléments de l'arrêté, du 3 octobre 95, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
a) Présentation
Le marquage CE, au titre des dispositifs médicaux1, découle des directives européennes 90/385/CEE du 20 juin 1990 (relative aux dispositifs médicaux implantables actifs) et 93/42/CEE du 14 juin 1993 (relative à l'ensemble des dispositifs médicaux), qui pour être appliquées sur le territoire français, ont été transposées en droit français par les lois n° 94-43 du 18 janvier 1994 et n° 95-116 du 4 février 1995 et le décret n° 95-292 du 16 mars 1995. Ces lois et ce décret constituant le livre V bis du code de la santé publique décrivant les dispositions relatives aux dispositifs médicaux.
Le marquage CE a pour objectif d'indiquer la conformité d'un dispositif médical à des " exigences essentielles " traduites en spécifications techniques dans un ensemble de normes harmonisées conçues par le Comité Européen de Normalisation (CEN) et le Comité Européen de Normalisation ELECtrotechnique (CENELEC).
La conformité des dispositifs médicaux à ces normes vaut présomption de conformité aux " exigences essentielles " des deux directives européennes, précitées, qui posent les principes suivants :
En outre, la directive 93/42 groupe les dispositifs médicaux en quatre classes (I, IIa, IIb, III) en fonction de leur niveau de risque (respectivement du risque le plus faible au plus élevé).
D'un point de vue pratique, pour vendre un produit
en Europe les fabricants doivent au préalable attester leur
conformité aux " exigences essentielles ". A ce niveau, les
normes européennes EN, bien que non obligatoires, peuvent
utilement servir de référence. Selon la classe de leurs
produits, les fabricants disposent de plusieurs possibilités
pour apporter la " preuve " de leur conformité.
|
|
|
|
Classe I |
- Déclaration de conformité
(auto-certification par le fabricant) - Annexe
VII |
|
Classe IIa |
|
|
Classe IIb |
|
|
Classe III |
|
Les dispositifs des classes IIa, IIb et III sont également soumis au contrôle des organismes " notifiés" (en France l'organisme notifié par les autorités est le G-MED2) qui effectuent la validation technique des produits. La validation par un seul organisme notifié suffit au fabricant pour que son produit dispose d'une reconnaissance mutuelle sur tout le territoire européen.
Par ailleurs, les deux directives européennes précitées, prévoient respectivement dans leur article 8 et 10, que les états membres recensent et évaluent de manière centralisée, les incidents mettant en cause les dispositifs médicaux mis sur le marché ; elles stipulent également l'obligation pour ces états d'en informer la commission des communautés (CCE) ainsi que les autres états membres. Ces directives imposent au fabricant de disposer d'un système de surveillance après-vente et en outre d'informer les autorités compétentes des incidents survenus.
Ces dispositions, ont donc amené les
états membres à instaurer leur propre système de
vigilance, en intégrant les principes généraux
émanant des lignes directrices rédigées par un
groupe de travail de la CEE, afin d'assurer une certaine
homogénéité entre ces différents
systèmes de vigilance.
b) Conséquences
Concernant la maintenance, il est important de souligner la présence du paragraphe n° 13.6.d de l'annexe I (définition des " exigences essentielles ") de la directive 93/42/CEE qui indique : " Le fabricant détermine les informations nécessaires pour vérifier si le dispositif en cause est bien installé et peut fonctionner correctement et en toute sécurité, ainsi que les indications concernant la nature et la fréquence des opérations d'entretien et d'étalonnage pour assurer en permanence le bon fonctionnement et la sécurité des dispositifs ".
L'exploitant de dispositifs médicaux doit donc se conformer aux indications communiquées par les fabricants concernant la maintenance des équipements dont il dispose. Il doit donc :
Il est intéressant de noter que dans la définition du dispositif médical (voir le glossaire), il y a prise en compte du logiciel nécessaire au bon fonctionnement de celui-ci. Il est donc important de pouvoir inventorier la version logicielle de chaque dispositif médical (si logiciel il y a !).
Une, des conséquences importantes du
marquage CE, est également la mise en place de la
matériovigilance, décrite ci-après.
I.1.4 ) La matériovigilance (décret 96/32 du 15 janvier 1996)a) Présentation
La matériovigilance trouve son origine dans les directives européennes 90/385/CEE et 92/42/CEE, relatives à la mise sur le marché des dispositifs médicaux. En effet ces directives imposent aux Etats membres de l'Union européenne de recenser et d'évaluer de façon centralisée les incidents graves mettant en cause des dispositifs médicaux. Ce système de matériovigilance est mis en place en remplacement du dispositif d'alerte qui existait déjà antérieurement en France dans le cadre de l'homologation des produits et appareils à usage préventif, diagnostique et thérapeutique.
Pour cela, le système s'appuie sur un " réseau national de matériovigilance " comportant deux niveaux :
Un " échelon local " de recueil et de transmission des informations,
Un " échelon central " d'analyse et de décision.
A l'échelon local, tout établissement de santé public ou privé doit désigner un " correspondant matériovigilance ". Le rôle du correspondant est notamment de coordonner les actions, veiller à la mise en place des mesures, conduire les enquêtes et travaux, collecter et transmettre les informations, sensibiliser les personnels utilisateurs de dispositifs médicaux.
A l'échelon central, le ministre chargé de la santé, par le biais de l'Agence Française de Sécurité SAnitaire des Produits de Santé (AFSSAPS), assure la mise en place et le fonctionnement du système national de matériovigilance, coordonne les actions, recueille et diffuse les informations, prends les décisions à l'encontre des dispositifs médicaux défaillants. Il s'appuie sur une " commission nationale de matériovigilance " qui évalue les informations recueillies sur les incidents ou risques d'incidents du fait des dispositifs médicaux, donne des avis sur les mesures à prendre, propose des enquêtes et travaux...
Obligatoire et sans délai, lorsqu'il met en
cause un dispositif ayant entraîné ou susceptible
d'entraîner la mort ou la dégradation grave de
l'état de santé d'un individu (patient, utilisateur ou
tiers), facultatif dans les autres cas, le signalement des incidents
ou de risque d'incidents sont effectués par toute personne
(fabricant, utilisateur ou tiers) qui en fait la constatation ou qui
en a connaissance. Le signalement est fait auprès du
correspondant local, qui ensuite rediffuse l'information à
l'échelon central.
b) Conséquences
Le tableau de l'annexe 3, reprend les principaux éléments, de la matériovigilance, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
I.1.5 ) L'accréditationa) Présentation
Introduite au sein du système de santé Français par l'ordonnance n° 96-346 du 24 avril 1996 portant réforme hospitalière et précisée par le décret n° 97-311 du 7 avril 1997, la procédure d'accréditation a pour objectif de s'assurer que les établissements de santé développent une démarche d'amélioration continue de la qualité et de la sécurité des soins délivrés aux patients.
L'accréditation est une procédure d'évaluation externe à un établissement de santé, effectuée par des professionnels des établissements de santé, indépendante de l'établissement et de ses organismes de tutelle, évaluant l'ensemble de son fonctionnement et de ses pratiques.
L'Agence Nationale d'Accréditation et
d'Evaluation en Santé (ANAES) est chargée de la mise en
L'accréditation a six objectifs principaux :
La procédure d'accréditation concerne tous les établissements de santé publics et privés civils et potentiellement les établissements militaires. Elle s'étend également aux réseaux de soins. Par contre les activités d'enseignement et de recherche n'entrent pas dans le champ de la procédure d'accréditation.
Il est important de noter que la procédure d'accréditation s'applique aux activités des établissements de santé qui participent directement et indirectement à la prise en charge du patient. Les services logistiques et techniques tel que le service biomédical, sont donc pleinement concernés.
Pour mener à bien cette démarche d'accréditation, l'ANAES s'appuie sur un manuel d'accréditation. Le manuel d'accréditation dans sa version de février 99 c'est :
3 chapitres, 10 domaines, 82
références et 296 questions ==> Combien de
références et quelles questions concernent la fonction
maintenance ?
b) Conséquences
Le " décodage " du manuel n'est pas chose évidente. A première vue, il existe deux domaines qui concerne directement le service biomédical (Gestion des fonctions logistiques et vigilances sanitaires, sécurité transfusionnelle). Mais en y regardant de plus près, d'autres domaines et donc d'autres références concernent les services biomédicaux.
Vous trouverez en annexe 4, les principaux éléments, du manuel d'accréditation, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
I.1.6 ) La loi du 1er juillet 1998 (n° 98-535)
a) Présentation
Cette loi a pour but de renforcer la sécurité sanitaire sur le territoire Français. Elle met en place:
Par ailleurs, le point III de l'article 14 de la présente loi, modifie l'article L.665-5 du code de la santé. En voici un extrait :
" Pour les dispositifs médicaux dont la liste est fixée par le ministre chargé de la santé après avis de l'agence française de sécurité sanitaire des produits de santé, l'exploitant est tenu de s'assurer du maintien de ces performances et de la maintenance du dispositif.
Cette obligation donne lieu, le cas échéant, à un contrôle de qualité dont les modalités sont définies par décret, et dont le coût est pris en charge par les exploitants des dispositifs. "
A ce jour, aucun décret d'application,
imposant un contrôle de qualité sur un type de
dispositif médical, n'est paru.
b) Conséquences
La mise en application de cet article de la loi du 1er juillet nécessitera, de la part des exploitants, de disposer de :
I.1.7 ) Lettres circulaires diverses émanant de la direction des hôpitauxa) Présentation
Régulièrement, la direction des hôpitaux par le biais de sa " Division des Equipements, des Matériels Médicaux et des innovations technologiques " rédige et transmet aux établissements de santé des lettres circulaires relatives à la sécurité d'utilisation des dispositifs médicaux.
Ces lettres circulaires font généralement suite à un ou plusieurs incidents graves ou risque d'incidents graves survenus sur les dispositifs médicaux incriminés. (Les déclarations d'incidents intervenant aujourd'hui, dans les deux sens, au titre de la matériovigilance).
Elles demandent la mise en
Ainsi, à ce jour, pour les dispositifs
suivants, une maintenance et ou des vérifications
régulières sont obligatoires : (Par ordre
chronologique jusqu'au 31/08/1999)
|
Type du dispositif médical |
|
|
|
Réseau de distribution de fluides médicaux6 |
|
|
|
Manodétendeurs |
DH/EM1/960327 |
30/01/1996 |
|
Appareils de SpO2 |
|
|
|
Microscopes opératoires et autres dispositifs illuminants (utilisés en ophtalmologie) |
|
|
|
Ventilateurs et mélangeurs de gaz employés pour l'anesthésie, la réanimation et la néonatologie. |
|
|
|
Flexibles de gaz médicaux |
|
|
|
Tables d'opérations |
|
|
|
Phacoémulsificateurs7 |
|
|
La périodicité des opérations de maintenance ou de vérifications, est soit clairement définie par la lettre circulaire, soit laissée à l'appréciation du fabricant.
Pour la nature et le contenu des opérations de maintenance ou de vérifications, il en va de même.
Pour la réalisation de ces opérations, 3 possibilités se présentes :
Enfin, il est indispensable de signaler la
circulaire ministérielle DH/EM1/EO1/97672 du
20/10/1997, relative à la stérilisation des
dispositifs médicaux dans les établissements de
santé qui demande la mise en place d'un système
d'assurance qualité en stérilisation des dispositifs
médicaux. Le traitement des dispositifs médicaux
doit donc être mis en
La stérilisation doit, entre autre, faire
appel à des procédés validés selon les
normes harmonisées européennes en vigueur et qui pour
la stérilisation par la vapeur d'eau saturée sous
pression est la norme NF EN 554 (Validation et contrôle
de routine pour la stérilisation à la vapeur). Il est
ainsi préconisé de réaliser une qualification
opérationnelle14
à la mise en service d'un appareil ou lors de modifications
importantes, puis une fois par an.
b) Conséquences
Pour la majeure partie des lettres circulaires, le service biomédical doit donc :
Vous trouverez en annexe 5, les principaux éléments, de la circulaire DH/EM1/EO1/97672, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
I.1.8 ) La réglementation émanant du ministère de l'industrie
Certains dispositifs, issus du monde de
l'industrie, équipent les établissements de
santé. Ceux-ci sont bien souvent régis par des textes
réglementaires émanent du ministère de
l'industrie.
a) Les appareils à pression de vapeur à couvercle amovible10
- a.a) Présentation
Utilisé depuis bien longtemps par les industriels, ce type d'équipement, potentiellement très dangereux, est soumis depuis de nombreuses années à des règles précises.
Le principal texte qui régit les contrôles sur ce type d'équipement date de 1926 (décret du 02/04/26). Des décrets et arrêtés sont depuis venus le compléter. Les plus importants sont :
Les exploitants d'appareils à pression de vapeur à couvercle amovible (plus souvent appelés " autoclaves "), sont notamment soumis à :
a.b)
Conséquences
Le tableau de l'annexe 6, reprend les principaux éléments des arrêtes pré-cités, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
b) Les instruments de pesage (balances...)
Les instruments de pesage sont soumis à différents textes réglementaires selon qu'ils sont à fonctionnement automatique ou pas. Dans les établissements de soins, la très grande majorité des instruments de pesage sont à fonctionnement non automatique.
Ces derniers sont définis par la directive européenne n° 90/384/CEE modifié par la directive n° 93/68/CEE. La transposition en droit français a été réalisée par le décret n° 91-330 du 27 mars 1991 et modifié par les décrets n° 93-973 du 27 juillet 1993 et n° 96-442 du 22 mai 1996.
Le contrôle des instruments de pesage à fonctionnement non automatique3, est régis par l'arrêté du 22 mars 1993, modifié par l'arrêté du 6 mai 1997.
Nota : Ces équipements sont
utilisés dans le cadre de nombreuses applications au sein des
établissements de soins. Ils sont, à tord, bien souvent
considérés comme des équipements anodins. Le
risque est cependant présent non seulement du fait d'une
réglementation particulièrement stricte mais aussi
parce qu'un résultat erroné délivré par
un instrument déréglé peut avoir de lourdes
conséquences...
- b.b) Conséquences
Le tableau de l'annexe 7, reprend les principaux éléments des arrêtes pré-cités, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
I.1.9 ) Le code du travail
Le ministère du travail contribue depuis de
très nombreuses années à réduire les
accidents graves liés à certains équipements, ou
à leur environnement, utilisés par les travailleurs.
Ainsi les équipements, réputés dangereux, sont
soumis à une réglementation stricte prévoyant
des vérifications périodiques, des formations pour les
utilisateurs...
a) Les appareils produisant des rayonnements ionisants
- a.a) Présentation
Les sources produisant des rayonnements ionisants sont classés comme suit :
Les appareils générateurs électriques,Les sources scellées,
Les sources non scellées.
Ils sont régis principalement par deux textes qui sont le décret n° 86-1103 du 02/10/1986 et l'arrêté du 02/10/1990.
Concernant les sources de radiothérapie externe, l'article L.44-4 (inséré par la loi n° 95-116) du code de la santé publique sera également applicable lorsqu'un décret d'application sera publié.
Ces textes prévoient principalement (pour l'aspect maintenance) :
Nota : La directive
européenne n° 97/43/Euratom du 30 juin 1997 relative
à la radioprotection, prévoie notamment outre les
contrôles déjà mis en place par les textes
prés-cités, des programmes appropriés
d'assurance de qualité, comprenant des mesures de
contrôle de qualité et des évaluations de la dose
du patient ou de l'activité administrée sur l'ensemble
des équipements radiologiques.
- a.b) Conséquences
Le tableau de l'annexe 8, reprend les principaux éléments du décret et arrêté pré-cités, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
Faute de temps et dans la mesure ou les décrets d'applications ne sont pas publiés à ce jour, les répercutions de la directive EURATOM ne sont pas évaluées dans le présent rapport.
b) Les centrifugeuses
- b.a) Présentation
Un certain nombre d'équipements de travail doivent faire l'objet de vérifications générales périodiques afin que soit décelé en temps utile toute détérioration susceptible de créer des dangers.
Le décret n° 93-41 du 11/01/93 défini les mesures d'organisation et d'utilisation, générales et particulières, des équipements de travail.
Les arrêtés du 5/03/1993 et du 4/06/1993 donnent la liste des équipements de travail pour lesquels des vérifications générales périodiques sont obligatoires. Ils définissent également la nature et le contenu des vérifications.
Cette liste d'équipement est assez vaste.
Elle va des presses en tous genres aux compacteurs d'ordures... A ce
jour, un seul équipement concerne les services
biomédicaux. Ce sont les centrifugeuses.
- b.b) Conséquences
Le chef d'établissement doit tenir à jour un registre de sécurité conforme à l'article L.620-6 du code du travail et dans les conditions des articles L.620-7 et D.620-1 du même code.
L'article L.620-7 est très intéressant puisqu'il précise que les entreprises peuvent avoir recours à des moyens autres que le support papier (informatiques notamment), pour la tenue de certains registres. Bien entendu, le support utilisé doit permettre une conservation dans les mêmes conditions de sécurité et de durée que celui auquel il se substitue.
Le tableau de l'annexe 9, reprend les principaux éléments du décret et des arrêtes pré-cités, dont il faut tenir compte pour définir les principales fonctionnalités et aptitudes d'un logiciel de " GMAO ". Celles-ci peuvent être résumées par :
c) La sécurité électrique
Le décret n° 88-1056 du 14/11/1988 contient les principes de prévention des différents dangers ayant pour origine d'une part l'utilisation des appareils et installations électriques, d'autre part les travaux de maintenance et d'entretien de ces installations.
L'expression " installation électrique " regroupe l'ensemble des matériels électriques utilisés dans les établissements jusque et y compris l'équipement électrique d'un dispositif alimenté par une batterie d'accumulateurs.
Treize arrêtés d'application du décret n° 88-1056 ont également été publiés. Ils définissent l'alimentation des matériels portatifs à main ou encore, la périodicité et l'étendue des vérifications des installations ainsi que le contenu des rapports de vérifications...
Le tableau de la page suivante reprend les
arrêtés d'application dont ils faut avoir connaissance
dans le cadre de notre activité biomédicale
:
|
|
|
|
Installation des matériels électriques sur les emplacements présentant des risques d'explosion. |
|
|
Périodicité, objet et étendue des vérifications des installations électriques et contenu des rapports de vérification. |
Modifié par l'arrêté du 10/01/1992. |
|
Conditions et modalités d'agrément des personnes ou organismes pour la vérification des installations électriques. |
Modifié et complété par l'arrêté du 23/12/1992. |
- c.b) Conséquences
Les mesures à mettre en
- Des actions de formation visant à assurer la sécurité des personnels, qu'il s'agisse des personnels utilisateurs ou des personnels spécialisés des services d'entretien chargés des travaux sous tension ou non, ou au voisinage de parties actives nues sous tension,
- Surveillance des installations et vérifications périodiques des installations.
Le tableau de
l'annexe
10, reprend les principaux
éléments du décret et des arrêtes
pré-cités, dont il faut tenir compte pour
définir les principales fonctionnalités et aptitudes
d'un logiciel de " GMAO ". Celles-ci peuvent être
résumées par :
I.1.10 ) Les normes obligatoiresa) Présentation
Dans le domaine biomédical, il existe
quatre normes rendues obligatoires. Toutes concernes
la distribution de gaz médicaux. Le tableau ci-dessous
précise leur champ d'application :
|
|
|
|
|
Prises murales et embouts correspondants pour fluides médicaux |
|
|
Air à usage médical: Taux d'impuretés admissibles et méthodes d'essais. |
|
|
Flexibles de raccordements pour fluides médicaux |
|
|
Réseaux de distribution de gaz médicaux6 |
Dans l'attente d'une norme européenne sur le sujet, ce sont ces normes françaises qui sont applicables sur le territoire Français. Les réseaux de distribution de gaz médicaux doivent également être en conformité avec l'article U41-PU5 du règlement de sécurité.
En effet, il est dans les réseaux de distribution de gaz médicaux vital que des normes, de haute sécurité, soient respectées afin d'éviter toute erreur de branchement, de panne d'approvisionnement ou tout incendie.
Les deux premières fixent les spécifications sur la construction des prises et des flexibles de gaz médicaux, la troisième fixe les taux maximums d'impureté concernant l'air à usage médical et donne les méthodes d'essais. Ces trois normes ne donnent pas d'indications particulières sur la maintenance de ces systèmes.
Par contre la norme NF S 90-155 fixe les spécifications minimales portant sur la construction, le fonctionnement, la documentation, les essais et la maintenance des réseaux de distribution de gaz médicaux pour assurer la sécurité du patient. Ces spécifications portent sur la centrale, le réseau de canalisations et les systèmes d'alarmes.
A noter l'existence de la circulaire DGS/3A/667bis
du 10/10/1985, émanant de la direction des hôpitaux,
relative à la distribution des gaz à usage
médical et à la création d'une commission locale
de surveillance de cette distribution qui demande de mettre en place
des contrôles périodiques des installations. D'autres
circulaires portant sur les manodétendeurs et sur les
flexibles de gaz médicaux existent (Voir le sous chapitre I
.1.7 portant sur les lettres circulaires diverses).
b) Conséquences
Le tableau de
l'annexe
11, reprend les principaux
éléments de la norme NF S 90-155 et des circulaires
pré-cités, dont il faut tenir compte pour
définir les principales fonctionnalités et aptitudes
d'un logiciel de " GMAO ". Celles-ci peuvent être
résumées par :
I.2.
Synthèse des besoins liés au contexte
réglementaire
Comme nous avons pu le constater au paragraphe
précèdent, un nombre important de
fonctionnalités souhaitables pour l'application informatique
sont communes à différents textes. Par
conséquent, nous avons souhaité les reprendre dans le
tableau de synthèse ci-dessous :
|
|
|
|
|
|
||
|
Inventaire des dispositifs biomédicaux. |
Tous. |
Doit intégrer un code et une dénomination " normalisée ".(Le code CNEH11 tendrait à disparaître au profit du code développé par l'ECRI12). |
|
Enregistrement des différentes actions de maintenance : - Maintenance utilisateur, (niveau 1 et 2
de maintenance) |
- GBEA, |
Pour chaque dispositif médical inventorié, il doit être possible d'enregistrer les différentes actions réalisées durant sa vie. Il est utile de pouvoir distinguer s' il s'agit d'une action de maintenance, de contrôle qualité ou de sécurité. Ainsi, il est possible de visualiser l'ensemble des opérations ou uniquement un type d'action bien particulier (pour éviter toute surcharge dans la présentation de l'historique dans le cas ou seul un type d'action nous intéresse). Les actions de maintenance ou de contrôle qualité " utilisateurs ", doivent être enregistrées. Par conséquent les utilisateurs chargés de ces opérations doivent disposer d'un accès contrôlé à l'application informatique afin de les enregistrer. Cette possibilité s'inscrit dans le cadre de la démarche Total Productive Maintenance (TPM4) visant à améliorer fortement le niveau de disponibilité des équipements. |
|
Enregistrement des actions de contrôle qualité. |
- GBEA, |
|
|
Enregistrement des actions de contrôle sécurité. |
- Accréditation, |
|
|
Gestion des demandes d'intervention. |
- Arrêté du 3 octobre
95, |
Possibilité donnée aux utilisateurs d'émettre des demandes d'intervention, de leurs services, à partir d'un poste informatique. Cette possibilité doit permettre par extension de communiquer d'autres informations du service biomédical vers les divers services de soins et médico-techniques de l'hôpital : inventaire du service considéré, état d'avancement des demandes d'intervention par exemple. Cette fonctionnalité nécessite que l'application est un fonctionnement en mode client serveur ou mieux encore via l'Intranet de l'établissement. (voir la partie aptitude) |
|
Gestion et suivi de la matériovigilance. |
- La matériovigilance. |
Enregistrer les différentes actions menées dans le cadre de la matériovigilance (ex : la correspondance, les commandes de pièces détachées ou de nouveaux équipements...). Disposer d'un outil d'aide quantitatif permettant d'évaluer, par un score, si un incident doit être déclaré avec ou sans délai. |
|
Planification de la maintenance préventive et des contrôles qualité et sécurité. |
Tous (à la matériovigilance prés). |
Vu le nombre important d'actions différentes à effectuer sur une quantité élevée de dispositifs, il est intéressant de disposer d'un outil de planification avec une présentation des tâches à effectuer et effectuées (avec un rappel automatique de celles ci). |
|
Gestion des contrats de maintenance et de services. |
Tous par extension (à la matériovigilance prés). |
Toutes les opérations de maintenance, de contrôle qualité et sécurité ne peuvent être réalisés en interne par manque de moyens humains, matériels ou de compétence. Par conséquent il doit être possible de gérer les contrats souscrits avec des prestataires externes et de les associer aux équipements concernés pour permettre, entre autre, la gestion des travaux sous contrat. L'aspect financier et " juridique " est également important. |
|
Gestion des compétences et habilitations du personnel affecté au service biomédical. |
Tous. |
Création d'un dossier individuel ou sont spécifiées les qualifications des agents et enregistrées les diverses formations suivies. Lien possible entre répartition des tâches et qualification des agents. |
|
Gestion des actions de formation sur les dispositifs médicaux aux utilisateurs. |
- GBEA, |
Les textes réglementaires,
marqués en gras, obligent clairement la mise
en place de formation pour les personnels utilisateurs ou "
responsables "... |
|
Gestion des pièces détachées. |
Tous (à la matériovigilance prés). |
Cette fonctionnalité doit permettre de prendre en compte les pièces détachées ou certains consommables fournis par le SBM, indispensables, pour assurer la continuité de fonctionnement d'une sélection de dispositifs médicaux considérés comme vitaux. |
|
Plan d'équipement (biomédical) |
Accréditation |
Suivi, pour chaque dispositif médical des différentes phases d'achat des dispositifs médicaux. |
|
Gestion de planning |
Accréditation |
Suivi des plannings des différents personnels répondant aux objectifs fixés par le service pour permettre la continuité des soins. |
|
Tableaux de bords/Indicateurs |
Accréditation |
Extraction d'indicateurs paramétrables afin de suivre les objectifs fixés et d'optimiser la gestion du parc d'équipement biomédical... |
|
Intégration de " fonctions " qualité |
Accréditation |
Permettre la gestion des analyses de risque, de la satisfaction des "clients" et la gestion des non conformités. |
|
|
||
|
Gestion Electronique de Documents (GED).ù et communication aisée avec d'autres éléments d'un système d'information. |
Tous. |
Il est primordial de disposer d'un " outil " apte à assurer l'archivage et la gestion des divers enregistrements produits dans le cadre des activités de la maintenance (procédures, rapports de tests et procès verbaux, documentations techniques...). Cette aptitude devra être " épaulée " par une communication aisée de l'application avec d'autres logiciels existants dans l'entreprise ! (Bureautique, comptabilité, CAO/DAO, multimédia...) |
|
Fonctionnement en multipostes (et en mode client/Serveur avancé) |
- GBEA, |
Pour permettre un échange d'information rapide, fiable et générateur de gains de temps entre le service biomédical et l'ensemble de l'établissement. |
|
Gestion de l'accès des différents utilisateurs (par mot de passe). |
- GBEA, Le fait même d'être en réseau. |
L'accès de l'application ne doit être possible que par une identification de l'utilisateur et un mot de passe valide. Un profil doit être configurable de sorte que les utilisateurs ne puissent afficher et manipuler que les données autorisées. |
|
Interfaçages d'équipements de Contrôle, de Mesures et d'essai (ECME). |
Tous (à la matériovigilance prêt). |
Permet un transfert automatisé des résultats de test de performance, de sécurité et ou de contrôle qualité vers l'application. Il y a un gain de temps considérable, une diminution des risques d'erreurs et de l'archivage papier... |
* : SBM = Service Biomédical.
II. LES
BESOINS DES SERVICES BIOMEDICAUX
II.1 Enquête auprès d'un échantillon de services biomédicaux
II.1.1) Présentation de l'enquête
A partir de notre étude sur les exigences à respecter vis à vis du contexte réglementaire pour l'activité biomédicale, nous avons établit un questionnaire afin de connaître les attentes des services biomédicaux vis à vis des logiciels de GMAO. Composé de 16 questions, ce questionnaire est constitué de la manière suivante:
Ce questionnaire à été envoyé à 44 services biomédicaux (voir ci après la représentation géographique de l'enquête menée). Cette enquête à été transmise par messagerie Internet, sous format HTML, et conçue de sorte qu'il soit facile et rapide d'y répondre (case à cocher, ...).
Représentation géographique de l'enquête menée:
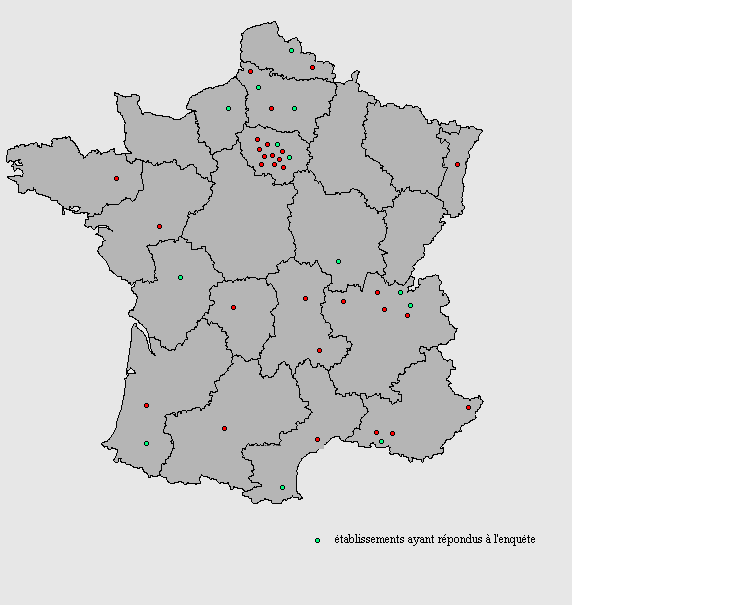
II.1.2) Analyse et interprétation des résultats de l'enquête
Sur 44 services biomédicaux sollicités, 14 ont répondu à l'enquête, soit un taux de réponse de 32%.
L'interprétation des résultats est basée sur le nombre de réponses.
Les résultats :
Sur ces 86%:
- 50% sont des GMAO "spécialisées biomédical"
- 36% sont des GMAO "industrielles"
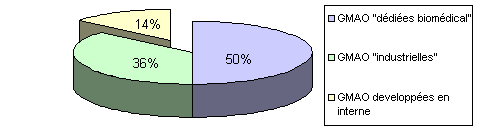
Sur la quantité des logiciels mis en place,
les logiciels spécifiquement développés pour le
biomédical, " Sophie " et " Optim ", sont assez logiquement
les plus implantés.
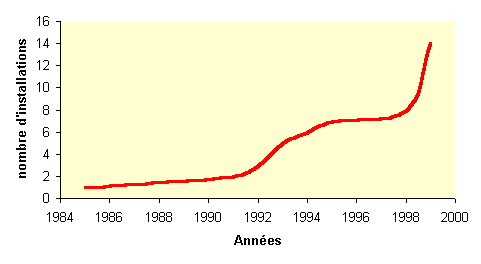
Cette courbe met en évidence que le nombre
d'installation de GMAO au sein des services biomédicaux
(AUDITES) est en sans cesse évolution avec une forte
progression en 1998. Le besoin d'un outil informatique se fait donc
ressentir pour pouvoir assurer la fonction "maintenance
biomédicale" et ceci en grande partie du fait des
différentes exigences réglementaires.
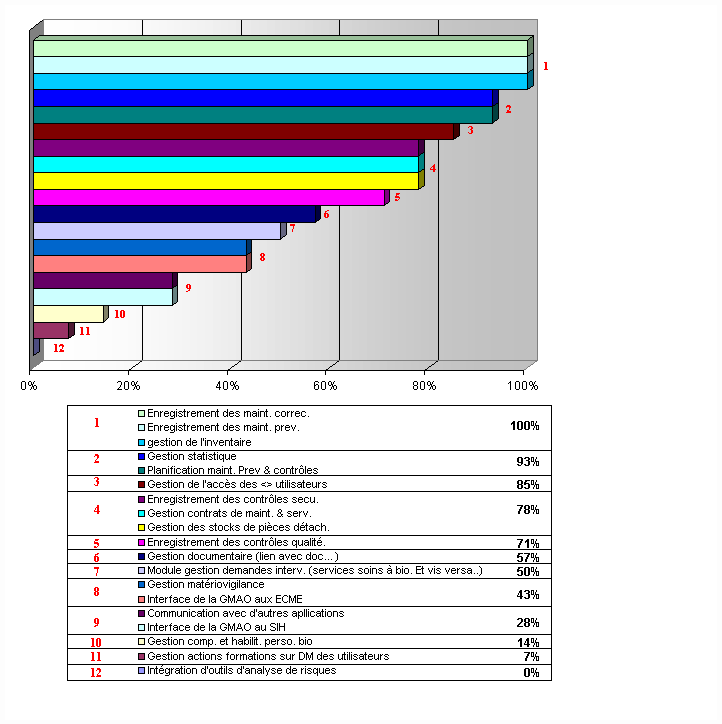
Il ressort de cet histogramme que les
fonctionnalités concernant la communication (avec d'autres
applications, interface SIH et au ECME), mais aussi tout ce qui
regroupe la gestion des informations, des habilitations et
l'intégration d'outils d'analyse de risques, sont très
peu présentes.
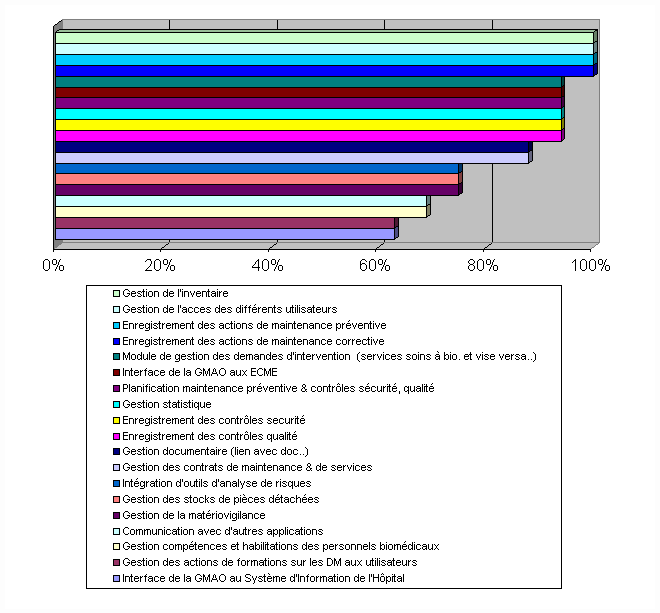
Aucune fonctionnalité possède, pour
les audités, un intérêt inférieur à
60%. Les fonctionnalités classées en fin de liste
(Intérêt compris entre 63 et 75%) sont celles qui
globalement n'existent pas sur les logiciels en place chez les
audités.
|
|
|
|
|
|
|
|
|
|
|
|
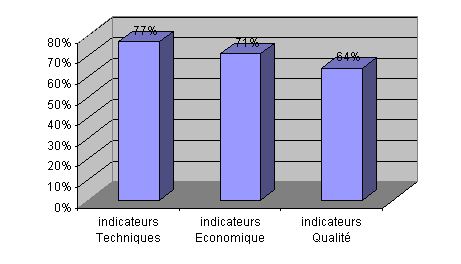
Classés par ordre croissant de
participation, les indicateurs techniques sont les plus
utilisés, vient ensuite les indicateurs économiques
puis qualité.
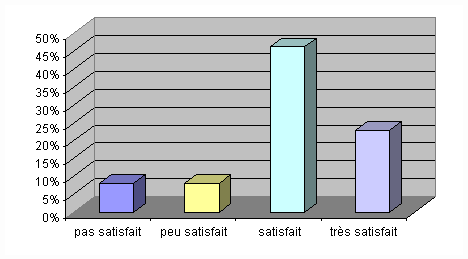
Voici un tableau, détaillant le
degré de satisfaction en fonction des différentes
GMAO:
|
|
|
|
|
|
|
|
(ancienne) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Il ressort de ce tableau que les audités
possédant des GMAO dédiées"biomédical"
(logiciels " Optim " et " Sophie ") sont les plus
satisfait.
II.2) Synthèse des besoins définis par les services biomédicaux
Les services biomédicaux souhaitent donc des produits assurant les fonctions suivantes :
(Classement par ordre de priorité)
Les fonctionnalités et aptitudes liées à la communication, l'échange de l'information et la qualité prennent de l'importance dans l'esprit des audités, puisque ces fonctionnalités, pour la plupart, absentes ou non installées sur leurs GMAO, ont un intérêt supérieur à 60 %.
L'accréditation, et les démarches
volontaires de certification de plus en plus nombreuses sont
certainement à l'origine de cet intérêt
grandissant.
III. ETUDE DES
PRINCIPAUX LOGICIELS DE GMAO DISPONIBLES
Cette étude à pour objet de présenter les principaux logiciels disponibles, en France, et d'évaluer leur adéquation avec les critères minimaux définis précédemment (fonctionnalités et aptitudes).
Pour cela, à partir d'une recherche réalisée principalement sur Internet et par le biais de revues spécialisées telles que Fonction maintenance et Maintenance et entreprise, treize éditeurs de solutions informatiques ont été identifiés.
Sur ces treize éditeurs, seuls six ont répondu à nos courriers de demande de renseignements postés courant novembre 1999. Des informations sur quatre des sept sociétés, n'ayant pas répondues, ont put être obtenues lors de la treizième édition du salon de la maintenance qui s'est tenu les 24-25-26 novembre 1999 à Paris (porte de Versailles) ou par le biais de contacts divers.
Cette étude porte donc sur dix fournisseurs de GMAO, et a été réalisée à partir des données récupérée sur les brochures commerciales, techniques et ou CD-rom de présentation (avec en général une version de démonstration du logiciel proposé).
Ces dix fabricants représentent plus de 80% de la base installée, de logiciels de GMAO, dans le secteur hospitalier.
En annexe 14, une liste complémentaire de logiciels disponibles sur le marché français, reprenant les coordonnées postales et/ou téléphoniques et informatiques des sociétés les commercialisant est proposée.
Il est possible de trouver sur le marché des logiciels dédiés au secteur biomédical. Par conséquent, nous avons délibérément présentés ces derniers logiciels et ceux rencontrés dans le secteur industriel sur deux tableaux séparés.
Ces tableaux s'attachent à présenter les différents points suivants :
L'environnement informatique du système :
Permet de connaître le langage de développement, le ou les systèmes d'exploitation compatibles et les bases de données supportées. A ce titre, pour être le plus ouvert possible, le logiciel doit intégrer une base de donnée " standard " travaillant donc sous SQL (Structured Query Language) et " puissante " afin de gérer les très grosses quantités d'information traitées par un logiciel de GMAO, sans avoir à attendre plus de quelques secondes lors d'une requête par exemple.
L'expérience montre que dans le domaine hospitalier, les deux bases de données les plus couramment rencontrées, toutes applications confondues, sont ORACLE© et SQL SERVER©. (Ces deux bases de données offrant par ailleurs, des garanties suffisantes quant à leur capacité à traiter de gros volumes d'informations et à communiquer sur l'extérieur).
Autres critères importants : le type d'architecture et l'ouverture du système à la technologie Intranet/Internet. Pour ce qui est de l'architecture, il faut s'orienter vers une solution " client/serveur évoluée ". En effet, tous les systèmes client/serveur ne sont pas construits de la même façon. Il faut en effet privilégier un système construit autour d'une véritable architecture à partie client allégée. Ainsi le serveur doit stocker et traiter la majeure partie des procédures afin de réduire le travail effectué sur les postes clients. Cette solution permet de diminuer les besoins en modernisation des processeurs coté client, et soulage l'administrateur du système en fournissant des mises à jour automatiques aux postes clients.
La technologie Intranet/Internet, permet de simplifier encore la configuration précédente, puisque dans ce cas, il n'est plus nécessaire d'installer l'application sur tous les postes clients mais uniquement coté serveur Intranet. Dans ce cas, l'application GMAO s'intègre totalement à l'Intranet de l'hôpital et les utilisateurs peuvent y accéder à partir du navigateur Intranet habituel installé dans l'hôpital. Cette solution est donc, pour les utilisateurs, gage de simplicité dans l'utilisation (réduisant par la même, le temps d'appropriation du logiciel). Coté administrateur système, les problèmes de mise à jour sont également grandement simplifiés et on peut espérer une diminution des coûts liés à la réduction du nombre de licences logicielles...
Les principales fonctions et aptitudes :
Nous avons repris les fonctions souhaitables dans le cadre de la réglementation et suite à l'enquête auprès des services biomédicaux hospitaliers.
Autres points :
III.2 Les logiciels rencontrés dans l'industrie
III.2.1) Présentation
Ces logiciels, comme l'indique l'enquête présentée au chapitre II, sont implantés à hauteur de 36% dans les services biomédicaux hospitaliers. Ce pourcentage semble se stabiliser, à cette valeur, depuis plusieurs années.
Il faut distinguer dans ces logiciels, deux grandes gammes de produits. La première, concerne des logiciels, relativement basiques, dont le prix oscille autour de vingt mille francs et la deuxième des produits plus " évolués " dont le prix dépasse généralement la centaine de milliers de francs et pouvant même atteindre plusieurs centaines de milliers de francs, dans des configurations étendues. Assez logiquement, les performances globales sont supérieures avec les produits de la deuxième gamme.
Enfin, les logiciels à " vocation "
industrielle privilégient une gestion par arborescence du parc
d'équipements. Cette méthode, n'est pas de, prime
abord, simple à appréhender. De plus dans le cas des
équipements biomédicaux, cette méthode n'est pas
forcément gage de simplicité.
III.2.2) Tableau des logiciels rencontrés dans l'industrie :
|
Société |
|
|
|
|
|
|
|
Nom du produit |
|
|
|
|
|
|
|
Environnement informatique |
|
|
|
|
|
|
|
Langage de développement de l'application |
|
|
|
|
|
|
|
Système d'exploitation (interfaçage graphique) |
|
OS/2, UNIX... (pour serveur) |
|
|
|
|
|
Supporte/utilise les bases de données: |
|
|
|
|
|
|
|
Type architecture |
|
|
|
|
|
|
|
Intégration de la technologie intranet/Internet |
|
|
|
|
|
|
|
Principales fonctions |
|
|
|
|
|
|
|
Type de gestion
inventaire |
|
(3 types fonctionnelle, locale, famille) |
|
|
|
|
|
Intégration d'un code inventaire "normalisé" |
|
|
|
|
|
|
|
Enregistrement par type d'
intervention |
oui ? ? |
oui ? ? |
oui oui oui |
oui ? oui |
oui ? ? |
oui ? ? |
|
Intègre un module de demande d'intervention utilisable par les services utilisateurs |
|
|
|
|
|
|
|
messagerie
électronique
|
|
|
électronique |
|
électronique |
|
|
Planification de la
maintenance |
|
|
|
|
|
|
|
Gestion des
alertes |
|
|
|
|
|
|
|
Gestion des stocks de pièces détachées |
|
|
|
|
|
|
|
Gestion des alertes (Seuils mini. atteints ...) |
|
|
|
|
|
|
|
Gestion des contrats de maintenance et de services associés |
|
|
|
|
|
|
|
Gestion des
alertes |
|
|
|
|
|
|
|
Gestion de la
matériovigilance |
|
|
|
|
|
|
|
Société |
|
|
|
|
|
|
|
Nom du produit |
|
|
|
|
|
|
|
Gestion des
compétences et habilitations |
|
|
|
|
|
|
|
Gestion des actions de
formation |
|
|
|
|
|
|
|
Intégration d'outils
d'aide dans l'analyse |
AMDEC
|
|
|
|
(type non précisé)
|
|
|
Gestion
statistiques |
|
|
|
|
|
|
|
Lien
documentaire |
|
|
|
|
|
|
|
Gestion des investissements (classe 2) |
|
|
|
|
|
|
|
Aptitude du produit à communiquer |
|
|
|
|
|
|
|
Gestion de l'accès des différents utilisateurs |
|
|
|
|
|
|
|
Export/Import de données vers/venant de tableurs... |
|
|
|
|
|
|
|
Interfaçage à des logiciels de l'établissement: achat, comptable, ERP... |
|
ERP, multimédia |
Tous logiciels financiers |
par table d'interface (API) |
par table d'interface (API) |
par table d'interface (API) |
|
Liste des produits interfacés |
|
|
|
les ERP |
les ERP |
|
|
Interfaçage, avéré, avec des ECME pour le |
|
|
|
|
|
|
|
Personnalisation logiciel possible |
|
|
|
|
|
|
|
Nombre de systèmes installés en France: |
|
|
|
|
|
|
|
- Toutes applications confondues: |
|
|
|
|
|
|
|
- Applications biomédicales |
|
|
|
|
|
|
|
Gamme de prix
(en francs Français
TTC) |
|
|
|
|
|
|
|
Observation(s) |
adaptation à prévoir Fonctionnalités qualités "originales" |
Analyse de défaillance Gestion par arborescence assez complexe |
Plus de 30 000 sites dont plus de 1000 dans les hôpitaux américains |
|
|
Analyse de défaillance |
|
Coordonnées des fabricants
|
84, bd du Gal Leclerc 59 100 ROUBAIX |
283, rue de l'étang 69 760 LIMONEST |
Z.A.C. des deux gares 34, av. F. Roosevelt 92 150 SURESNE |
Maintenance 81, rue de la gare 59 170 CROIX |
Immeuble ATRIA 2, rue du centre 93 885 NOISY LE GRAND |
6, rue Godefroy 92 821 PUTEAUX cedex |
|
Site Internet ou Email |
|
|
|
|
|
|
|
* Voir l'enquête (Chap. II). ** L4G: Langage de 4éme génération. |
||||||
III.3 Les
logiciels dédiés aux services
biomédicaux
III.3.1) Présentation
Quatre sociétés proposent des produits dédiés principalement à la maintenance en milieu hospitalier et plus précisément au génie biomédical.
Deux logiciels sont aujourd'hui
particulièrement bien implantés. Ce sont les logiciels
" Sophie " commercialisé par la société CGEM et
" Optim " par la société AGILENT (ex Hewlett
Packard).
III.3.2) Tableau des logiciels dédiés aux services biomédicaux
|
Société |
|
|
|
|
|
Nom du produit |
|
|
|
|
|
Environnement informatique |
|
|
|
|
|
Langage de développement de l'application |
|
|
|
|
|
Système d'exploitation (interfaçage graphique) |
|
OS/2, Unix... (pour serveur) |
|
|
|
Supporte/utilise les bases de données: |
|
|
|
|
|
Type architecture |
|
|
|
|
|
Intégration de la technologie Intranet/Internet |
|
|
|
|
|
Principales fonctions |
|
|
|
|
|
Type de gestion inventaire (Numéro ou arborescence) |
|
|
|
|
|
Intégration d'un code inventaire "normalisé" |
|
|
|
|
|
Enregistrement par type d'
intervention possible |
oui oui oui |
oui oui oui |
oui ? ? |
oui
|
|
Intègre un module de demande d'intervention utilisable par les services utilisateurs |
|
par Intranet |
|
|
|
Planification de la
maintenance |
|
|
|
|
|
Gestion des alertes (opérations non réalisées...) |
|
|
|
|
|
Gestion des stocks de pièces détachées |
|
|
|
|
|
Gestion des alertes (Seuils mini. atteints ...) |
|
|
|
|
|
Gestion des contrats de
maintenance |
|
|
|
|
|
Gestion des alertes (Échéances, visites non réalisées) |
|
|
|
|
|
Gestion de la matériovigilance (Intègre la tracabilité des actions menées pour chaque dossier) |
|
|
|
|
|
Société |
|
|
|
|
|
Nom du produit |
|
|
|
|
|
Gestion des
compétences et habilitations |
|
|
|
|
|
Gestion des actions de
formation des équipes |
|
|
|
|
|
Intégration d'outils d'aide dans l'analyse de risques (AMDEC, ...) |
|
|
|
|
|
Gestion
statistiques |
|
|
|
|
|
Lien documentaire (Lien à des documents scannés...) |
|
|
|
|
|
Gestion des investissements (classe 2) |
|
|
|
|
|
Aptitude du produit à communiquer |
|
|
|
|
|
Gestion de l'accès des différents utilisateurs |
|
|
|
|
|
Export/Import de données vers/venant de tableurs... |
|
|
|
|
|
Interfaçage à des logiciels de l'établissement: achat,comptable, ERP... |
|
|
|
|
|
Liste des produits interfacés |
|
|
(Ophélie...) |
|
|
Interfaçage, avéré, avec des ECME pour le transfert automatique des données |
|
|
|
|
|
Personnalisation logiciel possible |
|
|
|
|
|
Nombre de systèmes installés en France: |
|
|
|
|
|
- Toutes applications confondues: |
|
|||
|
- Applications biomédicales |
|
|
|
|
|
Gamme de prix
(en francs Français
TTC) |
|
|
|
|
|
Observation(s)
|
ceux obtenus d'une doc. de 1998. |
|
répondue à notre demande d'information les éléments sont ceux obtenus d'une doc. de 1997. |
ceux obtenus d'une doc. de 1998. |
|
Coordonnées des fabricants |
1 av. du Canada Z.I. de courtaboeuf 91 947 LES ULIS cedex |
32, 36 av. de l'Epi d'or 94 807 VILLEJUIF Cedex |
7, rue Aspasie & Jules Caron 94117 ARCEUIL cedex |
Résidence de l'Europe 5, rue du Tertre 44070 CARQUEFOU |
|
Site Internet ou Email |
|
|
|
|
|
* Voir l'enquête (Chap. II). ** L4G: Langage de 4éme génération. |
||||
III.4 Analyse comparée entre les besoins et les outils proposés
Les tableaux comparatifs, des pages précédentes, mettent en évidence qu'aucun logiciel de GMAO n'intègre la totalité des fonctionnalités définies dans le cadre du contexte réglementaire (chapitre I) ou souhaitées par les services biomédicaux (chapitre II).
Cette constatation est vrai pour les deux grandes catégories de logiciels étudiés (Industriel et biomédical).
En effet, les fonctionnalités suivantes ne sont pas présentes (ou leurs capacités sont insuffisantes) :
D'autres fonctionnalités, non évoquées dans les tableaux comparatifs précédents, comme la gestion de la satisfaction des " clients ", la gestion des non conformités, la gestion de la documentation qualité.... n'existent pas.
A noter que ce type de fonctionnalités peuvent être obtenues par le biais de logiciels spécifiquement dédiés à la qualité. A titre d'exemple le logiciel qualité " INQA 9000 santé " de la société INQA basée à Tours (37). Ce logiciel permet de gérer la majeure partie des opérations liées à la mise en place d'un système d'assurance de la qualité au sein d'un établissement de santé comme la gestion documentaire (logigrammes, processus, protocoles,...), suivi des compétences et des formations, suivi des vigilances, gestion de non conformités, auto-évaluation...
Il est donc possible d'imaginer l'utilisation
couplée d'un logiciel de GMAO et qualité afin de
satisfaire pleinement aux critères prédéfinis.
Dans ce cas, il faudra pouvoir interfacer les deux logiciels afin de
permettre un échange, en routine et de façon
automatisé, de certaines informations. Cet interfaçage
sera d'autant plus facile à mettre en
IV. VERS UNE NORMALISATION DE LA G.M.A.O
La multiplication des G.M.A.O utilisées dans les établissements de santé se traduit par une diversité des logiciels implantés. Cette diversité est une preuve de créativité et donne aux utilisateurs la possibilité de faire un choix plus vaste. Mais comme le montre les chapitres précédents, certains logiciels n'assurent pas forcément certaines fonctions devenues, par l'évolution des réglementations et des mentalités, indispensables. Des interrogations subsistes également quant à leurs réelles capacités à s'intégrer au système d'information de l'hôpital ...
Par conséquent, il est intéressant d'envisager la normalisation de certaines fonctionnalités de l'outil GMAO et de définir des garanties minimales en terme de capacités à communiquer et sur des aspects de sécurité et d'archivage des données.
Enfin, des paramètres externes aux
logiciels de GMAO, mais qui conditionnent beaucoup leur
cohérence et donc le partage d'informations entre ces
mêmes logiciels, sont abordés dans le présent
chapitre (Nomenclature des dispositifs médicaux, nomenclature
des services, ...).
IV.1. Présentation et intérêt de la normalisation
IV.1.1. Définition de la normalisation
D'après le Décret n° 84-74 du 26 janvier 1984:
" La normalisation à pour objet de fournir des documents de référence comportant des solutions à des problèmes techniques et commerciaux concernant les produits biens et services, qui se posent de façon répétée dans les relations entre partenaires économiques, scientifiques, techniques ou sociaux "
Une norme relative aux équipements biomédicaux permet la présomption de conformité aux exigences essentielles de sécurité et de santé.
Bien qu'elles n'aient pas un caractère obligatoire, elles constituent des outils privilégiés car issue d'un consensus entre les différents acteurs d'une profession.
Cependant pour que le consensus à l'origine d'une norme soit le plus représentatif des professionnels, ils leur est conseillé d'assister et de participer à l'élaboration de ces normes. Cette participation pouvant être coordonnée par les syndicats de professionnels de santé et des sociétés savantes.
L'articulation entre normalisation et réglementation est principalement définie dans l'article R.665-13 du Code de la Santé Publique . C'est L'AFNOR (Association Française de NORmalisation ) qui est chargée d'élaborer et gérer les normes.
IV.1.2. Intérêt d'un norme
L'intérêt des normes réside dans
le fait qu'elles apportent une clarification des solutions techniques
pour assurer la sécurité et la qualité des
dispositifs médicaux, elles sont par conséquent
régulièrement révisables.
Bien que la G.M.A.O ne soit pas d'après la définition de la directive CE, un dispositif médical, elle intervient en tant qu'outil de la maîtrise de la fonction maintenance qui est d'assurer la disponibilité des DM dans de bonnes conditions de fonctionnement et en toute sécurité pour le patient et les utilisateurs.
Dans la mesure où des données
relatives à la sécurité et à la
qualité y sont enregistrées, elles pourraient dans des
conditions de sécurité qui restent à
définir, assurer les fonctions des registres qualité et
sécurité obligatoires et précisés par la
réglementation.
IV.2. Différents axes d'études
IV.2.1 Définition des fonctions minimales
Après recoupement des différentes exigences de la réglementation, il se dégage 9 grandes fonctionnalités :
Elles sont développées ci-dessous,
sous forme de tableaux qui proposent lorsque cela est possible
certains champs ou liens (en bleu ) afin d'apporter quelques
complément d'information.
|
Inventaire |
La G.M.A.O doit permettre la gestion de l'inventaire pour les équipements ci-dessous :
Avec la Matériovigilance et l'Accréditation, tous les équipements biomédicaux sont concernés
|
|
Exemple de champs |
Equipement |
|
|
|
Numéro inventaire |
Contrat |
Produit |
|
|
Modèle |
Maintenance |
Numéro |
|
|
Version logiciel |
Tableau de bord |
Désignation |
|
|
Marque |
Gestion des pièces détachées |
Catégorie |
|
|
N° de série |
Groupe générique de DM |
||
|
Fournisseur |
Type du DM |
||
|
Etat |
Service |
||
|
Localisation |
U.A. unité administrative |
||
|
Libellé du service |
U.F unité fonctionnelle |
||
|
Date d'achat |
C.R. centre de responsabilité |
||
|
Date de mise en service |
|
|
Enregistrement
et suivi des différentes actions de
maintenance
|
La G.M.A.O.
doit permettre l'enregistrement des différentes
actions de maintenance (internes ou
externes):
Les
opérations de maintenance touchent des personnels
divers (utilisateurs, techniciens biomédicaux
internes et/ou externes...) il paraît judicieux de
disposer d'une application accessible, par les
différents acteurs, à la fois des services
utilisateurs et du service biomédical, donc en
réseau. Des
codes d'accès permettant l'identification du
demandeur, l'oriente, vers les différentes
fonctionnalités auxquelles il est autorisé
à accéder. Différentes
classes d'opérations doivent également
être définies (voir colonne type de
maintenance).
|
|||
|
Exemple de
champs obligatoires
|
|
|
|
|
|
N°
identifiant (Code
d'accès)
|
Utilisateurs
(1er niveau)
|
Inspection,
Nettoyage, Désinfection,
Remplacement de
capteurs, Etalonnage,
Contrôle
qualité...
|
N°
inventaire équipement, Date
de l'intervention, Etat
de l'intervention (A
faire, en cours, clôturée, ...), Nature
de l'intervention, Gestion
des stocks, Connexion
à un ECME, Planification
de la maintenance.
|
|
|
Service
biomédical
|
Maintenance
corrective Maintenance
préventive Contrôle
sécurité Contrôle
qualité, ...
|
|||
|
|
Services
externes Organismes
de contrôles
|
|||
|
Planification de la maintenance |
La G.M.A.O doit intégrer :
|
|
|
Exemple de champs |
|
|
|
N° inventaire des équipements |
Services (UA, UF) |
|
|
N° identifiant |
Dates prévisionnelles des visites |
|
|
N° de dossier |
Gestion des alarmes |
|
|
Contacts |
Délai d'avertissement avant déclenchement de l'alarme (rappel) |
|
|
|
||
|
|
Seuil du compteur horaire du DM |
|
|
Suivi des contrats de maintenance. |
La G.M.A.O doit permettre le suivi des contrats :
|
||
|
Exemple de champs |
|
|
|
|
N°inventaire des équipements concernés |
Contact (nom prénom) |
||
|
N° de contrat |
Société/organisme |
||
|
Libellé du contrat |
|
Adresse |
|
|
Date de début du contrat |
Déplacement inclut |
Moyens de communication |
|
|
Date de fin du contrat |
Sur site |
Téléphone |
|
|
Délai de résiliation |
En atelier |
Fax |
|
|
Contact (nom prénom) |
MO incluse |
|
|
|
Montant du contrat |
Kit de maintenance |
URL |
|
|
Formule de réactualisation |
|
|
|
|
Champ des clauses particulières |
|
||
|
Planification des visites (périodicité) |
|
||
|
Matériovigilance |
La G.M.A.O doit permettre :
|
|||
|
Exemple de champs |
|
|
|
G.E.D |
|
N° identifiant (code d'accès) |
Utilisateurs |
Des actions de maintenances réalisées |
Déclaration d'incident |
|
|
Service biomédical |
||||
|
Correspondant Matériovigilance |
Des fiches de déclaration |
Envoie des fiches CERFA Enregistrement des fiches d'alertes |
||
|
Gestion des pièces détachées |
Cette fonctionnalité doit permettre de prendre en compte les pièces détachées ou certains consommables fournis par le SBM indispensables pour assurer la continuité de fonctionnement d'une sélection de dispositifs médicaux considérés comme vitaux. |
||
|
Exemple de champs |
|
|
|
|
N° inventaire de la pièce |
Seuil mini |
Référence des pièces |
|
|
N° inventaire du DM |
Alarmes |
Prix (facultatif) |
|
|
N° nomenclature |
Services concernés |
Contact |
|
|
|
Contacts |
|
|
|
Suivi des qualifications et des
formations des personnels Gestion des plannings
|
Suivi des qualifications et des formations des personnels biomédicaux internes. Toutes les personnes amenées à intervenir sur les installations et les dispositifs médicaux doivent être formées ! Suivi des formations aux utilisateurs réalisées sous la responsabilité du service biomédical. Suivi prévisionnel de la présence des personnels biomédicaux en fonction de leur qualification afin d'assurer la continuité de la maintenance, donc des soins. |
|||
|
Exemple de champs obligatoires |
|
|
|
|
|
N° identification |
Date formation |
Interne |
Des formations |
|
|
Nom |
Nature de la formation |
Externe |
Date de la prochaine formation |
|
|
Prénom |
Lieux |
Formation |
Formateur |
|
|
Qualité |
Coût |
Habilitation |
|
|
|
|
N° nomenclature des équipements concernés |
Qualification |
Des congés et repos |
|
|
|
Localisation des certificats. |
|
|
|
|
Indicateurs et tableau de bord |
Extraction d'indicateurs paramétrables afin de suivre les objectifs fixés et d'optimiser la gestion du parc d'équipement biomédical... L'obtention des données doit se réaliser rapidement de façon fiable et simplement. La norme NFX 60-020 version 95 définit des indicateurs de maintenance. |
||
|
Exemple de champs |
|
|
|
|
N° identifiant |
techniques |
Construction |
|
|
N° inventaire des DM |
économiques |
Ou liens vers d'autres applications |
|
|
N° nomenclature |
qualités |
||
IV.2.2. Définition d'aptitude et fonctionnalités complémentaires
Les autres fonctionnalité ci-dessous ne sont pas obligatoires, mais permettent de satisfaire aux exigences réglementaires avec plus de facilité pour les utilisateurs, et les intervenants de la maintenance.
|
Mise en réseau |
La mise en réseau de la GMAO permet une meilleure diffusion de l'information assurant une amélioration de la communication entre les différents services de l'établissement. Une traçabilité sans discontinuité est assurée. Les applications définies ci-dessous sont directement concernées par cette aptitude. |
|
|
Exemple de champs |
|
|
|
N° identifiant |
Visualisation de l'inventaire |
|
|
Demandes d'interventions |
||
|
Demandes d'approvisionnement en accessoires & consommables |
||
|
Messagerie |
||
|
Suivi du plan d'équipement.. |
||
|
Maintenance |
||
|
Matériovigilance,... |
||
|
Matériovigilance (suite)
|
L'analyse des incidents devrait faire l'objet d'enregistrements. Un outil d'aide " quantitatif " permettant de définir si l'incident doit être déclaré avec ou sans délai serait fort utile ù Un outil " normalisé " devrait être développé dans cet esprit par les autorités et intégré aux logiciels de " G.M.A.O. ". A ce sujet voir l'article paru dans la revue RBM news n°21 (1999), p17-18 L'application doit permettre de réaliser et transmettre les déclarations internes de matériovigilance (du service x de l'établissement au correspondant ou ses suppléants) via le réseau informatique de l'établissement. Intérêt de réaliser
des études statistiques sur les répercutions
de la matériovigilance dans l'établissement.
(Coûts, temps passé, délai de mise en
|
|
Suivi du plan d'équipement |
La G.M.A.O. doit permettre le suivi, pour chaque dispositif médical des différentes phases d'achat des dispositifs médicaux :
L'intérêt du suivi du plan d'équipement en réseau réside dans le fait que la traçabilité des différentes phases d'achat est renforcée et cela permet d'éviter la perte des fiches d'évaluation par les utilisateurs... |
|
|
Exemple de champs |
|
|
|
N° identification |
N° nomenclature des DM |
|
|
N° de dossier |
Nom des service (U.A., U.F.) |
|
|
|
Fiche d'évaluation type |
|
|
|
Contacts |
|
|
Aptitudes à la Gestion Electronique de Documents (GED) |
L'aptitude à gérer des documents électroniques rendrait plusieurs services :
Au minimum, la G.M.A.O disposera d'un " champ " permettant d'indiquer, pour chaque appareil, la localisation et la version des documentations papier et/ou un lien possible avec une autre application accès sur ce type de prestations :
|
|
Intégration de fonctions qualité |
Différents outils devraient être intégrés pour permettre :
Ces outils relatifs à la qualité doivent ils être intégrés à la G.M.A.O ? Ne serait il pas plus intéressant d'utiliser un logiciel dédié à l'assurance qualité en relation avec la G.M.A.O ? |
IV.2.3. Définition de spécifications techniques importantes.
Le logiciel de GMAO doit donner des garanties suffisantes en terme de sécurité, de communication avec d'autres applications et de pérennité. Ces trois grands points sont développés ci-après :
a) Sécurisation du système
D'après le Guide de bonne utilisation de l'informatique (G.B.U.I20), document réalisé par la Société Française d'Informatique de Laboratoires en complément du G.B.E.A. :
" la sécurité des données, est la qualité d'un système informatique qui garantit que les informations qu'il contient sont identiques à celles qui ont été introduites dans les systèmes, qu'elles n'ont pas subies d'altérations, ou de modifications, au cours des divers traitements et qu'il n'y a pas eu perte ou altération d'information. "
On distingue généralement 3 niveaux de sécurités :
a.a) L'accessibilité
:
Elle définit le fait que l'information est, ou n'est pas directement consultable par des personnes extérieures au service concerné.
Cette accessibilité est généralement régie par mot de passe. Chaque personne susceptible d'accéder à l'information doit entrer son propre mot de passe. Il permet une identification de l'utilisateur et évite une éventuelle pollution de la base de données par une personne non habilité.
Différents niveaux d'accès doivent
pouvoir être définis, les trois principaux étant
:
|
3 |
|
|
2 |
|
|
1 |
|
a.b) La protection de l'intégrité des données :
L'intégrité des données traduit le fait que toutes les données sont conformes à leur entrée.
Cela implique que le système informatique soit conçu de façon à éviter les erreurs de saisie, de traitement, de stockage, de transmission et d'archivage. Mais aussi qu'il existe des procédures permettant de restaurer les données à leur valeur d'origine en cas de constatation d'erreur de celles-ci.
Un indicateur simple pour savoir si la procédure d'archivage s'est déroulée correctement est la taille du fichier de sauvegarde de la base de données. Elle est en général supérieure à la taille du fichier de sauvegarde précédente.
Un " journal " enregistrant les différentes opérations effectuées sur la base de données doit exister et être accessible uniquement aux personnes autorisées (en général, l'administrateur du système).
L'archive constituée par les
différents volume de sauvegarde (constitué du
journal, de la taille et de la date d'enregistrement de la base de
données) doit être conservée dans un endroit
sécurisé. En d'autres termes, sous une forme qui ne
puisse pas être altérée.
a.c) La confidentialité :
Le G.B.U.I dans sa partie II-1 (page 12), donne ici la définition suivante :
" Le devoir de confidentialité s'étend à toute personne ayant accès aux données dans l'exercice normal de ses fonctions sous la responsabilité de l'administrateur du système.
Cela implique que l'ensemble des utilisateurs est soumis au secret professionnel et que les personnels des sociétés de service chargés de la maintenance du système informatique sont soumis au secret professionnel et au devoir de confidentialité. "
Etant donnée la nature des données
stockées dans le cadre de la maintenance, il n'est peut
être pas justifié de recourir à cette
définition. Il faut rappeler que le guide de bonne utilisation
de l'informatique est un document qui apporte un certain nombre de
réponses aux exigences du Guide des Bonnes Exécution
des Analyses qui s'applique aux Laboratoires de Biologie
Médicale, donc en relation avec le dossier médicale des
patients.
b) Communicabilité et interfaçage
La nécessité de faire communiquer plusieurs systèmes informatique ensembles, afin de réunir les différentes données (économiques logistiques et techniques ) pour la construction des indicateurs et des tableaux de bords, ainsi que l'opportunité d'échanger des données entre les Equipements de Contrôle de Mesures et Essais (E.C.M.E.) et les G.M.A.O nécessite l'usage d'un environnement informatique possédant des protocoles de communication " standards ".
Il existe plusieurs niveaux de communicabilité et d'interfaçage :
b.a) Echange de données par
Intranet
De la même manière qu'il existe des grands réseaux comme Internet, il existe des réseaux locaux (Local .Area .Network.) comme l' Intranet. Ces réseaux qui composent certains système Informatique Hospitalier (S.I.H.) permettent des activités telles que :
- Textes
- Images
- Son
L'Intranet se présente de la même façon que Internet à la différence près que l'on accède aux données internes de l'établissement de santé et non à des données externes. Cette communication par Intranet apporte plusieurs opportunités.
Ainsi les services de soins peuvent avoir
accès à différentes informations relatives
à la maintenance pratiquée dans leur service telles que
:
|
La visualisation de l'inventaire |
Les personnes autorisées peuvent avoir accès à leur inventaire d'équipement biomédicaux. |
|
Les demandes d'intervention |
L'utilisateur rédige son bon d'intervention informatique et il est directement transmis au service biomédical, |
|
Les demandes de consommables et accessoires |
L'utilisateur remplis le formulaire informatisé de demande d'approvisionnement en consommables et accessoires. (gestion des stock) |
|
Le suivi des intervention en cours |
Permet de connaître l'état d'avancement d'une réparation |
|
Le suivi des investissements |
Pour connaître l'avancement du plan d'équipement pour son service. |
A terme, on peut aussi envisager que les co-traitants ainsi que les organismes de contrôles puissent transmettre leurs rapports d'interventions et leurs rapports de contrôles directement aux services biomédicaux via Internet.
Le ministère de la santé, par le biais de l'AFSSAPS, pourrait également envoyer les fiches d'alertes relatives à la matériovigilance par messagerie électronique (via Internet) et recevoir les fiches de déclaration d'incidents émanent des correspondants locaux de matériovigilance.
La mise en réseau des différents
partenaires de la maintenance permet de définir un nouveau
concept : le S.I.M.H. pour système d'Information de la
Maintenance Hospitalière, dont une représentation
schématique est donnée page suivante:
REPRESENTATION schematique DU SYSTEME D'INFORMATION DE LA MAINTENANCE HOSPITALIERE (S.I.M.H.)
b.b) Echange de données entre E.C.M.E et G.M.A.O
Le renforcement de la veille sanitaire institué par la loi du 1er juillet 1998 obligera l'accroissement des contrôles de sécurité et de qualité. La mise en place de ces programmes accrus de contrôles qualité sur les dispositifs médicaux engendrera une augmentation de l'activité qui devra être compensée par une diminution du temps passé au traitement et à l'archivage des résultats de tests.
Ainsi la GMAO doit pouvoir collecter et classer
automatiquement les résultats des tests effectués par
les ECME (après une validation du technicien responsable du
contrôle).
Représentation des liaisons entre ECME et la G.M.A.O.
b.c) Echange de données entre G.M.A.O et les autres applications informatiques de l'hôpital
Pour permettre un échange des données donc un partage de l'information, il est important de pouvoir s'interfacer avec les autres progiciels (ERP) présents à l'hôpital comme :
Cette capacité évite notamment les
doubles saisies sources d'erreurs et de perte de temps.
c) Pérennité
Pour assurer des sauvegardes qui puissent être réutilisées par une autre G.M.A.O, garantissant ainsi la pérennité des données archivées il est important que cette sauvegarde réponde à certaines caractéristiques :
Il est d'autant plus important de pouvoir garantir
la pérennité des données enregistrées que
le logiciel de GMAO est utilisé pour gérer des
données légales comme celles contenues dans les
registres de sécurité et de qualité.
IV.2.4.Définition d'un environnement commun.
Pour permettre l'échange d'informations d'un établissement à un autre il est nécessaire de " parler " le même langage. Ainsi, des éléments comme la nomenclature des dispositifs médicaux ou la dénomination des différents services doivent être les mêmes.
Ces deux nomenclatures, utilisées dans les
établissements de santé, permettent de suivre un
équipement sur le plan technique, logistique et
économique.
a) La nomenclature produit
C'est à partir de la nomenclature produit que les équipements biomédicaux sont répertoriés à l'hôpital. Selon le projet de norme ISO 15 225 la nouvelle nomenclature produit se présente sous la forme suivante :
Cette représentation à l'avantage d'offrir plusieurs filtres de recherche afin de faire des recoupements d'équipements.
Pour le moment, de nombreux établissements
de santé utilisent la nomenclature du
C.N.E.H.11
(datant de 1992 et à ce jour jamais
réactualisée). Une version remaniée est en cours
de parution. Toutefois, le projet de norme en cours, s'appui sur la
nomenclature développée par
l'ECRI12
donc l'avenir de la nomenclature " CNEH " est probablement
compromis...
b) La nomenclature service
Il existe une nomenclature service qui répertorie les différents services de soins, médico-techniques, administratifs, techniques et logistiques. Elle permet une gestion analytique des comptes et permet le suivi financier des équipements. On distingue les unités administratives (U.A), les unités fonctionnelles (U.F.), et les centres de responsabilités (C.R.).
Ces nomenclatures pouvant évoluer, la
G.M.A.O doit donc pouvoir disposer de tables de données
évolutives et/ou transposables lorsque des changements sont
à effectuer.
c) Définition d'un catalogue commun d'indicateurs
L'intérêt d'un catalogue commun d'indicateurs, serait la mise en place d'une base de données nationale capable d'offrir une aide à la décision d'achat (optimisation des investissements en comparant des dispositifs déjà en place), au choix ou à l'optimisation de sa politique de maintenance en vérifiant ses propres résultats par rapport à des moyennes et indirectement une aide à la gestion de la sécurité et de la fiabilité des équipements.
En effet, le suivi des dispositifs médicaux sur un site hospitalier à l'aide d'une G.M.A.O. même s'il permet une bonne gestion de son parc, n'offre pas un échantillon représentatif en terme statistique, pour certains équipements.
Dans sa thèse*, Laurent Bourgeois à décrit l'intérêt d'une telle base de données. Son travail a consisté à étudier la possibilité de transférer, au secteur biomédical, différents concepts appliquées dans l'industrie. On y retrouve notamment les indicateurs et tableaux de bords, comment les construire et l'intérêt de la comparaison inter-site (benchmarking22 ).
L'objectif de la comparaison inter-site, méthode importée des Etats-Unis, est de permettre à chaque adhérent d'étalonner ses performances en les comparants à celles de ses confrères et d'identifier de meilleures pratiques.
D'après Laurent Bourgeois " La communication d'ordre technique voire organisationnelle, s'inscrit complètement dans cette démarche d'amélioration de l'efficacité d'un service biomédical et vient de ce fait, renforcer la démarche Qualité. Pour la profession des Ingénieurs biomédicaux, cette base nationale serait un outil d'aide : à la maintenance, à la décision d'achat, et indirectement, à la gestion de la sécurité et de la fiabilité.
Pour que ces indicateurs soient pertinents, il est nécessaire que les données qui ont servis à leurs élaborations soient cohérentes, et standardisées pour l'ensemble des G.M.A.O des adhérents. En effet les indicateurs de maintenance sont construis à partir de données économiques, techniques et logistiques qui doivent être issues d'un même référentiel pour être pertinents et représentatifs.
REPRESENTATION DE LA BASE DE DONNEES NATIONALE
Les logiciels de GMAO, dans le contexte réglementaire actuel, deviennent inéluctables. Ils sont une aide indispensable dans la gestion quotidienne de l'activité du service biomédical. Ils peuvent permettre, par la somme des données recueillies, de " voir plus large " et donc de mieux gérer et planifier ses actions en toute connaissance de cause. De même, leur utilisation comme registre qualité/sécurité (sous réserve d'une évolution de la réglementation sur la validité des enregistrements informatiques) est un atout supplémentaire.
Toutefois, l'enquête menée auprès des différents services biomédicaux et l'étude des logiciels existants, montrent que les logiciels n'assurent pas toutes les fonctions souhaitables dans le cadre de la réglementation.
La définition d'une norme d'objectifs permettant de fixer des spécifications minimales est une démarche à approfondir.
Ces spécifications devraient notamment porter sur les fonctions jugées minimales, la sauvegarde et les conditions d'accès aux données, et la capacité des logiciels à partager leurs données (ouverture).
La définition d'un environnement commun (nomenclature des dispositifs médicaux, nom et code des services...) commun à l'ensemble des logiciels est également important pour permettre, dans l'avenir, une mutualisation des informations relatives au dispositifs médicaux.
Dans tous les cas, des solutions " standards " sont à privilégier, que se soit au niveau hardware ou logiciel (type de serveur, postes clients, base de données...).
Enfin, aux vues des profondes mutations en cours
et à venir de cet outil, il serait plus opportun de parler
de système d'information de la maintenance
hospitalière.
1 : Dispositif médical : Tous instrument, appareil, équipement, matière ou autre article, utilisé seul ou en association, y compris le logiciel nécessaire pour le bon fonctionnement de celui-ci, destiné par le fabricant à être utilisé chez l'homme à des fins :
- de diagnostic, de prévention, de contrôle, de traitement ou d'atténuation d'une maladie,
- de diagnostic, de contrôle, de traitement, d'atténuation ou de compensation d'une blessure ou d'un handicap,
- d'étude ou de remplacement ou modification de l'anatomie ou d'un processus physiologique,
- de maîtrise de la conception,
et donc l'action principale voulue dans ou sur le corps humain n'est pas obtenue par des moyens pharmacologiques ou immunologiques ni par métabolisme, mais donc la fonction peut être assistée par de tels moyens.
2 : G-MED : Groupement pour l'évaluation des dispositifs MEDicaux. Le G-MED est un GIE (Groupement d'Intérêt Economique) qui associe les moyens de deux laboratoires : le LCIE (Laboratoire Central des Industries Electriques) et le LNE (Laboratoire National d'Essais).
3 : Instrument de pesage à fonctionnement non automatique : Instrument de pesage nécessitant l'intervention d'un opérateur au cours de la pesée.
4 : TPM pour Total Productive Maintenance : Démarche qui réside dans l'élargissement de la fonction maintenance à la totalité du personnel. Ce n'est plus seulement le service biomédical qui est concerné, mais l'ensemble de l'établissement et en particulier les utilisateurs direct des équipements. Il s'agit ainsi d'un véritable décloisonnement de structures rigides afin d'agir le plus efficacement possible sur la totalité des paramètres dont dépend la performance des équipements. L'un des concepteurs de cette démarche est le Japonais Kunio SHIROSE (Voir bibliographie).
5 : Professionnel : Personne exerçant une activité, salariée ou non, dans un établissement de soins.
6 : Réseau de distribution de gaz médicaux : Réseau entier comprenant une centrale d'approvisionnement avec son tableau de commande, un réseau de canalisations et des prises murales fournissant les gaz médicaux avec son tableau de commande, un réseau de canalisations et des prises murales fournissant les gaz médicaux.
7 : Phacoémulsificateur : Dispositif médical utilisé lors d'opérations de la cataracte pour réaliser des phacoémulsifications. La phacoémulsification étant une technique récente d'extraction extracapsullaire du cristallin associant l'émulsification du contenu du cristallin par une sonde produisant des ultrasons, et son aspiration.
8 : Gestion Electronique de Documents : La GED permet de classer, gérer et stocker des documents préalablement numérisés, et de faciliter leur accès, leur mise à jour et leur diffusion. La GED permet donc de remplacer une grande partie des documentations papiers par un support électronique.
9 : Champ : Dans un enregistrement, emplacement réservé à une catégorie particulière de données.
10 : Appareils à pression de vapeur à couvercle amovible : Est amovible, au sens des textes tout couvercle assujetti sur l'appareil au moyen d'un ou plusieurs organes conçus pour permettre des fermetures et ouvertures plus rapides qu'avec des éléments de boulonnerie de conception courante.
11 : CNEH : Centre National d'Etudes Hospitalières. Organisme professionnel à statut associatif et à but non lucratif. Les principales missions du CNEH sont : le conseil, l'expertise, la formation, l'information dans les domaines de la santé.
12 : ECRI : Emergency Care Research Institute. L'ECRI est un institut américain privé, à but non lucratif. Il a été fondé il y a 20 ans pour évaluer en toute indépendance les performances des matériels médicaux.
13 : Enregistrement : Document qui fournit des preuves tangibles des activités effectuées ou des résultats obtenus.
14 : Qualification opérationnelle : Obtention et documentation de preuves selon lesquelles l'équipement fournira un produit acceptable dans la mesure ou il sera utilisé conformément aux spécifications du procédé.
15 : COFRAC : Comité Français d'Accréditation. Le COFRAC à pour principale mission de procéder à l'accréditation de tous les organismes de contrôle intervenant pour évaluer la conformité à un référentiel.
16 : CLIN : Comité de Lutte Contre les Infections Nosocomiales.
17 : ERP : Enterprise Ressource Planning, qui peut être traduit en français par gestion des ressources de l'entreprise. Celles-ci peuvent être classées en 3 catégories : humaines (paye et gestion du personnel), financières (comptabilité, analyse de gestion) et logistique (gestion des achats, de la maintenance, de la qualité, de la production...). Le terme français est Progiciel Intégré de Gestion (PIG).
18 : API : Application Programming Interface. C'est un " outil " fourni à un développeur pour réaliser des échanges de données entre deux applications.
19 : ODBC : Open Data Base Connectivity. API standard de Microsoft qui permet l'accès d'un programme client Windows à un très grand nombre de systèmes de gestion de base de données.
20 : GBUI: Guide de Bonne Utilisation de l'Informatique. A partir des textes réglementaires et sur la base d'une réflexion globale sur les modes de fonctionnement des laboratoires et sur l'utilisation des systèmes informatiques, la Société Française d'Informatique de Laboratoire (SFIL) à émis des recommandations qui s'articulent autour d'un certains nombre d'idées forces comme le respect du cadre juridique et réglementaire, la protection des personnes et du secret médical, l'assurance qualité des systèmes informatiques de laboratoire, traçabilité des actions et interventions... Pour en savoir plus, la SFIL dispose d'un site Internet : www.chez.com/sfil
21 : ULHIN : Unité de Lutte Contre le Infections Nosocomiales.
22 : Benchmarking : Démarche continue et méthodique d'évaluation des performances opérationnelles des méthodes et processus de gestion comparé à ceux d'autres entreprises performantes afin d'accroître sa position stratégique et de mieux satisfaire ses clients. Le benchmarking repose sur la découverte et le partage d'informations entre partenaires.
TEXTES REGLEMENTAIRES
Directives européennes :
Lois :
Décrets :
Arrêtés :
Code de la santé publique (CSP) :
Lettres circulaires émanant de la Direction des Hôpitaux :
NORMES
ARTICLES
MEMOIRES ou THESES D'ETUDIANTS
OUVRAGES
SITES INTERNET
|
N° |
|
|
|
|
|
|
|
|
|
|
Tous les appareils équipant le laboratoire |
Inspection, nettoyage, entretien et vérification périodique et efficace des appareils selon une procédure opératoire . |
Selon les recommandations du fabricant ou du vendeur |
Personnel qualifié,
compétent, formé et
expérimenté.
|
Un registre de maintenance propre à chaque instrument. (Sous la responsabilité du biologiste responsable de l'assurance qualité) Conservation pendant la durée d'utilisation des appareils. |
Personnel utilisateur, de maintenance et autorités sanitaires. |
|
|
|
Tous les appareils équipant le laboratoire |
Mise à disposition des notices d'utilisation et de maintenance |
Permanente |
Fabricant sous contrôle chef de service labo. et service biomédical. |
|
Personnel utilisateur, de maintenance et autorités sanitaires. |
|
|
|
L'appareillage et les matériels |
Rédaction et disponibilité des procédures opératoires (utilisation, entretien, étalonnage, vérification) |
Evolution selon les connaissances et données techniques |
Personnel qualifié, compétent, formé et expérimenté. |
Non défini. Conservation dans un fichier chronologique. |
Personnel utilisateur, de maintenance et autorités sanitaires. |
Nota : Il est spécifié
dans l'annexe, au chapitre VI-2, qu'en cas d'archivage informatique
des documents, une procédure de stockage doit être
établie pour éviter toute perte accidentelle des
informations. Les informations archivées doivent être
dupliquées sur deux supports distincts : le premier
servant à la consultation habituelle et le second étant
gardé en réserve. Enfin la lecture des informations
archivées doit pouvoir être accessible et
consultée pendant toute la durée de leur conservation.
(soit la durée d'utilisation des appareils).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N° |
|
|
|
|
|
|
|
|
|
|
Définit par les articles D.712-43 et D712-47 du code de la santé publique. |
Contrôle afin de s'assurer que leur installation est faite selon les spécifications prévues par le fabricant et l'établissement de santé. |
1ére mise en service, après dépannage ou interruption prolongée de fonctionnement. |
Personnel définit d'après l'organisation fixée, conformément à l'article 3 du présent arrêté, par l'établissement. |
L'établissement définit ses propres procédures d'enregistrement et les conditions d'archivages. |
Inspecteur de santé (contrôles à la diligence du préfet), Personnels utilisateurs et de maintenance. |
|
|
|
Maintenance organisée, adaptée à leurs conditions d'utilisation. |
En fonction des notices d'instructions des fabricants. |
Personnel définit d'après l'organisation fixée, conformément à l'article 5 du présent arrêté, par l'établissement. |
L'établissement définit ses propres procédures d'enregistrement et les conditions d'archivages. (Nota : un document doit préciser les modalités d'organisation mise en place) |
||
|
|
|
Mise en place de procédures ou systèmes destinés à pallier les défaillances de leur alimentation normale en gaz à usage médical et en énergie. |
|
Directeur de l'établissement ou son délégué (ingénieur biomédical par exemple) |
Description transcrite dans un document. |
||
|
|
|
Mise à jour du document regroupant les différentes procédures mises en place et distribution aux différents personnels concernés. |
Immédiate lors de toute modification |
|
|||
|
|
|
Définition de la nature et de la périodicité des opérations de maintenance organisées ainsi que des étalonnages. |
|
L'établissement définit ses
propres procédures d'enregistrement et les conditions
d'archivages.
|
|||
|
|
|
Définition de la qualité et de la formation des personnels éventuellement affectés à la maintenance. |
|
||||
|
|
|
Définition des conditions de commande et de réalisation des interventions an cas de panne. |
|
||||
|
|
|
Définition des modalités de vérification périodique de la bonne application des diverses procédures et de leur adéquation aux nouveaux dispositifs ou nouvelles pratiques de soins. |
Non précisé. |
L'établissement définit ses propres procédures d'enregistrement et les conditions d'archivages |
Nota : Concernant les contrôles
à la première mise en service et après un
dépannage ou une interruption prolongée de
fonctionnement (Art. 1 : §1), selon l'organisation mise en place
par l'établissement de santé, le service
biomédical est plus ou moins, voir pas du tout
concerné. Ces contrôles, comme ceux
réalisés à l'ouverture des blocs
opératoires ou avant chaque anesthésie, sont d'une
manière générale et assez logiquement
réalisés par le personnel utilisateur des
équipements.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N° |
|
|
|
|
|
|
|
|
|
|
Tous les DM*. |
De transmettre au ministre chargé de la santé tout incident ou risque d'incident. |
Sans délai ou trimestrielle (selon gravité). |
Correspondant matériovigilance. |
Feuille " cerfa " spécifique. |
|
|
|
Enregistrer, d'analyser et de valider des incidents ou risques d'incidents. |
Quand incident. |
Correspondant matériovigilance. |
Non défini. |
Inspecteur ASFFAPS. |
||
|
|
Conduire les enquêtes et travaux relatifs à la sécurité d'utilisation des DM demandés par le ministre chargé de la santé. |
Quand besoin. |
Correspondant matériovigilance. |
Non défini. |
Inspecteur ASFFAPS. |
* : Dispositif Médical.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 4 : Le manuel d'accréditation des établissements de santé (Version de Février 1999)
" L'habituel " tableau permettant le recueil des différentes exigences réglementaires, est pour le manuel d'accréditation aménagé :
|
N° |
|
|
|
|
|
|
|
Politique financière et budgétaire. |
Disposer d'une stratégie financière pluriannuelle. |
L'établissement. |
|
|
|
Politique budgétaire associant les personnels concernés. |
Personnels concernés. |
|
|
|
|
Gestion. |
Disposer d'outils de pilotage. |
L'établissement, les secteurs d'activités. |
|
|
|
Prestations fournies. |
Définir et suivre tous les ans les objectifs et les types de prestations en cohérence avec le projet d'établissement. |
Chaque secteur d'activité. |
|
|
|
Recherche de solutions aux problèmes posés. |
Mise en place d'un mode de concertation entre les professionnels de chaque secteurs d'activité. |
|
|
|
|
Prise en charge en continu des patients. |
Mise en place d'un système de gardes et astreintes. |
|
|
|
|
Structure organisationnelle des secteurs d'activité. |
Définition et communication de la structure organisationnelle de chaque secteur d'activité à l'ensemble des professionnels de l'établissement. |
|
|
|
|
Responsables et cadres des secteurs d'activités. |
Définition des compétences et responsabilités. |
|
|
|
|
Amélioration continue de la qualité. |
Mesure, évaluation et amélioration continue des différentes activités. (en en particulier du bon déroulement des démarches d'amélioration continue de la qualité). |
Le responsable du secteur d'activité. |
|
|
|
Suivi et évaluation des ressources. |
Connaissance des coûts de fonctionnement et de sa situation par rapport aux budgets alloués. |
|
|
|
|
Connaissance des compétences de son personnel. |
||
|
|
|
Objectifs quantifiables. |
Définition et actualisation annuelle des objectifs, en regard avec le projet d'établissement et communication à l'établissement. |
|
|
|
|
Fiches de fonction et profils de poste |
Description, actualisation et communication des fiches. |
Cadres du secteur concerné |
|
|
|
Accueil et intégration des professionnels et stagiaires. |
Une présentation de l'établissement et une information d'adaptation au poste est fournie concernant les exigences en matière de sécurité, le contrôle et la prévention du risque infectieux et les stratégies d'amélioration de la qualité. |
Chaque secteur d'activité |
|
|
|
Evaluation du personnel |
Entretien annuel de chaque membre du personnel permettant de fixer des objectifs et d'identifier les besoins individuels en formation. |
Cadre(s) de chaque secteur d'activité |
|
N° |
|
|
|
|
|
|
|
Maintien et amélioration du niveau de compétence des personnels. |
Identification des besoins et mise en place d'un programme adapté. |
Cadres du secteur concerné. |
|
|
|
Equipements et consommables. |
Evaluation qualitative et quantitative des besoins. |
L'établissement. à Services logistiques. |
|
|
|
Association des utilisateurs dans les procédures d'achat. |
||
|
|
|
Approvisionnement des secteurs d'activité à périodicité définie. |
||
|
|
|
Mettre en place une procédure d'approvisionnement en urgence. |
||
|
|
|
Equipements, installations (et bâtiments). |
Mise en |
|
|
|
|
Mise en place d'une politique de maintenance. |
||
|
|
|
Assurer une maintenance préventive. |
||
|
|
|
Assurer une maintenance curative (lire corrective). |
||
|
|
|
Ecriture de protocoles d'alerte et d'intervention. Ceux-ci doivent être connus des personnels concernés. |
||
|
|
|
Equipements (et locaux). |
Le nettoyage fait l'objet de protocoles et d'évaluations. |
|
|
|
|
Le personnel chargé du nettoyage est formé. |
||
|
|
|
Equipements (et personnes). |
Le transport fait l'objet de protocoles intégrant les éléments relatifs à la sécurité, à la qualité et à l'hygiène. |
|
|
|
|
Le personnel chargé du transport est formé. |
||
|
|
|
Déchets. |
Le personnel chargé de l'élimination des déchets est formé. |
|
|
|
|
Sécurité incendie. |
Les professionnels bénéficient d'une formation incendie actualisée. |
|
|
|
|
Services logistiques donc le biomédical. |
Evaluation des prestations auprès des secteurs d'activité utilisateurs. |
|
|
|
|
Systèmes d'information. |
Le système d'information et l'informatisation de l'établissement permettent de couvrir l'ensemble des activités de l'établissement et favorisent une approche et une utilisation coordonnées de l'information. |
Les instances concernées. |
|
|
|
Qualité. |
La politique qualité comporte des objectifs précis, mesurables dans le temps... |
Chaque secteur d'activité concerné. |
|
|
|
Formation des professionnels de l'établissement et assistance méthodologique. |
L'établissement par sa structure qualité. |
|
|
|
|
Mise en place d'un système de
gestion et d'analyse des réclamations " clients " et
mise en |
Chaque secteur d'activité concerné. |
|
|
|
|
Elaboration de protocoles qualités. |
Les secteurs d'activité. |
|
|
|
|
Evaluation des protocoles lors de leur utilisation. |
||
|
|
|
Elaboration d'indicateurs de résultats. |
||
|
|
|
Organisation de la gestion des documents internes (procédures, protocoles) et externes (textes réglementaires, recommandations, etc. ...) |
L'établissement, les secteurs d'activités (coordination indispensable...). |
GFL : Gestion des Fonctions Logistiques GSI : Gestion du
Système d'Information. QPR : gestion de la Qualité et
Prévention des Risques.
|
N° |
|
|
|
|
|
|
|
Risques et événements indésirables. |
Ceux-ci doivent être rassemblés. |
Notamment par service bio. A partir des éléments transmis par les secteurs d'activités. |
|
|
|
Mise en place d'un système de signalement. |
||
|
|
|
Analyse des événements indésirables et mise en place de mesures d'amélioration. |
||
|
|
|
Secteurs, pratiques, actes ou processus à risque. |
Identification de ceux-ci et priorisation dans le programme de prévention des risques. |
|
|
|
|
Risques et événements indésirables. |
Evaluation de l'efficacité du programme de prévention des risques. |
|
|
|
|
Evaluation du fonctionnement du système de signalement des événements indésirables. |
||
|
|
|
Vigilances sanitaires |
Mise en place de procédures en cas d'incident. Ces procédures sont connues des professionnels. |
Les différents groupes de vigilance (Pharmacovigilance, hémovigilance, matériovigilance et biovigilance) |
|
|
|
Traçabilité des dispositifs médicaux et des produits. |
||
|
|
|
Le système de vigilance doit alimenter une réflexion permettant l'amélioration des pratiques professionnelles quant à l'usage des produits et dispositifs médicaux. |
||
|
|
|
Formation des professionnels sur les conduites à tenir en cas d'incident. |
||
|
|
|
Evaluation et amélioration de l'efficacité de chaque vigilance. |
||
|
|
|
Hygiène et risque infectieux |
Formation en hygiène est dispensée à tout professionnel temporaire ou permanent lors de son arrivée. |
UHLIN20, CLIN16à Infirmières hygiénistes. |
|
|
|
Les actions de formation continue en hygiène concernent l'ensemble des professionnels, notamment lors de la diffusion de nouvelles procédures. |
||
|
|
|
Consultation du CLIN pour tout projet d'acquisition d'équipement ou de matériel, d'aménagement de locaux... pouvant avoir des conséquences sur l'hygiène. |
Tous professionnel achetant ou réalisant des travaux dans l'établissement... |
|
|
|
|
Les conclusions de l'analyse des données de surveillance, ainsi que les recommandations qui en découlent, sont communiquées aux secteurs d'activités concernés et à la direction. Elles sont utilisées pour adapter les activités de prévention du risque infectieux. |
UHLIN, CLIN... |
|
|
|
|
Utilisation des protocoles visant à maîtriser le risque infectieux. |
Tous les professionnels. |
|
|
|
|
Mise en place d'un système d'assurance de la qualité en stérilisation |
Pharmacie, UHLIN..., biomédical. |
|
|
|
|
Ecriture, validation et utilisation de procédures d'entretien (nettoyage, désinfection) des équipements et dispositifs médicaux. Leurs respect et pertinence sont évalués à périodicité définie. |
|
|
|
|
|
Ecriture, validation et évaluation régulière de procédures liées à l'environnement (eau, eau de dialyse, air au bloc opératoire....) |
Pharmacie, UHLIN..., service technique, biomédical |
|
|
|
|
Les procédures liées à l'environnement font l'objet d'une formation des professionnels |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 5 : Circulaire DH/EM1/EO1/97672 sur la stérilisation des Dispositifs Médicaux.
|
N° |
|
|
|
|
|
|
|
|
|
|
Tous les dispositifs* concourant à la stérilisation des DM |
Ecriture, validation et application de procédures écrites (A toutes les étapes du processus, dont la maintenance) |
A chaque modification de procédure. |
Responsable Assurance Qualité (AQ). |
Procédures écrites... |
Différents acteurs de la stérilisation, Responsable AQ, Ingénieur biomédical, Inspecteurs DDASS. |
|
|
|
Contrôle de la qualité de l'air, de l'eau et des autres fluides. |
Non précisé. Selon les recommandations constructeurs ou normes ! |
Personnel formé. Et pour les ECME les contrôles doivent être réalisés par un organisme accrédité par le COFRAC15. |
Non précisé. Le personnel ou les sociétés doivent être enregistrés et validés par le responsable assurance qualité donc le pharmacien. |
||
|
|
Maintenance des équipements. |
||||||
|
|
Maîtrise des équipements de contrôle de mesure et d'essai (ECME). |
||||||
|
|
Formation du personnel (et donc du personnel de maintenance). |
Nouveaux agents (ou appareils). |
Non précisé. (Fabricants/distributeurs des équipements, organismes agrées...° |
Non précisé. |
|||
|
|
|
La stérilisation doit faire appel à des procédés validés et des contrôles de routines doivent être réalisés suivant les normes existantes. Pour la stérilisation à la vapeur d'eau : NF EN 552. Concernant directement le biomédical : Réalisation d'une qualification opérationnelle à l'installation et d'une requalification périodique. |
12 mois (pour les requalifications) |
Personnel formé et structure disposant d'ECME conforment. |
Selon normes. (NF EN 554 si stérilisateur à la vapeur). Doivent en tout cas être validés et archivés. |
* : A titre d'exemple, citons : Stérilisateurs, soudeuses, sécheuses, machines à laver, adoucisseurs, osmoseurs...
Remarques :
Il est précisé au chapitre II, paragraphe 2.1.1 que le responsable de l'assurance qualité en stérilisation des dispositifs médicaux est le pharmacien. Il est précisé qu'il doit travailler en collaboration avec l'ensemble des services concernés par le sujet.
La stérilisation à la vapeur d'eau
doit être appliquée quant le dispositif à
stériliser le supporte.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 6 : Exploitation & contrôles périodiques sur appareils à pression de vapeur à couvercle amovible (Arrêté du 16/02/1989)
|
N° |
|
|
|
|
|
|
|
|
|
|
Appareils à pression de vapeur à couvercle amovible |
Entretien et vérification des dispositifs de sécurité et du système de fermeture, joints compris. |
18 mois maximum. |
Organisme de contrôle agréé. |
Attestation de conformité, annexée au registre d'entretien prévu par l'art. 40 du décret du 02/04/26. |
Inspecteur DRIRE*. |
|
|
|
Etalonnage sonde de température. |
18 mois maximum. |
Technicien compétent |
Registre d'entretien. |
||
|
|
|
Formations des agents utilisateurs. |
Nouveaux agents (ou appareils). |
Non précisé. (Société commercialisant l'équipement ou organisme de formation spécialisé dans ce type d'opérations)/ |
Non défini, mais justification doit pouvoir être apportée. |
* : DRIRE : Direction Régionale de
l'Industrie de la Recherche et de l'Environnement.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Remarques :
Arrêté du 22/03/1993 (modifié par l'arrêté du 06/05/1997)
|
N° |
|
|
|
|
|
|
|
|
|
|
Instruments de pesage à fonctionnement non automatique utilisés à l'occasion des opérations visées à l'article 1er , point 1, du décret n° 91-330 du 27/03/91* |
Réaliser une vérification périodique et effectuer la réparation par un réparateur agréé**. |
Tous les 12 mois pour la vérification périodique. Quant besoin pour une réparation ! |
Personnel d'une structure agréée. |
Carnet de métrologie (propre à chaque instrument). |
Personnel réparateur, Agents de l'Etat chargés d'effectuer des contrôles. |
|
|
|
La vérification périodique comprend un examen administratif et des essais métrologiques précisés dans ce même article 7. |
|
Toute absence ou détérioration du carnet métrologique entraîne le refus de l'instrument. |
|||
|
|
|
Apposition d'une vignette dont les caractéristiques sont définies par l'arrêté du 01/03/90. |
Lors des contrôles périodiques |
|
|||
|
|
|
Obligation de : - Veiller au bon entretien des
instruments, |
En permanence |
Les détenteurs d'instruments de pesage... |
|
* : Les instruments de pesage à fonctionnement non automatique utilisés, en ce qui concerne les établissements de soins, à :
** : Le réparateur agréé doivent avoir mis en place un système d'assurance de la qualité conforme à la norme NF EN 45001. Les personnels chargés des vérifications doivent avoir suivi une formation minimale et être déclarés nominativement auprès de l'administration. (Art. 6). Nota : Une société assurant l'entretien et la réparation des instruments de pesage à fonctionnement non automatique peut être agréée pour en effectuer la vérification périodique si les fonctions d'entretien et de réparation sont distinctes des fonctions de vérifications. Il est toléré qu'une même personne assure les deux types de fonctions.
Enfin, l'article 11 précise que
l'agrément peut, notamment, ne pas être reconduit si
l'organisme n'a pas vérifié au moins 500 instruments au
cours d'une année civile, pour une région
administrative donnée. Cette condition hypothèque
sérieusement la prise en charge de ce type de contrôle
par un service biomédical hospitalier, sauf si celui-ci se
spécialise et réalise ce type de contrôle pour
l'ensemble des établissements de soins de son
secteur.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 8 : Protection des travailleurs contre les risques liés aux rayonnements ionisants
A : Décret n°86-1103 du 02/10/1986
B : Arrêté du 02/10/1990
|
N° |
|
|
|
|
|
|
|
|
|
|
Sources scellées et générateurs électriques de rayonnements ionisants. |
Tenu et mise à jour constante d'un document contenant : - Caractéristiques de(s) la
source(s) ou générateur(s) En plus si l'établissement dispose
de sources scellées : |
|
Non précisé. Service Bio. et/ou personne compétente en radioprotection. |
" Un document " contenant les pièces évoquées dans la colonne " action à mener " du présent tableau. " Document " = registre, divers modèles existent, comme celui proposé par l'APAVE (mod. 111). |
L'inspecteur du travail, CHSCT* ou délégué du personnel, SCPRI**
|
|
|
|
Formation à la radioprotection des travailleurs exposés et remise d'une notice écrite précisant les dangers présentés par les rayonnements ionisants et les solutions pour s'en prémunir... Par extension à la maintenance ! |
Non précisé. Il est dit : " Périodiquement " |
L'employeur en liaison avec le CHSCT* Par la personne radiocompétente. |
Non précisé . |
||
|
|
|
Calcul et vérification de débit d'équivalent de dose auquel s'exposeront les travailleurs chargés de travaux sur les appareillages. |
Avant travaux. |
Non précisé. Par la personne radiocompétente. |
Non précisé. |
||
|
|
et B :1 |
Contrôle des sources
scellées et générateurs : |
Périodiquement : |
Organisme agréé, choisi par l'employeur, dans le cas de la 1ére mise en service, le contrôle périodique ou le dépassement des limites d'expo. Le contrôle après modification des matériels ou locaux est à réaliser par la personne radiocompétente. |
Réalisation de rapports archivés dans le document évoqué à l'article 18. |
||
|
|
|
Sources scellées et générateurs électriques de rayonnements ionisants |
Si sources non scellées : contrôle avant mise en service et ultérieur des installations et locaux où seront utilisées les sources non scellées et moyens d'évacuation des effluents et déchets. |
|
Organisme agréé, choisi par l'employeur, dans le cas de la 1ére mise en service, le contrôle périodique ou le dépassement des limites d'expo. Le contrôle après modification des matériels ou locaux est à réaliser par la personne radiocompétente |
Réalisation de rapports archivés dans le document évoqué à l'article 18. |
L'inspecteur du travail, CHSCT* ou délégué du personnel, SCPRI**. |
|
|
|
Si risque de contamination interne (cas
des sources) : |
(en zone contrôlé) |
Personne radiocompétente ou organisme agrée sous la responsabilité de l'employeur. |
|||
|
|
|
Les entreprises réalisant des
travaux de maintenance, d'intervention ou de mise en |
|
Organismes accrédités A ce jour l'arrêté fixant ces organismes ne serait pas publié |
Non précisé. |
Non précisé. |
|
|
|
|
Si détention d'un
générateur électrique de rayonnement
ionisants : Si détention d'une substance
radioactive naturelle : Si détention d'une substance
radioactive artificielle (idem si modification ou si
cessation d'utilisation) : |
|
Employeur. |
Déclaration non précisée. |
L'inspecteur du travail, CHSCT* ou délégué du personnel, SCPRI**. |
* : Comité d'Hygiène, de Sécurité et des Conditions de Travail.
** : Service Central de Protection contre les Rayonnements Ionisants (anciennement O.P.R.I. pour Office pour la Protection contre les Rayonnements Ionisants).
*** : Une norme existe précisant la méthodologie dans la réalisation des contrôles périodiques. C'est la norme NF C 15-160 :installations pour la production et l'utilisation des rayons X,
règles générales (version de 1984).
Remarques :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 9 : Vérifications générales périodiques sur équipements de travail (=> centrifugeuses)
A : Décret n° 93-41 du 11/01/1993
B : Arrêté du 05/03/1993
C : Arrêté du 04/06/1993
|
N° |
|
|
|
|
|
|
|
|
|
et B : 2 et C : 2 |
Equipement de travail (centrifugeuses) |
Vérifications générales périodiques (permettant de déceler en temps utile toute détérioration susceptible de créer des dangers). Le contenu est définit par l'arrêté du 04/06/93. |
12 mois ou après une opération de maintenance ayant nécessité le démontage des dispositifs de protection. |
Personnes qualifiées internes ou externes à l'établissement. |
Registre de sécurité conforment aux articles L.620-6, L.620-7 et D.620-1 du code du travail.
|
Inspecteur du travail, contrôleur du travail et CHSCT de l'établissement. |
|
|
|
Formation spécifique relative aux prescriptions à respecter, aux conditions d'exécution des travaux et aux matériels et outillages à utiliser. |
Avant la 1ére vérif. et si évolution de l'équipement |
Non précisé. Logiquement par fabricant ou distributeur de l'équipement |
Non précisé. |
||
|
|
|
Formation à la sécurité |
Mise en service et si évolution de l'équipement |
Non précisé. Logiquement par fabricant ou distributeur de l'équipement |
Non précisé. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Remarques :
Annexe 10 : Sécurité électrique - Décret n° 88-1056 du 14/11/88
|
N° |
|
|
|
|
|
|
|
|
|
|
Toutes les " installations électriques " = appareils électriques. |
S'assurer que les personnels utilisant ou réalisant des travaux sur les " installations électriques " possèdent une formation suffisante (Formation différente selon que l'on utilise ou que l'on réalise des travaux...). Organiser au bénéfice des travailleurs concernés la formation complémentaire en cas de connaissance insuffisante. Des rappels peuvent être effectués. |
En fonction des besoins.
|
L'employeur. Les compétences minimums des personnes en charge des formations n'est pas précisé. |
Non précisé. |
|
|
|
|
Signaler le plus rapidement possible toute anomalie constatée dans l'état apparent des " installations électriques " ou dans leur fonctionnement au personnel chargé de la surveillance. |
|
Les travailleurs (Personnels utilisateurs). |
Non précisé. |
||
|
|
|
Surveillance* et correction des défectuosités et anomalies sur les " installations électriques " |
Aussi fréquemment que de besoin. |
Personne compétente. Soit un électricien ou un technicien biomédical... |
Non précisé. |
||
|
|
|
Les travaux ou opérations sur des " installations électriques " ne peuvent être confiés qu'à des personnes qualifiés pour les effectuer et doit posséder une connaissance des règles de sécurité. |
|
L'employeur. |
Non précisé. |
||
|
|
|
Les travaux sous tension ne doivent être confiés qu'à des travailleurs ayant reçu une formation spécifique sur les méthodes de travail. Un outillage spécifique doit être mis à disposition. Si intervention dans le domaine de tension " BTB " ou plus, il faut un ordre écrit et une surveillance constante par une personne avertie des risques électriques. |
|
L'employeur. Les compétences minimums des
personnes en charge des formations n'est pas
précisé. L'employeur. |
Non précisé. |
||
|
|
|
Vérification périodique des " installations électriques " (et ou après avoir subi une modification de structure). |
12 mois (fixée par arrêté) |
Par un organisme, une personne agrée (Liste fixée par un arrêté) ou par une personne** appartenant ou non à l'établissement dont le nom est communiqué par le chef d'établissement au directeur régional du travail et de l'emploi |
Rapport détaillé dont le contenu est fixé par arrêté). |
L'inspecteur du travail |
|
|
|
|
Tenir un dossier comportant notamment :
|
|
Le chef d'établissement |
Voir colonne action à mener |
* : Il faut entendre par surveillance : le maintien des dispositions mettant hors de portée des travailleurs les parties actives de l'installation ; le bon état des conducteurs souples aboutissant aux appareils amovibles ainsi qu'à leurs organes de raccordement ; le maintien des calibres des fusibles et du réglage des disjoncteurs...
** : Ces personnes doivent avoir des
connaissances approfondies dans le domaine de la prévention
des risques dus à l'électricité et des
dispositions réglementaires qui y sont
afférentes.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 11 : Norme NF S 90-155 (Réseaux de distribution de fluides médicaux
|
N° |
|
|
|
|
|
|
|
|
|
|
Réseau de distribution de fluides médicaux6 |
Conserver les schémas de l'installation globale de l'établissement et les tenir à jour. |
Révisé une fois par an. |
Le propriétaire. |
Schémas reproductibles du réseau de canalisations. |
Commission locale de surveillance des gaz médicaux Commission de sécurité (locale ou autre) |
|
|
13 et 15 et annexe E |
Demander à l'installateur et conserver le dossier d'identité* du réseau de distribution. |
Documents du dossier d'identité. |
||||
|
|
et annexe E |
Un procès-verbal est dressé lors de chaque opération de contrôle (lors de la réception d'une installation neuve ou modification d'une installation). |
|
Les représentants de la commission locale de surveillance de fluides médicaux et l'installateur. |
Modèle libre. |
||
|
|
annexe E |
Entretien et surveillance de l'installation. |
Préventif, selon les recommandations constructeur(s) |
Personnel qualifié, habilité par le chef d'établissement. |
Les résultats des opérations d'entretien et les observations doivent être notés dans le système de documentation. |
||
|
|
|
Vérification périodique de l'installation. |
12 mois maximum. |
Personnel qualifié |
Rapport présentant les installations et les anomalies rencontrées. |
||
|
|
|
Mise au point de procédures d'urgences et de communication. Nomination de personnes responsables dans chaque zone de l'hôpital susceptibles d'être affectées. |
|
La commission locale de surveillance de fluides médicaux. |
Procédures écrites |
Commission de sécurité (locale ou autre) Personnels responsables et personnel qualifié d'entretien. |
|
|
|
|
Formation des personnels responsables. |
Non spécifié. |
Non spécifié. Possible par personnel qualifié de l'hôpital. |
Non spécifié. |
Commission de sécurité (locale ou autre). |
* : Le dossier d'identité du réseau
de distribution de fluides médicaux contient les
caractéristiques essentielles (références aux
textes réglementaires, fiches techniques des appareils ou
composants, documentation technique relative à la maintenance,
plan de l'installation avec indication des vannes de sectionnement,
des détendeurs, des prises, etc., des notes de calculs, les
fiches d'autocontrôle, les consignes d'utilisations,
...).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Annexe 12 : Enquête
GMAO
Non disponible
Annexe 13 : Articles
D712-43 & D712-47 du code de la santé
publique
Article D712-43
L'anesthésie est réalisée sur
la base d'un protocole établi et mis en
Les moyens prévus au 2° de l'article D.712-40 doivent permettre de faire bénéficier le patient :
- D'une surveillance clinique continue ;
- D'un matériel d'anesthésie et de suppléance adapté au protocole anesthésique retenu.
Article D712-47
La salle de surveillance post-interventionnelle est dotée de dispositifs médicaux permettant pour chaque poste installé :
- L'arrivée de fluides médicaux et l'aspiration par le vide ;
- Le contrôle continu du rythme cardiaque et l'affichage du tracé électrocardioscopique, par des appareils munis d'alarme, et le contrôle de la saturation du sang en oxygène (SpO2) ;
- La surveillance périodique de la pression artérielle ;
- Les moyens nécessaires au retour à un équilibre thermique normal pour le patient.
La salle de surveillance post-interventionnelle est en outre équipée :
Les personnels exerçant dans cette salle
doivent pouvoir accéder sans délai au matériel
approprié permettant la défibrillation cardiaque des
patients ainsi que l'appréciation du degré de leur
éventuelle curarisation.
|
|
|
D'origine |
|
Email ou site Internet |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|