|
Avertissement |
|
Si vous arrivez
directement sur cette page, sachez que ce travail est un rapport
d'étudiants et doit être pris comme tel. Il peut donc
comporter des imperfections ou des imprécisions que le lecteur
doit admettre et donc supporter. Il a été
réalisé pendant la période de formation et
constitue avant-tout un travail de compilation bibliographique,
d'initiation et d'analyse sur des thématiques associées
aux concepts, méthodes, outils et expériences sur les
démarches qualité dans les organisations. Nous ne faisons aucun usage commercial et la
duplication est libre. Si vous avez des raisons de contester ce droit
d'usage, merci de nous en faire part .
L'objectif de la présentation sur le Web est de
permettre l'accès à l'information et d'augmenter ainsi
les échanges professionnels. En cas d'usage du document,
n'oubliez pas de le citer comme source bibliographique. Bonne
lecture... |
| Mise
en
application
de
la
norme
ISO
15189
dans
les
Laboratoires
d’Analyses
de
Biologie
Médicale |

Charles DUCHENE
|
|
Référence bibliographique à rappeler pour tout usage :
Mise en application de la norme ISO 15189 dans les Laboratoires d'Analyse de Biologie Médicale, DUCHENE Charles,
Stage professionnel de fin d'études, MASTER Management de la Qualité (MQ), UTC, 2010-2011, URL : https://www.utc.fr/master-qualite, "Travaux, Qualité-Management", réf n°182 |
|
RESUME
Dans un souci d’excellence, le Centre
Pasteur du Cameroun a entrepris le passage de l’Assurance
Qualité vers un Système de Management de la
Qualité avec une mise à la norme ISO 15189 dans le cadre
de ses activités d’analyses. La réalisation d’une
auto-évaluation de conformité avec le
référentiel choisi est la première étape de
cette démarche afin d’évaluer la performance du
système qualité en place et de cibler les points à
améliorer pour obtenir l’accréditation. La mise à
jour du système documentaire a complété la
réalisation de l’autoévaluation durant ce stage. En
l’absence d’obligation règlementaire au Cameroun, la mise en
œuvre de cette démarche met en lumière l’engagement de la
Direction à fournir des prestations de qualité afin de
satisfaire ses clients.
Mots clés :
ISO
15189,
Certification,
Auto-évaluation,
Assurance
Qualité,
Système
documentaire. |
|
ABSTRACT
The
Centre Pasteur of Cameroon began the transition of its quality system
from a Quality Assurance System to a Quality Management System with an
upgrade to ISO 15189 as part of its analysis. Conducting a
self-assessment of compliance with the standard chosen is the first
step of this approach to evaluate the performance of the existing
quality system and target areas for improvement for the accreditation.
Updating of the laboratory documentary system completed the
implementation of the self-assessment for this training. In the absence
of regulatory obligations in Cameroon, the implementation of this
approach highlights the management commitment to provide quality
services to satisfy its customers.
Key words : ISO
15189,
Certification, Self-evaluation, Quality Assurance, Documentary System.
|
Remerciements
A Monsieur le Professeur Dominique
BAUDON,
Directeur Général du
Centre Pasteur du Cameroun, pour avoir permis la
réalisation de ce stage.
A Grâce ETONDE TANGA,
Responsable
Qualité, pour son
encadrement, ses conseils avisés en tant
que maître de stage et pour la confiance qu’elle m’a
accordé pour
accomplir ma mission.
A Madame le Docteur Suzanne BELINGA,
à
Madame le Docteur Marie
Christine FONKOUA, à Monsieur le Docteur Paul Jean Adrien
ATANGANA,
Chefs de Service
des laboratoires d’Hématologie et de Bactériologie,
Médecin Anatomo-Cytopathologiste, pour leur implication, leur
disponibilité et leur compréhension qui ont
contribué à la réussite de
ma mission.
A tout le personnel des laboratoires
d’Hématologie, de Bactériologie et
d’Anatomie Pathologique, pour tout
le travail accompli dans la bonne humeur, pour leur dynamisme
et leur implication dans la démarche qualité du Centre
Pasteur du
Cameroun.
A l’ensemble de l’équipe
pédagogique du Master Management de la
Qualité, pour la
qualité de ses enseignements, pour la disponibilité et
le soutien qu’ils nous ont accordé au cours de cette
année.
A toute l’équipe des stagiaires
«
blancs », pour l’ambiance
conviviale
qui a régné autour de ce stage et les bons moments
partagés.
Liste
des tableaux et figures
Tableaux
:
Tableau 1 : Analyse de risques de la mission
Figures
:
Figure 1 : Planification dynamique Stratégique de la
mission
Figure 2 : Pourcentage de conformité vis-à-vis des
exigences de l'ISO 15189
relatives au Management
Figure 3 : Pourcentage de conformité vis-à-vis
des exigences Techniques de l'ISO 15189
Figure 4 : Pourcentage de conformité vis-à-vis
des exigences de l'ISO 15189
relatives au Management (fin de
période de stage)
Figure 5 : Pourcentage de conformité vis-à-vis
des exigences Techniques de l'ISO 15189 (fin de période de stage)
Liste
des abréviations
AQ :
Assurance Qualité
COFRAC : COmité
FRançais d’ACcréditation
CPC : Centre Pasteur du Cameroun
IMPM : Institut de recherche
Médicale et d’étude des Plantes Médicinales
GBEA : Guide de Bonne
Exécution des Analyses de Biologie Médicale
LABM : Laboratoire d’Analyses
de Biologie Médicale
RIIP : Réseau
International des Instituts Pasteurs
SMQ : Système de
Management de la Qualité
UTC : Université de
Technologie de Compiègne
Analyse
: ensemble d’opérations destinées à
déterminer la valeur ou les caractéristiques d’une
propriété.
Autoévaluation
: méthode permettant de réaliser son propre
diagnostic par rapport à un référentiel
déterminé. Elle peut porter soit sur une activité,
soit sur un thème transversal, soit sur un organisme dans sa
globalité.
Audit
interne
: vérification périodique et
systématique, menée pour les besoins du laboratoire, de
l’application du système de management, de sa pertinence et de
sa conformité aux exigences externes applicables.
Contrôle
Qualité
Externe
(ou
CQE)
: Procédé
utilisant à des fins de contrôle de qualité, les
résultats de plusieurs laboratoires qui analysent le même
échantillon. Le contrôle de qualité externe permet
avant tout de montrer que le laboratoire ayant participé
à ce contrôle fournit des résultats comparables aux
autres laboratoires.
Examen
de
biologie
médicale
: ensemble des phases
pré-analytique, analytique et post-analytique au sens de la
norme NF EN ISO 15189.
Laboratoire
d’Analyses
de
Biologie
Médicale
: laboratoire
destiné à réaliser des analyses biologiques,
microbiologiques, immunologiques, biochimiques, hématologiques,
annatomopathologiques, ou d’autres analyses de substances d’origine
humaine pour apporter des informations utiles au diagnostic, à
la prévention ou au traitement des maladies ou à
l’évaluation de l’état de santé d’êtres
humains.
Traçabilité
:
Traçabilité
documentaire
: aptitude à démontrer par des
enregistrements l’application du système de management ;
Traçabilité
métrologique : preuve de raccordement d’un
équipement ou d’un matériau de référence
aux étalons nationaux ou internationaux, et des résultats
de mesures au système international d’unités.
Sommaire
Liste des tableaux et figures
Liste
des
abréviations
Glossaire
Introduction
I. Présentation
du Centre Pasteur du Cameroun
1. Historique
2. Missions
3. Vision
4. Valeurs
5. Organisation
II.
Contexte
a) Le Cameroun
b) Le
Centre Pasteur du Cameroun
c) L’Assurance Qualité dans
les Laboratoire
d’Analyses de Biologie Médicale
d) Le
Réseau International des Instituts
Pasteurs
III.
Enjeux
IV. Objectifs et
analyse des risques
1. Objectifs du stage
2. Analyse de risques
V.
Résultats
et
discussion
1. Choix du
questionnaire d’autodiagnostic
2. Résultat
de l’autodiagnostic
réalisé en début de mission
3.
Résultat de l’autodiagnostic
réalisé en fin de mission
4. Etat
du système documentaire
a) Laboratoire
d'Anatomie et Cytologie Pathologiques
b)
Laboratoire d'Hématologie
c)
Laboratoire de Bactériologie
5.
Perpectives à court terme
a) L'audit interne
b) La
sécurité du personnel
c) L'approche
processus
Conclusion
Bibliographie
Table
des annexes
Introduction
L’Assurance Qualité (AQ) suscite
un très fort intérêt dans les Laboratoires
d’Analyses de Biologie Médicale (LABM) depuis plusieurs
années mais son engouement a été augmenté
en France par la parution de l’ordonnance du 13 janvier 2010 relative
à la biologie médicale [1]. Ce texte impose en effet
aux LABM d’être accrédités selon les normes ISO
15189, ISO 17025 ou ISO 9001 en fonction d’un calendrier fixé.
Ainsi, à compter du 1er novembre 2013, aucun laboratoire ne
pourra fonctionner sans accréditation ou, à
défaut, sans justifier de son entrée dans une
démarche d’accréditation. La seconde date butoir est le
31 octobre 2016, date à laquelle toutes les autorisations
administratives autorisant le fonctionnement sans accréditation
seront abrogées [2]. C’est pourquoi la
Qualité est devenue un véritable enjeu économique
allant jusqu’à la pérennité du laboratoire.
De plus, ce type de démarche permet d’instaurer une relation de
confiance entre le laboratoire et ses clients en donnant l’assurance de
prestations de qualité. Cependant la mise en place d’une
démarche qualité ainsi que l’accréditation ne sont
pas des obligations règlementaires pour les LABM du Cameroun. La
démarche est donc totalement volontaire et s’inscrit dans un
souci d’excellence et dans le cadre de l’adhésion du Centre
Pasteur du Cameroun (CPC) au Réseau International des Instituts
Pasteur (RIIP).
Le Cameroun étant un pays en développement, le
système qualité mis en place au sein de l’entreprise doit
s’adapter aux différences culturelles, aux
spécificités propres à l’organisation et aux
méthodes de travail. Un engagement fort de la Direction est un
préalable indispensable à la réussite de la
démarche entreprise par le CPC. Il ne faut toutefois pas oublier
que la volonté et l’engagement du personnel sont aussi
nécessaires pour la bonne marche des actions engagées.
Il faut noter que la qualité doit devenir pour tous les acteurs
du laboratoire une évidence et la mise en place du
système qualité doit s’inscrire dans une évolution
progressive des pratiques du laboratoire.
I.
Présentation du Centre Pasteur du Cameroun
1.
Historique
L’histoire de la médecine
Pasteurienne au Cameroun commence dès 1922 avec Eugène
Jamot, un médecin militaire français qui organisa la
lutte contre la maladie du sommeil. Il avait suivi le « Grand
cours Pasteur » à Paris quelques années auparavant.
La suite de l’histoire du CPC est écrite par Jean Languillon qui
crée, en 1952, le « Centre de Recherches médicales
du Cameroun » à Yaoundé. Cette première
structure était essentiellement un laboratoire de biologie
médicale. A l’heure de l’indépendance du Cameroun, le
gouvernement signe une convention avec l’Institut Pasteur de Paris et
crée « l’Institut Pasteur du Cameroun ». A cette
époque, le Directeur et la plupart des cadres scientifiques
à la tête du centre sont des médecins militaires
français issus du « Grand cours Pasteur ». Trois ans
après la constitution de la « République Unie du
Cameroun », en 1972, l’Institut Pasteur est nationalisé et
intégré à « l’Institut de recherche
Médicale et d’étude des Plantes Médicinales
» (IMPM). En 1980, le centre devient autonome et prend
l’appellation de « Centre Pasteur du Cameroun ».
En 1992, le centre signe la Charte du Réseau International des
Instituts Pasteur et Instituts associés et devient membre du
RIIP. Ce dernier constitue un des plus grands réseaux de
recherche, d’intervention et de formation dans le monde. En accord avec
les fondements de l’Institut Pasteur, le réseau est
principalement orienté vers la recherche sur les maladies
infectieuses.
2.
Missions
Depuis les années 1980, le CPC est « Laboratoire national
de référence et de Santé publique ». Ses 4
missions principales sont les suivantes : Service, Santé
publique, Recherche et Formation.
La mission de Service se traduit par différentes
activités tels que la vaccination, l’analyse des eaux et des
aliments et les analyses de biologie médicale. Le CPC est centre
international de vaccination pour les voyageurs et centre de
vaccination antirabique. De plus, le laboratoire d’Hygiène et de
l’Environnement réalise 10 000 analyses microbiologiques des
eaux et des aliments par an, ainsi que des expertises toxicologiques.
Pour l’activité d’analyses médicales, ce sont plus de 320
000 examens biologiques qui sont réalisés chaque
année dans les différents laboratoires du CPC.
En ce qui concerne la mission de Santé publique, le CPC
participe à la surveillance épidémiologique des
maladies à risque épidémique, telles que la grippe
ou le choléra, ainsi qu’au contrôle de qualité des
eaux et des aliments grâce à son laboratoire
d’Hygiène et de l’Environnement.
Le CPC assure la formation de ses techniciens de laboratoire par le
biais de son école de formation des Techniciens
Médico-Sanitaires. De plus, le centre accueille
régulièrement des étudiants, aussi bien
Camerounais qu’étrangers, dans le cadre de leur formation.
Enfin, des cours et des conférences sont organisés pour
partager le savoir du centre dans ses domaines de compétences.
De nombreux programmes de recherche en collaboration avec des
structures nationales ou internationales sont menés au CPC avec
l’appui d’outils technologiques de pointe.
3.
Vision
Le CPC a pour ambition d’effectuer d’ici les 3 prochaines années
son passage de l’AQ vers un Système de Management de la
Qualité (SMQ) conformément aux exigences de la norme ISO
15189 dans le cadre de ses activités d’Analyses
Biomédicales.
4.
Valeurs
Depuis son cinquantenaire en 2009, la devise du CPC est «
L’excellence en Biologie accessible
à tous ». Tout est mis en œuvre pour offrir des
prestations de qualité et des réductions sont
accordées aux patients en fonction de leur catégorie
socio-professionnelle.
5.
Organisation
Le LABM regroupe différents services : Anatomo-pathologie,
Hématologie, Parasitologie, Bactériologie,
Mycobactériologie, Immunologie, Sérologie, Virologie et
Biochimie (cf :
Annexe
1)
[3-4].
a)
Le
Cameroun
D’abord possession Allemande, le Cameroun devient à la
fin de la première Guerre Mondiale, sur décision de la
Société Des Nations, un protectorat des administrations
de la France et du Royaume-Uni. Le pays est alors divisé en une
partie anglophone regroupant les régions du Sud-Ouest et du
Nord-Ouest et une partie francophone pour la partie orientale du pays.
En 1960, la zone administrée par la France obtient son
indépendance et prend le nom de « République du
Cameroun ». L’année suivante c’est au tour de la partie du
Cameroun Occidental d’obtenir son autonomie et de devenir la «
République fédérale du Cameroun ». Il faudra
attendre le référendum du 20 mai 1972 pour que la
réunification du pays soit effective. La «
République Unie du Cameroun » voit alors le jour
[5].
Malgré tout, des disparités culturelles subsistent encore
entre les régions issues de ces 2 protectorats, notamment au
niveau linguistique. En outre plus de 250 ethnies peuplent le pays.
Le pays est très riche en ressources naturelles et l’essentiel
de son économie est basée sur les exportations de
produits issus de l’agriculture. Le Cameroun est le 5ème
exportateur mondial de cacao
[6]. En dehors de l’agriculture,
d’importantes ressources minières, pétrolières et
forestières soutiennent l’économie du pays.
Le Cameroun est considéré comme un des pays de l’Afrique
Centrale ayant le plus fort potentiel de développement.
Grâce à l’aide des pays étrangers, le pays se
développe petit à petit, au bénéfice des
populations. La santé étant un secteur clé pour
tous les pays en développement, de nombreux effort sont fait
pour améliorer l’accès aux soins et la qualité des
prestations proposées.
b) Le
Centre Pasteur
du Cameroun
Le CPC est un établissement public administratif doté de
l’autonomie financière. Il est placé sous la tutelle des
Ministères de la Santé Publique et des Finances. Il
est le Centre National de Référence en santé
publique et se doit de donner l’exemple. Dans ce cadre, il a
engagé depuis quelques années, la mise en place
volontaire d’une démarche d’AQ pour l’ensemble de ses
activités. Le passage vers un SMQ s’opère
progressivement, apportant des changements organisationnels (nomination
de Chefs de service et d’un responsable qualité) et dans la
qualité des prestations fournies (respect des délais pour
le rendu des résultats…).
c)
L’Assurance
Qualité
dans
les
Laboratoire
d’Analyses
de
Biologie
Médicale
Le client doit obtenir à priori l’assurance de la qualité
des prestations qu’il demande au laboratoire. Les
référentiels à disposition des LABM sont une aide
précieuse pour apporter la confiance en la qualité de
l’organisation et de la réalisation des analyses. L’aptitude du
laboratoire à réaliser des analyses selon des
méthodes reconnues est d’une importance capitale. L’organisation
mise en place pour la maîtrise de l’ensemble des processus
internes doit permettre d’apporter la preuve de la qualité des
prestations proposées. Le référentiel choisi par
le CPC pour offrir ces garanties est la norme ISO 15189 : Laboratoires
d’analyses de biologie médicale - Exigences particulières
concernant la qualité et les compétences
[7].
d)
Le
Réseau
International
des
Instituts
Pasteurs
Le RIIP fédère des institutions autour des mêmes
valeurs Pasteuriennes. Il permet aux membres de coopérer pour
lutter efficacement contre les maladies infectieuses.
Le premier Institut Pasteur hors de France a été
créé en 1891 à Saïgon (actuelle Ho-Chi-Minh
Ville) au Vietnam, pour vacciner les populations contre la rage et la
variole. Par la suite, les élèves de Pasteur
créèrent spontanément des laboratoires dans leurs
pays et essaimèrent ainsi l’esprit Pasteurien dans le monde
entier. La proximité des différentes structures avec les
foyers infectieux offre au Réseau une capacité de
réaction et d'analyse unique. De nos jours, ce réseau
regroupe 32 instituts implantés dans 25 pays sur les 5
continents et près de 9500 scientifiques
[8].
Les LABM de France et de nombreux pays mettent en place des
démarches qualité, pas nécessairement à des
fins réglementaires mais aussi afin de fonctionner plus
efficacement. De plus cela permet de garantir la qualité de
leurs résultats et d’offrir aux clients des prestations de
meilleure qualité. La mise en œuvre de ce genre de
démarche permet de rationaliser l’activité et est un
levier pour améliorer l’organisation du laboratoire.
En effet, du point de vue du client, il n’est pas possible de s’assurer
de la conformité d’une analyse, contrairement à ce qui
peut être fait dans d’autres organisations, au moyen notamment
d’un cahier des charges. Ainsi, le rapport d’analyse ne pouvant pas
être contrôlé ou analysé par le client, il
pourrait être envisageable de réaliser l’analyse en double
pour apporter l’assurance de la prestation délivrée mais
cette option est difficile à mettre en œuvre du fait qu’il
serait presque impossible de déterminer le « vrai
résultat » du « faux ». C’est pourquoi l’AQ et
l’accréditation deviennent essentielles pour apporter la
confiance du client envers le LABM
[9].
En outre, le laboratoire doit démontrer que son organisation lui
permet de répéter, avec une bonne fiabilité, la
qualité des essais réalisés. Bien souvent il est
d’usage de réaliser des essais inter-laboratoires mais ceux-ci
permettent seulement d’analyser les aptitudes techniques d’un
laboratoire à effectuer des essais déterminés sur
un ou quelques échantillons particuliers, sans se soucier de son
aptitude organisationnelle à en assurer la qualité. La
mise en place d’un SMQ est à même de fournir le contexte
organisationnel assurant à la fois la
répétabilité et la fiabilité des analyses
effectuées.
Le CPC a déjà engagé depuis quelques années
une démarche de mise en conformité avec le Guide de Bonne
Exécution des Analyses de biologie médicale (GBEA)
[10-11]. Cependant, il subsiste, au sein du CPC, des
problèmes organisationnels notamment en ce qui concerne le rendu
des résultats avec des délais qui dépassent bien
souvent ceux qui sont annoncés lors du dépôt des
échantillons ou du prélèvement. La mise en
conformité avec la norme peut permettre de résoudre ce
genre de problèmes en rationalisant le circuit de
l’échantillon et en réorganisant l’activité en
trois processus : pré-analytique, analytique et post-analytique.
IV.
Objectifs et analyse
des risques
1.
Objectifs du stage
La certification n’étant pas une obligation réglementaire
pour le CPC, l’objectif que s’est fixé la Direction à
travers sa politique qualité est une mise à la norme sous
trois ans. La création d’un « Bureau Assurance
Qualité » en 2008, avec la nomination d’un Responsable
Qualité, a permis de sensibiliser petit à petit le
personnel à la qualité et de mettre en œuvre une
démarche d’AQ (cf :
Annexe 2). De nombreux points de
la norme ont donc été remplis bien avant le passage vers
un SMQ et la mise à la norme ISO 15189.
L’objectif principal de ce stage était donc de dynamiser la
démarche qualité du CPC et de mettre en lumière
les efforts à fournir pour remplir toutes les exigences de la
norme. Pour ce faire, la réalisation d‘une
auto-évaluation devait permettre d’avoir une vue globale de
l’état d’avancement de la démarche qualité afin de
déterminer les points à améliorer.
Cette mission s’est concentrée sur la mise en conformité
avec les points ne nécessitant pas de dépenses. Le
travail a porté sur des exigences de la norme relatives au
management (chapitre 4
[7]), ainsi que quelques
exigences techniques, notamment en ce qui concerne le matériel
et le personnel (chapitre 5
[7]). Trois laboratoires ont
été sélectionnés pour
bénéficier de ce travail : les laboratoires
d’Hématologie, de Bactériologie et d’Anatomie et
Cytologie Pathologique.
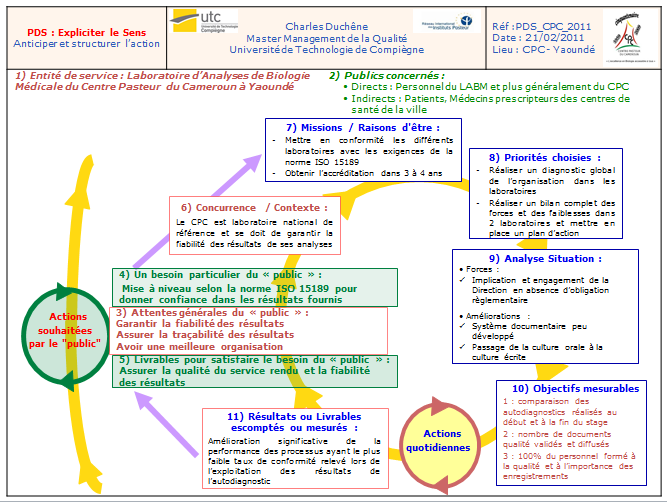
Une planification dynamique stratégique a été
réalisée afin d’expliciter les objectifs du stage et de
s’assurer de la compréhension des attentes auprès
de chacun des acteurs (
figure 1).
Figure 1 : Planification Dynamique
Stratégique de la mission
[12]
La phase d’auto-évaluation comporte plusieurs risques potentiels
liés à la mise en œuvre de l’audit, ayant
été identifiés préalablement. En ce qui
concerne la mise à jour du système documentaire, les
risques sont quant à eux liés au management du projet et
au personnel. En effet, la réussite de la démarche
qualité dépend essentiellement de la motivation du
personnel à adhérer à l’idée et à en
être le moteur, l’acteur principal ou au pire à ne pas en
être le frein. C’est pourquoi la sensibilisation est primordiale
avant toute chose.
Une série d’actions préventives a donc été
imaginée pour éviter de voir apparaitre ces causes de
dysfonctionnement qui auraient pu entraver la bonne avancée du
projet. L’analyse de risques a été réalisée
uniquement pour les deux grandes missions de ce stage,
c'est-à-dire la réalisation de l’auto-évaluation
et la mise à jour du système documentaire (
tableau 1).
En ce qui concerne les actions ponctuelles qui ont pu être
conduites pendant la période de stage, elles ne sont pas prises
en compte dans cette analyse étant donné que leur
réalisation n’était pas prévue en début de
mission.
Mission
|
Risque
|
Alternative
|
1) Réalisation d’un autodiagnostic de
conformité aux exigences de la norme ISO 15189
|
-
Manque
de
connaissances
du
référentiel
|
»
Décryptage
préalable
de
la
norme
avant
de
lancer
l’autodiagnostic
|
-
Inexpérience
dans
le
domaine
de
l’audit
|
»
Autoformation
sur
les
bases
de
l’audit
et
prise
en compte des
enseignements du Master MQ
|
-
Difficultés
à
recueillir
les
informations
nécessaires
au
remplissage
du
questionnaire
|
»
Entretien
individuel
avec
tous
les
membres
du
laboratoire,
le chef de
Service et le Responsable Qualité puis recoupement des
informations recueillies
|
2) Mise à jour du système documentaire
|
-
Manque
d’implication
de
la
part
du
personnel
du
laboratoire
|
»
Création
d’une
dynamique
de
rédaction/correction/validation
des
documents
(objectif
:
1
document validé par semaine)
|
- Manque de temps
|
»
Lancement
de
la
phase
de
rédaction
des
documents
le plus
tôt possible et suivi journalier de l’avancement
|
»
Répartition
de
la
rédaction
des
documents
entre
tout
le
personnel du laboratoire
|
Tableau 1 : Analyse de risques de la
mission
[12]
V.
Résultats et discussion
1.
Choix
du
questionnaire
d’autodiagnostic
Avant toute chose, il a fallu choisir un questionnaire d’autodiagnostic
adapté aux attentes exprimées pour ce stage. Plusieurs
solutions étaient envisageables : le questionnaire du
COmité FRançais d’ACcréditation (COFRAC)
d’autoévaluation et de préparation à
l’évaluation sur site selon la norme ISO 15189, ou la grille
d’autodiagnostic basée sur la norme ISO 15189 proposée
dans le cadre d’un projet d’intégration du Master Management de
la Qualité de l’Université de Technologie de
Compiègne (UTC)
[13-14].
Après
une
analyse
des
deux
outils,
il
est
apparu que le premier
était à même de donner des résultats plus
précis sur l’état d’avancement de la démarche
qualité du CPC. En effet, on y retrouve l’architecture de la
norme avec des séries de questions portant sur tous les sous
chapitres des exigences relatives au management et des exigences
techniques de celle-ci. Cependant le point faible de ce questionnaire
est l’absence d’outil de calcul automatique en fonction des
réponses données pour chaque question. Ainsi, il n’est
pas possible d’obtenir directement une cartographie présentant
graphiquement les résultats obtenus. Toutefois, le questionnaire
COFRAC a été retenu pour l’évaluation dans les
trois laboratoires sélectionnés pour cette mission. Le
travail réalisé précédemment par Dinha
Bouraï, étudiante en Mastère NQCE à l’UTC a
été une aide précise pour ce choix
[15].
2.
Résultat
de
l’autodiagnostic
réalisé
en
début
de
mission
Le choix de réaliser l’autodiagnostic dans le seul laboratoire
d’Hématologie a été fait par souci de gain de
temps. En effet, mis à part des différences au niveau de
l’avancement de la rédaction et de la validation de la
documentation interne, tous les laboratoires mettent en œuvre les
mêmes actions en ce qui concerne l’AQ. Ainsi si une exigence
n’est pas remplie dans un des trois laboratoires, elle a peu de chances
de l’être dans les autres. De plus, le questionnaire comporte
environ 200 questions, ce qui rend son utilisation longue et difficile
du fait de la disponibilité limitée des différents
interlocuteurs. Il aurait donc été inutile de recommencer
cet audit dans chacun des laboratoires concernés par ce travail.
Après analyse des résultats et élaboration de la
représentation graphique de ceux-ci sous forme d’une
cartographie « radar » (ou Kiviat), des points faibles sont
apparus.
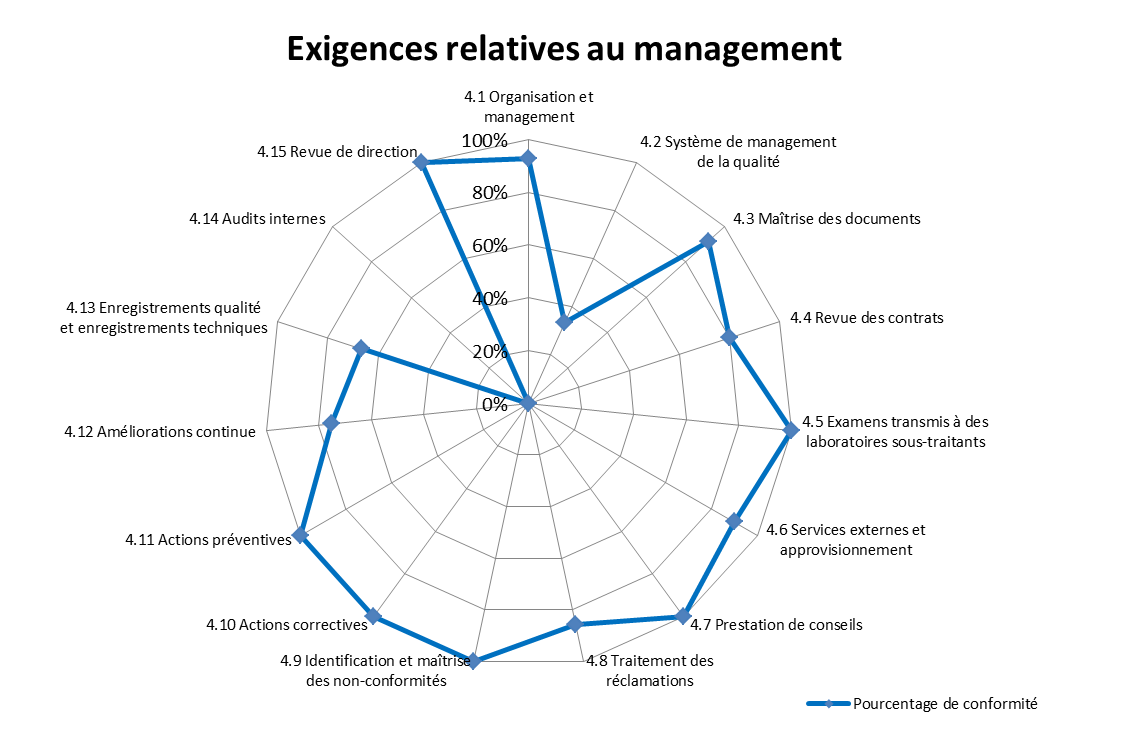
En ce qui concerne le chapitre des exigences relatives au management (
figure 2) :
- La politique qualité n’avait pas
été mise à jour pour l’année 2011 et ne
mentionnait pas l’engagement de la Direction à mettre en œuvre
un SMQ en conformité avec la norme.
- Le Manuel Qualité n’avait jamais
été finalisé, validé et diffusé.
- Un certain nombre de procédures de
fonctionnement n’avaient pas été rédigées
ou validées et diffusées.
- Aucun audit interne n’était
réalisé du fait qu’aucun personnel n’était
formé à la conduite d’audits.
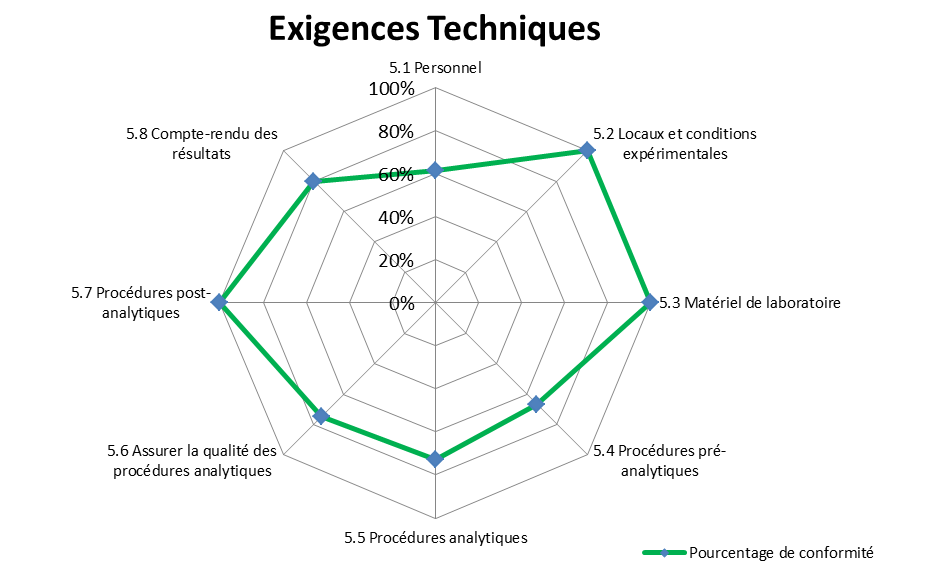
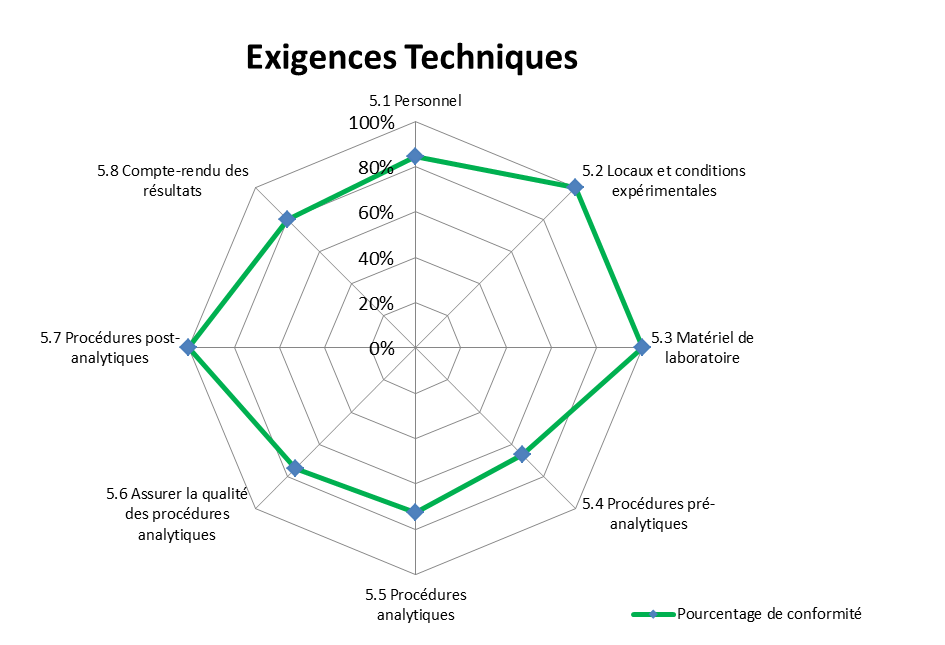
En ce qui concerne le chapitre des exigences techniques (
figure 3) :
- Les laboratoires ne disposaient pas d’organigrammes
de service.
- Les parcours d’habilitation du personnel
n’étaient pas définis.
- La procédure de traitement des
échantillons en urgence n’avait pas été
validée et diffusée.
- La métrologie des appareils et des
équipements de mesure (notamment les pipettes) n’était
pas réalisée.
- Les pratiques à suivre lorsque les
délais de rendu des résultats ne sont pas
respectés n’étaient pas formalisées.
La réalisation de cette auto-évaluation n’a pas aboutie
à l’élaboration d’un plan d’action avec un calendrier
précis pour remplir toutes les exigences. Cependant, les
conclusions de cet audit pourront aboutir à un plan d’action en
fonction des choix de la Direction sachant que le temps imparti n’est
pas limité par quelques exigences réglementaires que ce
soit. Ce stage aura toutefois permis de combler certains manques en
particulier en ce qui concerne la documentation.
De plus, le plus gros point faible du SMQ du CPC se situe au niveau de
la conduite d’audits internes. Il est donc nécessaire de
procéder à une formation visant à la fois le
Responsable Qualité et les correspondants qualité de
chaque laboratoire pour pouvoir palier à ce manque. Il est ainsi
essentiel qu’un message fort de la part de la Direction soit
émis et reçu par tous les acteurs de l’entreprise comme
étant une volonté réelle et un engagement net.
Figure 2 : Pourcentage de
conformité vis-à-vis des exigences de l'ISO 15189
relatives au Management
[12]
Figure 3 : Pourcentage de conformité vis-à-vis des
exigences Techniques de l'ISO 15189
[12]
3.
Résultat
de
l’autodiagnostic
réalisé
en
fin
de
mission
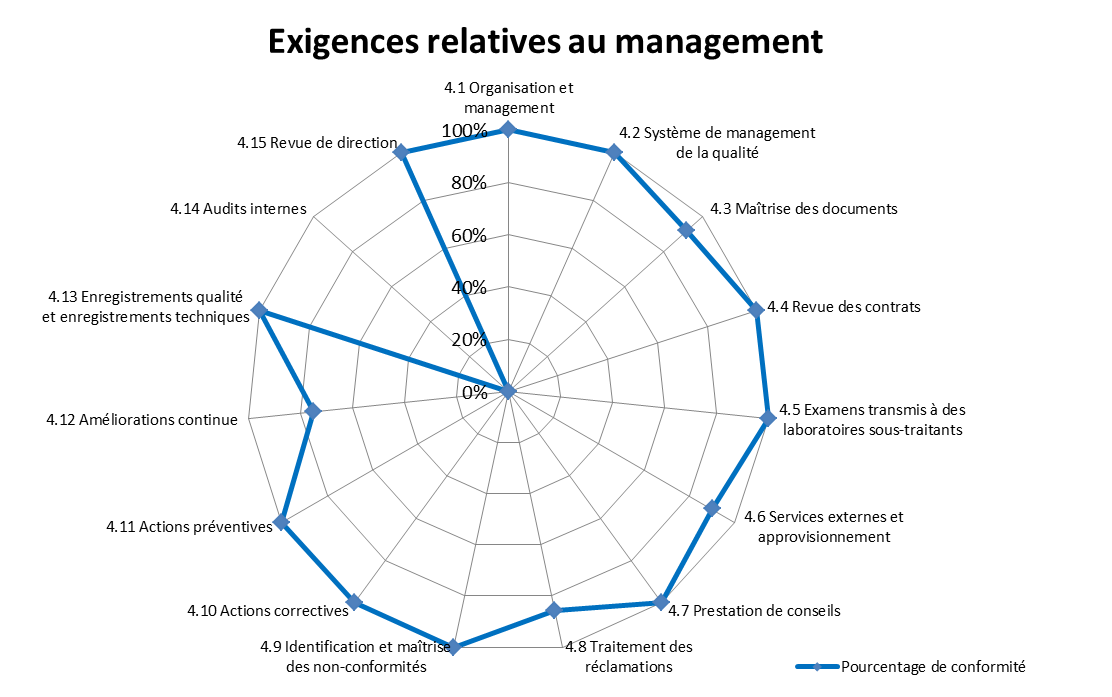
L’autodiagnostic réalisé en fin de mission a
permis de constater les apports de ce stage et de mettre en avant les
efforts restants à fournir pour remplir toutes les exigences de
la norme (figure 4 et 5).
Il apparait que désormais le plus gros point faible du SMQ du
CPC est l’absence d’audits internes.
En ce qui concerne le travail réalisé, plusieurs points
ont été remplis :
- Le manuel qualité a été
corrigé, validé et diffusé.
- La politique qualité a été
mise à jour avec des objectifs concrets fixés par la
Direction.
- Plusieurs Procédures d’organisation de
l’Assurance Qualité ont été validées et
diffusées.
- Les organigrammes des laboratoires concernés
par cette mission ont été établis et
validés.
- Les listes de documents, des analyses
réalisées (catalogue des analyses) et du matériel
ont été mises à jour ou créées.
- Les matériels de laboratoire ont
été identifiés.
- La répartition des tâches a
été formalisée à travers la validation et
la diffusion de tableaux de répartition des tâches.
Figure 4 : Pourcentage de
conformité vis-à-vis des exigences de l'ISO 15189
relatives au Management (fin de période de stage)
[12]
Figure 5 : Pourcentage de
conformité vis-à-vis des exigences Techniques de l'ISO
15189 (fin de période de stage)
[12]
Les différents services
n’étaient pas tous au même
état d’avancement en ce qui concerne la rédaction des
documents qualité. L’objectif initial du CPC en ce qui concerne
le système documentaire des laboratoires était d’avoir
100% de documents validés au 30 octobre 2011, cependant certains
laboratoires ont tenu à profiter de ce stage pour terminer
l’élaboration de leur documentation interne.
a)
Laboratoire d’Anatomie et Cytologie Pathologiques
Le seul laboratoire ayant
rédigé, validé et diffusé 100% de sa
documentation interne est le laboratoire d’Anatomie et Cytologie
Pathologique. Bien que ce soit l’un des plus petits services du CPC, la
documentation interne en début de mission était
totalement inexistante, ce qui en faisait le laboratoire le plus en
retard dans l’élaboration du système documentaire. Il a
donc d’abord fallu établir une liste des documents à
rédiger en concertation avec les techniciens et le chef de
service, puis instaurer une dynamique pour l’élaboration de
ceux-ci.
La sensibilisation du personnel à l’importance de la
documentation a été une étape importante dans ce
laboratoire puisqu’il fonctionnait auparavant sans aucune trace
écrite autre que les fiches de paillasse et quelques
enregistrements nécessaires au fonctionnement. De plus, la
culture orale a toujours une place importante au Cameroun, ce qui
explique l’inutilité apparente d’écrits. Cependant,
l’implication du personnel a été un des points forts du
travail dans ce service puisqu’ils ont très rapidement compris
l’opportunité que leur offrait ce stage.
Grâce à une méthode efficace le processus de
rédaction, correction, validation puis diffusion a
été bien maîtrisé par l’ensemble du
personnel technique et par le chef de service. La principale
difficulté rencontrée par le personnel a
été l’explication par écrit des activités
réalisées au laboratoire. La cause de cette
difficulté réside dans l’utilisation de la langue
française pour décrire les activités de
manière simple et compréhensible de tous. La
sensibilisation sur l’intérêt du système
documentaire et sur son fonctionnement permettra au laboratoire de
faire vivre celui-ci et facilitera le travail en cas de besoin de
nouveau document ou de révision.
b)
Laboratoire d’Hématologie
Le laboratoire d’Hématologie
possédait un grand nombre de documents rédigés
mais non corrigés donc inutilisés. Suite à des
problèmes informatiques, un grand nombre de ces documents de
travail ont été perdus, ce qui a ralenti
considérablement le travail d’élaboration de la
documentation qualité. Malgré tout, le taux de validation
des documents est passé de 34 à 73%. La rédaction
des documents a été répartie sur l’ensemble du
personnel du laboratoire et à l’issue de ce stage, la
majorité d’entre eux ont rédigé tous les documents
qui leur ayant été attribués. Pour des raisons de
disponibilité du personnel, seul quelques personnes se partagent
l’ensemble de la documentation restant à établir. La
dynamique instaurée devrait permettre de finaliser le
système documentaire dans les délais fixés.
c)
Laboratoire de Bactériologie
En ce qui concerne le service de
Bactériologie, une liste de documents qualité a
été établie. Cette dernière montrait que
près du tiers restaient encore à rédiger alors que
les autres devaient être corrigés et mis en forme avant
validation et diffusion. Le laboratoire de Bactériologie
constitue un service important et le personnel y est plus important en
termes d’effectif que dans les autres services concernés par ce
travail. De ce fait, le pilotage de la démarche de mise à
niveau du système documentaire y a été plus
compliqué. Le principal facteur ayant ralenti
l’élaboration des documents dans ce laboratoire n’est pas le
manque de motivation du personnel - bien au contraire - mais
plutôt le nombre de documents à établir ou à
mettre en forme. En effet, un grand nombre de « modes
opératoires » ou « d’instructions de travail »
a été rédigé mais le mode de
rédaction, la mise en forme et le contenu ne correspondait pas
à un document qualité. Il a donc fallu reprendre un par
un ces ébauches et les corriger, les compléter puis les
formater avant de passer à la phase de validation et de
diffusion. Cette étape supplémentaire a pris un temps
considérable aux vues du nombre de documents à revoir et
la disponibilité limitée des rédacteurs et
correcteurs.
L’explication de la structure de ces différents documents et
l’accompagnement réalisé pour la validation de certains
d’entre eux aura sans doute permis d’offrir plus d’autonomie aux
correspondants qualité et aux techniciens pour la
rédaction ou la validation des documents restants.
5. Perspectives
à court terme
a) L’audit
interne
Actuellement, le principal point faible du SMQ du CPC est l’absence
d’évaluation des performances des laboratoires. Il faut donc que
la Direction s’assure de la formation à la fois du Responsable
Qualité et des correspondants qualité afin que puisse
être mis en place un système d’audit croisé entre
les laboratoires. En effet, chacun d’eux possède des
spécificités qui lui sont propres et met en œuvre des
actions dans le cadre de l’AQ. L’audit permettra donc à chaque
laboratoire de s’inspirer des systèmes qualités
rencontrés dans les autres services pour les transposer et
dynamiser le SMQ.
Cette formation ne pouvant pas être assurée par le
Responsable Qualité, il est nécessaire de faire
intervenir un formateur extérieur au CPC, puis d’établir
un calendrier des audits internes afin que tous les laboratoires
puissent être à la fois audités et auditeurs
à une fréquence définie.
b) La
sécurité du personnel
Le transport des échantillons
au sein des locaux du CPC est à améliorer. En effet, le
service de prélèvement se situant au
rez-de-chaussée, les techniciens doivent
régulièrement descendre pour aller chercher les
échantillons destinés à leur laboratoire. Il faut
donc traverser le couloir où certains patients attendent pour
aller au secrétariat médical, puis monter les escaliers
et parcourir le couloir jusqu’au laboratoire. Ce trajet se fait trop
souvent dans des conditions de sécurité insuffisantes. En
effet, les techniciens ne mettent presque jamais de gants pour
transporter les échantillons (matériel biologique
potentiellement à risque) et les portoirs pour les tubes sont
régulièrement surchargés afin d’éviter des
voyages intempestifs.
La solution à ce problème ne réside pas dans la
réorganisation de l’espace de travail. Les locaux sont certes
relativement peu adaptés à l’activité mais il
n’est pas possible de modifier le circuit de l’échantillon sans
de lourds travaux d’aménagement difficilement envisageables. Il
serait donc judicieux de sensibiliser le personnel à
l’importance du port d’équipements de protection (gants
notamment) lors du transport des échantillons et à
l’utilisation de boites de transport fermée plutôt que les
portoirs pour les tubes.
c)
L’approche
processus
Certains laboratoires du CPC doivent
faire face à des problèmes liés au non-respect des
délais de rendu des résultats d’analyses, ce qui
crée des mécontentements au sein des patients et des
prescripteurs. Ces disfonctionnements sont essentiellement liés
à un manque de communication entre le service de retrait des
résultats, l’accueil, le service de prélèvement et
les laboratoires.
La mise en œuvre d’une approche processus avec la définition des
phases pré-analytiques, analytiques et post-analytiques pourrait
permettre de rationaliser le circuit de l’échantillon et
résoudre ce genre de problèmes organisationnels. Ce type
d’approche a déjà été employé dans
le Laboratoire d’Hygiène et de l’Environnement, en vue de
s a prochaine accréditation selon la norme ISO
17025
[16].
Conclusion
Ce stage aura été pour moi l’occasion de connaitre en
détails les exigences de la norme ISO 15189, ce qui sera d’une
grande aide pour la suite de mon projet professionnel. Celle-ci
étant construite sur le modèle de l’ISO 9001, ce travail
de décryptage, d’auto-évaluation et de mise en
application sera nécessairement bénéfique pour
comprendre, interpréter et mettre en œuvre les autres normes. De
plus, les LABM ayant le choix de mettre en application pour leur SMQ
soit l’ISO 15189, soit l’ISO 17025
[17] ou l’ISO 9001, j’ai pu
prendre
connaissance de ces trois référentiels, ce qui m’a permis
de m’approprier les textes en question dans l’optique de faciliter un
travail futur avec ces référentiels.
De même, l’aspect gestion de projet et pilotage d’une
équipe est un des points forts de ce stage du point de vue de
l’apport de connaissances de terrain. La formation pratique
complète parfaitement les enseignements théoriques et
techniques de cette année de Master. En effet, le travail dans
un pays socio-culturellement différent de la France est
très intéressant par le fait que les méthodes de
travail doivent être adaptées à la situation de
travail, ce qui apporte une plus grande autonomie et une
capacité d’adaptation importante.
En outre, les missions qui m’ont été confiées
m’auront offert de nouvelles compétences en ce qui concerne la
mise en place d’un système documentaire complet dans un LABM,
tant au niveau de la structure documentaire du laboratoire que de la
mise en place proprement dite avec toute la partie management
associée. La documentation étant d’une importance
capitale dans toutes les normes internationales construites sur le
modèle de l’ISO 9001, cet apport sera intéressant par la
suite pour d’autres missions qui pourront m’être confiées.
La dynamique instaurée au sein du CPC va permettre aux
laboratoires concernés par cette mission de continuer le travail
de finalisation de la documentation dans les délais fixés
par la Direction.
La mise en conformité du SMQ du CPC avec la norme
internationale, avec à la clé l’accréditation,
sera une reconnaissance du travail accompli et sera la preuve de la
qualité de la prestation d’analyse demandée par le
client.
Bibliographie
[1] Journal Officiel de la
République Française,
Ordonnance n°
2010-49 du 13 janvier 2010 relative à la biologie médicale,
2010
[en
ligne].
Page
consultée
le
23
février
2011,
mise à
jour du 15 janvier
2010. Disponible sur l’internet : www.legifrance.gouv.fr
[2]
CVM
Médiforce,
Fonctionnement
et conditions d’exploitation des
laboratoires. Page consultée le 05 mai 2011. Disponible
sur l’internet
: www.cvmmediforce.fr
[3]
Centre
Pasteur
du
Cameroun,
Célébration
du
Cinquantenaire
du Centre Pasteur du Cameroun, 2009, 124 p.
[4]
Centre
Pasteur
du
Cameroun,
Rapport
d’activité 2009, 2010 [en
ligne]. Page consultée le 14 février 2011. Disponible sur
l’internet :
http://www.pasteur-international.org
[5]
CRIAUD
Jean,
Histoire du Cameroun :
de la préhistoire à nos jours. Editions
Saint-Paul, Yaoundé. 129 p.
[6]
Les
Afriques,
Cacao : le Cameroun
veut améliorer son classement
et augmenter son taux de transformation, Article paru le 15
janvier
2010. Page consultée le 03 mai 2011. Disponible sur l’internet :
http://www.lesafriques.com/
[7]
Association
Française
de
Normalisation
(AFNOR),
NF EN ISO
15189,
Laboratoires d’analyses de biologie médicale - Exigences
particulières
concernant la qualité et les compétences, 2007 [en
ligne]. Disponible
sur l’internet : www.boutique.afnor.org
[8]
Site
institutionnel
du
Réseau
International
des
Instituts
Pasteurs.
Page
consultée le 16 mars 2011. Disponible sur
l’internet :
http://www.pasteur-international.org/
[9]
REVOIL
Gilles,
Assurance
qualité dans les laboratoires d’analyses et d’essais,
2ème tirage. 1996, AFNOR Editions. 209 p.
[10]
Journal
Officiel
de
la
République
Française,
Arrêté du 2
novembre 1994 relatif à la bonne exécution des
analyses de biologie
médicale - Guide de Bonne Exécution des Analyses de
Biologie Médicale,
1994 [en ligne]. Page consultée le 15 janvier 2011, mise
à jour du 11
décembre 1999. Disponible sur l’internet : www.legifrance.gouv.fr
[11]
HOCMENI
TEMBIWE
Christelle,
Application du GBEA à l’Assurance
Qualité au service de Biochimie-Sérologie du Centre
Pasteur du Cameroun
: Actualisation du Système Documentaire, Mémoire
de fin d’études de
Master Professionnel en Contrôle et Gestion de la Qualité,
Ngaoundéré :
Ecole nationale Supérieure des Sciences Agro-Industrielles –
Université
de Ngaoundéré (Cameroun), 2010, 50 p.
[12]
DUCHENE
Charles,
Mise en application
de la norme ISO 15189 dans
les Laboratoires d’Analyse de Biologie Médicale, Stage
professionnel de
fin d’études, MASTER Management de la Qualité (MQ-M2),
UTC, 2010-2011
[En ligne]. Disponible sur l’internet : www.utc.fr
[13]
Comité
Français
pour
l’Accréditation
(Cofrac),
Questionnaire
d’autoévaluation
–
Préparation de l’évaluation sur
site selon la norme
NF EN ISO 15189, 2010 [en ligne]. Page consultée le 15
février 2011.
Disponible sur l’internet : www. cofrac.fr
[14]
DE
FRONDAT
Fatima,
DELAHAYE
Valérie,
PODLUNSEK
Christophe,
GOMEZ
Papa-James,
Outil
d’autodiagnostic basé sur la norme ISO 15189
pour les Laboratoires d’Analyses de Biologie Médicale (LABM),
Projet
d'Intégration,
MASTER
Management
de
la
Qualité
(MQ),
Mastère
Spécialisé
Normalisation,
Qualité, Certification, Essai (NQCE), UTC,
2009-2010 [en
ligne]. Page consultée le 16 février 2011. Disponible sur
l’internet :
www.utc.fr
[15]
BOURAÏ
Dinha,
Mise en œuvre
d’une démarche qualité avec mise à
niveau selon la norme ISO 15189 dans un laboratoire d’analyses de
biologie médicale situé dans un pays
économiquement et
socio-culturellement différent des pays industrialisés :
le Cambodge,
Thèse professionnel Mastère NQCE. Compiègne :
Université de Technologie
de Compiègne, 2010, 56 p [en ligne]. Page consultée le 17
février 2011.
Disponible sur l’internet : www.utc.fr
[16]
SOUAIBOU
MAMMA
Rikiatou,
Mise en
place d’un système d’Assurance
Qualité par l’approche processus, Mémoire de fin
d’études de diplôme
d’Ingénieur Industries Agricoles et Alimentaire (IAA),
Ngaoundéré :
Ecole Nationale Supérieure des Sciences Agro-Industrielles -
Université
de Ngaoundéré (Cameroun), 2010, 41 p.
[17]
Association
Française
de
Normalisation
(AFNOR),
NF EN ISO
17025, Exigences générales concernant la
compétence des laboratoires
d’étalonnage et d’essais, 2005 [en ligne]. Disponible sur
l’internet :
www.boutique.afnor.org
retour
[18]
Centre
Pasteur
du
Cameroun,
Documentation
interne, 2011.
Table
des
annexes