Mes remerciements
vont à Monsieur Michel BAILLEUL, le Directeur adjoint des
Services Economiques et Logistiques du Centre Hospitalier Paul CHAPRON
pour m’avoir accueilli au sein de l’établissement.
Mes reconnaissances vont plus particulièrement à mon
maître de stage Laurent NEUGE ainsi qu’à toute
l’équipe technique, qui, d’une manière ouverte, ont
guidé mon intégration professionnelle tout au long de
cette période de stage.
Je tiens à remercier la secrétaire des services
techniques pour son accueil, son écoute et pour sa
disponibilité.
Mes remerciements à la responsable du service informatique et
l’ingénieur qualité pour m’avoir accordé leur
temps et voulu bien répondre à mes questions.
Cette période fut un grand moment dans mon parcours
professionnel.
Enfin, je tiens à remercier vivement l’équipe
pédagogique de l’Université de Technologie de
Compiègne pour l’encadrement, leur enseignement et leur
compétence, mes remerciements à Monsieur François
Thibault pour ses précieux conseils lors de sa visite sur mon
lieu de stage.
Sans oublier ma famille, mes amis qui m’ont intimement soutenu pendant
toute cette période et tous ceux, de près ou de loin, ont
contribué à la réalisation de ce projet
II.1.4.
La norme NF
S 99-171
Elle énonce le modèle et la définition pour
l’établissement et la gestion du registre de
sécurité, qualité et maintenance d’un dispositif
médical (RSQM).
Le registre RSQM, absolument, propre à chaque dispositif
médical concerné, se doit enregistrer toutes les
opérations de maintenance, de contrôle qualité et
des contrôle de sécurité menées sur ce
dernier dès sa toute première mise en service
jusqu’à son retrait du parc, le registre étant toutefois
accessible dans la période allant jusqu’à cinq ans
après la réforme du dispositif.
Cette norme définit la forme du registre RSQM par
différentes fiches qui peuvent être reproduites sous le
format papier ou informatisé (voire même la GMAO, ce qui
est le cas pour l’établissement) et de ce fait, la GMAO se devra
proposer d’éditer pour chaque dispositif, le minimum des
exigences de la norme.
Pour un RSQM informatisé, il faudra tenir compte des
éléments clés telles que : l’accessibilité
plus ou moins facile aux données, la facilité de la mise
à jour, une navigation aisée entre les données et
enfin la sécurisation des données afin d’éviter
toutes les altérations pouvant se faire occasionner sur les
données du registre de sécurité.
Par ailleurs, le RSQM, étant le moyen le plus fiable pour tracer
et éventuellement un outil indispensable pour la gestion des
dispositifs médicaux, il convient de déterminer la
responsabilité de chacun des acteurs du RSQM.
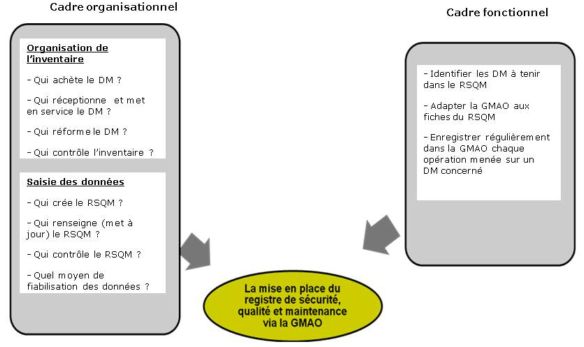
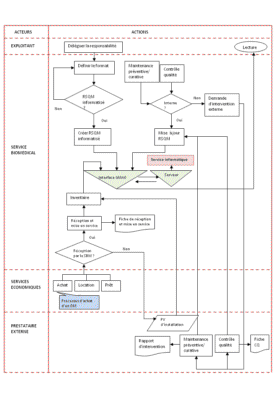
Le synoptique suivant reprend toutes les actions nécessaires
pour une mise en place d’un registre RSQM via la GMAO. Il faut
toutefois se fixer l’idée que si l’on ne dispose pas d’un
inventaire, il est pratiquement impossible d’établir un registre
RSQM.
II.2. La mise
en place du registre RSQM via la GMAO
II.2.1.
L’état de la situation actuelle au regard de la
réglementation
Au départ, une étude des états de lieux a
porté sur deux volets afin de s’assurer de la suite du projet :
i. Evaluer si la GMAO déjà en route
peut contenir le registre RSQM
ii. Partir de l’existant déjà dans la
GMAO (inventaire, diverses interventions) pour en tirer les
éléments manquants et les éléments à
améliorer.
Cette étude a été menée au regard des
fiches établies par la norme avec l’adjonction de quelques
éléments essentiels qui viendront en complément.
(Guide pratique de maintenance des dispositifs médicaux du DRASS
Midi-Pyrénées).
Pour ce faire, un tableau comparatif convenait bien pour dresser les
exigences de la norme, la position du centre hospitalier ainsi que les
actions à entreprendre pour se mettre en conformité avec
la norme.
Une annotation est attribuée de la manière suivante :
Pour 10 équipements évalués :
Satisfaisant : 7 à 10 répondent au critère
Peu satisfaisant : en dessous de 7 et supérieur à 0
Pas du tout fait : aucun équipement ne répond au
critère.
Le tableau comprend les champs à renseigner
impérativement et les champs recommandés.
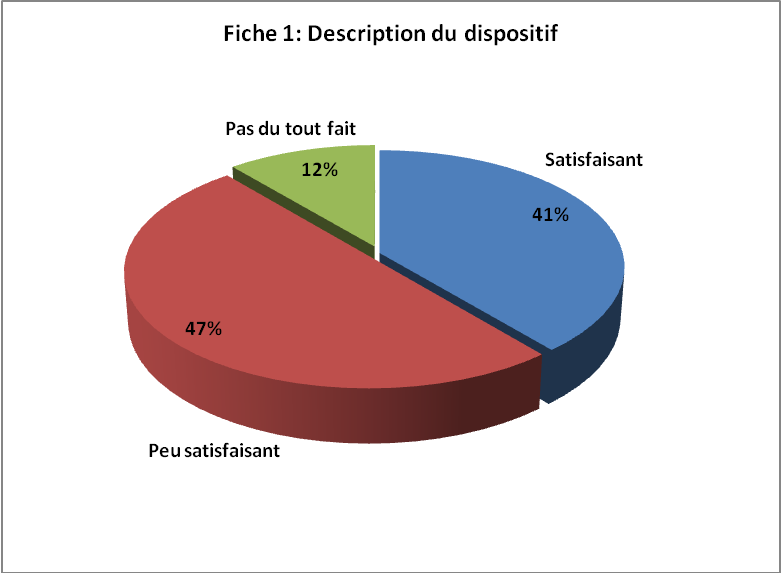
FICHE 1 : DESCRIPTION
DU DISPOSITIF
|
Contenu
|
Situation CH
|
Recommandations
|
Satisfaisant
|
Peu satisfaisant
|
Pas du tout fait
|
Nom
|
X
|
|
|
|
| N° d’identification dans
l’établissement |
X |
|
|
|
| Type |
X |
|
|
|
| N° de série |
X |
|
|
|
Classe CE
|
|
X |
|
• Exiger le fournisseur le certificat de
conformité aux exigences et effectivement la classe de son DM
(et ce, avant l’achat du DM)
|
Fabricant : - Nom
- Coordonnées
|
|
X |
|
• Veiller à tenir compte de cette
entrée et tenir à jour le RSQM en cas d’un
éventuel changement d’adresse du fabricant. |
Fournisseur : - Nom
- Coordonnées
|
|
X |
|
• L’entrée quasiment similaire
à la précédente, les deux pouvant parfois ne pas
être disponible en même temps
|
Exploitant
|
X |
|
|
|
Date de la réception
Responsable de la
réception
Statut de la réception
:
- Conforme à la commande
- Non-conforme à
la commande
|
|
X |
|
• Les copies de fiches de
réception
(par un Technicien Biomédical ou par le fournisseur) devraient
être
mises à la disposition du Service Biomédical et avec des
délais plus
brefs |
Date de mise en service
Responsable(s)
|
|
X |
|
• Les fiches de réception et mise
en service devraient être mises à disposition du service
biomédical (surtout celles élaborées par le
fournisseur, un PV d’installation) |
Durée de garantie
|
|
X |
|
• Critère important à
exiger au fournisseur dès l’élaboration du CCTP
|
| Durée d’exploitation |
|
|
X |
• Le plan
d’amortissement par le service financier devrait, à la rigueur,
mis à disposition du service biomédical
|
Localisation: Site, Service
|
X |
|
|
|
Référentiels
(textes réglementaires, décrets, arrêtés)
|
|
|
X |
• Créer un champ dans la GMAO afin
d’intercaler cette entrée,
• Prendre en compte le cadre
réglementaire auquel est soumis un DM
|
DM rattachés
(modules, accessoires)
|
|
X |
|
|
| Coûts :
Acquisition, Installation, Formation |
|
X |
|
• Améliorer la communication via
la GMAO avec les services économiques pour gagner du temps.
|
Contrats de maintenance
|
X |
|
|
• Amélioration de la communication
avec le Services économiques et à temps
• Le maintien à jour
des contrats
|
Versions logicielles
|
|
|
X |
• Demander au fournisseur au moment des
achats (CCTP, si elle existe)
|
Score
|
7/18
|
9/18
|
2/18
|
|
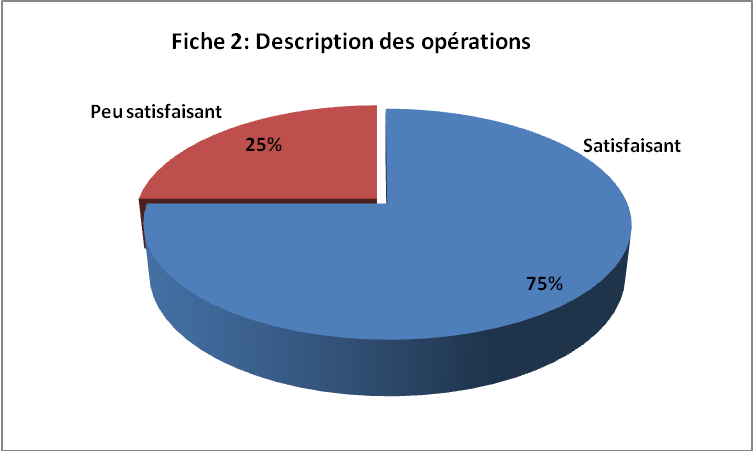
FICHE 2 : DESCRIPTION
DES OPERATIONS
|
Contenu
|
Situation
CH
|
Recommandations |
Satisfaisant
|
Peu
satisfaisant
|
Pas
du tout fait
|
Description
de l’opération
|
X |
|
|
|
Type
d’opération
-
Contrôle qualité interne
- Contrôle qualité externe
- Maintenance préventive
- Maintenance corrective
- Calibration
- Contrôle sécurité
- Reforme ou rebut
|
X |
|
|
|
| Elément
déclencheur (bons de travaux, planning préventif,
compteur horaire, mesure, …) |
X |
|
|
|
Compétences
requises de l’intervenant (définition des formations,
savoir-faire, habilitation)
|
|
X |
|
• Veiller à renseigner toujours la
vocation fonctionnelle pour un dispositif donné.
|
Mode opératoire
(Fiche 3 optionnelle)
Ex : Fiche
contrôle qualité appareils de monitorage SNITEM,….
FICHE 3 : REALISATION DES OPERATIONS
|
|
|
|
|
Score
|
3/4
|
1/4
|
0/4
|
|
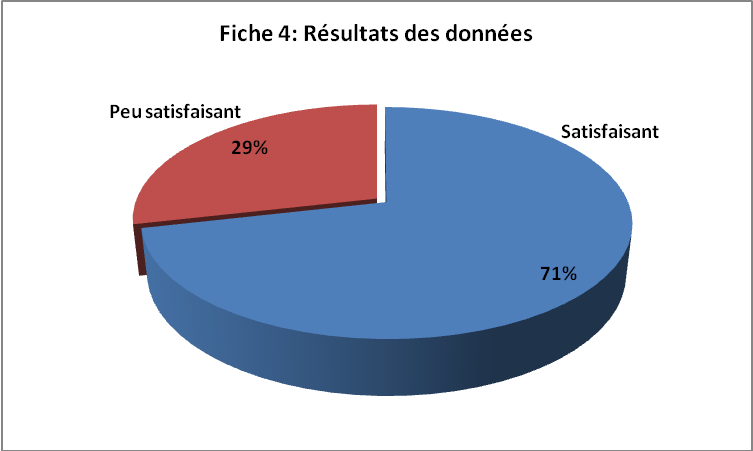
FICHE 4 : RESULTAT DES OPERATIONS
|
Contenu
|
Situation
CH
|
Recommandations
|
Satisfaisant
|
Peu
satisfaisant
|
Pas
du tout fait
|
Référence
du type d’action
|
X |
|
|
|
| Intervenant(s) |
X |
|
|
|
Résultat
-
Conforme
: Pas de description
- Non conforme :Fiche
d’enregistrement
:Rapport
|
|
X |
|
• Ce champ n’existant pas dans la GMAO,
il faudra indiquer dans le champ
«
Observations techniques » les résultats découlant
d’une opération sur un DM.
|
Date
de début
|
X |
|
|
|
| Date
fin de l’opération |
X |
|
|
|
Suites
données
- Sans suite
- Contrôle qualité
- Déclaration Matériovigilance
- Restriction d’utilisation
- Maintenance
- Contrôle de sécurité
- Action de formation
- Dérogation d’emploi
- Réforme
- Mise hors service
|
|
X |
|
▪ Il faudra chaque fois associer aux
résultats la suite des données, pour une
opération
réussie, à la limite, le mot ˝RESULTATS CONFORMES˝ ou
˝NON CONFORMES˝
pour faire suite aux
éventuelles prochaines actions pour surtout le dernier
cas.
|
Cause de
l’opération (Elément déclencheur, description du
défaut)
|
X |
|
|
|
Score
|
5/7
|
2/7
|
0/7
|
|
Champs verts :
obligatoires
DM : Dispositif
médical
CCTP : Cahier des
Clauses Techniques Particulières
Champs blancs
: recommandés
PV : Procès
verbal
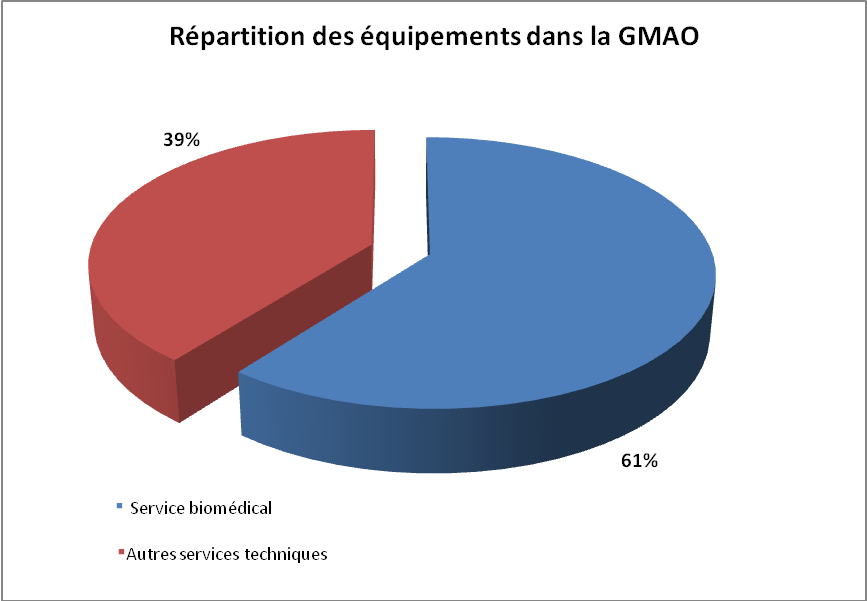
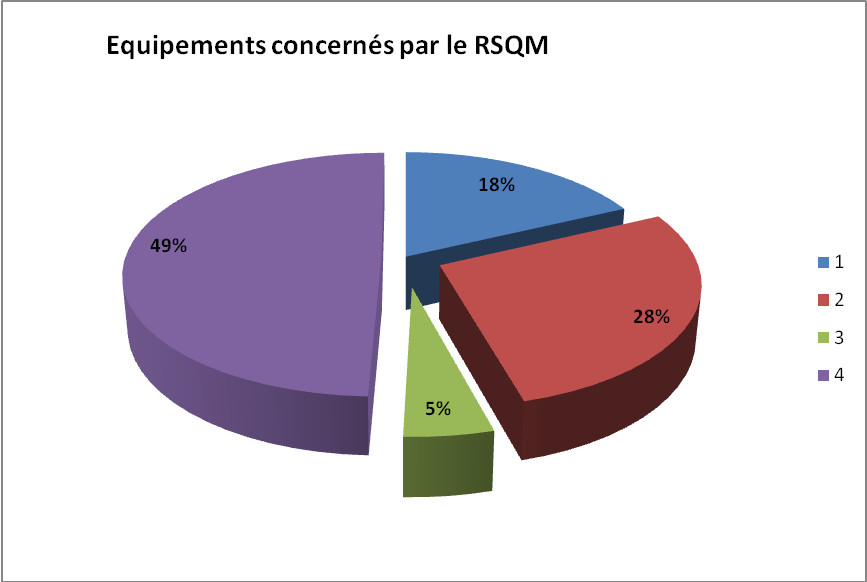
Les graphiques ci-haut reflètent la situation globale du centre
hospitalier qui n’est pas loin des exigences de la norme.
En outre, relever les points forts et les points faibles du
système déjà en place pourra offrir plus de pistes
d’actions d’amélioration à entreprendre.
Les
points forts :
- La
quasi-totalité des données du RSQM sont présentes
dans la GMAO
- Les opérations effectuées sur les DM
sont tenues dans la GMAO
Les
points faibles :
- Certains
dispositifs font défaut de l’inventaire
- Certaines données exigées par le RSQM
manquantes ou peu satisfaisantes
- La productibilité : la GMAO contient tous
les DM même ceux qui ne sont recensés par le RSQM sans
aucun élément distinctif les uns par rapport aux autres.
Les
principales actions à entreprendre:
- Inventorier tout le
parc.
- Partant de ce qui existe déjà dans la
GMAO, identifier les DM concernés par le RSQM et les distinguer
des autres DM.
- Adapter la GMAO aux fiches RSQM de manière
à rendre l’inventaire plus productible. (ici certains champs
faisant défaut devraient être crées à partir
des champs libres offerts par la GMAO (AssetPlus)
II.2.2.
La
procédure de la mise en place du registre de
sécurité et les risques associés
Cette procédure définira bien les responsabilités
de chacun des acteurs, les documents nécessaires ainsi que leurs
dépôts (les supports).
PROCEDURE N°
|
CENTRE HOSPITALIER DE
LA FERTE BERNARD
Service
Biomédical
|
Page 1/2
|
INDICE 0
|
Mise en place du
registre de sécurité RSQM via la GMAO
|
Date : 08 Juin 2009 |
CONTENU
|
Cette procédure a pour objet de
décrire l’organisation et les coordinations, les actions, les
documents, les enregistrements, pour la création, la mise
à jour et la production des registres sécurité,
qualité et maintenance des dispositifs médicaux.
|
| STRUCTURES CONCERNEES |
• Services
économiques
• Service
informatique
• Service
biomédical
• Services
des soins
|
| SUPPORTS UTILISES |
Le logiciel GMAO AssetPlus du service
biomédical
|
| DOCUMENTS ASSOCIES |
• La fiche de
réception et mise en service
• Le rapport
d’intervention
• Fiche de
contrôle qualité
•
Procès verbal (¨PV) d’installation)
|
| FONCTIONS CONCERNEES |
• Directeur
• Directeur des services économiques
• Directrice de services financiers, système
d’information et statistiques
• Responsable du service biomédical
|
| COMMENTAIRES ASSOCIES |
L’exploitant délègue la
responsabilité au technicien biomédical quant à la
création, la mise à jour et la production des RSQM.
Le technicien biomédical suggère la mise en place du
registre de sécurité RSQM via la GMAO au Directeur des
Services Economiques.
La réalisation du RSQM sera confiée au technicien
biomédical
Toutes les données contenues dans le RSQM seront sous la
responsabilité du technicien biomédical qui mettra
à disposition les éléments afin que les
différents acteurs, internes ou externes soient en mesure de
tenir à jour les données obligatoires
|
|
REDACTION
|
VERIFICATION |
VALIDATION |
NOM
FONCTION
DATE
VISA
|
KWIZERA Eric
Stagiaire biomédical
08 Juin 2009
|
NEUGE Laurent
Technicien Biomédical
08 Juin 2009
|
Karine HOTTIN THOREAU
Ingénieur qualité
08 Juin 2009
|
Sur le logigramme ci-haut, le
service informatique est cité dans le processus, revenir sur sa
responsabilité était indispensable: la
sécurisation des données du registre RSQM.
La GMAO, étant hébergé sur un serveur avec
d’autres applications en route dans l’établissement, une
attribution des droits d’accès aux données rassure la
fiabilité des données du registre. Le compte-rendu de
l’entrevue avec la responsable du service informatique est joint en
annexe (Annexe 4).
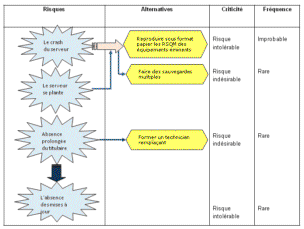
Il s’avère néanmoins nécessaire de figurer les
risques pouvant survenir et compromettre l’exploitation du registre et
des éventuelles solutions à envisager.
II.3.
Documents
nécessaires pour la procédure
D’emblée, pour réussir son registre
RSQM, il faut effectivement disposer d’un inventaire. A cet effet, il
importe de partir du début pour réunir tous les documents
nécessaires en vue, à la suite, de faciliter la saisie
dans l’inventaire. Ainsi, au moment des achats des dispositifs
médicaux, il serait plus raisonnable de demander au fournisseur
de mettre à disposition certains éléments qui
pourront, primo, faciliter l’inventaire, secundo, faire gagner du
temps car on n’aura pas à se renseigner auprès du
fournisseur plus tard pour la classe, par exemple, du dispositif
médical.
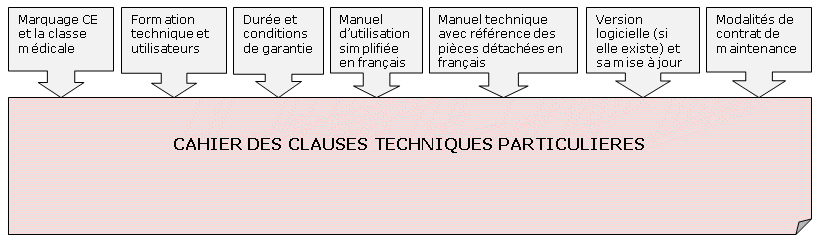
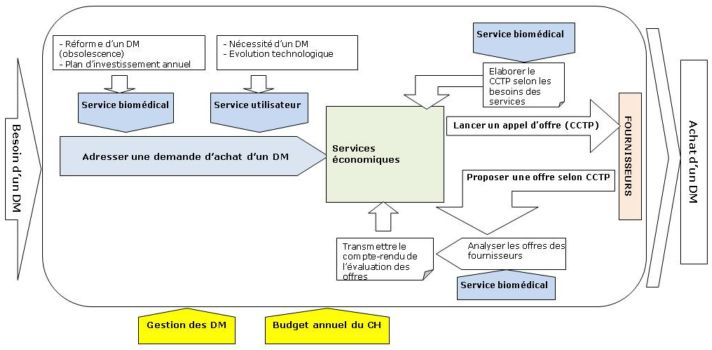
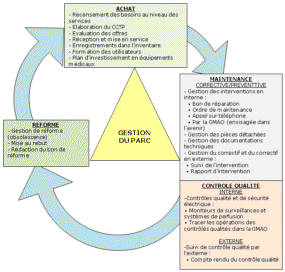
Cependant, à travers le CCTP (Cahier des Clauses Techniques
Particulières), on demandera tous les éléments
répertoriés sur le diagramme ci-dessus. Le service
biomédical, prenant une part assez importante dans le processus
d’achat
d’un dispositif médical, comme le reprend le synoptique dudit
processus d’achat en annexe (Annexe 7), il veillera à exiger le
fournisseur tout ce dont il a besoin pour la saisie d’un dispositif
dans l’inventaire et à la longue, la gestion optimale du parc.
Par ailleurs, dès la réception, les fiches de
réception et de mise en service (Annexe 8) et le
procès-verbal d’installation du fournisseur sont remplies et
pourraient également servir pour la saisie.
Enfin, pour les opérations de maintenance et le contrôle
qualité, seules les activités du correctif en interne
sont directement enregistrées dans la GMAO et celles
réalisées par le prestataire externe qui doivent
être sanctionnées par un rapport d’intervention sera
joint, en fin de compte, à la GMAO aux documents liés au
dispositif médical. Les activités de contrôle
qualité qu’elles soient réalisées en interne
(Annexe 9) ou en externe, les fiches de contrôle
qualité feront l’objet d’un document joint à un
dispositif (Annexe10).
II.4.
Conclusion
La mise en place du
registre RSQM dispose déjà d’un point de
départ solide dans la GMAO d’où toute l’activité
quotidienne du service biomédical est enregistrée.
Ce sera
déjà un atout vis-à-vis le critère 8.k de
l’accréditation V2010 relatif à la gestion des
équipements biomédicaux et le registre RSQM réunit
tous les éléments repris au point
˝E2 : Mise en œuvre de la gestion des
équipements biomédicaux˝ dudit critère.
Si bien que le parc
du centre hospitalier n’est pas aussi grand, il n’est pas
entièrement tenu dans la GMAO, cette dernière ayant
été relancée d’ici il y a peu.
Il revient à la direction de reconnaitre
cette procédure afin de fournir des appuis au service
biomédical quant à l’exécution et la
pérennité de la procédure.
Le service biomédical doit prendre conscience de cette nouvelle
approche fonctionnelle qui rentre bien dans sa responsabilité et
s’y mettre méticuleusement.
Il faut, tout de même, envisager l’accès des services de
soins à la GMAO afin d’améliorer la communication
inter-services et entre les acteurs immédiats du processus.
Il faudra particulièrement envisager la formation
d’un technicien remplaçant du titulaire capable de faire,
à la limite, les mises à jour du RSQM
Bilan
du stage
Cette période de stage a été pour moi un moment
d’intégration professionnelle dans le domaine biomédical
au sein d’un hôpital. Elle m’a permis d’appréhender
l’approche organisationnelle et fonctionnelle d’un service
biomédical afin de répondre efficacement aux besoins et
attentes de bénéficiaires des ses prestations.
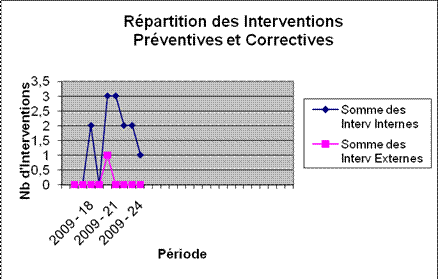
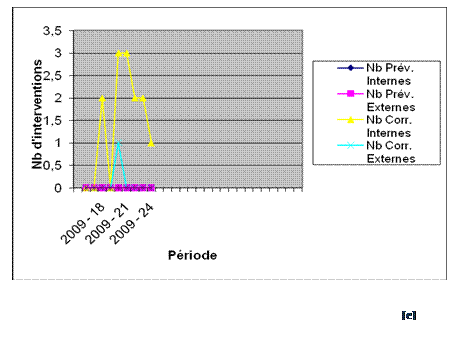
En plus, j’ai eu l’occasion d’effectuer certaines interventions que
ça soit du curatif, du préventif, du contrôle
qualité et contrôle de sécurité
électrique dont le compte-rendu au fil des semaines est
illustré ici-bas, et ce fut une opportunité de me
familiariser avec divers matériels de contrôle et
d’échanger avec d’autres professionnels dont l’habileté
et les compétences m’ont beaucoup apporté
d’expérience.
Bref, ce fut une expérience enrichissante, de consolidation de
ma carrière professionnelle en tant qu’un biomédical.
Bibliographie
[1] : La norme française
NF S 99-171 : modèle et la définition pour
l’établissement et la gestion du registre de
sécurité, qualité et maintenance d’un dispositif
médical (RSQM)
[2] : Guide pratique de
maintenance des dispositifs médicaux
[3] : Dispositifs
médicaux : Guide juridique et pratique
http://www.midipy.sante.gouv.fr/santehom/vsv/vigilanc/materio/maint_dm.htm
[4] : La norme NFC 20-030 :
Protection contre les chocs électriques
[5] : L’arrêté du
3 Octobre 1995
[6] : Le décret
N°2001-1 154 du 5 Décembre 2001 : relatif à
l’obligation de maintenance et de contrôle qualité des
dispositifs médicaux.
[7] : L’arrêté du
3 Mars 2003 : fixant la liste des dispositifs des dispositifs
médicaux soumis à l’obligation de maintenance et de
contrôle qualité.
[8] : Support de cours
Assurance qualité et maintenance dans un milieu hospitalier
dispensé à l’Université de Technologie de
Compiègne (TSIBH 2009) par Mr François THIBAULT.
[9] : Support de cours de
Management des processus dispensé à l’UTC (TSIHB 2009)
par Mr Gilbert FARGES
[10] : Manuel de certification
des établissements de santé V2010
Images
[a] : Intranet CH La
Ferté Bernard
[b] : Intranet CH du Mans
[c] et
[d] : photos prises de l’atelier
biomédical du CH de la Ferté Bernard
[e] : Statistiques issues de la
GMAO (AssetrPlus)
[f], [g], [h], [i]: diagramme
réalisés par moi-même en prenant des
références aux divers supports de cours (TSIBH 2009)
[j] et
[k]: organigrammes du CH de la
Ferté Bernard
Glossaire
AFSSAPS : Agence
française de sécurité sanitaire des produits de
santé
Arrêté : est une
décision exécutoire, à portée
générale ou individuelle, émanant d’un ou
plusieurs ministres (arrêté ministériel ou
interministériel) ou d’autres autorités administratives.
CH : Centre hospitalier
Circulaire : une lettre
adressée à plusieurs personnes pour transmettre des
instructions
Décret : est un acte
exécutoire, à portée générale ou
individuelle, pris par le Président de la République ou
le Premier Ministre qui exerce le pouvoir réglementaire (art. 21
de la constitution du 04 Octobre 1958)
DM : Dispositif médicaux
GMAO : Gestion de la
maintenance assistée par l’ordinateur
RSQM : Registre de
sécurité, qualité et maintenance
SBM : Service biomédical
Annexes
Annexe 1:
Le texte du décret N°2001-1 154
du 05 Décembre 2001

Annexe 2:
Le texte de l’arrêté du 3 Mars
2003 
Annexe 3:
La
classification des dispositifs médicaux (Annexe IX du livre 5 du
code de la Santé Publique) 
Annexe 4:
Le
questionnaire auprès du service informatique
QUESTIONS
SUR LA SECURISATION DES DONNEES DU RSQM
Questions
d’ordre général
Les serveurs
déjà en place
- Les serveurs sont spécifiques aux
applications déjà en route dans le CH ?
Pour
divers logiciels utilisés dans le CH
Les logiciels utilisés
n’ont pas souvent une grande capacité, pour cette raison, ils
cohabitent sur un même serveur
Accès aux
données
- Comment attribuez-vous des droits
d’administrateur ?
C’est
le service informatique qui en détient ? Oui
Ce
sont les chefs de service ? Ils
ne disposent de droits d’administrateur
Autres
? Non
-
L’architecture? Client/serveur
Sécurité de
données
- Comment procédez-vous pour assurer la
sécurité des données :
Vous
créez des multiples sauvegardes ?
Autres
méthodes ? Avec mots de
passes et donner accès aux utilisateurs ce dont ils ont besoin.
Questions
relatives à AssetPlus
- Y-a-t-il un serveur dédié uniquement
à AssetPlus ? Non
Sa
capacité ? Avec une
licence limitée à un certain nombre d’utilisateurs, il
n’est pas assez volumineux.
La
capacité dévolue à AssetPlus(Service
biomédical), est-elle limitée à l’avance ? Oui
Bientôt le RSQM via
AssetPlus
- Envisagez-vous étendre les
accès sur AssetPlus (les clients) ? Avec l’évolution du logiciel, on
peut acheter les licences selon la nécessité.
Jusqu’aux
services des soins afin qu’ils créent des appels ? Il y a un autre logiciel ClariLog par
lequel les services de soins peuvent créer des appels.
Jusqu’aux
services économiques pour la tenue à jour de divers
documents? Ils ont
déjà l’accès à la GMAO (AssetPlus)
Et
l’attribution de droits d’accès ? Toujours avec la limitation des
accès.
- Si AssetPlus cohabitait avec d’autres logiciels sur
un même serveur, comment comptez-vous le gérer ?
Lui
accorder encore plus d’espace ? Oui
Lui
dédier son propre serveur ? Il
continuera à cohabiter avec les autres applications vue sa
capacité
Et
la sécurité des données du RSQM ? La même politique de
sécurisation de données.
Annexe 5:
Les RSQM reproduits de la
GMAO 
Annexe 6:
La
capture d’écran du champ
ajouté à AssetPlus (Le champ ˝Maintenance˝)
Annexe 7:
Processus
d’achat d’un dispositif
médical
Annexe 8:
Fiche de réception et de mise
en service  Annexe 9:
Annexe 9:
Fiche de contrôle
qualité  Annexe 10:
Annexe 10:
Champ
de la GMAO pour joindre les
documents relatifs à un dispositif






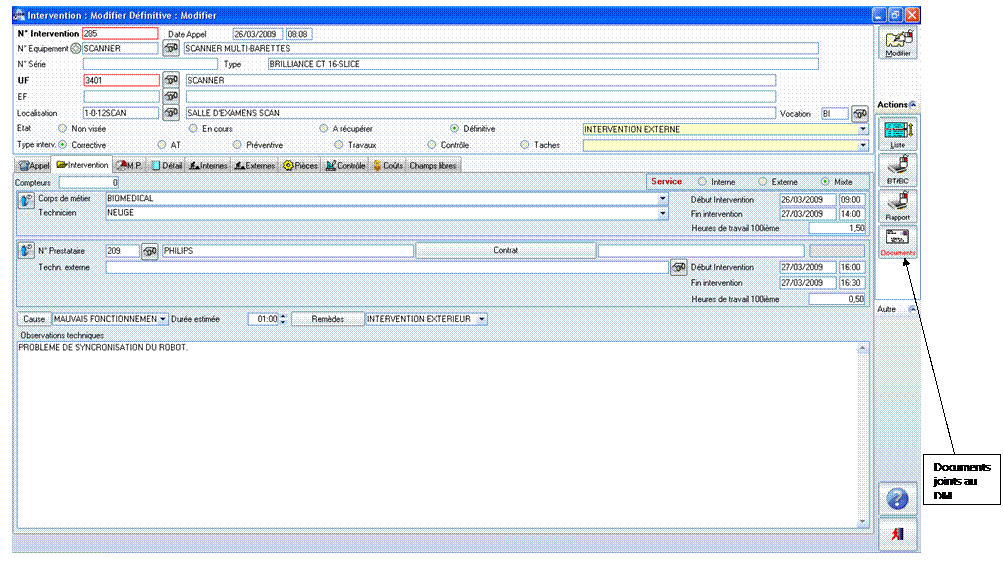
 obligatoire
obligatoire