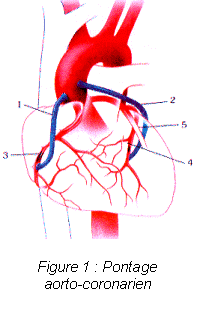
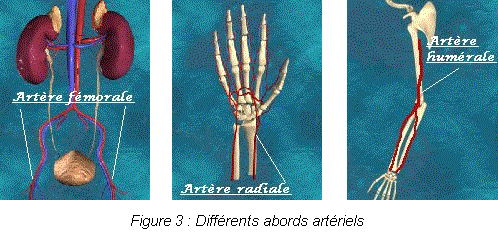
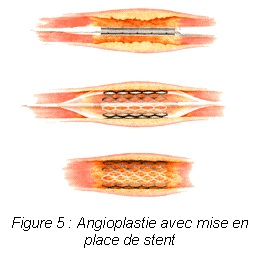
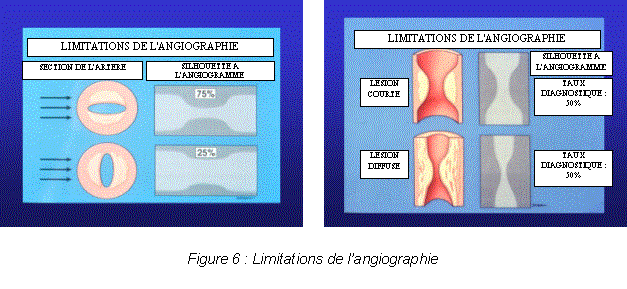
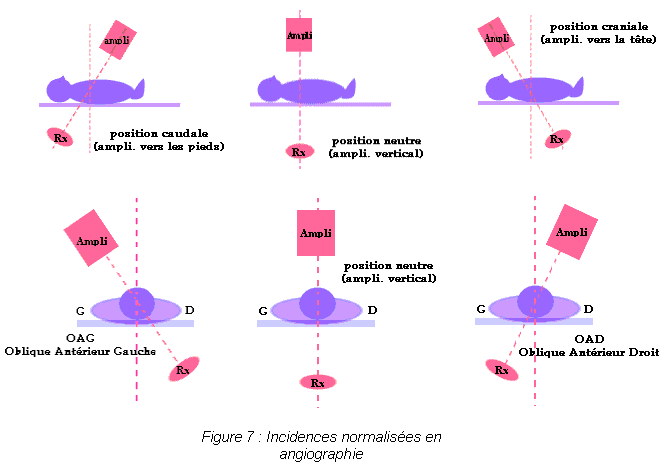
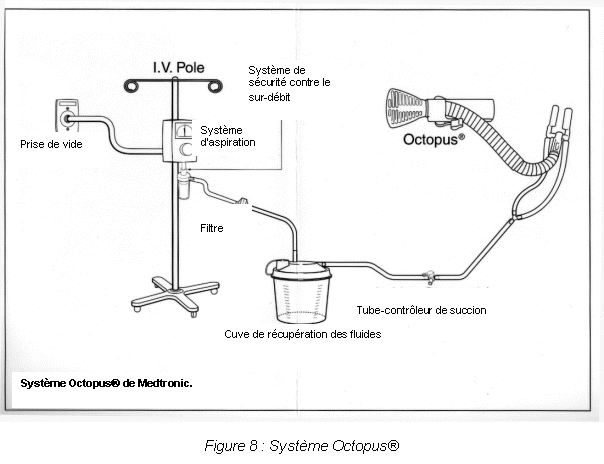
Les progrès
technologiques dans le domaine des endoprothèses ont
permis d'étendre les indications de l'angioplastie et
surtout de réduire considérablement les
complications immédiates, décès et
infarctus du myocarde. Malgré tout, la resténose
intra stent reste encore un problème préoccupant
et certaines lésions complexes sont toujours
inaccessibles. Certaines techniques, après avoir
laissé espérer des perspectives
intéressantes, sont réévaluées
négativement et tendent à être de moins en
moins indiquées pour ce traitement à l'exception
de situations anatomiques spécifiques. C'est le cas
notamment des différents modes d'athérectomie et,
dans une moindre mesure, de la brachythérapie.
Les grands espoirs se portent actuellement
sur la thérapie génique et sur les stents
revêtus. Ces derniers, si les premières
évaluations se confirment, pourraient donc permettre de
résoudre définitivement, dès le premier
acte interventionnel, un problème de sténose
affectant la plupart des artères.
Néanmoins, leur utilisation massive se
heurte dès à présent aux questions
économiques. En effet, s'ils ont un coût trois
fois supérieur à un stent classique, ils ne sont
pour le moment pris en charge par l'assurance maladie qu'au
prix de ce stent classique. Car dans le cadre de la
réforme du TIPS (Tarif Interministériel des
Prestations Sanitaires), le remboursement par l'assurance
maladie des dispositifs médicaux à usage
individuel sont désormais subordonné à
leur inscription sur une liste établie après avis
d'une commission basée sur le service médical
rendu. Pour le stent revêtu, qui est encore en
évaluation, la décision ne sera bien sûr
pas prise avant un certain temps.
Enfin, un concept multidisciplinaire est
développé actuellement appelé «
Hybridtherapie » qui associe, au cours d'une même
intervention, un pontage suivi d'une angioplastie.
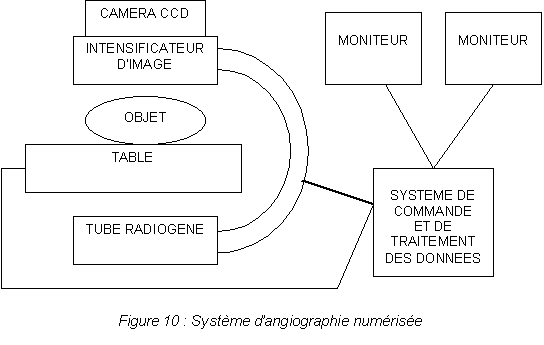
LŒangiographie diagnostique des
artères périphériques est encore
très majoritairement réalisée dans les
salles d'angiographie numérisée. Cette
modalité d'imagerie nécessite pourtant une
injection de produit de contraste par
cathétérisme et une exposition aux rayonnements
ionisants. C'est pour cette principale raison qu'il est de plus
en plus préconisé de faire ce diagnostic par IRM
à l'exception de lésions très
particulières.
Il sera probablement possible de
réaliser, à l'avenir, des
toto-artériographies en routine par Angiographie
par Résonance Magnétique. On pourra alors
visualiser l'ensemble de l'arbre vasculaire de la tête
aux pieds. On s'achemine ainsi, peu à peu, vers ce type
d'examen complet et totalement non invasif. Néanmoins,
la pénurie en équipement IRM que connaît la
France retarde cette évolution pour encore quelques
temps.
L'échographie et le Doppler, en tant
qu'imageries non invasive et non irradiante , surtout avec la
modalité 3D, sont aussi très prometteuses surtout
en complément des autres techniques pour le
diagnostique.
Pour le guidage des procédures
d'angioplastie, l'angiographie numérisée garde sa
prépondérance sur les autres modalités,
même si l'échographie intravasculaire (IVUS)
pourrait se développer et la remplacer parfois ou, plus
rapidement, lui venir en complément pour le
pronostic.
L'apparition et le développement des
techniques interventionnelles peu invasives ont
bouleversé le monde de la cardiologie et du vasculaire.
Les chirurgiens ont vu une part très importante de leur
activité disparaître au profit des cardiologues et
des radiologues. Avec les progrès techniques
réalisés ces dernières décennies et
leur mise en țuvre de plus en plus large, ceux-ci aussi voient
certains actes leurs échapper. En conséquence,
chaque métier cherche à s'assurer un avenir et on
assiste ainsi à beaucoup de débats et parfois de
polémiques car les enjeux sont énormes pour ces
spécialistes.
Pour les chirurgiens cardiaques, les pontages
coronariens ont beaucoup diminués mais ils restent
indispensables dans certaines situations. La chirurgie
mini-invasive tend à répondre à la
préoccupation majeure de la minimisation des risques
infectieux et de la réduction du traumatisme
opératoire.
Pour les cardiologues, qui effectuent quasi
exclusivement les interventions par cathétérisme
sur les coronaires, l'enjeu est de garder ce domaine et,
éventuellement pour certains d'entre eux, d'effectuer
des gestes largement similaires sur les vaisseaux
périphériques.
Pour les radiologues, qui s'attendent à
voir disparaître l'imagerie diagnostique sur l'arbre
vasculaire au profit de l'ARM, la préoccupation est de
garder l'angioplastie des artères
périphériques et de rester , de part leur
formation, les plus aptes à utiliser et
interpréter l'imagerie pour n'importe quel organe. Au
sein de la radiologie, un autre débat consiste à
savoir si les technologies utilisées justifient une
approche par spécialité envers un organe ou
plutôt l'émergence d'une spécialité
« transversale » comprenant tous les actes
diagnostiques (ou à visée
thérapeutiques) qui sont invasifs par
nature[42].
Enfin, pour les chirurgiens vasculaires, le
problème est, en raison la très forte progression
des angioplastie sur les artères
périphériques, de continuer à
réaliser ces gestes en « concurrence » avec
les radiologues.
Bien que tous ces spécialistes
souhaitent préserver leur avenir envers leurs «
concurrents », il est très souvent appelé
à une conjugaison des forces de chacun au travers d'une
approche multidisciplinaire où chacun apporte ses
connaissances spécifiques pour le bien des
patients.
Il apparaît, au terme de cet
état de l'art des techniques en cardio-vasculaire, que,
dès à présent, et en dépit des
pesanteurs administratives, d'importantes questions sont
posées aux différents protagonistes sur
l'évolution et les changements affectant :
- les spécialités
médicales en terme de
multidisciplinarité
- la composition des plateaux
techniques ( disparition de l'angiographie
diagnostique par rayons X, possibilité de services
dédiés à l'interventionnel)
- la formation des
médecins[43].
L'ingénieur biomédical fait
évidemment partie de ces protagonistes et il doit
connaître la problématique et les enjeux de cette
évolution.
Son rôle dans le choix des
matériels, dans la veille technologique et dans le
respect des normes et réglementations en vigueur
l'obligent à être attentif à toutes ces
questions.
Pour l'imagerie, son rôle reste celui
habituel de l'ingénieur biomédical pour les
dispositifs médicaux : choix le plus adéquat,
gestion de la maintenance, matériovigilance.
Pour le cathétérisme et le petit
matériel de chirurgie, il n'intervient pas
habituellement dans le choix mais il doit en connaître
les principes et les caractéristiques pour pouvoir
donner une première expertise technique aux
utilisateurs.
Pour les équipements tels que les
robots, son rôle reste mesuré. En effet, bien que
ces équipements et leur utilisation pour des
procédures novatrices soient souvent l'objet
d'informations retentissantes, ils restent rares en France et
sont surtout acquis et utilisés dans des situations
particulières. En effet, ceux actuellement
utilisés en France n'ont pas été
achetés mais sont mis à disposition des
hôpitaux dans le cadre de PHRC. Ainsi, il est du ressort
de l'ingénieur biomédical de surtout s'assurer
que la maintenance de ce type de matériel soit
entièrement l'objet de sous-traitance du fournisseur ou
d'un prestataire extérieur. En effet, la très
haute technologie utilisée dans ces appareils les rend
impossibles à être maintenus par le personnel
biomédical de la structure. En définitive, ces
équipements, de part leur coût, la durée
d'apprentissage et le nombre de leurs utilisateurs , ne doivent
concerner que très peu d'ingénieurs
biomédicaux dans le proche avenir.
L'orientation de toute l'organisation
hospitalière est désormais axée sur le
patient. Celui-ci, dans le cas d'un traitement pour une
sténose, demande à être guérit
définitivement, d'une manière indolore, sans
complication et dans un temps réduit. Pour cela, et en
fonction de sa maladie, l'hôpital moderne dispose
maintenant de différentes techniques qui continuent
à évoluer. L'ingénieur biomédical,
en s'assurant une connaissance raisonnable de ces techniques et
des implications pour son travail, participe pleinement au bien
être du patient.