|
Avertissement
|
| Si vous arrivez
directement sur cette
page, sachez que ce travail est un rapport d'étudiants et doit
être
pris comme tel. Il peut donc comporter des imperfections ou des
imprécisions
que le lecteur doit admettre et donc supporter. Il a été
réalisé pendant la période de formation et
constitue
avant-tout un travail de compilation bibliographique, d'initiation et
d'analyse
sur des thématiques associées aux technologies
biomédicales. Nous
ne faisons aucun usage commercial et la duplication est libre. Si vous
avez des raisons de contester ce droit d'usage, merci
de nous en faire part . L'objectif de la
présentation
sur le Web est de permettre l'accès à l'information et
d'augmenter
ainsi les échanges professionnels. En cas d'usage du document,
n'oubliez
pas de le citer comme source bibliographique. Bonne lecture... |
REMERCIEMENTS
Nous tenons à remercier
les personnes suivantes pour leur aide tout au long de notre projet :
Monsieur G. CHEVALLIER,
responsable de
la formation Master Management des Technologies en Santé
à l'U.T.C de Compiègne,
Monsieur F. LANGEVIN, directeur
du CIMA (Centre d'Imagerie Médicale Avancée) de
Compiègne.,
|
RESUME
Le
progrès scientifique a
permis un développement important des techniques
médicales. Celui-ci s'est traduit dans le domaine de l'imagerie
par son évolution jusqu'au niveau de l'interventionnel.
Echographie, angiographie, scanner et IRM permettent de réaliser
des examens interventionnels mini-invasifs et remplacent la chirurgie
"lourde". L'IRM interventionnelle, quant à elle, est une
technique prometteuse du fait de l'utilisation de l'IRM comme moyen de
contrôle en quasi temps réel voire temps réel.
ce projet a pour but de présenter l'IRM interventionnelle du
point de vue de son implantation au sein de l'hôpital, des
contraintes qui l'entourent, du choix du type d'IRM ainsi que de ses
perspectives.
Mots clés : IRM interventionnelle,
imagerie, installation.
|
|
ABSTRACT
The
scientific progress allowed
an important development of the medical techniques. These resulted in
the domain of the imagery in its evolution until the level of the
interventional. Scan, angiography, scanner and MRI permit to achieve
some mini-invasive interventional exams and take the place of the
"heavy"
surgery. The interventional MRI is a promising technique because of the
use of MRI to control the operation in almost real time or even in real
time.
This project has for goal to present the interventional MRI of the
point of view of its implantation within the hospital, of the
constraints that suround it, of the choice of the type of MRI as well
as its perspectives.
Key words : interventional MRI, imagery,
installation.
|
SOMMAIRE
Introduction
A.
Présentation et intérêt de l’imagerie
interventionnelle.
I. Les différents
types d’imagerie médicale.
1.
L’angiographie.
2.
L’échographie - doppler.
3. Le scanner.
II. Intérêt
de l’imagerie interventionnelle.
III. Imagerie
interventionnelle et chirurgie.
B.
L’imagerie par résonance magnétique ou IRM.
I. Le fonctionnement de
base de l’IRM.
1. Rappel de physique.
2. Composition
d’un IRM.
2.1.
L'aimant.
2.2
Les bobines
de
gradient.
2.3
Les antennes.
2.4
Les autres
organes de
l’appareil.
3. L’examen en
lui-même.
II.
Propriétés physiques de l’IRM.
III.
Création de
l’image à partir des mesures RMN.
IV.
Différents
modes d’utilisation de l’IRM.
1. L'IRM
anatomique.
2. L'IRM
fonctionnelle.
3. L'IRM
de diffusion.
V.
Avantages et
inconvénients.
1. Avantages.
2.
Inconvénients.
C.
IRM interventionnelle.
I.
Principe.
II. Avantages et
inconvénients.
1.
Les
avantages.
2. Les
inconvénients.
III. Installation d’une
IRM interventionnelle.
1. Choix du type d’IRM.
1.1. IRM à aimant
ouvert ou à bas
champ.
a.
Qualité des
images.
b.
Quelques exemples
d’applications.
1.2.
IRM à aimant
fermé ou à haut champ.
a.
Qualité des
images.
b.
Quelques exemples
d’applications.
2.
Sûreté et
compatibilité IRM.
2.1.
La salle : la
cage de
Faraday.
2.2. Les instruments.
3.
Contraintes liées à
l’IRM interventionnelle.
3.1. Contraintes
d’implantation.
3.2. Contraintes
financières.
3.3. Contraintes
réglementaires et
normatives.
IV. Cas pratique :
ablathermie de tumeur sous
contrôle IRM.
1.
Généralités.
2. IRM
couplé aux ultrasons
focalisés.
2.1.
Méthode.
2.2.
Résultats.
D.
Perspectives.
E.
Conclusion.
Bibliographie
INTRODUCTION
Aujourd’hui
l’imagerie n’est plus un
simple moyen de
voir l’intérieur du corps, elle permet de le réparer.
L’imagerie interventionnelle
regroupe l’ensemble des actes médicaux invasifs, à
visée diagnostique ou
thérapeutique, réalisés sous guidage radiologique,
échographique ou IRM. Les
actes effectués grâce aux méthodes de guidage
offrent des possibilités
immenses : d'un guidage banal de ponction sous échographe,
à un traitement
in situ d'une sténose d'une artère coronaire, le choix de
l’imagerie et du
matériel adapté dépendent du type d’acte à
effectuer.
Le nombre d’actes réalisés
sous imagerie
interventionnelle ne cesse d’augmenter : 80% d’angioplasties
coronaires se
font avec la pose de stents sous contrôle radiologique. Ce type
d’intervention
possède l’avantage d’être mini-invasif, donc moins
dangereux et gênant pour le
patient.
Une technique prometteuse est
l’IRM
interventionnelle, qui permet d’effectuer différentes
interventions sous
contrôle IRM (Imagerie par Résonance Magnétique).
Elle possède en effet des
avantages qui en font une technique très intéressante (un
excellent pouvoir de
contraste tissulaire, le monitorage de la température, une
sensibilité aux
liquides et aux flux).
Dans une première partie
nous
ferons le point sur les
différentes techniques d’imagerie interventionnelle. Dans un
deuxième temps
nous verrons les principes de bases de l’IRM, puis nous
développerons ses
aspects interventionnels (type d’IRM à utiliser, localisation de
la salle
d’intervention, hygiène, matériel compatible).
A. Présentation et
intérêt de l’imagerie interventionnelle.
Depuis la dernière décennie,
l’imagerie a pris une
part incontournable dans le monde médico-chirurgical.
Aujourd’hui, l’imagerie
interventionnelle est capable directement de soigner. Le radiologue
accompagne
le malade jusqu’au traitement et même jusqu’à la
guérison. Cette avancée de
l’interventionnelle ne vient pas d’un seul type d’imageur mais de la
majorité
d’entre eux.
I. Les différents
types d’imagerie
médicale.
Dans cette partie nous allons effectuer un
descriptif
rapide des différentes techniques d’imagerie utilisées en
interventionnel [1].
1.
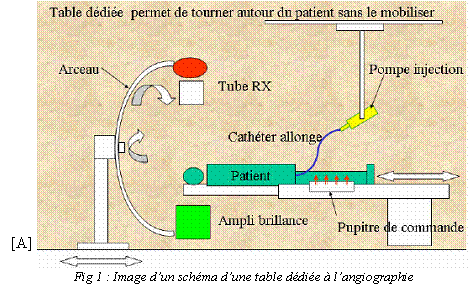
L’angiographie.
L’angiographie permet la
visualisation des
vaisseaux sanguins (artères
et veines) après injection de produit de contraste. Le patient
est couché sur
une table radio transparente qui peut se déplacer
horizontalement [2].
L’ensemble tube RX et
Ampli de brillance
(permettant des images
dynamiques) est solidarisé sur un arceau qui peut aussi se
déplacer dans tous
les sens. De ce fait, le patient peut être examiné sous
tous les angles sans
être bougé (facilité et sécurité).
Elle est utilisée
pour toutes les
interventions
vasculaires (périphérique, coronaire, neurologique,…).
80% d’angioplastie
s’effectue désormais grâce à ce système et
non plus en chirurgie classique.
Aujourd’hui cela représente en France près de 72000
interventions.
2.
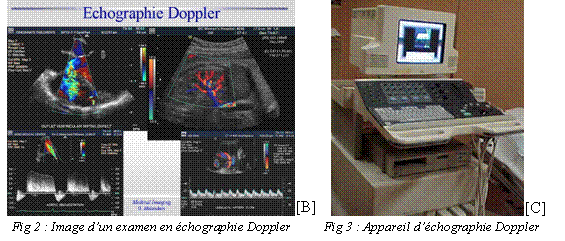
L’échographie -
doppler.
L’échographie
est une technique d’exploration basée sur les ultrasons. Une
sonde envoie un
faisceau d’ultrasons dans la zone du corps à explorer. Selon la
nature des
tissus, ces ondes sonores sont réfléchies avec plus ou
moins de puissance. Le
traitement de ces échos permet une visualisation des organes
observés.
Elle est employée pour les biopsies
et ponctions
percutanées, examens fréquents et relativement banals en
imagerie
interventionnelle.
En mode doppler
l’échographe permet
de quantifier
approximativement les vitesses et le sens des flux, l'intensité
de la couleur
étant proportionnelle à la vitesse d'écoulement.
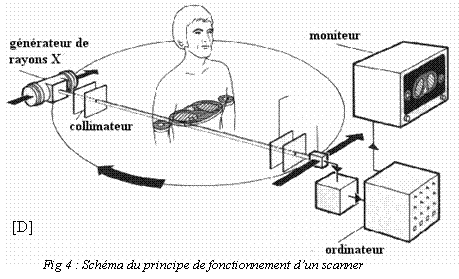
3. Le
scanner.
Le scanner appelé aussi
tomodensitométrie est un
examen qui utilise les rayons X. Son principe consiste à
réaliser des images en
coupes fines. En tournant autour du patient, le couple tube à
rayons X -
détecteurs permet d’obtenir une succession de projection de
l’absorption du
patient selon différents angles, qui permet de reconstruire une
image en coupe.
Le déplacement horizontal du
patient permet d’obtenir
autant de coupes que nécessaire au diagnostic. Le scanner
hélicoïdal permet de
reconstruire une image en 3 dimensions à l'aide de 60 à
80 coupes de 1 mm
d'épaisseur [3].
Un
scanner comprend une table, une gantry et une console de commande
située dans
une autre pièce. La gantry comprend un tunnel, autour duquel
sont embarqués et
tournent :
-
le tube à rayons X et générateur
-
les récepteurs
-
l’électronique
On utilise le scanner pour les biopsies,
le drainage
d’abcès ou le traitement de tumeur par radio fréquence.
4.
L’IRM.
Le principe de fonctionnement
de l’IRM
sera développé
dans le chapitre suivant [4].
II. Intérêt
de l’imagerie
interventionnelle.
L’imagerie
présente trois intérêts principaux. En effet, elle
constitue :
Ø
un progrès
pour le malade :
les procédures sont plus simples, plus
rapides : plusieurs heures d’intervention peuvent être
replacées par un
acte interventionnel d’une demi heure. Elles sont aussi moins
gênantes pour le
malade : l’hospitalisation est réduite à 1 ou 2
jours et moins risquées.
Ø
un progrès
thérapeutique
: la technique prépare, complète ou remplace l’acte
opératoire. Elle propose de nouveaux traitements inaccessibles
à la chirurgie
(ponction de sang fœtal, prélèvement d’ovocytes,…).
Ø
un progrès
pour l’hôpital
: la prise en charge est plus légère. En effet une
équipe
de chirurgie cardiaque classique comprendra de 7 à 10 personnes,
alors que pour
la même intervention l’équipe d’imagerie interventionnelle
comptera de 2 à 3
personnes. Par conséquent les coûts seront moins
élevés. Une chirurgie
cardiaque classique coûtera de 20 à 35 K€, le geste
interventionnel coûtera
quant à lui de 5 à 10 K€ [5]
[6].
Le tableau ci-dessous compare les trois
principales
techniques opératoires (chirurgie, coelioscopie,
interventionnel) [6]. Il montre les
avantages de
l’interventionnel pour le malade et l’hôpital.
|
|
Invasif
|
Mini-Invasif
|
Interventionnel
|
|
Anesthésie
|
Générale
|
Générale/locale
|
locale
|
|
Abord
|
Incision chirurgicale profonde
|
Laparo/coelio
scopie
|
Percutané ou
endoscopique
|
|
Perte sanguine
|
Importante
|
faible
|
minime
|
|
Stérilité
salle d’intervention
|
+++
|
++
|
+
|
|
Equipe
|
+++
|
++
|
+
|
|
Séjour en Réa
|
OUI
|
OUI/NON
|
NON
|
|
Hospitalisation
|
Plusieurs jours
|
48h
|
24h
|
|
Convalescence
|
Plusieurs semaines-mois
|
Quelques jours/sem
|
Quelques
jours
|
|
Risque opératoire
|
Significatif
|
Faible
|
Très
Faible
|
|
Coût de
santé
|
++++
|
+++
|
++
|
III. Imagerie
interventionnelle et
chirurgie.
L’imagerie d’intervention prépare,
complète ou
remplace la chirurgie [1]. Ces deux
disciplines semblent donc fonctionner en synergie pour le traitement du
patient
afin d’aboutir à la guérison de celui-ci. En effet, elles
présentent deux
intérêts différents :
- Le chirurgien voit directement le champ
opératoire par incision large et protège les organes
fragiles.
- L’interventionniste, surveille le trajet
par imagerie 2D (rayons X ou ultrasons) avec un point de ponction
réduit.
L’intérêt d’utiliser
l’imagerie interventionnelle par
rapport à la chirurgie est fonction de plusieurs
critères :
- les lésions sont plus
localisées
- plus de précision dans l’acte
opératoire
- moins de gène pour le patient
(perte de sang minime, pas de séjour en réanimation,
convalescence de courte durée)
- coût d’hospitalisation plus faible
L’imagerie interventionnelle
regroupe un
éventail de
techniques très diversifiées c’est pourquoi nous allons
présenter une technique
en particulier, l’IRM interventionnelle qui est une technique
très prometteuse.
B. L’imagerie par
résonance magnétique ou IRM.
I. Le fonctionnement de
base de
l’IRM.
1.
Rappel de
physique.
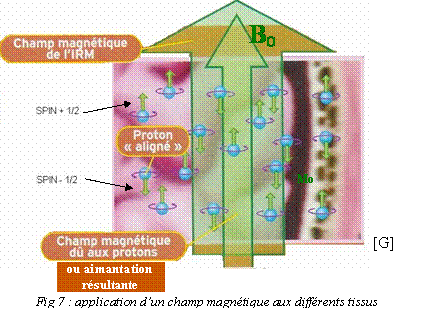
Un atome se compose
d'un
noyau et d'électrons qui gravitent
autour de celui-ci. Le noyau est constitué de nucléons
(neutrons et protons).
Le noyau
d'hydrogène
est constitué d’un proton chargé positivement.
Il est animé d’un mouvement, autour d’un axe de rotation,
appelé SPIN. Hors
d’un champ magnétique ce spin peut prendre n’importe quelle
orientation.
Dans un champ
magnétique B0 ce
mouvement de rotation peut prendre 2 orientations différentes :
"Spin +
1/2" et "Spin - 1/2". Les aimantations nucléaires correspondant
aux "spins + 1/2" s'orientent dans le sens du champ magnétique B0,
celles de "spin - 1/2" s'orientent dans le sens inverse de B0. Cette
propriété
de spin lui confère d'une part un moment cinétique, qui
dépend de sa masse m,
et d'autre part un moment magnétique qui dépend de sa
charge e+.
Il résulte
de tout
cela que la somme de
toutes les aimantations élémentaires pour une certaine
quantité d'hydrogène
présente dans un échantillon est non nulle, et
dirigée dans l'axe du champ
magnétique Bo. Cette somme d’aimantation est
appelée aimantation
résultante. Elle est bien sûr proportionnelle au nombre de
noyaux d'hydrogène
présents dans les tissus [7] [8] [9].
2.
Composition
d’un IRM.
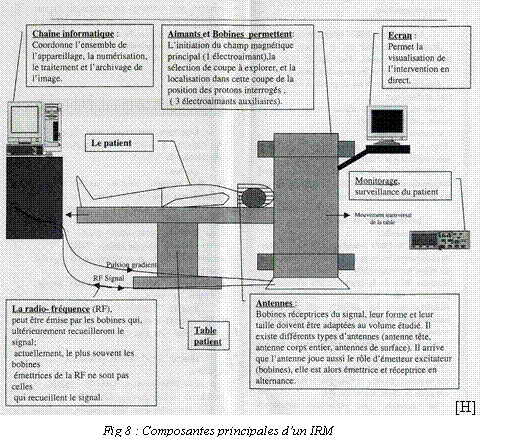
Un système IRM
comprend quatre
composantes principales :
2.1. L'aimant.
Il
s’agit de l’élément de base de l’appareil. Il produit le
champ B0
qui doit être intense et homogène. L’intensité de B0
est un des
éléments conditionnant la qualité de
l’image : le rapport signal sur bruit
augmente en même temps que lui.
L’homogénéité du champ est assurée par des
bobines additionnelles de correction appelées bobines de shim.
Les
aimants peuvent être classés selon l’intensité de
leur champ :
-
les
bas champs de 0,02T à 0,25T
-
les
champs moyens de 0,25T à 1T
-
les
hauts champs au-delà de 1T
Il
existe trois types d’aimant :
·
les aimants
résistifs
Ce
sont des électro-aimants constitués d’un enroulement de
fil de cuivre. Forts
consommateurs de courant électrique, ils nécessitent un
système de
refroidissement. Les champs obtenus avec ce type d’aimant sont de
faible
intensité (0,3T).
·
les aimants
permanents
Ils
sont constitués d’un bloc aimanté, ils ne consomment donc
aucun courant électrique
et ne nécessitent aucun refroidissement. Cependant, ils
présentent un poids
élevé pour un champ magnétique relativement faible.
·
les aimants
supraconducteurs
Ce
sont les plus répandus. Ils utilisent le phénomène
de supraconduction. Un tel
aimant est constitué d’une bobine supraconductrice et d’un
cryostat contenant
de l’hélium liquide à –269°C permettant de maintenir
la bobine à l’état
supraconducteur. Ces aimants permettent l’obtention de champs
élevés sans
pratiquement consommer de courant électrique.
Retour
sommaire
2.2 Les bobines de
gradient.
Les
bobines de gradient produisent des
champs magnétiques qui s’additionnent et se retranchent à
B0 et sont
alors responsables d’une variation graduelle de champ magnétique
dans l’espace.
Elles permettent ainsi le codage spatial de l’image.
Il
faut deux bobines pour produire un gradient de champ magnétique.
Ainsi,
l’appareil possède trois paires de bobines, une pour chaque
orientation dans
l’espace.
Ces
bobines sont alimentées à une cadence plus ou moins
rapide selon le type de
séquence. Chaque impulsion électrique dans les bobines
est à l’origine d’une
vibration produisant le bruit caractéristique de fonctionnement
de l’appareil.
Retour
sommaire
2.3 Les antennes.
Les
antennes jouent un rôle très important dans la
chaîne d’acquisition car elles
permettent l’émission des impulsions radiofréquences et
la réception du signal.
On
distingue deux types d’antennes :
·
les antennes
de volume
Elles
sont émettrices et réceptrices du signal RMN. Elles
peuvent contenir une région
de l’organisme (antenne tête, genou,…) voire tout le corps
(antenne corps). Les
antennes de volume permettent d’obtenir un signal homogène sur
tout le volume
exploré.
·
les antennes
de surface
Elles
sont uniquement réceptrices (l’antenne corps étant
émettrice) et sont
appliquées le plus prés possible des régions
explorées. Les antennes de surface
favorisent un rapport signal sur bruit élevé.
Retour
sommaire
2.4 Les autres organes
de l’appareil.
-
un ordinateur et des processeurs rapides, permettant l’acquisition des
données
selon les paramètres établis par l’opérateur, la
reconstruction des images et
la gestion des organes périphériques.
-
une ou plusieurs consoles (contrôle, visualisation) constituant
le lien entre
l’opérateur et la machine
-
des armoires d’alimentation du système
-
un reprographe pour fixer les images sur un support photographique
-
un système d’archivage des données : bandes
magnétiques, disque optique
numérique.
Retour
sommaire
3.
L’examen en lui-même.
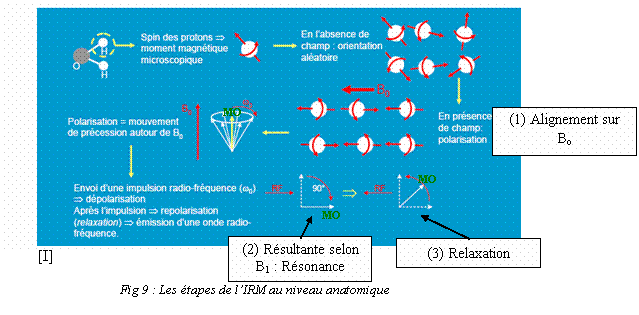
La création du
« signal
R.M.N. » se fait en deux temps :
Ø
Le corps examiné est
d’abord placé dans
un puissant champ magnétique Bo (de 5000 à 20000 gauss, 1 gauss = 10-4
Tesla) qui aligne les protons dans l’axe du champ (1).
Ø
Un deuxième champ
magnétique B1
oscillant à une fréquence de résonance (ondes
radiofréquence de fréquence fo
= 42,57 MHz dans un champ de 1 Tesla) perturbe l’équilibre et
déclenche un basculement des
axes de rotation des noyaux. Les noyaux d’hydrogène (ou protons)
vont être excités (2).
A l’arrêt du champ B1,
le système ainsi perturbé
revient à l’état initial, les protons H+ aimantés ont tendance à
reprendre leur orientation
initiale, tout en émettant à leur tour des ondes radio,
ou des signaux
électromagnétiques appelés
Free Induction Decay (F.I.D). Donc le système
réémet un signal
(restitution de l’énergie) pendant le temps du retour à
l’équilibre (temps de
relaxation longitudinale et transversale) (3).
Des codages spatiaux utilisant des
gradients de champ
magnétique permettent de mesurer les signaux ou les ondes
émis au cours de ce
phénomène de relaxation point par point et de
reconstruire l’image d’une coupe.
C’est une antenne qui capte, analyse et
reconstruit
par un système informatique, en fonction des informations
renvoyées par
l’organisme, ceci va composer une image numérique haute
définition.
II.
Propriétés physiques de l’IRM.
L’application d’un courant
sinusoïdal à
la fréquence de résonance de l'hydrogène, dans une bobine d'axe
perpendiculaire, crée un champ magnétique alternatif.
Celui-ci perturbe cette aimantation résultante Mo.
Tout se passe comme
si Mo tournait autour d’un plan perpendiculaire à
celui-ci [6] [10].
L'angle de basculement est proportionnel
à la
quantité d'énergie électrique transmise à
la bobine d'excitation, c'est-à-dire
à la durée et à l'amplitude de cette excitation.
On peut parfaitement
déterminer un angle de basculement de 90° ou 180° en
adaptant ces deux
paramètres. Si la fréquence d'excitation n'est pas proche
ou égale à la
fréquence de résonance, le système ne modifiera
pas sa position d'équilibre.
En retournant à
l’équilibre, le système
de spin doit céder l’énergie absorbée durant
l’impulsion RF.
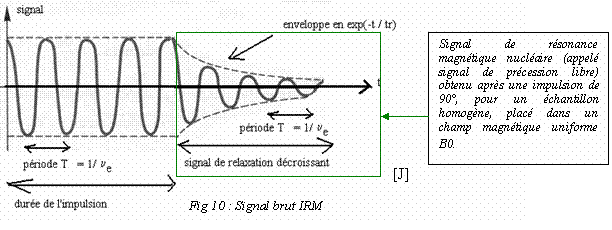
La relaxation
longitudinale dite
relaxation T1 ou encore relaxation
« spin-réseau »
correspond au retour à l'équilibre
énergétique du système. T1 sera
d'autant plus court que ces hydrogènes seront liés
à de grosses molécules, le
temps de relaxation T1 de l'eau pure pour l'hydrogène
est d'environ
3 secondes, celui de l'eau dans les tissus est de l'ordre de 0,5
seconde. Il se
définit par la durée au bout de laquelle l’aimantation
longitudinale a récupéré
63% de sa valeur initiale.
La relaxation transversale
dite
relaxation T2
représente la décroissance de la composante transversale.
Elle est en fait due
à la désynchronisation des aimantations
élémentaires dans leur mouvement autour
du champ magnétique B0,
désynchronisation qui est liée aux interactions entre les
aimantations
nucléaires de noyaux voisins. Ces interactions créent des
modifications locales
du champ magnétique, et sont responsables de ces
déphasages qui vont détruire la
composante transversale. La relaxation T2 est toujours
inférieure au
temps de relaxation T1. T2 dépend lui
aussi de la
mobilité des atomes ou des molécules sur lesquelles ces
atomes d'hydrogène sont
engagés. Ce temps est encore appelé temps de relaxation
« spin-spin ».
Le temps de relaxation T2 de
l'eau pure
est de 3 secondes, et dans les tissus il est de l'ordre de 50 ms. Il se définit par la durée
au bout de laquelle
l’amplitude du signal FID a diminuée de 63%.
Ces temps de relaxation vont varier pour
un tissu
donné selon l'organisation physico-chimique de l'eau dans ce
tissu, et c'est
sur ces variations qu'on s'appuiera pour détecter au sein d'un
tissu les
modifications liées à la présence d'une
lésion.
La
détermination des
« paramètres
tissulaires », pour chaque élément du tissu
étudié, est effectuée à partir
de séquences d’impulsion RF. Elles dépendent soit de la
durée, soit du temps de
répétition des impulsions, soit de l’angle de basculement
de l’aimantation.
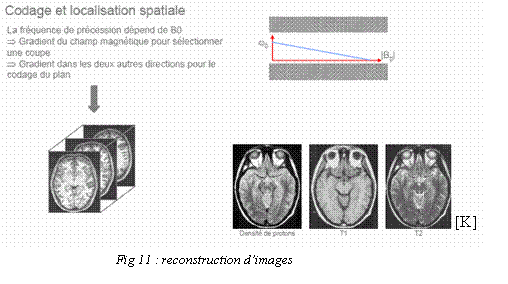
III.
Création de
l’image à partir
des mesures RMN.
Toute méthode d'imagerie
numérique consiste à
effectuer une mesure physique dans chaque élément de
volume de la coupe ou de
la région étudiée. La mesure est ensuite
numérisée et stockée dans une mémoire
informatique. Chaque nombre est ensuite représenté sur un
moniteur, sous forme
de point d'image ou pixel à l'aide d'une échelle de gris.
Les méthodes
d'imagerie ne diffèrent que par la nature de la mesure physique
effectuée. En
IRM, il s'agit de mesurer l'intensité du signal de
résonance dans chaque voxel.
Delà découle la terminologie utilisée pour
décrire une image : une région
"claire" représentant des nombres élevés sera dite
en hypersignal
alors qu'une région "sombre" de l'image sera dite en hyposignal.
La direction et l'intensité du
gradient permettent
respectivement de déterminer l'orientation et l'épaisseur
de la coupe ; la
fréquence de l'impulsion permet de choisir le niveau de coupe. A
la fin de
l'impulsion de 90°, seule la coupe sélectionnée est
entrée en résonance et les
aimantations de ses différents éléments de volume
sont basculées dans le plan
de mesure [11] [12].
IV.
Différents
modes d’utilisation
de l’IRM.
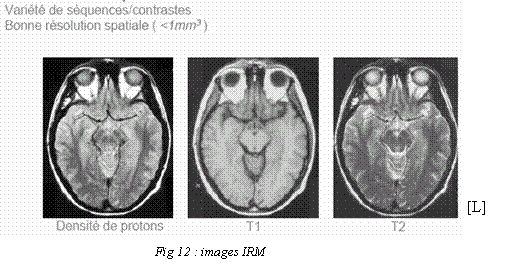
1.
L'IRM
anatomique.
En médecine, on applique
souvent la
RMN aux noyaux
d'hydrogène, élément présent en abondance
dans l'eau et les graisses des tissus
biologiques. C'est la structure anatomique que l'on visualise ainsi, et
on
parle alors d'IRM anatomique.
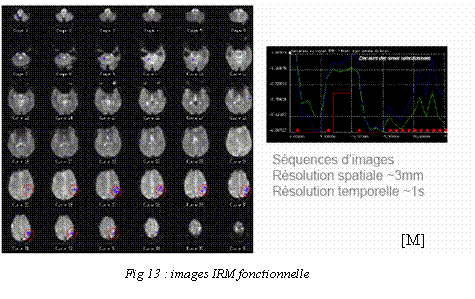
2.
L'IRM
fonctionnelle.
Avec le développement de
techniques
ultra rapides
d'acquisition et de traitement de données, il est devenu
possible de réaliser
des images RMN en des temps suffisamment brefs pour suivre certains
aspects du
métabolisme. On parle alors d'IRM fonctionnelle.
En imagerie cérébrale, on
applique la résonance
magnétique à l'hémoglobine dont les
propriétés magnétiques différent
légèrement
selon que cette molécule est liée ou non à
l'oxygène. On accède donc à
l'activité cérébrale en réalisant des
images où est visualisé le contraste
entre les régions riches en oxyhémoglobine et les
régions du flux sanguin.
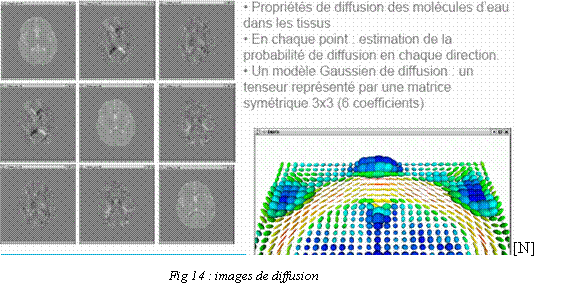
3.
L'IRM de
diffusion.
L'IRM de diffusion donne sous
forme
tensorielle une
information sur la directionalité des fibres nerveuses. Cette
information est
liée au tenseur des conductivités électriques et
devrait donc pouvoir être
utilisée pour affiner la modélisation de ces
conductivités utilisée dans les
algorithmes de reconstruction MEG + EEG.
V.
Avantages et
inconvénients.
1.
Avantages.
L’IRM présente trois
avantages
principaux [7] [13]:
- Sur le plan anatomique, c'est
la
méthode d'imagerie
qui, dans la plupart des cas, donne les informations les plus riches.
La
résolution spatiale habituelle est de l'ordre du
millimètre, c'est-à-dire du
même ordre que celle du TDM (tomodensitométrie), mais
l'IRM permet d'acquérir
des coupes dans toutes les directions de l'espace. Elle permet de plus
de
réaliser des acquisitions tridimensionnelles qui peuvent
être reconstruites à
posteriori selon n'importe qu'elle incidence de coupes. Seul le mode
spiralé a
permis à la TDM de rivaliser avec l'IRM dans ce domaine, dans la
mesure où
l'acquisition spiralée d'un volume permet aussi la
reconstruction de coupes
dans plusieurs orientations.
- Le nombre important de
paramètres
mesurés par l'IRM
est aussi un avantage dans la mesure où une même
pathologie peut être vue dans
plusieurs contrastes permettant une meilleure caractérisation.
C'est ainsi
qu'au niveau du cerveau, aucune autre méthode ne permet de mieux
distinguer la
substance grise et la substance blanche du cerveau qui sont pourtant
très
proches.
- La non agressivité de
la
méthode est aussi un
avantage important, puisque aucun rayonnement ionisant n'est
utilisé. De plus
l'utilisation des champs magnétiques intenses ou des ondes
radiofréquences ne
présente aucun effet sur les patients.
Remarque : C’est un examen totalement indolore mais
un peu
long et désagréable à cause du bruit
répétitif à l’intérieur de l’appareil.
2.
Inconvénients.
Les
principaux inconvénients sont de trois ordres :
D'une part, la durée
typique
d'acquisition en IRM est
de l'ordre de quelques minutes. Cependant, plusieurs coupes peuvent
être
acquises pendant ce temps. Par ailleurs, des séquences de plus
en plus rapides
permettent actuellement de raccourcir les temps d'examens. Toutefois,
la durée
d'un examen IRM est toujours plus importante que la durée d'un
examen en TDM.
D'autre part, en raison de la
haute
technicité du
matériel, et du nombre plus faible de patients examinés,
le prix d'un examen
IRM est environ deux fois plus élevé que celui d'un
examen TDM. De plus,
l'installation représente encore un investissement qui peut
être très
important. Donc les contraintes sont surtout financières,
à environ 3 millions
d'euros avec un prix de revient de 450 €
par examen).
Enfin l’IRM possédant un
champ
magnétique intense,
peut perturber les appareils électroniques et les enregistreurs
magnétiques. Il
s’agit alors d’utiliser du matériel compatible IRM.
Ces avantages et inconvénients font
au total que
l'IRM donne dans la plupart des cas des images de meilleure
qualité et
contenant plus d'informations anatomiques que les autres
méthodes d'imagerie
médicale, au moins dans l'étude des organes fixes tels
que le cerveau ou les
membres. Par contre cet avantage n'est pas toujours aussi
évident lorsque, en
raison de la durée d'acquisition, les mouvements respiratoires
gênent
considérablement l'interprétation des images au niveau de
l'abdomen et du
thorax. Par ailleurs, même lorsque la qualité est
supérieure, le rapport coût-efficacité
de l'IRM n'est pas toujours le meilleur dans un diagnostic
donné. L'IRM est
devenue une méthode complémentaire indispensable dans
certaines indications
comme l'étude de la moelle épinière.
C. IRM interventionnelle.
I.
Principe.
L’IRM
interventionnelle est une technique nouvelle dont le
développement reste
modeste mais dont l’avenir est certain. Les avantages sont
incontestables : c’est une technique non ionisante. Elle
possède une
résolution millimétrique, un excellent pouvoir contraste
tissulaire. De plus
l’IRM permet d’effectuer des acquisitions multi-plans en temps
quasi-réel, de
monitorer la température [4].
L’acte
interventionnel peut se réaliser de deux manières
différentes et dépend du type
d’IRM utilisé [19]. Mais dans
les
deux cas l’antenne se placera toujours autour du champ
opératoire pour obtenir
une image optimale de la zone à traiter.
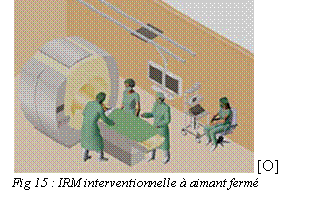
Si l’aimant est fermé
les gestes
chirurgicaux sont
effectués en dehors de l’aimant, l’IRM permet alors des
contrôles successifs.
On utilise se système lors de biopsies ou de traitements par
ultrasons
focalisés.
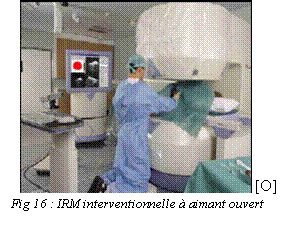
Si l’on utilise un
aimant ouvert
(horizontalement ou
verticalement) l'intervention chirurgicale se déroule
intégralement dans l’IRM.
Les images de résonance magnétique sont diffusées
par des moniteurs installés
sur les côtés de la table d'opération. Elles sont
obtenues toutes les cinq
secondes en moyenne et guident les cliniciens tout au long de
l'intervention
chirurgicale.
L’IRM
interventionnelle permet d’utiliser des techniques percutanées.
Elles
permettent d’éviter des chirurgies ouvertes qui
nécessitent plusieurs heures
d'intervention et qui demandent au patient plusieurs semaines pour
récupérer.
Ce sont donc des techniques moins traumatisantes pour le patient qui
voit son
temps d’hospitalisation diminuer fortement.
II.
Avantages et inconvénients.
[15]
1. Les avantages.
- intervention directe sur le patient tout
en bénéficiant en continu d’une image IRM pour surveiller
et contrôler les gestes chirurgicaux
- imagerie tridimensionnelle
- technique non ionisante
- qualité de la résolution en
signal
- anesthésie locale
- prise en charge plus légère
(temps de séjour réduit, coût moins
élevé)
- technique moins invasive (point de
ponction de 1 à 3 mm de diamètre)
2.
Les
inconvénients.
- Sont ceux de l’IRM conventionnelle :
les personnes portant des pace-maker, des corps étranger dans
l’organisme, des objets ferromagnétiques, ainsi que les femmes
enceintes (inférieur à trois mois) ne peuvent passer
l’examen.
- Difficulté pour les personnes
claustrophobes.
- Achat d’instrumentation amagnétique
et repérable sous imagerie
- Autres contraintes : l’appareil doit
être installé dans une salle d’intervention
dédiée :
- parce que l’aménagement doit
permettre que des interventionnistes (chirurgien et/ou radiologistes et
anesthésistes) puissent y effectuer des procédures allant
de la simple biopsie à la chirurgie du cerveau
- parce que les procédures se font
dans le champ de l’appareil
- parce que les instruments et appareils
servant aux procédures doivent tous être compatibles
à l’IRM
Retour
sommaire
III. Installation d’une
IRM
interventionnelle.
1.
Choix du type
d’IRM.
Pour une utilisation optimale en
interventionnel, les
spécifications suivantes sont indispensables :
- un accès direct et confortable au
patient
- une gamme étendue d’antennes de
surface génériques et dédiées
- une table mobile
- gamme d’outils de stabilisation
- acquisition multi-plan, en temps
quasi-réel, voire en temps réel
- système de
stéréotaxie virtuelle (méthode de repérage
en trois dimensions, de haute précision, principalement
utilisé en neurologie et pour les tumeurs
cérébrales)
- écrans rétro-diffuseurs
adajcents
En ce qui concerne le choix
proprement dit
du type
d’IRM à utiliser, soit IRM à bas champ soit IRM à
haut champ, cela va dépendre
de l’utilisation de la salle d’IRM interventionnelle [16].
Retour
sommaire
1.1.
IRM à aimant
ouvert ou à bas champ.
Les IRM à bas champ
magnétique (< 0,5
T) représentent aujourd'hui 18 % des appareils d'IRM
installés dans le monde.
Il en existe deux grands types : les appareils d'IRM dits
« dédiés »
car développés pour le diagnostic par IRM dans certaines
localisations
anatomiques précises, notamment ostéo-articulaires, et
des systèmes comportant
un aimant ouvert permettant la réalisation d'une gamme
étendue d'actes
diagnostiques.
Du fait de la
taille ou de
la structure
de l'aimant, ces IRM bas champ présentent des avantages
théoriques pour les
patients : l'accès à l'IRM est notamment plus aisé
pour les sujets
claustrophobes, anxieux, obèses. La configuration ouverte des
aimants facilite également
la réalisation d'actes chirurgicaux contrôlés par
imagerie.
Ces IRM bas champ
présentent, pour les
structures de soins, un avantage économique supposé du
fait des coûts
d'investissement, d'installation et de maintenance réduits par
rapport aux IRM
à champ magnétique élevé.
Les IRM de bas
champ
magnétique (moins de
1 Tesla) sont les moins coûteux à l'installation et
à l'usage, permettent la
réalisation de machines plus ouvertes, comme les IRM à
aimant permanent,
évitant pour une large part l'impression de confinement qui est
une gêne pour
un certain nombre de patients. La durée des examens est
cependant plus longue
et elles ne permettent pas l’utilisation des techniques d'exploration
les plus
avancées.
Retour
sommaire
a.
Qualité des
images.
Les différences, avec
l’IRM à haut champ,
dans la qualité de l’image n’apparaissent pas majeures au centre
du champ, mais
sont évidentes en périphérie. A ce niveau, la
résolution spatiale, la
sensibilité et l’uniformité des images se
dégradent. L’image est déformée là
où
se trouve le point d’entrée du matériel de ponction. De
même, le volume exploré
est moindre en aimant ouvert qu’en aimant fermé, car les
premières et dernières
coupes sont d’une qualité inconstante.
Retour
sommaire
b.
Quelques
exemples d’applications.
Ø
IRM interventionnelle en
neurochirurgie.
Le geste est
réalisé dans l’aimant
lui-même : biopsies en conditions
stéréotaxiques, évacuation d’un kyste,
instillations médicamenteuses. Un geste chirurgical peut
également être
effectué hors aimant, le patient étant
transféré de manière itérative dans
l’IRM pour vérification de la qualité de
l’exérèse tumorale.
La technique est
différente selon le type
d’aimant utilisé : si le geste est effectué
directement entre les aimants,
il est nécessaire de disposer d’un appareil d’IRM à
ouverture verticale
(exemple : General Electric Signa SPD 0,5 T) et également
d’une
instrumentation chirurgicale amagnétique. Si le geste est
effectué hors de
l’aimant, en bout de table ou dans une salle d’intervention annexe avec
des
contrôles itératifs, l’acte peut être
réalisé à l’aide de l’appareil précedent,
mais également à l’aide d’appareils dont l’entrefer est
horizontal
(exemple : magnetom Open Siemens 0,2 T, Hitachi Airis 0,3 T,
Picker).
Ø
IMR interventionnelle en chirurgie
générale.
Elle peut être
utilisée en cours de
chirurgie sous endoscopie et pour des biopsies dont le risque est tel
qu’un
passage en chirurgie conventionnelle doit être prévu.
L’avantage est que le
chirurgien a en permanence une exacte connaissance des structures et de
la
lésion.
Retour
sommaire
1.2.
IRM à aimant fermé ou à haut champ.
Les IRM de haut champ (au dessus de 1
Tesla), sont
plus coûteuses, nécessitent un refroidissement permanent
à l'hélium, mais
fournissent plus de précisions sur les explorations standards et
permettent
seules les imageries évoluées.
a.
Qualité des
images.
L’imagerie est de haute
qualité :
champs de 1 ou 1,5 T, antennes dédiées en réseau
phasé adjacente à la structure
étudiée.
En quelques minutes ou
secondes, les
images arrivent et peuvent être
agrandies, superposées, tout en demeurant de qualité.
Le champ est homogène.
Retour
sommaire
b.
Quelques
exemples d’applications.
Une autre perspective de
l’IRM
interventionnelle tend à développer les actes
effectués sous aimant fermé,
cylindrique, à haut champ, l’appareil étant
utilisé à la manière d’un scanner.
Les gestes sont effectués en dehors de l’aimant ainsi
réservés à des contrôles
successifs : biopsies de l’encéphale, du rachis, traitement
par ultrasons
focalisés des tumeurs du foie, du sein.
Cette voie d’avenir est
réelle, car les
gestes bénéficient d’une qualité d’image optimale.
Elle comporte toutefois des
difficultés particulières : élargissement et
raccourcissement de l’aimant,
jeu d’aiguilles de longueurs différentes, mise au point de
supports
d’instruments peu encombrant…
Un autre avantage, majeur,
tient dans
l’utilisation mixte de l’appareil : examens diagnostiques et
examens
interventionnels.
2.
Sûreté et
compatibilité IRM.
Retour
sommaire
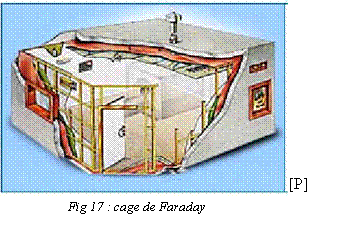
2.1. La
salle : la cage de Faraday.
Il s'agit de réaliser
une enceinte
métallique (donc conductrice de courant) qui permet d'isoler
l'intérieur de la
salle (et donc toute l'instrumentation) des perturbations
électriques
extérieures, en particulier les ondes de radiofréquence
qui viendraient
perturber les mesures réalisées dans la salle IRM,
lesquelles utilisent pour
leur part des mesures radio-fréquences particulièrement
précises.
Une idée fausse et
malgré tout largement
répandue consiste à croire que la cage de Faraday,
particulièrement dans le
cadre de l'environnement IRM, permet de protéger
l'extérieur de la salle du
haut champ magnétique issu de la machine IRM. Il n'en est rien !
La cage de
Faraday ne permet de s'isoler uniquement des radiofréquences,
à condition
qu'elle soit « suffisamment hermétique ».
Retour
sommaire
2.2.
Les
instruments.
Un instrument est sur pour
l’IRM lorsqu’il
ne
présente pas de risque additionnel pour le patient, pour
l’opérateur, quand il
est présent dans l’environnement de résonance
magnétique (à l’intérieur de la
ligne des 5 Gauss) [13].
Il y a quatre niveaux de
compatibilité
IRM :
v
Instrument
de zone 4 fonctionne :
-
normalement dans la salle
-
pendant l’intervention et
l’acquisition
d’images
-
mais seulement lorsque
gardé au-delà d’un
mètre de l’isocentre ou en dehors de la ligne de 200 gauss
v
Instrument
de zone 3 fonctionne :
-
normalement
dans la salle
-
durant l’intervention
-
mais pas pendant
l’acquisition parce
qu’il l’empêche
-
ex : chignole,
aspirateur US
v
Instrument
de zone 2 fonctionne :
-
normalement
dans le champ imagé
-
pendant l’intervention et
l’acquisition
des images
-
mais génère
des artefacts significatifs
-
ex : aiguilles,
scalpels, vis,…
v
Instrument
de zone 1 fonctionne :
-
normalement
dans le champ imagé
-
pendant
l’intervention et l’acquisition
des images
-
il
ne génère pas d’artefacts
significatifs lorsque
directement présent dans le champ imagé
-
ex :
canules de plastique,
dilatateurs, sondes
de cryothérapie, fibres optiques, thermosenseur optiques,…
Il existe des instruments
amagnétiques dont certains
sont repérables. Toutefois, les aiguilles amagnétiques ne
sont repérées que par
le vide de signal de leur paroi et les parties métalliques sont
repérées par
des artefacts sur l’image. Il est donc difficile de repérer avec
précision
l’extrémité de l’aiguille.
Retour
sommaire
3.
Contraintes
liées à l’IRM interventionnelle.
3.1.
Contraintes
d’implantation.
Les contraintes vont être
définies par l’utilisation
que l’on va faire de l’IRM interventionnelle.
Deux utilisations sont envisageables, soit
en bloc
opératoire soit dans le département d’imagerie.
Toutefois, certaines
contraintes d’asepsie doivent être prises en compte lors de
l’installation de
l’IRM interventionnelle.
Ø
En bloc opératoire.
L’IRM peut être installée
dans des locaux existants.
Cependant, il est préférable de concevoir de nouveaux
locaux qui permettraient
d’envisager la question du mode d’intervention : à
l’intérieur de l’aimant
ou à l’extérieur de l’aimant avec plusieurs
contrôles pendant l’acte
chirurgical.
Ø
Dans le département d’imagerie.
Il faut envisager un espace plus grand
pour la salle
d’IRM pour y intégrer du matériel comme une console de
lecture, des espaces
pour le matériel stérile, le matériel
d’anesthésie… Cette salle doit respecter
des normes d’asepsie. Une autre nécessité est de prendre
en compte le type de
geste qui va être réalisé. En effet, en cas
d’accident, un transfert vers le
bloc opératoire doit être le plus rapide possible.
Retour
sommaire
3.2.
Contraintes
financières.
L’IRM interventionnelle est une
technique
coûteuse du
fait de l’utilisation de l’IRM, c’est un appareil cher en
lui-même. Du fait de
sa faible présence sur le territoire français, son
utilisation est
prioritairement diagnostique et faiblement destinée à la
recherche.
3.3.
Contraintes
réglementaires et normatives.
Actuellement, il n’existe
pas de réglementation propre à la mise en place d’une
salle dédiée à l’IRM
interventionnelle. On peut imaginer qu’il faudra regrouper les normes
applicables aux blocs opératoires et celles applicables à
la salle d’IRM.
Les normes concernant la
mise en place d’un bloc opératoire sont relatives aux
dispositifs médicaux
utilisés (Arrêté du 3 Octobre 1995), au type de
secteur (Arrêté du 7 Janvier
1993), ainsi que tout ce qui concerne le bâtiment (NF S
61-940 : sécurité
incendie, ISO 14644-1 : traitement de l’air, NFC 15-211 :
installations électriques – installations dans les locaux
à usage médical,…).
Pour la salle d’IRM, il faut prendre en
compte les
normes citées précédemment et rajouter tout ce qui
concerne la protection en
terme de radio-fréquence. Il est donc nécessaire de
respecter les
préconisations du cagiste ainsi que les différentes
distances entre l’IRM et
les charges mobiles en mouvement, le tableau électrique,… qui
sont précisées
dans les documents constructeurs.
Cependant il existe un Guide de
Bonnes
Pratiques
d’Hygiène en Radiologie Interventionnelle [17]
qui recommande les actions et les dispositions à mettre en
place :
Dans un service de radiologie,
le secteur
interventionnel doit être indépendant du reste du service.
Il constitue une
zone dite « protégée » en raison
des actes à risques infectieux qui y
sont effectués. La définition d’une telle zone impose des
règles contraignantes
qui permettent d’éviter les allés et venues et la
désorganisation dans les
salles d’interventions.
Pour cela, il est
nécessaire
d’instaurer des règles
communes pour toutes personnes rentrant dans cette zone :
Ø
Un
accès
contrôlé pour le personnel, avec un sas d’habillage
permettant d’accéder à la
zone protégée ; ce sas implique le port d’une tenue
identifiable et un
équipement pour réaliser le lavage des mains.
Ø
Des
circulations des malades, du personnel, du matériel propre ou
stérile, des
déchets, du linge et du matériel contaminé, le
principe de la marche en avant
devant être respecté pour l'ensemble des circuits au sein
du service.
Ø
Un
secteur et
une organisation pour le nettoyage et la désinfection du
matériel
médicochirurgical et des locaux.
Ces circuits et l’organisation
doivent
être
formalisés, ainsi que les rôles et les tâches de
chaque personne, qui doivent
être identifiés et contrôlables à tout moment
(traçabilité). Ce secteur doit
être de taille adaptée aux besoins de la structure et doit
répondre aux
exigences des techniques radiologiques et chirurgicales requises.
L’organisation du travail doit être
rigoureuse. Elle
repose sur :
Ø
Une
programmation stricte des patients, en fonction du risque infectieux :
les
gestes nécessitant une asepsie rigoureuse et les patients les
plus fragiles en
début de programme et les patients à risque infectieux
connu en fin de
programme.
Ø
Un
nettoyage
et une désinfection rigoureux entre chaque intervention et en
fin de programme.
Ø
Une
discipline de l’ensemble du personnel.
Ø
Une
traçabilité par un relevé écrit des
activités de nettoyage.
La salle d’intervention doit être
équipée :
Ø
Du
mobilier
d’intervention (table de radiologie, éclairage
opératoire, table de préparation
du matériel, chariot du manipulateur…).
Ø
Du
matériel
radiologique (émetteur de rayonnements, console de commande,
injecteur
automatique…).
Ø
Du
matériel
d’anesthésie (chariot d’anesthésie complet avec tablette
pour poser le petit
matériel, ventilateurs, appareils de surveillance,
défibrillateur…).
Retour
sommaire
IV.
Cas pratique :
ablathermie
de tumeur sous contrôle IRM.
1.
Généralités.
Une des applications qui est
amenée
à se développer
dans les années futures est l’ablathermie de tumeur sous
contrôle IRM. Cette
technique mini invasive vise à traiter localement la tumeur tout
en préservant
les tissus sains environnants. On espère ainsi limiter les
effets secondaires
liés aux traitements.
L’IRM permet d’effectuer un
suivi
peropératoire de la
répartition de chaleur ou de froid au cours du traitement. Un
suivi post
opératoire des lésions créées est
également possible grâce à la sensibilité de
l’IRM aux modifications tissulaires.
Le monitorage de la
température
peut se réaliser de
différentes façons. Il utilise la sensibilité de
la fréquence de résonance du
proton, et la sensibilité du temps de relaxation T1
aux
modifications de
températures.
Pour réaliser la
nécrose de
la tumeur différentes
technologies peuvent être utilisées [18].
Le tableau suivant les récapitule et indique leurs
caractéristiques :
|
|
Utilisation de
sondes
|
Temps d'application
moyen
|
Volume des lésions
(mm3)
|
|
Radio Fréquence
|
oui
|
12 mn
|
2000-90000
|
|
Micro ondes
|
oui
|
1 mn
|
2100
|
|
Laser
|
oui
|
7-20 mn
|
800-19000
|
|
Ultra sons
focalisés
|
non
|
10s
|
20
|
|
Cryoablation
|
oui
|
10 mn
|
180000
|
[Q]
2. IRM
couplé aux
ultrasons focalisés :
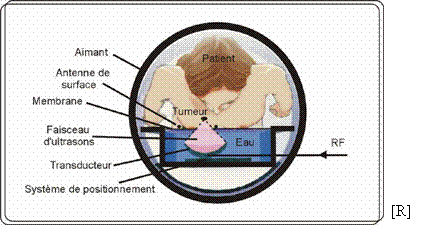
Le laboratoire de spectroscopie
et d'imagerie par résonance magnétique [14],
de l’Université de Montréal a réalisé une
étude sur une méthode non invasive
d'ablation des tumeurs du sein par ultrasons focalisés
guidés par des images de
résonance magnétique.
Retour
sommaire
2.1.
Méthode.
Les ultrasons focalisés
peuvent
détruire une lésion
interne en élevant la température localement et
provoquant ainsi une
coagulation et une nécrose du tissu. Dans un partenariat avec la
compagnie
InSightec Inc., le laboratoire évalue l’efficacité d’un
système expérimental
d'ablation des tumeurs cancéreuses du sein par énergie
ultrasonore focalisée
(USF) opérant à l’intérieur d’un imageur par
résonance magnétique (Figures 19
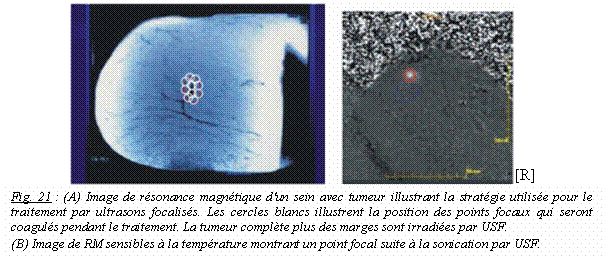
et 20). L’ablation de la tumeur s’effectue en appliquant une
série d'impulsions
USF, chacune détruisant un petit volume de la tumeur (Figure
21). L'imagerie
par résonance magnétique est utilisée pour la
détection et la caractérisation des
lésions, le guidage du traitement et la surveillance des doses
calorifiques
déposées dans le tissu grâce à des
techniques sensibles à la température. Après
le traitement, la tumeur irradiée est enlevée par
chirurgie et une analyse
pathologique est effectuée pour déterminer
l’efficacité du traitement.
Fig.
19 : Illustration du
système de
traitement des tumeurs du
sein par ultrasons focalisés dans un appareil de
résonance magnétique. Un
transducteur focalise un faisceau d'ultrasons sur la tumeur, augmente
la
température localement et détruit le tissu en le
coagulant. L'effet du
traitement est suivi sur des images de résonance
magnétique sensibles à la
température.
Fig. 20 : Table pour traitement des tumeurs
du sein par
ultrasons focalisés opérant dans un appareil de
résonance magnétique et
développée par InSightec Inc.
2.2.
Résultats.
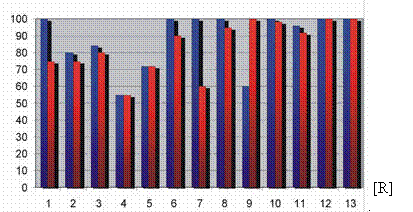
Plusieurs patientes ont
déjà
participé à ce
protocole. Les résultats du traitement évalués
pour 13 patientes par pathologie
sont illustrés à la Figure 4. Un taux croissant de
succès est obtenu et une
ablation complète de la tumeur est obtenue dans plusieurs cas.
Quand
l’efficacité de cette technique sera démontrée,
elle permettra d’éviter la
chirurgie dans la majorité des tumeurs du sein de petite taille
(moins de 2,5
cm).
De plus cette méthode non invasive
est prometteuse
pour déterminer la présence de tumeur résiduelle
après traitement.
Fig.
22 :
Résultats
d'histopathologie après traitement aux USF des 13 patientes,
abscisse: numéro
de la patiente, ordonnée: pourcentage de la tumeur dans la zone
de traitement
(bleu), pourcentage de la zone de traitement nécrosée
(rouge).
Cette technique peut aussi
être
utilisée dans le cas
de cancers du poumon et de l’utérus.
Retour
sommaire
D.
Perspectives.
L’implantation de l’IRM
interventionnelle
au sein de
l’hôpital peut se faire soit dans le service d’imagerie soit dans
le bloc
opératoire. Pour chacune de ses localisations, les perspectives
concernant
l’IRM interventionnelle vont être différentes.
Ø
IRM
interventionnelle en bloc
opératoire de chirurgie
générale.
On peut envisager que l’une des
salles
d’intervention
d’un bloc opératoire soit équipée d’une IRM
permettant ainsi la chirurgie
virtuelle à ciel ouvert ou sous endoscopes amagnétiques.
Le fait d’avoir des
images de façon régulière permet de guider le
geste du chirurgien de façon plus
fiable vers sa cible.
On peut comparer l’apparition de l’IRM
interventionnelle en chirurgie générale à celui de
l’introduction des
amplificateurs de brillance dans les blocs opératoires sans
rayons X. Par
contre, il restera à voir si les gestes chirurgicaux seront
réalisés sous les
aimants ou en-dehors de l’aimant avec un contrôle régulier
par translation du
patient.
Ø
IRM
interventionnelle en
département d’imagerie.
Dans le cas de l’implantation
de l’IRM en
imagerie,
sa fonction principale serait la biopsie. Il peut exister deux types de
mode de
visée en fonction de la complexité du geste. S’il s’agit
d’un geste simple, la
ponction peut être réalisée à main
levée et le geste est ensuite effectué dans
l’aimant ou hors aimant. Par contre, si le geste est complexe, il sera
réalisé
avec un mode automatisé de visée de la cible, le but
étant d’atteindre la cible
par un trajet unique.
L’un des inconvénients est le
repérage de l’extrémité
de l’aiguille qui n’est pas visible correctement. Une des perspectives
serait
que l’extrémité de l’aiguille amagnétique ou du
matériel de biopsie utiliserait
les techniques de repérage par haute fréquence. Cette
technique est en cours
de mise au
point en IRM interventionnelle vasculaire.
Retour
sommaire
E.
Conclusion.
Le point de départ de ce
projet a
été la présentation
des différentes techniques d’imagerie interventionnelle. Leur
intérêt a été
démontré par rapport à la chirurgie :
diminution du traumatisme de
l’intervention pour le patient et diminution des coûts
d’hospitalisation sont
deux avantages majeurs.
Puis nous nous sommes
intéressés à une technique
émergente de l’imagerie interventionnelle : l’IRM
interventionnelle. Elle
permet donc d’avoir une intervention directe sur le patient tout en
bénéficiant
en continu d’une image IRM pour surveiller et contrôler les
gestes
chirurgicaux, c’est une technique qui est moins invasive pour le
patient. Cette
technique semble très prometteuse et se développera
fortement dans les années à
venir. Ce développement devra prendre en compte l’utilisation de
l’IRM
interventionnelle par le personnel médical, son implantation
soit dans le
service d’imagerie, soit dans le bloc opératoire et
l’évolution de la médecine.
La collaboration entre les
équipes
chirurgicales et
radiologiques n’est pas à l’heure actuelle une pratique
courante. Cependant,
une telle équipe placée dans une structure adaptée
permettrait d'obtenir une
qualité de traitement et de diagnostique plus importante
grâce à une meilleure
expression des compétences de chacun.
Nous conclurons par une
citation du
Professeur G. Von
Schultess (Co-directeur du Centre de Résonance Magnétique
du Département de
Radiologie de l’Hôpital Universitaire de Zurich) :
« La chirurgie
guidée par RM sera chose courante… L’ablation thermique de
disques et de
tumeurs des tissus mous sera réalisée sous contrôle
RM… Beaucoup
d’interventions cardiovasculaires se feront sous guidance RM non
seulement
parce que la RM n’emploie pas de radiations ionisantes mais surtout
parce
qu’elle apporte une valeur ajoutée, l’imagerie 3D, la
caractérisation des
plaques et les mesures de flux pour contrôler les
résultats… ».
Retour
sommaire
BIBLIOGRAPHIE
Retour
sommaire
[1] Journée ACOPHRA du Jeudi 13
Février 1997 à Lyon, RADIOLOGIE
INTERVENTIONNELLE,
http://www.adiph.org/acophra/radiologie.html
[2] L’angiographie, http://www.doctissimo.fr/html/sante/imagerie/angiographie.htm
[3] « Pratique au
Diagnostic Morphologique, Le scanner et l’IRM »,
Dr. Jean-Yves TANGUY, CHU Angers, 4 octobre 2001,
http://www.med.univ-angers.fr/discipline/
radiologie/Infosetudiants.html
[4] L’IRM Imagerie par
résonance
magnétique –Généralités :
-
http://www.doctissimo.fr/html/sante/imagerie/irm.htm
- http://www.imagemed.org/cerf/cnr/edicerf/BASES/BA004_idx.html
- http://www.santemedia.com/mag/5_2000_10/5_irm.htm
[5] « Les
problèmes actuels en imagerie interventionnelle »,
A. Isnard, C. Pioche, Projet DESS « TBH », UTC,
1997, pp 37, https://www.utc.fr/~farges/dess_tbh/96-97/Projets/II/II.htm
[6] « La chirurgie
mini-invasive », Bruno Lecointe, Cours
UTC, 2004
[7] « RMN Notions de
base en vue de l’étude phénoménologique du
principe de Résonance Magnétique
Nucléaire », Michel ZANCA, Université
Montpellier 1 – UFR Médecine –
Biophysique, PCEM1, Janvier
2001, http://m-zanca@chu-montpellier.fr
[8] Présentation IRM, Philips
Systèmes médicaux, marketing IT, Philippe Lanièce,
UTC Compiègne, 24 Novembre
2003, https://www.utc.fr/~farges/Master
[9] «
The basics of MRI, Chapter 13 »,
http://www.cis.rit.edu/htbooks/mri/chap-13/chap-13.htm
[10] « Bases physiques
des mesures de vitesse circulatoire en imagerie
par résonance magnétique (IRM) », Jacques
BITTOUN, Unité de Recherche en Résonance
Magnétique
Médicale (ESA 8081 – CNRS) CIERM - Université Paris-Sud,
Hôpital de Bicêtre
-94270 Le Kremlin-Bicêtre- France,http://www.kb.u-psud.fr/niveau2/enseignements/niveau3/etudmed/cours-irm/accueil.htm
[11] « RMN et Optique
biomédicale : traitement du signal et
systèmes », Ecole doctorale EEA ; DEA Images
& Systèmes
Equipe (09/2002) : H. Saint-Jalmes (PR), D. Graveron-Demilly (IR) L.
Bouchet-Fakri (MC), S. Cavassila (MC), B. Favre (MC), E. Perrin
(MC) ;
Doctorants : M. Armenean (OC, HSJ, 02), C. Armenean (EP, HSJ, 05), F.
Jaillon
(HSJ, 03), F. Pilleul (OB, HSJ, 05), H. Ratiney (DG, SC, 04), H.
Sanchez (CC,
HSJ, 03) ; DEA : F. Lairi (DG),F. Seguro (ABC, HSJ), V. Surrel
(EP), Z.
Zhai (SC), http://laimac1.insa-lyon.fr/mastersids_lyon/labo_iis.htm
[12] « Les aspects du
traitement d’image »,
http://www.ese-metz.fr/metz/eleves/themes/imagerie/tomographie/principe.html
[13] « La
résonance magnétique d’intervention : introduction,
ingrédients du succès, et l’expérience du
CHUQ », Christian Moisan,
Centre hospitalier universitaire de Québec, http://irmi.gel.ulaval.ca/imri_cap_fr.pdf
[14] « CHUM-Laboratoire
de recherches en imagerie et spectroscopie par
résonance magnétique », http://pages.infinit.net/khiat/fr/tumeursdusein.html
[15] « Le journal de
l’Institut Curie, Comprendre pour agir contre le
cancer ; De nouveaux horizons pour l’IRM »,
p.11 ; Les
« yeux » de la recherche, p.12 ; novembre
2003,
http://www.curie.fr/home/presse/jic_recevoir.cfm/lang/_fr.htm
[16] « Evaluation
clinique et état du marché des appareils
d’IRM à bas champ magnétique (< 0.5
Tesla) », http://www.anaes.fr/anaes/Publications.nsf/nPDFFile/RA_ASSI-57JE8Z/$File/irmlong.pdf?OpenElement
[17] « Le Guide des
Bonnes Pratiques d’Hygiène en Radiologie
Interventionnelle »,
http://web.ccr.jussieu.fr/cclin/recommpreven.html
[18] « Suivi IRM des
destructions tissulaires par thermocoagulation in
vivo à bas champ : imagerie de température et
prédiction de la taille des
lésions », GERMAIN Delphine, Thèse de
doctorat UTC 2001
[19] « IRM
interventionnelle. Analyse des données et
perspectives. », J. Radiol 1999, n° 80, p.
1527-1530, Editions
françaises de radiologie.
Retour
sommaire
IMAGES
[A] [K] [L] [M] [N] Image d’un schéma d’une table
dédiée à l’angiographie,
http://www.hers.be/cours%20technique%20def.pdf
[B] Image d’un examen en
échographie Doppler,
http://www-sop.inria.fr/epidaure/personnel/malandain/cours/Imagerie-Medicale/sld105.htm
[C] Appareil d’échographie
doppler, http://www.ch-aulnay.fr/medico-technique/radiologie.htm
[D] Schéma du principe de
fonctionnement d’un scanner,
http://ese-metz.fr/metz/eleves/themes/imagerie/scannerX.fr
[E] Appareil IRM,
http://18jfirm.free.fr/servimag2.htm
[F] Image d’un examen IRM, http://www.artc.asso.fr/fr/tumeurs/systeme_nerveux/tumeurs_cerebrales.htm
[G] « Le corps
transparent », Magazine Sciences et Vie Junior Hors
Série 45, Juillet
2001, pages 74-81, Auteur : Sophie De Salettes
[H] Composantes principales
d’un IRM, http://www.ese-metz.fr/metz/eleves/themes/imagerie/irm_composants.html
[I] « Laboratoire des
sciences de l’information et des systèmes », Olivier
Coulon, 2004-2005,
http://www.esil.univ-mrs.fr/~ocoulon
[J] http://cours.univ-brest.fr/UFR-Medecine/MSBM/Traceurs/2_14_RMN_cours_bases_physique.pdf
[O] « La résonance
magnétique d’intervention : introduction,
ingrédients du succès, et
l’expérience du CHUQ », http://irmi.gel.ulaval.ca/imri_cap_fr.pdf
[P] Cours UTC, Présentation
IRM Philips Systèmes Médicaux, Philippe Lanièce
[Q] « Suivi IRM des
destructions tissulaires par thermocoagulation in vivo à bas
champ : imagerie
de température et prédiction de la taille des
lésions », GERMAIN Delphine,
Thèse de doctorat UTC 2001
[R] « CHUM-Laboratoire de
recherches en imagerie et spectroscopie par résonance
magnétique »,
http://pages.infinit.net/khiat/tumeursduseinbuts.html
Retour
sommaire