Mr
Chevallier Georges, Responsable de la formation Management des
Technologies en Santé de l’Université de Technologies de
Compiègne pour sa contribution au projet.
Mr
Farges Gilbert, enseignant chercheur à l’Université de
Technologies de Compiègne pour ses conseils durant la formation.
La
société BrainLAB pour nous avoir fourni de la
documentation et notamment Mr Emonides Jean Philippe (Ingénieur
d’application BrainLAB) et Mr Cochet
Régis (Directeur département orthopédie BrainLAB)
pour leur aide précieuse et leurs réponses à nos
questions.
II. Les systèmes de navigation
en neurochirurgie. 23
a)
Principales modalités d’imagerie utilisées : 23
b)
Autres modalités d’imagerie. 24
2. Modes de
repérage. 24
a)
Repérage du patient « surface matching » ou «
registration ». 24
b)
Localisation des instruments. 26
3. Composantes
d’un système de navigation
en neurochirurgie. 28
4.
Exemples de systèmes de navigation en neurochirurgi 30
a)
Système Radionics™ 30
b)
Gamme BrainLAB.. 31
5.
Performances, limites et précision. 33
a)
Le degré de maîtrise du système par le
neurochirurgien. 33
b)
Performances et limites de la technologie. 33
6.
Stérilisation. 36
7.
Environnement des Systèmes de Navigation en Neurochirurgie. 37
a)
Microscope opératoire. 37
b)
Instruments chirurgicaux. 38
c)
Tables d’opération. 38
d)
Robots de positionnement 39
e)
Systèmes d’imagerie peropératoire. 40
III.
Les nouveaux concepts et l’avenir des systèmes de
navigation en neurochirurgie. 43
1. La vision
des industriels. 43
2.
Un bloc opératoire dédié aux systèmes de
navigation en neurochirurgie : BrainSuite® iMRI 43
3.
Réorganisation du bloc opératoire. 45
4.
Thèmes de recherche. 46
Conclusion. 48
Bibliographie. 49
Index
figures et tableaux. 51
Annexe
I
Annexe
2
La
neurochirurgie est un exercice intellectuel et physique dans l'espace
tridimensionnel (3-D). Depuis l'époque des pionniers, des
médecins, des scientifiques et des partenaires industriels
unissent leurs efforts en vue de mettre au point des instruments
capables de limiter le risque de la navigation dans l'espace
tridimensionnel du cerveau lors des interventions. Le but ultime
consiste à offrir au neurochirurgien une précision et une
sécurité telles qu'il puisse atteindre des régions
cérébrales qui sont inaccessibles d'une autre
manière et traiter des affections incurables auparavant.
C’est
dans cette optique que les systèmes de navigation en
neurochirurgie actuels ont vu le jour au début des
années 1990.
Cette
technique suscite un grand intérêt de la part des
professionnels de la santé notamment des services de
neurochirurgie, que ce soit au niveau français ou international.
Cependant, elle implique une révolution des pratiques
chirurgicales conventionnelles, de l’organisation architecturale du
bloc opératoire, comme l’environnement des systèmes de
navigation en neurochirurgie, et des méthodes de travail de
l’ensemble du personnel médical. De
plus, l’acquisition d’un système de navigation ad hoc dans un
établissement de santé est un investissement lourd et
difficile à faire accepter par la communauté
médicale.
L’évolution
des techniques de télédétection, des
modalités d’imagerie, le développement informatique et
les progrès en terme de modélisation et de traitement de
l’image ont perfectionné les outils de neuronavigation.
Les
systèmes de neurochirurgie guidée par l’image tendent
à évoluer vers l’intégration et l’adaptation de
systèmes d’imagerie en peropératoire et vers des
solutions clé en main où le geste chirurgical du
praticien devient de plus en plus guidé et assisté. Ce
concept éveille une réflexion d’ordre éthique sur
la relation dominant/dominé entre le Neurochirurgien et le
Système de Navigation.
retour sommaire
I.
La neuronavigation
L’histoire
de la neuronavigation ou encore Chirurgie
Guidée par l’Image (Image Guided Surgery en Anglais) est
fortement liée à celle de la neurochirurgie et à
l’évolution des techniques de navigation en
général. Par conséquent, la suite de ce chapitre
retracera les moments historiques significatifs qui ont fait
évoluer la pratique de la neurochirurgie vers l’utilisation des
systèmes de Neuronavigation.
La
chirurgie du cerveau est peut être la plus vieille pratique de la
médecine. Des documents antiques archivés
décrivent la pratique de la chirurgie du cerveau par Hippocrate
en Grèce déjà à l’époque romaine
ainsi que par des chirurgiens du monde arabe à l’époque
médiévale. La neurochirurgie scientifique a
commencé au 19ème siècle avec la
découverte de la relation entre certaines parties du cerveau et
le contrôle du tempérament, de l’humeur, des sens et de
l’intelligence.
Avant
les années 1990, la réussite d’une opération
neurochirurgicale reposait sur les connaissances, l’expérience
et l’habileté du Neurochirurgien. Ces aptitudes étaient
développées au cours d’une longue formation post
graduée et continue. De plus,
l'absence de technique d'imagerie non invasive entraînait
l'utilisation simultanée du diagnostic et de la thérapie
par un contrôle visuel direct.

Figure 1: Cadre
stéréotaxique appliqué sur la tête du patient
Afin
de s’orienter dans l’espace, le praticien ne disposait que de
techniques limitées comme la stéréotaxie
peropératoire (figure 1), les tests
fonctionnels (stimulation
corticale) et la neuro-ultrasonographie (échographie) peropératoire.
Le chirurgien devait toujours effectuer la
visualisation mentale en 3 dimensions (3D) à partir d’images en
2 dimensions (2D). L’apparition des techniques d’imagerie
tomographiques en 3D comme l’IRM (Imagerie par Résonance
Magnétique) et la tomodensitométrie (scanner) ont
apporté une première réponse à ce
problème.
Grâce
à eux, la stéréotaxie sans cadre a
émergé, permettant l’utilisation de plusieurs
modalités d’imagerie avec un même
référentiel fixé sur la tête du patient. Les
innovations militaires d’acquisition et de suivi de cible pour les
avions et hélicoptères de combat ont permis la conception
du système « Compass » qui permettait
d’intégrer les images acquises dans un cadre
stéréotaxique et de reporter dans l’optique du microscope
chirurgical les contours de la lésion (Ex : Surgiscope [1]). Le nouveau GPS (Géo Positionnement par
Satellite ou Global Positionning System) du neurochirurgien est
né.
Le
progrès de l’informatique, l’ère du numérique et
de la modélisation 3D, ainsi que le développement des
réseaux informatiques et des techniques de détection ont
suscité une avancée formidable vers les systèmes
actuels qui se passent de cadre stéréotaxique. Il est
alors possible de matérialiser en temps réel la position
des instruments chirurgicaux, les cibles opératoires et les
zones à risque tout en reconstruisant l’image des régions
traversées afin de limiter les risques de lésions graves.
Dès
2000, on dénombrait déjà environ 800
systèmes de navigation chirurgicale toute application confondue [2]. Les systèmes dits de première
génération étaient des concepts difficiles de mise
en œuvre et nécessitaient l’assistance impérative de
personnes spécialisées. Les systèmes de navigation
de seconde génération (années 2000) furent
développés spécifiquement pour les chirurgiens
grâce à des interfaces graphiques Homme/Machine
adaptées. L’ère de la troisième
génération est arrivé, le but étant
d’inclure l’acte chirurgical aux systèmes d’information et
d’imagerie (figure 2).

Figure 2
: Système de neuronavigation Omnisight Excel™ de Radionics™
retour sommaire
Une
classification des systèmes de robotique chirurgicale et de
chirurgie assistée par ordinateur a été
élaborée par le Cédit de l’AP-HP (Assistance
Publique des Hôpitaux de Paris) en 2002 et intègre les
systèmes de Neuronavigation [3, 4]. Cette
classification a pour but de permettre une analyse des
différents enjeux posés par chaque catégorie de
système tels que les impacts médicaux, organisationnels,
économiques et les aspects règlementaires et de
sécurité sanitaire. Il est intéressant de noter
l’apport d’une telle classification pour la définition du Système
de neuronavigation.
Aujourd’hui
l’appellation des systèmes de neuronavigation
n’est toujours pas claire. Effectivement, les professionnels de la
santé (notamment en neurochirurgie) et la communauté
scientifique utilisent les termes suivants :
- Systèmes
de Neuronavigation (ou Neuronavigation en anglais)
- Systèmes
de Navigation en Neurochirurgie
- Systèmes
de Neurochirurgie Guidée par Image (ou IGS Image Guided Surgery
en anglais)
- CAO,
systèmes de Chirurgie Assistée par Ordinateur (ou CAS
Computer Assisted Surgery en anglais)
- Certains
parlent même de stéréotaxie sans cadre
Dans
tous les cas, ils sont considérés comme systèmes
intégrant une technologie permettant le lien entre les
instruments chirurgicaux et des logiciels d’assistance visuelle. On
leur attribue une attitude passive contrairement à ses cousins
les systèmes robotisés.
Il
est primordial de ne pas confondre ces systèmes de neuronavigation avec les systèmes
robotisés qui effectuent une tâche de l’acte
opératoire, un geste chirurgical. Dans ce cas, le
neurochirurgien n’est plus maître de ses gestes, il subit une
certaine contrainte due au mouvement du robot qui peut aussi être
autonome. On parle alors de robot semi actif ou actif.
En
ce qui concerne les robots actifs, on retrouve des
télémanipulateurs chirurgicaux [4].
Cependant, il faut
bien tenir compte du fait que la frontière est parfois proche
entre ces deux catégories : systèmes de navigation
(figure 3) et systèmes robotisés (figure 4).

Figure 3 :
Système de neuronavigation StealthStation®
TREON™ Medtronic

Figure 4 : Le robot chirurgical
DA VINCI®
Les
technologies utilisées par les systèmes de navigation en
neurochirurgie peuvent être issues mais
également adaptables ou applicables à des
opérations autres, telles que :
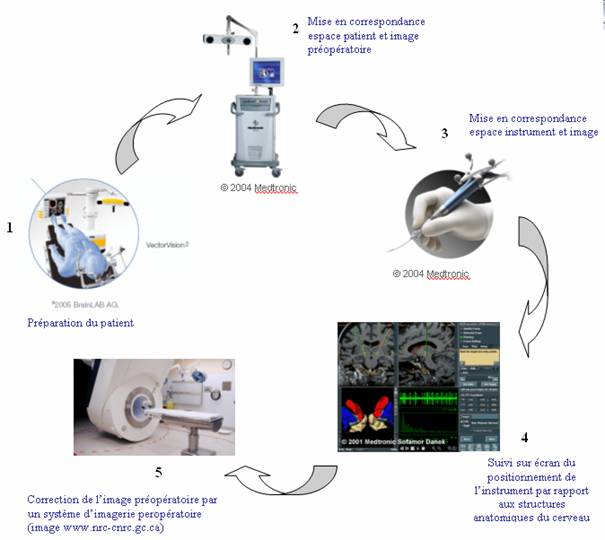
Figure
8 : les étapes de l’utilisation d’un système de neuronavigation en phase peropératoire
Les
différentes modalités d’imagerie utilisées, la
modélisation du cerveau, les techniques de mise en
correspondance des espaces et de repérage du patient et des
instruments seront développées au (chapitre II Les
systèmes de navigation en Neurochirurgie).
retour sommaire
4.
Intérêts
Les images préopératoires aident
à localiser et visualiser la lésion. Cependant, la forme
dans laquelle l'information est présentée
(négatoscope, coupes 2D de tomographies, …) n'est pas souvent la
plus optimale pour guider le neurochirurgien. Devant des images 2D, il
doit mentalement reconstruire la situation réelle dans l'espace
et déterminer la meilleure approche pour minimiser les risques.
D’où l’intérêt de développer des
systèmes de navigation 3D.
Ces systèmes de neurochirurgie
guidée par l’image développés à l’heure
actuelle présentent divers avantages.
retour sommaire
a) Une
meilleure préparation de l'intervention
La simulation
préopératoire permettra au neurochirurgien de
repérer les contours de la lésion et d’identifier les
zones du cerveau à éviter afin de réaliser les
meilleurs gestes opératoires. Cette augmentation de la
sûreté du geste est de nature à raccourcir la
durée de l'opération.
A
ce stade de planification opératoire, il s’agit d’optimiser la
stratégie neurochirurgicale : localisation d’une
lésion, définition de ses limites, voie d’approche,
évitement des zones éloquentes, protection de structures
telles que les artères nourricières ou les veines, le
tout dans un environnement 3D.
Elle
sert ensuite à définir avec précision les limites
d’une craniotomie ce qui permet d’en réduire la taille
(cicatrice de la peau, volet osseux).
retour sommaire
Le guidage en temps réel tout
au long de l'opération du travail du neurochirurgien lui permet
de visualiser la position précise des instruments chirurgicaux
sur le modèle en 3D. L'extrémité et l'axe des
instruments chirurgicaux manipulés pendant l'intervention se
connectent au système de neuronavigation.
Le chirurgien visualise ainsi en temps réel leur progression
à l'intérieur du cerveau du patient. L’évolution
des neuronavigateurs permet d’y associer un endoscope et de cumuler les
avantages de ces deux méthodes.
Une
fois le crâne ouvert, elle oriente le neurochirurgien dans ses
déplacements : elle l’avertit de la proximité d’une
zone éloquente ou d’une structure à protéger. Les
fautes d'orientation du neurochirurgien sont corrigées.
En
même temps, l’opérateur peut contrôler si les
informations qui lui sont fournies par le système correspondent
à la réalité chirurgicale.
retour sommaire
Pour
résumer, cette neurochirurgie pilotée évite un
rasage complet du crâne du patient, minimise la taille de
l'incision ou de l'ouverture du crâne au strict minimum, augmente
la précision du geste opératoire et permet de recourir
à une chirurgie la moins invasive possible. Cela raccourcit la
durée de l'intervention et de l'hospitalisation, au plus grand
bénéfice du patient qui peut ainsi être
opéré avec une plus grande sécurité et au
prix de moins de traumatismes et de douleur.
La
simulation préopératoire et le guidage
peropératoire permettent le traitement chirurgical de
lésions qui, par le passé, n'étaient pas
opérables ou seulement avec des risques importants. La
visualisation de la lésion et des structures adjacentes permet
de réduire la mortalité.
De
plus, ce type de guidage peropératoire a permis de remplacer
l’usage de l’amplificateur de brillance et de diminuer par
conséquent la dose reçue par le patient.
retour sommaire
a) Applications générales
Comme
les autres spécialités, la neurochirurgie se pratique
souvent dans un contexte multidisciplinaire et la collaboration avec le
neurologue, le radiothérapeute, l’oncologue, le radiologue,
l’anesthésiste est essentielle dans le traitement du patient
atteint d’une affection intracrânienne. [6,7]
La
neurochirurgie se situe le plus souvent dans un contexte d’acte
planifié. Le pronostic vital à court terme n’entre
généralement pas en ligne de compte lors de ce type
d’intervention.
Le
recours à un système de neuronavigation
dépend en outre de différents aspects : la taille de
la lésion, sa nature et/ou sa situation anatomique.
Ainsi,
les deux principaux domaines d’application de la neurochirurgie sont
les interventions sur le système nerveux (cerveau, moelle
épinière, nerfs) et sur la colonne vertébrale.
Les
interventions sur la base du crâne représentent la
meilleure indication. En effet, les tissus y sont plus denses et
adhèrent plus à la structure osseuse ; le
déplacement cérébral (brain shift), l’une des
limites de l’utilisation d’un tel système (voir
chapitre II.5.b) est alors moins important.
Autant le système de neuronavigation
est très utile pour intervenir sur des lésions de petites
tailles ; l’intérêt étant la localisation de
la lésion dans le volume tumoral ; autant son
intérêt en cas de grosse tumeur est limité. Seuls
l’axe de progression et la distance du point de
pénétration cortical à la lésion
représentent un réel avantage ; l’information sur le
contourage de la lésion devenant fausse au fur et à
mesure de l’ablation des grosses tumeurs.
La nature histologique des lésions est en
majorité de type tumoral : gliomes, cavernomes,
méningiomes (figure 9) et métastases correspondent aux
types de lésions les plus fréquemment
opérées.
Les interventions peuvent également
être de seconde intention :
- reliquat
tumoral
- récidive
- intervention
post chimiothérapie
- intervention
post radiothérapie
Outre
les affections cérébrales intracrâniennes, les
neurochirurgiens se sont consacrés de tout temps au traitement
des affections de la colonne vertébrale, dont l’exemple le plus
connu est la hernie discale dont le diagnostic est posé et le
traitement est mis en œuvre par les neurochirurgiens.
Ainsi,
les applications de la neurochirurgie sont nombreuses :
- La résection
chirurgicale de tumeurs ou malformations vasculaires
cérébrales
- Les biopsies
cérébrales
- La neurochirurgie
fonctionnelle (épilepsie, maladie de Parkinson)
- La mise en place de
drains ventriculaires en cas d’hydrocéphalie
- La chirurgie du
rachis
- La
neuroendoscopie
- La
thérapie cellulaire
- La
curiethérapie interstitielle
- …
retour
sommaire
b)
Cerveau et crâne
Voici
un aperçu des interventions neurochirurgicales les plus
courantes sur le cerveau et le crâne [6,7] :
Accidents-traumatismes
- Hémorragies :
hématomes extradural/intradural
- Monitorage de la
pression intracrânienne
- Traitement des
fractures par affaissement de la voûte crânienne
- Traitement des
fractures de la base du crâne avec perte du liquide
céphalo-rachidien
Tumeurs
- Bénignes
(méningiomes (figure 9) : tumeurs
des enveloppes
cérébrales, neurinomes : tumeur des nerfs
crâniens, tumeur de bas grade du tissus et soutient des neurones)
- Malignes
(gliomes : tumeurs malignes du tissu d’appui)
Hydrocéphalie
- Opérations de
shunt (pose d’un système de drainage du cerveau vers le cœur ou
la cavité abdominale)
Affections
cérébrales
- Craniosténose
(trouble de l’ossification du crâne chez un enfant jeune se
traduisant par exemple par un crâne trop petit ou une
déformation du crâne)
- Tumeurs (tumeurs du
tissu osseux crânien proprement dit)
Affections
vasculaires, hémorragies cérébrales
- Anévrisme
(pose d’un ‘clip’ sur le prolapsus qui a saigné)
- Malformation
artérioveineuse
- Hémorragies
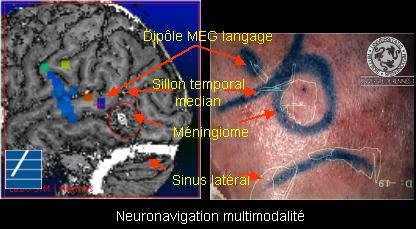
Figure
9 : Représentation d’un méningiome en neuronavigation multi modalité
(Laboratoire IDM RENNES France)
retour sommaire
Le
marché des systèmes de Neuronavigation attire un grand
nombre de fabricants et fournisseurs dont les principaux sont :
- BrainLAB
- Radionics (Tyco Healthcare)
- Medtronic Sofamor Danek
- Zeiss
- Elekta
- Philips Medical Systems
- Sulzer Medica
- General Electric Healthcare
- Surgical Navigation Specialists (SNS)
- …
Parmi
ces constructeurs et/ou distributeurs, on retrouve majoritairement des
sociétés d’instrumentation chirurgicale (les plus
performantes car elles disposent de forces de vente et de
spécialistes en chirurgie). Viennent ensuite des
sociétés de logiciel et d’imagerie médicale.
Ces
sociétés proposent des contrats de maintenance
adaptés au système vendu. Celle-ci peut être
réservée exclusivement à des ingénieurs
support produit, notamment concernant la maintenance lourde comme la
mise à jour de logiciels [Annexe 1].
Certains techniciens ayant
suivi des formations spécifiques peuvent aussi intervenir sur
des aspects moins lourds tels que la mécanique et
l’électronique ; ceci à condition d’être
habilité par le constructeur.
Malgré
un coût élevé, la quasi-totalité des
services de neurochirurgie français sont dotés de
systèmes de chirurgie guidée par l’image, avec 92% d’entre eux équipés [annexe
1], [8]. Cependant, en terme de technologie, on
remarque un retard important de la France vis-à-vis de son
voisin allemand [annexe 1].
retour
sommaire
Les
systèmes de navigation en neurochirurgie sont
considérés comme du matériel de bloc
opératoire ; les normes sont moins drastiques que celles
des dispositifs d’imagerie [Annexe 1].
Ces systèmes de neuronavigation
doivent tout
de même respecter le « marquage CE dispositif
Médical, et la norme européenne EN 6000 [Annexe 1], [9] » pour pouvoir
être commercialisés et utilisés.
Le marquage CE [3] garantit les exigences
essentielles de sécurité (obligatoire depuis le 14 juin
1998, Directive européenne 93/42/CEE). Il existe aussi une
classification de la FDA (Food and Drug Administration) [10]
américaine qui est plus exigeante au niveau clinique. Il est
intéressant de se renseigner auprès de cet organisme de
contrôle de mise sur le marché ou bien auprès de
l’AFSSaPS (Agence Française de Sécurité Sanitaire
des Produits de Santé) [11] avant l’achat
d’un tel dispositif. L’acquisition de ce type d’appareil dans un
établissement public nécessite le recours aux
procédures d’appel d’offre du code des marchés publics [12]. Pour un établissement privé, la
procédure d’achat se fait de façon directe sans
spécification précise.
retour sommaire
c) Enjeux
économiques
Le
coût d’investissement peut s’avérer lourd au
départ ; de l’ordre de 150 k€ pour une simple station de neuronavigation (VectorVision®
Kolibri BrainLAB, environ 110k€.
Néanmoins, les diminutions du temps d’intervention, du
coût opératoire, du séjour hospitalier et la
réduction des complications cliniques s’en ressentent.
Cependant, il faut savoir rester vigilent et prendre conscience des
facteurs de coût annexes ou coûts d’exploitation,
comme : les charges d’amortissement, le prise en charge de la
formation du personnel soignant, le contrat de maintenance et des
coûts variables induit par les consommables, les
réparations et l’achat de l’instrumentation. Ce sont autant de
paramètres qu’il faut prendre en compte au moment de l’achat
d’un tel dispositif médical.
Le
coût d’investissement peut être réduit grâce
aux donations et financements externes par des associations, les
conseils régionaux et généraux. Ceci fut le cas du
Centre Hospitalier Universitaire de Rouen en 1997. Pour un montant de
2,8 millions de francs (environ 430 k€), plus de la moitié
de l’investissement fut pris en charge par la Fondation Charles Nicolle
et le conseil général et régional. [13]
retour sommaire
La
sélection d’un système de neuronavigation
en neurochirurgie peut s’effectuer selon les critères suivants [14] :
- les contrats de maintenance
et la qualité du Service Après Vente ou S.A.V
-
les attentes et les besoins
du neurochirurgien
-
les performances de la
station informatique
- une seconde station de travail avec des logiciels
de
pré planning
-
les possibilités de
connexion avec les imageurs
-
les compatibilités
réseau (standard DICOM 3)
-
le transfert des images
(réseau DCM, Ethernet, cartouche ZIP, Cd-rom …)
-
la diversité et la
simplicité d’utilisation des logiciels proposés
-
la facilité de
navigation dans l’interface graphique (pédales, tablette de
contrôle avec stylet, par le mouvement de l’instrument,
reconnaissance vocale …)
-
l’instrumentation
(coût, méthodes de stérilisation, durée de
vie, encombrement …)
-
le système de
repérage (l’axe caméras/récepteurs doit rester
libre pour les systèmes infra rouge)
-
l’intégration d’un
microscope chirurgical
-
le coût des consommables
-
l’ergonomie (facilité
de mise en route, d’installation et d’utilisation, interface
utilisateur)
- les facilités de mobilité de la station de
travail et l’encombrement
...

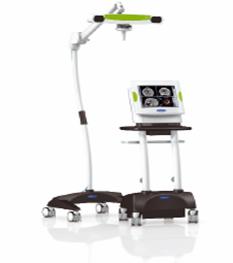
Figure
24 : Système de neuronavigation
VectorVision® Sky
& Data Panel de BrainLAB
retour sommaire
La
complexité actuelle des dispositifs de navigation demande une
certaine compréhension technique ainsi qu’une formation
adaptée et régulière des neurochirurgiens. Ces
derniers doivent intégrer le concept de perception virtuelle et
réelle de l’image et de l’orientation. Ils doivent garder
à l’esprit que la technique ne reste qu’un support dans l’acte
opératoire et qu’il doit rester seul maître de la conduite
de l’intervention. De plus, l’instrumentation de tels systèmes
reste peu maniable dans un espace exigu. C’est pourquoi, les
résultats opératoires ne peuvent être meilleurs que
si la technologie est utilisée à bon escient et
intelligemment. Le praticien ne doit pas se laisser guider mais garder
une part d’autonomie et d’intuition.
retour sommaire
Différents
paramètres entrent en jeu dans la précision de l’acte
chirurgical guidé par un système de neuronavigation,
et cela, à toutes les étapes de la procédure. La
précision globale des systèmes de neuronavigation
(de l’ordre de 4 millimètres [14]),
tient compte de
l’ensemble des paramètres inhérents à la
technique. [14]
- La précision mécanique de l’appareil
de localisation
La
précision mécanique est relative à la
capacité du système de repérage de donner une
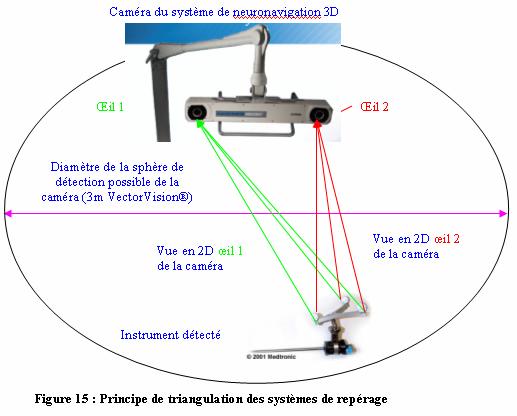
position réelle exacte dans l’espace. Elle dépend
principalement de la résolution spatiale des deux caméras
de repérage par triangulation et de la position des
émetteurs par rapport aux détecteurs pour les dispositifs
optiques (de l’ordre de 0,2 à 0,6 millimètres environ [14]).
- L’erreur de mise en correspondance
patient/instruments/système de navigation
Elle
équivaut à l’erreur qui existe entre la position
réelle de l’instrument dans l’espace chirurgical et son image
sur la station de travail. Elle dépend des erreurs dans l’espace
imageur (résolution spatiale de la matrice image ou performances
de l’imageur, épaisseur de coupe, distorsion de l’image) et des
erreurs dans l’espace chirurgical (imprécision mécanique
du système de localisation, type et/ou nombre de marqueurs
utilisés [14], mise en correspondance
de la tête du patient avec ses images…). Par exemple, plus le
vide entre deux coupes de scanner est important, plus le système
de navigation va extrapoler. Par conséquent, le nombre de coupes
accroît la précision mais implique un espace de stockage
plus important en format DICOM (plusieurs Megaoctets) [Annexe 1]
ce
qui nécessite des systèmes informatiques puissants.
|
Système
de repérage
|
Avantages
|
Inconvénients
|
|
Bras
articulé
|
Aucun
risque d’occultation, grande précision, aucune perturbation de
l’environnement par le système et aucune perturbation des
mesures par l’environnement.
|
encombrement
élevé, faible aisance d’utilisation
|
|
Triangulation
par ultrasons
|
Rapidité
de changement d’instruments, encombrement réduit
|
Possibles
perturbations de l’environnement par le système,
précision réduite, aisance d’utilisation réduite,
risque d’occultation élevé, fortes perturbations des
mesures par l’environnement.
|
|
Triangulation
électromagnétique
|
Rapidité
de changement d’instruments, encombrement réduit, risque
d’occultation faible
|
Possibles
perturbations de l’environnement par le système, faible
précision, aisance d’utilisation réduite, fortes
perturbations des mesures par l’environnement.
|
|
Triangulation
optique infrarouge
|
Rapidité
de changement d’instruments, encombrement réduit, grande
précision, aucune perturbation de l’environnement par le
système et des mesures par
l’environnement.
|
Aisance
d’utilisation réduite, risque d’occultation élevée.
|
Tableau 1 : Avantages et
inconvénients des systèmes de repérage en
navigation
.
- Les variations anatomiques et les
pertes de correspondance
L’utilisation
des systèmes de navigation en neurochirurgie est freinée
par des limites majeures qui sont dues à la modification des
structures des tissus au cours de l’opération :
- le
« BrainShift » ou déplacement de la
surface du cerveau (jusqu'à
25 millimètres) [17] et des
structures cérébrales à l’ouverture de la dure
mère (affaissement ou renflement de la surface corticale) quand
la lésion est située en périphérie.
Cependant, ce phénomène est minime pour des
régions d’intérêt situées en profondeur
(figure 25).
-
l’affaissement du liquide
céphalo-rachidien (lors de la craniotomie et pendant toute la
durée de l’opération)
-
les modifications dues à
l’accès à la zone lésionnelle (déformations
dues au passage de l’instrumentation)
-
la résection de
matière
Le
recalage rigide réalisé par le système de neuronavigation entre les examens
préopératoires et la position du patient en salle
d'opération est donc entaché d'une imprécision.
Ainsi, les informations fournies par le système de navigation
deviennent partiellement obsolètes. D’où
l’intérêt de nouvelles acquisitions d’images
peropératoire (IRM interventionnelle, ultrasonographie ou
échographie, scanner …) (Cf. Chapitre II. 7. e.) permettant au système de
navigation d’assurer une rectification en temps réel et
d’afficher des images corrigées.
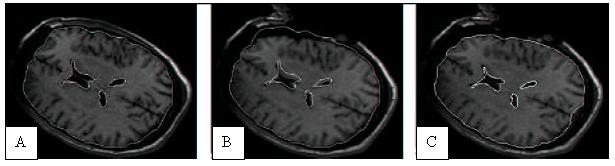
Figure 25 : Illustration du
phénomène de « Brainshift » sur des
Images par Résonnance Magnétique intra opératoire
(IRMi). En A, position du cerveau avant craniotomie avec superposition
du contour du cortex et des ventricules. En C, position du cerveau
après craniotomie avec mise à jour des contours. En B,
superposition des contours avant craniotomie et de l’image après
celle-ci.
retour sommaire
Les
constructeurs doivent se plier à la réglementation
française et fournir des instruments adaptés à
cette réglementation.
Les
méthodes de stérilisation dépendent tout d’abord
de l’utilisation du système de repérage, actif ou passif.
Les
outils chirurgicaux utilisant le principe actif sont parfaitement
autoclavables et permettent ainsi de respecter la législation
française en vigueur en matière de stérilisation.
Les éléments du système dit passif (sphères
ou boules en plastique recouvertes de films et utilisées pour
les caméras) ne sont stérilisables qu’au gaz à la
fabrication (elles sont livrées sous double emballage
stérile).
Le
traitement de surface réfléchissant des sphères
est détérioré lors des cycles de
stérilisation imposés. Il faut donc considérer les
marqueurs passifs comme des consommables, ce qui augmente les
coûts d’intervention.
Les
fournisseurs proposent différentes méthodes de navigation
dans l’interface graphique de la console. Ceux-ci ont un impact direct
sur les règles d’asepsie. En effet, le neurochirurgien à
la possibilité d’utiliser des écrans tactiles que l’on
devra alors recouvrir d’une housse (figure 26).

Il
existe cependant d’autres méthodes, comme l’utilisation d’une
souris, la détection du mouvement de l’instrument chirurgical
[Annexe 2]...
La commande vocale serait une autre alternative.
retour sommaire
Il
est important de tenir compte de l’environnement direct avec le
système de chirurgie guidée par l’image afin
d’élaborer une réflexion sur l’aménagement de
l’espace du bloc opératoire et des problèmes de
compatibilité avec les dispositifs voisins. En voici quelques
exemples.
Il
existe des systèmes de navigation associant le microscope
opératoire. Partie intégrante des
salles d’opération en neurochirurgie, le microscope
opératoire permet une visualisation adéquate du cerveau
et des structures associées lors des chirurgies.
Le
support de ce dernier peut être motorisé et ainsi fournir
au chirurgien une aide au déplacement. Pour pouvoir utiliser le
microscope comme dispositif de repérage, il est
nécessaire que celui-ci renvoie l’information de la position du
point focal dans l’espace. En effet, le point focal ne se situe pas
forcément sur la structure où est effectuée la
mise au point (le chirurgien visualise nettement les objets sur
toute la profondeur de champ et non pas seulement au point focal).
Ainsi, l’erreur commise peut être de quelques centimètres [22]. A partir de ces systèmes, on peut
donc afficher la position du point focal sur les images
préopératoires. Ainsi, le microscope devient un outil de
repérage. Le chirurgien peut donc à chaque instant
connaître sa position dans le cerveau. Il est également
possible de superposer le contourage réalisé pendant le
pré planning dans l’optique du microscope chirurgical
(Exemple : figure 27 SurgiScope® [1]).
Figure 27 : Microscope opératoire
SurgiScope®
retour sommaire
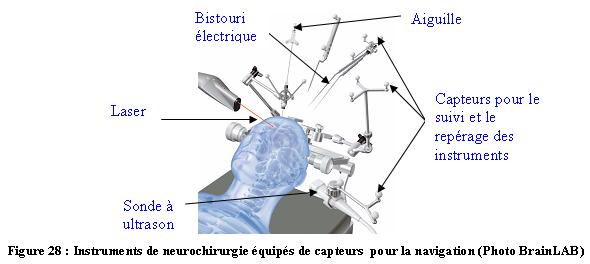
Pour que le système de navigation puisse suivre les actes
du neurochirurgien lors de son intervention, il est nécessaire
d’équiper son instrumentation opératoire de capteurs
(boules). Par conséquent, il faut tenir compte de
l’adaptabilité des systèmes de capteurs aux instruments
chirurgicaux (figure 28 et 29).
retour sommaire
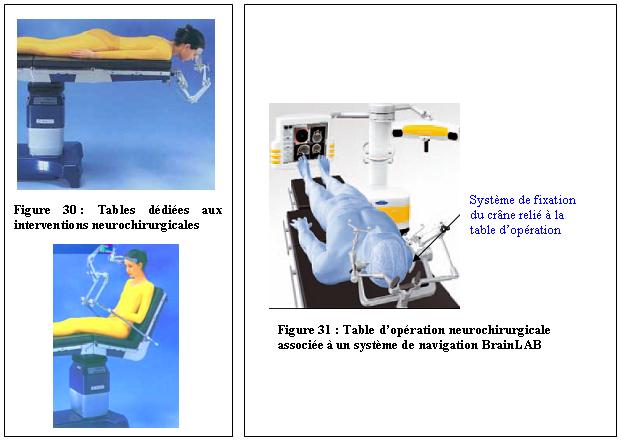
Les
tables d’opération font partie de l’environnement des
systèmes de navigation et jouent un rôle important. En
effet, souvent équipées de cadres
stéréotaxiques fixés au niveau de la tête
(figure 30 et 31), elles
permettent l’immobilité du patient
pendant la durée de l’intervention neurochirurgicale. Elles
doivent être adaptées au système d’imagerie
peropératoire.
retour sommaire
Ils
permettent de positionner automatiquement divers instruments tel qu’un
neuroendoscope. L’intérêt étant toujours de
faciliter la manipulation des instruments pour le neurochirurgien et
ses assistants. Par conséquent, ils
sont équipés d’un bras porteur d’instruments et sont soit
commandés par le praticien par le biais d’une pédale ou
par commande vocale, soit pilotés par un système de
navigation pour le calcul des coordonnées dans l’espace de
l’instrument. Le développement actuel des « Operating
Rooms » induit une évolution des interfaces
homme/instrument. De ce fait, il est possible de nos jours de suivre
les mouvements de la tête du Neurochirurgien grâce à
un pointeur fixé sur son casque qui seront transmis au bras
support de l’endoscope. L’analyse des mouvements de la tête
du Neurochirurgien d’une part et de ses instruments d’autre part,
permet un repositionnement du bras robotisé afin d’offrir un
meilleur champ de vue ou angle de vision.
Exemples
de systèmes de positionnement [3] :
-
AESOP (Computer Motion) et EndoAssist (Armstrong Healthcare) :
positionnement d’endoscope.
- NEURO2000 (Zeiss), SurgiScope® et
ViewScope : positionnement de microscope.
retour sommaire
L’ensemble
des imageurs, présentés par la suite, sont
utilisés en peropératoire afin de corriger les images
préopératoires devenues obsolètes au cours de
l’opération. En effet, l’intervention du neurochirurgien induit
une modification de la structure des tissus cérébraux et
ce dès la craniotomie (voir paragraphe
II.5.b). Par conséquent, les images prises du patient avant
l’opération ne représentent plus la position
réelle des structures et nécessitent une correction. La
solution à ce phénomène est le couplage du
système de navigation en neurochirurgie à un dispositif
d’imagerie peropératoire.
Figure 32 : IRM per-
opératoire bas champ Polestar Medtronic
Cette technique d’imagerie n’est certes pas performante en terme
de résolution spatiale mais elle suffit pour être
exploitée par les systèmes de neurochirurgie
guidée par l’image. Elle possède l’avantage que les
neurochirurgiens peuvent évoluer dans un environnement
faiblement magnétique (0,12 Teslas pour le système Odin
Polestar N10 de Medtronic [23]) qui permet
l’utilisation d’instruments ferromagnétiques. De plus, sa
capacité à se rétracter en position basse sous la
table opératoire permet un gain de place. Il coûte 30%
moins cher qu’un dispositif IRM classique (le coût de maintenance
avoisine les 76 000€). [Annexe 1]
- L’IRM
interventionelle peropératoire (figure 33):
Figure 33 : IRM interventionelle
Siemens dédiée à la neurochirurgie
Dans
le cas de l’IRM interventionnelle, l’antenne se placera toujours autour
du champ opératoire pour obtenir une image optimale de la zone
à traiter.
Dans
le cas d’un IRM fermé, les gestes chirurgicaux sont
effectués en dehors de l’aimant. L’IRM permet des
contrôles successifs pendant l’opération.
|
Avantages
|
Inconvénients
|
|
-
non ionisante
-
résolution
millimétrique
-
excellent pouvoir contraste
tissulaire
-
acquisitions multi plans 3D
-
rapide (10 minutes [17])
|
-
objets ferromagnétiques
interdits (pacemakers…)
-
achat d’instrumentation
amagnétique
-
appareil à installer dans
une salle d’intervention dédiée (cage de faraday,
aménagement, appareillage compatible IRM…)
|
Tableau
2 : Avantages et inconvénients de l’IRM
interventionnelle
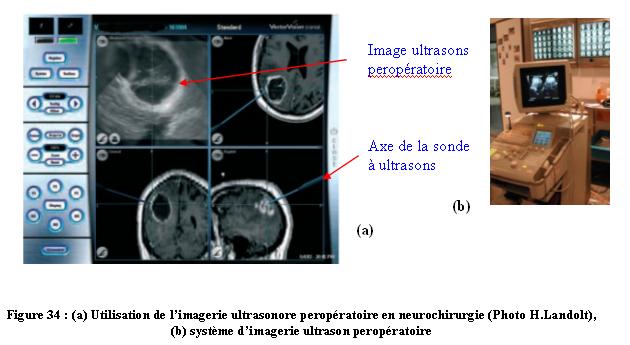
- l’ultrasonographie
peropératoire (figure 34)
L’ultrasonographie
peropératoire est basée sur les techniques d’imagerie par
ultrasons classiques. Elle vient en complément de l’imagerie préopératoire IRM ou
TDM. Elle doit être placée sur le cortex
cérébral (étant inopérante sur l’os). Les
données recueillies permettent de recaler le système de
navigation en neurochirurgie à mesure que l’image de
référence perd de sa valeur avec la résection
tumorale. Un suivi de certains instruments est aussi possible [16] ainsi qu’une imagerie
vasculaire peropératoire avec la technologie écho
doppler. Cette technologie est relativement récente mais n’est
pas systématique. Le projet IRIS [24] développe
l’utilisation de l’ultrasonographie 3D en peropératoire.
D’autres
systèmes d’imagerie sont encore utilisés ; comme la
Tomodensitométrie ou le CT.Scan (Computerised Tomography
Scanner) [16], la fluoroscopie [3]
(pour la fluoronavigation)…
retour sommaire
Les
industriels orientent leurs recherches vers le développement de
systèmes « clé en main »
intégrant les systèmes de neuronavigation.
Petit à petit, on s’oriente vers une situation ou le
neurochirurgien aura tous les outils en main pour réaliser son
opération dans des conditions optimales, tant au niveau de
l’accessibilité des dispositifs médicaux (commandes
vocales, écran tactiles) que de leur ergonomie, fiabilité
et robustesse. Cette conception du bloc opératoire du futur
induit un risque majeur pour le service biomédical en charge de
leur installation. Ce risque repose sur les problèmes de
compatibilité du système de neurochirurgie guidée
par l’image avec l’appareillage environnant (Cf. Chap. III. 3.). La pression des lobbies
industriels (partenariats, contrats de maintenance…) est une
difficulté supplémentaire à prendre en compte. Les
ingénieurs biomédicaux sont en droit de se demander
quelles seront leurs libertés au niveau de
l’évolutivité de tels aménagements,
paramètre primordial de nos jours étant donné la
rapidité de l’évolution des technologies et des enjeux
économiques impliqués.
retour sommaire
Cette
partie à pour but de donner une idée de ce à quoi
peut ressembler un bloc opératoire intégrant un
système de neurochirurgie guidée par l’image au
21ème siècle (et non pas de le promouvoir). Le concept
clé en main présenté nommé BrainSuite®
iMRI (figure 35) est développé par
la
société BrainLAB (Prix du
bloc intégral : 5 à 6 millions d’euros [Annexe 1].
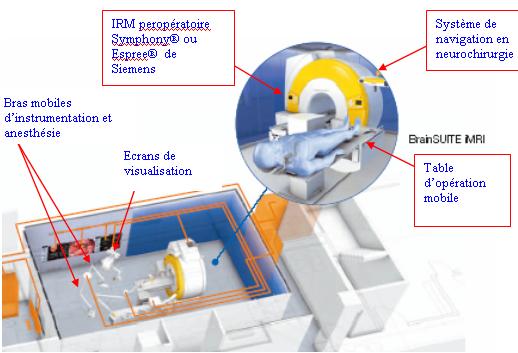
(a)

Figure 35 : (a) et (b) Modèle
d’intégration d’un système de navigation en
neurochirurgie dans un bloc opératoire équipé d’un
système IRM
retour sommaire
L’introduction
des systèmes de chirurgie guidée par l’image au bloc
opératoire n’est pas uniquement une avancée
technologique, c’est aussi une révolution organisationnelle de
par :
- la
formation du personnel au matériel
- les
nouvelles règles d’asepsie
- la
réticence à la manipulation du matériel
informatique
- la
difficulté dans la programmation des interventions
- la
prise en charge de tels systèmes en urgence
Elle
entraîne également des contraintes architecturales
d’aménagement de l’espace et de conception du bloc
opératoire. Il est possible d’intégrer les
systèmes de neuronavigation dans
les blocs actuels mais il faut rester prudent et rigoureux quant
à la conception des futures salles qui devront tenir compte de
contraintes architecturales, telles que :
- l’estimation
de l’occupation de l’espace des dispositifs du bloc opératoire
- l’installation
du système d’imagerie peropératoire et sa
compatibilité avec le système de neuronavigation
(champ magnétique pour l’IRM peropératoire…)
- le
passage des câbles d’alimentation électrique, de
réseau informatique …
- les
compatibilités des réseaux de communication
(Système d’Information Hospitalier SIH, Système
d’Information Radiologique SIR, Systèmes PACS ou Picture
Archiving & Communication System, formats et transferts d’images…)
- les
possibilités de mise en place de
téléconférence et téléformation
autour du système de neurochirurgie guidée par l’image.
Enfin,
la gestion du temps entre aussi en compte. D’une part, le choix d’une
intervention en Neurochirurgie avec un système de neuronavigation requiert une immobilisation
temporelle du dispositif médical relativement longue. D’autre
part, le déploiement national des systèmes de neuronavigation au niveau des
établissements de santé implique un partage
éventuel entre différentes équipes ou
spécialités de l’établissement et parfois
même des structures voisines.
retour sommaire
Les
laboratoires français ou internationaux se penchent aujourd’hui
sur les deux inconvénients majeurs des systèmes de
navigation en neurochirurgie ou des procédures
neurochirurgicales guidées par l’image. Ils ne s’appuient pas
vraiment sur une connaissance du geste chirurgical réel et ne
tiennent pas encore compte des modifications de l’anatomie du cerveau
du patient lors de l’intervention neurochirurgicale. Par
conséquent, le défi est d’appuyer la conception des
nouveaux systèmes de neuronavigation
sur une modélisation des procédures chirurgicales en les
décomposant en étapes associées à une
action. Dans un second temps, il faudra tenir compte des mouvements de
la matière pendant l’opération en mettant à jour
les images préopératoires grâce à la
détection et à la quantification de ces mouvements.
L’outil adéquat est la modélisation mathématique
des propriétés biomécaniques des tissus
cérébraux ainsi que l’association de l’imagerie
peropératoire telle que l’IRM. Néanmoins, il n’existe
toujours pas de solution totalement satisfaisante pour pallier à
ce problème. C’est pourquoi tous les efforts en terme de
recherche sont concentrés vers cette problématique qui
relève de l’informatique et des techniques de
modélisation. Le service de Neurochirurgie de Rennes et le
laboratoire IDM (Intégration de Données
Multimédia) de l’Université I de Rennes travaillent sur
de tels projets d’amélioration des systèmes de navigation
en neurochirurgie. [25]
Les
autres thèmes de recherche d’actualité sont :
-
La correction automatique, en temps
réel des images peropératoires IRM (Universités de
Liège et de Bruxelles) [17]
-
Les nouvelles possibilités
d’extension des systèmes de navigation à des simulateurs
-
L’utilisation de l’IRMf
peropératoire (inconvénients : malade
éveillé, temps trop long de 45 min, champ
magnétique trop important de 3T [17])
-
Le couplage des systèmes
de navigation aux nouvelles techniques d’imagerie du type TEP (imagerie
fonctionnelle permettant de localiser les tumeurs grâce à
leur consommation en glucose. Utilisation du marqueur [18F]
FDG), tractographie IRM (permettant la localisation des faisceaux de
neurones qui peuvent être comprimés ou
déplacés par une tumeur, leur position anatomique est
alors anormale)
-
La fusion des modalités d’imagerie
-
La création de nouveaux atlas
anatomiques
-
Le développement de l’approche
réseau et l’intégration des systèmes de neuronavigation à ces réseaux
(intégration aux SIH, SIR …)
-
La conception de nouveaux capteurs
dédiés à la neuronavigation
en neurochirurgie
-
Le développement de nouveaux
algorithmes mathématiques de correction des images, plus
performants et plus rapides [Annexe 1]
- ...
…
retour sommaire
Les
systèmes de navigation en neurochirurgie sont aujourd’hui des
technologies de pointe approuvées par un grand nombre de
neurochirurgiens et de scientifiques. En effet, même si leur
bénéfice en terme de coût et de temps pour les
établissements de santé reste à démontrer,
leur avantage est certain concernant le
patient (temps d’hospitalisation diminué, complications
postopératoires minimisées,…).
L’attrait
des neurochirurgiens pour cette technologie se ressent par le nombre de
services de neurochirurgie équipés dans les centres
hospitaliers publics (92% de services en sont dotés et ont
accès à un système de neuronavigation
en France) [ Annexe
1]. Cependant,
cela implique une réorganisation du bloc opératoire
notamment suite à l’implantation de concepts
« clé en main » intégrant un
équipement d’imagerie peropératoire (IRM, CT…).
Aujourd’hui,
l’évolution de ces systèmes est surtout liée au
progrès de l’informatique et au développement de nombreux
logiciels et algorithmes toujours plus performants.
Bien
que le rôle de la technologie soit de plus en plus
prépondérant, le neurochirurgien ne doit pas être
asservi par la machine mais seulement guidé et rester
maître de ses actes.
A
l’heure actuelle, « Les systèmes de neuronavigation sont au neurochirurgien ce que
le microscope est au biologiste, autrement dit un outil d’aide quasi
indispensable ».
Néanmoins,
on est en droit de se demander ce que sera l’avenir des systèmes
de navigation en neurochirurgie concernant l’exérèse des
tumeurs compte tenu de l’évolution de la recherche en
génie génétique [17] :
thérapies géniques, immunothérapie et
vaccinothérapie…
retour sommaire
Revues
scientifiques :
[2] Stéphane
Lavallée. Gestes médico-chirurgicaux assistés par
ordinateur (GMCAO), ITBM, Novembre 1999, vol. 20, supplément
n°1, ISSN 0243-7228
[3] A. –F Fay, J.-P. Perrin,
E. Féry-Lemonnier. Classification des systèmes de
robotique chirurgicale et de chirurgie assistée par ordinateur. ITBM-RBM, 2002, 23, 326-332
[4] L. Bourgeois, M.
Decouvelaere, Chirurgie assistée par ordinateur : les
télémanipulateurs chirurgicaux. ITBM-RBM, 2004, 25, 14-27
[14] Di Donato P, Bergery A,
Largillière S, Lemaire JJ. La neuronavigation :
principe et intérêt. ITBM-RBM 2000 ; 21 : 70-7
[19] Eric
Grimson, Image Guided Surgery, Artificial Intelligence Laboratory, MIT,
Cambridge MA Michael Leventon, Stanford University, Palo Alto CA, Ron
Kikinis, Brigham and Women's Hospital, Boston MA, welg@ai.mit.edu
[23] Utilisation de l’IRM
intra-opératoire dans la neurochirurgie guidée par
l’image, A.L Benabid, ITBM-RBM news juin-juillet 2005-vol 26-N° 3-4
[27] Pierrick
Coupé, Pierre Hellier and Christian Barillot. Etat de l’art des méthodes de
correction des déformations cérébrales
peropératoires, rapport de recherche, Juin 2005, INRIA Rennes,
N°5589, 51 p, ISSN 0249-6399
[28] H. Landolt,
Neurochirurgie : neuronavigation,
must pour la neurochirurgie ? Ou expédition dans
l’incertain…, Traduit par le Dr G-A. Berger, Highlights 2003, Forum Med
Suisse, N° 52-52, 17
Rapports de stage et
Travaux :
[5] Stéphane LITRICO.
Assistance Robotique à la chirurgie hypophysaire, rapport de
Stage, DEA SIC Image Vision, Nice Sophia Antipolis, septembre 2001.
[21] Iracane M., Schwob L.,
Vedoni C., Imagerie de navigation per-opératoire, Fiche
technique, Module d’imagerie, DESS TBH 2001-2002, Université de
technologies de Compiègne
[26] Système de
Neuronavigation - Application et Marketing, A.Isnard, Stage DESS, UTC,
1997, pp 38
Sites Internet :
[1] Surgiscope : http://www.isis-robotics.com/fr/surgiscope.html
[6] Dienst
Neurochirurgie, www.neurochirurgie.be/fr/index.php?Frame=/fr/
body-neuronavigatie.php
[7] Neuronavigation. http://www.chuv.ch/neurochir/nch_home/nch_cliniques
/nch_interventions_adultes/nch_neuronavigation.htm
[8] Fusion de données
en chirurgie guidée par l’image Labo IDM France,
http://idm.univ-rennes1.fr/theme1.html
[13] Réseau N7 CHU
Rouen, http://www.reseau-chu.org/Journal7/Rouen7.htm
[15] Campus numérique
de neurochirurgie société française de
neurochirurgie http://www.unilim.fr/campus-neurochirurgie/
[16] BrainLAB Global Site, www.brainlab.com/download/pdf/BrainLAB_ Neurosurgery_Solutions.pdf
[17] Navigation en mode
virtuel - neurochirurgie - N° 212 - Juin 2005 – Par numéro
Athena, http://recherche-technologie.wallonie.be/xml/doc__fr-IDC-1418-IDD-1669-PROFIL-PART-.html
[18] Utilizing Segmented MRI
Data in Image-Guided Surgery, Grimson, W.E.L., Ettinger, G.J., Kapur,
T., Leventon, M.E., Wells III, W.M. and Kikinis
http://www.ai.mit.edu/projects/medical-vision/surgery/surgical_navigation.html
[20] Dienst Neurochirurgie, www.neurochirurgie.be/fr/index.php?Frame=/fr/
body-neuronavigatie.php
[22] CHUS: www.neurochirurgie.ca/freepage.php?page=3
[24] Precarn
– Ultrason tridimensionnel à l’appui d’interventions
fondées sur l’image (TULIP), www.precarn.ca/IRIS/IRISphase3projects/itemqCobQzA
UgA_fr.html
[25] Laboratoire IDM, http://sim3.univ-rennes1.fr/recherche.html
Medtronic, www.medtronic.com
Medtronic ENT, www.xomed.com
www.spineuniverse.com
Radionics : Image guided surgery,
http://www.radionics.com/default-igs.shtml
Réglementation et
normes :
[9] Norme EN 6000, http://sagaweb.afnor.fr/Default.asp?cookie%5Ftest= 32818416
[10] Food and
Drug Administration, http://www.fda.gov/
[11] Agence Française
de Sécurité Sanitaire des Produits de Santé,
http://afssaps.sante.fr/
[12] Code des marchés
publics, http://www.legifrance.gouv.fr/
Cours :
Cours Master2 Management des Technologies en
Santé Université de Technologies de Compiègne,
année 2005-2006, Mr Vigneron
retour sommaire
Figures
Figure 1:
Cadre
stéréotaxique appliqué sur la tête du patient
(Source :
www.nvvn.org)
Figure 2
:
Système de neuronavigation Omnisight Excel™ de Radionics™
(Source : www.radionics.com/products/frameless/omnisight/omnisight-brochure.pdf
)
Figure 3
:
Système de neuronavigation StealthStation® TREON™ Medtronic
(Source :
www.spineuniverse.com/displayarticle.php/article728.html)
Figure 4
: Le robot
chirurgical DA VINCI®
(source :
www.utc.fr/~farges/DESS_TBH/99-00/projets/robots/robots.htm)
Figure
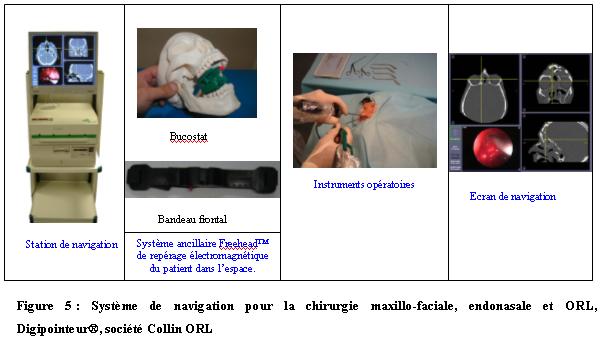
5 :
Système de navigation pour la chirurgie maxillo-faciale,
endonasale et ORL, Digipointeur®, société Collin ORL
(Source :
www.collin-orl.com/index.php?rub=digipointeur)
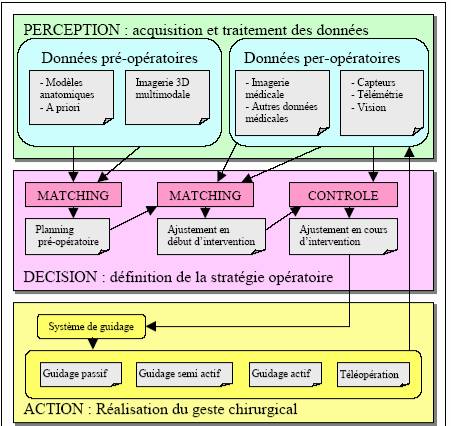
Figure 6
: La boucle
Perception/Décision/Action
(Source P.Cinquin &
Al. IMAG Grenoble)
Figure
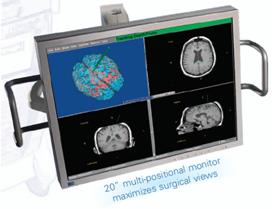
7 : Affichage
d’une console de planning/navigation (Photo BrainLAB).
(Source :
www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
8 : les
étapes de l’utilisation d’un système de neuronavigation en phase peropératoire
(Source :
www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf , www.medtronic.com, www.nrc-cnrc.gc.ca)
Figure
9 :
Représentation d’un méningiome en neuronavigation
multimodalité (Laboratoire IDM
RENNES-France)
(Source :
idm.univ-rennes1.fr/theme1.html)
Figure
10 : Cadre
stéréotaxique
(Source :
www.ulb.ac.be.erasme.fr)
Figure
11 : marqueurs
collés sur la tête du patient
(Source :
www.neurochirurgie.be/fr/index.php?frame=/fr/body-neuronavigatie.php)
Figure
12 :
Identification de la position du patient par pointeur
(Digipointeur® Collin ORL)
(Source :
www.collin-orl.com/index.php?rub=digipointeur)
Figure
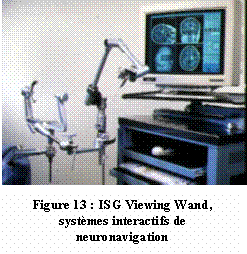
13 : ISG
Viewing Wand, systèmes interactifs de neuronavigation
(Source : www.neurochirurgie.be/fr/index.php?frame=/fr/body-neuronavigatie.php)
Figure
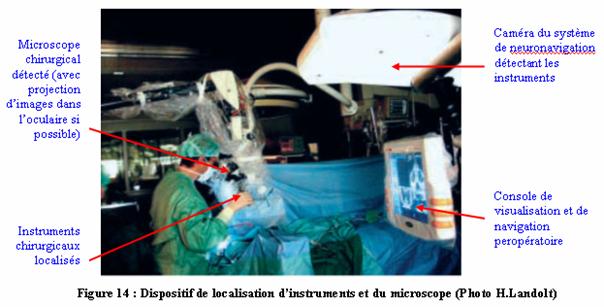
14 :
Dispositif de localisation d’instruments et du microscope (Photo
H.Landolt)
(Source :
www.medicalforum.ch/pdf/pdf_f/2003/2003-51/2003-51-256.PDF)
Figure
15 : Principe
de triangulation des systèmes de repérage
(Source : www.radionics.com/products/frameless/omnisight/omnisight-brochure.pdf
et www.medtronic.com)
Figure
16 : Stations
informatiques de préplanning VectorVision® (a) et (b)
(Source :
www.neurochirurgie.be/fr/index.php?frame=/fr/body-neuronavigatie.php)
Figure
17 : console
de pré planning mobile iPLAN®
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
18 : Station
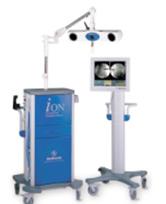
de navigation The StealthStation® ION™
(Source :
www.spineuniverse.com/displayarticle.php/article726.html)
Figure 19
:
Système de neuronavigation Omnisight Excel™ de Radionics™
(Source : www.radionics.com/products/frameless/omnisight/omnisight-brochure.pdf
)
Figure
20 : Affichage
des paramètres de pré planning sur la console de
navigation
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
21 :
Système de navigation Kolibri® BrainLAB
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
22 :
Système de navigation VectorVision® Compact BrainLAB
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
23 :
Système de navigation VectorVision2® BrainLAB
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
24 :
Système de neuronavigation VectorVision® Sky
& Data Panel de BrainLAB
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
25 : Illustration
du phénomène de « Brainshift » sur
des Images par Résonnance Magnétique
intraopératoire (IRMi).
(Source :
Photo brainshift Pierrick Coupé, Pierre Hellier and Christian
Barillot. Etat
de l’art des methods de correction des deformations
cérébrales peropératoires, rapport de recherche,
Juin 2005, INRIA Rennes, N°5589, 51 p, ISSN
0249-6399)
Figure
26 : Console
de navigation BrainLAB Photo H. Landolt
(Source :
www.medicalforum.ch/pdf/pdf_f/2003/2003-51/2003-51-256.PDF)
Figure
27 :
Microscope opératoire SurgiScope®
(Source :
www.isis-robotics.com/fr/surgiscope.html )
Figure
28 :
Instruments de neurochirurgie équipés de capteurs pour la navigation (Photo BrainLAB)
(Source :
www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure 29
:
Instruments de neurochirurgie équipés de capteurs pour la navigation (Photo Medtronic Sofamor
Danek)
(Source :
www.spineuniverse.com/displayarticle.php/article728.html)
Figure
30 : Tables
dédiées aux interventions neurochirurgicales
(Source :
www.medproducts.com2)
Figure
31 : Table
d’opération neurochirurgicale associée à un
système de navigation BrainLAB
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure
32 : IRM
peropératoire bas champ Polestar Medtronic
(Source :
www.ulb.ac.be/erasme/fr/actualites/communiques/polestar-n10-conferencedepresse.htm)
Figure
33 : IRM
interventionelle Siemens dédiée à la
neurochirurgie
(Source :
www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Figure 34
: (a)
Utilisation de l’imagerie ultrasonore peropératoire en
neurochirurgie (Photo H.Landolt) (Source :
www.medicalforum.ch/pdf/pdf_f/2003/2003-51/2003-51-256.PDF), (b)
système d’imagerie ultrason peropératoire
(Source :
www.neurochirurgie.ca/freepage.php?page=3)
Figure
35 : (a) et
(b) Modèle d’intégration d’un système de
navigation en neurochirurgie dans un bloc opératoire
équipé d’un système IRM
(Source : www.brainlab.com/download/pdf/BrainLAB_Neurosurgery_Solutions.pdf)
Tableaux
Tableau
1 : Avantages et inconvénients des systèmes de
repérage en navigation
Tableau
2 : Avantages et inconvénients de l’IRM interventionnelle