Master Qualité - Communication
publique des résultats d'un projet d'intégration
Master Qualité
- UTC - rue du docteur Schweitzer - CS 60319 - 60203
COMPIEGNE Cedex - France - master-qualite@utc.fr - Téll : +33 (0)3 44 23 44 23
|
|
Avertissement : Si vous arrivez directement sur cette page, sachez
que ce travail est un rapport d'étudiants et doit être
pris comme tel. Il peut donc comporter des
imperfections ou des imprécisions que le lecteur doit
admettre et donc supporter. Il a été réalisé pendant
la période de formation et constitue avant-tout un
travail de compilation bibliographique, d'initiation
et d'analyse sur des thématiques associées aux
concepts, méthodes, outils et expériences sur les
démarches qualité dans les organisations. Nous ne
faisons aucun usage commercial et la duplication est
libre. Si, malgré nos
précautions, vous avez des raisons de contester ce
droit d'usage, merci de nous
en faire part, nous nous efforcerons d'y
apporter une réponse rapide. L'objectif de la
présentation sur le Web est de permettre l'accès à
l'information et d'augmenter ainsi les échanges
professionnels. En cas d'usage du document, n'oubliez
pas de le citer comme source bibliographique.
Bonne lecture... |
Nouvelle ISO 9001 (2015) et future ISO
13485 (2016) :
Mutualisation des exigences et outil bi-diagnostic pour la performance des entreprises biomédicales |

Amine Harkani
|

Sansan Kambou
|

Alyssa Kouiten
|

Gustave
Noulaquape
|

Hamdi
Ben-Charrada
|

Ted Julien Tchinde
|
Référence
bibliographique à rappeler pour tout usage :
Nouvelle ISO 9001 et future ISO 13485 : mutualisation des
exigences et outil bi-diagnostic pour la performance des
entreprises biomédicales ,
Alyssa Kouiten, Amine Harkani, Gustave Noulaquape, Hamdi Ben
Cherrada, Sansan Kambou, Ted Tchinde,
Université de Technologie de
Compiègne ; Master Qualité et Performance dans les Organisations (QPO) ; Master Technologies et
Territoires de Santé (TTS) ; Mastère Spécialisé Normalisation, Qualité, Certification,
Essai (NQCE)
Mémoire d'Intelligence Méthodologique du projet
d'intégration, janvier 2015, www.utc.fr/master-qualite,
puis "Travaux", "Qualité-Management", réf n°339, https://doi.org/10.34746/rmvg-mk69
|
RESUME
La double
certification ISO 13485 et ISO 9001 des entreprises
biomédicales représente un
avantage concurrentiel face à l’environnement économique
et au marché des
dispositifs médicaux. ISO 13485 définit les exigences du
système de management
de la qualité (SMQ) pour les entreprises biomédicales.
Elle contribue de façon
importante à l’obtention du marquage CE obligatoire pour
la libre circulation
des produits en Europe. L’ISO 9001 dont le principe
fondamental est la
satisfaction client apporte quant à elle, le support
nécessaire pour une
gestion efficace et la maitrise des processus des
organisations. Dans le cadre
de nouvelles réformes, une révision des deux normes a
été élaborée. La nouvelle
version de la norme ISO 9001 est parue en septembre
2015. La norme ISO 13485
est disponible sous la forme FDIS et sera probablement
rendue officielle en
2016. Le but de ce projet consiste à réaliser un outil
bi-diagnostic construit
sur la base des exigences mutualisées des deux normes
pour permettre aux
entreprises biomédicales de vérifier la conformité de
leur SMQ par rapport aux
nouvelles versions. Cet outil pleur
permettra alors de mettre en place la démarche
Visualiser, Identifier,
Spécifier, Agir (VISA) pour avoir un SMQ plus
performant.
Mots-clefs : FDIS ISO 13485,
ISO 9001 :2015, outil d’auto diagnostic, VISA,
marquage CE, entreprises biomédicales.
|
|
ABSTRACT
Both
ISO 13485 and ISO 9001
certification is a competitive advantage for
biomedical companies face the
economic environment. ISO 13485 specifies the
requirements of the quality
management system (QMS) for biomedical companies. It
contributes significantly
to the CE Marking approval required for the free
movement of products in
Europe. ISO 9001 whose fundamental principle is
customer satisfaction brings
meanwhile, the support necessary for effective
management and mastery of the
organizations processes. Under the new reforms, a
review of the two standards
was developed. The new version of ISO 9001 was
published in september 2015. ISO
13485 is available as FDIS form and will probably be
made official in 2016. The
goal of this project is to achieve a bi-diagnostic
tool built on the basis of
pooled requirements of both standards to enable
biomedical companies to verify
compliance of their QMS in relation to new versions.
This tool will help
companies to implement the approach View, Identify,
specify, Act (VISA) for a
more efficient QMS.
Keywords: FDIS ISO 13485, ISO
9001 :2015, self-assessment, VISA, CE marking,
biomedical companies. |
Remerciements
Nous Remercions M. Isabelle Claude et Mr.
Gilbert Farges pour leurs encadrements tout au long du projet.
Glossaire
- Dispositif médical : C’est un
instrument, appareil, équipement ou encore un logiciel destiné,
par son fabricant, à être utilisé chez l’homme à des fins,
notamment, de diagnostic, de prévention, de contrôle, de
traitement, d’atténuation d’une maladie ou d’une blessure.
(Directive 93/42/CEE relative aux dispositifs médicaux)
- Exigences : Expression d'un besoin documenté sur ce
qu'un produit ou un service particulier devraient être ou
faire.
- Mutualiser : action qui consiste à regrouper des moyens
financiers, humais, organisationnels, etc., dans le but
d’optimiser une procédure ou diminuer les couts d’un projet.
- Management de la Qualité : Le
management de la qualité, ou gestion de la qualité, est une
discipline du management regroupant l'ensemble des concepts et
méthodes visant à maîtriser ou/et améliorer la
qualité produite par une organisation.
- Norme : Une norme est un document qui définit des
exigences, des spécifications, des lignes directrices ou des
caractéristiques à utiliser systématiquement pour assurer
l'aptitude à l'emploi des matériaux, produits, processus et
services. (ISO 9000 :2005)
- Performance : Résultat obtenu dans l'exécution d'une
tâche.
- Processus : un ensemble d'activités corrélées ou
interactives qui transforme des éléments d'entrée en éléments de
sortie (norme ISO 9000:2005).
- Qualité: Selon L’ISO 9000, la qualité peut être définie
comme l’aptitude d'un ensemble de caractéristiques intrinsèques
à satisfaire des exigences
Liste des abréviations
- DIS: Draft International Standardization
- FDIS: FinalDraft International Standardization
- DM : Dispositif Médical
- ISO: International Organization for Standardization
- MIM : Mémoire d’Intelligence
Méthodologique
- NQCE : Normalisation,
Qualité, Certification,
Essai.
- NF EN : Norme Française – Norme Européenne
- PDS : Planification Dynamique Stratégique
- QQOQCP : Qui, Quoi, Où, Quand, Comment, Pourquoi
- QPO : Qualité et Performance
des Organisations
- QPO12 : Communication de projets
- SMQ : Systéme de Mnagement de la Qualité
- TTS : Technologies et
Territoires de Santé
Introduction
Chapitre I :
Entreprises biomédicales, normes ISO 9001, ISO 13485 et Enjeux
de la certification.
I.1 Les
entreprises biomédicales
I.2 La norme ISO
9001 systèmes de management de la qualité
a)
De ISO 9001 :2008 à ISO 9001 :2015
I.3 La norme ISO
13485 Dispositifs Médicaux- système de management de la qualité
a)
De ISO 13485 :2003 à FDIS ISO 13485
I-4) La norme
ISO 9001 :2015 et FDIS ISO 13485
I-5) Les
enjeux de la certification ISO 9001 et ISO 13485 pour les
entreprises biomédicales
a) Enjeux
économiques
b) Enjeux sociaux
c)
La population d’entreprise concernés par la double
certification ISO 9001 et ISO 13485
Chapitre
II : Méthodologie de mutualisation des exigences et de
construction de l’outil d’auto diagnostic
II.1) Démarche
de mutualisation des exigences des normes ISO 9001 :2015 et FDIS
ISO 13485
II.2) Démarche de conception de l’outil d’auto diagnostic.
a)
La structure de l’outil d’auto diagnostic
b) La structure de l’évaluation
Chapitre
III: La démarche Visualiser, Identifier, Spécifier, Agir
(VISA)
III.1)
Caractéristiques de l’outil d’auto diagnostic.
III.2) L’outil d’auto diagnostic au service de la démarche
VISA.
Conclusion
Références
Bibliographiques
Pour les
entreprises biomédicales, les normes ont pour objectifs de cadrer
l’aspect réglementaire des dispositifs médicaux afin d’assurer la
sécurité des consommateurs et l’accomplissement de la fonction
prévue du produit. Certaines d’entre elles sont à appliquer pour
tous les types des dispositifs médicaux comme l’ISO 14971
pour la gestion des risques, d’autres sont spécifiques à un
certain type de DM comme l’ISO 8359 pour les Concentrateurs
d’oxygène.
Ce document va être centré sur deux principales normes : FDIS ISO
13485 Dispositifs médicaux — Systèmes de management de la qualité
— Exigences à des fins réglementaires et NF EN ISO 9001 (2015)
Systèmes de management de la qualité - Exigences.
L’ISO 13485 est une norme harmonisée,
obligatoire pour l’obtention du marquage CE ; elle est la
déclinaison de la norme ISO 9001 pour les entreprises de
dispositifs médicaux. Relativement au cycle de vie des dispositifs
médicaux, il est important pour les entreprises de respecter à la
fois les exigences relatives à la norme ISO 9001 et celles
relatives à la norme ISO 13485.
Le présent projet vise à faciliter le processus
de certification aux deux normes, à travers l’exploitation d’un
outil d’auto diagnostic compatible pour les deux référentiels. Le
rapport est divisé en trois parties, tout d’abord, la description
du contexte socio-économique des entreprises biomédicales et les
enjeux de la double certification ISO 9001 et ISO 13485 ; la
deuxième partie présente les évolutions des deux normes et la
méthodologie de résolution du problème, la dernière partie
présente la démarche Visualiser, Identifier, Spécifier, Agir
(VISA) qui exploite l’outil d’auto diagnostic conçu pour un
système de management de la qualité plus performant et plus
robuste.
retour sommaire
Chapitre
1 : Entreprises
biomédicales, normes ISO 9001, ISO 13485 et Enjeux de la
certification.
I.1 Les entreprises biomédicales
La France
compte approximativement 1100 entreprises des dispositifs
médicaux, avec un marché global d’environ 20 Milliards d’euro [2].
Elles interviennent essentiellement au niveau de la recherche, du
développement (R&D), de la conception et à faible proportion
pour la commercialisation. La figure 1 présente la
répartition des entreprises biomédicales en France en fonction de
leur taille et de leur secteur d’activité. La couleur bleue
désigne les entreprises qui travaillent en R&D et la couleur
marron, les entreprises qui commercialisent les DM
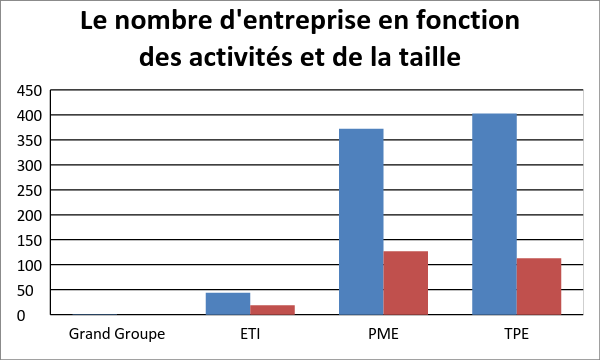
Figure 1 Les domaines
d'application des entreprises de DM en France[2].
Ces entreprises biomédicales doivent démontrer
l’impact thérapeutique favorable des dispositifs médicaux. Ces DM
peuvent être des équipements, des appareils, matière ou produit, à
l’exception des produits d’origine humaine [2]. On distingue
plusieurs catégories de DM :
● les DM à usage unique
● les DM de diagnostic in
vitro
● les DM implantables actifs,
● les équipements médicaux.
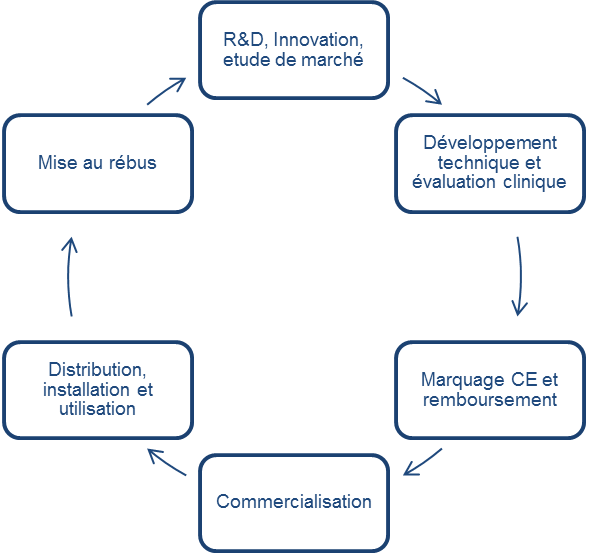
Tel que présenté à la figure suivante, La vie
d’un DM passe par plusieurs étapes, principalement, la
conception, le développement, la production, l’utilisation et la
mise à la réforme. A ces différentes étapes peuvent s’associer,
des prestations telles que le stockage, la distribution,
l'installation et les supports techniques
Figure 2 : Cycle de vie d’un
DM[2].
En considérant
par exemple la phase de conception présentée dans le cycle
ci-dessus, les entreprises doivent vérifier que les produits
remplissent normalement les fonctions pour lesquelles ils ont été
fabriqués à destination des patients et les utilisateurs. De même,
elles doivent s’assurer qu’il n’y a pas de problèmes de sécurité
liés à la fonction du DM. Ces règles sont clairement détaillées
dans les Directives Européennes relatives aux différentes
catégories de dispositifs médicaux. Le respect de ces exigences
est obligatoire pour l’obtention du marquage CE et donc
l’autorisation de mise sur le marché Européen du DM.
Dans un
environnement ou la concurrence est sans cesse croissante et /ou
la sécurité et la satisfaction du client est à la base de la
qualité, il est nécessaire, voire obligatoire pour les entreprises
de démontrer la performance de leurs différents processus de
conception, de production, de fabrication, de communication… il
s’agit en fait de démontrer la performance de leur système de
management.
L’ISO 9001
est la norme principale en matière de système de management de la
qualité. Elle est exploitée dans plusieurs secteurs, l’ISO 13485
est la déclinaison de la norme ISO 9001 dans le cadre des
entreprises de dispositifs médicaux. Ces normes sont décrites dans
la suite de ce document.
retour
sommaire
I.2 La norme ISO 9001, systèmes de management de la qualité
La norme ISO
9001 définit une série d'exigences concernant la mise en place
d'un système de management de la qualité. Elle permet à tout type
d’organisme d’améliorer la satisfaction du client et d’appliquer
l’amélioration continue. Elle est utilisée pour confirmer que
l'organisme à la capacité de fournir des produits ou
des services répondants aux besoins des clients et aux exigences
réglementaires. Avec l'expansion continue de l'économie de marché
et de la mondialisation, l’ISO 9001 renforce la crédibilité du
produit, réduit la duplication des tests, diminue et élimine les
obstacles techniques et protège les intérêts de toutes les parties
(producteurs, distributeurs et consommateurs). L’ISO 9001 est la
norme la plus utilisée dans le monde, d’après une « Etude ISO »
sur la certification ISO 9001. L’ISO comptabilise 1.129.446
certificats ISO 9001 en décembre 2013, soit une augmentation de 3
% par rapport à 2012 [6]. En France, le nombre d’organismes
certifiés ISO 9001 a augmenté de manière considérable entre 1993
(moins de 250 certificats) et 2000 (plus de 20000 certificats), et
ensuite plus progressivement des années 2009 à 2013, ce qui montre
l’importance de cette norme dans la chaîne économique française
[6].
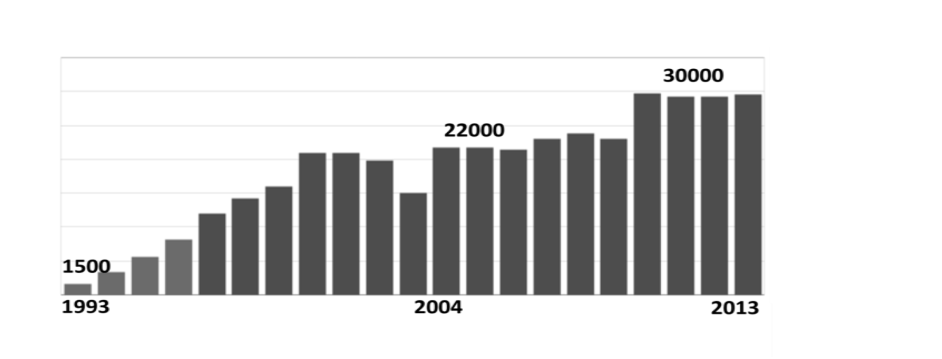
Figure 3 : Nombre de
certificats ISO 9001 en France [6]
La norme ISO
9001 a évolué entre 2008 et 2015, la France dénombre aujourd’hui
environ 29000 entreprises et organismes certifiés ISO 9001 :2008
[4] ; 1000 entreprises étant des acteurs du secteur des
dispositifs médicaux [6]. La dernière version de la norme est
disponible depuis le 24 septembre 2015, une période transitoire de
3 ans est nécessaire pour la mise à jour du système de management
de la qualité de chacune de ces entreprises.
a)
De ISO 9001 :2008 à ISO 9001 :2015
La norme ISO
9001:2015 concerne le système de management de la qualité d’un
organisme ; elle est composée de 10 chapitres alors que l’ancienne
version n’en compte que 8; Cette nouvelle version
comporte 4 articles intitulés différemment par rapport à
l’ancienne version, il s’agit des articles : 4. Contexte de
l'organisme ; 5. Leadership ; 6. Planification ; 9. Évaluation des
performances.
L’article 7 : Support, remplace l’article 6 intitulé
Management des ressources dans la version 2008, l’article 8 :
Réalisation des activités opérationnelles quant à lui
remplace l’article 7 : Réalisation du produit de l’ancienne
version.
La version 2015 est conçue suivant 3 Piliers
fondamentaux : l’approche processus, l’approche par les risques,
l’amélioration continue. L’analyse des risques est la grande
nouveauté de cette version, Le terme risque apparaît 50 fois seul
ou en combinaison avec le mot opportunité [8]; le paragraphe
actions préventives de la version 2008 a quant à lui été
supprimé, le système de management de la qualité et
l'approche par les risques sont considérés comme outil un global
de prévention.
Plusieurs termes ont été
remplacés ou rajoutés [8] :
• procédure
documentée et enregistrement sont remplacés par informations
documentées
• fournisseur est remplacé par prestataire
externe
• exclusion est remplacée par applicabilité
• représentant de la direction n'est plus
utilisé
• Les termes contexte, leadership, prestataire
externe et information documentée apparaissent pour la première
fois
Au total ressortent 309 critéres
("shall"(doit,doivent)) tandis que l’ancienne version n’en
comptait que 305. Les documentations des procédures deviennent des
exigences règlementaires. ISO 9001 :2015 compte 5 procédures et 19
informations documentées contre 6 procédures et 21 enregistrements
dans l’ancienne version.
I.3 La norme ISO 13485 dispositifs médicaux- système de management de la qualité
La norme ISO
13485 spécifie les exigences relatives au système de management de
la qualité appliquées aux entreprises des dispositifs
médicaux. La version DIS2 est disponible depuis mars 2015,
elle a été établie suite au rejet de la première version
en juillet 2014. La version Final Draft International
Standard (FDIS) est disponible depuis novembre 2015. Après
la publication de la version officielle d’ISO 13485 en 2016, les
entreprises biomédicales disposeront d’un délai de 3 ans pour
effectuer une mise à jour de leur système de management de
la qualité.
a)
De ISO 13485 :2003 à FDIS ISO 13485
Cette norme
spécifie les exigences d'un système de management de la qualité
pouvant être utilisé par un organisme impliqué dans une ou
plusieurs phases du cycle de vie d'un dispositif médical ; elle
est composée de 8 chapitres comme l’ancienne version avec la même
structure que l’ISO 9001 :2008 ; la nouvelle version de la
norme met un accent sur les notions : « d’exigences réglementaires
applicables », « d’enregistrements » et « de risques ». La
maîtrise des risques pourra se faire selon l’ISO 14971, mais la
norme ne l’impose pas. Cette Nouvelle version n’évoque pas que les
risques liés à la conformité du produit, mais aussi les
risques pouvant affecter la capacité de l’organisme à
fournir des produits conformes.
Il est
important de noté que, dans le chapitre 3 :
Définitions, la définition de dispositif médical n’est pas
celle de la 93/42/CE mais celle donnée par la GHTF qui n’existe
plus (remplacer par l’IMDRF) [6].
Cette version réclame au minimum un manuel qualité, 18 procédures,
30 enregistrements, et plusieurs autres documents. Le texte
de la norme permet de répertorier au total 375 critéres
("shall"(doit,doivent)). Les procédures doivent être
documentées.
retour
sommaire
I-4) La norme ISO 9001 :2015 et FDIS ISO 13485
Depuis 1987, plusieurs normes ont découlé de la
norme ISO 9001, avec des spécificités dans différents domaines,
notamment le médical, en 2001 à travers la norme ISO 13485.
Initialement Basées sur la même structure, les deux normes
étaient modifiées en conservant à chaque fois cette
structure, jusqu’à la version 2015 de ISO 9001 qui intègre des
évolutions différentes de celles observées dans la version FDIS de
l’ISO 13485.
Le présent projet est basé sur
FDIS ISO 13485 et ISO 9001 :2015. Chacun des documents de
norme présente des spécificités, notamment :
• Le concept
risque/opportunité, l’amélioration continue des processus et
l’orientation client qui sont propres à la norme ISO 9001 :2015.
En effet, la FDIS ISO 13485 se contente d’exiger la mise en place
des actions préventives et le maintien de l’efficacité des
processus. De même, cette norme n’aborde pas l’orientation client,
elle ne traite que du respect des exigences liées aux relations de
l’organisme vis-à-vis du client.
• La
matériovigilance, les essais cliniques et le suivi à long terme de
ces essais, qui sont quant à eux traités avec importance dans la
norme FDIS ISO 13485, alors qu’ils ne sont pas abordés dans l’ISO
9001:2015.
Dans le but de garantir la sécurité
d’utilisation des dispositifs médicaux, la FDIS ISO 13485 donne
une place plus importante que l’ISO 9001 :2015 aux notions
d’assurance qualité, de traçabilité et de documentation.
Le tableau de la Figure 2 permet de présenter les spécificités de
chacune des normes, telles que mentionnées ci-dessus.
Paramètres |
ISO 9001:2015 |
FDIS ISO 13485 |
Concept
de risque/opportunité |
Explicite et important |
Non
explicite et remplacé par les actions préventives |
Amélioration continue
des processus |
Explicite et important |
Remplacé
par le maintien de l’efficacité des processus |
Orientation
client |
Important |
Absent |
Manuel
qualité |
Facultatif |
Obligatoire
(Exigence) |
Assurance
qualité, traçabilité, documentation |
Abordé avec moins d’importance |
Important
(permet de garantir la sécurité d’utilisation des
DM) |
Matériovigilance,
essais cliniques et suivis |
Absent |
Important |
Nombre
de critères (“shall” (doit, doivent)) |
309 |
375 |
Nombre
de critères après mutualisation |
425 |
Figure 4 : Tableau d’étude comparative des
normes ISO 9001 :2015 et FDIS ISO 13485 [1].
Dans son annexe B, FDIS ISO
13485 fournit une étude comparative par rapport à la norme ISO
9001 :2015 [7]. Cette étude présente clairement les exigences
communes aux deux référentiels. La conformité à l’un des
référentiels est la preuve d’une conformité partielle à l’autre.
L’exploitation de cet annexe a permis de réduire le nombre de
critère des deux référentiels à un ensemble de 425 critères,
comprenant à la fois les exigences communes et les exigences
spécifiques aux deux normes.
I-5) Les
enjeux de la certification ISO 9001 et ISO 13485 pour les
entreprises biomédicales
Les enjeux de la certification aux normes ISO 9001 et ISO 13485 pour
les entreprises sont d’ordre sociaux et d’ordre économique
a)
Enjeux économiques
Les enjeux d’ordres
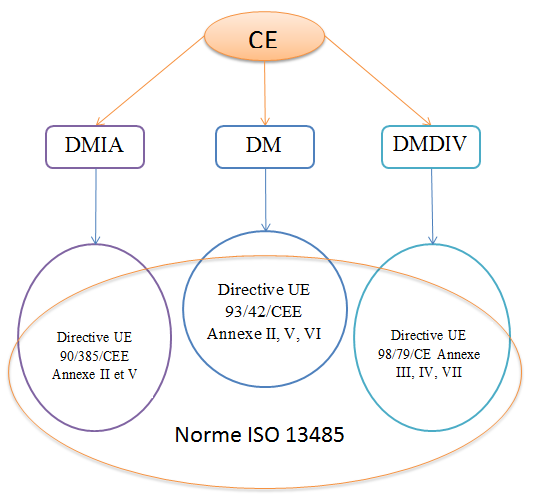
économiques sont principalement liés à l’obtention du marquage CE
et à la réduction des couts de certification. Le marquage CE est
obligatoire pour la mise sur le marché et la libre circulation des
dispositifs médicaux dans l’union Européenne. L’obtention du
marquage CE passe par la preuve de la conformité du DM aux
exigences des directives Européennes associées. A travers la
conformité aux exigences de la norme ISO 13485, l’entreprise fait
également preuve du respect des nombreuses exigences de la
directive 93/42/CEE, de la directive 98/79/CE et de la
directive 90/385/CEE, relatives respectivement à tous les
dispositifs médicaux, aux dispositifs médicaux de diagnostic in
vitro ( DMDIV) et aux dispositifs médicaux implantables actifs
(DMIA) . La figure ci-dessous est une synthèse schématique des
liaisons mentionnées.
Figure 5 : Relation entre le marquage CE et l'ISO 13485[1].
Les coûts pour la réalisation d’un processus de certification
peuvent être importants, cela dépend de plusieurs paramètres
notamment l’activité de l’entreprise et sa taille, il existe deux
grands types de coûts associés à ce processus :
• Les coûts externes dus :
- Aux frais de dossier auprès de
l’organisme certificateur
- Aux frais d’audit de certification (2 à
4 jours ou plus à un ou deux auditeurs
selon l’importance de l’entreprise)
- Éventuellement aux frais de consultants
externes et aux frais d’acquisitions de matériels (informatique,
métrologie,…)
• Les coûts internes (réunions,
rédactions et gestion des documents, communication, formation,
salaire RAQ,…). En ce qui concerne ces coûts, il n’y a pas de
limites. Ils sont bien plus conséquents que les premiers, mais pas
de même nature. Les coûts internes comptabilisent le temps
passé par le personnel et l’encadrement :
- à rédiger les procédures et documents
écrits du système Qualité,
- à gérer ces documents et à les améliorer
- à assister aux ateliers formations
- à rémunérer salaire du Responsable Assurance
Qualité.
Le projet de mutualisation des normes FDIS ISO 13485 et ISO 9001
:2008 permettra aux entreprises biomédicales de réduire
considérablement ces couts puisque certains frais ne seront engagés
qu’une seule fois, pour l’obtention de deux certifications.
b)
Enjeux sociaux
Sur le plan social, la double certification permet aux entreprises
biomédicales
● D'accroître la motivation du
personnel
● D’augmenter la notoriété et la
visibilité de l’entreprise
● De maîtrise accrue des processus
● D’avoir une meilleure qualité des
produits/services
● D’avoir une efficacité accrue
● Bi-assurance qualité pour le client
La facilité d’obtention des certifications permettraient
éventuellement d’encourager le développement de nouvelles
entreprises.
c)
La population d’entreprise concernés par la double
certification ISO 9001 et ISO 13485
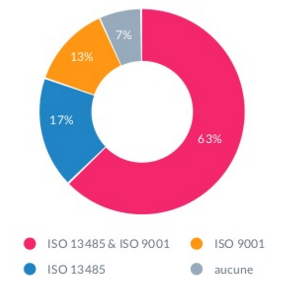
Une étude statistique a été réalisée en mars 2015 sur 47 entreprises
biomédicales prises aléatoirement en France. Il était question de
déterminer le nombre d’entreprise disposant des deux certifications
ISO 9001 :2008 et ISO 13485 :2003. Les résultats de l’étude sont
matérialisés sur la courbe de la figure 5.
Figure 6 : certifications des entreprises
présentes aux forums LNE 2015 [3].
Cette figure permet de
ressortir le fait que 30 entreprises biomédicales sur 40 sont
certifiées à la fois ISO 9001 :2008 et ISO 13485 :2003. En
extrapolant ces résultats à toute l’étendue du territoire
Français, près de 800 entreprises biomédicales sont
susceptibles d’être doublement certifiées en 2015.
Comment aider ces entreprises à faire évoluer leurs systèmes de
management de la qualité conformément aux deux normes qui malgré
le changement de structure, ont des exigences communes ?
Telle est la question à laquelle répond ce projet, à travers la
mutualisation des exigences des normes ISO 9001 :2015 et FDIS ISO
13485.
retour sommaire
Chapitre 2 : Méthodologie de
mutualisation des exigences et de construction de l'outil
d'auto diagnostic
II.1)
Démarche de mutualisation des exigences des normes ISO
9001 :2015 et FDIS ISO 13485
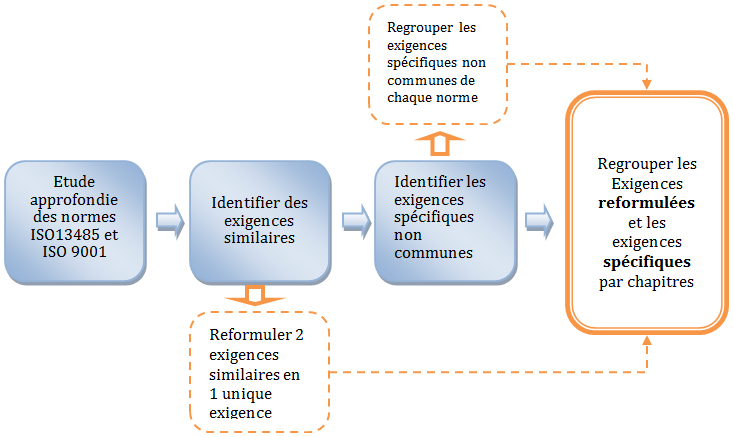
La mise en
commun des normes ISO 9001 :2015 et FDIS ISO 13485
nécessite d’avoir les deux documents de normes à disposition. La
mutualisation a consisté dans un premier temps à identifier les
exigences similaires retrouvées dans les deux normes. La norme
ISO 13485 étant spécifique au système de management de la
qualité pour les entreprises biomédicales, sa structure a été
prise comme référence.
La démarche générale de
mutualisation est résumée par la Figure 7.
Figure 7: Démarche de mutualisation des normes FDI ISO 13485
et ISO 9001 :2015 [1]
Le processus de
mutualisation des exigences se termine par un ensemble
d’exigences comprenant les exigences communes et mutualisées
des deux normes, ainsi que les exigences spécifiques à chaque
norme. Les exigences issues de ce processus sont par la suite
regroupées et affinés par chapitres selon la structure d’ISO
13485, la prochaine étape de travail désigne la réalisation de
l’outil d’auto diagnostic.
II.2)
Démarche de conception de l’outil d’auto diagnostic.
a)
La structure de l’outil d’auto diagnostic
Deux solutions
hypothétiques ont été évoquées pour l’élaboration d’un outil
d’auto diagnostic permettant de vérifier son niveau de
conformité aux exigences des deux normes ISO 9001 :2015 et FDI
ISO 13485. L’exploitation d’une matrice
avantages/Inconvénients a permis de mieux circonscrire l’outil
final.
Outil |
Avantages |
Inconvénients |
Outil d’auto diagnostic pour
chacune des normes |
-Précis
-Spécifique à chaque norme
- facile à implémenter |
-Durée de réalisation relativement
importante
-Durée des évaluations élevée
-Nombre d’exigences élevé |
Outil d’auto diagnostic
compatible aux deux normes |
-Nombre d’exigences
réduites
-Évaluation de
conformité rapide et moins contraignante
-Une seule
évaluation, trois résultats |
-Nécessite la mutualisation des
exigences des deux normes
-difficulté de reformulation
des exigences mutualisées |
Figure 8: Tableau des avantages et
inconvénients des deux types d'outils d'auto diagnostic[1].
En prenant en compte la
facilité d’utilisation, le temps de réalisation, et le temps
d’exploitation par les utilisateurs, un unique outil d’auto
diagnostic compatible aux deux normes est préférable. De plus,
les structures des deux normes étant rapprochées, la
mutualisation des exigences a permis de réduire le nombre de
critères d’évaluation. L’outil peut se présenter sous
plusieurs formes, les avantages et inconvénients pour
différentes formes d’outil sont présentés dans le tableau
ci-dessous.
Forme
de l’outil |
Avantages |
Inconvénients |
Outil sous forme papier |
-Facile à implémenter
-Accessible à toutes personnes
-Possibilité de distribution
facile |
-Possibilité de perdre ou
désorganiser les feuilles
-Nécessite des calculs et
analyses manuels
-Pollution environnementale |
Outil automatisé, logiciel
Web ou Windows |
-Ergonomique
-Facile d’utilisation
-Attractif
-Calcul automatique
-Analyse des résultats
-Possibilité de modifier les variables
du programme |
-limité aux Systèmes
d’Exploitation
-Difficile à mettre en œuvre,
nécessite des compétences en programmation
orientée objet
-Nécessite des mises à jour
progressives
-Nécessite un investissement
important de l’entreprise |
Outil Excel, avec MACRO |
-facile d’utilisation
-Calcul automatique
-Analyse des résultats
-Accessibilité d’Excel
-Possibilité de modifier facilement le
programme |
-Limité aux Systèmes
d’exploitation
-nécessite des compétences en
programmation |
Outil
Excel, calcul simple |
-
Facile d’utilisation
-
Calcul automatique
-
Analyse des résultats
-
Accessibilité d’Excel
-
Pas besoin de programmer
-
Portable |
-Moins
ergonomique
-Moins
attractif |
Figure 9: Tableau Avantages et
inconvénients pour déterminer la forme et le support de
l’outil [1]
Un outil conçu sous
Excel présente l’avantage de la disponibilité du logiciel, que
ce soit pour une entreprise ou pour une personne indépendante.
L’application fonctionne sans aucune contrainte liée au
système d’exploitation ou à la version du logiciel. De même,
le fichier Excel est mis en libre-service, avec possibilité de
modification des contenues, cette solution a été adoptée pour
la poursuite de notre projet. De même, Pour mesurer la
familiarité du personnel aux outils d’autodiagnostic, une
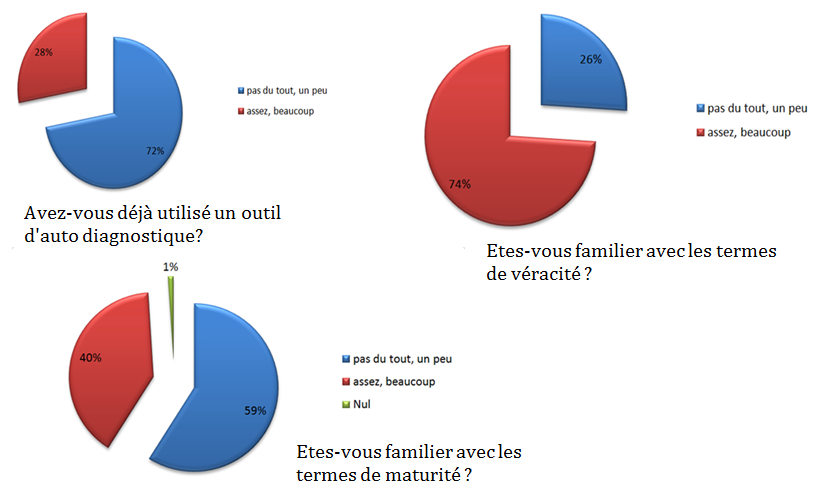
étude sur le terrain consistant en un sondage a été réalisée
en 2013 auprès de 95 services biomédicaux [11]. Les questions
posées dans le cadre de ce sondage visaient spécifiquement la
familiarité du personnel aux expressions de véracité et de
maturité.
Figure 10 : résultats de sondage sur la
perception des outils d’auto diagnostic par les utilisateurs
[11].
Ce sondage a été
effectué dans le cadre du projet de mutualisation des
exigences des normes ISO 9001 V 2015 et NF S99-170. Les
résultats permettent de démontrer qu’un outil d’autodiagnostic
développé sous Excel serait plutôt bien perçu des
utilisateurs, en plus la majorité ayant déjà utilisé un
outil d’auto diagnostic basé sur des critères de véracité.
Avec la matrice avantage/inconvénient vu précédemment
concernant le choix de la forme de l’outil, les résultats de
ce sondage permettent de démontrer qu’un outil développé sous
Excel est un choix pertinent dans le cadre de ce projet.
b)
La structure de l’évaluation
Plusieurs exigences
sont obtenues en sortie du processus de mutualisation,
celles-ci correspondent intégralement ou partiellement aux
exigences des normes distinctes. Ces exigences sont par la
suite décomposées en phrases simples, comprenant un verbe
d’action, et un ou plusieurs compléments associés. Les phrases
sont construites de façon à être compréhensible par une
personne totalement étrangère au vocabulaire de la qualité.
Les phrases affirmatives ainsi construites sont regroupées par
chapitres/catégories, en adéquation avec la mutualisation et
les sommaires spécifiques des normes.
L’évaluation du niveau de conformité comprend deux aspects,
tout d’abord, l’évaluation des exigences et l’évaluation des
chapitres.
• L’évaluation des
exigences
Il est question ici de
donner un niveau de véracité à chacune des affirmations
décrites plus haut. Une échelle de véracité à 6 niveaux a été
priorisé pour cet outil d’auto diagnostic. 6 niveaux de
véracités correspondent à une plage suffisamment large pour
permettre à chacun des évaluateurs de nuancer au maximum sa
réponse. Ce choix est d’autant plus important que les
exigences ont été reformulées, en s’éloignant de la
signification des exigences initiales. Les niveaux de
véracités ainsi que les pourcentages correspondant sont
représentés dans le tableau ci-dessous.
Niveau de
véracité |
Pourcentage % |
Commentaire |
Faux unanime |
0 |
L’action n’est pas du tout
réalisée |
Faux |
20 |
L’action
est réalisée de manière aléatoire |
Plutôt faux |
40 |
L’action est parfois
réalisée de façon informelle |
Plutôt vrai |
60 |
L’action
est formalisée et réalisée de manière
convaincante |
Vrai |
80 |
L’action formalisée est
réalisée, améliorée et tracée |
Vrai prouvé |
100 |
L’action est
réalisée, des preuves existent |
Figure 11 : tableau des valeurs de
véracité [1].
Pour chaque exigence, un choix de véracité est effectué.
L’ensemble des évaluations effectuées permet alors d’avoir une
évaluation par chapitre.
• L’évaluation des
chapitres
Les niveaux de véracité attribués à chaque
exigence sont exploités, un calcul de moyenne arithmétique
permet de déterminer les niveaux de conformité des organismes
à chaque chapitre d’exigences. Plusieurs niveaux de conformité
sont matérialisés dans le tableau ci-dessous.
Somme des %
de véracité |
Niveaux
de Conformité |
Commentaires |
[0%
; 9%] |
Insuffisant |
Niveau
1: Il est nécessaire de formaliser les activités |
[10%
; 49%] |
Informel |
Niveau
2: Il est nécessaire de pérenniser la bonne
exécution des activités |
[50%
; 89%] |
Convaincant |
Niveau
3: Il est nécessaire de tracer et d'améliorer les
activités |
[90%
; 100%] |
Conforme |
Niveau
4: BRAVO! Continuez de progresser et communiquez
vos résultats |
Figure12: tableau des niveaux de
conformité [1].
A la fin du test d’auto
diagnostic, les résultats sont obtenus automatiquement. Ces
résultats seront exploités au sein de l’entreprise pour
implémenter la démarche Visualiser, Identifier, Spécifier,
Agir (VISA). Cette démarche est présentée en détail dans la
suite de ce document.
Chapitre
III: La démarche Visualiser, Identifier, Spécifier,
Agir (VISA)
III.1)
Caractéristiques de l’outil d’auto diagnostic.
L’outil propose une
évaluation du système de management de la qualité basée sur
425 affirmations. De même, l’application est ergonomique et
intuitive puisqu’elle propose un mode d’emploi ainsi qu’un
code couleur correctement adapté à ses fonctionnalités (Vert
pour FDIS ISO 13485, rose pour ISO 9001 :2015). La
figure ci-dessous présente quelques exemples de critères à
évaluer.
Figure 13: Onglet d’évaluation de
l’outil d’autodiagnostic[1].
Une fois l’évaluation terminée, 3 feuilles de
résultats sont obtenues :
La première feuille de résultats désigne le niveau de conformité
de l’entreprise biomédical pour les deux normes mutualisées. Les
deux autres feuilles désignent les résultats relatifs aux
niveaux de conformité de l’entreprise, pour les référentiels de
normes distincts ISO 9001 :2015 et FDIS ISO 13485.
Pour chaque feuille de résultats, 2 types
de graphiques sont présentés, notamment des histogrammes et
des diagrammes radars. Les histogrammes seront tracés pour
matérialiser le nombre de critères correspondant à chaque
niveau de véracité. Les diagrammes radars quant à eux sont
tracés pour montrer le niveau de conformité du système de
management de la qualité pour chaque article de la norme
considérée. Ces résultats sont exploités par l’équipe du
service qualité de l’entreprise pour implémenter le cycle
VISA.
III.2)
L’outil d’auto diagnostic au service de la démarche VISA.
La méthode VISA a été proposée afin de
permettre aux entreprises biomédicales de suivre une
démarche méthodologique pour évaluer leur SMQ et mettre en place
les actions correctives nécessaires. Le but étant d’améliorer
leur niveau de conformité et satisfaire à toutes les exigences
des deux normes pour une éventuelle certification. La démarche
proposée comprend en 4 étapes :
• Visualiser votre SMQ en
seul coup d’œil
L’outil d’autodiagnostic permet à
l’utilisateur de s’évaluer selon des exigences mutualisées pour
les normes ISO 13485 et ISO 9001 :2015 et ainsi d’obtenir des
résultats sous forme de graphe représentant les résultats du
niveau de conformité pour chaque chapitre. Ceci permet de situer
l’état général des différents paramètres du SMQ de l’entreprise.
Les figures ci-dessous sont des représentations graphiques des
niveaux de conformité pour chacun des sous articles des normes
FDIS ISO 13485 et ISO 9001 :2015 respectivement.
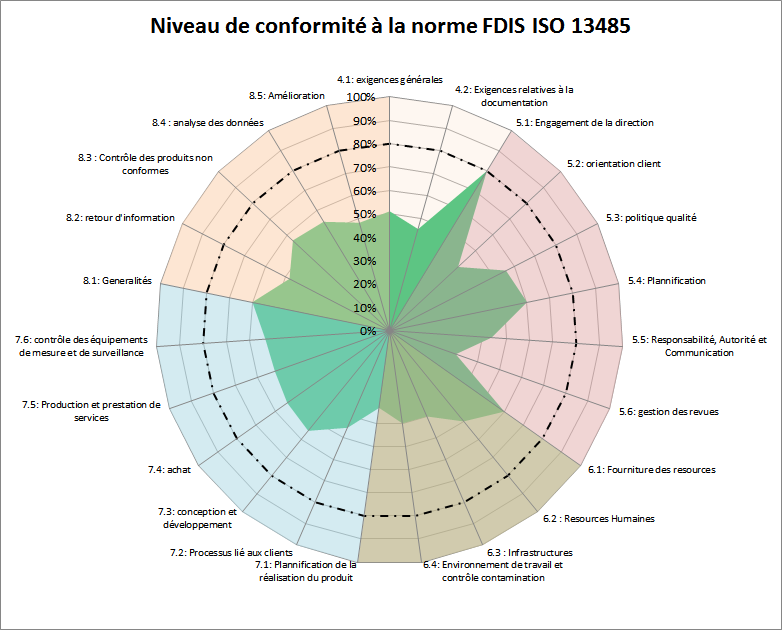
Figure 14: Résultat du test d’auto diagnostic concernant la
FDIS ISO 13485[1].
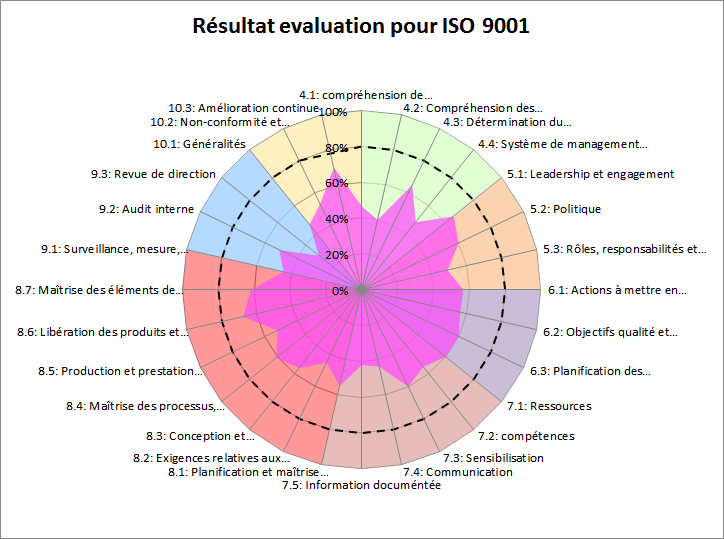
Figure 15: Résultats du test concernant
l’ISO 9001:2015[1].
Le système de management de la qualité considéré dans cette
évaluation est généralement en dessous de la limite de
conformité qui est fixée ici à 60%.
• Identifier les faiblesses
du SMQ
La deuxième étape du
cycle consiste à identifier les points critiques sur lesquels
il serait judicieux d’intervenir en priorité pour améliorer le
système qualité. Des graphes spécifiques à chaque article de
chacune des normes permettent d’avoir une vision plus globale
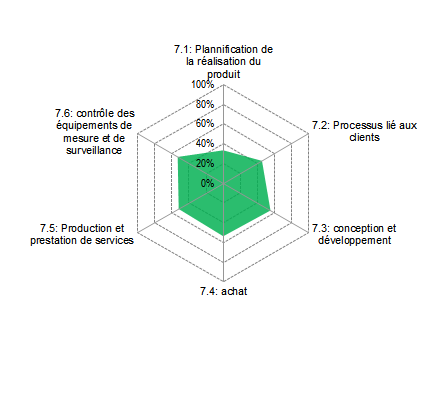
du niveau de conformité. En considérant l’exemple exposé dans
les figure 12 et figure 13, il pourrait être intéressant de «
zoomer » sur l’article 7 de la norme ISO 13485 portant sur la
réalisation du produit. La figure 14 présente les résultats de
conformité pour cet article.
Figure 16 : Résultat de conformité de
l’article 7 : « réalisation du produit », FDIS ISO 13485[1].
Ce graphique permet de mettre
en évidence le fait que tous les sous articles de l’article 7
sont non conformes, par rapport au référentiel FDIS ISO
13485. Il faudrait alors travailler progressivement par
sous article pour spécifier des plans d’action, dans le but
d’atteindre la conformité souhaitée.
• Spécifier les plans
d’action
Pour chaque écart constaté, il est
question à ce niveau de spécifier des plans d’action
d’amélioration, en définissant clairement les responsabilités
et les ressources associées. Ce travail peut se faire par
groupe de personnes ayant réalisé l’évaluation. Un tableau à
compléter est mis à disposition dans l’outil d’autodiagnostic
pour faciliter ces opérations. La figure 15 est un exemple
correspondant au sous article 7.6 : Contrôle des équipements
de mesure et de surveillance.
QUOI |
QUI |
QUAND
ET OU |
Plan
n°1:
Établir les fiches de contrôle qualité des
équipements |
Chef
de service et responsable qualité |
Mensuellement
Pendant la phase de conception des DM |
Plan
n°2:
Archiver les fiches |
Responsable
qualité |
Mensuellement
en conception |
Figure 17 : Tableau à compléter par les
évaluateurs en fonction des résultats fournis par l’outil
d’auto diagnostic, étape « Spécifier» de la démarche VISA[1].
L’exploitation de ce tableau par la suite permet alors d’agir
conformément aux plans d’action spécifiés.
•
Agir
En fonction des résultats et des
plans d’actions spécifiés, l’entreprise pourra agir pour
progresser. Il sera question dans un premier temps de corriger
toutes les non-conformités pour mieux satisfaire aux exigences
normatives, rendant alors possible une auto certification
conformément à la norme ISO 17050. Dans un second temps, ou
pour une entreprise déjà performante, cette étape lui
permettra de communiquer ses résultats pour améliorer sa
visibilité, de fixer de nouveaux objectifs en repoussant sa
limite de conformité et de boucler sur l’étape de
visualisation pour maintenir son niveau de performance et de
robustesse atteint.
Les étapes de la démarche VISA s’enchainent dans la logique
d’un cycle d’amélioration continue.
Les
entreprises biomédicales doivent garantir la sécurité des
dispositifs médicaux pour le patient et les utilisateurs.
Pour cela plusieurs référentiels existent notamment la norme ISO
13485 et la norme ISO 9001, qui sont abordées dans ce
mémoire. Ces deux normes ont subie des évolutions en 2015,
entrainant ainsi un changement de leur structure initialement
commune.
Ce projet a consisté à mutualiser les exigences de l’ISO FDIS
13485 et de l’ISO 9001 :2015 et établir un outil
bi-diagnostic pour l’évaluation de la conformité des entreprises
biomédicales aux exigences de chacune des normes. L’outil
développé est simple d’utilisation il évalue selon 6 niveaux de
véracité en 1h30 environ. Les résultats sont affichés
automatiquement en temps réel sous formes de tableaux,
histogrammes, ou en encore cartographies radar ; ceci pour
permettre l’identification rapide des points à améliorer et
définir les plans d’action prioritaires à réaliser. L’utilisation
de cet outil favorise et facilite l’évaluation et
l’amélioration continue du SMQ des entreprises biomédicales
retour sommaire
- [1] Alyssa K. ; Amine H. ; Hamdi
Ben C. ; Kambou S. ; Noulaquape G. ; Tchinde J. ; nouvelle iso 9001 et
future iso 13485 :
mutualisation des exigences et outil d’autodiagnostic pour la
performance des
entreprises biomédicales. Université de Technologie de Compiègne . Master QPO /TTS ; UE QPO11.
- [2] PIPAME, « Dispositifs médicaux : diagnostic et
potentialités de
développement de la filière française dans la concurrence
internationale ».
Ministère de l’Economie, des Finances et de l’Industrie, 2011.
- [3] Guillaume PROME, « Une double certification ISO 9001
:2015 et ISO
13485 :2016 toujours possible ? », Qualitiso, novembre 2015, http://www.qualitiso.com/double-certification-iso-9001-2015-et-iso-13485-2016/
Page
Web ; [En ligne], consulté le 20/11/2015.
- [4] International Organization for
Standardization (ISO). « The ISO Survey of Management System Standard
Certifications - 2014 ». [En
ligne].
Disponible sur: http://www.iso.org/iso/iso-survey. [Consulté le:
07-oct-2015]
- [5] Mathieu Cynober, « Le marché des dispositifs médicaux
», Agence
d’Intelligence économique 2011.
- [6] ISO « l’étude ISO », 2014. URL:
http://www.iso.org/iso/FR/home/standards/certification/iso-survey.htm?certificate=ISO%2013485&countrycode=FR#standardpick.
[En
ligne], consulté le 2/10/2015.
- [7] Norme, « NF EN ISO 13485-dispositifs
médicaux-systèmes de management
de la qualité-exigences à des fins réglementaires ». Afnor,
septembre 2012,
www.afnor.org. [En ligne], consulté le 1/10/2015.
- [8] Norme, « NF EN ISO 9001-systèmes de management de la
qualité-exigences ». Afnor, novembre 2008, www.afnor.org [En ligne], consulté le 4/10/2015.
- [9] M. Bertrand, L.
Garet,
B.Nord, A.Riaz, G.Farges, « Qualité, sécurité et respect de la
réglementation :
les apports de l’ISO 13485 adaptée aux services biomédicaux.
- [10] Melle POYET Angélique, « Le dispositif médical :
Aspect
règlementaires et économiques. Evolution sur les dix dernières
années », Thèse
de doctorat en pharmacie, 2003.
- [11] J. Aubertin, S. Gadek, S. Kopytko, J. Séhier, G.
Farges, J.M. Prot,
« Outil d’autodiagnostic bi-compatible sur le critère HAS 8k et
la norme NF
S99-170 », IRBM News, vol 36, 2015.
- [12] S. Collet, A. Vial, J. Taglia, Y. Yang, G. Farges, «
NF S99-170 et
ISO 9001 : la certification biomédicale accessible à tous ! »,
IRBM News, 2009.
- [13] T. Bellon, N. Boisrond, et G. Farges, «
Autodiagnostic NF S99-170 :
une contribution pour la sécurité du patient », IRBM News, vol.
35, no 4, p.
119‑124, juillet 2014.
Pour citer le présent mémoire :