|
|
| Si vous arrivez directement sur cette page, sachez que ce travail est un rapport d'étudiants et doit être pris comme tel. Il peut donc comporter des imperfections ou des imprécisions que le lecteur doit admettre et donc supporter. Il a été réalisé pendant la période de formation et constitue avant-tout un travail de compilation bibliographique, d'initiation et d'analyse sur des thématiques associées aux technologies biomédicales. Nous ne faisons aucun usage commercial et la duplication est libre. Si vous avez des raisons de contester ce droit d'usage, merci de nous en faire part . L'objectif de la présentation sur le Web est de permettre l'accès à l'information et d'augmenter ainsi les échanges professionnels. En cas d'usage du document, n'oubliez pas de le citer comme source bibliographique. Bonne lecture... |
|
|
|
A. Guyard, L. Tamames, Projet DESS "TBH", UTC, 2003-2004 , URL : https://www.utc.fr/~farges/dess_tbh/ Imagerie 3D en
Tomodensitométrie
|
||
Yann Evrard |
Julien Mouchel |
Damien Strainchamps |
REMERCIEMENTS
Nous tenons à remercier Monsieur LERALLUT, enseignant chercheur à l'U.T.C de Compiègne pour son aide et son suivi durant la réalisation de cette étude.
Nous remercions également Monsieur CHEVALLIER, directeur de la formation DESS "TBH" à l'U.T.C de Compiègne,
|
L’évolution technologique, le développement informatique ainsi que le traitement de l’information de plus en plus rapide ont permis à l’imagerie médicale de devenir un secteur de haute technologie et d’innovation. Aujourd’hui, l’apparition de la 3D (Trois Dimensions) dans le diagnostic médical commence à voir le jour grâce à des consoles spécifiques de « Post-Traitement » qui sont généralement à la base de l’exploitation des données acquises par le scanner. Plusieurs étapes sont nécessaires avant l’obtention de cette image 3D. Donc pour comprendre cette technologie au sein de cette chaîne d’imagerie, nous nous sommes intéressé dans un premier temps à la chaîne d’acquisition qui concerne le scanner en traitant son fonctionnement ainsi que ces applications médicales. En ce qui concerne la chaîne de traitement, nous avons expliqué tout d’abord les techniques permettant le passage d’une image en deux dimensions (2D) à une image en trois dimensions (3D) et ensuite, on s’est focalisé sur l’intérêt de la reconstruction en trois dimensions (3D) dans le milieu médical : Peut on parler d’Imagerie « Médicale » ou d’Imagerie « Artistique » ? Par ailleurs dans notre dernière partie, nous avons regardé les critères d’aide au choix d’une console de reconstruction par le biais d’une enquête réalisé auprès d’Ingénieurs Biomédicaux et Radiologue. Mots clés : Imagerie 3D, Technique de
reconstruction,
Application, Traitement, Cout |
|
Technological development, the data-processing development as well as the data processing moreover in faster allowed the medical imagery to become a sector high technology and of innovation. Today, appearance of the 3d (Three Dimensions) in the medical diagnosis starts to be born thanks to specific consoles of "Postprocessing" which are generally with the base of the exploitation of the data gathered by the scanner. Several stages are necessary before obtaining this image 3d. Thus to include/understand this technology within this chain of imagery, we are interested initially in the chain of acquisition which relates to it scanner by treating its operation like these medical applications. Then with dimensions data processing sequence, we explained the techniques first of all allowing the passage of an image in two dimensions (2d) an image in three dimensions (3d) and then, one focused oneself on the interest of rebuilding in three dimensions (3d) in the medical environment: it is not necessary to confuse "Medical imagery" and "Imagery Artistic ". In addition in our last part, we have looked at criteria of assistance to the choice of a console of rebuilding by the means of one inquire carried out near Biomedical Engineers and Radiologist.
Key words : Imagery 3d, technique of rebuilding,
Application, treatment, cost
|
B. Principes de bases et fonctionnement
2. Fonctionnement du scanner :
III. RECONSTRUCTION D’IMAGES 3D
1. Acquisition des données brutes :
2. Principe du scanner hélicoïdal :
2. Reconstruction multi planaire bidirectionnelle (2D) :
3. Reconstruction 3D surfacique :
4. Reconstruction 3D volumique :
IV. INTERETS DE LA 3D POUR L’APPLICATION MEDICALE
V. CRITERES DE CHOIX D’UNE CONSOLE DE RECONSTRUCTION 3D
L’évolution technologique, le développement informatique ainsi que le traitement de l’information de plus en plus rapide ont permis à l’imagerie médicale de devenir un secteur de haute technologie et d’innovation. L’imagerie apporte des informations de plus en plus complètes, précises avec des méthodes moins invasives que d’autres examens. Elle devient alors un outil essentiel pour le diagnostic et elle permettra d’adapter la thérapeutique en fonction de la nature de la lésion.
Le scanner ne déroge pas à cette règle. Depuis quelques années, cette technique d’imagerie n’a cessé d’évoluer. Le scanner représente une évolution majeure de la radiologie classique. En effet, ce nouveau dispositif médical utilise le même type de rayonnement (Rayons X) mais sa technologie de réception de l’information s’est considérablement développée. Nous sommes passés d’un film radiographique pour la radiologie classique à un dispositif de plusieurs milliers de récepteurs électroniques pour le scanner. Cette nouvelle technologie a été développée afin de trouver des solutions aux contraintes de la radiographie classique (Manque de différenciation des tissus mous, localisation imprécise).
Le scanner a su aujourd’hui résoudre ces problèmes et continue à évoluer pour tenter d’aller plus loin dans le diagnostic médical. Afin d’avancer vers cet objectif, cette modalité a du s’ouvrir à la représentation en trois dimensions. Cette nouvelle visualisation apporte beaucoup de bénéfices en faveur du diagnostic médical. Mais cette nouvelle technologie n’est possible qu’avec l’utilisation de consoles de post-traitement. Ces consoles sont des ordinateurs utilisant des algorithmes spécifiques afin de pouvoir reconstruire les images scanner en trois dimensions. Elles ont aujourd’hui, un rôle de plus en plus important et sont à la base de l’exploitation des données acquises par le scanner.
Par conséquent, afin d’obtenir une image en trois dimensions lors d’un examen médical, plusieurs étapes seront nécessaires. Nous parlerons donc dans un premier temps, du fonctionnement du scanner et de ces applications médicales. Dans une deuxième partie, nous expliquerons comment nous obtenons le passage d’une image en deux dimensions (2D) à une image en trois dimensions (3D). La troisième partie se focalisera sur l’intérêt de la reconstruction en trois dimensions dans le milieu médical. Pour finir, dans une dernière partie, nous verrons les critères d’aide au choix d’une console de reconstruction ainsi que les produits des différents constructeurs.
La radiographie fut la première technique d’imagerie médicale découverte à la fin du 19ème siècle grâce aux travaux du physicien allemand Röntgen (1845-1823). Les rayons X venaient d’être découvert, permettant de voir l’intérieur du corps humain sans avoir besoin de l’ouvrir. Depuis, de nombreuses améliorations ont été apportées à ce principe révolutionnaire, jusqu’à la radiographie aux rayons X telle que nous la connaissons aujourd’hui.
A l’aide de l’informatique et du traitement numérisé des images, le scanner fut mis au point en 1972, par les radiologues britanniques Allan Mc Cornack (1924-1998) et Godfrey N.Hounsfield (1918). Grâce à cette découverte ils obtiennent en 1979 le prix Nobel. Ce scanner est un scanner dit de « première génération » possédant un tube à rayons X et un seul détecteur. La durée d’acquisition d’une coupe prenait alors 5 minutes. Les premières images réalisées à l’aide de ce type de scanner furent celles d’un cerveau (1971). Par la suite, tout le reste du corps fut exploré. Depuis trois nouvelles générations de détecteurs ont vue le jour. La deuxième génération est apparue en 1975 avec une augmentation du nombre de récepteurs (10 à 60). Une coupe ne durait plus qu’une minute. En 1980, la troisième génération proposait une durée d’acquisition de 5 secondes par coupe. Puis, la dernière génération, apparu en 1990, est constituée d’un tube et d’une couronne de détecteurs où seul le tube est animé d’un mouvement de rotation. Une coupe ne prend alors qu’une seconde.
Par
ailleurs,
d’autres principes physiques ont été découverts
permettant le
développement de
nouvelles techniques d’Imagerie (Echographie, Médecine
Nucléaire, IRM,
TEP).
Ces techniques ne vont pas être un obstacle à
l’évolution du scanner
mais
plutôt des techniques complémentaires pour le diagnostic
médical.
Ainsi, au
jour d’aujourd’hui, le scanner se développe toujours, avec
notamment
des
avancées au niveau du nombre de barrettes.
B. Principes de bases et fonctionnement :
Le
scanner (tomodensitométrie) repose
sur l’utilisation des rayons X. Ces rayons X sont des ondes
électromagnétiques
qui possèdent d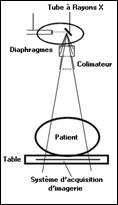 ifférentes
propriétés :
ifférentes
propriétés :
- Ils sont absorbés par des substances solides.
- Ils peuvent être atténués par toutes sortes de substances telles que les liquides et les gaz.
- Ils peuvent traverser le corps humain.
Ces rayons X
seront produits par des tubes à rayons X utilisant une
différence de
potentiel
pour accélérer un flux d’électrons. Ce flux
d’électron percutera une
cible qui
est l’anode du système. Cette anode, composé de
Tungstène, émettra des
rayons X
qui seront utilisés pour l’acquisition d’images en scanner.
Pour
l’application
médicale, les rayons X seront envoyés sur le patient et
traverseront le
corps
humain. Ils seront plus ou moins atténués selon la
densité électronique
des
structures traversées.
2. Fonctionnement du scanner :
Tout d’abord, le patient est placé sur une table qui se déplace dans le sens longitudinal à l’intérieur d’un court anneau. Celui-ci contient un tube à rayons X qui génère un faisceau d’une épaisseur de 1 à 10 millimètres et qui va tourner autour du patient. En face du tube sont disposés des milliers de détecteurs qui vont mesurer l’intensité résiduelle du faisceau qui a traversé le corps.
En fait, une partie du rayonnement incident qui entre en contact avec le corps est absorbé par les tissus traversés. Le rayonnement qui ressort est capté par les détecteurs électroniques qui tournent en même temps que le tube. Les détecteurs électroniques recueillent donc le rayonnement résiduel après traversée de l’organe à explorer et, par comparaison avec un rayonnement témoin, mesurent l’atténuation des rayons X dans l’axe du pinceau. Les détecteurs convertissent les signaux des rayons X en signaux électroniques eux-mêmes convertis en informations numériques exploitables par les programmes de l’ordinateur.
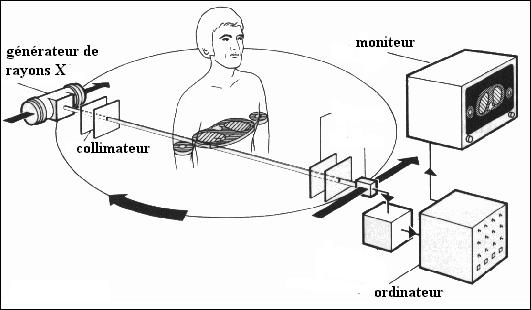
Un peu plus de deux millions de données sont alors enregistrées en quelques secondes par l’ordinateur. Le programme de celui-ci permet de calculer l’absorption du rayonnement en chaque point de la coupe. Le scanner utilise l’absorption des rayons X en relation directe avec la densité des tissus que les rayons ont rencontrés. Les résultats sont alors mis en mémoire.
Un traitement informatique complexe permet ensuite de faire apparaître sur l’écran l’image reconstituée d’une coupe axiale de 1 à 10 millimètres d’épaisseur. Cette image traduit les variations d’absorption des tissus traversés auxquelles sont associées des variations de nuances (noir, gris, blanc) ou des couleurs conventionnelles.
Ce
traitement
informatique sera exécuté par les consoles de
reconstruction (ou
console de
post-traitement).
Le scanner est donc une technique permettant d’établir une succession d’image « de coupe » de la zone scannée. Ces images sont le résultat d’un traitement et d’une reconstruction informatique de l’information reçue par les capteurs de l’appareil.
Le scanner permet de visualiser des modifications de volume ainsi que des anomalies de structure au niveau des tissus ou des organes. Cette technique est utilisée dans divers domaines d’application :
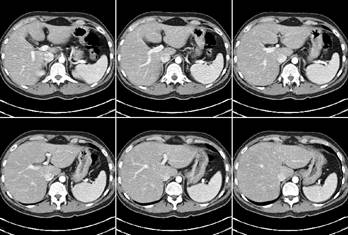
- La cancérologie pour la détection de nodules, le contrôle de la réponse à la chimiothérapie et le bilan d’extension des cancers (pulmonaires, bronchiques, pelviens, ORL).
- La chirurgie pour localiser précisément la zone où l’on envisage l’intervention.
- La traumatologie pour l’étude de traumatismes et de fractures.
Beaucoup d’autres domaines d’applications utilisent cette technique d’imagerie. Afin d’étudier certains organes, l’injection par voie intraveineuse ou l’ingestion d’un « produit de contraste » à base d’iode, opaque aux rayons X sera nécessaire.
Bien
que le
scanner puisse effectuer ces diverses opérations, il ne permet
pas de
préciser
la nature des lésions observées. Dans ce cas, nous
compléterons cet
examen en
faisant un examen IRM.
III. RECONSTRUCTION D’IMAGES 3D
Dans le milieu des spécialistes en imagerie médicale, il est courant d’entendre que la qualité de formation d’une image tridimensionnelle dépend beaucoup de la qualité des données initiales et des techniques de reconstructions tridimensionnelles employées. En effet, le fait d’avoir des données de mauvaise qualité à l’entrée du système (scanner) aura un effet non négligeable sur la qualité des images à la sortie (écran de visualisation). Il y a plusieurs paramètres principaux qui ont besoin d’être optimisés afin de pouvoir obtenir les meilleures données possibles :
La synchronisation d'injection du produit de contraste et de l’acquisition d’images (Directive EURATOM sur les protocoles de dosimétrie).
La parfaite continuité des
différentes
coupes
transversales du volume balayé, ce qui avec les progrès
technologiques
et les
recherches effectuées dans le domaine de l'informatique, de
l'imagerie
et de
l'électronique, a été rendu possible au travers
d’une nouvelle
génération de
machine : le scanner hélicoïdal ou encore appelé le
scanner à rotation
continue.
1. Acquisition de données brutes
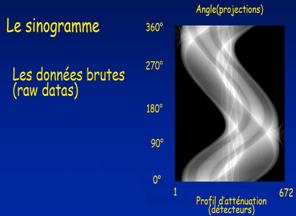
La tomodensitométrie repose sur le principe de mesure de la densité de tissus traversés par un faisceau de rayons X à partir du calcul du coefficient d'atténuation. En effet, en tournant autour du patient (objet sur le schéma) le couple tube RX – Détecteurs permet d’obtenir une succession de projection de la « transparence » du patient selon différents angles répartis sur 360°. Cette information est captée par les détecteurs électroniques et transformée en données numériques. Ces différents histogrammes numériques constituent les données brutes (Raw Data) ou profil de densité qui sont analysées par un calculateur et qui, après calcul, produit les images CT. Le déplacement horizontal du patient permet d’obtenir autant de coupes que nécessaire pour faire le diagnostic.
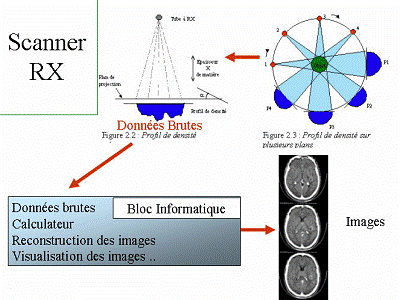
Voyons
maintenant comment est faite la mesure des coefficients
d’atténuation.
Prenons
premièrement le cas où l’objet étudié est
en fait un objet homogène.
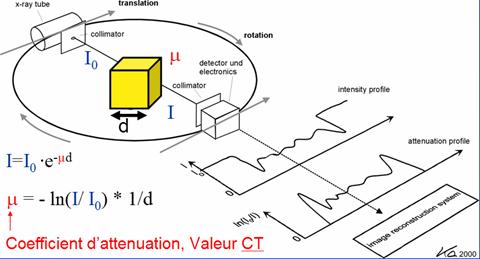
Soit Io, l’intensité initiale du faisceau de rayons X. Si le faisceau (I) de rayon X, à la sortie de l’objet d’épaisseur d, est rendu monochromatique ou quasi-monochromatique par une filtration appropriée, on peut calculer le coefficient d'atténuation µ correspondant au volume de tissu irradié, par application de la formule générale d'absorption des rayons X dans la matière.
Dans l’application médicale, l’objet étudié est le corps humain. Ce volume est loin d’être un volume homogène. Par conséquent, afin d’évaluer l’atténuation du faisceau de rayons X, il sera important d’évaluer le coefficient d’atténuation pour un objet complexe. En effet, l’atténuation le long d’un rayon est déterminée par la moyenne des coefficients d’atténuation linéique, µ, le long de celui-ci.
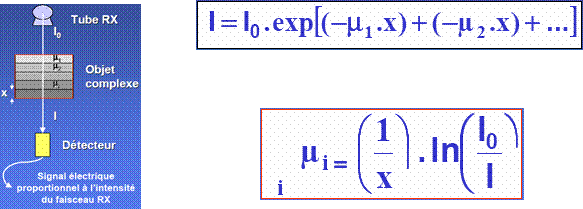 |
Donc en résumé, le détecteur transforme les photons X en signal électrique. Ce signal est directement proportionnel à l’intensité du faisceau de rayons. D’autre part, le profil d’atténuation ou projection correspond à l’ensemble des signaux électriques fourni par la totalité des détecteurs pour un angle de rotation donné. Un mouvement de rotation autour du grand axe de l’objet à examiner, permet d’enregistrer une série de profils d’atténuation de la traversée de la même coupe selon différents angles de rotation (de l’ordre de 1000 mesures par rotation). Pour finir, ces informations seront converties en données numériques. Cette numérisation consiste à transformer le signal de type analogique en données chiffrées qu’un ordinateur peut classer, stocker dans une matrice de reconstruction et traiter ensuite (échantillonnage et quantification).
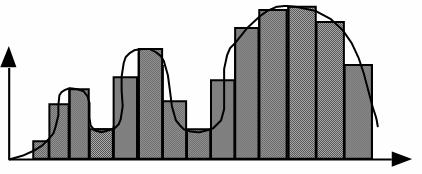
Nous
avons
donc des données converties ou données brutes qui sont
des valeurs
numériques
avec une adresse spatiale. Il nous est donc possible maintenant,
à
partir de n
projections obtenues selon des angles différents, de
reconstruire une
image du
plan de coupe étudié. Ces projection sont rétro
projetées sur une
matrice de
reconstruction. Chaque profile d’atténuation est projeté
selon le même
angle
qu‘à l’acquisition. A partir des valeurs d’atténuation
mesurées par
chaque
détecteur, l’ordinateur calcule la densité de chaque
pixel de la
matrice. Ces
calculs complexes reposent sur un principe simple : connaissant la
somme des
chiffres d’une matrice selon tous ses axes (rangées, colonnes et
diagonales),
on peut en déduire tous les chiffres contenus dans la matrice.
Cette matrice est un tableau composé de n lignes et n colonnes définissant un nombre de carrés élémentaires ou pixels. Les matrices actuelles sont le plus souvent en 5122. A chaque pixel de la matrice de reconstruction correspond une valeur d’atténuation ou de densité. En fonction de sa densité, chaque pixel est représenté sur l’image par une certaine valeur dans l’échelle des gris. Les coefficients de densité des différents tissus sont exprimés en unités Hounsfield UH. Voyons donc maintenant comment fonctionne cette échelle.
Afin de déterminer les différents types de tissus présents dans chaque pixel, Hounsfield a mis en place une échelle qui affecte aux quatre densités fondamentales les valeurs suivantes :
· Air = -1000
· Graisse = -60 à – 120
· Eau = 0
· Os = + 1000
Ainsi, on définit l'indice Hounsfield (IH) par la formule mathématique suivante :

Les images comportent alors des niveaux de gris qui traduisent les coefficients Hounsfield.
D’autre part, compte tenu de la dynamique propre des appareils vidéo et des performances de l'oeil humain, il est nécessaire de se limiter à l'étude d'une fraction des densités qui peuvent s'étaler sur une large échelle de -1000 à +1000. Le scanner permet de projeter une fraction de l'échelle de densité sur toute l'échelle de gris de l'écran vidéo grâce à la fonction de fenêtrage (redistribution des niveaux de gris).
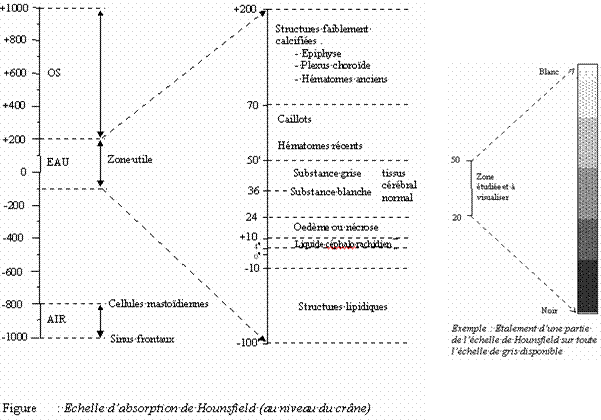 |
Dans l'exemple, on fait glisser la fenêtre de largeur 30 (20-50) sur l'ensemble des valeurs de Hounsfield pour pouvoir analyser ou voir des zones de densité différentes proches. Par ailleurs, cette échelle sera également utilisée dans la reconstruction 3D.
A l’aide des scanners
hélicoïdaux, la
reconstruction 3D
s’est développée considérablement. Voyons donc
maintenant, quelles sont
les
principales caractéristiques de ce type de scanner.
2. Principe du scanner helicoidal :
Le scanner hélicoïdal est caractérisé par la
rotation
continue du couple tube détecteurs autour d'un lit d'examen, se
déplaçant à
vitesse constante durant l'acquisition. Le tube à rayons X
réalise
ainsi un
déplacement en hélice, décrivant un cylindre si on
se place dans un
repère lié
à la table. Les avantages de cette acquisition
hélicoïdale volumique
sont
multiples et en particulier en ce qui concerne la reconstruction
tridimensionnelle.
Le
balayage hélicoïdal en scanner est permis par deux
paramètres :
- Le premier est représenté par la rotation continue d'un tube à rayons X. Elle est étroitement couplée à un système de détecteurs répartis en couronne autour du lit où repose le patient. Lorsque le faisceau de RX tourne autour de l'objet, on obtient une grande quantité de projections et de mesures, dans le plan de référence avec différents angles de projections de a.
- Le second par la progression à vitesse constante du lit. Ainsi ce balayage nous permet d'accéder très rapidement à l'acquisition d'informations concernant un volume, puis aux différents traitements secondaires de ces mêmes informations.

En
scanner hélicoïdal, les données brutes (projections
numérisées) ne
peuvent être
utilisées directement (contrairement au mode séquentiel)
en raison du
déplacement continu du patient durant l’acquisition. Si l’on
reconstruit les
images directement à partir des données ainsi
recueillies, la qualité
des
images sera altérée par des artefacts de mouvement. Il
est donc
indispensable de
calculer des données brutes planes à partir des
données volumiques. Ce
calcul
est réalisé grâce à des algorithmes
d’interpolation.
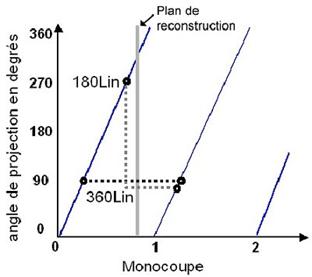
La projection des données d’une
hélice peut être représenté sous forme d’une
ligne oblique. Chaque
point de la
ligne représente une projection. Chaque point est indexé
à l’axe Oz en
raison
du déplacement du lit et correspond à un angle de
rotation précis. Si
l’on
considère un plan de reconstruction à une position
précise dans l’axe
Oz, un
seul point de l’hélice croise le plan de reconstruction : une
seule
projection
est réellement mesurée. Il faut calculer par
interpolation toutes les
autres
projections du plan de coupe d’angle 0° à 360°.
En scanner monocoupe, les deux algorithmes d’interpolation les plus fréquemment utilisés sont :
· l’algorithme 360° linéaire : il interpole les données mesurées à deux positions angulaires identiques avant et après la position du plan de reconstruction. Il utilise donc les données de deux rotations de 360°.
· l’algorithme 180° linéaire : il est similaire à celui utilisé en 360° linéaire mais n’emploie que les données acquises durant une rotation de 360°. Les projections manquantes sont considérées comme similaires à celles mesurées avec l’angle symétrique. Par exemple les données obtenues à 270 (90° + 180°) sont similaires à celles recueillies à 90°.
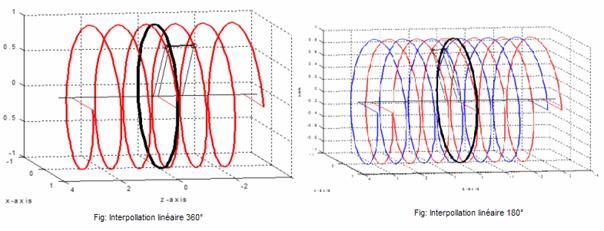
Ces deux types d’interpolation permettent de reconstruire des coupes à n'importe quel niveau le long de l'axe de déplacement longitudinal du lit d'examen. Les données brutes acquises constituent une représentation fidèle du volume balayé.
D’autre part, en ce qui concerne les scanners multicoupes,
4 mesures peuvent être recueillies à chaque position
angulaire par
rotation de
360°. L’interpolation n’est plus limitée à deux
mesures comme en
monocoupe mais
peut être réalisée à partir de plusieurs
points. Il existe certains
pitchs où
une partie des données de deux hélices successives se
chevauchent et
sont
redondantes. Ces pitchs sont peu favorables pour l’interpolation
optimale des
données. Ceci explique que certaines machines ne proposent pas
toutes
les
valeurs de pitch.

Comme nous l’avons expliqué auparavant, nous obtenons des profils d’atténuation qui seront convertis par une transformée de Fourrier en une gamme de fréquence. Une rétroprojection sera ensuite appliquée. L’étape suivante consiste à effectuer une convolution afin d’améliorer la qualité d’image de l’objet reconstruit. Les spectres fréquentiels subissent une fonction de filtrage. La sélection des fréquences élevées par des filtres « durs » ou spatiaux privilégie la représentation des limites anatomiques des structures tout en rendant plus visible le bruit de l’image. A l’inverse, l’élimination des fréquences élevées par des filtres « mous » ou de densité atténue le bruit et la visibilité des contours permettant une meilleure discrimination des structures à faible écart de densité.
Donc, ces filtres optimisent l’image reconstruite selon la structure étudiée. Les filtres « mous » sont adaptés aux structures à faible contraste et les filtres durs aux structures à contraste naturel élevé, telles que l’os, le poumon. Ci-dessous, nous pouvons constater l’utilité de cette étape en comparant un traitement avec ou sans convolution.
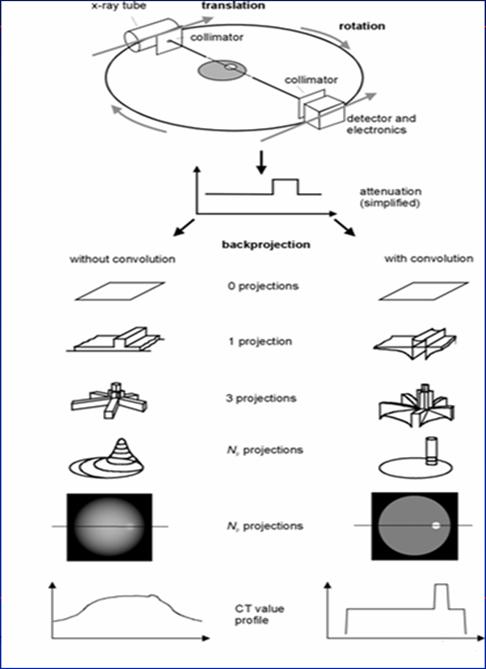
Ci-dessous, le tableau récapitule les étapes pour l’obtention d’une image 2D entre un scanner conventionnel et un scanner hélicoïdal. On remarque qu’en mode spiralée, une étape supplémentaire est nécessaire à la reconstruction :
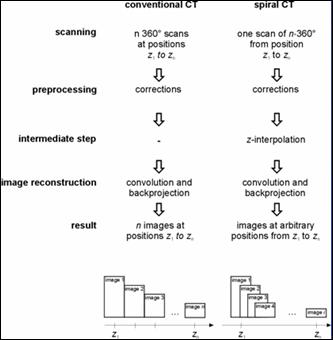
Un des avantages des scanners
hélicoïdaux, est la
parfaite continuité des différentes coupes transversales,
du volume
balayé.
Ainsi le traitement secondaire des informations acquises, va permettre
de faire
des reconstructions, 2D multiplanaires (MPR Multiplanar
Reconstruction), 3D
surfacique, 3D volumique, ou bien encore de l'endoscopie virtuelle
d'excellente
qualité. Voyons donc maintenant les techniques nous permettant
d’obtenir les
images en 3D.
1. Principe général :
Nous allons voir maintenant comment il est possible d’obtenir une image 3D ainsi que les principales applications permettant d’exploiter au maximum ce type d’imagerie.
Nous avons donc une série de coupes qui ont été acquises par un scanner de type hélicoïdale. Ces coupes sont des coupes de type jointives qui vont être empilées les unes sur les autres afin de pouvoir reconstituer un volume.
D’autre part, dans le but de joindre complètement toutes les coupes, il sera possible d’utiliser une méthode d’interpolation. Pour trouver la valeur d’un voxel entre deux coupes, cette méthode utilise la valeur du point correspondant de la coupe précédente et suivante.
Dans le volume de données ainsi obtenu, il est possible d'appliquer divers traitements informatiques permettant les reconstructions suivantes :
- La reconstruction multi planaire bidirectionnelle (2D) et mode « ciné ».
- La reconstruction 3D surfacique.
- La reconstruction 3D volumique.
- L’endoscopie virtuelle.
2. Reconstruction multi planaire bidirectionnelle (2D) :
Ø Principe :
 Il
s'agit d'un mode de traitement de l'image facilement
accessible
sur la console du scanner. Cette reconstruction multi planaire 2D
permet en
effet de réaliser à travers le volume d'acquisition des
coupes
bidirectionnelles frontales, sagittales, obliques ou curvilignes. Il permet, notamment, de mettre dans un plan
toute courbe
arbitraire dans le patient. Pour obtenir des images
analysables, en
particulier pour éviter l'aspect en "marches d'escalier", il est
souhaitable de réaliser à l'acquisition des coupes
jointives avec un
pitch égal
à 1 et de reconstruire en chevauchant les coupes (overlap). Ce
mode
d'analyse
est immédiatement accessible sur la console du scanner et ne
consomme
pratiquement pas du temps médecin.
Il
s'agit d'un mode de traitement de l'image facilement
accessible
sur la console du scanner. Cette reconstruction multi planaire 2D
permet en
effet de réaliser à travers le volume d'acquisition des
coupes
bidirectionnelles frontales, sagittales, obliques ou curvilignes. Il permet, notamment, de mettre dans un plan
toute courbe
arbitraire dans le patient. Pour obtenir des images
analysables, en
particulier pour éviter l'aspect en "marches d'escalier", il est
souhaitable de réaliser à l'acquisition des coupes
jointives avec un
pitch égal
à 1 et de reconstruire en chevauchant les coupes (overlap). Ce
mode
d'analyse
est immédiatement accessible sur la console du scanner et ne
consomme
pratiquement pas du temps médecin.
Ø Applications médicales :
Cette technique de reconstruction 3D se révèle très utile pour l'étude de l'arbre trachéo-bronchite, des régions frontières (diaphragme et apex pulmonaire) et de la paroi. Le mode multi planaire bidirectionnel 2D présente néanmoins certaines limites en particulier lorsqu'on utilise le mode curviligne. En effet dans ce cas, la situation dans l'espace de certains éléments anatomiques ou pathologiques peut être erronée. Mais ce mode s’avère utile pour suivre un vaisseau sanguin ou un maxillaire (ou une mandibule) en CT dentaire.
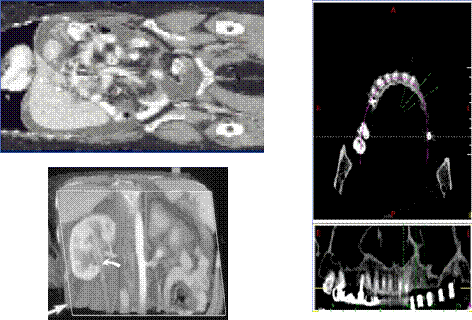 |
Figures gauches : Coupe frontale et coupe en biais du tronc d’un Homme.
Figure droite : Passage d’une maxillaire courbe à une maxillaire plan.
Ø Application du mode « ciné » :
Il est possible de rapprocher le mode multi planaire 2D et le mode "ciné", qui est une vision dynamique sur la console de traitement. En agissant sur la souris de l'ordinateur, il est possible de faire défiler à la vitesse voulue les différentes coupes transversales acquises en mode spiralé, de bas en haut ou de haut en bas. Ce mode est très intéressant pour étudier les artères pulmonaires dans l'embolie pulmonaire. Dans le cadre du cancer bronchique il peut être utilisé pour préciser les rapports vasculaires d'une tumeur.
3. Reconstruction 3D surfacique :
Ø Principe :
Le mode 3D surfacique est un mode d'imagerie spectaculaire qui a l'honneur de tous les médias médicaux. Il procure une vision tridimensionnelle extérieure d'éléments anatomiques et pathologiques. Il nécessite plusieurs traitements de l'image, dont le plus important est la détermination du seuillage des voxels. Ce seuillage permet de sélectionner certains éléments anatomiques ou pathologiques dont la densité correspond aux pixels choisis. Les surfaces sont crées en reliant tous les pixels correspondant à la même atténuation. Selon l'échelle de pixels choisis, nous pouvons obtenir un moule positif ou négatif de l’objet étudié. Sur l'image ainsi obtenue, il est possible grâce à un bistouri électronique de se débarrasser des éléments anatomiques qui gênent la lecture. Il est possible également d’appliquer une lumière imaginaire, se reflétant sur les surfaces, leur permettant d’apparaître sous différents niveaux colorimétriques.
L'image obtenue est très impressionnante, surtout lorsqu'on l'observe sur la console de post-traitement. En effet, sur l'écran, un mouvement alternatif de droite à gauche permet une vision tridimensionnelle dynamique. Il est possible de basculer l'image sous tous ses angles (de haut en bas, d'avant en arrière et de droite à gauche).
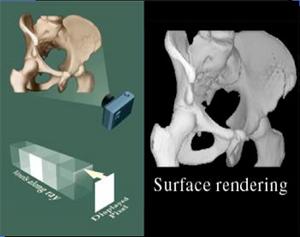
Ø
Ø Applications médicales :
En pratiquant un double seuillage, on peut obtenir un effet de paroi comme par exemple pour la paroi trachéale. Grâce aux diverses manipulations informatiques, il est possible d'isoler totalement la trachée de son environnement et de l'observer sous tous ses angles. En segmentant l'image par différentes coupes d'usure, on peut pénétrer à l'intérieur de la lumière trachéale et apprécier ainsi l'effet de paroi créé par le double seuillage. Cette étude de la trachée est particulièrement démonstrative dans le cas des sténoses trachéales.

Bien que très
spectaculaire l'imagerie en 3D surfacique a plusieurs
inconvénients.
C'est une
technique opératoire dépendante qui construit une image
3D à partir
d'un
seuillage arbitraire de pixels. A ce seuillage automatique, peut
s'ajouter un
seuillage anatomique grâce à un "bistouri
électronique" qui permet
d'éliminer manuellement des voxels gênants.
L'objet 3D surfacique correspond en fait à une vision extérieure "d'un moulage" qui ne tient pas compte des éléments anatomiques ou pathologiques de l'objet reconstruit. Sans être forcément un objet "manipulé" il n'a pas la spontanéité et la richesse d'information d'une série de coupes tomodensitométriques. Les traitements de l'image pour aboutir à un objet 3D demandent actuellement un temps médecin compris entre 20 et 30 minutes.
Ainsi
l'imagerie en 3D surfacique n'est utilisée en pathologie
thoracique que
dans
certaines indications. En dehors des fistules artério-veineuses
pulmonaires qui
bénéficient de cette technique, les principales
indications sont
l'étude de
l'arbre trachéo-bronchique, en particulier la trachée et
l'étude de la
paroi.
4. Reconstruction 3D volumique :
Ø
Principe
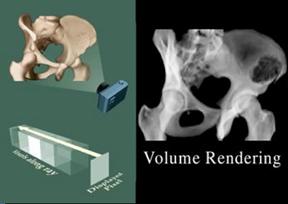 Le rendu volumique attribue
des opacités et des couleurs
aux différents tissus en fonction de leur atténuation.
Afin de
normaliser
l’opacité et les couleurs de ce rendu, une technique de
« rayon » est
appliquée sur celui-ci. De plus il est possible d’enlever
certains
organes en
définissant une certaine fenêtre de seuils ou en les
enlevant à l’aide
d’un
crayon électronique. Des algorithmes de reconstructions
complémentaires
sont
possibles telles que le Maximum Intensité Projection
(MIP) qui
sélectionne tous les pixels d'intensité maximale et le
minimum
Intensité
Projection (mIP) qui sélectionne tous les pixels
d'intensité minimum.
Le rendu volumique attribue
des opacités et des couleurs
aux différents tissus en fonction de leur atténuation.
Afin de
normaliser
l’opacité et les couleurs de ce rendu, une technique de
« rayon » est
appliquée sur celui-ci. De plus il est possible d’enlever
certains
organes en
définissant une certaine fenêtre de seuils ou en les
enlevant à l’aide
d’un
crayon électronique. Des algorithmes de reconstructions
complémentaires
sont
possibles telles que le Maximum Intensité Projection
(MIP) qui
sélectionne tous les pixels d'intensité maximale et le
minimum
Intensité
Projection (mIP) qui sélectionne tous les pixels
d'intensité minimum.
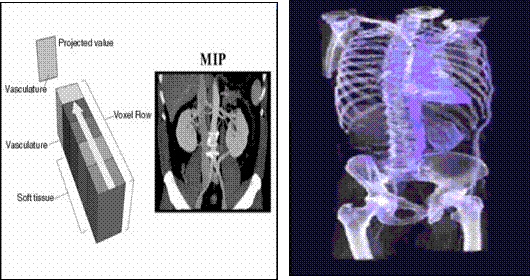
Ø
Applications médicales
 Ainsi
lorsqu’il est pratiqué une Haute Résolution volumique
avec Maximum
Intensité
Projection (MIP) sont essentiellement sélectionnés les
pixels des
vaisseaux
pulmonaires et des parois des bronches. L'imagerie
des
vaisseaux pulmonaires périphériques est extrêmement
précise et permet
de
distinguer des micro-nodules indiscernables sur les coupes en Haute
Résolution
classique car confondus avec des coupes vasculaires. A l’opposer, le
mode
minimum Intensité Projection (mIP) permet d'apprécier de
faibles
variations de
densité du parenchyme pulmonaire comme par exemple, la mise en
évidence
d'un
aspect en "mosaïque" ou la détection de petites bulles.
Ainsi
lorsqu’il est pratiqué une Haute Résolution volumique
avec Maximum
Intensité
Projection (MIP) sont essentiellement sélectionnés les
pixels des
vaisseaux
pulmonaires et des parois des bronches. L'imagerie
des
vaisseaux pulmonaires périphériques est extrêmement
précise et permet
de
distinguer des micro-nodules indiscernables sur les coupes en Haute
Résolution
classique car confondus avec des coupes vasculaires. A l’opposer, le
mode
minimum Intensité Projection (mIP) permet d'apprécier de
faibles
variations de
densité du parenchyme pulmonaire comme par exemple, la mise en
évidence
d'un
aspect en "mosaïque" ou la détection de petites bulles.
5. L’endoscopie virtuelle :
Ø Principe et application médicale
L'endoscopie virtuelle représente le dernier développement des nouvelles techniques d'imagerie médicale dérivées du mode spiralé en tomodensitométrie. L'endoscopie virtuelle procure une vision endoscopique "virtuelle" de l'arbre trachéo-bronchique. Pour cela plusieurs opérations sont nécessaires :
- acquisition d'un volume en mode spiralé avec un pitch égal à 1 et une épaisseur de coupe faible.
- Reconstruction de ce volume en chevauchant les coupes (overlap).
- Segmentation de ce volume grâce à un seuillage des pixels et sélection des voxels retenus participant à la création de la vue endoluminale.
 |
L'impression de relief est
produite selon une technique d'éclairage et d'ombrage qui est
fonction
de
l'éloignement et de la position du voxel considéré
comme l'objectif de
l'endoscope virtuel à chaque niveau endoluminal, le logiciel
peut
reconstruire
la paroi et l'environnement sur 360°. Il est donc possible de
naviguer
dans la
lumière explorée en temps réel grâce
à l'inter activité et à la
puissance des
logiciels.
En déplaçant le curseur sur une coupe bidirectionnelle 2D frontale, passant par la trachée et les bronches, il est possible d'obtenir une vision circonférentielle à chaque niveau.
Par rapport à l'endoscopie classique, l'endoscopie virtuelle présente plusieurs avantages et bien sûr des inconvénients. Le principal intérêt de l'endoscopie virtuelle est d'être non invasive ce qui est bien sûr très apprécié par les malades. Ensuite, elle permet une étude des bronches au delà des sténoses bronchiques infranchissables par l'endoscope optique. Compte tenu de la possibilité de vision à 360° par rapport au point d'observation, il est possible par exemple, d'obtenir une vision rétrograde d'une lésion bronchique. Enfin, l'endoscopie virtuelle s'intègre dans une exploration tomodensitométrique globale du thorax où tous les modes de traitements de l'image précédemment décrite peuvent être utilisés.
Malheureusement l'endoscopie virtuelle présente d'importantes limites.Tout d'abord, il s'agit d'une image reconstruite avec un seuillage de pixels arbitraire. Ainsi même si on effectue un coloriage de l'image, l'aspect de la muqueuse bronchique est tout à fait artificiel et ne correspond pas à la vision endoscopique optique. En effet, l'imagerie de la muqueuse bronchique en endoscopie virtuelle est obtenue à partir d'un seuillage arbitraire situé à environ - 500 UH. Ce seuillage correspond grossièrement à la limite entre la muqueuse bronchique et l'air. D'éventuelles lésions situées sur la muqueuse bronchique et dont la densité serait inférieure à -500 UH sont éliminées et invisibles. Pour permettre une meilleure observation des bronches périphériques, un seuillage dégressif pourrait être utilisé dans l'avenir. Dans certains cas, la survenue d'artéfacts respiratoires et vasculaires gêne l'observation. Une autre limite de la méthode est représentée par sa consommation temps médecin qui reste assez élevée : entre 15 minutes et 30 minutes.
IV. INTERETS DE LA 3D POUR L’APPLICATION MEDICALE
A l’aide de l’imagerie médicale, il est possible aujourd’hui, de visualiser l’anatomie interne du patient sans pour autant avoir recours à la chirurgie. Les images obtenues sont des séries de coupes 2D sur lesquelles il n’est pas toujours facile d’interpréter les différents problèmes auxquels sont confrontés les médecins. Afin de palier à ces problèmes, il a été développé l’imagerie 3D. Cette technique, va permettre aux médecins, de visualiser son patient en 3D virtuelle. Cela apportera une meilleure représentation de l’anatomie interne dans le but d’optimiser les chances de bons diagnostics.
La reconstruction 3D est un apport pour toutes les spécialités médicales. Voyons alors, dans quels cas, cette reconstruction apparaît utile.
Tout d’abord, la reconstruction 3D peut être utilisée pour visualiser en trois dimensions les différents organes du corps humain. En effet, au niveau hépatique par exemple, il est possible de reconstruire le foie en 3D. Grâce au couplage de la reconstruction et de logiciels informatiques, il est possible de repérer des tumeurs ne mesurant que 3mm (1 cm pour l’analyse classique). Ceci va permettre notamment, un diagnostic plus rapide des tumeurs et donc un traitement qui commencera plus rapidement. Mais aussi, la reconstruction 3D donnera la possibilité d’évaluer plus précisément l’efficacité thérapeutique avec le calcul des volumes tumoraux. Par conséquent, l’imagerie 3D est devenue un outil incontournable dans la lutte contre le Cancer.
Il est possible de reconstruire également, à partir d’images TDM de la trachée, la peau, les os ainsi que les voies aériennes et les poumons.
D’autre part, la reconstruction 3D est largement utilisée pour la chirurgie. En effet, l’image virtuelle sera utilisée avant l’opération afin d’avoir une anatomie interne équivalente à celle du patient et non plus une anatomie théorique et peu précise. Grâce à l’imagerie 3D, le chirurgien pourra même simuler son opération avec une résection virtuelle, dans le but de limiter au minimum les risques lors des interventions chirurgicales.
De plus, l’imagerie tridimensionnelle a des applications en chirurgie orthopédique. En effet, outre l’exploration de l’appareil locomoteur à des fins diagnostiques, la reconstruction 3D va permettre d’élaborer des techniques chirurgicales plus sûres. Elle est également utilisée dans l’aide à la chirurgie maxillo-fasciale en simulant les actes chirurgicaux et en mettant en évidence les résultats.
La reconstruction 3D est également utilisée dans l’imagerie de l’os fœtal. En effet, l’imagerie 2D est insuffisante pour évaluer certaines malformations osseuses (Explorations fines des extrémités osseuses, métaphyses …) et par conséquent imprécise sur le diagnostic. Outre l’échographie 3D, La tomodensitométrie 3D permet d’obtenir d’excellentes images de l’ensemble des marqueurs osseux. Seul point négatif, l’irradiation. Mais celle-ci apparaît acceptable au vue des résultats.
Pour finir, la
reconstruction 3D peut être utilisée pour effectuer une
endoscopie
virtuelle
comme par exemple dans l’étude du colon. En effet, cette
technique de
reconstruction permet de déceler au préalable
d’éventuelles lésions.
Deux cas
peuvent alors se présenter. Premièrement l’examen est
négatif et il n’y
a pas
de suite donnée. Par contre, si l’examen s’avère positif,
une
endoscopie
« réelle » sera réalisée
pour localiser la lésion et une
biopsie
pourra être réalisée. La reconstruction 3D permet
alors d’éviter une
endoscopie
« réelle » lorsque aucune lésion
n’est détectée. Ces deux
techniques
sont donc complémentaires.
La reconstruction 3D
est donc très utile dans diverses applications médicales
notamment en
donnant
la possibilité de simuler certains actes chirurgicaux. Ces
applications
vont se
diversifier de plus en plus avec le développement de la
reconstruction.
Ces
applications sont une des caractéristiques des consoles de
reconstruction.
Voyons donc maintenant quels peuvent être les critères de
choix de ces
consoles.
V. CRITERES DE CHOIX D’UNE CONSOLE DE RECONSTRUCTION 3D
L’achat de ces consoles de post-traitements, nécessite des études approfondies. Afin de pouvoir répondre aux attentes et aux besoins des futurs acheteurs et utilisateurs de ces consoles, il nous est apparu normal d’effectuer une enquête. Celle-ci fut destinée aux Ingénieurs biomédicaux ainsi qu’aux radiologues.
Tout d’abord, ce questionnaire (Cf Annexe) a été envoyé à 100 personnes. Après 15 jours de délai, nous avons reçu 10 retours ce qui correspond à 10 % de réponses. Regardons les différents critères qui ressortent de cette enquête.
1. L’aspect technique :
Afin de pouvoir utiliser la reconstruction 3D, l’architecture informatique doit être très poussée. En effet les ordinateurs sont équipés avec :
- Une tour avec un bi–processeur.
- Des cartes mères spécifiques aux processeurs.
- Une Mémoire vive très importante.
- Des cartes graphiques puissantes.
- Des écrans plats (2 écrans splittés).
D’autre part, il faudra vérifier la compatibilité informatique des images au format standard DICOM ainsi que la polyvalence de la console dans le traitement des différentes modalités (TDM, IRM, TEP).
2. L’aspect financier :
Le prix est un critère très important. En effet, étant donné les performances techniques requises, le prix peut être très élevé. Il faut compter pour l’achat d’une console seule aux alentours de 55000 euros.
De plus, il faut ajouter à ce prix, le coût de maintenance sans oublier les « upgrade » du logiciel et la formation du personnel médical du service de radiologie qui s’impose.
3. Temps de traitement :
Un autre paramètre à prendre en compte est le temps de traitement. Le temps de reconstruction des images peut varier de quelques minutes à quelques dizaines de minutes pour un examen. Par exemple, lorsque un médecin travaille sur ce type de console pour le diagnostic médical, nous pouvons supposer qu’il substitue ce temps de traitement à un temps de travail auprès du patient. Par conséquent, ces consoles doivent être très rapide.
4. Les applications :
Afin d’obtenir un diagnostic de plus en plus fiable, les consoles de reconstruction doivent proposer le maximum d’applications telles que :
- Reconstruction multi planaire bidirectionnelle (2D) et mode « ciné ».
- Reconstruction 3D surfacique qui permet notamment de travailler sur des fractures complexes.
- Reconstruction 3D volumique ou Rendu de Volume avec application possible du mode Minimum ou Maximum Intensité Projection qui permet l’exploration en imagerie vasculaire, en imagerie des canaux et en imagerie des liquides.
- Endoscopie virtuelle.
5. Autres critères :
Outre leur rapidité, les consoles doivent être très faciles d’accès. L’interface machine–utilisateurs doit être très conviviale, facile d’utilisation : l’ergonomie joue alors un rôle très important.
D’autre part, la
console de
reconstruction doivent être fiables afin d’optimiser les
performances.
1. GE Health-Care :
Ils proposent une console de traitement appelée Advantage Workstation (AW). Sur le plan technique, elle reconstruit les images avec une vitesse de 6 images/seconde, en proposant une disponibilité des images sur la console opérateur et console Advantage Workstation en temps réel.
Les différentes applications qu’elle propose sont :
- Reconstruction volumétrique en mode MPVR, MIP, Volume Rendering ainsi que la navigation virtuelle.
- Evaluation quantitative : étude des structures vasculaires, quantification des nodules pulmonaires, analyse de perfusion, détection des polypes et lésions du colons, traitement dentaire.
- Cardiologie : visualisation et études des coronaires et des cavités pour toutes phases du cycle cardiaque, quantification des sténoses, segmentation 3D du cœur, analyse fonctionnelle du myocarde (mobilité, fraction et volume d’injection).
- Cancérologie : Simulation de thérapie.
2. Philips :
La console de post-traitement Philips, se nomme « Brillance Extended Workspace ». Cette station de visualisation, possède comme interface « ViewForum » utilisant comme algorithme de reconstruction COBRA et qui assure des fonctions d'affichage, de stockage et de reprographie des données d'un patient, disponibles sous un format numérique. Elle peut traiter des données provenant de photographies RX ou d'acquisitions TDM ou RM.
On retrouve les différentes techniques de reconstruction telles que le reformatage (MPR), la projection MIP, le Rendu de volume, l’Endoscopie 3D (Pour créer un chemin et visualiser les parois internes des structures creuses). Elle propose une option « Score cardiaque TDM » qui permet d'effectuer des mesures fournissant des données quantitatives sur les dépôts de calcium dans les principales artères coronaires. Elle est principalement utilisée pour l’analyse cardiaque aux Rayons X. Par ailleurs, on peut elle propose des analyses sur les perfusions de cerveau, sur les nodules pulmonaires.
La station de travail ViewForum Philips exige non seulement une utilisation correcte, mais également une maintenance préventive régulière et certains contrôles incombant à l'utilisateur. Cette maintenance et ces contrôles sont essentiels pour que le matériel reste sûr, efficace et fiable.
Voici un exemple, de ces caractéristiques techniques :
En moyenne, il faut a peut près 3 minutes pour reconstruire une acquisition.

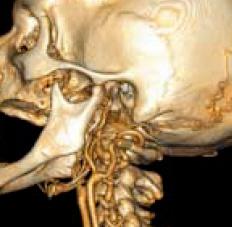
Cette image représente une reconstruction 3D, effectuée par la console Philps, au niveau du crane et surtout sur le cou (avec les vaisseaux : aortes, carotides…)
Voici
quelques applications de reconstruction 3D :
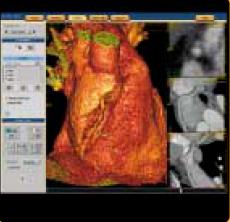
La fonction « CT cardiaque Angio » évalue,
identifie et mesure la sténose provoquée par les plaques
molles,
calcifiées ou
fibreuses. Elle permet de segmenter automatiquement le cœur et ses
structures
environnantes. L'ecran couleur identifie automatiquement des structures
indicatives de la plaque molle, fibreuse ou calcifiée.

L’Endoscopie 3D et l'environnement parfait pour l'endoscopie virtuelle, créant les vues intérieures de l'anatomie. L’Endoscopie 3D permet par exemple l'inspection du sinus nasal, ou bien de
la trachée et des bronches, des structures vasculaires (des vaisseaux sanguins et des anévrismes), les intestins (estomac, petits intestins et deux points). En fait, l'intérieur de n'importe quelle structure creuse ou tubulaire peut être inspectée. Cet outil est complet pour aider à diagnostiquer la maladie.
Par ailleurs, cette console propose d’autres applications qui sont :
- La perfusion de cerveau : cette technique est capable d'évaluer la perfusion de tumeur pour améliorer votre capacité de caractériser les lésions connues.
- Marquage De Calcium : cette fonction mesure rapidement les calcifications d'artère coronaire (CAC).
- Évaluation De Nodule Du Poumon (LNA) : grâce à cette fonction, on peut obtenir des informations quantitatives au sujet de la taille, de la forme et de la période finie de changement des nodules au niveau du poumon. On peut aussi évaluez exactement les changements avec le temps.
3. Siemens :
Le dispositif médical qui va être présenté est le scanner Siemens SOMATOM « sensation open » qui fonctionne en parallèle avec un logiciel de post-traitement.
Avant tout, ce scanner est à la pointe de la technologie au niveau de ces caractéristiques. En effet, ses dimensions font de lui un dispositif médical très pratique avec une harmonisation entre le volume de couverture, la vitesse d’acquisition et l’excellente visualisation des détails. Ce scanner peut être utilisé dans différentes applications telles que :
· Le diagnostique et le suivie pour la radiothérapie.
· Les applications traumatiques.
· Les procédures interventionnelles.
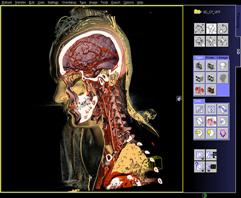
La console de post-traitement de chez Siemens se nomme LEONARDO. Cette console permet le traitement de plusieurs modalités d’imagerie différentes tout en utilisant la même interface. Elle sert à la fois à l’acquisition des données et à la reconstruction des images. Elle est relativement facile à utiliser et très intuitive permettant des diagnostics rapides et corrects. Ce logiciel est flexible pour tout le personnel et peut être modifié pour n’avoir que ce qui n’est utile à l’utilisateur. Il existe également différents formats immédiatement disponibles tels que : VRT, MIP, MPR.
De plus, un gain de temps est possible d’une part, par le fait que l’acquisition et la reconstruction peuvent s’effectuer en parallèle et d’autre part par l’élimination de la reconstruction manuelle. Une lecture directe du volume dynamique est également possible. Ceci va alors entraîner une réduction par 10 du nombre de données.
D’autre part, LEONARDO reconnaît le format DICOM, fonctionne sous le système d’exploitation Windows et a accès à Internet.
Nous allons voir maintenant quelques exemples de techniques et d’applications médicales utilisant la reconstruction 3D.
- Syngo 3D VRT :
C’est une technique de rendu de volume totalement intégré dans le poste de travail et facile d’utilisation permettant l’interprétation volumique. Cette application permet d’exploiter des informations sur la densité, l’opacité et la réfraction des tissus afin d’obtenir des vues différentes pour les utiliser dans les cas cliniques.
Afin de différencier les organes par exemple, l’application classera les différents tissus en quatre classes. Cette application permet également d’éliminer facilement toute information obstruant l’objectif clinique. Des fonctions d’érosion ou de dilatation sont pour cela disponible.
 |
Il est possible par exemple, de visualiser le réseau artériel et de la même façon les occlusions artérielles.
D’autre part, Il est possible d’utiliser cette application pour une évaluation post chirurgicale. Par exemple, après la pose d’un clipping, il est possible, grâce à la console de post-traitement, de visualiser si celui-ci a été correctement posé. Il en est de même pour les stents.
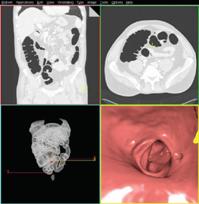
- Syngo colonography :
Il existe également une application non invasive de colonographie virtuelle : « Syngo Colonography ». Cette technique permet de localiser et d’évaluer les différentes lésions au niveau du colon. Grâce à cette technique, il est possible de détecter et de traiter ces lésions plus rapidement et donc d’avoir un diagnostique vital plus favorable.
Cette application offre plusieurs avantages :
ü Une vue en endoscopie 3D virtuelle en temps réél.
ü Une lecture de l’examen avec un écran divisé en quatre fenêtres. Chaque partie représente le colon avec une technique particulière. Les deux premières fenêtres représentent deux vues différentes en MPR. Une autre fenêtre représente le colon en mode VRT. Ce mode permet de visualiser l’appareil digestif dans son entier et ainsi permet de situer les lésions. La dernière fenêtre représente l’endoscopie virtuelle. Ces différents modes permettent de localiser la présence de toutes les lésions.
ü Une capacité de mesurer les dimensions de la lésion.
- Syngo lungCARE CT :
Cette application aide à la visualisation, à l’évaluation et au suivi des nodules et lésions pulmonaires. Elle permet un diagnostic plus rapide et par conséquent un diagnostic vital également plus optimiste pour les patients.
Plusieurs fonctions sont disponibles telles que :
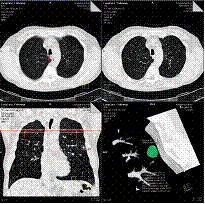 La
segmentation
automatique du nodule pulmonaire.
La
segmentation
automatique du nodule pulmonaire.- La possibilité de la visualisation 3D avec les techniques de MPR, MIP et VRT.
- La mesure automatique des dimensions et du volume du nodule pulmonaire.
- L’écran divisé en quatre fenêtre, chacune utilisant une technique de visualisation différente (MIP, coupe de référence, MPR, volume d’intérêt en VRT).
- La capacité de moduler les densités afin de distinguer le réseau vasculaire du nodule.
- La capacité de tourner autour du nodule et de zoomer sur la région d’intérêt.
L’imagerie médicale ne cesse d’évoluer de jours en jours. Grâce à la technologie numérique qui avance à grand pas, nous pouvons acquérir beaucoup plus d’informations très rapidement. C’est le cas du Scanner qui se voit passer de 16 coupes à 32 et même 64 coupes par seconde.
- Reconstruction multi planaire bidirectionnelle (2D) et mode « ciné ».
- Reconstruction 3D surfacique qui permet notamment de travailler sur des fractures complexes.
- Reconstruction 3D volumique ou Rendu de Volume qui permet l’exploration en imagerie vasculaire, en imagerie des canaux et en imagerie des liquides.
- Endoscopie virtuelle.
Ces applications permettent principalement l’étude des structures vasculaires, la quantification des nodules pulmonaires, l’analyse de la perfusion et la détection des polypes et lésions du colon.
Mais attention à ne pas confondre « Imagerie Médicale » et « Imagerie Artistique ». En effet, l’achat d’une telle console doit être justifiée par le fait qu’elle doit être utile à la fois pour le patient par l’amélioration de la visualisation de leur pathologie (extension, rapports anatomiques) mais aussi pour le chirurgien pour une meilleure compréhension anatomique pré-opératoire. Par contre, il ne faudrait pas que cette nouvelle technologie ne serve uniquement qu’à l’obtention de belles images car le coût en temps-médecin est très élévé. Il faudra donc trouver le juste équilibre.
- Cours :
Traitement numérique d'images médicales de Lerallut, Jean-francois - 2001 - Cours
http://www4.utc.fr/~bm06/cours/3-bases.pdf
- Livres :
SCANNER HELICOIDAL Principes et
modalités
pratiques
d'utilisation de Blum
Alain , Régent
Denis, Edition : Masson
Bases physiques et évolution de l'imagerie radiologique de J. Giron et F. Joffre Edition Masson (1993)
- Revue :
RBM : Revue Européenne de Technologie Biomedicale Décembre 1998, Volume 20, n°10
RBM : Revue Européenne de Technologie Biomedicale Mars 1999, Volume 21, n°1
- Site Internet :
http://www.gemedicalsystemseurope.com/frfr/index.html
http://www.medical.philips.com/main/
http://www.siemens.com/index.jsp?sdc_p=pfsn1006816d1005794c58mut4o1010648l2