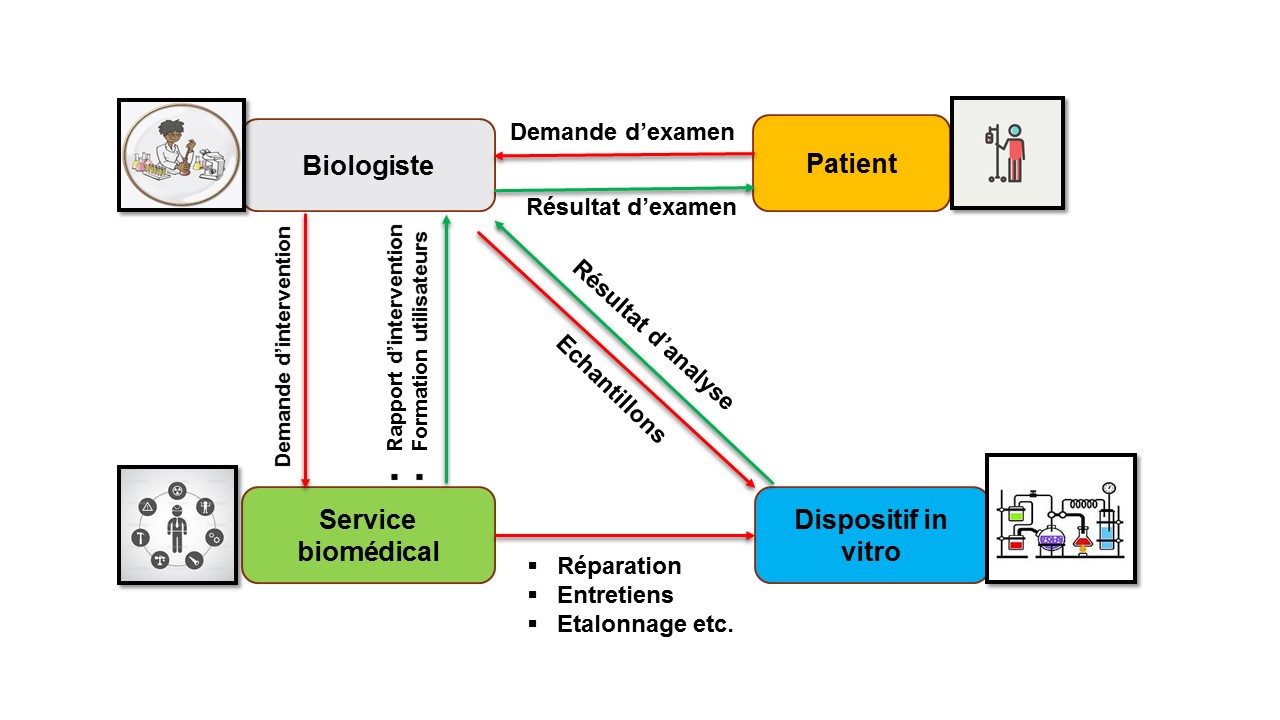
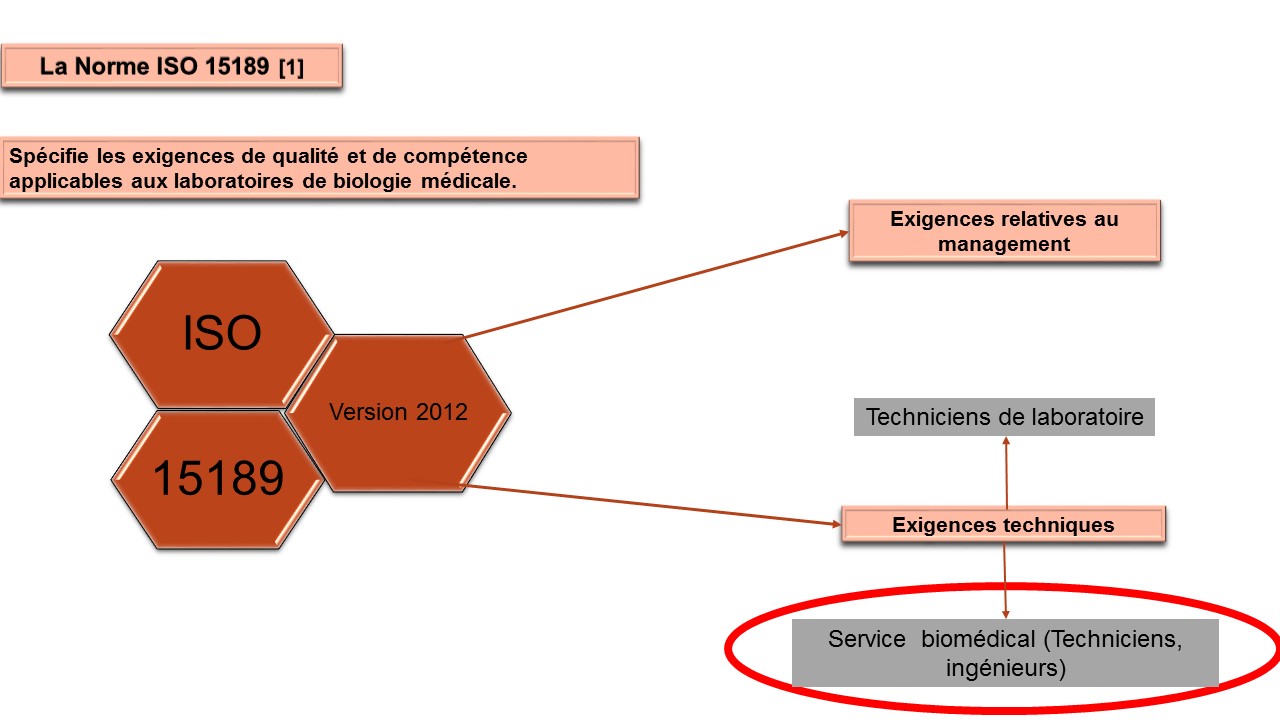
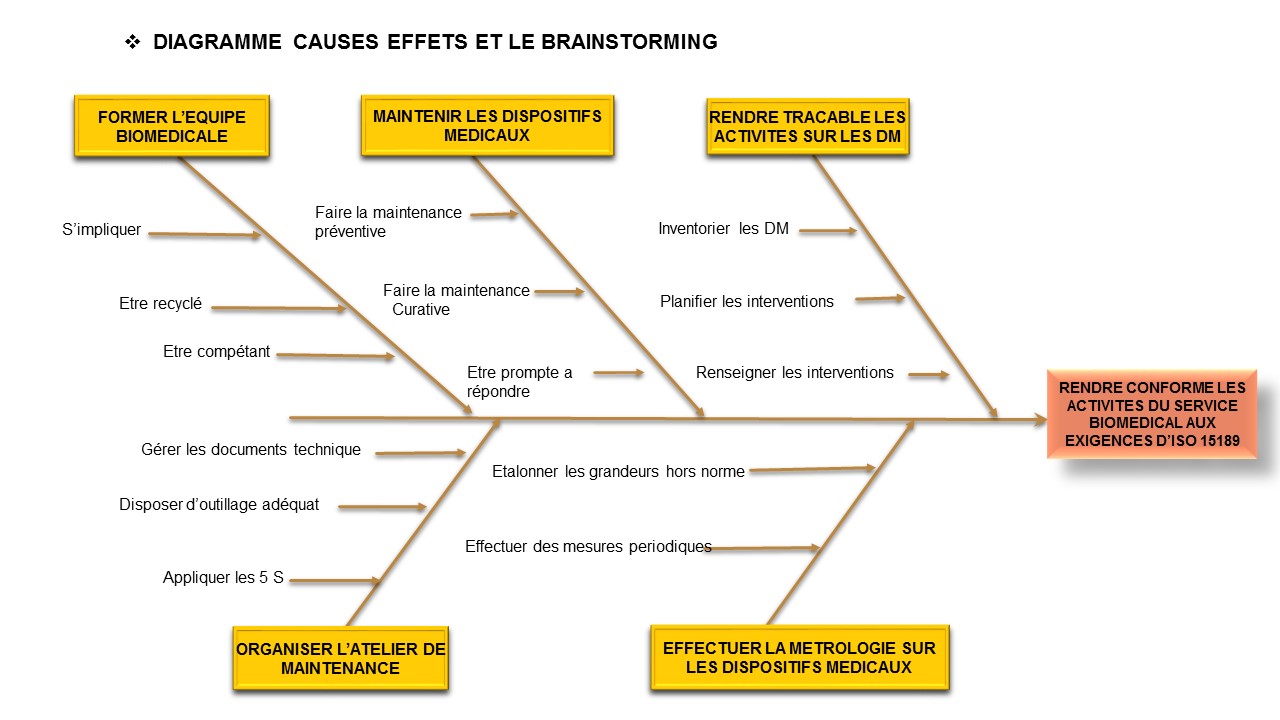
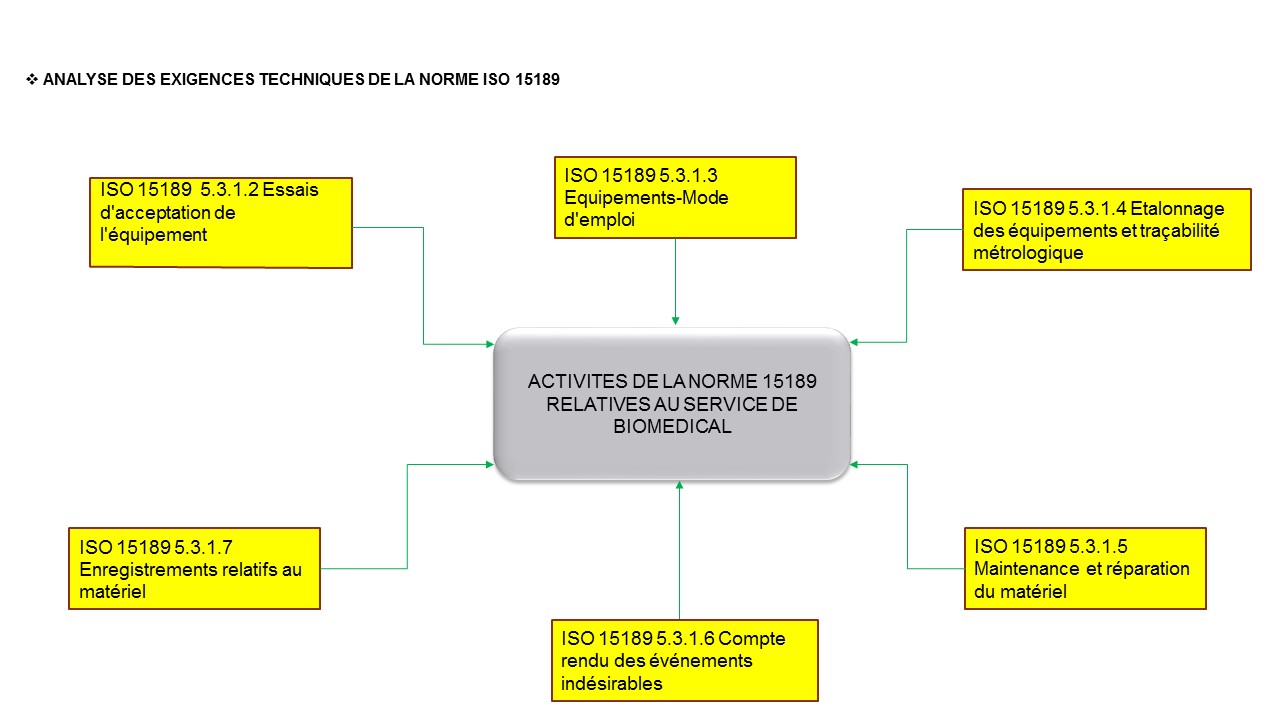
5.3.1.2 Essais d'acceptation de
l'équipement
Le laboratoire doit vérifier, lors de l'installation et
avant utilisation, que le matériel est capable d'atteindre
la performance nécessaire et qu'il est conforme aux
exigences relatives aux examens concernés
NOTE Cette exigence s'applique au matériel utilisé dans le
laboratoire, au matériel prêté ou au matériel utilisé dans
des locaux associés ou mobiles par des tiers autorisés par
le laboratoire.
Chaque élément du matériel doit être étiqueté, marqué ou
identifié d'une façon univoque.
5.3.1.3 Équipements — Mode
d'emploi
Le matériel doit être utilisé à tout moment par du
personnel formé et autorisé.
Des instructions sur l'utilisation, la sécurité et la
maintenance du matériel (y compris tous les manuels et
toutes les instructions d'utilisation fournis par le
fabricant) doivent être disponibles.
Le laboratoire doit disposer de procédures garantissant la
manipulation, le transport, le stockage et l'utilisation
en toute sécurité du matériel d'analyse afin d'empêcher
toute contamination ou détérioration.
5.3.1.4 Étalonnage des équipements
et traçabilité métrologique
Le laboratoire doit disposer d'une procédure documentée
pour l'étalonnage de l'équipement susceptible d'affecter
directement ou indirectement les résultats d’examens :
- En tenant compte des conditions d'utilisation et
des instructions du fabricant
- En enregistrant la traçabilité métrologique du
matériau d'étalonnage et l'étalonnage traçable de
l'élément du matériel ;
- En vérifiant l'exactitude de mesure requise et le
fonctionnement du système de mesure à différents
stades ;
- En enregistrant l'état et la date d’étalonnage ;
- En s'assurant que, si l'étalonnage donne lieu à un
certain nombre de facteurs de, les facteurs
d'étalonnage précédents sont correctement mis à jour ;
- En prévoyant des sauvegardes afin d'éviter les
réglages ou les falsifications susceptibles
d'invalider les résultats d'analyse.
La traçabilité métrologique doit porter sur un matériau ou
une procédure de référence jusqu'à un matériau de
référence de qualité supérieure.
NOTE La documentation de la traçabilité de l'étalonnage
jusqu'à un matériau de référence de qualité supérieure ou
d'une procédure de référence peut être fournie par un
fabricant de systèmes d'analyses. Une telle documentation
est acceptable tant que le système d'analyses du fabricant
et les modes d'étalonnage sont utilisés sans modification.
Si cela s'avère impossible ou non pertinent, d'autres
moyens de prouver la fiabilité des résultats doivent être
appliqués, tels que les suivants, sans s'y limiter :
- Utilisation de matériaux de référence certifiés ;
- Examen ou étalonnage réalisé selon une autre
procédure ; et
- L’emploi de normes ou de méthodes clairement
établies, spécifiées, caractérisées et ayant fait
l'objet d'un accord entre les parties concernées.
5.3.1.5 Maintenance et réparation du
matériel
Le laboratoire doit disposer d'un programme
documenté de maintenance préventive qui, au minimum,
observe les instructions du fabricant.
Le matériel doit être entretenu dans un état de
fonctionnement exempt de danger et en état de marche. Cela
doit inclure l'analyse de la sécurité électrique, des
dispositifs d'arrêt d'urgence (s'ils existent), ainsi que
la manipulation et l'élimination correctes des matières
chimiques, radioactives et biologiques par des personnes
autorisées. Les plannings et/ou instructions du fabricant
doivent être utilisés.
Si un matériel se révèle défectueux, il doit être mis hors
service et clairement identifié. Le laboratoire doit
garantir que le matériel défectueux n'est pas utilisé tant
qu'il n'a pas été réparé et montré, par vérification,
qu'il répondait aux critères d'acceptation spécifiés. Le
laboratoire doit examiner l'effet des défauts sur des
examens précédents et mettre en place des actions
immédiates ou correctives.
Le laboratoire doit prendre des mesures raisonnables pour
décontaminer le matériel avant de l'utiliser, de le
réparer ou de le mettre hors service et fournir les
équipements de protection individuelle appropriés.
Si le matériel n'est plus sous le contrôle direct du
laboratoire, le laboratoire doit garantir que sa
performance est vérifiée avant qu'il ne soit réutilisé au
laboratoire.
5.3.1.6 Compte rendu des événements
indésirables
Les incidents et accidents défavorables qui peuvent être
attribués directement à du matériel spécifique doivent
être étudiés et signalés au fabricant et aux autorités
appropriées, si nécessaire.
5.3.1.7 Enregistrements relatifs au
matériel
Des enregistrements doivent être conservés pour chaque
élément du matériel, contribuant ainsi au niveau de
performance des examens. Ils doivent comprendre, sans y
être limités, les renseignements suivants :
- l'identification du matériel ;
- le nom du fabricant, le modèle et le numéro de
série ou toute autre identification univoque ;
- les coordonnées du fournisseur ou du fabricant ;
- la date de réception et la date de mise en service
;
- sa localisation ;
- l'état à la réception (par exemple neuf ou
reconditionné) ;
- les instructions du fabricant ;
- les enregistrements qui ont confirmé l'aptitude
initiale du matériel à l'utilisation lorsqu'il est
intégré dans le laboratoire ;
- la maintenance effectuée et le planning de
maintenance préventive ;
- les enregistrements de la performance du matériel
confirmant que le matériel est actuellement adapté à
l’utilisation ;
|